La resistencia hipofisaria selectiva a las hormonas tiroideas es un síndrome que consiste en la respuesta inadecuada de la tirotropina a los cambios en las hormonas tiroideas y que, a diferencia de los síndromes de resistencia generalizada, cursa con hipertiroidismo central y clínica de tirotoxicosis. En ocasiones puede no ser diagnosticada adecuadamente y se la trata con fármacos con efectos deletéreos en el tiroides, como la amiodarona, lo que dificulta el diagnóstico y puede llegar a exacerbar la enfermedad. El tratamiento de esta enfermedad, por una parte, es sintomático, basado en el control de la taquicardia y la ansiedad, y por otra, etiológico, dirigido a la hipófisis, con la regulación de la secreción de tirotropina o la glándula tiroides y el control de la producción de hormonas tiroideas. Presentamos el caso de un paciente con resistencia hipofisaria a hormonas tiroideas tratado con amiodarona para el control de una fibrilación auricular paroxística.
Selective pituitary resistance to thyroid hormones is a syndrome that involves inadequate response of thyroid-stimulating hormone to changes in thyroid hormones. Unlike generalized resistance syndromes, this entity produces central hyperthyroidism and clinical thyrotoxicosis. Sometimes the disease may not be properly diagnosed and is treated with drugs with harmful effects on the thyroid, such as amiodarone, hampering diagnosis and possibly exacerbating the disorder. The treatment of this condition can be symptomatic, based on control of tachycardia and anxiety, or etiological, acting on the pituitary to regulate thyrotropin secretion or on the thyroid gland to control thyroid hormone production. We report the case of a patient with pituitary resistance to thyroid hormone, who was treated with amiodarone to control paroxysmal atrial fibrillation.
El síndrome de resistencia a las hormonas tiroideas consiste en la falta de respuesta de los órganos diana a dicha hormona. Se suele clasificar en resistencia generalizada, hipofisaria o periférica en función del perfil clínico y bioquímico1.
Dentro de este síndrome la resistencia hipofisaria es una entidad que, a diferencia de los otros subtipos, produce una clínica de hipertiroidismo de difícil diagnóstico y tratamiento limitado2.
CASO CLÍNICOVarón de 45 años con antecedentes personales de diabetes mellitus tipo 2 e hipercolesterolemia, y sin antecedentes familiares de afección tiroidea; en seguimiento por el servicio de cardiología por fibrilación auricular paroxística y tratamiento con amiodarona desde hacía 1 mes, fue remitido a la consulta de endocrinología por alteración de las pruebas de función tiroidea: tirotropina (TSH), 2,12 μU/ml (0,2-4,5 μU/ml); T4 libre, 4,38ng/ dl (0,9-1,7ng/dl).
Desde hace años el paciente refiere episodios diarreicos frecuentes, nerviosismo, dificultad para conciliar el sueño, palpitaciones, a pesar del tratamiento, y sudoración fría. A la exploración se objetivó bocio difuso grado Ib, firme, sin nódulos ni adenopatías y temblor distal de las extremidades superiores.
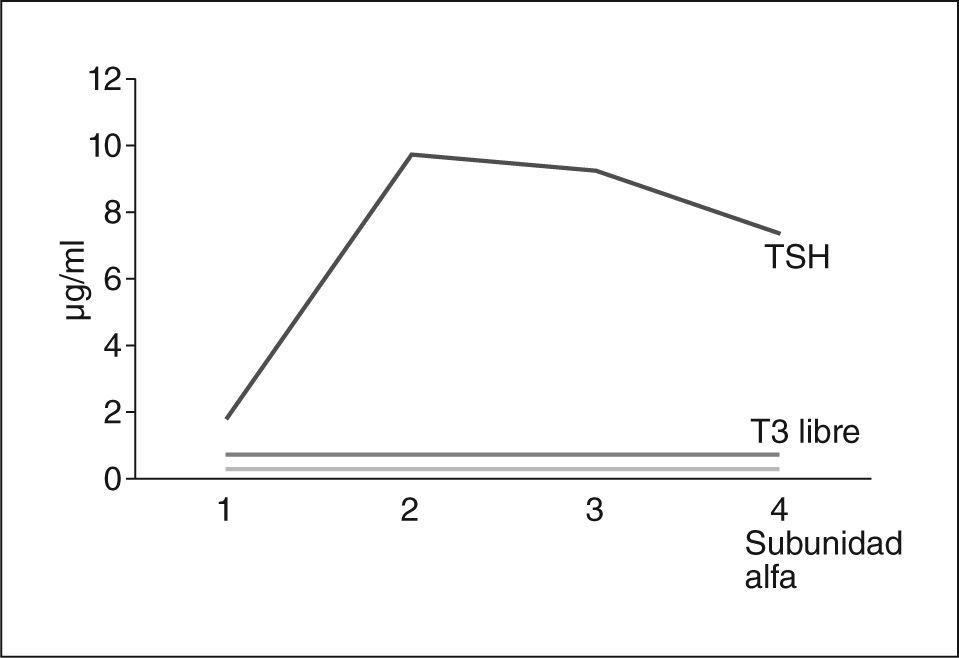
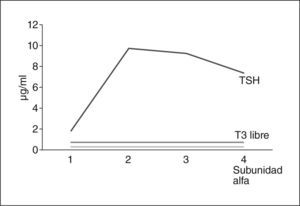
Se suspendió la amiodarona y se repitieron las pruebas: TSH, 1,99 μU/ml; T4 libre, 3,92ng/dl, y anticuerpos anti-TSI < 0,1 U/ml. Se realizó gammagrafía tiroidea, en la que se observó un bloqueo parcial de la captación, a pesar de ello, se objetivó un bocio difuso. Se realizó prueba de TRH en la que se observó respuesta normal de TSH y de subunidad alfa (fig. 1).
Los resultados obtenidos descartaron un tumor hipofisario productor de TSH al mostrar una respuesta normal de la TSH a la TRH. A causa del tratamiento con amiodarona se estableció un diagnóstico diferencial entre tirotoxicosis medicamentosa y síndrome de resistencia hipofisaria a las hormonas tiroideas. Se inició tratamiento con prednisona 45mg/día y metimazol 10mg/8h, que hubo que cambiar a propiltiouracilo 100mg/8h debido a un exantema medicamentoso.
A pesar de las dosis altas de antitiroideos y glucocorticoides persistieron la clínica y la alteración bioquímica (tabla 1). Se realizó una nueva gammagrafía en la que se observó una glándula tiroides de localización normal y de forma regular, cuyas dimensiones estaban notablemente aumentadas a expensas de ambos lóbulos de forma simétrica; la captación fue homogénea y de intensidad normal. Se decidió tratar con radioyodo.
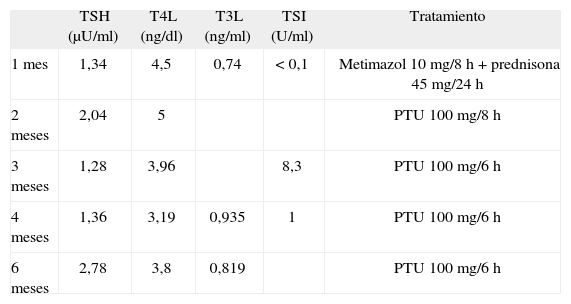
Evolución de las pruebas de función tiroidea tras tratamiento antitiroideo
| TSH (μU/ml) | T4L (ng/dl) | T3L (ng/ml) | TSI (U/ml) | Tratamiento | |
| 1 mes | 1,34 | 4,5 | 0,74 | < 0,1 | Metimazol 10mg/8h + prednisona 45mg/24h |
| 2 meses | 2,04 | 5 | PTU 100mg/8h | ||
| 3 meses | 1,28 | 3,96 | 8,3 | PTU 100mg/6h | |
| 4 meses | 1,36 | 3,19 | 0,935 | 1 | PTU 100mg/6h |
| 6 meses | 2,78 | 3,8 | 0,819 | PTU 100mg/6h |
PTU: propiltiouracilo; TSH: tirotropina; TSI: anticuerpos contra los receptores de tirotropina; T3L: triyodotironina no unida a proteína; T4L: tiroxina no unida a proteína.
Se administraron 29,3mCi de 131I, tras lo cual el paciente sufrió una exacerbación de la clínica con intenso dolor cervical y elevación de pruebas de función tiroidea (TSH, 0,033 μU/ml; T4 libre, > 7,77ng/dl; T3 libre, 2,37ng/dl). Con el diagnóstico de tiroiditis tras radioyodo, se inició tratamiento con ácido acetilsalicílico 500mg/8h, prednisona 60mg/día en dosis decreciente y se aumentó el propiltiouracilo a 150mg/6h. Mejoró la clínica y comenzaron a normalizarse las hormonas tiroideas (tabla 2).
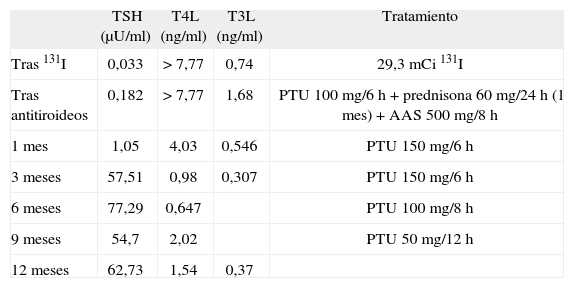
Evolución de las pruebas de función tiroidea tras radioyodo
| TSH (μU/ml) | T4L (ng/ml) | T3L (ng/ml) | Tratamiento | |
| Tras 131I | 0,033 | > 7,77 | 0,74 | 29,3mCi 131I |
| Tras antitiroideos | 0,182 | > 7,77 | 1,68 | PTU 100mg/6h + prednisona 60mg/24h (1 mes) + AAS 500mg/8h |
| 1 mes | 1,05 | 4,03 | 0,546 | PTU 150mg/6h |
| 3 meses | 57,51 | 0,98 | 0,307 | PTU 150mg/6h |
| 6 meses | 77,29 | 0,647 | PTU 100mg/8h | |
| 9 meses | 54,7 | 2,02 | PTU 50mg/12h | |
| 12 meses | 62,73 | 1,54 | 0,37 |
PTU: propiltiouracilo; TSH: tirotropina; TSI: anticuerpos contra los receptores de tirotropina; T3L: triyodotironina no unida a proteína; T4L: tiroxina no unida a proteína.
Tras un tiempo sin recidiva de la clínica por probable ablación tiroidea, se repitió el test de TRH confirmándose el diagnóstico de resistencia hipofisaria a las hormonas tiroideas.
En el momento actual el paciente se encuentra sin clínica de tirotoxicosis, y con los siguientes resultados analíticos: TSH, 77,81 μU/ml; T4 libre, 1,05ng/ml; T3 libre, 0,302ng/ml. A la exploración física no se detecta bocio ni otras alteraciones relevantes.
DISCUSIÓNLa resistencia a las hormonas tiroideas es un síndrome de prevalencia baja (1/40.000 nacidos vivos) que se manifiesta por igual en ambos sexos y se suele heredar de manera autosómica dominante3. La resistencia hipofisaria es la segunda en frecuencia dentro del síndrome, y se ha descrito desde 1975 en alrededor de 150 familias4.
En resistencia a hormonas tiroideas se ha descrito un total de 124 mutaciones en 343 familias no relacionadas. Estas mutaciones se encuentran: a) en un 85% en el receptor TRα, y b) en un 15% (mutaciones "non-TR-RTH") pueden estar relacionadas con el gen de alguno de los cofactores que interaccionan con el receptor. Ambas entidades son clínica y bioquímicamente indistinguibles. Aproximadamente 45 de estas mutaciones son compartidas por más de una familia5-7.
La intensidad de la resistencia hormonal varía entre distintos tejidos en el individuo afecto y entre los sujetos con la misma mutación. Las variaciones del fenotipo (talla baja, edad ósea retrasada, alopecia congénita, índice de masa corporal bajo) tienen una base molecular, de manera que en sujetos heterocigotos para una deleción del gen TRα tienen un fenotipo normal, mientras que la resistencia a las hormonas tiroideas se manifiesta en sujetos homocigotos por la ausencia completa del gen del TRα (forma más intensa) y en heterocigotos que expresan una mutación con efecto dominante negativo8,9.
La resistencia hipofisaria aislada, en su mayoría, se produce debido a mutaciones puntuales inactivantes del gen que codifica las isoformas α1 y α2 del receptor de las hormonas tiroideas (RHT). Los receptores se distribuyen principalmente por hígado, riñón, hipófisis e hipotálamo. Estas mutaciones alteran la capacidad de unión de la T3 libre con su receptor8,10. La mutación en el gen de RHTα asocia a resistencia selectiva hipofisaria y hepática a las hormonas tiroideas. Sin embargo, al no existir mutación en el gen de RHTα, localizado preferentemente en el miocardio, no hay alteración de la acción de las hormonas tiroideas en esta localización4.
A diferencia del síndrome de resistencia generalizada a la hormona tiroidea, que cursa de manera prácticamente asintomática o con síntomas inespecíficos, el síndrome de resistencia hipofisaria presenta una clínica de hipertiroidismo secundario con bocio, hiperactividad, taquicardia y otra serie de síntomas de tirotoxicosis1,2,8.
En cuanto a las alteraciones analíticas, en esta enfermedad observamos unas concentraciones séricas de T4 elevadas con unas concentraciones de TSH no suprimidas (elevadas o inadecuadamente normales). Las concentraciones de T3 y rT3 suelen encontrarse también elevadas y normalmente suelen ser congruentes con las de T4; como resultado se obtiene un índice T3/T4 normal8,10.
El paciente estuvo tomando amiodarona que presenta un doble efecto tóxico en el tiroides. Por un lado, el propio fármaco y su metabolito activo, la desetilamiodarona, inhiben las deyodinasasa D1 y D2, bloquean el receptor tiroideo y tienen una acción tóxica directa en los tirocitos foliculares. Por otro, el alto contenido en yodo de la molécula (un 37% del peso total) puede producir alteraciones tipo Jod-Basedow o efecto Wolf-Chaikoff en tiroides patológicos11.
Teniendo en cuenta todas estas consideraciones, el diagnóstico diferencial se nos planteó entre una secreción inadecuada de TSH secundaria a un tumor hipofisario secretor de tirotropina (TSHoma) y resistencia hipofisaria a hormonas tiroideas.
Si no se considera la clínica de hipertiroidismo, o se considera como una alteración independiente, tendríamos que tener en cuenta en el diagnóstico diferencial las siguientes entidades: aumento en suero de las proteínas de unión, hipertiroxinemia familiar disalbuminémica, anticuerpos endógenos contra hormonas tiroideas y anti-TSH, síndrome del enfermo eutiroideo o alteración iatrogénica (amiodarona)10.
Con la repetición de las pruebas de función tiroidea, volvimos a observar la misma alteración (T4 libre elevada con TSH no suprimida) y una elevación de la T3 que excluye un posible trastorno por amiodarona. Por otro lado, este fármaco artefactó la gammagrafía que realizamos para descartar una posible alteración tiroidea subyacente. El diagnóstico de confirmación de la resistencia lo hubiese dado la detección de una mutación en el gen del RHTα por secuenciación directa, aunque no se realizó en este caso al haber excluido las demás causas12.
El tratamiento a realizar tiene dos objetivos: el control de los síntomas, que debería ser el inicial, y el control etiológico disminuyendo la secreción de tirotropina o de hormonas tiroideas. El tratamiento sintomático se dirige principalmente a controlar la taquicardia y el temblor por medio de los bloqueadores beta y a disminuir el nerviosismo mediante las benzodiacepinas. El tratamiento etiológico se dirige principalmente a inhibir o suprimir la TSH: a) los análogos de las hormonas tiroideas que actúan sobre el RHTα, de los cuales el más eficaz es el ácido triyodotiroacético; b) los análogos de la somatostatina que han demostrado ser mejores en el control de los adenomas productores de TSH, y c) los agonistas dopaminérgicos que no son capaces de suprimir de forma persistente la secreción de TSH. Otra opción terapéutica es disminuir la producción de hormona tiroidea mediante el tratamiento con antitiroideos, radioyodo y/o cirugía tiroidea. Sin embargo, estos procedimientos no pueden corregir las cifras de TSH e incluso pueden incrementarlas más, produciendo un aumento del tamaño del bocio13.
En el caso discutido, al presentar una tirotoxicosis difícilmente controlable, se inició el tratamiento con antitiroideos a dosis crecientes que no consiguieron controlar en ningún momento la clínica y las pruebas. Como última opción, se decidió por una ablación con radioyodo, que supuso el control tanto de las pruebas analíticas como de la clínica.
En estos pacientes, la indicación de iniciar tratamiento sustitutivo con hormona tiroidea ante concentraciones elevadas de TSH es el desarrollo de clínica de hipotiroidismo o la existencia de bocio y/o afección nodular9. En el momento actual y tras el tratamiento con radioyodo, el paciente se mantiene asintomático, sin bocio.
En conclusión, ante cifras discordantes de las pruebas de función tiroidea, es necesario descartar un posible síndrome de resistencia, una entidad rara que trataremos en el caso de existir clínica, siendo cautelosos con el tipo de tratamiento y teniendo en cuenta sus posibles consecuencias.
Los autores declaran no tener ningún conflictos de intereses.