Los tumores virilizantes son poco frecuentes, proceden del ovario o de la corteza adrenal. El diagnóstico etiológico es en ocasiones muy complejo debido a que los tumores ováricos secretores de andrógenos son habitualmente de tamaño milimétrico y no se detectan mediante las pruebas de imagen convencionales. Presentamos el caso de una paciente de 71 años de edad con hiperandrogenismo grave de perfil típicamente ovárico, en la que se detectó una masa adrenal de 10 cm.
Virilizing tumors are rare disorders that commonly develop in the adrenal cortex or the ovaries. Because these tumors are usually millimetric, androgen-secreting ovarian tumors can be particularly difficult to identify through commonly available imaging techniques and can thus pose a diagnostic challenge. We present the case of a 71-year-old woman who presented with severe clinical hyperandrogenism and biochemical traits suggestive of an ovarian source but who was diagnosed with a 10-cm adrenal mass.
El objetivo primordial en la evaluación de una mujer con hiperandrogenismo grave es localizar el origen del exceso hormonal. Los tumores virilizantes de ovario son generalmente microscópicos, de crecimiento muy lento, y en ocasiones la exploración quirúrgica es la única manera de localizarlos. La presencia añadida de una gran masa adrenal puede actuar como factor de confusión.
CASO CLÍNICOPaciente de 71 años, remitida a la consulta de endocrinología desde el servicio de dermatología donde había consultado por alopecia. Fumadora de 1 paquete de cigarrillos al día. Presentaba como antecedentes personales: hipertensión arterial sin tratamiento; diabetes mellitus tipo 2 (DM2) sin complicaciones metadiabéticas, de 2 años de evolución y en tratamiento con 875 mg/8 h de metformina; colecistectomía en 1995; resección transuretral en el año 2004 de un carcinoma urotelial grado I.
Su historia obstétrica incluía 15 gestaciones, menarquia a los 13 años y menopausia a los 46 años de edad. Había presentado reglas regulares hasta la menopausia. En el momento de la consulta no tomaba ninguna medicación con efecto androgénico. Relataba aparición rápidamente progresiva, de 1 año de evolución, de vello terminal en zonas andrógenodependientes, alopecia importante, agravamiento del tono de voz y un aumento de 6 kg de peso. En la exploración física presentaba presión arterial 165/90 mmHg; peso, 95 kg; talla, 172,5 cm; índice de masa corporal, 32,8. Mostraba una distribución central de la grasa, piel seca, intensa alopecia frontotemporal e hirsutismo grave de 24 puntos en la escala de Ferriman-Galway. En la exploración abdominal no se detectaron masas y en la exploración ginecológica se objetivó clitoromegalia.
En el estudio analítico presentaba: hematíes, 5.261.000/l; hemoglobina, 17,3 g/dl; hematocrito, 50,4%; volumen corpuscular medio, 88,9 fl; leucocitos y plaquetas normales; glucosa, 180 mg/dl; creatinina, 1,3 mg/dl; ácido úrico, 7,2 mg/dl; Na, 140 mmol/l; K, 3,8 mmol/l; colesterol total, 200 mg/dl; colesterol LDL, 174 mg/dl; colesterol HDL, 32 mg/ dl; triglicéridos, 209 mg/dl, glucohemoglobina A1c (HbA1c), 8,2%. El resto de las determinaciones, incluyendo urea, calcio, fósforo, pruebas de función hepática, proteínas y coagulación, fueron normales.
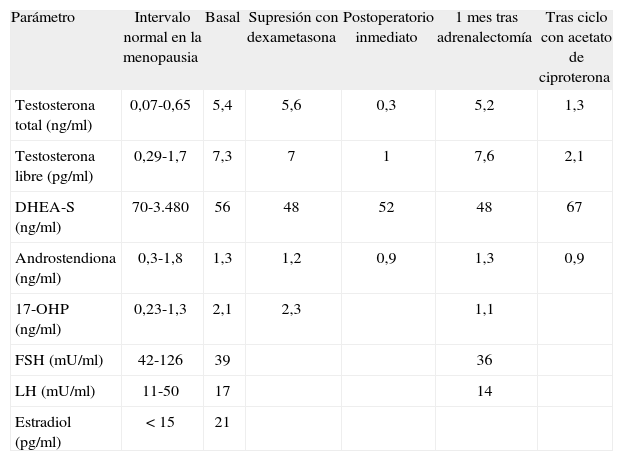
Los resultados del estudio hormonal se presentan en la tabla 1. El estudio mostró cifras elevadas de testosterona total, 5,4 (normalidad en menopausia, 0,07-0,65) ng/ml; testosterona libre, 7,3 (normalidad en menopausia, 0,29-1,7) pg/ml, y 17-hidroxiprogesterona (17-OHP), 2,1 (normalidad en menopausia, 0,23-1,3) ng/ml, con concentraciones de sulfato de deshidroepiandrosterona (DHEA-S) y androstendiona normales. La concentración de testosterona libre se cuantificó mediante valoración directa. Mediante el test de ACTH (250 μg) se descartó el déficit de 21-hidroxilasa en su forma no clásica, con respuesta de 17-OHP y cortisol normales. Los valores de folitropina (FSH), lutropina (LH) y estradiol eran concordantes para su edad y estado posmenopáusico. Los marcadores tumorales: gonadotropina coriónica, alfafetoproteína, antígeno carcinoembrionario (CEA) y CEA-125 resultaron negativos.
Determinaciones hormonales en situación basal, tras test de supresión con dexametasona, tras realizar adrenalectomía y tras tratamiento con acetato de ciproterona
| Parámetro | Intervalo normal en la menopausia | Basal | Supresión con dexametasona | Postoperatorio inmediato | 1 mes tras adrenalectomía | Tras ciclo con acetato de ciproterona |
| Testosterona total (ng/ml) | 0,07-0,65 | 5,4 | 5,6 | 0,3 | 5,2 | 1,3 |
| Testosterona libre (pg/ml) | 0,29-1,7 | 7,3 | 7 | 1 | 7,6 | 2,1 |
| DHEA-S (ng/ml) | 70-3.480 | 56 | 48 | 52 | 48 | 67 |
| Androstendiona (ng/ml) | 0,3-1,8 | 1,3 | 1,2 | 0,9 | 1,3 | 0,9 |
| 17-OHP (ng/ml) | 0,23-1,3 | 2,1 | 2,3 | 1,1 | ||
| FSH (mU/ml) | 42-126 | 39 | 36 | |||
| LH (mU/ml) | 11-50 | 17 | 14 | |||
| Estradiol (pg/ml) | < 15 | 21 |
DHEA-S: sulfato de deshidroepiandrosterona; 17-OHP: 17-hidroxiprogesterona; FSH: folitropina; LH: lutropina.
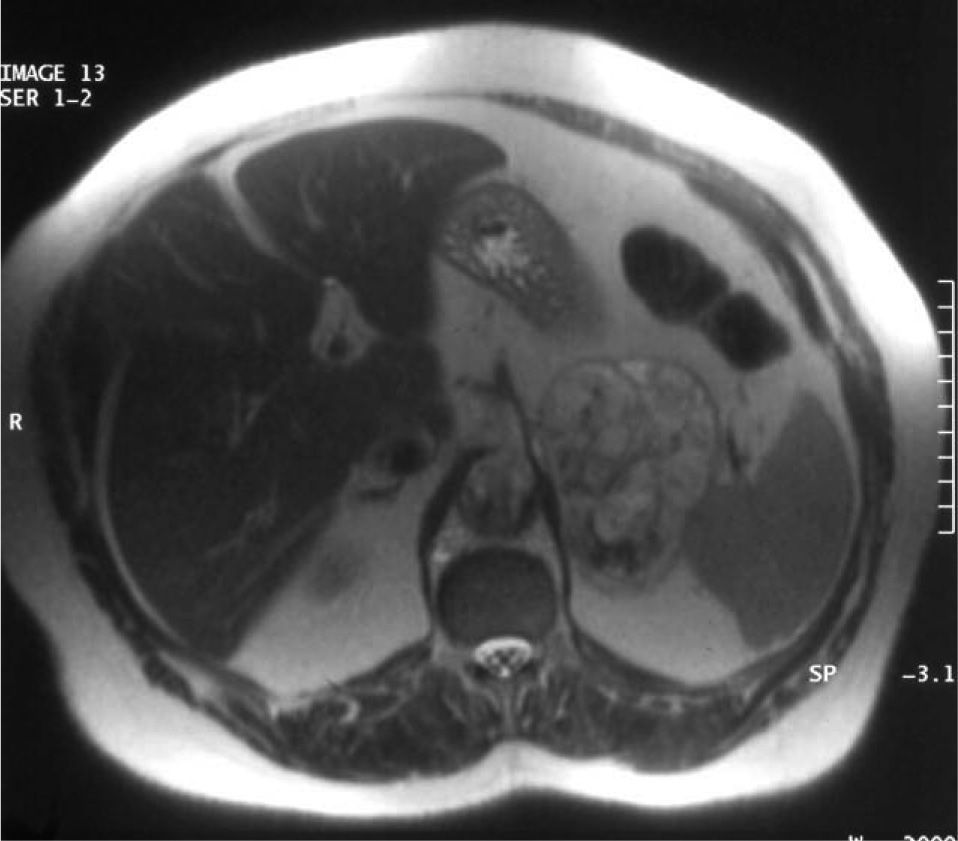
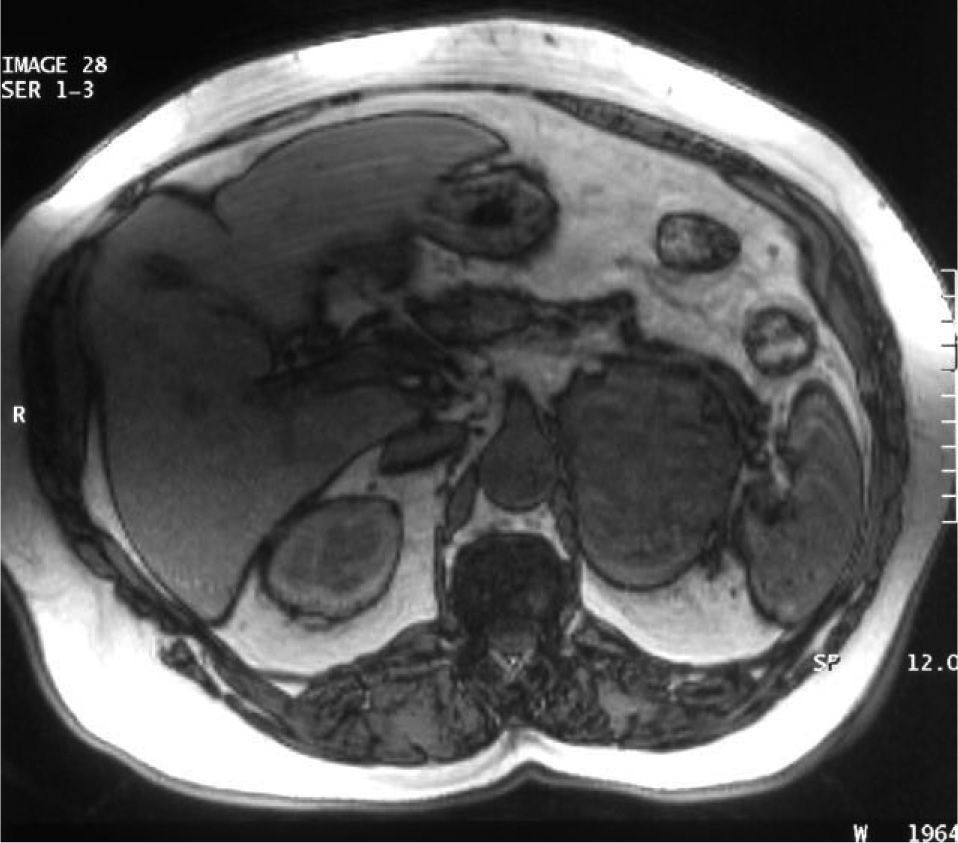
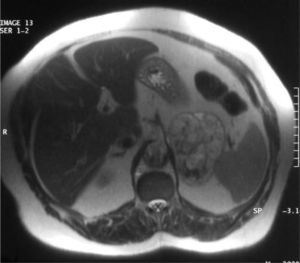
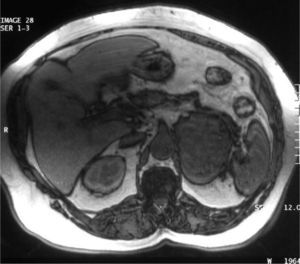
Con la sospecha de hiperandrogenismo de origen ovárico se realizó estudio de imagen. En la eco-Doppler transvaginal no se observaron masas anexiales ni líquido libre. La resonancia magnética abdominal y pelviana identificó una gran masa heterogénea, en la glándula suprarrenal izquierda, de bordes bien definidos de 10 cm de diámetro. La tumoración era hiperintensa en T2 y, en la fase opuesta, en T1 perdía intensidad, lo que indicaba contenido graso en su interior, indicativo de adenoma. El útero y los ovarios eran de aspecto y tamaño normales (figs. 1 y 2).
Se completó entonces estudio de funcionalidad con los siguientes resultados: cortisol basal, 20,01 μg/dl (6–26); cortisol a las 23 h, 1,6 μg/dl; cortisoluria, 128 μg/24 h (35–200); cortisol tras test de supresión nocturna con 1 mg de dexametasona, 1,4 μg/dl; ACTH, 21 pg/ml; cortisol y cortisoluria tras test de supresión débil con dexametasona (0,5 mg/6 h/2 días), 0,7 μg/dl y 0,64 μg/24 h; las metanefrinas en orina, aldosterona y actividad renina plasmática fueron normales.
Las concentraciones de testosterona no mostraron cambios tras supresión con dexametasona (0,5 mg/6 h/2 días) (tabla 1).
En este punto nos planteamos el siguiente diagnóstico diferencial: coexistencia de tumor ovárico (oculto) productor de andrógenos e incidentaloma suprarrenal frente a tumor adrenal secretor de testosterona de forma aislada. Aunque el primero de los diagnósticos parecía el más probable, debido al gran tamaño y las características radiológicas de la masa adrenal se decidió realizar una intervención en dos tiempos, inicialmente se realizaría la adrenalectomía y posteriormente la histerectomía con salpingo-ooforectomía bilateral.
Como estaba programado, se intervino quirúrgicamente a la paciente mediante abordaje transperitonal subcostal izquierdo y se extirpó la glándula suprarrenal izquierda.
Al día siguiente de la cirugía, se solicitó analítica, y se observó la normalización de las cifras de testosterona total y libre (tabla 1). Se repitió la analítica pasado 1 mes (tabla 1) objetivándose cifras de testosterona similares a las prequirúrgicas.
El resultado anatomopatológico de la pieza fue de adenoma adrenal. Macroscópicamente, la glándula adrenal estaba totalmente reemplazada por una masa adenomatosa de 10 × 9 cm de tamaño, que pesaba 380 g. La masa estaba compuesta primariamente por cordones de células alargadas, de núcleo pequeño, de citoplasma rico en lípidos semejantes a las células de la zona fascicular adrenal, junto con nidos dispersos de células de compacto citoplasma eosinófilo semejantes a las células de la zona reticular adrenal. No se observaron atipias ni invasión capsular.
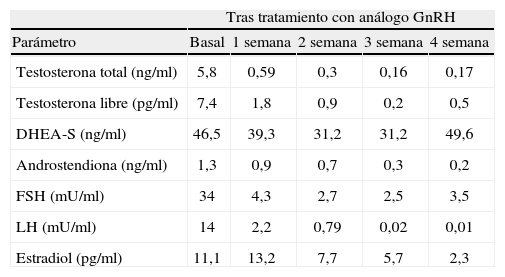
Debido a un postoperatorio muy largo y complicado (infección de la herida quirúrgica, neumonía hospitalaria bilateral y descompensación hiperglucémica), la paciente rechazó la doble anexectomía más histerectomía. Ante la negativa al tratamiento quirúrgico y con la certeza del origen ovárico del hiperandrogenismo, se le planteó el tratamiento con análogos de GnRH (hormona liberadora de gonadotrofinas). La reducción de los valores de testosterona en el postoperatorio inmediato indicaba que la secreción de andrógenos dependía de gonadotrofinas, suprimidas transitoriamente por el estrés de la cirugía. Además, tras realizar un ciclo corto con acetato de ciproterona (Androcur®), se suprimieron parcialmente las cifras de testosterona (tabla 1). Para confirmar la sospecha de hiperandrogenismo ovárico dependiente de gonadotropinas se realizó un test con análogos de GnRH. Tras la administración intramuscular en dosis única de 3,5 mg de triptorelina, se midieron las concentraciones hormonales semanalmente (días 0, 7, 14, 28) durante 1 mes (tabla 2). Las concentraciones de testosterona total y libre decrecieron hasta normalizarse en torno a la segunda semana. El mismo efecto se comprobó en las cifras de androstendiona, 17-OHP, FSH, LH y estradiol. Los valores de DHEA-S no se modificaron.
Determinaciones hormonales en situación basal y tras administración intramuscular de 3,75 mg de triptorelina
| Tras tratamiento con análogo GnRH | |||||
| Parámetro | Basal | 1 semana | 2 semana | 3 semana | 4 semana |
| Testosterona total (ng/ml) | 5,8 | 0,59 | 0,3 | 0,16 | 0,17 |
| Testosterona libre (pg/ml) | 7,4 | 1,8 | 0,9 | 0,2 | 0,5 |
| DHEA-S (ng/ml) | 46,5 | 39,3 | 31,2 | 31,2 | 49,6 |
| Androstendiona (ng/ml) | 1,3 | 0,9 | 0,7 | 0,3 | 0,2 |
| FSH (mU/ml) | 34 | 4,3 | 2,7 | 2,5 | 3,5 |
| LH (mU/ml) | 14 | 2,2 | 0,79 | 0,02 | 0,01 |
| Estradiol (pg/ml) | 11,1 | 13,2 | 7,7 | 5,7 | 2,3 |
DHEA-S: sulfato de deshidroepiandrosterona; FSH: folitropina; LH: lutropina.
Actualmente la paciente está a la espera de iniciar tratamiento con análogos de GnRH y de replanteamiento de la cirugía como tratamiento definitivo.
DiSCUSiÓNLa aparición de hirsutismo con signos de virilización, junto con cifras marcadamente elevadas de testosterona, generalmente se produce por hiperandrogenismo ovárico: tumor ovárico secretor de andrógenos o hipertecosis ovárica1 (variante más grave del síndrome de ovario poliquístico). Pero también puede ser causada por un tumor virilizante de origen adrenal. Los tumores secretores de andrógenos proceden con mayor frecuencia del ovario y constituyen menos del 5% del total de las neoplasias ováricas2.
La principal complicación en el manejo de una paciente con hiperandrogenismo es frecuentemente la localización del exceso de andrógenos. La presentación clínica de un proceso tumoral es similar en unos y otros tumores y no permite distinguir la fuente del exceso de andrógenos. En los casos de hipertecosis la evolución suele ser más lenta3 y generalmente se asocia a resistencia a la insulina, obesidad central, hipertensión arterial, hiperlipemia, glucemia basal alterada o DM2 e hiperuricemia3,4.
El estudio hormonal es el primer paso en el diagnóstico etiológico. Concentraciones de testosterona total superiores a 2 ng/ml con valores de testosterona libre que duplican el límite superior de la normalidad indican un proceso tumoral5,6, aunque también pueden aparecer estas cifras en la hipertecosis ovárica7. El estudio hormonal que mostró la paciente fue: cifras de testosterona libre > 7 pmol/l, con concentraciones de DHEAS y androstendiona normales y sin evidencia de déficit de 21-hidroxilasa. Este perfil hormonal orientaría hacia una fuente ovárica de hiperproducción de andrógenos, ya que los tumores de origen adrenal típicamente producen grandes cantidades de DHEA-S (> 800 μg/ dl), con cifras más bajas de testosterona6,8. Sin embargo, aunque muy raros, se han descrito tumores adrenales productores de testosterona de forma aislada, con cifras normales de DHEA-S9–11.
Con el perfil clínico y hormonal de la paciente, es preciso realizar pruebas de imagen para valorar la anatomía de los ovarios y de las glándulas adrenales. Los hallazgos observados en la paciente complicaron en gran medida el diagnóstico: la eco-Doppler transvaginal no evidenció anomalías, los ovarios eran de tamaño y ecoestructura normales para la edad de la paciente. En la resonancia magnética se identificó una gran masa en la glándula suprarrenal izquierda de 10 cm de diámetro. La ecografía transvaginal combinada con el Doppler-color es actualmente la técnica más sensible para los procesos ováricos12,13. La hipertecosis ovárica suele presentarse como un alargamiento bilateral de los ovarios incluso en la posmenopausia, aunque también pueden ser de tamaño normal3. Por el contrario, los tumores virilizantes del ovario en el adulto son frecuentemente tan pequeños que no se detectan mediante esta técnica, ya que precisa de un tamaño tumoral de entre 0,5 y 2 cm para su correcta detección12,14,15, por lo que en muchas ocasiones se recurre a técnicas invasivas, como la cateterización selectiva de las venas ováricas o la laparotomía exploradora. En el estudio de las glándulas adrenales la tomografía computarizada y la resonancia magnética son las técnicas de elección. Los tumores virilizantes de origen adrenal generalmente son grandes masas benignas16.
A la vista de los resultados, se completó estudio de funcionalidad adrenal que descartó síndrome de Cushing y las concentraciones de testosterona no respondieron a la supresión con dexametasona. La prueba de supresión con dexametasona, al igual que otros tests dinámicos (supresión con análogos de GnRH o estímulo con gonadotropina coriónica humana), no discrimina entre un origen ovárico o adrenal como fuente de andrógenos, ni tampoco distingue entre procesos tumorales o no tumorales. La supresión de la testosterona tras la administración de análogos de GnRH se ha descrito tanto en hiperandrogenismos de origen ovárico como en tumores adrenales e hiperplasias adrenales secretoras de testosterona10,16,17. Del mismo modo, la supresión con dexametasona tampoco permite el diagnóstico diferencial, pues se han documentado tumores virilizantes de ovario que respondían a dexametasona8, y para complicar el diagnóstico el 10% de los tumores ováricos de células esteroideas producen cortisol y muestran signos bioquímicos similares a los de un Cushing adrenal18.
En este punto, nos planteamos el diagnóstico diferencial entre hiperandrogenismo de origen ovárico (tumor oculto frente a hipertecosis) asociado a incidentaloma suprarrenal y tumor adrenal secretor de testosterona de forma aislada. La primera de las opciones parecía la más probable debido a la gran prevalencia de adenomas adrenales no secretores en la población general, la baja frecuencia de tumores adrenales productores de testosterona de forma aislada y el pequeño tamaño de muchos tumores virilizantes de ovario.
Se decide efectuar intervención en dos tiempos, inicialmente suprarrenalectomía y posteriormente histerectomía con doble anexectomía. El procedimiento terapéutico de elección en una mujer posmenopáusica con sospecha de hiperandrogenismo de origen ovárico (tumoral, hipertecosis) en el que no se detectan lesiones ováricas es la ooforectomía bilateral con análisis histológico de la pieza quirúrgica, se recomienda asociar histerectomía debido a que la secreción ovárica de grandes cantidades de andrógenos aumenta la producción periférica de estrógenos, lo que incrementa el riesgo de hiperplasia y carcionoma endometrial4,19,20. Además, en esta paciente está indicada la adrenalectomía izquierda debido a las dimensiones de la masa, ya que un tamaño mayor de 6 cm es indicación de extirpación quirúrgica independientemente de que la masa sea o no funcionante y de que sea o no el origen del hiperandrogenismo21,22. Se realizó primeramente suprarrenalectomía izquierda, con el resultado anatomopatológico de la pieza de adenoma adrenal. Con la certeza del origen ovárico del hiperandrogenismo de la paciente, se le propuso completar el tratamiento con una histerectomía más salpingo-ooforectomía bilateral, proceso que rechazó debido a un postoperatorio muy complicado.
Aunque la naturaleza exacta del hiperandrogenismo ovárico no se puede determinar en la paciente estudiada, la conducta fisiológica de una hipertecosis ovárica no se diferencia de un tumor oculto virilizante de ovario, pues su naturaleza suele ser benigna en más del 95% de los casos23. La gran mayoría de los descritos en mujeres posmenopáusicas suelen ser tumores de células del Leydig1,18,20,24–26 (del subtipo células del hilio), que se caracterizan por ser tumores unilaterales, de pequeño tamaño, frecuentemente menores de 1 cm, por lo que no se detectan con facilidad mediante las pruebas de imagen habituales12, en su mayoría son benignos y de excelente pronóstico27.
Ante la negativa al tratamiento quirúrgico y en los casos de hiperandrogenismo ovárico en los que la cirugía está contraindicada, se han empleado con éxito los análogos de GnRH. Estudios previos han demostrado que la secreción de andrógenos producida por la hipertecosis ovárica y ciertos tumores ováricos es sensible a gonadotropinas, es decir, la producción ovárica de andrógenos no es autónoma20,23,24. Para confirmar el diagnóstico de hiperandrogenismo ovárico dependiente de gonadotropinas, se realizó a la paciente un test con el análogo de GnRH triptorelina. Tras la administración de triptorelina la paciente presentó un marcado descenso de las gonadotrofinas acompañado de la normalización de las cifras de testosterona. Los resultados demostraron la dependencia de gonadotrofinas del hiperandrogenismo de la paciente. Este hecho explicaría, como en otros pacientes28, la normalización transitoria de la testosterona observada en el postoperatorio inmediato de la adrenalectomía, probablemente debida a un descenso transitorio de las gonadotropinas por el estrés de la cirugía. Además, las cifras basales de FSH y LH de la paciente (en intervalo normal para la menopausia, a pesar de las concentraciones elevadas de andrógenos) indicaban que la secreción de andrógenos no tenía efecto inhibitorio directo en la secreción de gonadotropinas. Por último, la respuesta parcial al acetato de ciproterona o a los anticonceptivos orales se ha descrito en muchos otros casos29–31. El efecto inhibidor de los análogos de GnRH en la secreción de andrógenos por el ovario no sólo está mediado por la supresión de las gonadotropinas endógenas, sino que se ha demostrado un efecto directo en las células tumorales32,33.
A día de hoy, se ha replanteado la cirugía a la paciente y por el momento la desestima, por lo que nos planteamos el uso terapéutico de los análogos de GnRH. Aunque actualmente no hay consenso en el tratamiento con análogos de GnRH en esta enfermedad, se han descrito ciclos de duración de 6 semanas hasta 16 meses, tanto en hipertecosis como en tumores virilizantes de ovario23,25,34. Se han documentado remisiones prolongadas, con normalización de las cifras de testosterona y ausencia de síntomas durante periodos de observación de 3 y 4 años tras suspender la medicación23,25. La utilización de este tratamiento se descarta como primera opción teniendo en cuenta los buenos resultados de la cirugía y su mejor relación coste-eficacia. Sin embargo, se ha propuesto el uso de análogos de GnRH como una nueva vía de tratamiento conservador en pacientes que no aceptan la cirugía o en aquellos en los que está contraindicada19.
Las conclusiones obtenidas de este caso son: la presencia de un tumor adrenal no descarta la fuente ovárica de secreción de andrógenos, el diagnóstico diferencial es, en ocasiones, muy complicado debido a la poca especificidad de las pruebas dinámicas y a la alta prevalencia de incidentalomas adrenales. Los resultados analíticos postoperatorios se deben interpretar con cautela pues, como en el presente caso, pueden inducir a error. Y en segundo lugar, la respuesta a los agonistas de GnRH informa sobre la dependencia del hiperandrogenismo ovárico a las gonadotropinas. Los análogos de GnRH inducen la inhibición de las concentraciones de gonadotropinas y permiten la normalización de las de andrógenos, por lo que podrían ser una opción terapéutica en pacientes que están a la espera de cirugía o en aquellos en los que está contraindicada o la rechazan.