Tras estudios propios referentes a la evolución del sellado distal modificamos la actitud en el sellado de las endoprótesis de aorta abdominal: sellando en iliacas primitivas (IP) si eran menores de 16mm de diámetro y en iliacas externas (IE) si eran mayores. El objetivo del trabajo es valorar los efectos del cambio de criterio en el sellado distal.
Pacientes y métodosSe incluyeron los aneurismas infrarrenales programados consecutivos tratados mediante endoprótesis, desde enero de 2008 a diciembre de 2012. Se evaluó el crecimiento iliaco medio y las tasas de incidencia de endofugas tipo i distales (Ib), reintervenciones iliacas, trombosis de rama, rotura aórtica, mortalidad global y mortalidad relacionada con el aneurisma. Se excluyeron los casos con un seguimiento radiológico menor a 12 meses, aunque sí que fueron incluidos para valorar la mortalidad.
ResultadosSe incluyeron un total de 81 pacientes y 126 iliacas. La fijación distal se realizó en 86 IP y 40 IE. El seguimiento medio fue de 30,6±14 meses. El crecimiento medio de las IP fue –0,17±3mm (+1mm si la fijación fue en IP y –2,6mm si la fijación fue en IE; p=0,0001) y el de las IE fue de –0,10±1,4mm (–0,3mm si se fijó en IP y +0,4mm si se fijó en IE; p=0,01). No se detectaron endofugas Ib ni rotura del aneurisma. La tasa de reintervenciones iliacas total fue del 3,2% (4 casos, 1,1% en IP y 7,5% en IE; p=0,09). La tasa de trombosis de rama fue mayor en los pacientes con sellado en IE (10% frente a 0%; p=0,009), al igual que una mayor incidencia de claudicación glútea (37,5% frente a 4,6%; p=0,0001). La mortalidad postoperatoria fue del 2,5%. La mortalidad global y la relacionada con el aneurisma a los 3 años fue del 19,5% y 2,5% respectivamente (sin influir las reintervenciones en la mortalidad).
ConclusionesLos resultados avalan el cambio de estrategia en el sellado distal eliminando el riesgo de fuga Ib y de rotura aórtica en nuestra experiencia. Sin embargo, el sellado distal en IE se asocia a mayor trombosis de rama (sin aumentar la mortalidad relacionada con el aneurisma) y de claudicación glútea.
After assessing the results our own studies regarding the outcomes of patients in relation to distal sealing strategy, we modified our previous sealing approach of abdominal aortic endografts. For this study, distal sealing on common iliac artery (CI) is proposed when its diameter was less than 16mm, and in external iliac artery (EI) for diameters greater than 16mm. The aim of this study is to assess the effects of the modification of fixation criteria during follow-up.
Patients and methodsPatients consecutively treated for infrarenal aortic aneurysms by elective endovascular repair during the period between January 2008 and December 2012 were included.
Average iliac growth, type I distal endoleak (Ib), limb thrombosis, re-interventions due to iliac related complications were assessed, as well as overall mortality and aneurysm related mortality.
Patients with less than 12 months follow-up were excluded, although they were included in the analysis to assess mortality.
ResultsA total of 81 patients accounting for 126 iliacs were included. Distal fixation was carried out at CI in 86 and EI in 40 cases, respectively. Mean follow-up was 30.6±14 months. Average CI growth rate was –0.17±3mm (+1mm when fixation was performed in CI and -2.6mm when for fixation in EI; P=.0001); and -0.10±1.4mm for EI (–0.3mm when fixation was performed in CI and +0.4mm for fixation in EI; P=.01). No type 1b endoleaks or aneurysm ruptures were detected during follow-up. Total iliac re-intervention rate was 3.2% (4 cases, 1.1% in CI vs 7.5% in EI; P=.09). Limb thrombosis rate was higher in patients with sealing in EI (10% Vs 0%; P=.009), as well as the incidence of buttock claudication (37.5% vs. 4.6%; P=.0001). Perioperative mortality rate was 2.5%. Overall and aneurysm-related mortality at 3 years was 19.5% and 2.5% respectively (re-interventions did not have any influence on mortality rates).
ConclusionsThe observed results support the strategy modification in distal sealing zone, eliminating the risk of Ib endoleaks and aneurysm rupture in our experience. However, distal sealing in EI was associated with a higher incidence of limb thrombosis (Without any increase in aneurysm-related mortality), and buttock claudication.
El tratamiento endovascular de los aneurismas de aorta infrarrenales (EVAR) es en la actualidad el tratamiento de elección en muchos centros. Este se presenta como una técnica atractiva y mínimamente invasiva. Sin embargo, existen complicaciones durante el seguimiento que potencialmente requieren reintervención o conversión a cirugía abierta; especialmente complicaciones como endofugas tipo i o migraciones que pueden asociar crecimiento y rotura del aneurisma y la trombosis de rama1.
En nuestro centro se realizaron 2 estudios en los que se evaluó la evolución del sellado distal en el EVAR2,3. En el primer análisis se observó que en el sellado distal de arterias iliacas primitivas (IP) mayores a 16mm existía una mayor tasa de incidencia de endofugas Ib, tasa de reintervenciones y tasa de rotura del aneurisma con respecto a las IP menores de 16mm, así bien la tasa de mortalidad global y relacionada con el aneurisma fue menor, pero de forma estadísticamente no significativa. En el segundo se objetivó que en IP>16mm con sellado en arteria iliaca externa (IE) o en la propia IP existía menor tasa de endofugas Ib, reintervenciones iliacas, rotura aórtica y mortalidad relacionada con el aneurisma en el grupo de sellado en IE.
Tras los resultados se planteó una nueva estrategia de sellado distal en la que el sellado se realizara en IP si fuesen <16mm y en IE si fueran >16mm.
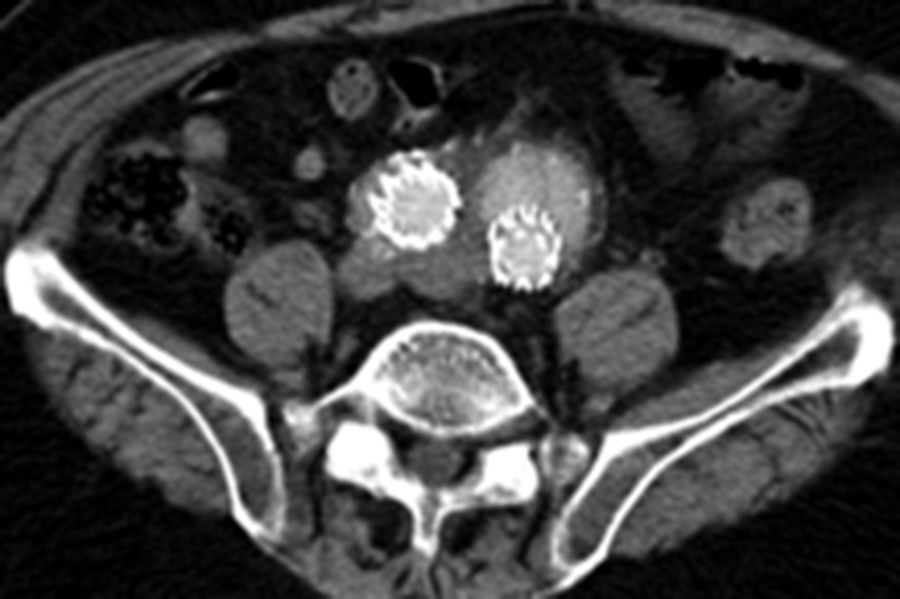
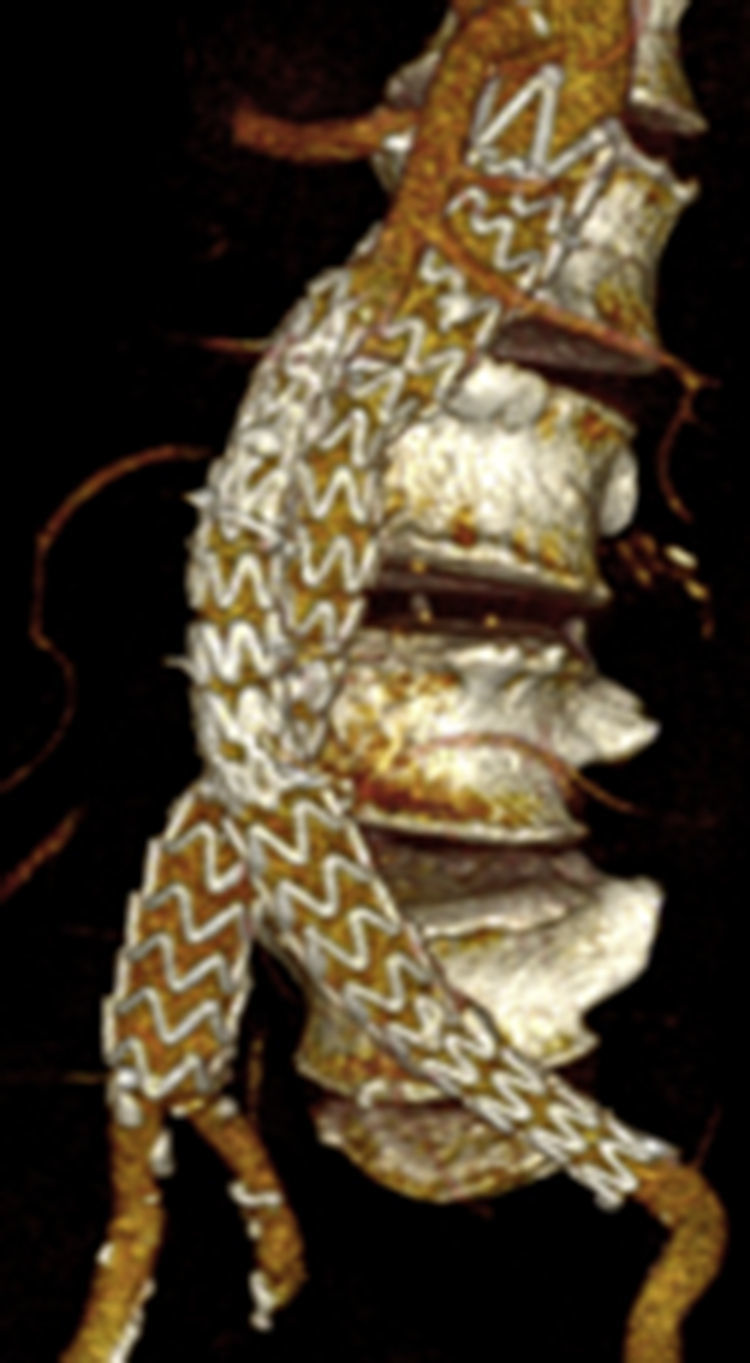
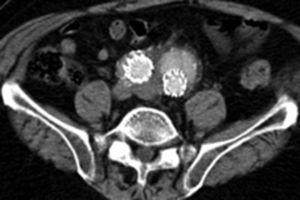
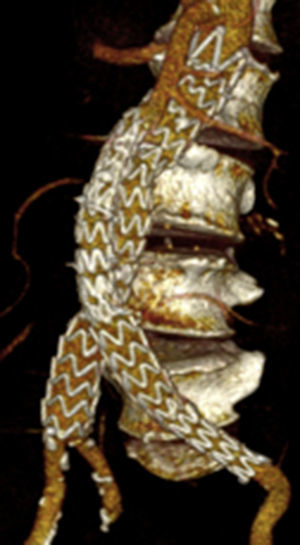
Por todo esto, el objetivo de este estudio es mostrar los resultados en la evolución de los aneurismas aórticos infrarrenales tratados de forma endovascular desde el cambio de estrategia del sellado distal (figs. 1 y 2).
Pacientes y métodoSe incluyeron los aneurisma aórticos infrarrenales tratados mediante EVAR de forma programada y consecutiva entre enero de 2008 y diciembre de 2012, se incluyeron aquellos en que se implantó una endoprótesis de sellado infrarrenal con fijación infrarrenal o suprarrenal, y bifurcadas o aortomonoiliacas. En lo que hace referencia al sellado distal se incluyeron los fijados en iliacas comunes, externas y también los que asociaban ramificación hipogástrica (iliac branch), excluyéndose estos últimos para la valoración de la claudicación glútea.
Se excluyeron los aneurismas tratados de forma urgente. Los pacientes con un seguimiento radiológico menor a 12 meses se desestimaron para el estudio comparativo pero no para el seguimiento clínico.
Se distinguió entre el seguimiento clínico (hasta la última revisión ambulatoria vascular) y el radiológico (última angio-TC realizada para estudio del EVAR.
A todos los pacientes incluidos en el estudio se les practicó al menos un estudio radiológico tipo angio-TC previo a la intervención, al mes postintervención y al año. El tamaño de los vasos iliacos se estimó mediante la realización de la línea central o center lumen line y midiendo de fuera a fuera de la pared arterial (outer to outer) en la zona de mayor diámetro. Todos los procedimientos de implante fueron practicados en un quirófano e íntegramente por cirujanos vasculares. Los pacientes completaron el postoperatorio con un mínimo de 24h en la Unidad de Cuidados Intensivos. El seguimiento clínico se realizó mediante exploración física y control analítico al mes, a los 6 meses y al año, y desde entonces anualmente. El seguimiento radiológico de la muestra fue mediante angio-TC; una previa a la intervención, al mes postintervención, al año y posteriormente de forma anual.
Variables a estudio y análisis estadísticoDe forma retrospectiva, mediante revisión de historias clínicas y exámenes radiológicos, se realizó un análisis descriptivo de los parámetros demográficos y de mortalidad, tanto global como relacionada con el aneurisma. A su vez realizamos un análisis comparativo entre el sellado en IP y en IE, en el que se comparó el crecimiento medio de las arterias iliacas, la incidencia de endofugas tipo Ib en la angio-TC, la tasa de trombosis de rama y de reintervención iliaca, la incidencia de claudicación glútea y de rotura aneurismática.
El procesamiento de datos se realizó con el programa SPSS® (versión 20 Mac) y los análisis estadísticos mediante el test de la «t» de Student para comparación de medias de muestras independientes, Chi-cuadrado de Pearson para el contraste de proporciones, el método de Kaplan-Meier para las curvas de supervivencia y el test de log-rank para su comparación.
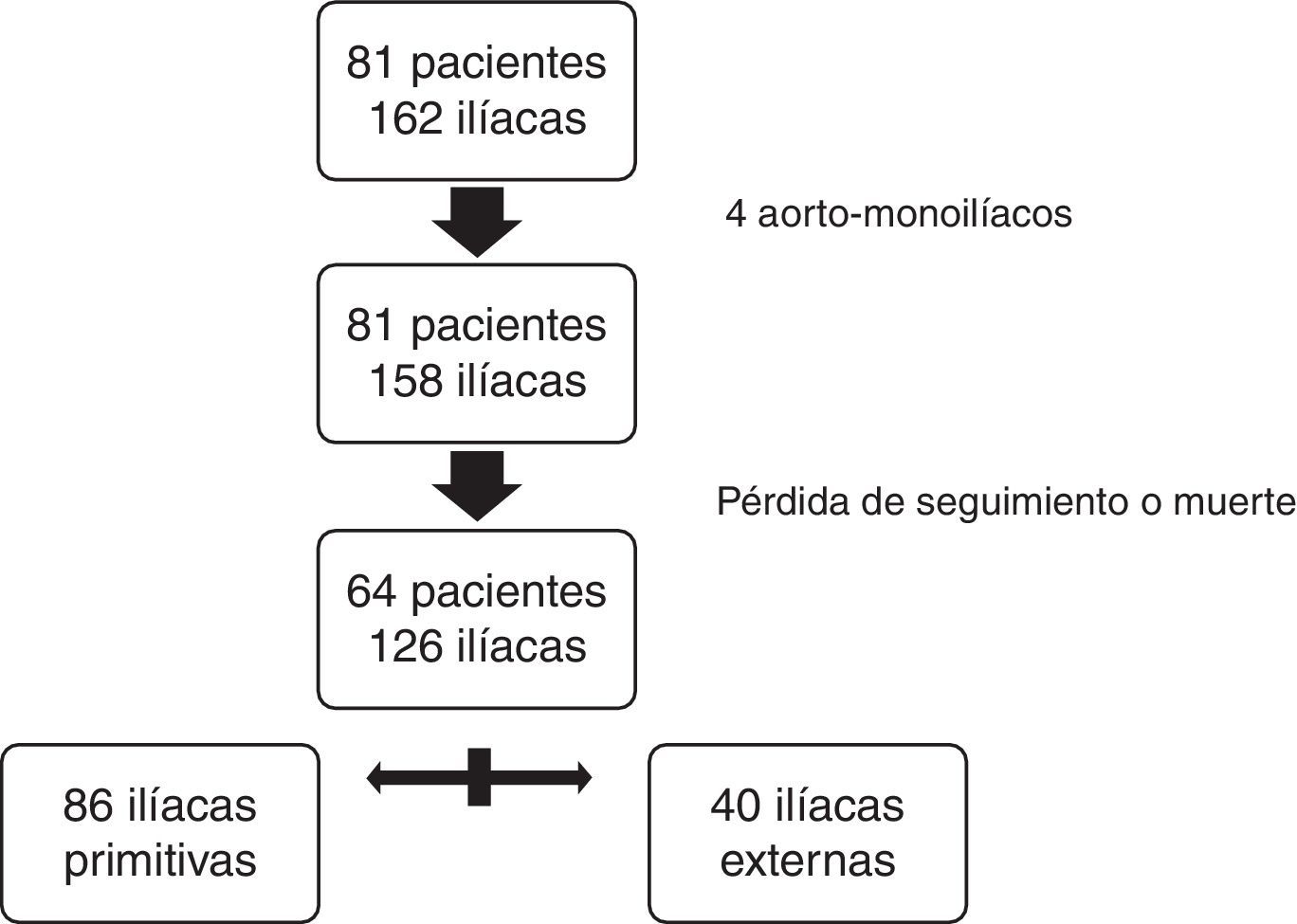
ResultadosDe los 81 pacientes con AAA reparados 4 recibieron un implante aorto-monoiliaco y 77 fueron reparados con prótesis bifurcadas.
Se emplearon 4 tipo de endoprótesis aórticas: 41 Excluder® (Gore, Flagstaff, Arizona), 24 Zenith® (Cook Medical Inc, Bloomington, Indianapolis), 14 Endurant® y 2 Talent® (Medtronic, Minneapolis, Minnesota). En lo que hace referencia a las 158 ramas iliacas iniciales: 85 fueron Excluder®, 27 Endurant®, 5 Talent®, 41 Zenith® (32 Flex, 3 LP, 2 ZSLE y 4 ZBIS).
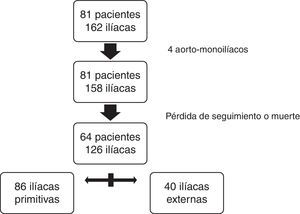
Para el estudio comparativo se excluyeron 17 pacientes (2 con prótesis aortomonoiliacas): 2 por muerte postoperatoria y el resto por falta de seguimiento radiológico mayor a un año. Finalmente, un total de 64 pacientes y 126 arterias iliacas cumplieron los criterios de inclusión definidos para el estudio comparativo. De las 126 fijaciones distales 86 se realizaron en IP y 40 en IE (fig. 3).
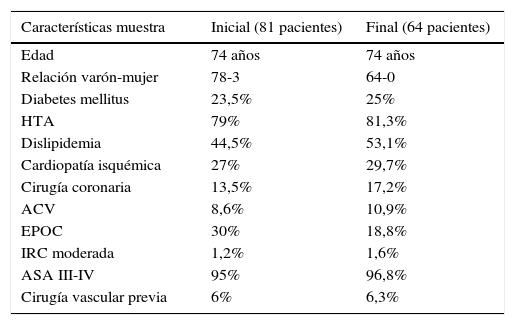
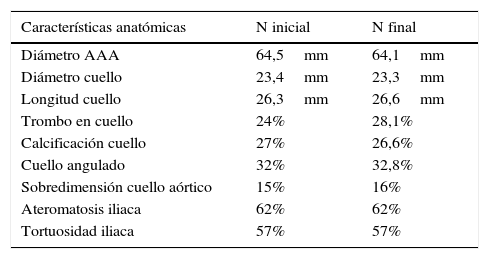
Las variables demográficas recogidas en el estudio y las variables anatómicas de los aneurismas aórticos tratados y su morfología ilíaca se encuentran representadas en las tablas 1 y 2.
Factores de riesgo de la muestra
| Características muestra | Inicial (81 pacientes) | Final (64 pacientes) |
|---|---|---|
| Edad | 74 años | 74 años |
| Relación varón-mujer | 78-3 | 64-0 |
| Diabetes mellitus | 23,5% | 25% |
| HTA | 79% | 81,3% |
| Dislipidemia | 44,5% | 53,1% |
| Cardiopatía isquémica | 27% | 29,7% |
| Cirugía coronaria | 13,5% | 17,2% |
| ACV | 8,6% | 10,9% |
| EPOC | 30% | 18,8% |
| IRC moderada | 1,2% | 1,6% |
| ASA III-IV | 95% | 96,8% |
| Cirugía vascular previa | 6% | 6,3% |
ACV: accidente cerebrovascular; ASA: Sociedad Americana de Anestesiología; EPOC: enfermedad pulmonar obstructiva crónica; HTA: hipertensión; IRC: insuficiencia renal crónica.
características del aneurisma
| Características anatómicas | N inicial | N final |
|---|---|---|
| Diámetro AAA | 64,5mm | 64,1mm |
| Diámetro cuello | 23,4mm | 23,3mm |
| Longitud cuello | 26,3mm | 26,6mm |
| Trombo en cuello | 24% | 28,1% |
| Calcificación cuello | 27% | 26,6% |
| Cuello angulado | 32% | 32,8% |
| Sobredimensión cuello aórtico | 15% | 16% |
| Ateromatosis iliaca | 62% | 62% |
| Tortuosidad iliaca | 57% | 57% |
N: muestra.
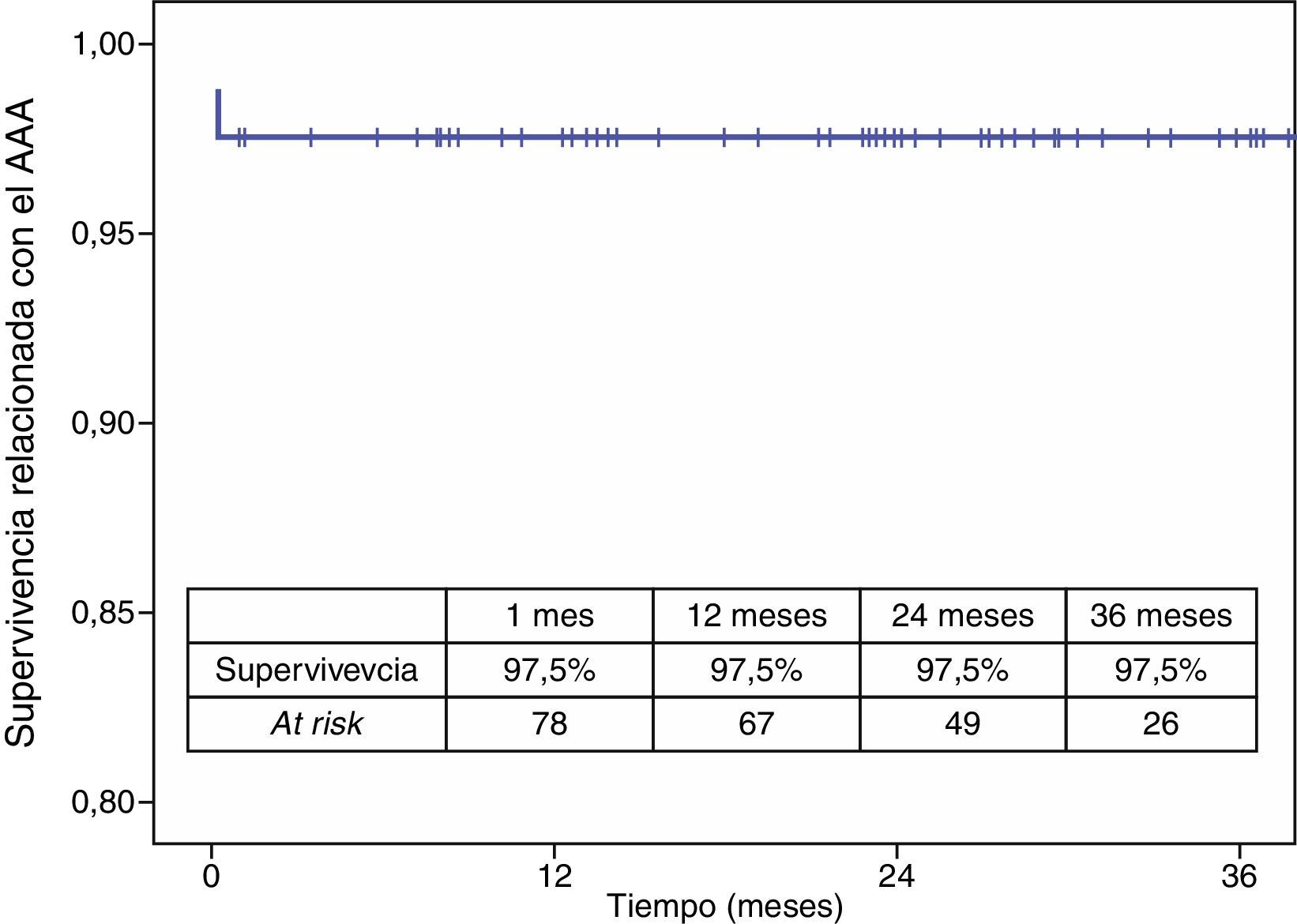
El seguimiento clínico medio fue de 30,6 meses y el radiológico de 24,6 meses.
En lo que hace referencia al comportamiento de las arterias ilíacas el tamaño medio de las IP, donde el sellado se realiza en la misma ilíaca primitiva, fue de 13,9mm previo a la intervención, y tras su seguimiento de 14,9mm, con un crecimiento de 1mm; sin embargo, si el sellado se producía en IE, el tamaño medio de IP previo era de 20,2mm y posteriormente de 17,6mm, con un decrecimiento de 2,6mm. Esta diferencia de crecimiento se mostró estadísticamente significativa con p<0,0001, siendo el crecimiento medio general de las IP de –0,17±3mm.
En lo que respecta al tamaño medio de las IE si el sellado se realiza en la IP fue de 9,1mm previo y 8,7mm posteriormente, con un decrecimiento de 0,3mm. En cambio, si el sellado se encontraba en la propia IE el tamaño inicial era de 10mm y el posterior de 10,4mm, con un crecimiento de 0,4mm. Esta diferencia de crecimiento también se mostró estadísticamente significativa con p<0,01, siendo el crecimiento medio de las IE de –0,10±1,4mm (tabla 3).
Comportamiento de iliaca primitiva y de iliaca externa
| Arteria ilíaca primitiva | Sellado en IP (86) | Sellado en IE (40) | p |
|---|---|---|---|
| Tamaño inicial (mm) | 13,9 | 20,2 | |
| Tamaño final (mm) | 14,9 | 17,6 | |
| Crecimiento (mm) | +1 | –2,6 | 0,0001 |
| Arteria ilíaca externa | Sellado en IP (86) | Sellado en IE (40) | p |
|---|---|---|---|
| Tamaño inicial (mm) | 9,1 | 10 | |
| Tamaño final (mm) | 8,7 | 10,4 | |
| Crecimiento (mm) | –0,3 | +0,4 | 0,01 |
IE: ilíaca externa; IP: ilíaca primitiva.
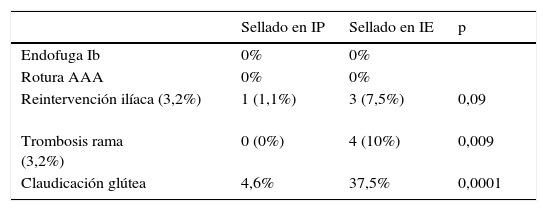
La tasa de reintervención iliaca fue del 3,2% (4 casos, 3 en IE y uno en IP), siendo del 1,1% si el sellado distal se realizó en IP y 7,5% en IE; p=0,09. Las 3 IE reintervenidas fue por trombosis aguda de rama y se solventaron mediante derivación extraanatómica (uno de ellos requirió puente axilobifemoral por tratarse de endoprótesis aortomonoilíaca y en los otros 2 puente femorofemoral). La reintervención de IC fue por estenosis significativa de rama, y se intervino de forma programada mediante angioplastia simple.
La tasa de trombosis de rama fue del 3,2% (4 casos), todos a expensas de sellado en IE (10% frente a 0%; p=0,009). En 3 se presentó de forma aguda (descrito previamente) y el otro caso se halló de forma casual en el control radiológico en paciente asintomático.
La incidencia de claudicación glútea en el primer control fue del 37,5% si el sellado era en IE frente al 4,6% en IP (p=0,0001). En este apartado se excluyeron las endoprótesis ilíacas ramificadas. Durante el seguimiento la claudicación se mantuvo en el 20% de los sellados en IE.
Durante el seguimiento no se detectaron endofugas tipo Ib (tanto en sellado en IP como en IE), al igual que no se observaron episodios de rotura aórtica en los pacientes (tabla 4).
Repercusión clínica
| Sellado en IP | Sellado en IE | p | |
|---|---|---|---|
| Endofuga Ib | 0% | 0% | |
| Rotura AAA | 0% | 0% | |
| Reintervención ilíaca (3,2%) | 1 (1,1%) | 3 (7,5%) | 0,09 |
| Trombosis rama (3,2%) | 0 (0%) | 4 (10%) | 0,009 |
| Claudicación glútea | 4,6% | 37,5% | 0,0001 |
AAA: aneurisma de aorta abdominal; IE: ilíaca externa; IP: ilíaca primitiva.
Otras variables secundarias valoradas fueron las fugas tipo ii, que en la primera TC de control se presentaron en 26 casos y en la última TC de control en 12 de ellos sin aparecer de novo. Cuatro requirieron reintervención mediante embolización selectiva de la endofuga. También se presentó un caso de endotensión, reintervenido de forma endovascular con éxito.
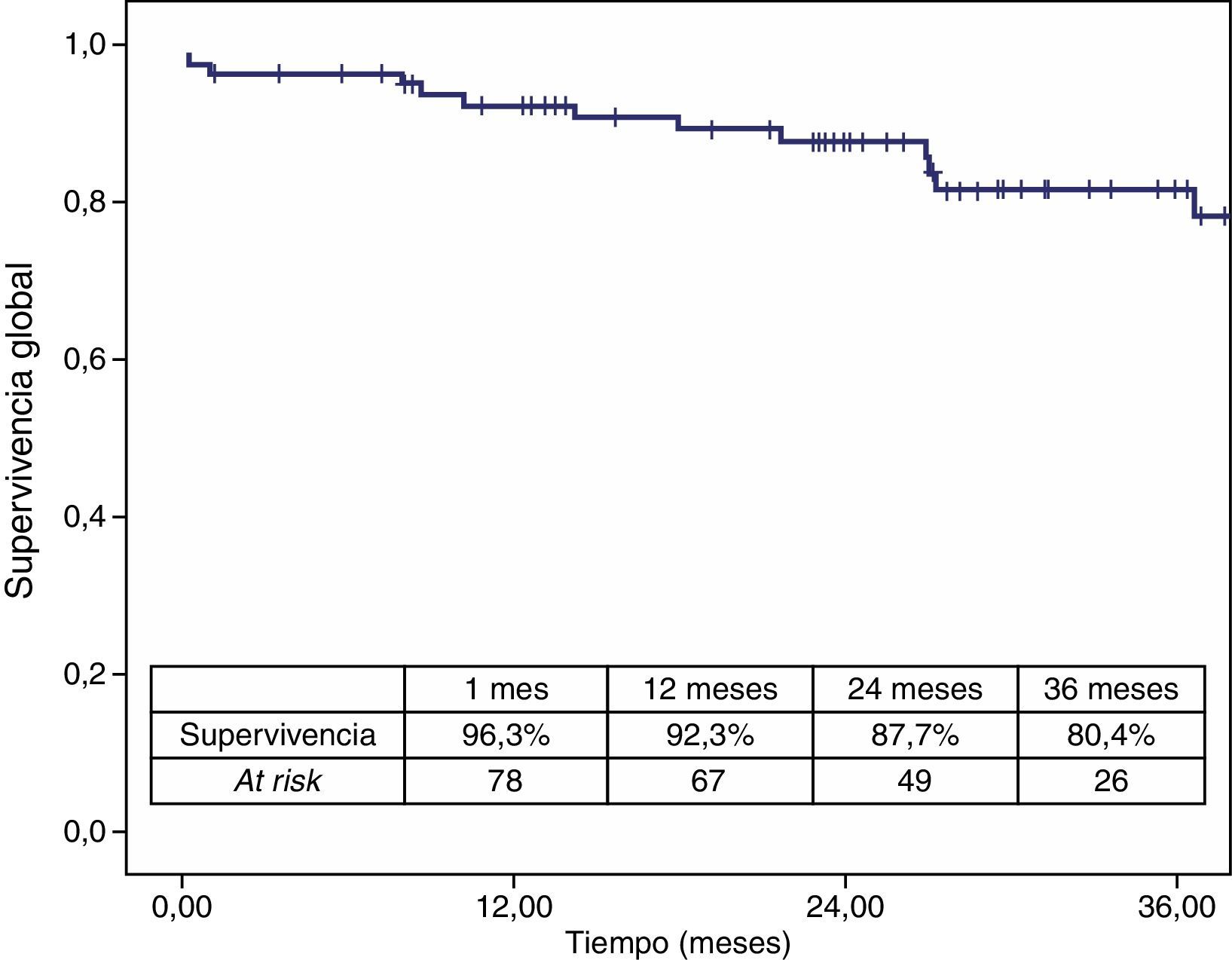
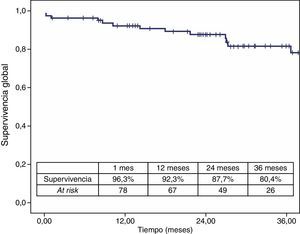
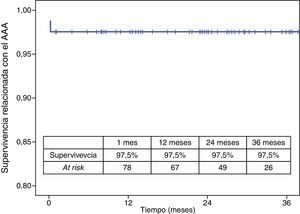
La mortalidad postoperatoria fue del 2,5% (2 casos). La mortalidad relacionada con el aneurisma a los 3 años fue del 2,5% y la global fue del 19,6%. Los casos que precisaron reintervención no aumentaron la mortalidad relacionada con el aneurisma (figs. 4 y 5).
DiscusiónEntre el 15% y el 30% de los AAA infrarrenales asocian dilatación o aneurisma de las IP en el momento del diagnóstico4,5. Anteriores estudios estimaron un crecimiento medio de 1mm anual para las IP menores de 3cm y de 2,6mm/año para las mayores, con un crecimiento medio de 1,5mm/año para las IP entre 17 y 30mm6. En nuestra serie se observa un ritmo de crecimiento similar, por lo que una IP de 16mm suele alcanzar a los 3 años un diámetro superior al de la prótesis a ese nivel, considerando los porcentajes de sobredimensión habituales, circunstancia constatada en otras series7. Este dato sugiere que la probabilidad de desarrollar una endofuga tipo Ib con las potenciales consecuencias de la misma no es despreciable.
En este nuevo estudio observamos una tendencia al crecimiento en la zona de sellado y una disminución del tamaño en la no sellada de forma estadísticamente significativa.
En los estudio previos propios se objetivó una tasa de endofugas Ib del 17% en el sellado en ilíacas comunes >16mm, comparándose con la ausencia de estas en el estudio actual. A su vez, la tasa de rotura aórtica en el mismo grupo del estudio previo fue del 7,5%, en cambio en el estudio actual no se observan.
Sin embargo, esta estrategia aumenta las probabilidades de trombosis de rama y de claudicación glútea: la trombosis de rama representa la tercera causa de reintervención en el EVAR y presenta una incidencia del 0-15% (nuestra tasa de trombosis de rama se encuentra entre estos márgenes)8,9. Los factores de riesgo predisponentes a la trombosis en el sellado distal son: la angulación o tortuosidad, calcificación o trombo mural y diámetros pequeños. Estos factores afectan en mayor medida a la región de la iliaca externa, observándose una mayor incidencia de trombosis frente al sellado en IC, al igual que se observa en nuestra muestra, donde únicamente se produjo trombosis en el grupo de sellado en IE10–13.
En su mayoría se presentan en los 6 primeros meses postimplantación y entre 68-87% se presentan de forma aguda, al igual que nuestra serie14.
La isquemia pélvica se produce por la interrupción de flujo directo a las arterias hipogástricas (HG) y su trascendencia es variable e impredecible. La complicación más frecuente es la claudicación glútea, con una tasa del 30-35%, y su desaparición o atenuación se estima en el 80% de los casos al año de tratamiento15–17. Sin embargo, en nuestra serie se observa una persistencia más elevada de la clínica de claudicación glútea (37,5% inicial y 20% persistente), al igual que en el estudio se Farahmand et al., donde observaron en el grupo de sellado en IE una tasa de claudicación persistente en el tiempo del 33%18. La segunda complicación por isquemia pélvica es la disfunción eréctil, que se presenta en un 17,5-25% de los casos, y a diferencia de la claudicación no se objetiva mejoría en el tiempo. Otras complicaciones menos habituales, pero de mayor gravedad, son la colitis isquémica o la isquemia medular, con una incidencia del 0,2-2% y <0,2%. En nuestra serie no se ha observado ningún caso sintomático de isquemia colónica o medular19,20.
Estas complicaciones isquémicas presentan mayor incidencia si la exclusión hipogástrica es bilateral o asocia embolización15,21,22. En los claudicantes pélvicos de nuestra serie el 43% asociaba embolización de hipogástrica y el 64% sellado en externas de forma bilateral.
Actualmente existen dispositivos ramificados para preservar la perfusión pélvica y disminuir la morbilidad de su exclusión, que en nuestra serie han sido implantados en 4 casos (ZBIS iliac branch, Zenith, Cook Medical). Estos dispositivos, además, son una vía de compensación, por colateralidad, de la perfusión de miembros inferiores en caso de arteriopatía periférica por medio de la comunicación al sistema pélvico contralateral y al sistema femoral profundo ipsilateral; también permiten preservar parte de la perfusión medular, y que en caso de precisar un tratamiento aórtico más extenso, disminuye el riesgo de isquemia medular23.
Al igual que otros grupos, creemos que los IBD son dispositivos efectivos a corto y medio plazo24,25. Pero hay que realizar una selección de los paciente que pueden beneficiarse de este tipo de tratamiento, ya que aumentan la complejidad y coste del procedimiento, y precisan de unas anatomías ilíacas concretas para poder colocarse26,27.
La mortalidad postoperatoria, la relacionada con el aneurisma y la global de nuestra serie son similares a la bibliografía revisada28,29. Cabe destacar que las complicaciones isquémicas, tanto pélvicas como de los miembros inferiores y las reintervenciones asociadas al EVAR, en nuestra serie no provocan un aumento de la mortalidad, siendo la mortalidad asociada al aneurisma la misma que la mortalidad postoperatoria, a diferencia de otras series publicadas30.
ConclusiónEn nuestra experiencia actual la ausencia de endofugas tipo Ib y de rotura aórtica como consecuencia del cambio de estrategia en el sellado distal avalan su normalización para nuestra serie.
Sin embargo, el sellado distal en IE se acompaña de un mayor número de trombosis de rama, aunque sin aumentar la mortalidad relacionada con el aneurisma en nuestra serie. El sellado en IE también asocia una mayor tasa de claudicación glútea.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesExiste conflicto de intereses por parte del Dr. Gómez Palonés (Consultor de Gore y Cook) y del Dr. Plaza Martínez (Consultor de Bard; esta casa comercial no está relacionada con el material empleado en el estudio).