Evaluar el porcentaje de sujetos con dislipidemias genéticas que alcanzaba el objetivo terapéutico de colesterol-LDL tras un año de seguimiento en las unidades de lípidos y riesgo vascular (URLV) de la Sociedad Española de Arteriosclerosis (SEA).
DiseñoEstudio observacional, longitudinal, retrospectivo, multicéntrico que incluyó de forma consecutiva a pacientes de ambos sexos mayores de 18 años remitidos por dislipidemias a las ULRV de la SEA. Se recogió información de la historia clínica del paciente en la primera visita y al año de seguimiento.
ResultadosParticiparon 527 pacientes diagnosticados de una dislipidemia genética, 241 de hipercolesterolemia familiar heterocigota (HFH) y 286 de hiperlipidemia familiar combinada (HFC). La mediana de tiempo entre las 2 visitas fue de 12,9 meses. La edad media fue de 48 años, siendo el 60% varones. En la visita final un 94% tomaba una estatina, un tercio lo asociaba a ezetimiba, pero solo un 41% tomaba un tratamiento hipolipemiante de alta potencia. Un 28,5% de los participantes alcanzó un colesterol-LDL<100mg/dl, un 35,8% consiguió un descenso del colesterol-LDL>50% en la última visita y un 53,8% alguno de los 2 objetivos. En el análisis multivariante la edad, el tabaquismo y la presencia de enfermedad vascular (solo en los sujetos con HFC) se asociaron significativamente con la consecución del objetivo del colesterol-LDL.
ConclusiónMás de la mitad de los pacientes con dislipidemias genéticas alcanza algún objetivo terapéutico de colesterol-LDL tras un año de seguimiento. La utilización de tratamientos con mayor potencia hipolipemiante podría mejorar estos resultados.
To evaluate low-density lipoprotein-cholesterol (LDLc) achieved in patients with genetic dyslipidemia treated during one year in Lipid and Vascular Risk Units (LVRU) of the Spanish Society of Arteriosclerosis (SSA).
DesignObservational, longitudinal, retrospective, multicenter national study that included consecutive patients of both sexes over 18 years of age referred due to dyslipidemia to LVRU of the SSA. Information was collected from medical records corresponding to two visits in the lipid unit.
ResultsA total of 527 patients (mean age 48 years, 60.0% men) diagnosed with genetic dyslipidemia (241 with heterozygous familial hypercholesterolemia, and 286 with familial combined hyperlipidemia) were included. The mean follow-up was 12.9 months. In the last visit, 94% were taking statins, one third combined with ezetimibe, although only 41% were taking a high-intensity hypolipidemic treatment. Overall, 28.5% of patients attained an LDLc level<100mg/dL, 35.8% decreased their LDLc by >50%, and 53.8% achieved one of the two. Predictors of target LDLc levels in the multivariate analysis were age, smoking habit and the presence of vascular disease.
ConclusionOver half of the patients with genetic dyslipidemia followed up by LVRU of SSA achieve LDLc objectives after one year of follow-up. The use of high-intensity hypolipidemic treatment could improve these results.
La hipercolesterolemia familiar heterocigota (HFH) y la hiperlipidemia familiar combinada (HFC) son 2 de las dislipidemias genéticas más prevalentes. La primera se caracteriza por una mutación generalmente del gen del receptor de las lipoproteínas de baja densidad (LDL) que se hereda con un rasgo autosómico dominante con una prevalencia aproximada de 1:5001. La HFC tiene un mecanismo hereditario probablemente poligénico y su prevalencia es alrededor de 1:502,3. Mientras que la HFH presenta concentraciones muy elevadas de colesterol-LDL desde el nacimiento, la HFC cursa con un fenotipo lipoproteico variable, generalmente una dislipidemia mixta, condicionado por factores genéticos, metabólicos y ambientales3. Ambas se caracterizan por presentar un riesgo muy aumentado de enfermedad coronaria prematura4,5. Así, las guías europeas de prevención cardiovascular clasifican a los pacientes con dislipidemias familiares como de alto riesgo cardiovascular con un objetivo de colesterol-LDL<100mg/dl6.
Numerosos ensayos clínicos han demostrado de manera inequívoca que los descensos del colesterol-LDL secundarios al tratamiento con estatinas se asocian con significativos descensos en el riesgo de nuevos eventos cardiovasculares7. Este efecto es independiente de la concentración basal de colesterol-LDL y es mayor en los pacientes con un mayor riesgo cardiovascular absoluto7. Así, se ha descrito que los pacientes con HFH tratados con estatinas tienen un riesgo de cardiopatía isquémica casi similar a la población general8, especialmente cuando se emplean tratamientos hipolipemiantes potentes9. Desafortunadamente un porcentaje importante de pacientes con HFH no reciben tratamiento hipolipemiante o si lo reciben tiene poca potencia hipolipemiante10.
El objetivo de este estudio fue investigar el porcentaje de pacientes con HFH e HFC seguidos en las unidades de lípidos y riesgo vascular (ULRV) de la Sociedad Española de Arteriosclerosis (SEA) que alcanzan el objetivo terapéutico de colesterol-LDL, los factores asociados a la consecución del mismo y el tratamiento hipolipemiante recibido.
Pacientes y métodosDiseño del estudioEl EDICONDIS-ULISEA fue un estudio observacional, longitudinal, retrospectivo, multicéntrico y nacional con el objetivo de investigar la tasa de éxito terapéutico en pacientes remitidos a las ULRV acreditadas por la SEA11. El presente trabajo es un subestudio del mismo, centrándose en los pacientes con 2 dislipidemias de origen genético (la HFH y la HFC). Se incluyeron de forma consecutiva a pacientes de ambos sexos mayores de 18 años de edad, remitidos por dislipidemia a dichas unidades, entre junio y octubre de 2010. Se excluyeron los pacientes que estaban o habían participado en ensayos clínicos en los 15 meses anteriores al inicio del estudio, y aquellos con hipotiroidismo no controlado, insuficiencia renal grave, hepatopatía crónica, cáncer, dislipidemias secundarias a fármacos o embarazo. Se recogió la información de la historia clínica del paciente correspondiente a 2 consultas realizadas en las ULRV: la primera, visita inicial, efectuada entre los meses de junio a octubre de 2010, y la segunda coincidiendo con una consulta de seguimiento que fuera la última visita registrada en la unidad de la que se tengan datos disponibles para completar el registro. El periodo de recogida de datos fue del 1 de diciembre de 2011 al 29 de febrero de 2012. De cada paciente se registró la edad, el sexo, los datos demográficos, el diagnóstico de la dislipidemia, las características antropométricas, los factores de riesgo cardiovascular, así como el perfil lipídico, glucemia, tratamiento farmacológico y no farmacológico en el momento de sus 2 consultas (primera y última disponible). El consumo de alcohol se estratificó en bajo-medio (<30g/día en la mujer; <40g/día en el varón), alto (>30g/día en la mujer; >40g/día en el varón) y no bebedor. La estrategia farmacológica hipocolesterolemiante se clasificó en los siguientes niveles según el tipo y la dosis de estatina utilizada y su asociación o no con ezetimiba: a) baja potencia: simvastatina 10mg, pravastatina 10 y 20mg, lovastatina 20mg, fluvastatina 20 y 40mg, pitavastatina 1mg; b) potencia moderada: atorvastatina 10 y 20mg, rosuvastatina 5 y 10mg, simvastatina 20 y 40mg, pravastatina 40mg, lovastatina 40mg, fluvastatina 80mg, pitavastatina 2 y 4mg, y cualquier mezcla de estatina de baja potencia con ezetimiba; c) alta potencia: atorvastatina 40 u 80mg, rosuvastatina 20mg, y cualquier mezcla de estatina de moderada o alta potencia con ezetimiba. Se consideró que se había alcanzado el objetivo terapéutico del colesterol-LDL cuando su concentración en la última visita era <100mg/dl, de acuerdo con la guías europeas de prevención cardiovascular de 200712. Como objetivo secundario se consideró alcanzar un colesterol-LDL <100mg/dl o conseguir un descenso del colesterol-LDL>50%.
Análisis estadísticoLas variables categóricas se resumen con la frecuencia relativa (%). Para las variables continuas se calculó en primer lugar la «normalidad» de las variables mediante el test de bondad de ajuste a la distribución normal de Kolmogorov-Smirnov; en caso de aproximarse a la misma, se calculó como medida de tendencia central la media y la desviación típica como medida de dispersión, y la mediana y el rango intercuartílico en caso contrario. Para el estudio de las posibles diferencias en las variables cuantitativas entre grupos de comparación, en caso de normalidad se empleó la prueba de la t de Student con corrección para varianzas no homogéneas, sí fue necesario para la comparación entre 2 grupos y ANOVA cuando se compararon más de 2 grupos utilizando el test de Bonferroni como prueba de comparaciones múltiples. En el caso de que las variables no siguieran una distribución normal se realizó el test no paramétrico más apropiado (Mann-Whitney o Kruskal-Wallis). Las comparaciones de los valores cuantitativos medidos entre las 2 visitas se realiza con el test de la t de Student de muestras pareadas o bien con el test de Wilcoxon, según los valores se aproximarán o no a la distribución gaussiana. Para analizar la asociación entre variables cualitativas se realizaron tablas de contingencia empleando la prueba de «ji-cuadrado de Pearson» si el tamaño de la muestra era suficientemente grande y el test exacto de Fisher en los casos en que fue necesario debido al escaso tamaño de la misma (20 o más celdas con valores de frecuencia esperada inferiores a 5). Para la comparación de los valores cualitativos de muestras pareadas, comparando los valores de la primera versus la última visita, se empleó el test de McNemar. Se realizó una regresión logística condicional binaria. La variable dependiente fue el cumplimiento de los objetivos de colesterol LDL. En primer lugar se realizó con cada una de las variables independientes una regresión univariante en cada uno de los 2 grupos estudiados (HFH e HFC). En las que se obtuvo un valor de significación estadística p<0,2, se efectuó una regresión logística multivariante mediante el método de pasos sucesivos hacia delante (stepwise forward), con una probabilidad de entrada de 0,1 y de salida de 0,15. En todos los análisis se estableció un nivel de significación en valores por debajo de 0,05. Para el análisis de los resultados se empleó el programa estadístico SPSS, versión 19.0, para Windows.
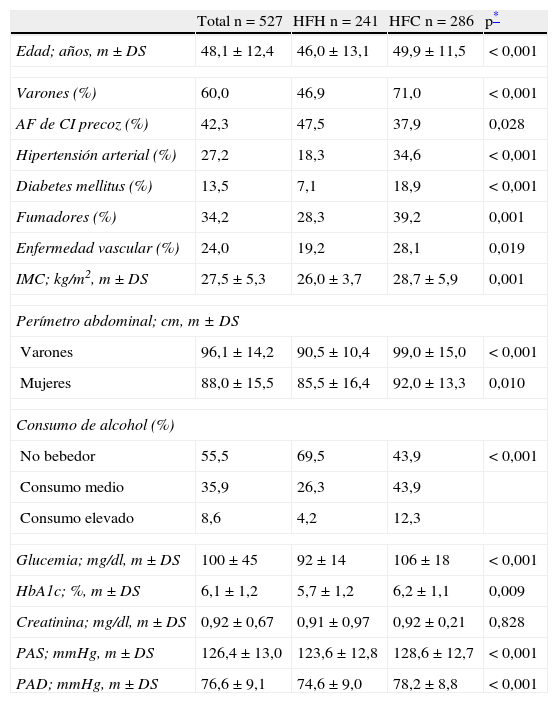
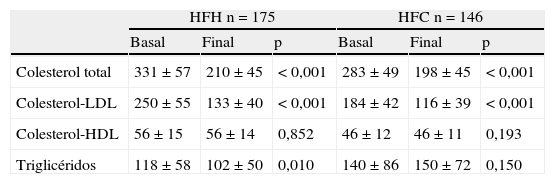
ResultadosDe los 1.828 pacientes procedentes de las 43 ULRV de la SEA incluidos en el estudio original, un total de 241 estaban diagnosticados de HFH y 286 de HFC. Estos 527 pacientes son la base del presente análisis. La edad media era de 58,1 años, un 60% eran varones, un 13,5% eran diabéticos y un 24% ya habían padecido una enfermedad cardiovascular. Las características clínico-biológicas del total de la población y separada por el tipo de dislipidemia se muestra en la tabla 1. Los pacientes con HFH eran más jóvenes con un mayor porcentaje de mujeres, mientras que los sujetos con HFC tenían una mayor prevalencia de los factores de riesgo y de enfermedad cardiovascular, tenían un mayor sobrepeso, junto con glucemias y presiones arteriales más altas. En la tabla 2 se muestra el perfil lipídico basal y en la última visita de los participantes que no tomaban fármacos hipolipemiantes en la primera visita. Los pacientes con HFH tenían concentraciones de colesterol total, colesterol LDL y colesterol-HDL más altas en ambas visitas, mientras que los sujetos con HFC tenían concentraciones superiores de triglicéridos. La mediana de tiempo entre las 2 visitas fue de 12,9 meses. En ambos grupos de pacientes hubo un descenso significativo de la media del colesterol total y del colesterol-LDL. No se modificó el colesterol-HDL, mientras que los triglicéridos disminuyeron solo en los sujetos con HFH.
Características clínico-biológicas de la población en general y divididos según el tipo de dislipidemia: hipercolesterolemia familiar heterocigota (HFH) e hiperlipidemia familiar combinada (HFC)
| Total n=527 | HFH n=241 | HFC n=286 | p* | |
| Edad; años, m±DS | 48,1±12,4 | 46,0±13,1 | 49,9±11,5 | <0,001 |
| Varones (%) | 60,0 | 46,9 | 71,0 | <0,001 |
| AF de CI precoz (%) | 42,3 | 47,5 | 37,9 | 0,028 |
| Hipertensión arterial (%) | 27,2 | 18,3 | 34,6 | <0,001 |
| Diabetes mellitus (%) | 13,5 | 7,1 | 18,9 | <0,001 |
| Fumadores (%) | 34,2 | 28,3 | 39,2 | 0,001 |
| Enfermedad vascular (%) | 24,0 | 19,2 | 28,1 | 0,019 |
| IMC; kg/m2, m±DS | 27,5±5,3 | 26,0±3,7 | 28,7±5,9 | 0,001 |
| Perímetro abdominal; cm, m±DS | ||||
| Varones | 96,1±14,2 | 90,5±10,4 | 99,0±15,0 | <0,001 |
| Mujeres | 88,0±15,5 | 85,5±16,4 | 92,0±13,3 | 0,010 |
| Consumo de alcohol (%) | ||||
| No bebedor | 55,5 | 69,5 | 43,9 | <0,001 |
| Consumo medio | 35,9 | 26,3 | 43,9 | |
| Consumo elevado | 8,6 | 4,2 | 12,3 | |
| Glucemia; mg/dl, m±DS | 100±45 | 92±14 | 106±18 | <0,001 |
| HbA1c; %, m±DS | 6,1±1,2 | 5,7±1,2 | 6,2±1,1 | 0,009 |
| Creatinina; mg/dl, m±DS | 0,92±0,67 | 0,91±0,97 | 0,92±0,21 | 0,828 |
| PAS; mmHg, m±DS | 126,4±13,0 | 123,6±12,8 | 128,6±12,7 | <0,001 |
| PAD; mmHg, m±DS | 76,6±9,1 | 74,6±9,0 | 78,2±8,8 | <0,001 |
m±DS: media±desviación estándar.
AF: antecedentes familiares; CI: cardiopatía isquémica; HbA1c: hemoglobina glicada; IMC: índice de masa corporal.
Perfil lipídico basal y en la última visita de los 321 participantes que no estaban recibiendo tratamiento hipolipemiante en la visita basal
| HFH n=175 | HFC n=146 | |||||
| Basal | Final | p | Basal | Final | p | |
| Colesterol total | 331±57 | 210±45 | <0,001 | 283±49 | 198±45 | <0,001 |
| Colesterol-LDL | 250±55 | 133±40 | <0,001 | 184±42 | 116±39 | <0,001 |
| Colesterol-HDL | 56±15 | 56±14 | 0,852 | 46±12 | 46±11 | 0,193 |
| Triglicéridos | 118±58 | 102±50 | 0,010 | 140±86 | 150±72 | 0,150 |
En mg/dl. Media±Desviación estándar.
HFC: hiperlipidemia familiar combinada; HFH: hipercolesterolemia familiar heterocigota.
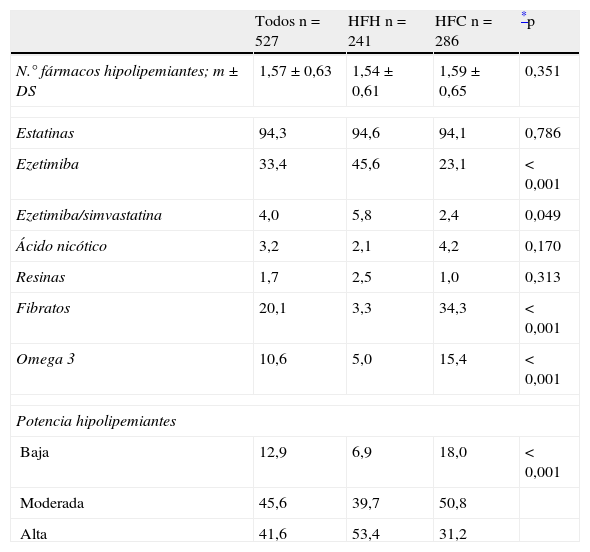
Respecto al tratamiento hipolipemiante todos los pacientes lo estaban recibiendo en la visita final. Tomaban una media de 1,57±0,63 fármacos, sin que hubiera diferencias entre subgrupos. La tasa de utilización de los diferentes fármacos hipolipemiantes se muestra en la tabla 3. Un 94% de los pacientes tomaba estatinas. Los sujetos con HFH utilizaban más frecuentemente la ezetimiba, mientras que aquellos con HFC usaban los fibratos y los omega-3 con mayor frecuencia. La mitad de los pacientes con HFH tomaban fármacos con una potencia hipolipemiante alta frente a un tercio de los participantes con HFC.
Tratamiento hipolipemiante en la última visita en el total de la población y divididos según el tipo de dislipidemia: hipercolesterolemia familiar heterocigota (HFH) e hiperlipidemia familiar combinada (HFC)
| Todos n=527 | HFH n=241 | HFC n=286 | *p | |
| N.° fármacos hipolipemiantes; m±DS | 1,57±0,63 | 1,54±0,61 | 1,59±0,65 | 0,351 |
| Estatinas | 94,3 | 94,6 | 94,1 | 0,786 |
| Ezetimiba | 33,4 | 45,6 | 23,1 | <0,001 |
| Ezetimiba/simvastatina | 4,0 | 5,8 | 2,4 | 0,049 |
| Ácido nicótico | 3,2 | 2,1 | 4,2 | 0,170 |
| Resinas | 1,7 | 2,5 | 1,0 | 0,313 |
| Fibratos | 20,1 | 3,3 | 34,3 | <0,001 |
| Omega 3 | 10,6 | 5,0 | 15,4 | <0,001 |
| Potencia hipolipemiantes | ||||
| Baja | 12,9 | 6,9 | 18,0 | <0,001 |
| Moderada | 45,6 | 39,7 | 50,8 | |
| Alta | 41,6 | 53,4 | 31,2 | |
En % salvo que se exprese otras unidades.
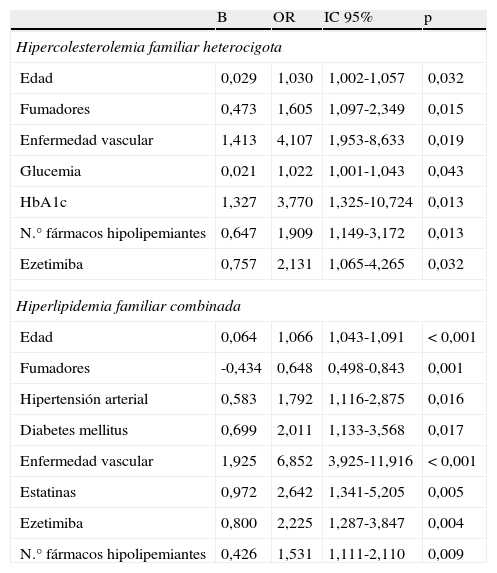
Un 56% de los pacientes estaba tomando tratamiento hipolipemiante en la visita basal y de ellos un 17,6% tenía un colesterol-LDL<100mg/dl (7,5 y 26,9% para los grupos HF y HFC respectivamente). Un 28,5% de los participantes alcanzaron dicho objetivo en la última visita (15,8% de los sujetos con HFH y un 39,2% de aquellos con HFC). En la tabla 4 se muestran los factores asociados significativamente con la consecución de dicho objetivo en el análisis univariante. En el análisis multivariante la edad (OR=1,065 [IC 95% 1,015-1,118], p=0,011) y el tabaquismo (OR=2,524 [IC 95% 1,371-4,646], p=0,003) se asociaron con la consecución de objetivos en los pacientes con HFH, mientras que la edad (OR=1,059 [IC 95% 1,024-1,096], p=0,001), el tabaquismo (OR=0,526 [IC 95% 0,362-0,765], p=0,001) y la presencia de enfermedad vascular (OR=3,207 [IC 95% 1,571-6,543], p=0,001) en los sujetos con HFC.
Factores asociados significativamente (p<0,05) en el análisis univariante con la consecución del objetivo de colesterol-LDL<100mg/dl en sujetos con hipercolesterolemia familiar heterocigota (HFH) e hiperlipidemia familiar combinada (HFC)
| B | OR | IC 95% | p | |
| Hipercolesterolemia familiar heterocigota | ||||
| Edad | 0,029 | 1,030 | 1,002-1,057 | 0,032 |
| Fumadores | 0,473 | 1,605 | 1,097-2,349 | 0,015 |
| Enfermedad vascular | 1,413 | 4,107 | 1,953-8,633 | 0,019 |
| Glucemia | 0,021 | 1,022 | 1,001-1,043 | 0,043 |
| HbA1c | 1,327 | 3,770 | 1,325-10,724 | 0,013 |
| N.° fármacos hipolipemiantes | 0,647 | 1,909 | 1,149-3,172 | 0,013 |
| Ezetimiba | 0,757 | 2,131 | 1,065-4,265 | 0,032 |
| Hiperlipidemia familiar combinada | ||||
| Edad | 0,064 | 1,066 | 1,043-1,091 | <0,001 |
| Fumadores | -0,434 | 0,648 | 0,498-0,843 | 0,001 |
| Hipertensión arterial | 0,583 | 1,792 | 1,116-2,875 | 0,016 |
| Diabetes mellitus | 0,699 | 2,011 | 1,133-3,568 | 0,017 |
| Enfermedad vascular | 1,925 | 6,852 | 3,925-11,916 | <0,001 |
| Estatinas | 0,972 | 2,642 | 1,341-5,205 | 0,005 |
| Ezetimiba | 0,800 | 2,225 | 1,287-3,847 | 0,004 |
| N.° fármacos hipolipemiantes | 0,426 | 1,531 | 1,111-2,110 | 0,009 |
IC: intervalo de confianza; OR: Odds ratio.
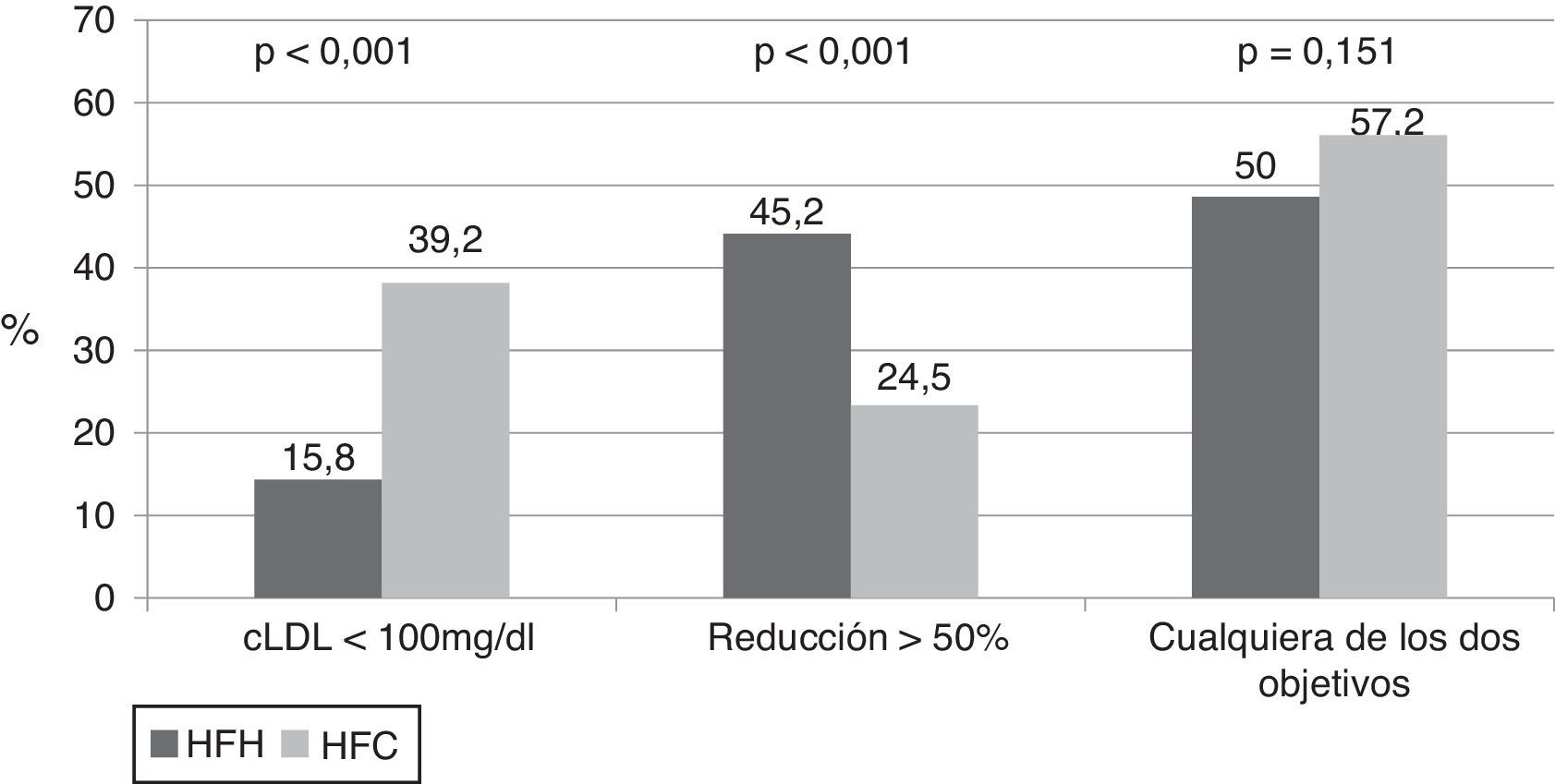
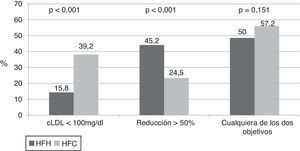
Un 35,8% de los pacientes consiguió un descenso del colesterol-LDL>50% (45,2% en los pacientes con HFH y 24,5% en aquellos con HFC). El objetivo secundario de conseguir un colesterol-LDL <100mg/dl o un descenso del colesterol-LDL>50% fue alcanzado por un 53,8% de los participantes, un 50% en el grupo de HFH y un 57,2% en el de HFC (fig. 1).
DiscusiónMás de la mitad de los pacientes con HFH e HFC seguidos en las ULRV de la SEA alcanzaron algún objetivo terapéutico recomendado, colesterol-LDL<100mg/dl o descenso de colesterol-LDL superior al 50%, a pesar de partir todos ellos de concentraciones lipídicas muy elevadas.
Tal como era de esperar, los pacientes con HFH partían con concentraciones basales más altas de colesterol-LDL, mientras que los participantes con HFC tenían una mayor concentración de triglicéridos y un menor colesterol-HDL, además de ser más obesos con una mayor proporción de hipertensos y diabéticos. Nuestros resultados confirman la frecuente asociación de la HFC con las alteraciones del metabolismo hidrocarbonado y los distintos componentes del síndrome metabólico4. Comparando las características de nuestros pacientes con los de la mayor serie nacional con más de 1.000 sujetos con diagnóstico genético de HFH, a pesar de tener una edad similar nuestros participantes presentaban concentraciones de colesterol-LDL basales casi 30mg/dl más altas, que podrían justificar su mayor prevalencia de enfermedad vascular (19,4 versus 14%)13.
Casi el 95% de nuestros pacientes recibían tratamiento con estatinas, un tercio de ellos asociado con ezetimiba especialmente en el grupo con HFH, y un quinto de ellos asociado con un fibrato especialmente en el grupo con HFC, siendo el uso de otros hipolipemiantes poco relevante. En la serie de Mata et al.13 el porcentaje de participantes tomando estatinas era similar pero su asociación con ezetimiba era inferior (31,3 versus 45,6%). Nuestro porcentaje de pacientes con HFH y tratamiento combinado fue similar al de una cohorte norteamericana (44%)14 y algo inferior al de una cohorte holandesa (52%)15.
Las guías europeas de prevención cardiovascular recomiendan reducir el colesterol-LDL por debajo de 100mg/dl, como objetivo terapéutico en los pacientes con dislipidemias familiares6. Poco más de un cuarto de los participantes (28,5%) alcanzaron dicho objetivo en la última visita (15,8% de los sujetos con HFH y un 39,2% de aquellos con HFC), si bien solo un tercio de los participantes con HFC y más de la mitad de los pacientes con HFH utilizaban un tratamiento hipolipemiante de alta potencia. Nuestro porcentaje de consecución de objetivos en los pacientes con HFH es claramente superior a la serie de Mata (3,4%), probablemente por su menor utilización de tratamientos combinados13. Piljman et al.15, en una cohorte holandesa con más de 1.200 pacientes con HFH, alcanzaron el objetivo terapéutico en un 21% de los participantes. Por otra parte, Ellis et al.14 en más de 300 sujetos con HFH seguidos en un mismo hospital de Cincinnati lograron el objetivo en un 30% de ellos, si bien tenían un alto porcentaje de pacientes con un evento cardiovascular y hasta el 21% de los participantes tomaba 3 fármacos hipolipemiantes simultáneamente.
Entre los factores asociados con alcanzar el objetivo terapéutico de colesterol-LDL en el análisis univariante en los 2 grupos de nuestro estudio destacaban la mayor edad, el tabaquismo, la presencia de enfermedad vascular, el número de fármacos hipolipemiantes y el tratamiento con ezetimiba, entre otros.
La asociación del tratamiento con ezetimiba con la consecución de objetivos ya ha sido previamente descrita13, así como su asociación con la presencia de enfermedad vascular15. Solo la edad, el tabaquismo y la presencia de enfermedad vascular, esta última solo en la HFC, se mantuvieron significativos en el análisis multivariante. A destacar el efecto paradójico del tabaquismo en ambas entidades, ya que mientras su presencia se asociaba a la consecución del objetivo en la HFH, era su ausencia la que lo hacía en la HFC, sin que tengamos una clara explicación para este hecho.
Algunas guías no mencionan un objetivo concreto de descenso del colesterol-LDL pero sí recomiendan reducirlo>50% en los pacientes con dislipidemias genéticas16,17. Más de un tercio del total de nuestros pacientes consiguió dicho descenso, un 45% en el grupo con HFH. Esta cifra es similar a la alcanzada en la serie de Mata (51,5%)13 y en la de Piljman (47%)15. Las recientes guías de la Sociedad Americana del Corazón18 se olvidan de los objetivos terapéuticos y recomiendan tratar a los individuos de alto riesgo con estatinas de alta potencia para conseguir descensos del colesterol-LDL mayores del 50%. En dichas guías insisten que la no consecución del objetivo de colesterol-LDL en pacientes con HFH no debe considerarse un fracaso ya que en estudios observacionales con dichos pacientes se han descrito reducciones de los eventos cardiovasculares asociados a descensos del colesterol LDL superiores al 50%, independientemente de haber alcanzado el objetivo terapéutico18.
La insuficiente proporción de pacientes con dislipidemias genéticas que alcanzaron cualquiera de los 2 objetivos se puede atribuir a las altas concentraciones basales de colesterol-LDL, a la utilización de estatinas poco potentes, a la limitada utilización de combinaciones de fármacos hipolipemiantes y, en algunos casos, por la insuficiente potencia hipolipemiante de los fármacos disponibles10. El desarrollo de nuevos fármacos como los inhibidores de la PCSK-9 tendrán sin duda un importante papel en este tipo de pacientes19,20.
Entre las principales limitaciones de nuestro estudio se incluirían el diseño retrospectivo del estudio, que los diagnósticos de HFH y HFC se hicieron en cada una de las unidades y no de forma centralizada, que no todos los pacientes con HFH tenían un diagnóstico genético y que es posible que alguno de los pacientes diagnosticado de HFC fuera en realidad una HFH ya que no se descartó esta posibilidad mediante el test genético.
En conclusión, más de la mitad de los pacientes con dislipidemias genéticas seguidos en las ULRV de la SEA alcanzan algún objetivo terapéutico de colesterol-LDL tras un año de seguimiento. La utilización de tratamientos con mayor potencia hipolipemiante podría mejorar estos resultados.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A las ULRV de la Sociedad Española de Arteriosclerosis (véase anexo 1).
Listado alfabético de participantes por Unidades de Lípidos y Riesgo Vascular de la Sociedad Española de Arteriosclerosis
Fátima Almagro Múgica (Hospital Donostia, San Sebastián). José Luis Aranda Arcas (Hospital Universitario 12 de Octubre, Madrid). Jorge Argimón Pallás (Hospital Sagrat Cor, Barcelona). Pedro Armario García (Hospital General de l’Hospitalet, l’Hospitalet de Llobregat, Barcelona).Teresa Arrobas Velilla (Hospital Virgen Macarena, Sevilla). Aurelio Baixauli Rubio (Hospital de Manises, Manises, Valencia). Miguel Ángel Barba Romero (Complejo Hospitalario y Universitario de Albacete, Albacete). Antonio Becerra Fernández (Hospital Universitario Ramón y Cajal, Madrid). Ángel Brea Hernando (Hospital San Pedro, Logroño). Julio A. Carbayo Herencia (Clínica Nuestra Sra. del Rosario, Albacete). Fernando Civeira Murillo (Hospital Universitario Miguel Servet, Zaragoza). Margarita Esteban Salán (Hospital de Cruces, Bilbao). Jacinto Fernández Pardo (Hospital General Universitario Reina Sofía, Murcia). Juan Carlos Ferrando Vela (Hospital Royo Villanova, Zaragoza). Francisco Fuentes Jiménez (Hospital Universitario Reina Sofía, Córdoba). Montserrat García Cors (Hospital General de Catalunya, Sant Cugat del Vallès, Barcelona). Juan de Dios García Díaz (Hospital Universitario Príncipe de Asturias, Alcalá de Henares, Madrid). Francisca García Iglesias (Hospital Carlos III, Madrid). José Luis Hernández Hernández (Hospital Universitario Marqués de Valdecilla, Santander). Luis Irigoyen Cucalon (Hospital Universitario Araba, Vitoria). Sergio Jansen Chaparro (Hospital Carlos Haya, Málaga). Sara Jordán (Hospital Universitari de Bellvitge, l’Hospitalet de Llobregat, Barcelona). Sergio Martínez Hervás (Hospital Clínico Universitario de Valencia, Valencia). Esperanza Martorell Mateu (Hospital Comarcal d’Inca, Inca, Mallorca). Marta Mauri Pont (Hospital de Terrassa, Terrassa, Barcelona). Jesús Millán Núñez-Cortés (Hospital Universitario Gregorio Marañón, Madrid). Clotilde Morales Coca (Hospital General de Manresa, Manresa, Barcelona). Ovidio Muñiz Grijalvo (Hospital Virgen del Rocío, Sevilla). Josefa María Panisello (FUFOSA, Madrid). Àngels Pedragosa Vall (Hospital del Mar, Barcelona). Gonzalo Fernando Pía Iglesias (Hospital Arquitecto Marcide, Ferrol, A Coruña).Nuria Plana Gil (Hospital Universitari San Joan, Reus, Tarragona).Rafael Ramírez Montesinos (Hospital de Santa Tecla,Tarragona).Leonardo Reinares García (Hospital Clínico, Madrid).Celestino Rey-Joly Barrosso (Hospital Universitari Germans Trias i Pujol, Badalona, Barcelona). Antonio Ruiz García (Centro de Salud Pinto, Madrid). Julio Sánchez (Complejo Hospitalario de Navarra, Pamplona). Pedro Sáenz Aranzubía (Hospital de Mérida, Mérida, Badajoz). Manuel Suárez Tembra (Hospital San Rafael, A Coruña). Pedro Valdivielso Felices (Hospital Virgen de la Victoria, Málaga). Maite Villarroel Salcedo (Hospital San Jorge, Huesca). Daniel Zambón Rados (Hospital Clínic, Barcelona). Alberto Zamora Cervantes (Hospital de Blanes, Blanes, Girona).