Determinar las prevalencias ajustadas por edad y sexo de concentraciones bajas de colesterol HDL (cHDL-bajo) y de dislipidemia aterogénica (DA), y valorar sus asociaciones con factores de riesgo cardiovascular, enfermedad renal crónica, enfermedades cardiovasculares y cardiometabólicas.
MétodosEstudio observacional transversal de base poblacional realizado en atención primaria, con sujetos adultos seleccionados aleatoriamente. Se consideró DA si los pacientes tenían hipertrigliceridemia (triglicéridos≥150mg/dL) y cHDL-bajo (<40mg/dL [hombres],<50mg/dL [mujeres]). Se determinaron las tasas de prevalencia crudas y ajustadas por edad y sexo, y se realizó análisis univariado y multivariante para evaluar los factores cardiometabólicos relacionados.
ResultadosPoblación de estudio con 6.588 adultos (55,9% mujeres) con edad media de 55,1 (±17,5) años. Las medias de cHDL fueron 49,2 (±12,6) mg/dL en hombres y 59,2 (±14,7) mg/dL en mujeres. Las prevalencias crudas de cHDL-bajo y de DA fueron 30,8% (IC95%: 29,7-31,9), y 14,3% (IC95%: 13,5-15,2), respectivamente. Las prevalencias ajustadas de cHDL-bajo fueron 28% en hombres y 31% en mujeres, y de DA fueron 16,4% en hombres y 10,6% en mujeres. El 73% de la población con DA tenía riesgo cardiovascular alto o muy alto. Los factores independientes asociados con cHDL-bajo o con DA fueron diabetes, tabaquismo, obesidad abdominal y obesidad. Los principales factores asociados con cHDL-bajo y con DA fueron hipertrigliceridemia y diabetes, respectivamente.
ConclusionesCasi un tercio de la población adulta presentaba cHDL-bajo y la mitad de ellos cumplía criterios de DA. Los factores cardiometabólicos se asociaban con cHDL-bajo y DA, destacando la hipertrigliceridemia con el cHDL-bajo, y la DM con la DA.
To determine the crude and sex- and age-adjusted prevalence rates of atherogenic dyslipidemia (AD) and low HDL-cholesterol levels (low-HDLc), and to assess their associations with cardiovascular risk factors, chronic kidney disease, cardiovascular and cardiometabolic diseases.
MethodsPopulation-based cross-sectional study conducted in Primary Care, with randomly selected adult subjects. The AD was considered if the patients had hypertriglyceridemia (triglycerides≥150mg/dL) and low-HDLc (<40mg/dL [men];<50mg/dL [women]). Crude and sex- and age-adjusted prevalence rates were determined, and univariate and multivariate analysis were performed to assess related cardiometabolic factors.
ResultsStudy population with 6,588 adults (55.9% women) with mean age 55.1 (±17.5) years. The mean HDLc levels were 49.2 (±12.6) mg/dL in men and 59.2 (±14.7) mg/dL in women. The crude prevalence rates of low-HDLc and AD were 30.8% (95%CI: 29.7-31.9), and 14.3% (95%CI: 13.5-15.2), respectively. The adjusted prevalence rates of low-HDLc were 28.0% in men and 31.0% in women, and AD were 16.4% in men and 10.6% in women. Seventy-three percent of the population with AD had high or very high cardiovascular risk. The independent factors associated with low HDLc or with AD were diabetes, smoking, abdominal obesity, and obesity. The major factors associated with low HDLc and AD were hypertriglyceridemia and diabetes, respectively.
ConclusionsAlmost a third of the adult population had low HDL-C and half of them met AD criteria. Cardiometabolic factors were associated with low HDL-C and AD, highlighting hypertriglyceridemia with low HDLc, and DM with AD.
La dislipidemia aterogénica (DA) se caracteriza por la coexistencia de concentraciones bajas de colesterol unido a lipoproteínas de alta densidad (cHDL), hipertrigliceridemia (HTG) y concentraciones altas remanentes de lipoproteínas ricas en triglicéridos (TG), y un predominio de lipoproteínas de baja densidad (LDL) pequeñas y densas1.
La DA aumenta el riesgo de enfermedad cardiovascular arteriosclerótica (ECVA) como consecuencia de la acción sinérgica de estos 3 factores: disminución de las funciones antiaterogénicas por concentraciones bajas de cHDL (cHDL-bajo)2, mayor aterogenicidad por el aumento de TG y remanentes, y partículas LDL pequeñas y densas, que penetran más fácilmente en la pared vascular y son más susceptibles a la oxidación3.
A pesar del uso generalizado de las estatinas en estos pacientes, el control de cLDL aún no es suficiente. Esto se puede justificar porque el efecto sinérgico de HTG y cHDL-bajo confiere un riesgo aterogénico residual que persiste a pesar de haber conseguido los objetivos de control de cLDL4–6. Existen muchos estudios que valoran estos efectos, bien analizando de forma aislada el cHDL-bajo, bien junto con la HTG dentro del concepto de DA. Con relación al cHDL-bajo, existen metaanálisis que muestran que existe una mayor incidencia de episodios cardiovasculares graves en pacientes con cHDL-bajo, incluso en tratamiento con estatinas7,8. En un análisis de pacientes con riesgo cardiovascular (RCV) alto o equivalentes de enfermedad coronaria (EC), el cHDL-bajo estaba presente en el 66%, alcanzando el 79% en pacientes con cLDL controlado, independientemente de la terapia con estatinas9.
Con relación a la DA, la Sociedad Española de Arteriosclerosis (SEA) valoró la importancia del riesgo de la DA, siguiendo la iniciativa de reducción de riesgo residual (R3i)4, mostrando que la prevalencia de DA era más alta en los pacientes con RCV alto y c-LDL controlado, y hasta un tercio de los pacientes con diabetes mellitus (DM) o antecedentes de ECVA6. En el estudio PROCAM, el riesgo de infarto de miocardio se multiplicaba por 5 en pacientes con HTG o cHDL-bajo a pesar de tener el cLDL controlado10. En el estudio TNT, los pacientes con EC estable en tratamiento con estatinas de alta intensidad y cLDL controlado tenían mayor riesgo si además padecían DA11. En el estudio ACCORD-Lipid, los pacientes con DM y DA tenían un 71% de mayor riesgo de ECVA12.
Este fenotipo del perfil lipídico de la DA se expresa frecuentemente en pacientes con antecedentes de ECVA, enfermedad renal crónica (ERC), DM, síndrome metabólico (SM), o hiperlipidemia familiar combinada, por lo que es muy importante determinar las concentraciones de TG y cHDL para evaluar el RCV global, y considerar la presencia de la DA para evaluar el riesgo residual de estos pacientes1,4,6,13–15.
La importancia del cHDL-bajo y la DA se justifica por la relevancia clínica que tienen al asociarse con un aumento del riesgo de la ECVA y por ser entidades infradiagnosticadas, infratratadas e infracontroladas5,15. Según el Plan de acción mundial para las enfermedades no transmisibles, es necesario evaluar la prevalencia de los factores de riesgo de ECVA para mejorar su prevención, planificar los recursos de salud, y para monitorizar y evaluar las estrategias establecidas16.
El objetivo del presente estudio es determinar en la población adulta las prevalencias ajustadas por edad y sexo de DA y de cHDL-bajo, y evaluar sus respectivas asociaciones con factores de riesgo cardiovascular (FRCV), ERC y enfermedades cardiometabólicas.
Material y métodosEl estudio SIMETAP-DA forma parte del proyecto SIMETAP, aprobado por la Comisión de Investigación de la Gerencia de Atención Primaria del Servicio de Salud de la Comunidad de Madrid (SERMAS). El presente estudio es una investigación observacional transversal, realizada por 121 médicos de familia interesados en participar en el proyecto de investigación SIMETAP, cuyo objetivo era valorar las prevalencias de los FRCV, SM y enfermedades cardiovasculares o cardiometabólicas relacionadas. Los médicos desempeñaban su actividad laboral en 64 centros de atención primaria dependientes del SERMAS (25% de los centros de salud del SERMAS). Los médicos participantes fueron seleccionados competitivamente hasta conseguir el tamaño muestral necesario. Los detalles del material y métodos (diseño, muestreo, reclutamiento, criterios de inclusión y exclusión de los sujetos del estudio, recogida de datos, análisis estadístico y criterios que definen las variables y categorías de RCV) del estudio SIMETAP se han detallado previamente en esta revista17. A efectos del presente estudio, se consideró HTG si TG≥150mg/dL o si este diagnóstico estaba registrado en la historia clínica; cHDL-bajo si cHDL<40mg/dL en hombres o <50mg/dL en mujeres; DA: HTG con cHDL-bajo. La población de estudio se obtuvo mediante muestreo aleatorio simple de la población mayor de 18 años asignada a los médicos de atención primaria del SERMAS que participaban en el estudio. Por protocolo de estudio, se obtuvo el consentimiento informado de todos los sujetos del estudio y se excluyeron aquellos pacientes terminales, institucionalizados, con deterioro cognitivo, embarazadas o sujetos sin información de las variables bioquímicas. La muestra final fue 10.084 sujetos de estudio, cuya tasa de respuesta fue del 65,8%.
El análisis estadístico se realizó con el programa Statistical Package for the Social Sciences. El análisis descriptivo determinó rango, mediana y rango intercuartílico (RIC) (percentil 25; percentil 75) de la variable edad, y media y desviación estándar (±DE) de otras variables continuas. Las variables cualitativas se analizaron mediante porcentajes en cada categoría, presentadas con límites inferior y superior del intervalo de confianza (IC) del 95%. Las prevalencias se determinaron como tasas crudas y tasas ajustadas por edad y sexo. El ajuste de tasas por edad y sexo se realizó usando grupos etarios decenales estandarizados con los de la población española mediante método directo18. La información de la población española de enero de 2015 se obtuvo de la base de datos del Instituto Nacional de Estadística19. Se realizó el ajuste de tasas según la población española en vez de la población de la Comunidad de Madrid, porque no existían diferencias significativas en los resultados de las tasas de prevalencia ajustadas entre ambas poblaciones y para facilitar la comparación de resultados con otras poblaciones. Las comparaciones de las variables continuas se realizaron mediante la prueba t-Student o el análisis de varianza (ANOVA). El análisis de las variables categóricas se realizó mediante la prueba chi-cuadrado. Las odds-ratios (OR) se determinaron con IC del 95%. Se utilizó el análisis multivariado de regresión logística con el método introducir para evaluar el efecto sobre las respectivas variables dependientes (cHDL-bajo y DA) de aquellas variables independientes (FRCV y comorbilidades) que el análisis univariado realizado previamente hubiera mostrado asociación estadísticamente significativa con las variables dependientes. La variable SM20 no se incluyó en el análisis multivariante. Todas las pruebas se consideraron estadísticamente significativas si el valor de p de 2 colas era inferior a 0,05. Para comparar las tasas de prevalencia de cHDL-bajo y DA determinadas en el presente estudio, se realizó una búsqueda bibliográfica en PubMed, Medline, Embase, Google Scholar y Web of Science de los principales estudios relacionados con estas tasas, publicados entre 2005 y 2015.
ResultadosPoblación de estudio. La media (±DE) de edad era 55,1 (±17,5) años, su mediana (RIC) era 54,7 (41,7-68,1) años, y su rango entre 18 y 102,8 años. La diferencia del porcentaje entre hombres (44,1% [IC 42,9-45,3%]) y mujeres (55,9% [IC 54,7-57,1%]) era significativa (p<0,001). La diferencia de las medias [±DE] de edad entre las poblaciones masculina (55,3 [±16,9] años) y femenina (55 [±18] años) no era significativa (p=0,634).
La diferencia del porcentaje de la población masculina entre las poblaciones con cHDL-bajo (46,5% [IC 44,2-48,8%]) y sin cHDL-bajo (43,2% [IC 41,8-44,6%]) era significativa (p=0,014). La diferencia de las medias [±DE] de edad entre las poblaciones con cHDL-bajo (56,4 [±16,9] años) y sin cHDL-bajo (54,7 [±17,7] años) era significativa (p<0,001).
La diferencia del porcentaje de la población masculina entre las poblaciones con DA (54,6% [51,4-57,8%]) y sin DA (42,3% [41-43,6%]) era significativa (p<0,001). La diferencia de las medias [±DE] de edad entre las poblaciones con DA (58,7 [±15,1] años) y sin DA (54,5 [±17,8] años) era significativa (p<0,001).
Las características clínicas de la población de estudio se han descrito previamente en esta revista21. Las medias (±DE) de las concentraciones de los parámetros lipídicos fueron: colesterol total (CT) 192,8 (±39,3) mg/dL; TG 120,5 (±83,2) mg/dL; cHDL 54,8 (±14,7) mg/dL; cLDL 114,2 (±34,5) mg/dL. La media [±DE] de cHDL fue significativamente más baja (p<0,001) en hombres (49,2 [±12,6] mg/dL) que en mujeres (59,2 [±14,7] mg/dL), y la media [±DE] de TG fue significativamente más alta (p<0,001) en hombres (135,7 [±100,6] mg/dL) que en mujeres (108,6,2 [±63,8] mg/dL).
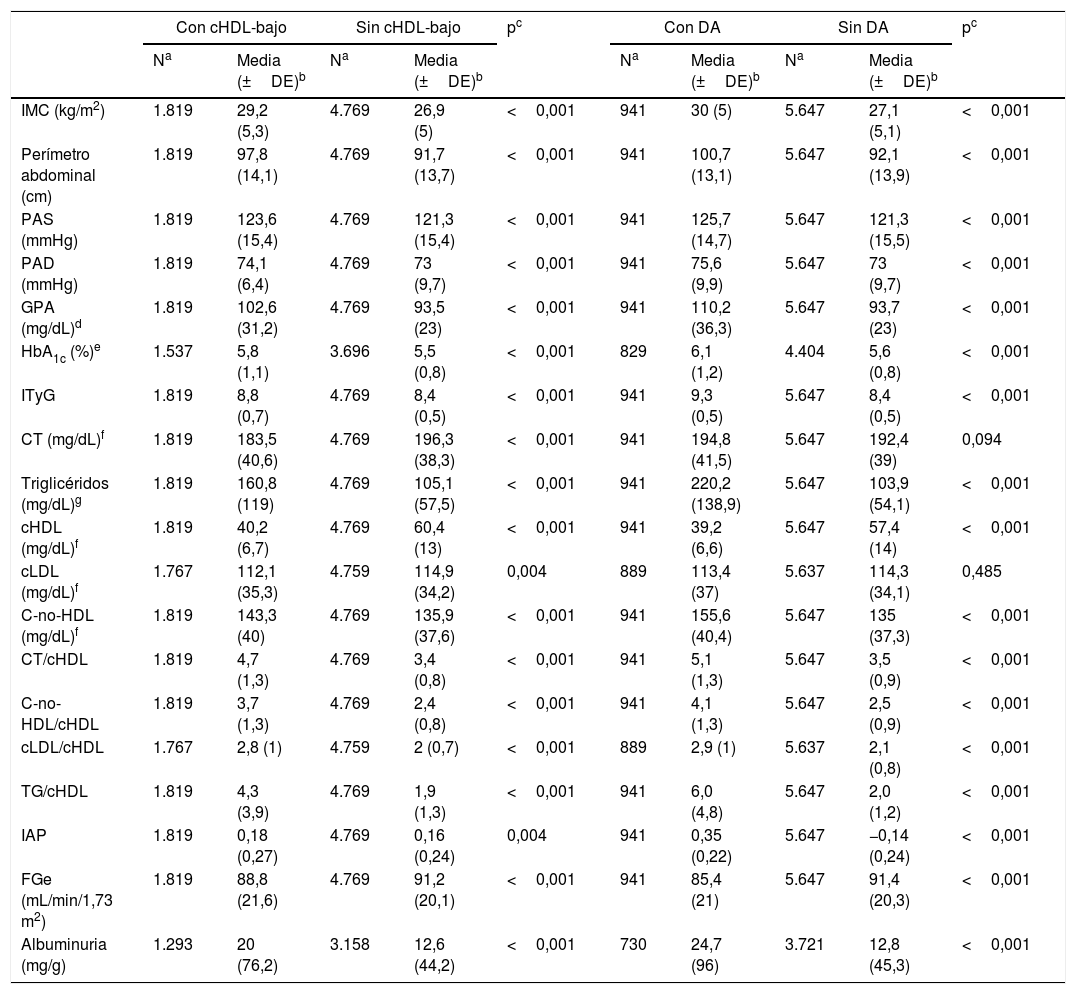
La descripción de las características clínicas de las poblaciones con y sin cHDL-bajo, y con y sin DA se muestran en la tabla 1. Las medianas (RIC) de las concentraciones de TG en las poblaciones con y sin cHDL-bajo eran 134 (96-194) mg/dL y 92 (68-127,5) mg/dL respectivamente. Las medianas (RIC) de las concentraciones de TG en las poblaciones con y sin DA eran 191 (156-246,5) mg/dL y 93 (69-125) mg/dL respectivamente.
Características clínicas de las poblaciones con y sin cHDL-bajo, y con y sin DA
| Con cHDL-bajo | Sin cHDL-bajo | pc | Con DA | Sin DA | pc | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Na | Media (±DE)b | Na | Media (±DE)b | Na | Media (±DE)b | Na | Media (±DE)b | |||
| IMC (kg/m2) | 1.819 | 29,2 (5,3) | 4.769 | 26,9 (5) | <0,001 | 941 | 30 (5) | 5.647 | 27,1 (5,1) | <0,001 |
| Perímetro abdominal (cm) | 1.819 | 97,8 (14,1) | 4.769 | 91,7 (13,7) | <0,001 | 941 | 100,7 (13,1) | 5.647 | 92,1 (13,9) | <0,001 |
| PAS (mmHg) | 1.819 | 123,6 (15,4) | 4.769 | 121,3 (15,4) | <0,001 | 941 | 125,7 (14,7) | 5.647 | 121,3 (15,5) | <0,001 |
| PAD (mmHg) | 1.819 | 74,1 (6,4) | 4.769 | 73 (9,7) | <0,001 | 941 | 75,6 (9,9) | 5.647 | 73 (9,7) | <0,001 |
| GPA (mg/dL)d | 1.819 | 102,6 (31,2) | 4.769 | 93,5 (23) | <0,001 | 941 | 110,2 (36,3) | 5.647 | 93,7 (23) | <0,001 |
| HbA1c (%)e | 1.537 | 5,8 (1,1) | 3.696 | 5,5 (0,8) | <0,001 | 829 | 6,1 (1,2) | 4.404 | 5,6 (0,8) | <0,001 |
| ITyG | 1.819 | 8,8 (0,7) | 4.769 | 8,4 (0,5) | <0,001 | 941 | 9,3 (0,5) | 5.647 | 8,4 (0,5) | <0,001 |
| CT (mg/dL)f | 1.819 | 183,5 (40,6) | 4.769 | 196,3 (38,3) | <0,001 | 941 | 194,8 (41,5) | 5.647 | 192,4 (39) | 0,094 |
| Triglicéridos (mg/dL)g | 1.819 | 160,8 (119) | 4.769 | 105,1 (57,5) | <0,001 | 941 | 220,2 (138,9) | 5.647 | 103,9 (54,1) | <0,001 |
| cHDL (mg/dL)f | 1.819 | 40,2 (6,7) | 4.769 | 60,4 (13) | <0,001 | 941 | 39,2 (6,6) | 5.647 | 57,4 (14) | <0,001 |
| cLDL (mg/dL)f | 1.767 | 112,1 (35,3) | 4.759 | 114,9 (34,2) | 0,004 | 889 | 113,4 (37) | 5.637 | 114,3 (34,1) | 0,485 |
| C-no-HDL (mg/dL)f | 1.819 | 143,3 (40) | 4.769 | 135,9 (37,6) | <0,001 | 941 | 155,6 (40,4) | 5.647 | 135 (37,3) | <0,001 |
| CT/cHDL | 1.819 | 4,7 (1,3) | 4.769 | 3,4 (0,8) | <0,001 | 941 | 5,1 (1,3) | 5.647 | 3,5 (0,9) | <0,001 |
| C-no-HDL/cHDL | 1.819 | 3,7 (1,3) | 4.769 | 2,4 (0,8) | <0,001 | 941 | 4,1 (1,3) | 5.647 | 2,5 (0,9) | <0,001 |
| cLDL/cHDL | 1.767 | 2,8 (1) | 4.759 | 2 (0,7) | <0,001 | 889 | 2,9 (1) | 5.637 | 2,1 (0,8) | <0,001 |
| TG/cHDL | 1.819 | 4,3 (3,9) | 4.769 | 1,9 (1,3) | <0,001 | 941 | 6,0 (4,8) | 5.647 | 2,0 (1,2) | <0,001 |
| IAP | 1.819 | 0,18 (0,27) | 4.769 | 0,16 (0,24) | 0,004 | 941 | 0,35 (0,22) | 5.647 | −0,14 (0,24) | <0,001 |
| FGe (mL/min/1,73 m2) | 1.819 | 88,8 (21,6) | 4.769 | 91,2 (20,1) | <0,001 | 941 | 85,4 (21) | 5.647 | 91,4 (20,3) | <0,001 |
| Albuminuria (mg/g) | 1.293 | 20 (76,2) | 3.158 | 12,6 (44,2) | <0,001 | 730 | 24,7 (96) | 3.721 | 12,8 (45,3) | <0,001 |
cHDL: colesterol unido a lipoproteínas de alta densidad; cHDL-bajo: colesterol unido a lipoproteínas de alta densidad<40mg/dL (hombres) y <50mg/dL (mujeres); cLDL: colesterol unido a lipoproteínas de baja densidad; C-no-HDL: colesterol no unido a HDL; CT: colesterol total; DA: dislipidemia aterogénica; FGe: tasa de filtrado glomerular estimado (Chronic Kidney Disease Epidemiology Collaboration, CKD-EPI); GPA: glucosa plasmática en ayunas; HbA1c: hemoglobina glucosilada A1c; IAP40: índice aterogénico de plasma [log (TG/cHDL)]; IMC: índice de masa corporal; ITyG39: índice triglicéridos y glucosa; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TG: triglicéridos.
En la población con cHDL-bajo, la media [±DE] de cHDL era significativamente más alta (p<0,001) en mujeres (43,2 [±5,7] mg/dL) que en hombres (36,8 [±5,9] mg/dL), y la media [±DE] de TG era significativamente más alta (p<0,001) en hombres (182,2 [±143,3] mg/dL) que en mujeres (142,3 [±88,9] mg/dL).
En la población con DA, la media [±DE] de cHDL era significativamente más alta (p<0,001) en mujeres (42,3 [±6] mg/dL) que en hombres (36,6 [±6] mg/dL), y la media [±DE] de TG era significativamente más alta (p<0,001) en hombres (233,2 [±163,3] mg/dL) que en mujeres (204,6 [±100,2] mg/dL).
Las prevalencias crudas de cHDL-bajo, HTG, y DA fueron 30,8% (IC: 29,7-31,9); 29,6% (IC: 28,4-30,7) y 14,3% (IC: 13,5-15,2), respectivamente. La diferencia de prevalencia cruda de cHDL-bajo entre mujeres (32,1% [IC: 30,6-33,6]) y hombres (29,1% [IC: 27,5-30,8]) era significativa (p=0,009). La diferencia de prevalencia cruda de DA entre hombres (17,7% [IC: 16,3-19,1]) y mujeres (11,7% [IC: 10,6-12,7]) era significativa (p<0,001).
Las tasas de prevalencia ajustadas por edad y sexo de HTG fueron 27% (global); 34,6% (hombres) y 21,4% (mujeres); las de cHDL-bajo fueron 29,6% (global), 28% (hombres) y 31% (mujeres); y las de DA fueron 13,1% (global); 16,4% (hombres) y 10,6% (mujeres).
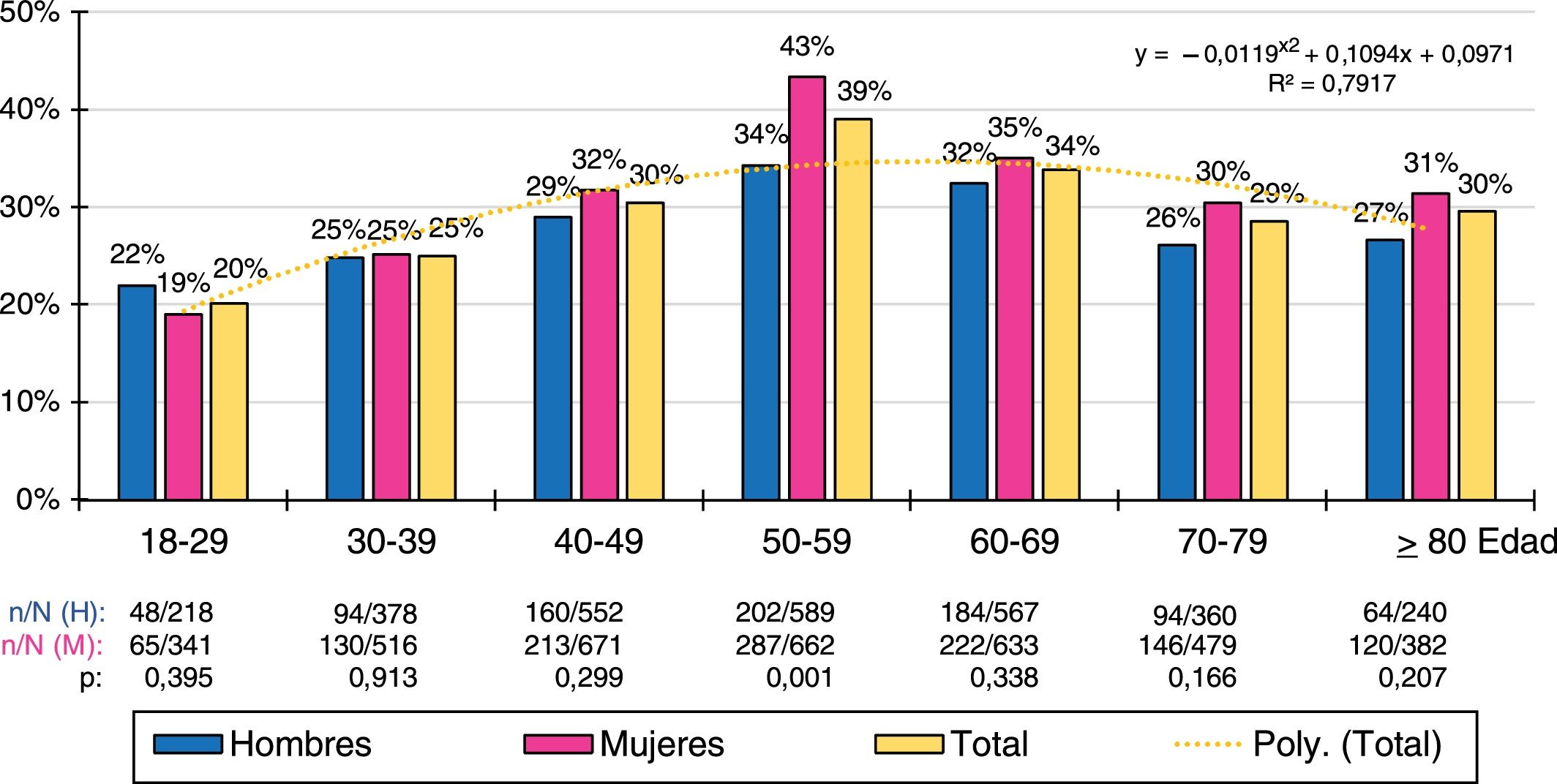
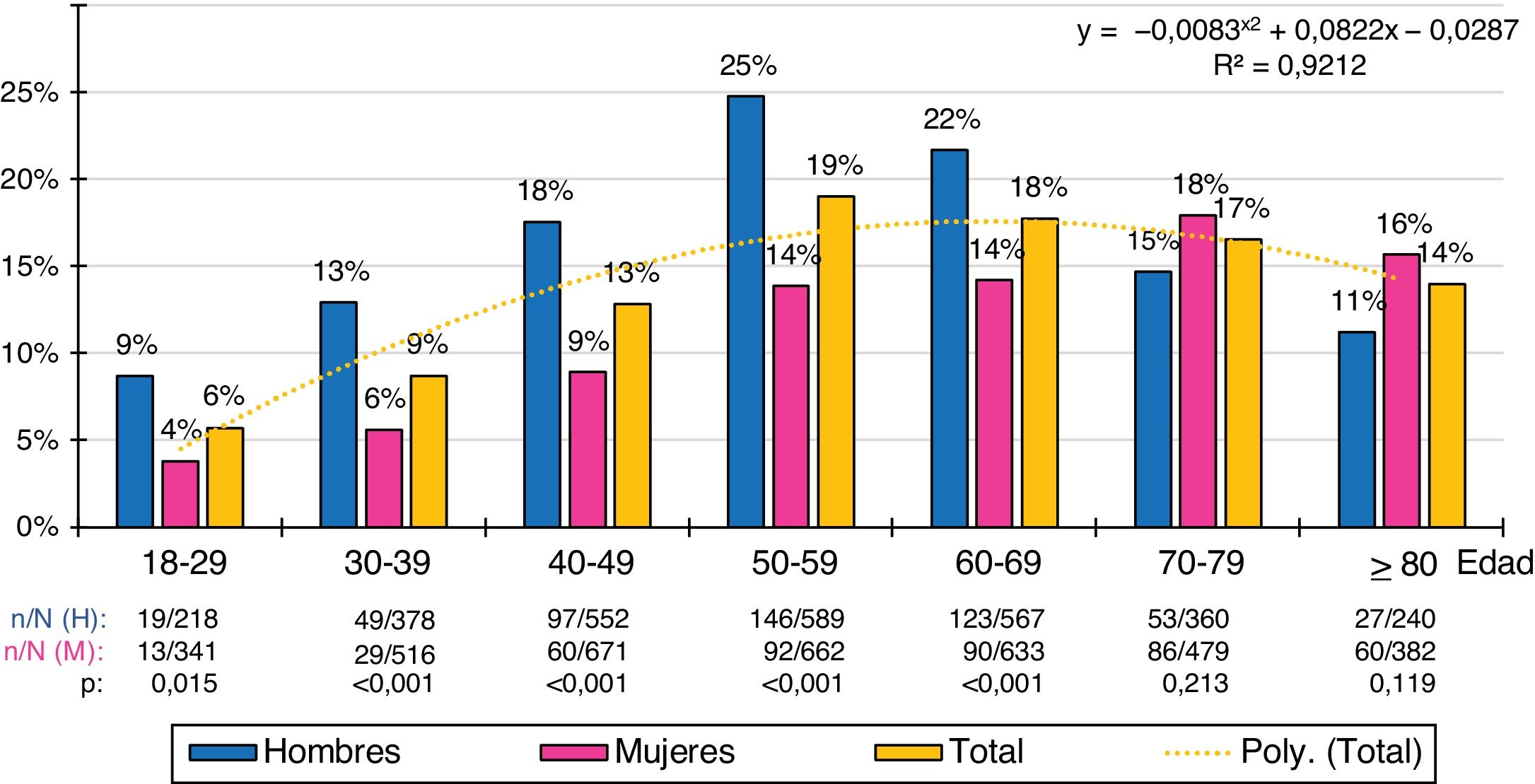
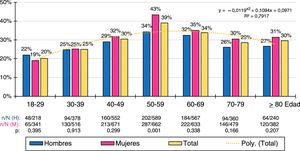
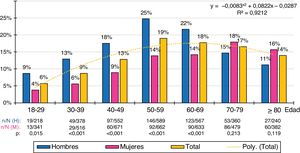
Las distribuciones por grupos etarios decenales de las tasas de prevalencia de cHDL-bajo y DA se ajustaban (R2=0,79 y 0,92 respectivamente) a las siguientes funciones polinómicas: y=−0,0119x2+0,1094x+0,0971; y=−0,0083x2+0,0822x−0,0287 respectivamente. La prevalencia de cHDL-bajo era similar en hombres y mujeres en todos los grupos etarios, excepto en la década de los 50, donde existía una mayor prevalencia en la población femenina. La prevalencia de DA aumentaba con la edad, alcanzando el máximo en la década de los 50 en la población masculina, y en la década de los 70 en la femenina. La población masculina tenía mayores tasas de prevalencia de DA que la femenina en todos los grupos etarios hasta la década de los 60, invirtiéndose posteriormente con una mayor prevalencia de DA en la población femenina (figs. 1 y 2).
El 37,7% (IC: 35,4-39,9%) de la población con cHDL-bajo estaba en tratamiento con fármacos hipolipidemiantes, y el 51,5% (IC: 48,1-54,9%) de la población con DA. Los porcentajes de sujetos categorizados según su RCV17 de las poblaciones con cHDL-bajo y con DA fueron respectivamente los siguientes: RCV bajo: 19% (IC: 17,2-20,9%) y 5,7% (IC: 4,2-7,5%); RCV moderado: 22,1% (IC: 20,2-24,0%) y 21,6% (IC: 18,8-24,5%); RCV alto: 19,4% (IC: 17,6-21,3%) y 26,6% (IC: 23,6-29,6%); RCV muy alto: 39,5 (IC: 37,3-41,8%) y 51,5% (IC: 48-54,9%).
Todos los parámetros descriptivos (presión arterial, cardiometabólicos, lipídicos y renales) eran significativamente mayores en la población con cHDL-bajo que en la población sin cHDL-bajo. A excepción del CT y del cLDL, todos los parámetros descriptivos eran significativamente mayores en la población con DA que en la población sin DA (tabla 1).
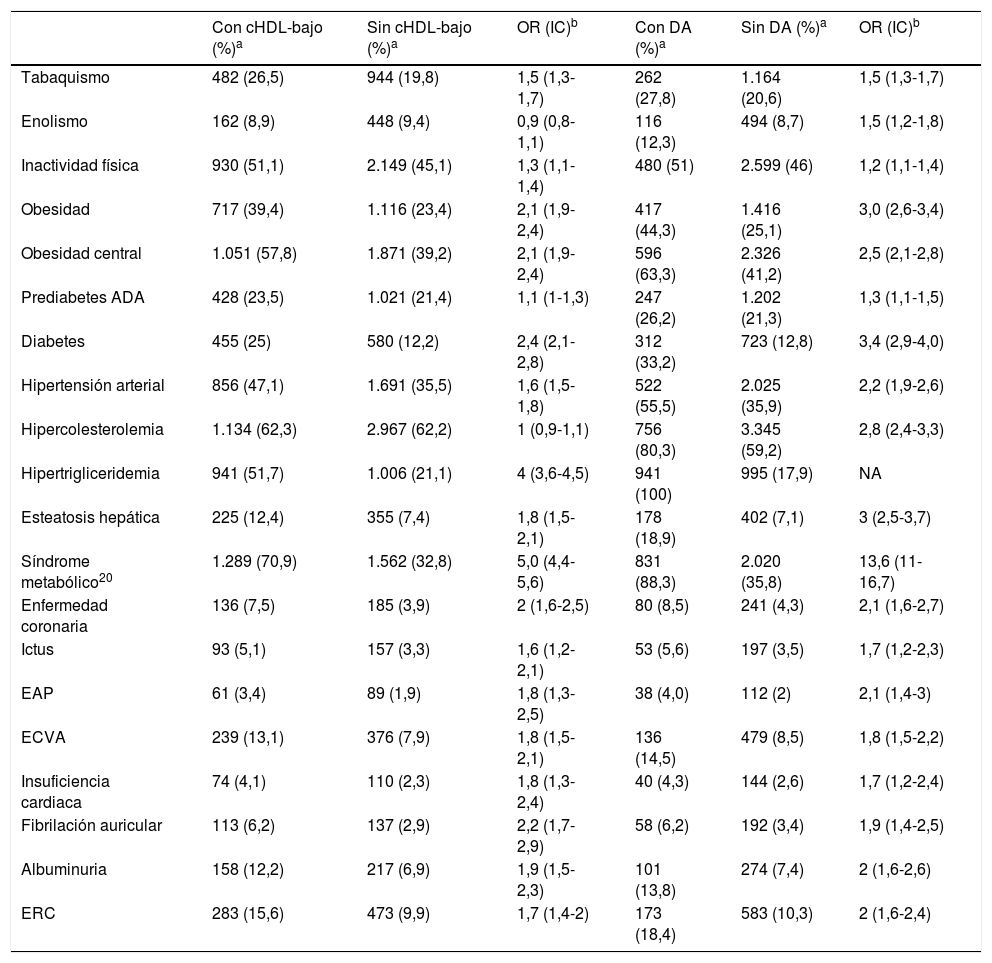
Todas las variables cardiometabólicas, cardiovasculares y renales estaban estadísticamente relacionadas con el cHDL-bajo y con la DA, excepto enolismo y prediabetes, que no estaban relacionadas con el cHDL-bajo (tabla 2). Los factores independientes asociados con el cHDL-bajo y con la DA se muestran en las tablas 3 y 4 respectivamente.
Comorbilidad asociada con y sin cHDL-bajo, y asociada con y sin DA
| Con cHDL-bajo (%)a | Sin cHDL-bajo (%)a | OR (IC)b | Con DA (%)a | Sin DA (%)a | OR (IC)b | |
|---|---|---|---|---|---|---|
| Tabaquismo | 482 (26,5) | 944 (19,8) | 1,5 (1,3-1,7) | 262 (27,8) | 1.164 (20,6) | 1,5 (1,3-1,7) |
| Enolismo | 162 (8,9) | 448 (9,4) | 0,9 (0,8-1,1) | 116 (12,3) | 494 (8,7) | 1,5 (1,2-1,8) |
| Inactividad física | 930 (51,1) | 2.149 (45,1) | 1,3 (1,1-1,4) | 480 (51) | 2.599 (46) | 1,2 (1,1-1,4) |
| Obesidad | 717 (39,4) | 1.116 (23,4) | 2,1 (1,9-2,4) | 417 (44,3) | 1.416 (25,1) | 3,0 (2,6-3,4) |
| Obesidad central | 1.051 (57,8) | 1.871 (39,2) | 2,1 (1,9-2,4) | 596 (63,3) | 2.326 (41,2) | 2,5 (2,1-2,8) |
| Prediabetes ADA | 428 (23,5) | 1.021 (21,4) | 1,1 (1-1,3) | 247 (26,2) | 1.202 (21,3) | 1,3 (1,1-1,5) |
| Diabetes | 455 (25) | 580 (12,2) | 2,4 (2,1-2,8) | 312 (33,2) | 723 (12,8) | 3,4 (2,9-4,0) |
| Hipertensión arterial | 856 (47,1) | 1.691 (35,5) | 1,6 (1,5-1,8) | 522 (55,5) | 2.025 (35,9) | 2,2 (1,9-2,6) |
| Hipercolesterolemia | 1.134 (62,3) | 2.967 (62,2) | 1 (0,9-1,1) | 756 (80,3) | 3.345 (59,2) | 2,8 (2,4-3,3) |
| Hipertrigliceridemia | 941 (51,7) | 1.006 (21,1) | 4 (3,6-4,5) | 941 (100) | 995 (17,9) | NA |
| Esteatosis hepática | 225 (12,4) | 355 (7,4) | 1,8 (1,5-2,1) | 178 (18,9) | 402 (7,1) | 3 (2,5-3,7) |
| Síndrome metabólico20 | 1.289 (70,9) | 1.562 (32,8) | 5,0 (4,4-5,6) | 831 (88,3) | 2.020 (35,8) | 13,6 (11-16,7) |
| Enfermedad coronaria | 136 (7,5) | 185 (3,9) | 2 (1,6-2,5) | 80 (8,5) | 241 (4,3) | 2,1 (1,6-2,7) |
| Ictus | 93 (5,1) | 157 (3,3) | 1,6 (1,2-2,1) | 53 (5,6) | 197 (3,5) | 1,7 (1,2-2,3) |
| EAP | 61 (3,4) | 89 (1,9) | 1,8 (1,3-2,5) | 38 (4,0) | 112 (2) | 2,1 (1,4-3) |
| ECVA | 239 (13,1) | 376 (7,9) | 1,8 (1,5-2,1) | 136 (14,5) | 479 (8,5) | 1,8 (1,5-2,2) |
| Insuficiencia cardiaca | 74 (4,1) | 110 (2,3) | 1,8 (1,3-2,4) | 40 (4,3) | 144 (2,6) | 1,7 (1,2-2,4) |
| Fibrilación auricular | 113 (6,2) | 137 (2,9) | 2,2 (1,7-2,9) | 58 (6,2) | 192 (3,4) | 1,9 (1,4-2,5) |
| Albuminuria | 158 (12,2) | 217 (6,9) | 1,9 (1,5-2,3) | 101 (13,8) | 274 (7,4) | 2 (1,6-2,6) |
| ERC | 283 (15,6) | 473 (9,9) | 1,7 (1,4-2) | 173 (18,4) | 583 (10,3) | 2 (1,6-2,4) |
Albuminuria: cociente albúmina-creatinina>30mg/g; cHDL-bajo: colesterol unido a lipoproteínas de alta densidad<40mg/dL (hombres) y <50mg/dL (mujeres); DA: dislipidemia aterogénica; Diabetes: GPA≥126mg/dL o HbA1c≥6,5% o diagnóstico registrado en historia clínica; EAP: enfermedad arterial periférica; ECVA: enfermedad cardiovascular arteriosclerótica; Enolismo: consumo habitual de alcohol>210g/semana (hombres) o>140g/semana (mujeres); ERC: enfermedad renal crónica; HbA1c: hemoglobina glucosilada A1c; Hipercolesterolemia: colesterol total≥200mg/dL o diagnóstico en historia clínica; Hipertrigliceridemia: triglicéridos≥150mg/dL o diagnóstico en historia clínica; IMC: índice de masa corporal; Inactividad física: actividad física<150min/semana; NA: no aplicable; Obesidad: IMC≥30kg/m2; Obesidad central: perímetro abdominal≥102cm (hombres); ≥88cm (mujeres); Prediabetes ADA (American Diabetes Association): glucosa plasmática en ayunas (GPA) 100-125mg/dL, o HbA1c 5,7-6,4%: Tabaquismo: consumo de cualquier cantidad de cigarrillos o tabaco durante el último mes.
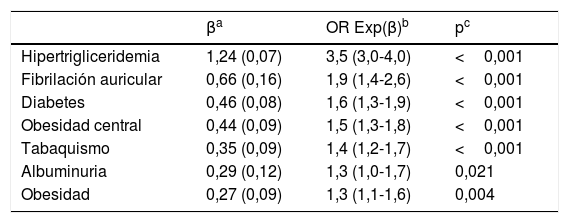
Factores independientes asociados con el cHDL-bajo
| βa | OR Exp(β)b | pc | |
|---|---|---|---|
| Hipertrigliceridemia | 1,24 (0,07) | 3,5 (3,0-4,0) | <0,001 |
| Fibrilación auricular | 0,66 (0,16) | 1,9 (1,4-2,6) | <0,001 |
| Diabetes | 0,46 (0,08) | 1,6 (1,3-1,9) | <0,001 |
| Obesidad central | 0,44 (0,09) | 1,5 (1,3-1,8) | <0,001 |
| Tabaquismo | 0,35 (0,09) | 1,4 (1,2-1,7) | <0,001 |
| Albuminuria | 0,29 (0,12) | 1,3 (1,0-1,7) | 0,021 |
| Obesidad | 0,27 (0,09) | 1,3 (1,1-1,6) | 0,004 |
Albuminuria: cociente albúmina-creatinina>30mg/g; cHDL-bajo: colesterol unido a lipoproteínas de alta densidad<40mg/dL (hombres) y <50mg/dL (mujeres); Diabetes: glucosa plasmática en ayunas≥126mg/dL o HbA1c≥6,5% o diagnóstico registrado en historia clínica; Fibrilación auricular: diagnóstico en historia clínica; HbA1c: hemoglobina glucosilada A1c; Hipertrigliceridemia: triglicéridos≥150mg/dL o diagnóstico en historia clínica; IMC: índice de masa corporal; Obesidad: IMC≥30kg/m2; Obesidad central: perímetro abdominal≥102cm (hombres); ≥88cm (mujeres); Tabaquismo: consumo de cualquier cantidad de cigarrillos o tabaco durante el último mes.
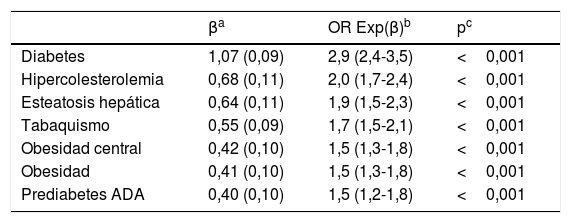
Factores independientes asociados con la dislipidemia aterogénica
| βa | OR Exp(β)b | pc | |
|---|---|---|---|
| Diabetes | 1,07 (0,09) | 2,9 (2,4-3,5) | <0,001 |
| Hipercolesterolemia | 0,68 (0,11) | 2,0 (1,7-2,4) | <0,001 |
| Esteatosis hepática | 0,64 (0,11) | 1,9 (1,5-2,3) | <0,001 |
| Tabaquismo | 0,55 (0,09) | 1,7 (1,5-2,1) | <0,001 |
| Obesidad central | 0,42 (0,10) | 1,5 (1,3-1,8) | <0,001 |
| Obesidad | 0,41 (0,10) | 1,5 (1,3-1,8) | <0,001 |
| Prediabetes ADA | 0,40 (0,10) | 1,5 (1,2-1,8) | <0,001 |
Diabetes: glucosa plasmática en ayunas≥126mg/dL o HbA1c≥6,5% o diagnóstico registrado en historia clínica; Esteatosis hepática: diagnóstico en historia clínica; HbA1c: hemoglobina glucosilada A1c; Hipercolesterolemia: colesterol total≥200mg/dL o diagnóstico en historia clínica; Obesidad: índice de masa corporal≥30kg/m2; Obesidad central: perímetro abdominal≥102cm (hombres); ≥88cm (mujeres); Prediabetes ADA (American Diabetes Association): glucosa plasmática en ayunas 100-125mg/dL, o HbA1c 5,7-6,4%; Tabaquismo: consumo de cualquier cantidad de cigarrillos o tabaco durante el último mes.
El presente estudio actualiza la información sobre los valores medios de cHDL y las prevalencias de cHDL-bajo y de DA en la población adulta, ofreciendo unos resultados intermedios entre los publicados por otros estudios internacionales y nacionales. Las características cardiometabólicas y renales de la población con cHDL-bajo eran significativamente más elevadas que la población sin cHDL-bajo, siendo las diferencias más acusadas cuando se comparaban entre las poblaciones con y sin DA (tabla 1). La media de cHDL del estudio SIMETAP-DA era similar a las de Estados Unidos22 (53mg/dL), Francia23 (57mg/dL) y Alemania24 (56mg/dL), e inferior a las de China25 (50mg/dL) e India26 (49mg/dL). La media de cHDL era similar a las de los estudios DARIOS27 (54mg/dL) y ENRICA28 (53mg/dL) realizados en España. El estudio PREDIMERC29, realizado en Madrid, mostró una media más alta que la del presente estudio en mujeres (64mg/dL) y similar en hombres (50mg/dL).
La prevalencia de cHDL-bajo del estudio SIMETAP-DA era similar a la de Estados Unidos22 (30%), superior a la de China25 (22%), e inferior a las de India26 (43%). La prevalencia era superior a las de los estudios DARIOS27 (20% [hombres]; 28% [mujeres]), ENRICA28 (26%), y PREDIMERC29 (18% [hombres]; 9% [mujeres]). Se podrían justificar estas menores prevalencias que la del estudio SIMETAP-DA, debido a que el estudio ENRICA28 excluyó a los pacientes con TG>400mg/dL, el estudio PREDIMERC29 consideró cHDL-bajo a una concentración más estricta (<46mg/dL) en mujeres, y el estudio DARIOS27 seleccionó a una población limitada entre 35 y 74 años. En el presente estudio, la prevalencia de DA en los sujetos adultos<35 años y>70 años no era despreciable (8% y 16% respectivamente), por lo que se podría recomendar incluir a estos 2 grupos etarios para evaluar con más precisión a toda la población adulta.
Las prevalencias de cHDL-bajo y de DA son más elevadas en pacientes con ECVA. En el estudio CLYDIA30, la prevalencia de cHDL-bajo era del 34,4% en los pacientes con ECVA, más alta que la del presente estudio realizado en la población general. En pacientes coronarios, el estudio LIPICERES31 mostraba una prevalencia de cHDL-bajo del 32% en hombres y del 45% en mujeres, y en el estudio PRESENAP32, la prevalencia de cHDL-bajo fue del 26%. Las prevalencias de DA en los estudios LIPICERES31 y PRESENAP32 eran respectivamente del 11,2% y del 13%, similares a la del estudio SIMETAP-DA, considerando los rangos etarios de dichos estudios.
Asimismo, las prevalencias de cHDL-bajo y de DA suelen ser más elevadas en pacientes con DM o con mayor RCV. En el estudio EDICONDIS-ULISEA33, que incluyó a pacientes valorados en Unidades de Lípidos de la SEA por padecer dislipidemias, el 36,1% tenían cHDL-bajo y el 17,9% tenían DA. En una encuesta de salud realizada en Europa34 que incluía a pacientes con DM o SM (93% con fármacos hipolipidemiantes), la prevalencia de cHDL-bajo era del 34%. En un análisis del estudio DYSIS35 realizado con pacientes tratados con estatinas, la prevalencia de cHDL-bajo fue del 23%, y la prevalencia de DA fue del 13,1%, igual que la del presente estudio. El estudio Di@bet.es36 mostraba una prevalencia de cHDL-bajo del 28%, inferior que la del estudio SIMETAP-DM37 que mostraba una prevalencia del 41% en pacientes con DM. Finalmente, en la población con DA, las concentraciones de cHDL del presente estudio fueron similares al del Registro realizado por la SEA38 en pacientes con HTG (41mg/dL [global]; 39mg/dL [hombres]; 46mg/dL [mujeres]).
La afectación metabólica en las poblaciones con cHDL-bajo o con DA es importante. Además de la obvia asociación con el SM20, la DM fue la comorbilidad con mayor asociación con la DA y también tenía una potente asociación con el cHDL-bajo. Además, la obesidad y el aumento de perímetro abdominal también eran factores independientes asociados con ambas entidades. Por otra parte, se ha sugerido que el índice TG y glucosa (Ln [TG×GPA/2]) es un buen marcador de riesgo de DM39. Los índices TG y glucosa también eran altos en las poblaciones con cHDL-bajo y con DA (8,8 y 9,3 respectivamente), lo que orienta que estas entidades pueden ser buenos marcadores de insulinorresistencia.
La afectación cardiovascular en las poblaciones con cHDL-bajo o con DA también era importante pues la hipertensión arterial, ECVA (EC, ictus y enfermedad arterial periférica), insuficiencia cardiaca y fibrilación auricular estaban relacionadas con el cHDL-bajo y con la DA. La ERC y la albuminuria también aparecían como factores asociado con el cHDL-bajo y con la DA, siendo las OR ligeramente mayores en la DA, aunque solo la albuminuria destacaba como factor independiente asociado con el cHDL-bajo (tablas 2-4).
Las concentraciones de TG modulan la concentración de las partículas HDL hacia unas subclases más densas y de menor tamaño (HDL3), produciendo un resultado neto de disminución del cHDL. En la población con cHDL-bajo del presente estudio, destaca la estrecha relación existente entre el cHDL y los TG tanto en el análisis univariado (OR: 4) como en el multivariado (OR: 3,5), a pesar de evaluarse en una población con cHDL-bajo, cuya media y mediana de la concentración de TG eran 161 y 134mg/dL respectivamente (tablas 1-3).
El aumento de CT no se encontraba asociado con el cHDL-bajo y, sin embargo, estaba fuertemente asociado con la DA, lo que podría indicar que la valoración parcial del CT puede infraestimar el fenotipo lipídico y que es importante la evaluación integral de todo el perfil lipídico, incluyendo las concentraciones de cHDL y TG. El índice aterogénico de plasma (log [TG/cHDL]) es un predictor de riesgo de arterioesclerosis, cuyos valores entre −0,3 y 0,11 están asociados con RCV bajo, entre 0,1 y 0,21 con RCV moderado y>0,21 con RCV alto40. En pacientes con HTG, los índices Castelli-I41 (CT/cHDL) y Castelli-II41 (cLDL/cHDL) se han considerado como índices de riesgo de EC más sensibles y específicos que el CT, y se han asociado a mayor riesgo de EC cuando son>4 y>3 respectivamente42. En los pacientes en los que no se pueda calcular el cLDL por TG>400mg/dL, el coeficiente aterogénico (C-no-HDL/cHDL) refleja el potencial aterogénico de las partículas que contienen apolipoproteína B2. En el presente estudio, todos estos índices eran elevados en las poblaciones con cHDL-bajo o con DA, indicando que sus riesgos aterogénicos eran superiores que en las poblaciones sin cHDL-bajo o sin DA. Este mayor riesgo aterogénico junto con una alta prevalencia de ECVA, DM, obesidad, hipertensión arterial y SM en la población de DA, podría justificar el que un 73% de esta población tuviera un RCV alto o muy alto, por lo que es recomendable detectar la DA en el perfil lipídico y considerarla como un importante marcador de riesgo aterogénico.
Una limitación del presente estudio fue el posible infradiagnóstico al excluir por protocolo a pacientes terminales, institucionalizados, o con deterioro cognitivo. Otra limitación fue que los investigadores debían recoger la información de los parámetros más recientes de los análisis realizados durante el último año, por lo que la observación transversal realizada podría estar influenciada por las patologías de los pacientes que en dicho momento estuvieran padeciendo y por sus tratamientos. También cabe señalar que las variables edad y sexo no se utilizaron en el análisis multivariante por estar fuertemente asociadas con FRCV, enfermedades cardiovasculares o cardiometabólicas, con el fin de destacar aquellas otras variables que pudieran estar asociadas con el cHDL-bajo o con DA. Por otra parte, es plausible que las prevalencias de cHDL-bajo y de DA pudieran ser algo mayores si las poblaciones con cHDL-bajo o con DA no estuvieran bajo la influencia de la terapia hipolipidemiante (38% y 52% respectivamente), circunstancia que éticamente no se puede evitar en este estudio observacional. Otra limitación fue la incapacidad de un estudio transversal para determinar la causalidad.
Las principales fortalezas del presente estudio fueron la selección aleatoria con base poblacional de una extensa muestra que incluyó a todo el rango de la edad adulta entre 18 y 102 años de edad, la descripción de las prevalencias en todos los grupos etarios decenales de adultos, la presentación con tasas ajustadas por edad y sexo, y la evaluación de las posibles asociaciones entre estas entidades y los FRCV, enfermedades cardiometabólicas, ERC, y ECVA.
La SEA recomienda promover y difundir los conocimientos existentes de la DA y el riesgo asociado, e implementar medidas para su correcta identificación, tratamiento y control43. Es necesario realizar más estudios epidemiológicos que analicen en toda la población las prevalencias de cHDL-bajo y de DA, para poder planificar mejor las políticas de intervención de prevención cardiovascular, optimizar los recursos de salud disponibles, y mejorar la atención médica y la calidad de vida de los pacientes con DA. En este sentido, es deseable que el presente estudio contribuya a mejorar el conocimiento epidemiológico de la DA y a valorar la importancia del riesgo asociado a la ECVA que conlleva la DA.
ConclusionesExiste una alta variabilidad en los estudios realizados sobre prevalencia cHDL-bajo o de DA, dependiendo de las comorbilidades y de la edad media de las poblaciones estudiadas. El presente estudio muestra unas concentraciones medias de cHDL y unas tasas de prevalencia de cHDL-bajo y de DA, intermedias con respecto a las de otros estudios.
La prevalencia de estas entidades es elevada, pues casi un tercio en la población adulta presentaba cHDL-bajo, y la mitad de ellos cumplía criterios de DA.
Las variables cardiometabólicas se asociaban con el cHDL-bajo y la DA, destacando la HTG como el principal factor asociado con el cHDL-bajo, y la DM como el principal factor asociado con la DA.
La frecuente asociación de estas entidades con los FRCV, la DM y la ECVA obliga a una rápida identificación de dichos pacientes para implementar cuanto antes el tratamiento y control de sus factores de riesgo y de la enfermedad cardiovascular.
FinanciaciónLa financiación del estudio SIMETAP (código beca: 05/2010RS) RS_AP10/8 fue aprobada según la Orden 472/2010, de 16 de septiembre, de la Consejería de Sanidad, por la que se aprueban las bases reguladoras y la convocatoria de ayudas para el año 2010 de la Agencia «Pedro Laín Entralgo» de Formación, Investigación y Estudios Sanitarios de la Comunidad de Madrid, para la realización de proyectos de investigación en el campo de resultados en salud en atención primaria.
Comité Ético de InvestigaciónComisión de Investigación de la Gerencia Adjunta de Planificación y Calidad.
Gerencia de Atención Primaria. Servicio Salud de la Comunidad de Madrid (SERMAS).
Conflicto de interesesLos autores no tienen conflictos de intereses para esta publicación.
Se agradece la colaboración prestada por los siguientes médicos que han participado en el Grupo de Investigación del Estudio SIMETAP: Abad Schilling C, Adrián Sanz M, Aguilera Reija P, Alcaraz Bethencourt A, Alonso Roca R, Álvarez Benedicto R, Arranz Martínez E, Arribas Álvaro P, Baltuille Aller MC, Barrios Rueda E, Benito Alonso E, Berbil Bautista ML, Blanco Canseco JM, Caballero Ramírez N, Cabello Igual P, Cabrera Vélez R, Calderín Morales MP, Capitán Caldas M, Casaseca Calvo TF, Cique Herráinz JA, Ciria de Pablo C, Chao Escuer P, Dávila Blázquez G, de la Peña Antón N, de Prado Prieto L, del Villar Redondo MJ, Delgado Rodríguez S, Díez Pérez MC, Durán Tejada MR, Escamilla Guijarro N, Escrivá Ferrairó RA, Fernández Vicente T, Fernández-Pacheco Vila D, Frías Vargas MJ, García Álvarez JC, García Fernández ME, García García Alcañiz MP, García Granado MD, García Pliego RA, García Redondo MR, García Villasur MP, Gómez Díaz E, Gómez Fernández O, González Escobar P, González-Posada Delgado JA, Gutiérrez Sánchez I, Hernández Beltrán MI, Hernández de Luna MC, Hernández López RM, Hidalgo Calleja Y, Holgado Catalán MS, Hombrados Gonzalo MP, Hueso Quesada R, Ibarra Sánchez AM, Iglesias Quintana JR, Íscar Valenzuela I, Iturmendi Martínez N, Javierre Miranda AP, López Uriarte B, Lorenzo Borda MS, Luna Ramírez S, Macho del Barrio AI, Magán Tapia P, Marañón Henrich N, Mariño Suárez JE, Martín Calle MC, Martín Fernández AI, Martínez Cid de Rivera E, Martínez Irazusta J, Migueláñez Valero A, Minguela Puras ME, Montero Costa A, Mora Casado C, Morales Cobos LE, Morales Chico MR, Moreno Fernández JC, Moreno Muñoz MS, Palacios Martínez D, Pascual Val T, Pérez Fernández M, Pérez Muñoz R, Plata Barajas MT, Pleite Raposo R, Prieto Marcos M, Quintana Gómez JL, Redondo de Pedro S, Redondo Sánchez M, Reguillo Díaz J, Remón Pérez B, Revilla Pascual E, Rey López AM, Ribot Catalá C, Rico Pérez MR, Rivera Teijido M, Rodríguez Cabanillas R, Rodríguez de Cossío A, Rodríguez De Mingo E, Rodríguez Rodríguez AO, Rosillo González A, Rubio Villar M, Ruiz Díaz L, Ruiz García A, Sánchez Calso A, Sánchez Herráiz M, Sánchez Ramos MC, Sanchidrián Fernández PL, Sandín de Vega E, Sanz Pozo B, Sanz Velasco C, Sarriá Sánchez MT, Simonaggio Stancampiano P, Tello Meco I, Vargas-Machuca Cabañero C, Velazco Zumarrán JL, Vieira Pascual MC, Zafra Urango C, Zamora Gómez MM, Zarzuelo Martín N.