En los pacientes que han alcanzado un control óptimo del c-LDL persiste un riesgo residual de enfermedad cardiovascular aterotrombótica (ECVA) relacionado con alteraciones del metabolismo lipídico, entre las que las alteraciones de las lipoproteínas ricas en triglicéridos y del colesterol que contienen, denominado colesterol remanente, juegan un papel principal. El colesterol remanente tiene una relación con el riesgo residual de ECVA que es independiente del c-LDL y ha sido demostrada en los estudios epidemiológicos y de aleatorización mendeliana, y en los análisis de los ensayos clínicos con fármacos hipolipidemiantes. Las partículas remanentes de las lipoproteínas ricas en triglicéridos son altamente aterogénicas, por su capacidad de entrar y ser retenidas en la pared arterial, su alto contenido en colesterol y su capacidad de generar células espumosas y una respuesta inflamatoria. La valoración del colesterol remanente puede aportar información sobre el riesgo residual de ECVA más allá de la información aportada por el c-LDL, el c-no HDL y la apoB, en particular en los individuos con hipertrigliceridemia, diabetes tipo 2 o síndrome metabólico. En el estudio REDUCE-IT se demostró que el icosapento de etilo tiene un efecto preventivo frente a la ECVA en los pacientes de muy alto riesgo cardiovascular con hipertrigliceridemia tratados con estatinas y con un c-LDL en objetivos. Los nuevos fármacos hipolipidemiantes contribuirán a definir la eficacia y los criterios en el tratamiento del exceso de colesterol remanente y de la hipertrigliceridemia en la prevención de la ECVA.
In patients who have achieved optimal LDL-C control, there remains a residual risk of atherothrombotic cardiovascular disease (ACVD) related to alterations in lipid metabolism, where alterations in triglyceride-rich lipoproteins and the cholesterol they contain, called remnant cholesterol, play a major role. Remnant cholesterol has an association with residual risk of ACVD that is independent of LDL-C and has been demonstrated in epidemiological and Mendelian randomisation studies, and in analyses of clinical trials of lipid-lowering drugs. Remnant triglyceride-rich lipoproteins particles are highly atherogenic, due to their ability to enter and be retained in the arterial wall, their high cholesterol content, and their ability to generate “foam cells” and an inflammatory response. Assessment of remnant cholesterol may provide information on residual risk of ACVD beyond the information provided by LDL-C, Non-HDL-C, and apoB, particularly in individuals with hypertriglyceridaemia, type 2 diabetes, or metabolic syndrome. In the REDUCE-IT study, icosapent ethyl was shown to have a preventive effect against ACVD in very high cardiovascular risk patients with hypertriglyceridaemia treated with statins and target LDL-C. New lipid-lowering drugs will help to define efficacy and criteria in the treatment of excess remnant cholesterol and hypertriglyceridaemia in the prevention of ACVD.
Las guías actuales sobre el tratamiento de las dislipidemias en la prevención de las enfermedades cardiovasculares de origen aterotrombótico (ECVA) se centran en la disminución del colesterol de las lipoproteínas de baja densidad (c-LDL)1–3, un planteamiento que ha aportado un gran beneficio en años y calidad de vida ganados en las últimas décadas4. Sin embargo, en los grandes ensayos clínicos de tratamiento de la hipercolesterolemia con estatinas en monoterapia, o asociadas a ezetimiba o anticuerpos monoclonales frente a la proteína PCSK9 (iPCSK9), se ha observado que a pesar de un control estricto del c-LDL5–8 continúa existiendo un riesgo residual que puede explicarse por factores lipídicos y no lipídicos9. Con referencia a los primeros, una amplia base de evidencias ha demostrado que las lipoproteínas ricas en triglicéridos (LPRTG) y las partículas que resultan de su metabolización, las denominadas partículas remanentes, juegan un papel principal en dicho riesgo residual10. La hipertrigliceridemia es un problema muy frecuente en la población general debido a polimorfismos genéticos relacionados con el metabolismo de las LPRTG y a la prevalencia creciente de obesidad y diabetes mellitus. Alrededor de un 25% de los pacientes tratados con estatinas presentan hipertrigliceridemia11 a pesar de que mantengan un c-LDL en objetivos, y esta situación es aún más común en la población con ECVA o diabetes12. Sin embargo, la hipertrigliceridemia es un problema clínico que pasa desapercibido o sobre el que no se actúa en la mayoría de los pacientes13. Por ello, la hipertrigliceridemia y el exceso de colesterol remanente puede considerarse como una de las principales asignaturas pendientes en la amplia y compleja materia de la prevención cardiovascular.
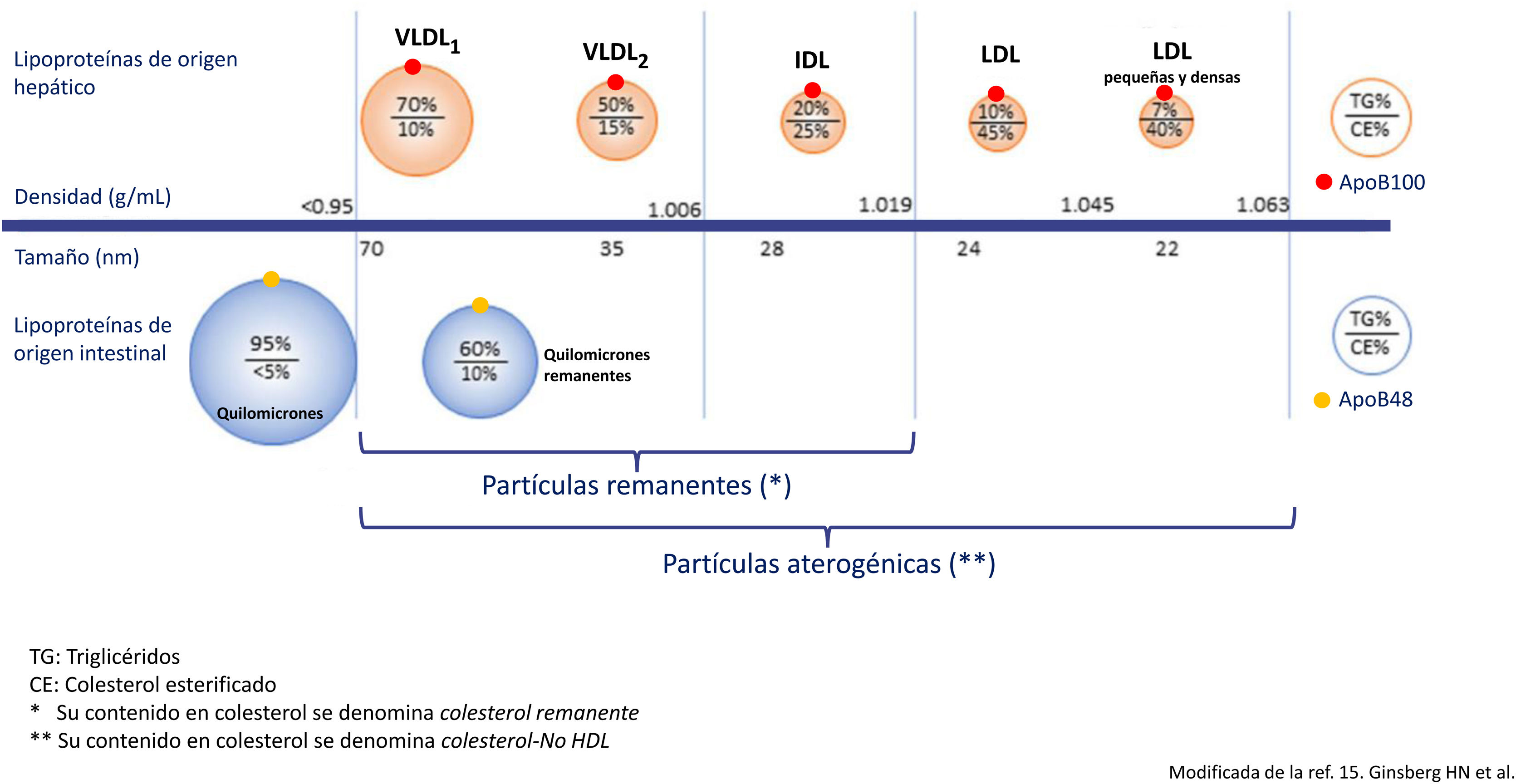
Metabolismo de las LPRTG y su relación con la arteriosclerosisLas LPRTG incluyen los quilomicrones, que transportan los triglicéridos de origen intestinal, y las lipoproteínas de muy baja densidad (VLDL), que vehiculizan los triglicéridos mayoritariamente de origen hepático, si bien se ha descrito que hasta un 25% de las VLDL son de origen intestinal14. Las LPRTG de origen hepático contienen apoB100 y las de origen intestinal una forma truncada de esta con un 48% de su peso molecular, la apoB48. Tan pronto entran en el torrente sanguíneo, las LPRTG empiezan a perder triglicéridos bajo la acción de la lipoproteína lipasa (LPL) y también apolipoproteínas C, y se enriquecen en colesterol y en apoE, transformándose en las mencionadas partículas remanentes15; en este proceso las LPRTG disminuyen de tamaño, pudiendo ser eliminadas en el hígado, o en el caso de las VLDL, transformarse en lipoproteínas de densidad intermedia (IDL) y, finalmente, bajo la acción de la lipasa hepática (LH), en partículas LDL16. Así, en el plasma sanguíneo se encuentra una heterogénea población de partículas remanentes de LPRTG y al colesterol que contienen se le denomina colesterol remanente. Las VLDL son procesadas de forma muy rápida a partículas remanentes, por lo que se puede considerar que la mayoría de las lipoproteínas que se encuentran en el plasma son remanentes; estas presentan un diámetro<70nm, lo que les permite atravesar la pared arterial por transcitosis, donde ejercerán su efecto aterogénico. Los quilomicrones, al ser de mayor tamaño, requieren una mayor exposición a la LPL para disminuir el tamaño lo suficiente para poder entrar en la pared arterial, de manera que a pesar de que las partículas con apoB48 pueden incorporarse a la placa de ateroma, las que predominan son las que contienen apoB10015.
La acción de la LPL y el aclaramiento hepático de las LPRTG depende de distintas enzimas y proteínas transferidoras de lípidos, y de su composición en lípidos y apolipoproteínas. Tanto un exceso de producción de LPRTG como una disminución de su catabolismo dan lugar a un aumento de la concentración plasmática de partículas remanentes. En la hipertrigliceridemia grave, definida como unas concentraciones superiores a 880mg/dL (10mmol/L)1, el mecanismo predominante es el aclaramiento insuficiente de dichas partículas lipoproteicas. En esta situación predominan las partículas VLDL más grandes, ricas en triglicéridos (VLDL1), y los quilomicrones, partículas que por su mayor tamaño tienen más dificultad para entrar en la pared arterial, un menor potencial aterogénico (fig. 1) y un mayor riesgo de desencadenar una pancreatitis. Por el contrario, en la hipertrigliceridemia moderada, definida como unas concentraciones entre 150 y 880mg/dL (1,7-10mmol/L)1,3, existe un aumento de partículas VLDL1 y de partículas remanentes, una situación altamente aterogénica debido a varios mecanismos. En primer lugar, se produce un intercambio de triglicéridos por colesterol entre las LPRTG, las LDL y las lipoproteínas de alta densidad (HDL), mediado por la proteína transferidora de ésteres de colesterol, que provoca una alteración en la estructura, composición y funcionalidad de las LDL y de las HDL17, dando lugar a unas LDL pequeñas y densas (fig. 2) más aterogénicas, y a su vez las HDL pierden propiedades antiaterogénicas. Por otro lado, las partículas remanentes entran fácilmente en la pared arterial y son retenidas en el espacio subendotelial con mayor afinidad que las LDL, entre otros factores por su capacidad de unión a los proteoglicanos. En tercer lugar, y en virtud de su contenido en apoE, son captadas por los receptores basurero (scavenger) macrófagos sin necesidad de modificarse, lo que les confiere una alta capacidad de generar células espumosas, superior a la de las LDL. Las partículas remanentes tienen un alto contenido en colesterol, que es al menos 4 veces mayor por partícula que el de las LDL, y un cociente molar colesterol/apoB 2 veces mayor que el de estas últimas18, lo que también favorece la formación de células espumosas19. Con todo, las principales suministradoras de colesterol a la pared arterial son las partículas LDL tanto en situación de ayuno como posprandial, ya que son entre 3-10 veces más numerosas en el plasma sanguíneo que las LPRTG y permanecen en la circulación por más tiempo, entre 2,5 y 3,5 días, a diferencia de los quilomicrones y las VLDL, que en situación de hipertrigliceridemia permanecen entre 4 y 13h. Se ha estimado que las partículas remanentes, entendiendo por estas las fracciones VLDL e IDL, transportan alrededor de un 30% de la carga de colesterol que contienen el conjunto de lipoproteínas con apoB.
Modificada de Ginsberg et al.15.
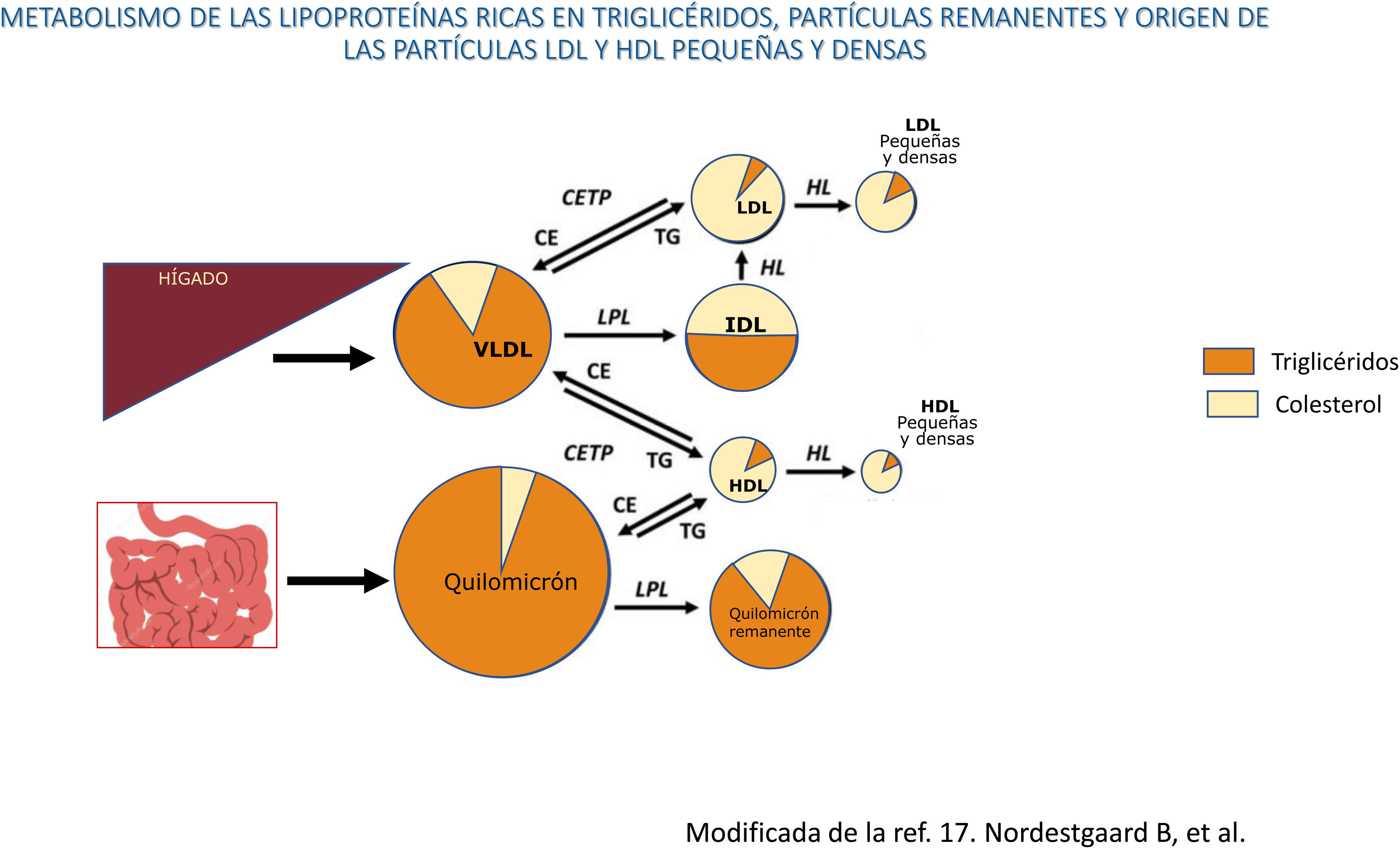
Los quilomicrones y las VLDL son secretados desde el intestino y el hígado, respectivamente, a la circulación sanguínea, donde sufren un proceso rápido de delipidación por la lipoproteinlipasa y la lipasa hepática que inducen la liberación de ácidos grasos libres y la formación de partículas remanentes, tanto de los quilomicrones, como de las VLDL. En las situaciones que cursan con un aumento del flujo de ácidos grasos al hígado, como el síndrome metabólico y la resistencia a la insulina, se produce una mayor producción y secreción de VLDL hepáticas, situación que aumenta la actividad de la proteína transferidora de ésteres de colesterol (CETP), que da lugar a que las partículas remanentes adquieran colesterol de las HDL a cambio de triglicéridos, y todo ello, junto con la delipidación de los triglicéridos por las lipasas, da lugar a la formación de unas partículas remanentes pequeñas, ricas en colesterol y deplecionadas de triglicéridos, con un aumento del colesterol remanente plasmático. Así mismo, la activación de la CETP induce la transferencia de triglicéridos desde las LPRTG a las HDL y las LDL y estas partículas deplecionadas de colesterol y ricas en triglicéridos, una vez sufren la acción de la lipasa hepática, se transforman en unas LDL y HDL pequeñas y densas. Las LDL pequeñas y densas tienen un alto potencial aterogénico y las HDL pequeñas y densas tienen un menor efecto protector frente a la arteriosclerosis, lo que resulta en una situación altamente aterogénica.
Entre los distintos lípidos plasmáticos, el colesterol es el principal protagonista del proceso aterogénico, ya que, a diferencia de los triglicéridos, que pueden ser degradados por la mayoría de las células20, este no puede procesarse y queda retenido en la pared arterial. Aunque, en menor medida, los triglicéridos también son aterogénicos porque bajo la acción de la LPL, la fosfolipasa y otras enzimas liberan ácidos grasos libres y lisolípidos que desencadenan una respuesta inflamatoria21. En un estudio de aleatorización mendeliana se observó que un aumento de la concentración plasmática de colesterol de las partículas remanentes de 39mg/dL (1mmol/L) se asociaba a un incremento de 3 veces en las concentraciones de proteína C reactiva22. Por otro lado, las grasas de la dieta pueden condicionar la respuesta inflamatoria desencadenada por los triglicéridos, ya que esta depende del tipo de ácidos grasos asociados a la molécula de glicerol, siendo más evidente con los ácidos grasos saturados21. En la aterogenicidad del colesterol remanente también pueden intervenir algunas proteínas clave en la regulación del metabolismo lipídico, como la apoCIII y la ANGPTL3, que actuarían a través de mecanismos distintos de la apoB23.
Medición del colesterol remanenteEl colesterol remanente se puede calcular a partir del perfil lipídico convencional restando al valor del colesterol total el valor del c-LDL y del c-HDL24. En los casos en los que el c-LDL se obtiene mediante la ecuación de Friedewald, el valor del colesterol remanente equivale simplemente a la división de la concentración de triglicéridos por 5 (cuando las unidades de medida son mg/dL), que es la proporción que se asume existe entre los triglicéridos y el colesterol en las partículas VLDL. La hipertrigliceridemia se define como una concentración de triglicéridos superior a 150mg/dL (1,8mmol/L)1–3; por ende, el exceso de colesterol remanente se define como una concentración superior a 30mg/dL (0,8mmol/L). Otra forma más exacta de calcular el colesterol remanente consiste en la obtención del valor del c-LDL mediante ecuaciones en las que se utiliza un factor ajustable variable en función de la concentración plasmática de triglicéridos y de colesterol-no HDL (c-no HDL)25. Estas ecuaciones más precisas son especialmente necesarias en los pacientes con hipertrigliceridemia, en los que la ecuación de Friedewald tiene un amplio margen de error, ya que infraestima el c-LDL conforme los triglicéridos aumentan, sobre todo a partir de una concentración de triglicéridos de 200mg/dL, y no es utilizable a partir de unas concentraciones de triglicéridos de 400mg/dL26. Existen, además, otros métodos de medición directa del colesterol remanente que son poco aplicables a la práctica clínica por su complejidad y falta de estandarización27, si bien recientemente se ha comercializado un método homogéneo totalmente automatizado28, aún no estandarizado. Desde hace unos años disponemos, además, de un método de espectroscopia con resonancia magnética nuclear, una técnica que permite un análisis rápido y sin necesidad de pretratar las muestras de suero, que nos informa de la cantidad, composición y tamaño de las lipoproteínas, y nos aporta una visión más profunda del estado del metabolismo lipídico y del riesgo de ECVA en los pacientes dislipidémicos29.
Ante esta diversidad de opciones para calcular o medir el colesterol remanente, parece necesario llegar a un consenso sobre el método más adecuado y asequible a los laboratorios clínicos. Las guías y documentos actuales tanto de los Estados Unidos2 como de Europa1,3,30 indican que el perfil para el estudio del metabolismo lipídico debe incluir el colesterol total y los triglicéridos plasmáticos, el c-LDL, el c-no HDL y la lipoproteína(a), esta última al menos en una ocasión a lo largo de la vida. Así mismo, y aunque el valor del c-no HDL incluye tanto el c-LDL como el colesterol remanente, parece razonable que en todo perfil lipídico se incluya además este último, ya que, al tratarse de 2 componentes claramente diferenciados desde el punto de vista metabólico, pueden requerir estrategias terapéuticas diferentes.
Otro parámetro al que se ha prestado menor atención, pero que no por ello es menos relevante, es la apoB. La apoB se considera en la actualidad el marcador más preciso de riesgo de ECVA, por encima del c-LDL y el c-no HDL31. La masa de colesterol que contienen las partículas aterogénicas (VLDL, IDL y LDL) es variable, pero cada partícula lipoproteica contiene una sola molécula de apoB, de modo que la concentración plasmática de apoB es un buen indicador del número de partículas aterogénicas del plasma. Se ha postulado, como se describe más adelante, que este número de partículas es el principal factor causante de la arteriosclerosis, por encima de la concentración de colesterol y triglicéridos plasmáticos32, y que cada partícula con apoB es la unidad fundamental con capacidad de lesionar la pared arterial33. En consonancia con este concepto, en un estudio reciente a partir de los datos del biobanco del Reino Unido y de 2 grandes ensayos clínicos, el estudio Fourier y el IMPROVE-IT, se ha demostrado que la apoB predice mejor el riesgo de infarto de miocardio que el c-LDL y el c-no HDL, e incluso que el contenido en triglicéridos de dichas lipoproteínas34. Estos datos apoyan el concepto de que el objetivo principal del tratamiento de las dislipidemias para prevenir la ECVA sea la disminución de la apoB y que se deben llevar a cabo estrategias más enérgicas si, a pesar de un óptimo control del c-LDL y c-no-HDL, esta continua elevada. Por otro lado, las guías de la ESC/EAS de 2019, las de la American Association of Clinical Chemistry y las de la European Federation of Laboratory Medicine indican que la apoB puede medirse con mayor precisión que el c-LDL y el c-no HDL, particularmente en la hipertrigliceridemia y ante unas concentraciones bajas de colesterol total35.
De acuerdo con lo referido en el presente apartado, el perfil lipídico ideal, además del c-LDL, el c-HDL, el c-no HDL y los triglicéridos, debería incluir el colesterol remanente y la apoB, con independencia de que en al menos una ocasión se mida la lipoproteína(a).
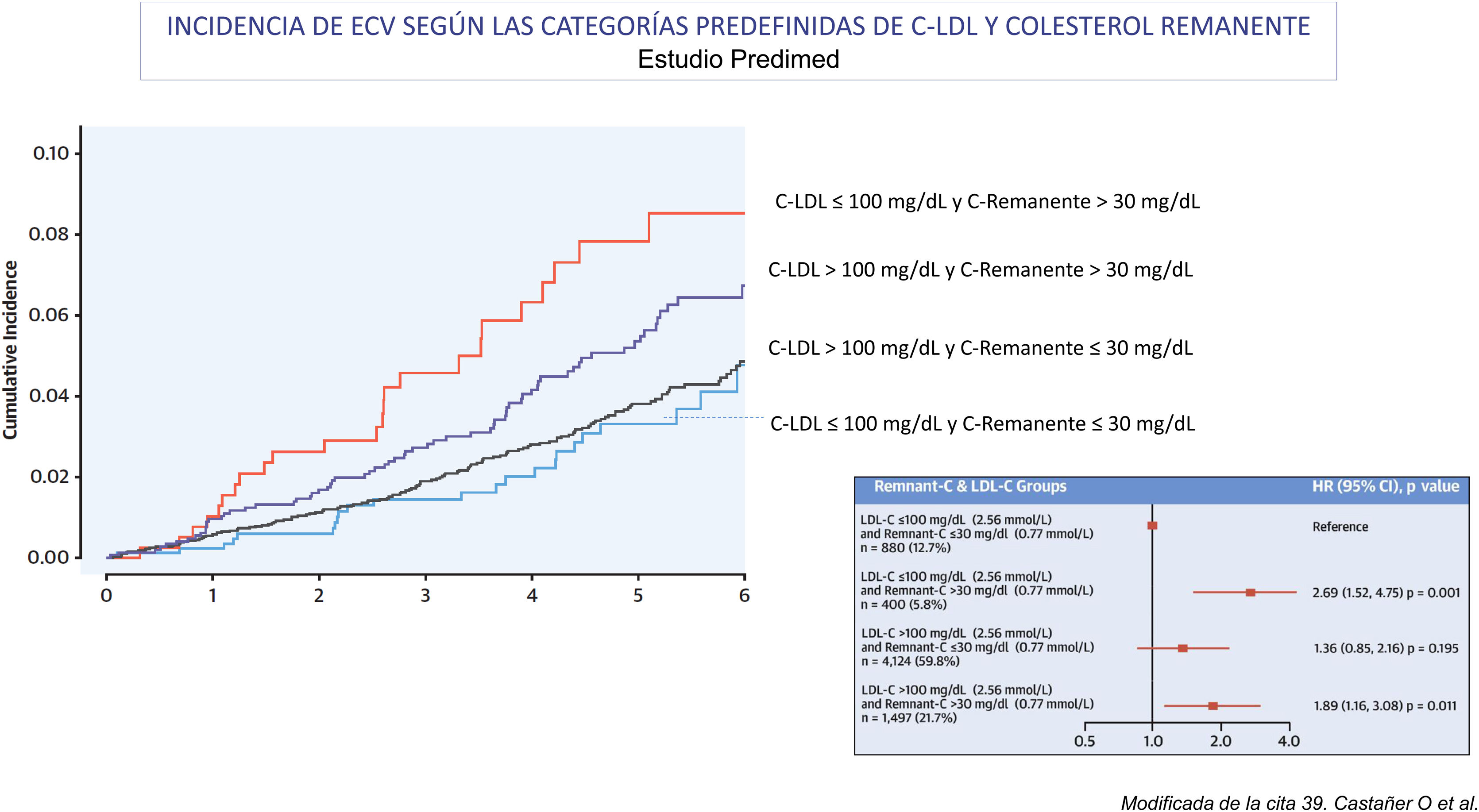
Colesterol remanente y riesgo de ECVALa relación entre el colesterol remanente y el riesgo de ECVA ha quedado bien demostrada a partir de una amplia base de datos que han surgido de los estudios epidemiológicos prospectivos en muestras muy amplias de población general, los estudios de aleatorización mendeliana y los análisis post hoc de los ensayos clínicos aleatorizados36. Distintos estudios epidemiológicos prospectivos a gran escala, como el Copenhagen City Heart Study y el Copenhagen Ischemic Heart Disease Study, que se realizaron principalmente sin situación de ayuno20,37, y un estudio de intervención con dieta mediterránea, el estudio Predimed, en el que las muestras se obtuvieron en ayunas37 (fig. 3), han demostrado la relación que existe entre la concentración plasmática de triglicéridos, el colesterol remanente y el riesgo de ECVA. A partir de los datos de población danesa también se ha demostrado que el colesterol remanente es un mejor predictor de la mortalidad por todas las causas que el c-LDL38. Así mismo, en un estudio de 17.532 individuos sin ECVA, que fueron seguidos durante un tiempo medio de 18,7 años y que habían sido incluidos en el Atherosclerosis Risk in Communities study (n=9.748), el Multi-Ethnic Study of Atherosclerosis (n=3.049) y el Coronary Artery Risk Development in Young Adults (n=4.735)39, se observó que el logaritmo del colesterol remanente, que se calculó restando al c-no HDL el valor del c-LDL calculado, era un predictor independiente del riesgo de ECVA en los análisis ajustados por el c-no HDL, la apoB y otros factores de riesgo de ECVA. También se observó que entre los individuos con discordancia entre el colesterol remanente y el c-LDL, solo los que presentaban un colesterol remanente elevado y un c-LDL bajo tenían un riesgo aumentado de ECVA al compararlos con los que no presentaban discordancia entre ambos valores (HR 1,21, IC95% 1,08-1,34).
En la figura se muestra la relación entre el perfil lipídico basal y la incidencia de episodios mayores de enfermedad cardiovascular aterotrombótica (ECVA) en la población del estudio Prevención con Dieta Mediterránea (Predimed; con una edad media de 67 años, un índice de masa corporal de 30kg/m2, 43% varones y 48% con diabetes) durante un seguimiento de 4,8 años. La relación entre las concentraciones de lípidos como variables categóricas y la incidencia de episodios mayores de ECVA se analizó mediante modelos ajustados y no ajustados de riesgo proporcional de Cox (n=6.901; casos de ECVA=263). En cada subgrupo de c-LDL (>100 o≤100mg/dL [2,59mmol/L]), un colesterol remanente basal alto (>30mg/dL [0,78mmol/L]) identificaba a los individuos con mayor riesgo de ECVA en comparación con los que tenían concentraciones menores. La menor incidencia de episodios mayores de ECVA se observó en los grupos con colesterol remanente bajo, con independencia de las concentraciones de c-LDL y de otros factores de riesgo cardiovascular.
Existen también datos de 17 informes publicados a partir de 13 cohortes independientes en los que se describe una asociación estadísticamente significativa entre el exceso de colesterol remanente y la ECVA10, tanto en los individuos isquémicos como en los no isquémicos40, y en ambos sexos41. A su vez, los pacientes tratados con estatinas que han alcanzado un control óptimo del c-LDL, pero presentan unas concentraciones de triglicéridos elevadas, tienen un mayor riesgo de ECVA que se mantiene a pesar de ajustar por otros factores lipídicos, como el c-HDL y el c-LDL42,43. En estos pacientes tratados con estatinas, la disminución del colesterol remanente se ha asociado a una disminución del riesgo de ECVA con una relación independiente de la disminución del c-LDL44.
También existen datos de la relación del colesterol remanente con la evolución de las lesiones arteriales coronarias. En un análisis agrupado de estudios con ecografía intracoronaria se observó que las concentraciones de colesterol remanente durante el seguimiento y los cambios de este se asociaron a la progresión de la arteriosclerosis con independencia de las concentraciones de apoB y de otros factores de riesgo de ECVA45.
Por otro lado, se ha cuestionado si los modelos estadísticos que se utilizan para analizar la relación entre el metabolismo de las LPRTG y el riesgo de ECVA deben incluir, además de los triglicéridos, el c-HDL, y se ha argumentado que el metabolismo de ambos se encuentra estrechamente vinculado, lo que puede conducir a un exceso de ajuste que interfiera la valoración de dicha relación. En el mismo sentido, se ha planteado que las alteraciones de los triglicéridos y de las HDL son, ambas, el reflejo de una alteración del metabolismo de las partículas remanentes de las LPRTG más que factores causales independientes46.
La relación entre las LPRTG y el riesgo de ECVA también ha sido demostrada en los estudios genéticos de aleatorización mendeliana17. En ellos, las variantes de los genes relacionados con el metabolismo de los triglicéridos, asociadas a una mayor actividad lipolítica y a unas concentraciones menores de triglicéridos y de colesterol remanente, incluyendo el gen de la LPL, de la apoCIII, la ANGPTL3 y la ANGPTL4, se han asociado a un menor riesgo de ECVA46–48. En sentido opuesto, las variantes genéticas asociadas a una menor actividad de la LPL y de la LH y a un aumento de los triglicéridos y del colesterol remanente se asocian a un mayor riesgo de ECVA49,50. Por el contrario, los estudios de aleatorización mendeliana no han demostrado una relación entre las variantes genéticas asociadas a menores concentraciones de c-HDL y el riesgo de ECVA. Así, Varbo et al., a partir de una amplia muestra de población de Copenhague, analizaron el riesgo coronario en relación con 3 grupos de variantes genéticas, las asociadas de forma más específica con el colesterol remanente, las que se asociaban tanto con el colesterol remanente como con el c-HDL, y las relacionadas con el c-LDL. Observaron que las variantes vinculadas al colesterol remanente, y también al c-LDL, pero no al c-HDL, se relacionaban con el riesgo de enfermedad coronaria22. En dicho estudio se estimó que por cada incremento de 1,0mmol/L en el colesterol remanente el riesgo de cardiopatía isquémica aumentaba 2,8 veces, con independencia de los valores de c-LDL y de c-HDL, y el riesgo aumentaba 1,5 veces por cada incremento de 1mmol/L en el c-LDL.
En otro gran estudio de aleatorización mendeliana se ha demostrado la relevancia de la apoB en la predicción del riesgo de ECVA32. Se trata de un estudio con 654.783 participantes, entre los que se encontraban 91.129 casos de enfermedad coronaria, en el que se comparó la influencia de 2 puntuaciones genéticas, una a partir de las variantes de la LPL asociadas a las concentraciones de triglicéridos y otra con las variantes del receptor LDL asociadas a las concentraciones de c-LDL. Se observó que por cada 10mg/dL de disminución en la concentración de apoB asociada a la puntuación genética de la LPL, la concentración de triglicéridos era 70mg/dL inferior y sin asociarse a variaciones en el c-LDL. Así mismo, por cada 10mg/dL de disminución de la apoB asociada a la puntuación genética del receptor LDL, el c-LDL disminuía 14mg/dL, sin variaciones en la concentración de triglicéridos. .Se observó que la disminución del riesgo coronario asociado a la disminución de 10mg/dL en la concentración de apoB era similar, con independencia de si se asociaba a una disminución del c-LDL o de los triglicéridos(OR 0,771 y OR 0,773, respectivamente). Además, en los análisis multivariados la asociación entre los triglicéridos y el c-LDL con el riesgo coronario desaparecía al ajustar por las diferencias en la apoB. Por tanto, el cambio absoluto en las concentraciones de apoB era el que determinaba el beneficio asociado a unas concentraciones menores de triglicéridos23. Sin embargo, el colesterol y los triglicéridos no son los únicos componentes proaterogénicos que contienen las lipoproteínas con apoB, sino que también contienen fosfolípidos oxidados que ejercen una potente acción proinflamatoria y tienen un alto potencial para lesionar la pared arterial.
Tratamiento de la hipertrigliceridemia y del exceso de colesterol remanentePara controlar la hipertrigliceridemia y disminuir el colesterol remanente es prioritario mejorar los hábitos de vida, en particular la dieta inadecuada y el sedentarismo, y corregir las posibles causas de hipertrigliceridemia secundaria51,52. Salvo en los pacientes con hipertrigliceridemia grave, en los que el primer objetivo es disminuir los triglicéridos para prevenir la pancreatitis aguda, en la hipertrigliceridemia moderada el primer paso es controlar el c-no HDL con una estatina. Las estatinas aumentan el aclaramiento plasmático de las partículas remanentes de origen hepático e intestinal, disminuyen la lipidemia posprandial y, como ocurre con otros fármacos, su efecto sobre los triglicéridos es tanto más acusado cuanto mayor es el grado de hipertrigliceridemia15. Si con estatinas en monoterapia no se alcanzan los objetivos de c-no HDL, es necesario asociar ezetimiba1–3. La ezetimiba inhibe la proteína Niemann-Pick C1L1, disminuye la absorción intestinal de colesterol y el contenido en colesterol de los quilomicrones remanentes, y aumenta el catabolismo de la apoB100 y de las partículas remanentes de origen hepático53. En los pacientes de muy alto riesgo de ECVA que no logran los objetivos de c-LDL y c-no HDL con estatinas en monoterapia o asociadas a ezetimiba, pueden estar indicados los iPCSK9. Estos, igual que las estatinas, aumentan la actividad de los receptores de las LDL, pero su efecto sobre las concentraciones de triglicéridos es más modesto y parece limitarse a las partículas remanentes de origen hepático y menor tamaño, pero no intestinal, en situaciones de hipertrigliceridemia moderada15. Solo en los pacientes de alto riesgo que después de alcanzar el control del c-LDL y del c-no HDL persiste una concentración de triglicéridos>200mg/dL se puede considerar añadir un fibrato, o cuando los triglicéridos se mantienen por encima de 135mg/dL, icosapento de etilo1, teniendo en cuenta que el objetivo es disminuir el riesgo de ECVA, más que alcanzar una concentración determinada de triglicéridos o de partículas remanentes, ya que las evidencias sobre el beneficio de lograr unos objetivos de triglicéridos o de colesterol remanente en los estudios de intervención son escasas. De todos modos, en los análisis agrupados de múltiples ensayos clínicos con fármacos que disminuyen en mayor medida los triglicéridos que el c-LDL (fibratos, ácido nicotínico y ácidos grasos omega-3 [AG-n3]) y también de los ensayos con estatinas, se ha observado que la disminución de los triglicéridos se asocia a un menor riesgo de episodios de enfermedad vascular, incluso después de ajustar por la disminución del c-LDL, si bien el efecto es menor que el obtenido al disminuir el c-LDL. Así, una disminución del c-LDL de 40mg/dL se asociaba a un riesgo cardiovascular un 20% menor, pero al disminuir los triglicéridos 40mg/dL el riesgo era solo un 4-5% menor54.
Los fármacos actualmente disponibles con mayor efecto sobre las LPRTG que sobre las LDL son los fibratos y los AG-n355.
Los principales fibratos o derivados del ácido fíbrico son el fenofibrato, el gemfibrozilo y el bezafibrato, y actúan mediante la activación de los receptores alfa activados por los proliferadores de los peroxisomas (PPAR-α) que dan lugar a una mayor expresión de la LPL y otros genes relacionados con la lipolisis y la función de las HDL. Estos fármacos activan el aclaramiento de las VLDL, sobre todo de las partículas más grandes y ricas en triglicéridos (VLDL1), y disminuyen el colesterol remanente, la lipidemia posprandial y la concentración de triglicéridos entre un 30 y un 50%, con una respuesta variable que depende en gran medida del grado de hipertrigliceridemia56. Los fibratos disminuyen moderadamente la apoB y el c-LDL en la hipertrigliceridemia moderada, pero pueden aumentar, también en grado moderado, el c-LDL en los pacientes con hipertrigliceridemia severa15. La eficacia de los fibratos para prevenir la ECVA ha sido evaluada en distintos ensayos clínicos aleatorizados en pacientes de alto riesgo cardiovascular tratados con estos fármacos en monoterapia y utilizados en monoterapia o combinados con estatinas, con resultados controvertidos57,58. Sin embargo, estos ensayos adolecen de que la hipertrigliceridemia no era un criterio obligado de inclusión en ninguno de ellos. Sacks et al.59, al analizar los resultados de los 5 principales ensayos clínicos con fibratos, observaron que entre los pacientes con dislipidemia aterogénica, definida como una concentración de triglicéridos≥204mg/dL y de c-HDL≤34mg/dL, el tratamiento con estos fármacos se asoció a una disminución de un 35% (IC95% 22-46) en el riesgo de presentar episodios de enfermedad coronaria, mientras que en los que no presentaban dicha dislipidemia no se observó un efecto significativo. Estos resultados han sido reafirmados en metaanálisis más amplios de los ensayos con fibratos60, pero al tratarse de análisis secundarios no han permitido establecer recomendaciones firmes sobre sus indicaciones en el tratamiento de la hipertrigliceridemia1–3. Los datos de un estudio reciente han añadido más incertidumbre sobre el papel de los fibratos en la prevención cardiovascular. Se trata del estudio Prominent, realizado con pemafibrato, un fármaco definido como el primer modulador selectivo de los receptores PPAR-α con capacidad de disminuir la concentración de triglicéridos plasmáticos por encima del 50%61, en el que se incluyeron 10.000 pacientes diabéticos con hipertrigliceridemia y déficit de c-HDL62. Este ensayo ha sido interrumpido antes de su finalización por razones de futilidad63 y en este momento se mantienen otros ensayos clínicos con pemafibrato en pacientes con hipertrigliceridemia grave y con esteatosis hepática64. Ference et al.32 han postulado que los resultados negativos de los ensayos con fibratos pueden ser debidos a que sean necesarias disminuciones mucho más acusadas de las concentraciones de triglicéridos a las conseguidas en los ensayos realizados hasta la actualidad. Estos autores plantean que si consideramos que la concentración de colesterol de las LPRTG se calcula dividiendo la concentración de triglicéridos (expresada en mg/dL) por 5, y si aceptáramos que todas las lipoproteínas con apoB tienen un efecto aterogénico similar, para disminuir el riesgo cardiovascular un 20%, que es lo que se logra al disminuir el c-LDL 40mg/dL, habría que disminuir la concentración de triglicéridos 5 veces más, es decir, unos 200mg/dL. Sin embargo, en los ensayos clínicos realizados hasta la actualidad no se han logrado disminuciones mayores de 50mg/dL. Habrá que esperar los resultados de los ensayos con los nuevos fármacos de mayor potencia hipotrigliceridemiante que actualmente están en investigación, para valorar esta hipótesis.
Omega-3Los AG-n3, el ácido eicosapentaenoico (EPA) y el ácido docosahexanoico (DHA) ejercen sus efectos lipídicos a través de las vías metabólicas mediadas por los PPAR65 y aumentan el catabolismo de los ácidos grasos, disminuyen la lipogénesis e incrementan la lipolisis hepática. Además, mejoran la estabilidad de la membrana de las células del endotelio vascular y ejercen efectos antiinflamatorios, antioxidantes y antitrombóticos66. En la hipertrigliceridemia moderada disminuyen los triglicéridos alrededor de un 20% y sus efectos sobre la concentración plasmática de colesterol son escasos; mientras que el EPA induce un ligero descenso, el DHA provoca un aumento, también ligero. La indicación principal de los AG-n3 es la hipertrigliceridemia moderada o severa. La mayoría de los estudios con la combinación de EPA y DHA no han demostrado eficacia en la prevención primaria o secundaria de la ECVA63. Sin embargo, sí se ha observado un efecto preventivo en los ensayos con EPA. En el ensayo clínico Reduction of Cardiovascular Events with Icosapent Ethyl-Intervention Trial (REDUCE-IT)67, en el que se incluyeron pacientes con ECVA o diabéticos con al menos un factor de riesgo cardiovascular adicional, que siguiendo un tratamiento con estatinas presentaban unas concentraciones de triglicéridos de 135 a 500mg/dL y de c-LDL de 41 a 100mg/dL, los pacientes fueron tratados con icosapento de etilo, un éster etílico de EPA, 2g/12h, o con placebo durante 5 años. En los primeros se observó una disminución del riesgo de la variable cardiovascular principal de un 25% (HR 0,75; IC95% 0,68-0,83). En el grupo de tratamiento activo los triglicéridos disminuyeron un 18,3% y en el grupo placebo aumentaron un 2,2%, mientras que el c-LDL aumentó un 3,1 y un 10,2%, respectivamente. El efecto preventivo frente a la ECVA se relacionó escasamente con la disminución de los triglicéridos, siendo las concentraciones séricas de EPA las que se relacionaron de forma más evidente con dicho efecto. Por ello, se ha planteado que los efectos favorables del icosapento de etilo se deben a otros efectos biológicos, más allá del metabolismo lipídico, incluyendo la inflamación, la oxidación o la trombosis; sin embargo, este es un aspecto que se está estudiando actualmente. También sería interesante analizar si hubo alguna relación entre el colesterol remanente, el c-no HDL y la apoB con dicho efecto preventivo. Un aspecto controvertido del estudio REDUCE-IT es que en el grupo control se utilizó como placebo un aceite mineral que se relacionó con un incremento del c-LDL y de la proteína C reactiva, lo que podría haber provocado una sobreestimación del efecto del EPA68. Sin embargo, los análisis agrupados de otros ensayos clínicos en los que se ha utilizado este mismo placebo y el estudio de la influencia que pudieron haber ejercido los cambios en el c-LDL y la proteína C reactiva del grupo placebo en los resultados cardiovasculares descartan que ello tenga una influencia relevante, teniendo en cuenta la magnitud del efecto preventivo observado69. En otro estudio con EPA, un estudio abierto en población japonesa con un gran número de individuos en prevención primaria y secundaria que eran tratados con dosis bajas de estatinas, el Japan EPA Lipid Intervention Study70, también se observó un efecto preventivo frente a la ECVA con dosis más bajas de EPA (1,8g/día). Sin embargo, las concentraciones séricas de EPA en los pacientes de este estudio fueron similares a las del REDUCE-IT, lo que se ha atribuido a que partían de unas concentraciones elevadas de EPA debido al alto consumo de pescado, propio de la población japonesa. Los resultados del estudio REDUCE-IT han justificado que en las guías europeas de prevención cardiovascular71 y de dislipidemias1 se incluya el tratamiento con icosapento de etilo, 2g, 2 veces al día, como una opción terapéutica para prevenir la ECVA en los pacientes con hipertrigliceridemia y alto riesgo cardiovascular.
Nuevos fármacosEn los próximos años dispondremos de nuevas terapias de alta eficacia para controlar las alteraciones del metabolismo de las LPRTG y del colesterol remanente. Entre ellas se encuentran los inhibidores de la apoCIII y la ANGPTL3, proteínas que, entre otros efectos, disminuyen la actividad LPL, inhiben la lipolisis y aumentan las concentraciones plasmáticas de triglicéridos72. El volanesorsén (ISIS 304810; Akcea-Ionis Pharmaceuticals) es un oligonucleótido antisentido de la apoCIII que inhibe la traducción del ARNm de apoCIII y disminuye la síntesis de esta proteína. Disminuye los triglicéridos plasmáticos por encima del 80% y ya ha sido aprobada su financiación en los pacientes con diagnóstico genético de síndrome de quilomicronemia familiar, pero no en las formas menos graves de quilomicronemia de origen multifactorial. Su principal efecto secundario es la trombocitopenia, que puede llegar a ser severa73.
También se encuentran en fase avanzada de investigación un oligonucleótido antisentido frente a la apoCIII de acción selectiva hepática y con menor riesgo de trombocitopenia (AKCEA-APOCIII-LRx), el evinacumab, que es un anticuerpo anti-ANGPTL3, y el vupanorsén (AKCEA-ANGPTL3-LRx), un oligonucleótido antisentido frente a la ANGPTL3. Los inhibidores del ANGPTL3 disminuyen los triglicéridos por encima del 70-80%, y además de disminuir el colesterol remanente, inducen marcados descensos del c-LDL, el c-no HDL y la apoB74,75
Es muy probable que estos fármacos contribuyan a definir la eficacia del control del riesgo residual relacionado con las LPRTG y con el colesterol remanente en los pacientes que ya han logrado un control adecuado del c-LDL, y a establecer los objetivos terapéuticos de la hipertrigliceridemia y el colesterol remanente. El olezarsén (Akcea-Ionis Pharmaceuticals; anteriormente AKCEA-APOCIII-LRx) es igual que el volanesorsén, un oligonucleótido antisentido de apoCIII, pero conjugado con una partícula de N-acetil galactosamina, lo que le confiere mayor afinidad hepática y, por tanto, presenta menores concentraciones plasmáticas, lo que se espera se acompañe de una disminución de los efectos secundarios76. En la actualidad se están llevando a cabo ensayos clínicos en fase iii en pacientes con síndrome de quilomicronemia familiar (NCT04568434) y pacientes con quilomicronemia multifactorial (NCT05079919) para evaluar el descenso de triglicéridos, y se iniciarán estudios para evaluar su eficacia en la disminución del riesgo cardiovascular en pacientes con hipertrigliceridemia. Existe otro antagonista de la apoCIII que se encuentra en fase de investigación y que es el ARO-APOC-III; se trata de un ARN de interferencia dirigido al ARN de apoCIII. En los ensayos clínicos en fase i ha mostrado reducciones en las concentraciones de triglicéridos de entre el 78-92% y se están llevando a cabo estudios en fase iii en pacientes con hipertrigliceridemia poligénica (NCT04720534). El evinacumab es un anticuerpo monoclonal anti-ANGPTL3 que ha sido aprobado para el tratamiento de los pacientes con hipercolesterolemia familiar homocigota, por haber presentado en los ensayos en fase iii descensos del c-LDL de un 47,1% y de los triglicéridos de un 55%77. El evinacumab no ha demostrado eficacia en la reducción de triglicéridos en los pacientes con síndrome de quilomicronemia familiar, sí en cambio en los pacientes con quilomicronemia multifactorial, en los que disminuye un 64,8-81,7% la concentración de triglicéridos y varía en función del genotipo que presenten78. Actualmente se está llevando a cabo un estudio dirigido para evaluar la eficacia del evinacumab en los pacientes con quilomicronemia multifactorial (NCT03175367). Por último, el vuparnorsén, un oligonucleótido antisentido conjugado con N-acetilgalactosamina dirigido contra el ARNm de ANGPTL3, mostró unos resultados prometedores en los ensayos clínicos iniciales; sin embargo, el ensayo de fase iii fue suspendido al demostrarse un insuficiente descenso de los lípidos que se asociaba con un mayor contenido de grasa hepática y elevación de las transaminasas79.
ConclusionesEn los pacientes que han alcanzado un control óptimo del c-LDL persiste un riesgo residual de origen lipídico en el que las alteraciones de las LPRTG y del colesterol remanente tienen un papel principal.
La relación entre el colesterol remanente y el riesgo residual de ECVA es independiente del c-LDL y ha sido demostrada en los estudios epidemiológicos, los estudios de aleatorización mendeliana y los análisis de los ensayos clínicos con fármacos hipolipidemiantes.
Las partículas remanentes de las LPRTG son altamente aterogénicas por su facilidad para entrar y ser retenidas en la pared arterial, por su alto contenido en colesterol y por su capacidad de generar células espumosas y una respuesta inflamatoria.
La valoración del colesterol remanente puede aportar información sobre el riesgo residual de ECVA más allá de la información aportada por el c-LDL, el c-no HDL y la apoB, en particular en los individuos con hipertrigliceridemia.
El estudio REDUCE-IT ha demostrado que el icosapento de etilo tiene un efecto preventivo frente a la ECVA en los pacientes de muy alto riesgo cardiovascular con hipertrigliceridemia tratados con estatinas y con un c-LDL en objetivos.
Los nuevos fármacos hipolipidemiantes contribuirán a definir la eficacia y los criterios en el tratamiento del exceso de colesterol remanente y de la hipertrigliceridemia en la prevención de la ECVA.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Emili Corbella por la revisión del manuscrito y su ayuda en la
Agustín Blanco (Servicio de Medicina Interna, Hospital Universitario 12 de Octubre, Madrid, España); Mariano Blasco (Centro de Salud Delicias Sur, Área Sanitaria III, Zaragoza, España); José Luís Díaz Díaz (Unidad de Lípidos y Riesgo Cardiovascular, Medicina Interna, Hospital Universitario A Coruña, A Coruña, España); Ángel Díaz Rodríguez (Centro de Salud de Bembibre, Universidad de León, León, España); Alipio Mangas (Internal Medicine Department, School of Medicine, Institute of Research and Innovation in Biomedical Sciences [INiBICA], University Hospital Puerta del Mar, University of Cadiz, Cádiz, España); Vicente Pascual (Centro de Salud Palleter, Universidad CEU-Cardenal Herrera, Castellón, España); Juan Pedro Botet (Unidad de Lípidos y Riesgo Vascular, Servicio Endocrinología y Nutrición, Hospital del Mar; Universitat Autònoma de Barcelona, Barcelona, España); Pablo Pérez Martínez (Grupo de Trabajo Nutrición y Estilo de Vida, Sociedad Española de Arteriosclerosis [SEA], España; Unidad de Lípidos y Arterioesclerosis, Universidad de Córdoba/Hospital Universitario Reina Sofía/Instituto Maimónides de Investigación Biomédica de Córdoba [IMIBIC], Córdoba, España; CIBER Fisiopatología de la Obesidad y Nutrición [CIBEROBN], Instituto de Salud Carlos III, Madrid, España. Dirección electrónica: pabloperez@uco.es).








![En la figura se muestra la relación entre el perfil lipídico basal y la incidencia de episodios mayores de enfermedad cardiovascular aterotrombótica (ECVA) en la población del estudio Prevención con Dieta Mediterránea (Predimed; con una edad media de 67 años, un índice de masa corporal de 30kg/m2, 43% varones y 48% con diabetes) durante un seguimiento de 4,8 años. La relación entre las concentraciones de lípidos como variables categóricas y la incidencia de episodios mayores de ECVA se analizó mediante modelos ajustados y no ajustados de riesgo proporcional de Cox (n=6.901; casos de ECVA=263). En cada subgrupo de c-LDL (>100 o≤100mg/dL [2,59mmol/L]), un colesterol remanente basal alto (>30mg/dL [0,78mmol/L]) identificaba a los individuos con mayor riesgo de ECVA en comparación con los que tenían concentraciones menores. La menor incidencia de episodios mayores de ECVA se observó en los grupos con colesterol remanente bajo, con independencia de las concentraciones de c-LDL y de otros factores de riesgo cardiovascular. En la figura se muestra la relación entre el perfil lipídico basal y la incidencia de episodios mayores de enfermedad cardiovascular aterotrombótica (ECVA) en la población del estudio Prevención con Dieta Mediterránea (Predimed; con una edad media de 67 años, un índice de masa corporal de 30kg/m2, 43% varones y 48% con diabetes) durante un seguimiento de 4,8 años. La relación entre las concentraciones de lípidos como variables categóricas y la incidencia de episodios mayores de ECVA se analizó mediante modelos ajustados y no ajustados de riesgo proporcional de Cox (n=6.901; casos de ECVA=263). En cada subgrupo de c-LDL (>100 o≤100mg/dL [2,59mmol/L]), un colesterol remanente basal alto (>30mg/dL [0,78mmol/L]) identificaba a los individuos con mayor riesgo de ECVA en comparación con los que tenían concentraciones menores. La menor incidencia de episodios mayores de ECVA se observó en los grupos con colesterol remanente bajo, con independencia de las concentraciones de c-LDL y de otros factores de riesgo cardiovascular.](https://static.elsevier.es/multimedia/02149168/0000003500000004/v1_202308020950/S0214916823000086/v1_202308020950/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)