La enfermedad de Kawasaki (EK) es una de las vasculitis sistémicas más comunes en niños menores de 5 años de edad. La epidemiología de la enfermedad no está bien establecida en México. El objetivo de este trabajo fue describir la epidemiología, características clínicas y tratamiento de los pacientes con EK atendidos en el Hospital Infantil de México Federico Gómez (HIMFG).
MétodosSe realizó un estudio retrospectivo, descriptivo y analítico de pacientes diagnosticados con EK en el HIMFG en el periodo comprendido entre enero de 2004 y diciembre de 2014.
ResultadosSe analizaron 204 casos, la mayoría de sexo masculino (55%), con mediana de edad de 32.5 meses (6-120) y una tasa de hospitalización del 96%. El 20% de los pacientes presentó EK incompleto. No se reportaron diferencias en la somatometría ni signos vitales. La sintomatología más frecuente fue fiebre, conjuntivitis (89%), cambios orales (84%), faringitis (88%) y lengua en fresa (83%). Se encontraron reactantes de fase aguda más elevados en las presentaciones clásicas. Se reportaron alteraciones ecocardiográficas en 60 pacientes (29%), de las cuales el 12% fueron ectasia y el 11% aneurismas coronarios. Por otro lado, 169 pacientes (83%) recibieron inmunoglobulina intravenosa (IGIV), 18 (9%) resistencia a IGIV, 6 (3%) requirieron corticosteroides y 2 (1%) infliximab; todos recibieron ácido acetilsalicílico.
ConclusionesNo se encontraron diferencias importantes entre las presentaciones clásicas e incompletas. La incidencia de alteraciones cardiacas es menor a la reportada previamente en México, pero similar a la de otros países.
Kawasaki disease (KD) is one of the most common systemic vasculitis in children under 5 years of age. The epidemiology of the disease is not well established in Mexico. The objective of this study was to describe the epidemiology, clinical features and treatment of patients with KD at the Hospital Infantil de Mexico Federico Gomez (HIMFG).
MethodsWe conducted a retrospective, descriptive and analytical study of patients diagnosed from January 2004 to December 2014 with KD in the HIMFG.
ResultsWe analyzed 204 cases from which 55% were male, with a median age of 32.5 months (6-120) and a rate of hospitalization of 96%. Twenty percent of patients presented incomplete KD. No differences in the somatometric measurements or vitals were reported. The most frequent symptoms were fever, conjunctivitis (89%), oral changes (84%), pharyngitis (88%) and strawberry tongue (83%). We found higher acute phase reactants in the classic presentation. Echocardiographic alterations in 60 patients (29%), of which 12% were ectasia and 11% reported coronary aneurysms. On the other hand, 169 (83%) patients received intravenous immunoglobulin (IVIG), 18 (9%) presented resistance to IVIG, 6 (3%) required corticosteroids, and 2 (1%) infliximab; all received acetylsalicylic acid.
ConclusionsThere were no important differences between classic and incomplete presentations. The incidence of cardiac alterations is less than previously reported in Mexico, but similar to that of other countries.
La enfermedad de Kawasaki (EK) es una de las vasculitis sistémicas más frecuentes en niños menores de 5 años de edad1–3. Es una enfermedad autolimitada que afecta predominantemente vasos de mediano calibre, particularmente las arterias coronarias.
A pesar que han pasado más de 45 años desde que T. Kawasaki reportó este padecimiento, la etiología continúa siendo desconocida. Se ha sugerido la participación de agentes infecciosos (estreptococo, estafilococo, Propionibacterium sp., Yersinia sp., virus de Epstein Barr, retrovirus, virus parainfluenza, Candida sp. y Lactobacillus sp., entre otros) como desencadenantes. Sin embargo, la tendencia actual está dirigida a los superantígenos bacterianos relacionados con la sobreproducción de citocinas proinflamatorias, células mononucleares, anticuerpos citotóxicos y células T activadas. En otros estudios se han encontrado alteraciones genéticas asociadas (ITPKC, CASP3, BLK, CD40), desbalance entre células T cooperadoras (Th17) y reguladoras, incremento de células plasmáticas productoras de IgA, concentraciones de los componentes de la velocidad de sedimentación globular (VSG), incremento de la actividad de metaloproteinasas y la hipótesis del sistema de proteínas de homeostasis1,4–7. Estas teorías pueden explicar alteraciones tan significativas como la aparición de eritema en el sitio de vacuna BCG secundario a un polimorfismo en el gen que codifica para la enzima ITPKC8.
La EK es diagnosticada con base en signos y síntomas característicos. Los criterios clásicos son la fiebre persistente por cinco o más días, la inyección conjuntival bilateral, cambios en labios y cavidad oral, eritema polimorfo, cambios en extremidades y linfadenopatía cervical aguda no purulenta. Al menos cinco de estas manifestaciones deben estar presentes para realizar el diagnóstico de EK9. Algunos pacientes no reúnen los criterios clásicos y solamente muestran algunas de las características principales. Esto representa un reto diagnóstico y se denomina como “EK incompleta”10,11.
La forma típica de la enfermedad tiene tres fases: la aguda, que dura 10 días y se caracteriza por fiebre de alto grado, adenopatías, eritema o edema periférico, conjuntivitis y enantema. La fase subaguda que dura de 11 a 21 días, y se caracteriza por trombocitosis, descamación y resolución de la fiebre. Por último, la fase de convalecencia (de 21 a 60 días), durante la cual desaparecen los signos clínicos de manera paulatina12.
La baja presunción favorece el retardo en el diagnóstico de EK, convirtiéndose en un problema mayor dado que se incrementa el riesgo de complicaciones13. Entre estas, se ha observado el desarrollo de aneurismas de las arterias coronarias (AAC) en más del 25% de pacientes que no reciben tratamiento14, comparado con solo el 5% de quienes reciben inmunoglobulina intravenosa (IGIV) en el curso de los primeros 10 días de evolución4.
La EK es casi exclusiva de la infancia: la mitad de los casos tienen lugar antes de los 2 años de edad, el 80% antes de los 4 años, y es excepcional por encima de los 12 años. Es 1.5 veces más frecuente en varones, y la mortalidad, aunque baja, se registra más en edades tempranas, oscilando entre el 1 y 4%12,13.
La incidencia media mundial es de 1-10/100,000 por año12,13. Sin embargo, aunque se ha reportado en la mayoría de los grupos étnicos, existe una abrumadora variabilidad entre diferentes países15, además de que parece incrementarse en un número importante de regiones16. Aunque se ha mencionado la relación entre la incidencia de EK y la urbanización, existen aún resultados contradictorios al respecto17–19.
Las diferencias entre las presentaciones clásica e incompleta de la EK y el riesgo de desarrollar AAC están pobremente definidas; así mismo, el comportamiento epidemiológico en América Latina13. El objetivo de este trabajo fue describir la evolución clínica de pacientes con EK en el Hospital Infantil de México Federico Gómez (HIMFG).
2MétodosSe realizó un estudio retrospectivo en el que se incluyeron pacientes menores de 18 años de edad con EK (según los criterios establecidos por el doctor Tomisaku Kawasaki en 1967) que se presentaron en el HIMFG y fueron evaluados por el Servicio de Reumatología en el periodo comprendido entre enero del 2004 y diciembre del 2014. Los datos se tomaron de los registros clínicos del expediente de cada paciente. Se excluyeron pacientes con expedientes incompletos o ilegibles, pacientes con antecedentes de administración de IGIV durante los 28 días previos al inicio de la EK y pacientes con enfermedades concomitantes infecciosas severas en las 2 semanas previas a la aparición de los síntomas o con antecedentes de aneurismas o ectasias coronarias al inicio de la enfermedad.
Se recolectaron datos sociodemográficos, características clínicas, tratamiento, complicaciones, desarrollo de AAC y mortalidad, que fueron almacenados en una base de datos con el programa Statistical Product for the Social Science (SPSS) versión 17.0, el cual se utilizó para el análisis estadístico posterior. Estos datos se representaron con medidas de tendencia central y dispersión, y se realizaron las pruebas de contraste χ2, exacta de Fisher, U de Mann-Whitney y t de Student para analizar la presencia de diferencias entre los tipos de presentación (EK clásica o incompleta). Se analizó el riesgo de desarrollo de AAC, además de la regresión logística para completar la evaluación multivariada.
3ResultadosSe analizaron 204 casos durante el periodo de estudio. El 55% fue de sexo masculino con una mediana de edad de 32.5 meses (6-120 meses), tasa de hospitalización del 96% y 4 días de estancia (0-15 días). El 20% de los pacientes presentó EK incompleto. Los pacientes acudieron a 1.5 consultas previas (0-6 consultas) y el 76.5% recibió antibióticos durante su evolución, principalmente por un diagnóstico de infección de vías aéreas superiores (67%). Se encontraron diferencias significativas entre los pacientes con presentación clásica e incompleta en la edad (27 vs. 38 meses, p=0.001), en el reconocimiento de la EK al ingreso (100 vs. 90.5%, p=0.002) y el motivo del uso del antibiótico (p=0.003).
Se reportaron peso y talla normales para la edad en la mayoría de los pacientes (12.9 kg [6.7-42] y 91cm [69-156], respectivamente), mientras que para los signos vitales presentaron fiebre 39°C (37.8-41°C), taquicardia de102 latidos/min (80-125/min) y polipnea de 22 respiraciones/min (18-45/min). No se encontraron diferencias significativas entre la presentación clásica e incompleta de EK en ningún parámetro de signos vitales ni de somatometría.
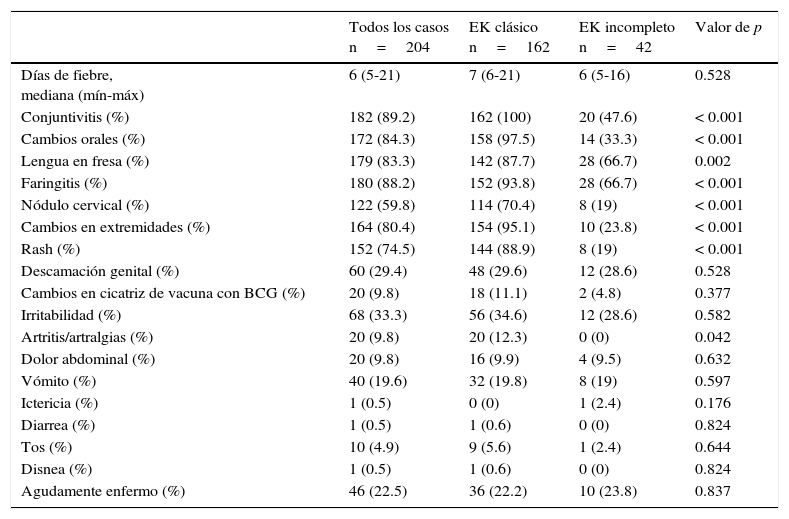
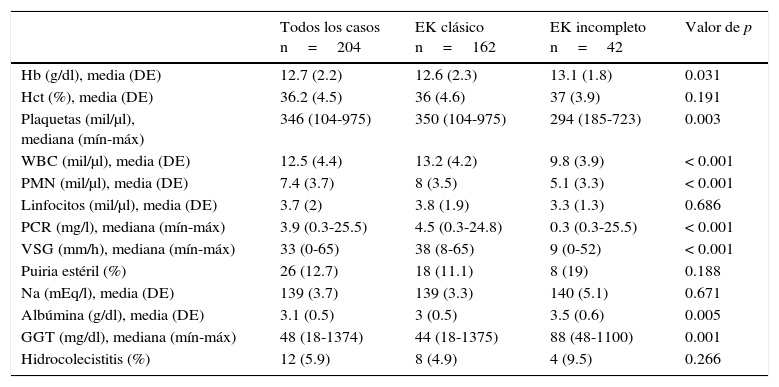
Los signos y síntomas más frecuentemente encontrados fueron fiebre, conjuntivitis (89.2%), cambios orales (84.3%), faringitis (88.2%) y lengua en fresa (83.3%); otros hallazgos poco frecuentes, como eritema e induración de la cicatriz de la vacuna BCG, se presentaron en el 9.8% de los pacientes. La descripción completa de estos hallazgos y las diferencias entre los tipos de presentación se muestran en la tabla 1. Los resultados de laboratorio más relevantes fueron el incremento en la cuenta leucocitos y polimorfonucleares, proteína C reactiva (PCR) y velocidad de sedimentación globular (VSG) elevadas (tabla 2).
Características clínicas de los pacientes al ingreso
| Todos los casos n=204 | EK clásico n=162 | EK incompleto n=42 | Valor de p | |
|---|---|---|---|---|
| Días de fiebre, mediana (mín-máx) | 6 (5-21) | 7 (6-21) | 6 (5-16) | 0.528 |
| Conjuntivitis (%) | 182 (89.2) | 162 (100) | 20 (47.6) | < 0.001 |
| Cambios orales (%) | 172 (84.3) | 158 (97.5) | 14 (33.3) | < 0.001 |
| Lengua en fresa (%) | 179 (83.3) | 142 (87.7) | 28 (66.7) | 0.002 |
| Faringitis (%) | 180 (88.2) | 152 (93.8) | 28 (66.7) | < 0.001 |
| Nódulo cervical (%) | 122 (59.8) | 114 (70.4) | 8 (19) | < 0.001 |
| Cambios en extremidades (%) | 164 (80.4) | 154 (95.1) | 10 (23.8) | < 0.001 |
| Rash (%) | 152 (74.5) | 144 (88.9) | 8 (19) | < 0.001 |
| Descamación genital (%) | 60 (29.4) | 48 (29.6) | 12 (28.6) | 0.528 |
| Cambios en cicatriz de vacuna con BCG (%) | 20 (9.8) | 18 (11.1) | 2 (4.8) | 0.377 |
| Irritabilidad (%) | 68 (33.3) | 56 (34.6) | 12 (28.6) | 0.582 |
| Artritis/artralgias (%) | 20 (9.8) | 20 (12.3) | 0 (0) | 0.042 |
| Dolor abdominal (%) | 20 (9.8) | 16 (9.9) | 4 (9.5) | 0.632 |
| Vómito (%) | 40 (19.6) | 32 (19.8) | 8 (19) | 0.597 |
| Ictericia (%) | 1 (0.5) | 0 (0) | 1 (2.4) | 0.176 |
| Diarrea (%) | 1 (0.5) | 1 (0.6) | 0 (0) | 0.824 |
| Tos (%) | 10 (4.9) | 9 (5.6) | 1 (2.4) | 0.644 |
| Disnea (%) | 1 (0.5) | 1 (0.6) | 0 (0) | 0.824 |
| Agudamente enfermo (%) | 46 (22.5) | 36 (22.2) | 10 (23.8) | 0.837 |
En ningún paciente se reportaron signos meníngeos. EK: enfermedad de Kawasaki.
Resultados de laboratorio de los pacientes al ingreso
| Todos los casos n=204 | EK clásico n=162 | EK incompleto n=42 | Valor de p | |
|---|---|---|---|---|
| Hb (g/dl), media (DE) | 12.7 (2.2) | 12.6 (2.3) | 13.1 (1.8) | 0.031 |
| Hct (%), media (DE) | 36.2 (4.5) | 36 (4.6) | 37 (3.9) | 0.191 |
| Plaquetas (mil/μl), mediana (mín-máx) | 346 (104-975) | 350 (104-975) | 294 (185-723) | 0.003 |
| WBC (mil/μl), media (DE) | 12.5 (4.4) | 13.2 (4.2) | 9.8 (3.9) | < 0.001 |
| PMN (mil/μl), media (DE) | 7.4 (3.7) | 8 (3.5) | 5.1 (3.3) | < 0.001 |
| Linfocitos (mil/μl), media (DE) | 3.7 (2) | 3.8 (1.9) | 3.3 (1.3) | 0.686 |
| PCR (mg/l), mediana (mín-máx) | 3.9 (0.3-25.5) | 4.5 (0.3-24.8) | 0.3 (0.3-25.5) | < 0.001 |
| VSG (mm/h), mediana (mín-máx) | 33 (0-65) | 38 (8-65) | 9 (0-52) | < 0.001 |
| Puiria estéril (%) | 26 (12.7) | 18 (11.1) | 8 (19) | 0.188 |
| Na (mEq/l), media (DE) | 139 (3.7) | 139 (3.3) | 140 (5.1) | 0.671 |
| Albúmina (g/dl), media (DE) | 3.1 (0.5) | 3 (0.5) | 3.5 (0.6) | 0.005 |
| GGT (mg/dl), mediana (mín-máx) | 48 (18-1374) | 44 (18-1375) | 88 (48-1100) | 0.001 |
| Hidrocolecistitis (%) | 12 (5.9) | 8 (4.9) | 4 (9.5) | 0.266 |
EK: enfermedad de Kawasaki; DE: desviación estándar; Hb: hemoglobina; Hct: hematocrito; WBC: leucocitos; PMN: polimorfonucleares; PCR: proteína C reactiva; VSG: velocidad de sedimentación globular; GGT: gamma-glutil transpeptidasa.
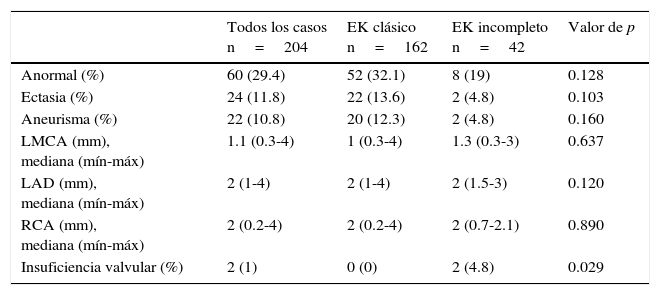
Se encontraron alteraciones ecocardiográficas en 60 pacientes (29.4%): en el 11.8% fue ectasia y en el 10.8% aneurismas coronarios (tabla 3). Por otro lado, 169 pacientes (82.8%) recibieron inmunoglobulina intravenosa (IGIV) a 2g/kg en dosis única, 18 pacientes con la forma de presentación incompleta (8.8%) presentaron más resistencia al tratamiento con IGIV (6.2 vs 19%, p=0.027). Seis pacientes (2.9%) requirieron corticosteroides y dos pacientes (1%) infliximab, sin diferencias significativas entre ambos grupos. Ningún paciente desarrolló eventos adversos por IGIV. Todos los pacientes recibieron ácido acetilsalicílico (AAS) a 80mg/kg/d hasta la supresión de la fiebre. Posteriormente se disminuyó a dosis antiagregante (3-5mg/kg/d). En el seguimiento de los pacientes, se encontró que un tercio presentaron descamación en extremidades; también se observó baja incidencia de líneas de Beau, mejoría considerable de las alteraciones coronarias, y el fallecimiento de dos pacientes (tabla 4).
Resultados ecocardiográficos de los pacientes al ingreso
| Todos los casos n=204 | EK clásico n=162 | EK incompleto n=42 | Valor de p | |
|---|---|---|---|---|
| Anormal (%) | 60 (29.4) | 52 (32.1) | 8 (19) | 0.128 |
| Ectasia (%) | 24 (11.8) | 22 (13.6) | 2 (4.8) | 0.103 |
| Aneurisma (%) | 22 (10.8) | 20 (12.3) | 2 (4.8) | 0.160 |
| LMCA (mm), mediana (mín-máx) | 1.1 (0.3-4) | 1 (0.3-4) | 1.3 (0.3-3) | 0.637 |
| LAD (mm), mediana (mín-máx) | 2 (1-4) | 2 (1-4) | 2 (1.5-3) | 0.120 |
| RCA (mm), mediana (mín-máx) | 2 (0.2-4) | 2 (0.2-4) | 2 (0.7-2.1) | 0.890 |
| Insuficiencia valvular (%) | 2 (1) | 0 (0) | 2 (4.8) | 0.029 |
Solo un paciente con EK incompleto presentó derrame pericárdico.
EK: enfermedad de Kawasaki; LMCA: arteria coronaria izquierda principal (left main coronary artery); LAD: arteria descendente anterior izquierda (left anterior descending artery); RCA: arteria coronaria derecha (right coronary artery).
Seguimiento de los pacientes
| Todos los casos n=204 | EK clásico n=162 | EK incompleto n=42 | Valor de p | |
|---|---|---|---|---|
| Descamación de manos y pies (%) | 75 (36.8) | 65 (40.1) | 10 (23.8) | 0.043 |
| Líneas de Beau (%) | 4 (2) | 4 (2.5) | 0 (0) | 0.451 |
| Ecocardiograma de seguimiento de un mes con resultado anormal (%) | 14 (6.9) | 12 (7.4) | 2 (4.8) | 0.655 |
| Ecocardiograma de seguimiento de 3 meses con resultado anormal (%) | 12 (5.9) | 10 (6.2) | 2 (4.8) | 0.725 |
| Tiempo de uso de AAS (meses), mediana (min-máx) | 98 (68-825) | 97 (68-825) | 99 (91-223) | 0.901 |
| Muerte (%) | 2 (1) | 2 (1.2) | 0 (0) | 0.625 |
EK: enfermedad de Kawasaki; AAS: ácido acetilsalicílico.
La EK es una de las patologías reumatológicas más frecuentes en la edad pediátrica. A pesar de ello, existe poca información. Este trabajo se realizó con el objetivo de describir las características principales de esta enfermedad, constituyendo la serie más numerosa en un nosocomio de atención pediátrica en la República Mexicana. Con esta información se pretende contribuir al mejor conocimiento de la EK en América Latina.
Los datos sociodemográficos generales como edad y sexo son similares a los reportados en otros trabajos3,13,15. En cuanto al sexo, la relación masculino/femenino en Taiwán es de 1.5 a 1.720, y en Australia21 y Holanda19 de 1.5; estos datos contrastan un poco con el valor de 1.2 encontrado en este estudio, similar a los datos en Austria22, Turquía23 y Japón24. La edad de presentación de los pacientes fue igual que en Turquía23, Japón24, Holanda19 y Austria22, pero casi un año menor en Australia21, donde una parte significativa de la población fue aborigen, lo que podría explicar esta diferencia.
La forma incompleta de presentación en este estudio (20.5%) fue similar a lo registrado en la literatura3,13,15,25. A pesar de ello, se observaron diferencias con algunos estudios de Australia (9.6%)21, Austria (25%)22, Turquía (36.7%)23 y Japón (1.8%)24, que pudieran estar en relación con las características étnicas de cada población. En Holanda se reportó una cifra similar (22.3%)19, con una mayor proporción de menores de un año que aquellos pacientes que presentaron la forma clásica, al igual que en este reporte. Los datos muestran diferencias regionales importantes, con mayor variabilidad al comparar la población estudiada con países asiáticos.
Llama la atención el gran número de consultas que antecedieron al diagnóstico de EK, además de que tres cuartas partes de los pacientes recibieron terapia con antibióticos, principalmente por la presencia de infección de vías aéreas superiores. Esto refleja el bajo índice de sospecha y el uso inadecuado de antibióticos. Sin embargo, aunque no ha sido reportado consistentemente este fenómeno, es similar a lo presentado por Binder y colaboradores en una serie de casi 10 años en Austria, donde el 78% de los pacientes recibieron tratamiento antibiótico antes del diagnóstico de EK22. Esto fue más evidente en pacientes con EK incompleto en ambas poblaciones. Este punto se ha investigado poco en países latinoamericanos, aunque se ha reportado el uso de antibiótico en el 72% de los pacientes antes de establecer el diagnóstico de EK en Costa Rica26.
Otro dato importante es que en el 43% de los pacientes no se consideraba la EK como diagnóstico de referencia, circunstancia ya registrada en la literatura al mencionar esta enfermedad oculta en pacientes con fiebre de origen desconocido22. Esto se puede explicar porque los médicos, en general, están poco familiarizados con los padecimientos reumatológicos12.
Los hallazgos clínicos encontrados en esta serie coinciden con los criterios clásicos de EK reportados en la literatura13,21. Tal como se observó en este estudio, los cambios en la mucosa oral y el exantema fueron las manifestaciones más frecuentes en Australia y Holanda, mientras que la linfadenopatía, la menos19,21. Además del exantema, otros trabajos mostraron la conjuntivitis como uno de los signos más prevalentes22, lo que también se encontró en un gran número de los pacientes de este estudio.
Al comparar las características clínicas principales entre EK clásico e incompleto se encontraron diferencias significativas en la mayoría de ellas (excepto la fiebre), lo cual es claramente explicado por la definición “incompleta”, por lo que la presencia de estas manifestaciones es mayor en la presentación clásica. A pesar de lo anterior, el resto de los hallazgos (comunes o atípicos) fue similar entre los dos grupos, a excepción de artritis que fue más común en EK clásico. Estas diferencias han sido poco reportadas; sin embargo, concuerdan con las descritas por Tacke y colaboradores, quienes encontraron el 10% de prevalencia de artritis19 y contrastan con el 25% reportado en Australia21. En cuanto a las pruebas de laboratorio, se encontraron diferencias significativas solamente en las concentraciones de albúmina, que eran menores en EK clásico19, mientras que Binder y colaboradores no identificaron diferencias en su estudio en Austria22. Estos datos contrastan con los aquí presentados, donde hubo menor concentración de hemoglobina, albúmina y transaminasas en la presentación clásica y menor nivel de plaquetas, leucocitos y neutrófilos en EK incompleto. Llama la atención que los pacientes con EK clásico presentaron mayor elevación de los reactantes de fase aguda, lo cual difiere de lo registrado en otras series19,22.
En este estudio se encontró una mayor incidencia de alteraciones ecocardiográficas (29.4%) en comparación con las reportadas en la literatura, que van desde el 3.3% en Japón24 hasta el 26.5% en Turquía23; sin embargo, la presencia de ectasia fue similar a lo descrito en poblaciones caucásicas16,21. Por otro lado, el 10.8% de los pacientes aquí reportados desarrollaron AAC, frecuencia mayor a lo reportado en Australia (6.8%)21 y menor a lo reportado en Holanda (13.5%)19 y Austria (18%)22. En California se reportó el 19% de alteraciones cardiacas y el 5% de AAC27, mientras que un reporte reciente en Cleveland encontró AAC en el 9.5% de los casos28. En México se realizó un reporte de 214 pacientes con EK donde el 58% de pacientes presentó alteraciones cardiacas (dilatación, ectasia o AAC)29, mientras que Sotelo-Cruz realizó una revisión de pequeñas series y reportes de casos, y reportó el 32% de dilataciones coronarias13; ambos trabajos presentaron una mayor incidencia de alteraciones cardiacas que las encontradas en este estudio y otras publicaciones. En Chile encontraron el 53% de pacientes con alteraciones ecocardiográficas, de las cuales el 9.4% eran AAC30, mientras que en Cuba se reportó el 42.8% en un solo centro31, aunque ambos estudios con menor número de pacientes que el presente estudio.
La mayoría de los niños tratados en esta serie recibieron IGIV, todos ellos en la fase aguda; a quienes no se les administró fue porque acudieron después del décimo día de evolución o porque no presentaban datos de actividad de la enfermedad al momento de la valoración. El uso de IGIV fue similar a lo reportado en Australia partir de 199021 y también fue parecido a lo registrado en Holanda entre 2008 y 201219; sin embargo, contrasta con el 46% reportado en América Latina32.
Por otro lado, el número de casos con resistencia a IGIV (8.8%) fue menor al reportado en otros centros12,21,25. En Chile, el 12.5% de los pacientes requirieron dos dosis de IGIV30, mientras que en Cuba el 43%31; en Australia, el 0.03% de los casos recibieron esteroides y el 16% requirieron una segunda dosis de IGIV; en Holanda, el 23.1% fueron re-tratados con IGIV y el 5.5% con esteroides, dos pacientes con infliximab y uno con anakinra, reportando el 2.2% de los casos con efectos adversos a la IGIV19. Finalmente, en Turquía el 11.6% de los pacientes fueron refractarios a IGIV23; todos estos datos fueron mayores a los encontrados en este estudio. En Taiwán se reportó el 6.6% de AAC y el 1.5% de refractariedad; además, se realizó un análisis dependiendo del tipo de IGIV, y resultó que aquellas fabricadas con β-propiolactonación fueron las más asociadas con recaídas (RR 1.45)33.
En todos los pacientes se utilizó AAS inicialmente a dosis antiinflamatoria, siguiendo las recomendaciones clásicas de manejo de EK, sin presentar eventos adversos relacionados con este medicamento. Sin embargo, en las recomendaciones recientes se sugiere una dosis antiagregante desde el inicio de la enfermedad4,34. No se encontró incremento en la mortalidad respecto a otras series12,21.
En resumen, los datos de esta población fueron similares a lo reportado en la literatura en cuanto a edad, sexo y proporción de formas incompletas de la EK. Se encontró variabilidad importante al comparar con poblaciones asiáticas. Igual que en otros países, existe una gran cantidad de pacientes referidos con otros diagnósticos y tratados con antibióticos antes de establecer el diagnóstico de EK, lo que habla de una baja sospecha y la necesidad de difundir la sospecha de EK.
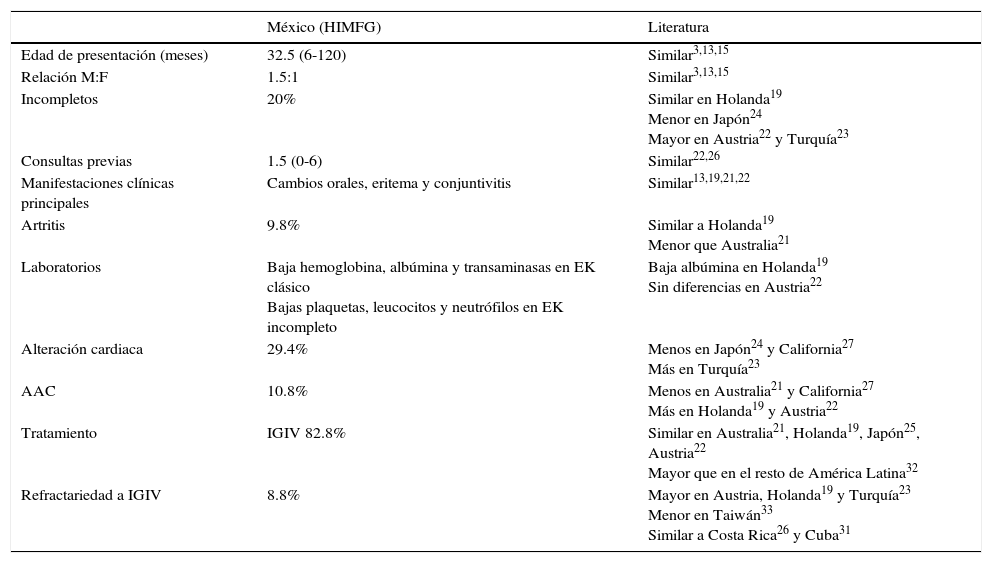
Las características clínicas más frecuentes fueron similares a lo ya reportado en la literatura, mientras que los resultados de laboratorio varían un poco de lo encontrado en otras series, como las concentraciones de hemoglobina, albúmina y transaminasas y la cuenta de plaquetas, leucocitos y neutrófilos. La incidencia de alteraciones cardiacas fue similar a las descritas en países caucásicos y mucho menor a lo previamente estudiado en México. En contraste, el tratamiento fue adecuado y se encontró un menor número de casos refractarios que en otras series, con la misma mortalidad que en otros países (tabla 5).
Principales diferencias entre los pacientes estudiados y lo reportado en la literatura
| México (HIMFG) | Literatura | |
|---|---|---|
| Edad de presentación (meses) | 32.5 (6-120) | Similar3,13,15 |
| Relación M:F | 1.5:1 | Similar3,13,15 |
| Incompletos | 20% | Similar en Holanda19 Menor en Japón24 Mayor en Austria22 y Turquía23 |
| Consultas previas | 1.5 (0-6) | Similar22,26 |
| Manifestaciones clínicas principales | Cambios orales, eritema y conjuntivitis | Similar13,19,21,22 |
| Artritis | 9.8% | Similar a Holanda19 Menor que Australia21 |
| Laboratorios | Baja hemoglobina, albúmina y transaminasas en EK clásico Bajas plaquetas, leucocitos y neutrófilos en EK incompleto | Baja albúmina en Holanda19 Sin diferencias en Austria22 |
| Alteración cardiaca | 29.4% | Menos en Japón24 y California27 Más en Turquía23 |
| AAC | 10.8% | Menos en Australia21 y California27 Más en Holanda19 y Austria22 |
| Tratamiento | IGIV 82.8% | Similar en Australia21, Holanda19, Japón25, Austria22 Mayor que en el resto de América Latina32 |
| Refractariedad a IGIV | 8.8% | Mayor en Austria, Holanda19 y Turquía23 Menor en Taiwán33 Similar a Costa Rica26 y Cuba31 |
HIMFG: Hospital Infantil de México Federico Gómez; M: masculino; F: femenino; AAC: aneurismas de las arterias coronarias; IGIV: inmunoglobulina intravenosa.
La presente revisión tiene la limitación del diseño retrospectivo, no obstante que se reunió el mayor número de pacientes de las distintas series reportadas en México hasta este día. Sin embargo, ofrece notables particularidades sociodemográficas de la población mexicana. Las características clínicas, tratamiento y pronóstico de estos pacientes permiten notar que la variabilidad de la enfermedad lleva implícita la necesidad de más estudios que sienten las bases para el desarrollo de guías clínicas sustentadas con la experiencia observada en nuestro medio.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciamientoNinguno.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al personal administrativo, de enfermería y residentes de Pediatría que contribuyeron a la atención de los pacientes incluidos en este trabajo.