En cirugía hepática, la laparoscopia no ha conseguido la difusión obtenida en otras áreas debido a la complejidad de este tipo de cirugía y a la falta de equipos quirúrgicos con experiencia en ambos campos.
Material y métodosEl objetivo de este trabajo es presentar la técnica utilizada en nuestro centro para realizar la seccionectomía lateral izquierda por laparoscopia (SLI). Entre febrero de 2000 y julio de 2010, 70 pacientes han sido intervenidos por laparoscopia por patología hepática, tanto benigna como maligna. En veintiún casos se realizó una SLI según la técnica descrita. Se describe la técnica quirúrgica, destacando aspectos como la disposición de los trocares, la movilización del hígado o la transección hepática. Se analiza la morbimortalidad relacionada con el procedimiento.
ResultadosSe ha realizado la SLI en 12 mujeres y 9 hombres con edades comprendidas entre los 35 y los 89 años. El número de lesiones fue de 1,4 (entre 1 y 4), con un tamaño de 3,5cm. El tiempo operatorio fue de 142min (entre 90 y 210). Hubo una conversión a laparotomía. Se registraron complicaciones en 3 pacientes (14%). No hubo reintervenciones y un paciente requirió una transfusión. La estancia media hospitalaria fue de 4,3 días.
ConclusionesLas mejoras técnicas y la mayor experiencia en laparoscopia han permitido plantear la realización de este procedimiento con una morbilidad inferior al 15% y una mortalidad nula. La SLI es una técnica segura y efectiva en pacientes seleccionados. La descripción detallada de este procedimiento puede estimular a otros grupos de cirugía hepática a realizar este abordaje.
Laparoscopy has not been as widely used in hepatic surgery as in other areas due to the complexity of this type of surgery and the lack of surgical teams with experience in both fields.
Material and methodsThe aim of this work is to present the technique used in our centre to perform left lateral sectionectomy (LLS) using laparoscopy. A total of 70 patients have been operated on using laparoscopy due to both benign and malignant liver between February 2000 and July 2010. An LLS was performed on twenty-one cases using the technique described. The surgical technique is described, highlighting aspects such as, the arrangement of the trocars, the mobilisation of the liver or hepatic transection. The morbidity and mortality associated with the procedure is analysed.
ResultsLLS was performed on 12 women and nine men, with ages between 35 and 89 years. The mean number of lesions was 1.4 (between 1 and 4), with a mean size of 3.5cm. The mean surgical time was 142minutes (between 90 and 210). There was one conversion to laparotomy. Complications were recorded in 3 (14%) patients. There were no repeat surgery, and one patient required a transfusion. The mean hospital stay was 4.3 days.
ConclusionsThe best techniques and the wide experience in laparoscopy has enabled this technique to become established, with a morbidity of less than 15% and zero mortality. LLS is a safe and effective technique in selected patients. The detailed description of this procedure may stimulate other surgery groups to perform this approach.
El éxito obtenido por la laparoscopia en la cirugía abdominal es indudable. Sin embargo, en la cirugía hepática no ha conseguido una difusión general, ello es debido a la complejidad intrínseca de la misma y a la falta de equipos quirúrgicos especializados en ambos campos (cirugía hepática y laparoscopia)1–5.
La primera resección anatómica del hígado por laparoscopia se realizó en 1996 y en España en el 20006. Desde sus inicios, la mayoría de los grupos coinciden en definir unos segmentos hepáticos favorables y más accesibles para el abordaje laparoscópico como los segmentos laterales izquierdos y los anteriores derechos7–9.
La anatomía del sector lateral izquierdo y la disposición de sus pedículos portales y suprahepático predisponen a que su abordaje laparoscópico sea factible y seguro, con resultados oncológicos superponibles a los de la cirugía abierta si se realizan resecciones R0 con márgenes de resección libres. El abordaje laparoscópico en las lesiones situadas en el sector lateral izquierdo debe ser considerado la vía de abordaje de elección en centros con experiencia10–12, con mejores resultados en cuanto a pérdidas hemáticas, tiempo operatorio y estancia hospitalaria respecto el abordaje laparotómico13–19.
El objetivo de este trabajo es describir la técnica quirúrgica de la seccionectomía lateral izquierda (SLI) tal y como se realiza en nuestro grupo y analizar la morbimortalidad relacionada con esta.
Pacientes y métodosPacientesEn el año 2000 se inició la cirugía hepática por laparoscopia en nuestro centro, los primeros casos fueron por patología benigna, y posteriormente se realizaron resecciones laparoscópicas por patología maligna. Se han realizado 70 abordajes laparoscópicos por patología hepática; 17 casos por patología quística (6 quistes simples, 4 quistes hidatídicos, 6 poliquistosis y 1 cistoadenomas); 10 casos de tumores sólidos benignos (8 adenomas, 1 colangitis esclerosante y 1 hemangioma), y 43 casos por tumores malignos (21 metástasis de cáncer colorrectal, 10 hepatocarcinomas (HCC), 5 metástasis de cáncer de mama, 2 metástasis de cáncer de pulmón, 2 colangiocarcinomas, 1 linfoma, 1 metástasis de hemangioendotelioma y 1 metástasis de melanoma). Fue a partir de 2005 cuando la resección laparoscópica de lesiones en los segmentos II y III quedó bien establecida.
Técnica quirúrgicaSe realiza con anestesia general balanceada, utilizando como inductor propofol y como mantenimiento sevoflorane y remifentanilo en perfusión continua. Se monitorizan de forma cruenta la presión arterial y la presión venosa central. Durante la intervención se administran los líquidos necesarios para mantener una diuresis de 0,5mg/kg/h sin superar una presión venosa central (PVC) de 6mmHg, administrándose las drogas vasoactivas necesarias según la tolerancia del paciente a los pinzamientos y despinzamientos del hilio hepático.
El paciente se coloca en decúbito supino con las piernas abiertas (posición francesa). La mesa se coloca en posición de anti-Trendelemburg. Se utilizan seis trocares (tres de 10-12mm y tres de 5mm). Se realiza el neumoperitoneo con aguja de Veress a nivel umbilical. Se trabaja a una presión de 10-12mm Hg y se utiliza CO2 para el neumoperitoneo.
La óptica es de 30° y se coloca a nivel umbilical. Los trocares de trabajo de 10-12mm se colocan a cada lado de la línea media a unos 5cm por encima del ombligo. Se coloca un trocar de 5mm en el hipocondrio izquierdo y otro en posición muy lateralizada en el hipocondrio derecho, que se utilizará para realizar la maniobra de Pringle.
Finalmente, se coloca un último trocar de 5mm en epigastrio para traccionar del ligamento redondo durante la transección. El cirujano se coloca entre las piernas del paciente, el primer ayudante a la izquierda del paciente y el segundo ayudante a la derecha.
Se realiza una inspección de toda la cavidad abdominal para descartar la presencia de enfermedad diseminada en caso de patología maligna.
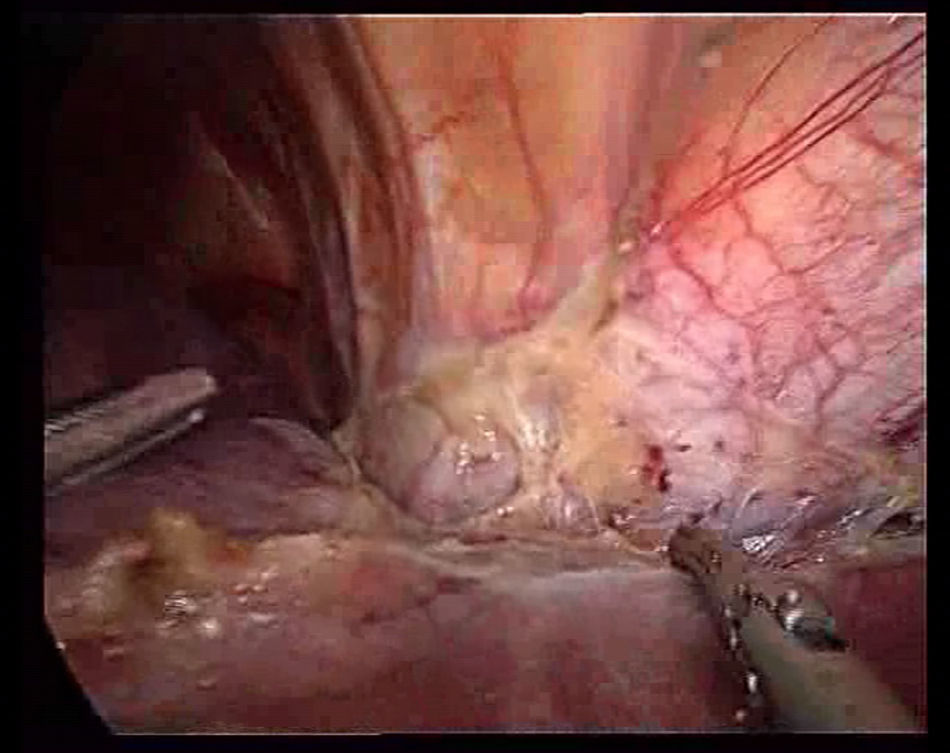
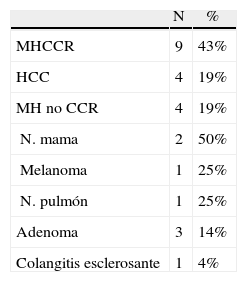
Se prosigue con la sección del ligamento redondo con Ligasure® V (Valleylab, Tyco Healthcare) o Ultracision® (Ethicon EndoSurgery, Johnson &. Johnson Ltd., Cincinnati, OH, EE. UU.) seccionándolo lo más cerca posible de la pared abdominal, para traccionar durante la transección y además no dificulta la visión. Se sigue la sección del ligamento falciforme hasta llegar a la proximidad de las venas suprahepáticas, cuya disección es favorecida por el neumoperitoneo (fig. 1). Esta maniobra permite tener acceso rápido a las venas suprahepáticas para realizar un pinzamiento de estas, si fuera necesario.
Se secciona el ligamento triangular izquierdo, siendo muy importante respetar la vena diafragmática izquierda, que discurre muy cerca del ligamento, debido a que si es lesionada se comporta como una lesión en la vena suprahepática, provocando una hemorragia de difícil control y el consiguiente riesgo de embolismo gaseoso. La movilización completa de los segmentos II y III es de vital importancia porque permite separarlos del diafragma, facilita la transección hepática y la colocación de las endograpadoras en un ángulo más adecuado.
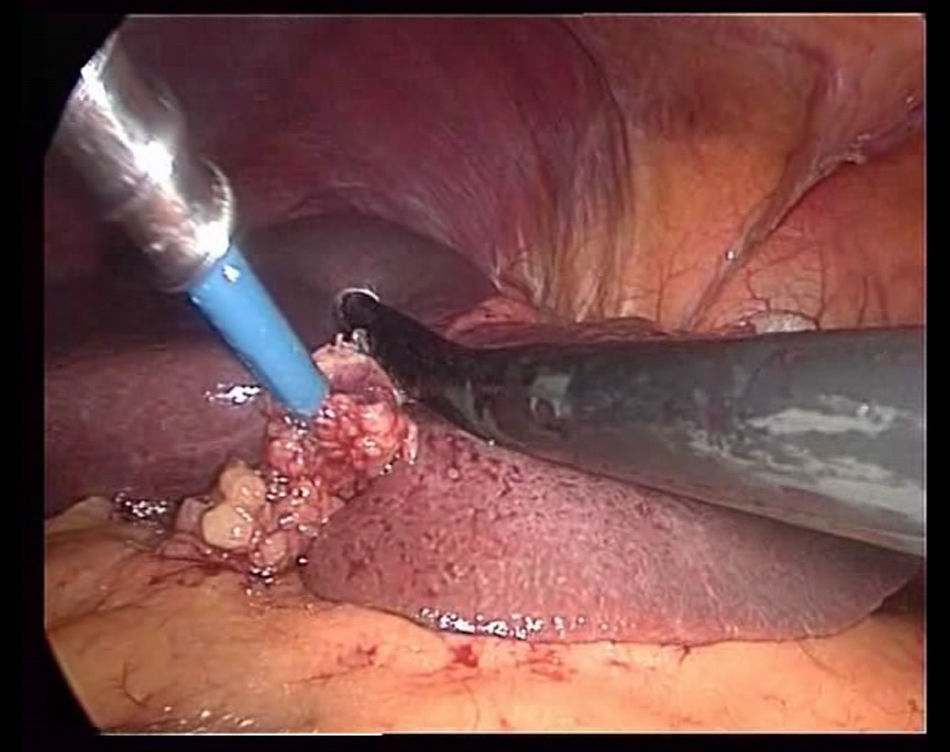
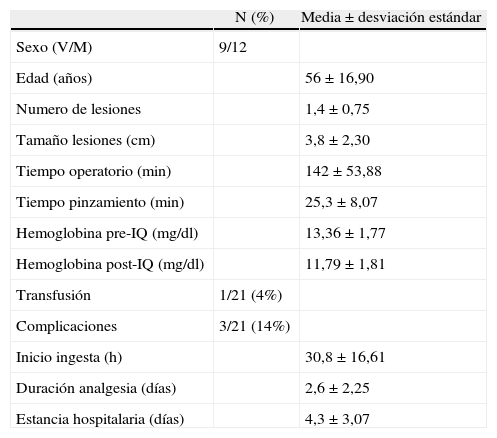
La ecografía intraoperatoria (ECOIO) (fig. 2) se realiza de forma rutinaria ya que nos permite: a) descartar lesiones no diagnosticadas preoperatoriamente; b) asegurar una línea de transección con márgenes correctos, y c) diagnosticar variantes de los pedículos principales para prevenir hemorragias durante la transección.
Traccionando del ligamento redondo y con una pinza levantando el segmento IV, se expone el hilio hepático y la pars fláccida del omento menor que se secciona. Utilizando una pinza a través del trocar situado en posición lateral en el hipocondrio derecho, se pasa por debajo del hilio, a través del hiato de Winslow, hasta salir por el orificio que hemos practicado en el omento menor, se pasa una cinta de unos 10cm no elástica alrededor del hilio hepático y los extremos se pasan a través de un tubo de silastic de unos 2cm de longitud, que servirá para realizar el pinzamiento con una pinza de agarre situada en el trocar lateral derecho. En el caso de pacientes con una disección previa del hilio hepático, el paso de la cinta por el hiato de Winslow puede ser dificultoso, por lo que se puede optar por la utilización de una pinza laparoscópica por la cara anterior del hilio hepático.
Durante la transección hepática es fundamental mantener la PVC lo más baja posible, ya que esto disminuye en gran medida las pérdidas hemáticas. Debido al efecto del neumoperitoneo sobre el transductor de PVC, las lecturas no son del todo fiables, por lo que es mejor iniciar la monitorización de esta antes de hacer el neumoperitoneo.
Para la transección del parénquima hepático normal se pueden utilizar múltiples dispositivos. La zona más superficial del parénquima hepático está poco vascularizada, por lo que es posible realizar la primera parte de la transección con el bisturí monopolar hasta una profundidad de 0,5 a 1cm. A partir de esta profundidad se disecan los vasos con el disector ultrasónico laparoscópico y se coagulan con Ligasure Atlas® de 5mm o Ultracision® combinado con el Tissuelink® laparoscópico (Salient Surgical Technologies). El Tissuelink® proporciona una coagulación superficial del parénquima hepático y de pequeños vasos, mientras que el Ligasure Atlas® y el Ultracision® coagulan y seccionan los vasos de mayor calibre y el parénquima.
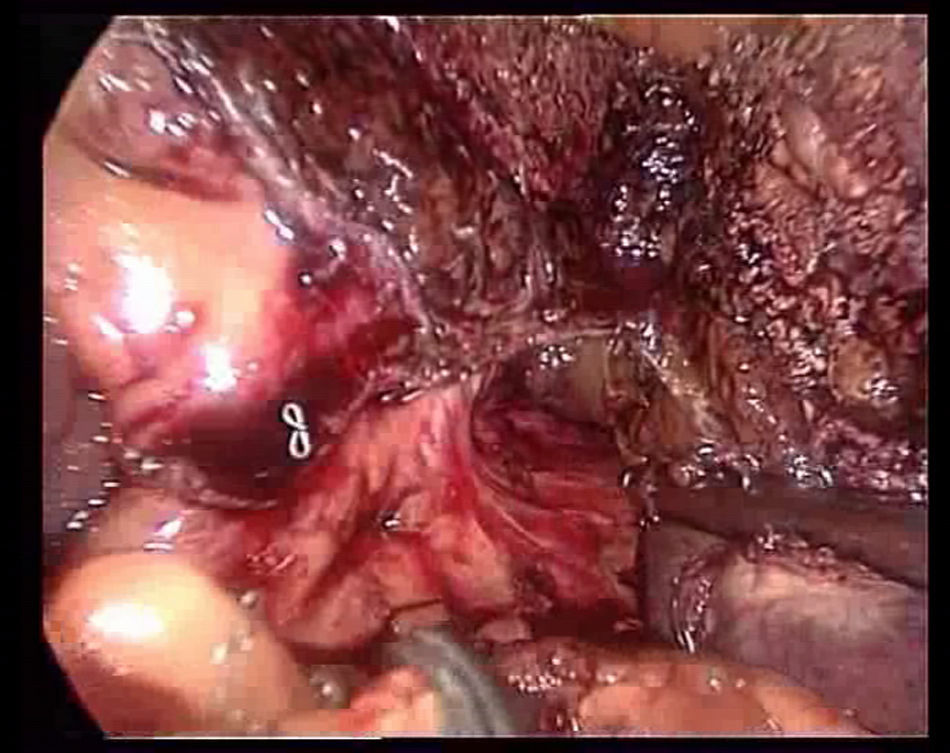
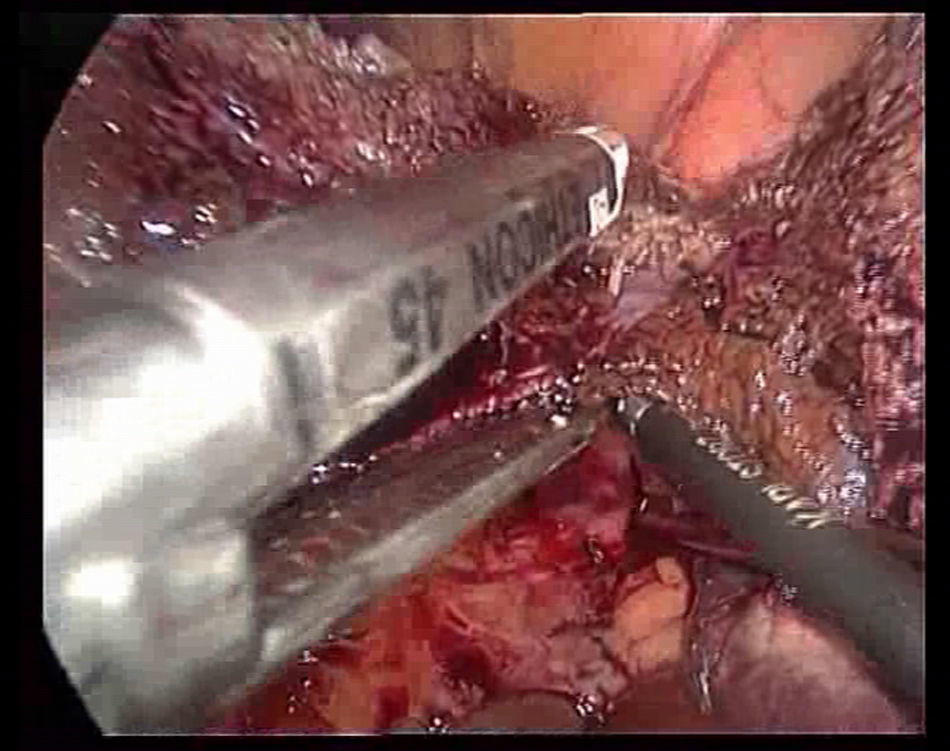
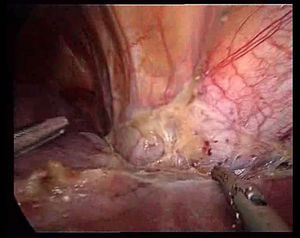
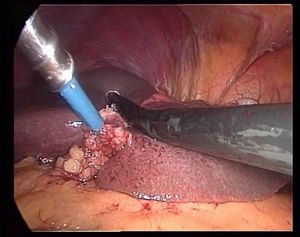
La transección se realiza bajo una oclusión continua del pedículo hepático (maniobra de Pringle). Durante la transección se tracciona del ligamento redondo hacia la derecha con una pinza a través del trocar localizado en epigastrio, se marca la línea de transección en la superficie del parénquima hepático realizando una coagulación superficial con el Tissuelink® y se procede a la transección del parénquima superficial utilizando los dos dispositivos antes descritos hasta llegar a la zona de los pedículos segmentarios portales principales. Para su sección se usan endograpadoras lineales tipo GIA® con carga vascular. Generalmente, es necesaria una carga para el pedículo portal del segmento III, otra para el pedículo portal del segmento II (fig. 3) y una tercera para la sección de la vena suprahepática izquierda (fig. 4).
Con el fin de asegurar la hemostasia y la biliestasia, se aplica sobre la superficie de transección hepática una esponja de material hemostático-sellante de colágeno con fibrina y trombina (Tachosil®, Nycomed).
La pieza quirúrgica se extrae entera por una incisión accesoria dentro de una bolsa. Si la tumoración no es de gran tamaño, habitualmente solo es necesario ampliar lateralmente uno de los orificios de los trocares de 10-12mm hasta unos 3-4cm. En pacientes con tumoraciones mayores, se realiza una incisión de Pfannenstiel. Se coloca un drenaje aspirativo por debajo del lecho de resección a través del trocar de 5mm del flanco derecho. La incisión accesoria y los trocares de 10-12mm se cierran con puntos reabsorbibles.
ResultadosEntre mayo de 2005 y julio de 2010 se ha intervenido a 21 pacientes siguiendo el procedimiento anteriormente descrito (tabla 1). La distribución por sexo fue 12 mujeres y 9 hombres, con edades comprendidas entre los 35 y los 89 años.
Etiología de las SLI laparoscópicas realizadas en Hospital Mútua de Terrassa (n=21). Periodo 2005-2010
| N | % | |
| MHCCR | 9 | 43% |
| HCC | 4 | 19% |
| MH no CCR | 4 | 19% |
| N. mama | 2 | 50% |
| Melanoma | 1 | 25% |
| N. pulmón | 1 | 25% |
| Adenoma | 3 | 14% |
| Colangitis esclerosante | 1 | 4% |
HCC: hepatocarcinoma; MHCRR: metástasis hepáticas de cáncer colorrectal; MH no CCR: metástasis hepáticas de cáncer no colorrectal.
En 17 pacientes la indicación fue por patología maligna (9 metástasis de cáncer colorrectal, 4 HCC y 2 metástasis de neoplasia de mama, 1 metástasis de melanoma y 1 metástasis de primario pulmonar) y en 4 casos fue por patología benigna (3 adenomas y 1 caso de colangitis esclerosante) (tabla 1).
El número de lesiones por paciente fue de 1,4 (1-4), con un tamaño medio de 3,8cm (1-5). El tiempo de cirugía fue de 142min (entre 90 y 210 min). En la mayor parte de los casos (76%) se realizó la maniobra de Pringle durante la transección hepática, con una duración media de 26min (10-60).
En un caso fue necesario convertir a laparotomía para completar la resección de una lesión no diagnosticada en las exploraciones previas durante la ecografía intraoperatoria. En 3 pacientes se registraron complicaciones posquirúrgicas (14%): una infección de herida quirúrgica (grado I de la clasificación Dindo-Clavien), un TEP en una paciente intervenida de M1 de melanoma con poca repercusión clínica (grado II) y una colección intraabdominal en el lecho de resección que se trató con un drenaje percutáneo (grado III). No hubo reintervenciones en ningún paciente. Se realizó una transfusión de concentrados de hematíes intraoperatoria en una paciente con M1 de cáncer de mama que presentó una hemorragia intraoperatoria por lesión de un vaso epiploico que se controló por laparoscopia.
Los pacientes iniciaron la tolerancia oral a las 30 h postoperatorias (16-72). Los requerimientos analgésicos fueron de 2,6 días (2-4). La estancia hospitalaria media fue de 4,3 días (2-7). El estudio anatomopatológico de los márgenes de resección fue negativo en todos los casos (tabla 2).
Resultados de SLI laparoscópicas realizadas en Hospital Mútua de Terrassa (n=21). Periodo 2005-2010
| N (%) | Media±desviación estándar | |
| Sexo (V/M) | 9/12 | |
| Edad (años) | 56±16,90 | |
| Numero de lesiones | 1,4±0,75 | |
| Tamaño lesiones (cm) | 3,8±2,30 | |
| Tiempo operatorio (min) | 142±53,88 | |
| Tiempo pinzamiento (min) | 25,3±8,07 | |
| Hemoglobina pre-IQ (mg/dl) | 13,36±1,77 | |
| Hemoglobina post-IQ (mg/dl) | 11,79±1,81 | |
| Transfusión | 1/21 (4%) | |
| Complicaciones | 3/21 (14%) | |
| Inicio ingesta (h) | 30,8±16,61 | |
| Duración analgesia (días) | 2,6±2,25 | |
| Estancia hospitalaria (días) | 4,3±3,07 |
La resección hepática de los segmentos II y III es una técnica factible y segura. Los resultados actuales reproducen e incluso mejoran los de la cirugía abierta en casos seleccionados con una tasa de mortalidad < 5% y de morbilidad < 20%20–24.
La SLI debería considerarse la técnica de elección en las lesiones localizadas en segmentos II y III, tanto benignas como malignas en pacientes que no presenten comorbilidades severas que contraindiquen la laparoscopia. Los antecedentes de cirugía abierta previa son habituales en nuestro medio (laparotomías para resección de colon) pero no contraindican el abordaje laparoscópico, aunque sí pueden aumentar las dificultades técnicas por las adherencias.
Algunos grupos abogan por la cirugía laparoscópica asistida por la mano en casos de lesiones grandes25–27, pero dado que la línea de transección a la izquierda del ligamento redondo y falciforme es siempre la misma, creemos que el tamaño tumoral por sí solo no es un criterio de exclusión para la realización de una resección totalmente laparoscópica, si es posible realizar una correcta movilización del hígado.
Los trocares deben situarse siguiendo una línea cóncava a la lesión colocando un trocar de 5mm en el flanco derecho lo más posterior y superior posible, para facilitar la realización de la maniobra de Pringle al conseguir un mejor ángulo para acceder al hiato de Winslow.
La movilización completa del lóbulo hepático izquierdo facilita la transección y permite un correcto acceso a las venas suprahepáticas. La disección de la cara anterior de las venas suprahepáticas permite realizar un pinzamiento directo de estas en caso de hemorragia y evita la lesión de la vena diafragmática izquierda al separarse el hígado del diafragma. El control de la vena suprahepática izquierda intrahepática es mejor cuando el hígado izquierdo está movilizado, al quedar la vena en posición perpendicular respecto la endograpadora.
La ecografía intraoperatoria por laparoscopia hay que realizarla siempre para descartar lesiones no diagnosticadas con el estudio preoperatorio. Este punto es de vital importancia cuando estamos tratando enfermedad maligna, principalmente MHCCR, ya que en un 20% de casos, la ECOIO diagnostica lesiones hepáticas no visualizadas con otras técnicas28–30, como ocurrió en uno de los pacientes de nuestra serie en el que la ECOIO demostró una lesión metastásica profunda no diagnosticada, en el segmento V que requirió conversión a laparotomía para completar la resección oncológica con seguridad.
El pinzamiento del hilio hepático durante la transección es un punto controvertido. Existen posibles complicaciones postoperatorias en relación con pinzamientos prolongados (mayores de 1 h)2,3. En nuestra experiencia, no se ha registrado ninguna complicación posquirúrgica atribuible a la maniobra de Pringle. Por otro lado, el pinzamiento continuo no suele durar más de 25min y suele ser bien tolerado por parte del paciente tanto intra como post-operatoriamente.
La realización del precondicionamiento isquémico con un pinzamiento de 10min y un despinzamiento de 10min podría ejercer un efecto beneficioso sobre la célula hepática por varios mecanismos, incluyendo la inhibición de la apoptosis y la liberación local de antagonistas de citocinas proinflamatorias que la protege de posteriores lesiones de isquemia-reperfusión31–33.
A pesar de que hay grupos que defienden no realizar sistemáticamente el pinzamiento hiliar en las SLI laparoscópicas34, nosotros utilizamos el pinzamiento hiliar con precondicionamiento isquémico de forma sistemática por: a) ausencia de efectos secundarios observados en nuestra serie tras pinzamientos continuos, tanto en cirugía laparoscópica como abierta; b) mantener un campo lo más exangüe posible, ya que la presencia de sangre en el campo absorbe la luz oscureciendo la imagen y dificulta la identificación de estructuras durante la transección hepática, y c) las pérdidas hemáticas y la consiguiente transfusión de concentrados de hematíes en los pacientes sometidos a resección hepática por metástasis de cáncer de colon puede ser un factor pronóstico sobre la supervivencia a largo plazo35–37. En nuestra serie, una paciente requirió la transfusión de un concentrado de hematíes al producirse una lesión de un vaso gastroepiploico durante las maniobras de movilización, ocasionando una hemorragia importante debida al aumento de presión esplácnica por el pinzamiento hiliar y que fue controlada sin necesidad de convertir a cirugía abierta.
Es conveniente trabajar con una presión baja de neumoperitoneo de CO2, alrededor de 10 a 12mmHg, para minimizar en lo posible la entrada de gas al sistema venoso en caso de lesión de una vena suprahepática. Por otro lado, la presión venosa central a diferencia de lo estandarizado en cirugía abierta en que se mantienen cerca de 0mmHg para minimizar la hemorragia, es conveniente mantenerla alrededor de 6mmHg para disminuir el gradiente entre la presión intraabdominal y la PVC, reduciendo el riesgo de embolismo gaseoso3,38–40.
En cuanto al tratamiento de la patología hepática maligna, la SLI está indicada en casos seleccionados siempre y cuando se respeten los principios de las resecciones oncológicas, con un margen libre adecuado. Existe una preocupación sobre la posibilidad de facilitar la diseminación tumoral intraabdominal y las metástasis en los puertos de entrada de los trocares en las resecciones laparoscópicas por patología maligna41–44. Los resultados obtenidos en estudios realizados en neoplasias de colon parece que contradicen estas teorías. En nuestra serie, todos los casos de patología maligna fueron resecados con un margen libre mayor de 1cm y hasta la fecha no hemos registrado recidivas a nivel de pared abdominal en ningún paciente.
La resección laparoscópica del HCC localizado en el sector lateral izquierdo ofrece ventajas respecto a la cirugía abierta, es un abordaje menos invasivo que preserva la circulación colateral de la pared abdominal y disminuye la posible descompensación ascítica en el postoperatorio. Por este motivo, podría sugerirse ampliar la indicación quirúrgica en pacientes seleccionados con cirrosis hepática e hipertensión portal45–48.
En conclusión, la SLI por laparoscopia es una técnica factible y reproducible. La disposición anatómica de los segmentos II- III y sus pedículos portal y suprahepático facilita su abordaje laparoscópico. Asimismo, ha demostrado ser eficaz y segura en el tratamiento tanto de la enfermedad benigna como maligna en pacientes seleccionados49. Finalmente, la estandarización del procedimiento posiblemente facilitará que sea una técnica ampliamente aceptada para la mayoría de los cirujanos hepáticos con experiencia en laparoscopia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.