la detección de antigenuria es la herramienta fundamental para el diagnóstico de la infección por Legionella. El objetivo es comparar cinco métodos disponibles comercialmente para la detección de antígenos solubles de Legionella pneumophila en orina.
Métodosse han estudiado 71 muestras de orina procedentes de casos de infección por la bacteria (62 muestras) o de casos de infección por virus respiratorio sincitial (9 casos). Las muestras se han analizado para la detección de antígenos solubles de L. pneumophila por métodos inmunoenzimáticos (ELISA) (Binax y Bartels) e inmunocromatográficos (IC) (Binax, SAS y Uni-Gold).
Resultadosse ha obtenido resultado idéntico en los cinco análisis en 52 muestras (73,2%) (35 positivas y 17 negativas). Las muestras con resultado discrepante se han clasificado por el criterio de la mayoría de los resultados y/u otros resultados de laboratorio (serología) y/o antecedentes epidemiológicos. Así han sido finalmente clasificadas como positivas 51 muestras, y como negativas, las 20 restantes. Los valores de sensibilidad de ELISA-Binax, ELISA-Bartels, IC-Binax, IC-SAS e IC-Uni-Gold han sido del 80,4, el 100, el 82,4, el 86,3 y el 70,6%, respectivamente. Los valores correspondientes de especificidad han sido del 90, el 95, el 100, el 95 y el 100%.
Conclusioneslos resultados indican que los métodos evaluados son adecuados al diagnóstico de la infección por Legionella, con algunas reservas en cuanto a la sensibilidad de alguno de ellos.
Antigenuria detection is the main approach for diagnosing Legionella infections. The aim of this study was to compare 5 commercially available methods for detecting Legionella pneumophila soluble antigens in urine.
MethodsSeventy-one urine samples were tested, 62 from patients with bacterial infection and 9 from patients with respiratory syncytial virus infection. All samples were assayed for the presence of L. pneumophila by immunoenzymatic (ELISA) (Binax and Bartels), and immunochromatographic (IC) (Binax, SAS and Uni-Gold) methods.
ResultsIdentical results (35 positive and 17 negative) were obtained by the 5 assays in 52 samples (73.2%). Samples showing discrepant results were classified by the majority criterion, and/or other laboratory results (serology), and/or epidemiological findings. On this basis, 51 samples were ultimately classified as positive, and 20 as negative. Sensitivity values of ELISA-Binax, ELISA-Bartels, IC-Binax, IC-SAS and IC-Uni-Gold were 80.4, 100, 82.4, 86.3, and 70.6%, respectively. Corresponding values for specificity were 90, 95, 100, 95 and 100%.
ConclusionsThe results indicate that the methods compared are all adequate for diagnosing Legionella infection, although some have certain limitations regarding sensitivity.
La infección por Legionella pneumophila es una causa importante de neumonía adquirida en la comunidad en España, que ocasiona brotes de importancia1,2. El diagnóstico directo de la infección por L. pneumophila se puede realizar mediante inmunofluorescencia directa, aproximación que adolece de cierta falta de especificidad y es muy poco sensible3,4, y que adicionalmente se complica por la dificultad de producir esputo que tienen los pacientes con legionelosis, así como por el requerimiento de personal altamente cualificado para la correcta interpretación de los resultados. El aislamiento de la bacteria requiere el uso de medios específicos, toma varios días y es relativamente poco sensible3,4, por lo que no resulta una aproximación útil para el diagnóstico. Sin embargo, es el método más adecuado para la correcta caracterización epidemiológica de brotes, ya que permite establecer la relación con otros aislados de otros pacientes o de muestras ambientales. Por otra parte, el diagnóstico serológico, realizado por inmunofluorescencia indirecta (IFI), muestra buena sensibilidad3,4 y es de gran utilidad para la caracterización etiológica de los casos, aunque no resulta aplicable al diagnóstico, puesto que se precisa el estudio de muestras separadas 15–20 días para evidenciar la seroconversión. Con estos antecedentes, la detección de antígenos solubles en orina es la aproximación diagnóstica fundamental para el diagnóstico de la infección por Legionella por los valores adecuados de sensibilidad y especificidad3–5, y porque que se obtienen resultados en pocos minutos o pocas horas, según el ensayo empleado, y de esta manera permite establecer el tratamiento antibiótico específico más adecuado de forma inmediata6.
En los últimos años se han comercializado métodos basados tanto en técnica inmunoenzimática (ELISA) como inmunocromatográfica (IC) para la detección de antígenos solubles de L. pneumophila en orina que han permitido generalizar el diagnóstico en laboratorios clínicos y en urgencias. En el presente estudio se comparan las características de funcionamiento de cinco de estos ensayos para la determinación de antígenos solubles de L. pneumophila en orina.
Material y métodoSe ha empleado un total de 71 muestras de orina, agrupadas como sigue:
- •
34 muestras de casos de neumonía procedentes de 2 brotes de infección por Legionella ocurridos en 1996 (brote 1) (14 casos, 15 muestras) y en 2000 (brote 2) (19 muestras de 19 casos). Entre las del brote 1 fueron positivas por ELISA-Binax 7 muestras sin concentrar, 3 más después de concentrar 25x, y las 5 restantes fueron negativas. Entre las muestras del brote 2 fueron positivas por ELISA-Binax 10 muestras sin concentrar, 4 más después de concentrar 25x, y las 5 restantes fueron negativas.
- •
28 muestras de casos esporádicos de neumonía, ocurridos entre 1999 y 2001, de las que 26 fueron positivas en ELISA-Binax sin concentrar, y las 2 restantes lo fueron después de concentrar 25x.
- •
9 muestras de niños con infección respiratoria por virus respiratorio sincitial (VRS), recogidas en 2001, todas ellas negativas en ELISA-Binax, tanto en orina completa como en orina concentrada 25x.
Todas las muestras se analizaron, tanto concentradas como sin concentrar, a su recepción mediante ELISA-Binax (Legionella urinary antigen enzyme immunoassay kit, Binax, Portland, Estados Unidos), alicuotadas en viales de 5ml, y congeladas a −20°C.
Las muestras se analizaron por ELISA-Binax, IC-Binax (Binax Now Legionella urinary antigen test, Binax), durante 1998-2001, ELISA-Bartels (ELISA-Bartels, Legionella urinary antigen, Bartels, Trinity Biotech, Wicklow, Irlanda), durante 2001, IC-SAS (SAS Legionella Test, SA Scientific, San Antonio, Texas, Estados Unidos), durante 2006, e IC-Uni-Gold (Uni-Gold Legionella urinary antigen rapid test, Trinity Biotech, Wicklow, Irlanda), durante 2007. Todos los análisis evaluados han sido diseñados para la detección de antígenos solubles de L. pneumophila serogrupo (SG) 1. En todos los casos las pruebas se han llevado a cabo siguiendo las instrucciones de los fabricantes.
Para asegurar la reactividad de las muestras, conservadas hasta 10 años, se volvió a analizarlas en 2006 mediante ELISA-Bartels.
La concentración de muestras de orina se realizó por ultrafiltración selectiva, mediante el kit Minicon B15 (Amicon, Millipore, Estados Unidos).
Se realizaron determinaciones de anticuerpos en suero frente a L. pneumophila SG1 en muestras de 9 pacientes (casos 1 a 9, tabla 1) para lo que se utilizó la técnica de IFI, siguiendo un procedimiento estándar7.
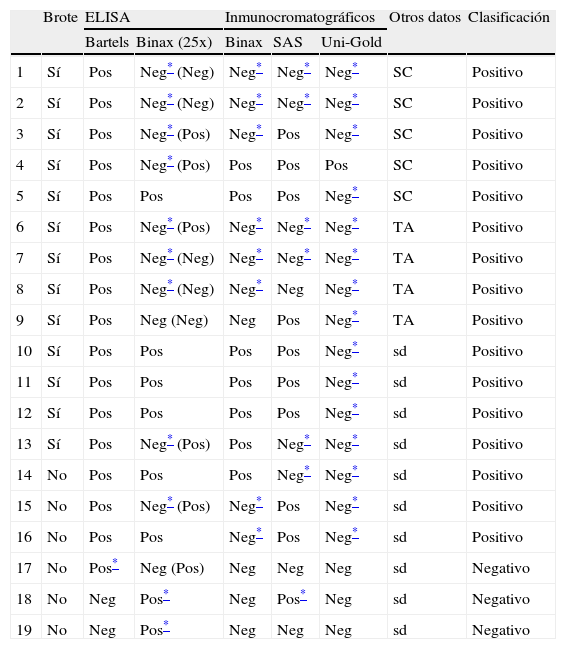
Resultados discrepantes obtenidos por los métodos comparados*
| Brote | ELISA | Inmunocromatográficos | Otros datos | Clasificación | ||||
| Bartels | Binax (25x) | Binax | SAS | Uni-Gold | ||||
| 1 | Sí | Pos | Neg* (Neg) | Neg* | Neg* | Neg* | SC | Positivo |
| 2 | Sí | Pos | Neg* (Neg) | Neg* | Neg* | Neg* | SC | Positivo |
| 3 | Sí | Pos | Neg* (Pos) | Neg* | Pos | Neg* | SC | Positivo |
| 4 | Sí | Pos | Neg* (Pos) | Pos | Pos | Pos | SC | Positivo |
| 5 | Sí | Pos | Pos | Pos | Pos | Neg* | SC | Positivo |
| 6 | Sí | Pos | Neg* (Pos) | Neg* | Neg* | Neg* | TA | Positivo |
| 7 | Sí | Pos | Neg* (Neg) | Neg* | Neg* | Neg* | TA | Positivo |
| 8 | Sí | Pos | Neg* (Neg) | Neg* | Neg | Neg* | TA | Positivo |
| 9 | Sí | Pos | Neg (Neg) | Neg | Pos | Neg* | TA | Positivo |
| 10 | Sí | Pos | Pos | Pos | Pos | Neg* | sd | Positivo |
| 11 | Sí | Pos | Pos | Pos | Pos | Neg* | sd | Positivo |
| 12 | Sí | Pos | Pos | Pos | Pos | Neg* | sd | Positivo |
| 13 | Sí | Pos | Neg* (Pos) | Pos | Neg* | Neg* | sd | Positivo |
| 14 | No | Pos | Pos | Pos | Neg* | Neg* | sd | Positivo |
| 15 | No | Pos | Neg* (Pos) | Neg* | Pos | Neg* | sd | Positivo |
| 16 | No | Pos | Pos | Neg* | Pos | Neg* | sd | Positivo |
| 17 | No | Pos* | Neg (Pos) | Neg | Neg | Neg | sd | Negativo |
| 18 | No | Neg | Pos* | Neg | Pos* | Neg | sd | Negativo |
| 19 | No | Neg | Pos* | Neg | Neg | Neg | sd | Negativo |
SC: seroconversión; sd: sin datos adicionales; TA: título (1/256 frente a L. pneumophila SG1.
Con el análisis realizado durante 2006 mediante ELISA-Bartels se obtuvieron resultados cualitativos equivalentes a los que se obtuvieron en el estudio inicial, por lo que el panel se consideró adecuado para la comparación de los análisis.
Se ha obtenido resultado idéntico en los cinco análisis en 52 (73,2%) muestras (35 positivas y 17 negativas, incluidas entre estas las muestras de niños con infección respiratoria por VRS). Las 19 muestras con resultado discrepante se relacionan en la tabla 1. De éstas, 13 procedían de brotes de infección por la bacteria; 9 muestras (1 a 9) eran de casos que mostraban seroconversión o título alto frente a L. pneumophila SG1. Las 4 muestras restantes (10 a 13), de las que no se disponía de otros datos de laboratorio, mostraron resultado positivo en al menos 3 de los métodos empleados, y se las clasificó como positivas; 6 muestras más (14 a 19) eran de casos esporádicos. En ninguno de estos casos se dispuso de datos adicionales de laboratorio. Tres de estas muestras se clasificaron como positivas (muestras 14 a 16), ya que se obtuvo resultado positivo en al menos tres de los análisis, en tanto que las tres muestras restantes se clasificaron como negativas, por mostrar resultado positivo en dos análisis (muestras 17 y 18) o sólo en uno (muestra 19). De acuerdo con esta clasificación de casos, finalmente se ha considerado positivas 51 muestras, y negativas las 20 restantes.
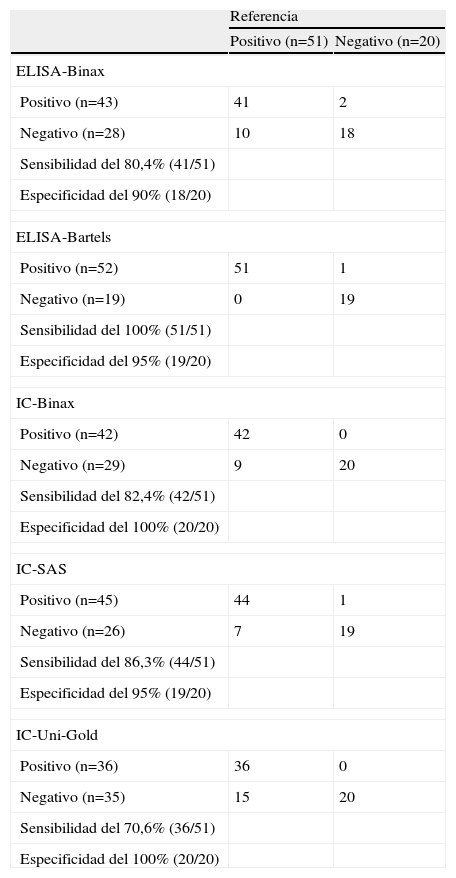
En la tabla 2 se muestran los resultados obtenidos por cada uno de los métodos, de acuerdo con la clasificación final de las muestras. Los valores de sensibilidad de los análisis evaluados han variado desde el 70,6% (IC-Uni-Gold) hasta el 100% (ELISA-Bartels). La especificidad, por otra parte, varió entre el 90% (ELISA-Binax) y el 100% (IC-Binax e IC-Uni-Gold).
Comparación de los resultados obtenidos por ELISA-Binax, ELISA-Bartels, IC-Binax, IC-SAS e IC-Uni-Gold después de la clasificación final de los casos
| Referencia | ||
| Positivo (n=51) | Negativo (n=20) | |
| ELISA-Binax | ||
| Positivo (n=43) | 41 | 2 |
| Negativo (n=28) | 10 | 18 |
| Sensibilidad del 80,4% (41/51) | ||
| Especificidad del 90% (18/20) | ||
| ELISA-Bartels | ||
| Positivo (n=52) | 51 | 1 |
| Negativo (n=19) | 0 | 19 |
| Sensibilidad del 100% (51/51) | ||
| Especificidad del 95% (19/20) | ||
| IC-Binax | ||
| Positivo (n=42) | 42 | 0 |
| Negativo (n=29) | 9 | 20 |
| Sensibilidad del 82,4% (42/51) | ||
| Especificidad del 100% (20/20) | ||
| IC-SAS | ||
| Positivo (n=45) | 44 | 1 |
| Negativo (n=26) | 7 | 19 |
| Sensibilidad del 86,3% (44/51) | ||
| Especificidad del 95% (19/20) | ||
| IC-Uni-Gold | ||
| Positivo (n=36) | 36 | 0 |
| Negativo (n=35) | 15 | 20 |
| Sensibilidad del 70,6% (36/51) | ||
| Especificidad del 100% (20/20) | ||
El método de elección para el diagnóstico de la infección por Legionella es la detección de antígenos solubles en orina, dadas las dificultades que hay para aplicar otros métodos de diagnóstico directo, como el aislamiento, por la baja sensibilidad, o la detección directa, por la baja sensibilidad y las limitaciones de especificidad. La aplicación de técnicas para la detección de antígenos solubles en orina ha facilitado el diagnóstico de la infección por Legionella, puesto que se realiza sobre muestra fácilmente accesible, y ofrece unos valores muy adecuados de sensibilidad, con una excelente especificidad3–5. Con la inclusión de determinaciones de antígeno en orina, se ha incrementado el número de casos notificados. Así, en 1997 se declararon a la Red Nacional de Vigilancia Epidemiológica 191 casos y 1.343 en 20068.
En la actualidad, hay varios métodos para la detección de antígenos solubles de Legionella; la mayor parte de ellos están diseñados para detectar antígenos del SG 1, que es la causa de la mayor parte de los casos de neumonía9. En primer término se desarrollaron métodos de aglutinación de partículas de látex, que mostraron ser poco adecuados10. Con la aplicación de técnicas de radioinmunoanálisis5, de diferentes métodos de ELISA11–13 e inmunocromatográficos14, se han demostrado las buenas características de funcionamiento de los tests de antigenuria. En la actualidad hay métodos disponibles comercialmente de ELISA e inmunocromatográficos para la detección de antígenos solubles, que permiten el diagnóstico de la infección por Legionella de forma eficaz. Se han comparado cinco de estos métodos. Las mejores condiciones para la evaluación de métodos para la detección de antígenos en orina incluyen el análisis de muestras recién obtenidas, lo que no resulta siempre posible, teniendo en cuenta las dificultades de obtener muestras positivas de forma prospectiva. Alternativamente, se puede recurrir al uso de colecciones de muestras mantenidas en buenas condiciones de conservación. Para el presente estudio se ha empleado una colección de orinas obtenidas entre 1996 y 2001, y conservadas en alícuotas a –20°C. Se consideró que las muestras y los resultados históricos eran adecuados para esta comparación al reanalizarlas en 2006, con el mismo método del que se disponía de resultado en 2001 (ELISA-Bartels), y obtener resultados cualitativos equivalentes en todas las muestras.
La sensibilidad de los análisis comparados ha estado por encima del 70% en todos los casos, y la especificidad por encima del 90%. Las mejores cifras de sensibilidad se han obtenido para el ELISA-Bartels, que ha identificado como positivos al 100% de los casos clasificados como positivos. Esta excelente sensibilidad ya ha sido documentada13,15. ELISA-Binax ha mostrado una sensibilidad del 80,4%, debido a que en 10 muestras clasificadas como positivas se ha obtenido resultado negativo. En 5 de éstas, sin embargo, se obtuvo resultado positivo después de concentrar por ultrafiltración selectiva, de esta manera se confirmó que la concentración de la muestra aumenta la sensibilidad de los tests de antigenuria11.
Entre los análisis inmunocromatográficos, la mejor sensibilidad se ha obtenido con el IC-SAS (86,3%), aunque un estudio previo ha encontrado que muestra menor sensibilidad que el IC-Binax en orinas sin concentrar (el 82,9 frente al 91,4%)16. Hasta este momento no hay datos acerca de las características de funcionamiento del análisis IC-Uni-Gold.
En lo que se refiere a la especificidad, los mejores valores han sido de IC-Binax e IC-Uni-Gold (100%), en tanto que ELISA-Binax mostró valores del 90% (2 resultados falsos positivos, uno de ellos único en este ensayo) y ELISA-Bartels e IC-SAS, del 95% (1 resultado falso positivo). Sin embargo, es bien reconocido que la detección de antígenos en orina es una aproximación muy específica para el diagnóstico de Legionella3–5; por lo tanto, no se puede excluir que, a pesar de los criterios aquí empleados, todos los resultados positivos sean verdaderos resultados positivos, por las concentraciones bajas de antígeno presentes en la muestra. Esto justificaría los resultados clasificados como negativos falsos obtenidos en la mayoría de los análisis sobre muestras procedentes de brotes, situación en la que, por la intensa investigación epidemiológica, se estudian casos menos graves, en los que la sensibilidad de los análisis es menor13,17,18.
Como conclusión, los resultados indican que los métodos evaluados son adecuados al diagnóstico de la infección por Legionella, con algunas reservas en cuanto a la sensibilidad de alguno de ellos.