Durante el año 2000 se llevó a cabo el primer estudio nacional de Escherichia coli y Klebsiella pneumoniae productoras de betalactamasas de espectro extendido (BLEE). En 2006, los autores de este artículo desarrollaron el segundo estudio nacional para conocer la evolución de este problema en España.
MétodoEstudio prospectivo multicéntrico sobre aislados consecutivos de E. coli y K. pneumoniae productoras de BLEE en 44 hospitales españoles entre febrero y marzo de 2006. En el centro coordinador se comprobó la identificación y se confirmó la producción de BLEE según indicaciones del Clinical and Laboratory Standards Institute.
ResultadosSe recogieron 1.021 cepas de E. coli y 162 cepas de K. pneumoniae. Se aislaron cepas de E. coli productora de BLEE en los 44 hospitales participantes y cepas de K. pneumoniae productora de BLEE en 34 hospitales. El porcentaje de producción de BLEE entre las cepas de E. coli y K. pneumoniae fue del 4,04% (rango de 0,4 a 20,3) y del 5,04% (rango de 0 a 30), respectivamente. Entre los casos de E. coli productora de BLEE, la adquisición se consideró como comunitaria estricta en el 32%, se consideró relacionada con los cuidados sanitarios en el 37% y se consideró nosocomial en el 29%. En los casos de K. pneumoniae productora de BLEE, la adquisición se consideró como comunitaria estricta en el 10%, se consideró relacionada con los cuidados sanitarios en el 18% y se consideró nosocomial en el 68% (p<0,001). Las muestras más frecuentes fueron orinas (el 77% E. coli y el 48,2% K. pneumoniae) y exudado de herida (el 8,6% E. coli y el 14,8% K. pneumoniae).
ConclusionesDesde el año 2000, el porcentaje de aislados de E. coli y K. pneumoniae productoras de BLEE en España se ha multiplicado por 8 y por 2, respectivamente. El aumento de E. coli productora de BLEE en España se debe principalmente a cepas aisladas de pacientes no hospitalizados, en su mayoría de origen urinario.
During the year 2000, the 1st nationwide project (GEIH-BLEE Project 2000) on Escherichia coli and Klebsiella pneumoniae producing extended-spectrum ß-lactamases (ESBL) was carried out in Spain. The 2nd nationwide study was developed in 2006 to investigate the evolution of this problem.
MethodsA prospective multicenter study was designed, including all ESBL-producing E. coli and K. pneumoniae strains isolated at 44 Spanish hospitals between February and March 2006. Identification was verified at the coordinating centre and ESBL production was confirmed following CLSI guidelines.
ResultsA total of 1021 E. coli and 162K. pneumoniae strains were collected. ESBL-producing E. coli strains were isolated in all the participating hospitals, whereas ESBL-producing K. pneumoniae were isolated in 34. The overall percentage (range) of ESBL production among E. coli and K. pneumoniae was 4.04% (0.4–20.3) and 5.04% (0–30), respectively. In ESBL E. coli (Ec) cases, acquisition was considered community-acquired in 32%, related to health care in 36%, and nosocomial in 30%; and in ESBL K. pneumoniae (Kp) cases, acquisition by these routes was 10%, 18%, and 68% respectively. The samples most commonly showing these microorganisms were urine (77% Ec and 48.2% Kp) and wound exudate (8.6% Ec and 14.8% Kp).
ConclusionsSince 2000, the percentage of ESBL-producing strains among E. coli and K. pneumoniae isolates in Spain has increased 8-fold and 2-fold, respectively. The increase in ESBL-producing E. coli mainly occurred in isolates from outpatients, and most commonly in urine samples.
Las betalactamasas de espectro extendido (BLEE) son enzimas producidas por bacilos gramnegativos capaces de hidrolizar las cefalosporinas de amplio espectro y los monobactámicos, pero no las cefamicinas ni los carbapenémicos. Son betalactamasas mediadas generalmente por plásmidos y derivan de otras enzimas con menor espectro hidrolítico1. La aparición de las BLEE ha dificultado enormemente el tratamiento de numerosas infecciones bacterianas porque estas cepas presentan, además de resistencia a la gran mayoría de los betalactámicos, altas tasas de resistencia a antimicrobianos de otras familias1.
Las primeras BLEE se describieron en 1983 en Alemania en diferentes aislados de enterobacterias que presentaban resistencia a cefotaxima y ceftazidima y que podían transferirse por conjugación2. Desde entonces, estos microorganismos se han descrito cada vez con más frecuencia en diferentes países del mundo.
Los primeros aislados con BLEE reconocidos en España se detectaron en 1988 en 2 hospitales de Madrid y correspondían a cepas de Escherichia coli y de Klebsiella pneumoniae3,4. Durante la década de 1990 se describieron epidemias importantes en distintos hospitales españoles, en las que estuvieron implicados aislados de K. pneumoniae, Salmonella enterica y Enterobacter aerogenes4,5,6. Las cepas productoras de BLEE han ido aumentando en frecuencia progresivamente.
En un estudio realizado entre 1994 y 1996 en el Hospital de la Santa Creu i Sant Pau de Barcelona se observó que tan sólo un 0,2% de los aislados de K. pneumoniae y un 0,1% de los aislados de E. coli presentaban BLEE7. Entre marzo y junio de 2000 se llevó a cabo el primer estudio nacional de E. coli y K. pneumoniae productoras de BLEE del Grupo de Estudio de Infección Hospitalaria (proyecto GEIH-BLEE 2000), que mostró unos porcentajes de cepas de K. pneumoniae y E. coli con BLEE del 2,7 y del 0,5%, respectivamente8. En 2006, para comprender mejor la diseminación reciente y rápida de estos microorganismos en España, los autores de este artículo han desarrollado el segundo estudio nacional de E. coli y K. pneumoniae productoras de BLEE (proyecto GEIH-BLEE 2006).
MétodosCentros participantesEn el estudio participaron 44 hospitales representativos de todo el territorio nacional español (figura 1); de éstos, 30 habían participado en el proyecto GEIH-BLEE 20008. Se incluyeron hospitales pertenecientes a cada una de las comunidades autónomas. Igualmente participaron hospitales tanto de tercer nivel como regionales, públicos y privados. El centro coordinador fue el Hospital Universitario Virgen Macarena y la Facultad de Medicina de Sevilla.
Figura 1. Distribución de centros participantes. La correspondencia de los números se detalla en la tabla 1 .
MicroorganismosDurante los meses de febrero y marzo de 2006, en cada centro participante se recogieron todos los aislados consecutivos de muestras clínicas de E. coli y de K. pneumoniae con fenotipo de producción de BLEE según los criterios del Clinical and Laboratory Standards Institute9. Cada hospital participante utilizó la metodología que habitualmente se realiza en su centro para la selección de las cepas compatibles con fenotipo de producción de BLEE. A efectos de la recogida de cepas presumiblemente productoras de BLEE también se aceptaron los resultados obtenidos mediante tiras de E-test ESBL (AB Biodisk) y la técnica de doble disco.
Se excluyeron los aislados obtenidos de la misma muestra y del mismo paciente, en los que el antibiograma de rutina no indicó diferencias fenotípicas de interés. También se excluyeron los aislados obtenidos de muestras de vigilancia epidemiológica.
Datos demográficos y clínicosDe cada paciente en que se había aislado E. coli o K. pneumoniae productora de BLEE se recogieron datos clínicos y epidemiológicos, incluidos fecha de aislados del microorganismo, edad y sexo del paciente, muestra clínica y tipo de adquisición (comunitaria estricta, relacionada con los cuidados sanitarios o nosocomial).
DefinicionesLa adquisición se consideró como comunitaria o nosocomial según los criterios clásicos del Center for Disease Control10. En el caso de la adquisición nosocomial se indicó el servicio y los días de ingreso hasta la fecha del cultivo. En los casos de adquisición comunitaria se consideró que ésta se relacionaba con los cuidados sanitarios si cumplía alguno de los siguientes criterios: hemodiálisis, trasplante, atención en hospitalización domiciliaria u hospital de día, más de 2 visitas en consultas externas hospitalarias, ingreso hospitalario de más de 48 h o ingreso en centro sociosanitario en los últimos 3 meses. El resto de los casos se consideró como adquisición comunitaria estricta.
Datos hospitalariosAdicionalmente a los datos clínicos y demográficos, se solicitaron datos generales de cada centro participante, en los que se incluía el tipo de hospital, la población de referencia, si reciben todas las muestras del área, las camas de hospitalización y de cuidados intensivos, los ingresos y estancias en el período de estudio, así como el número total de cepas de E. coli y de K. pneumoniae aisladas en ese período.
Identificación de los microorganismosTodas las cepas seleccionadas en cada hospital se enviaron al centro coordinador, en donde se comprobó la identificación mediante el sistema de pruebas bioquímicas API 20E (bioMèrieux). La confirmación de producción de BLEE se realizó mediante microdilución con cefotaxima y ceftazidima con y sin ácido clavulánico (4μg/ml). Una disminución de 8 o más veces de la concentración mínima inhibitoria de cefotaxima o de ceftazidima en presencia de ácido clavulánico respecto a cefotaxima o ceftazidima sola indicó la presencia de producción de BLEE.
Análisis estadísticoEl porcentaje de aislados productores de BLEE se calculó en base al número total de aislados de E. coli y de K. pneumoniae obtenidos durante el período de estudio comunicados por los centros participantes. La incidencia mensual de infección y colonización por E. coli y K. pneumoniae productoras de BLEE se estimó como la mitad del número de casos incluidos en cada centro (dado que el período de estudio fue de 2 meses) por cada 100.000 habitantes, considerando la población de referencia de cada centro. Las variables continuas se compararon mediante el uso del test de la U de Mann-Whitney. Las variables cualitativas se compararon mediante el uso del test de χ2 o el test exacto de Fisher. Los datos se analizaron a través del programa informático SPSS.
ResultadosDe los 44 hospitales participantes, 13 (29,5%) tenían más de 1.000 camas; 20 (45,5%) tenían entre 500 y 1.000 camas y 11 (25%) tenían menos de 500 camas. Treinta y seis (81,8%) eran hospitales públicos de tercer nivel; 6 (13,6%) eran hospitales públicos comarcales y 2 (4,5%) eran hospitales privados comarcales. Treinta y un hospitales recibían todas las muestras de sus áreas correspondientes.
Durante el período de estudio se enviaron 1.233 cepas: 1.051 (85,2%) fueron de E. coli, 173 (14%) fueron de K. pneumoniae y 9 (0,8%) fueron de otras enterobacterias. En el estudio se incluyeron 1.183 de las cepas enviadas: 1.021 (86,3%) cepas de E. coli y 162 (13,7%) cepas de K. pneumoniae. De las 50 cepas excluidas, 19 se aislaron en una fecha fuera del período de estudio, 9 fueron enterobacterias distintas a E. coli y a K. pneumoniae, una E. coli era no productora de BLEE y 21 fueron cepas aisladas de muestras de vigilancia epidemiológica.
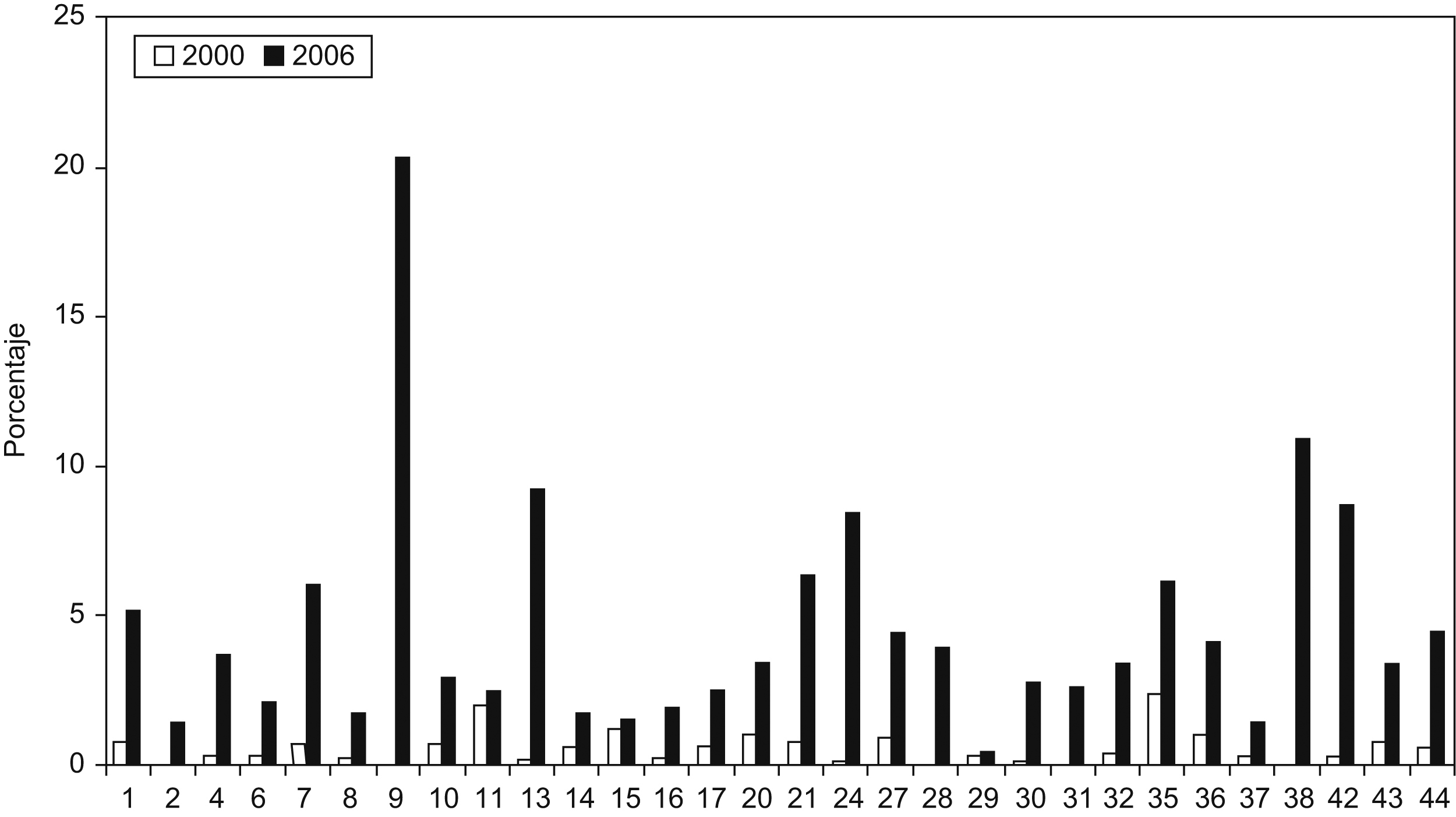
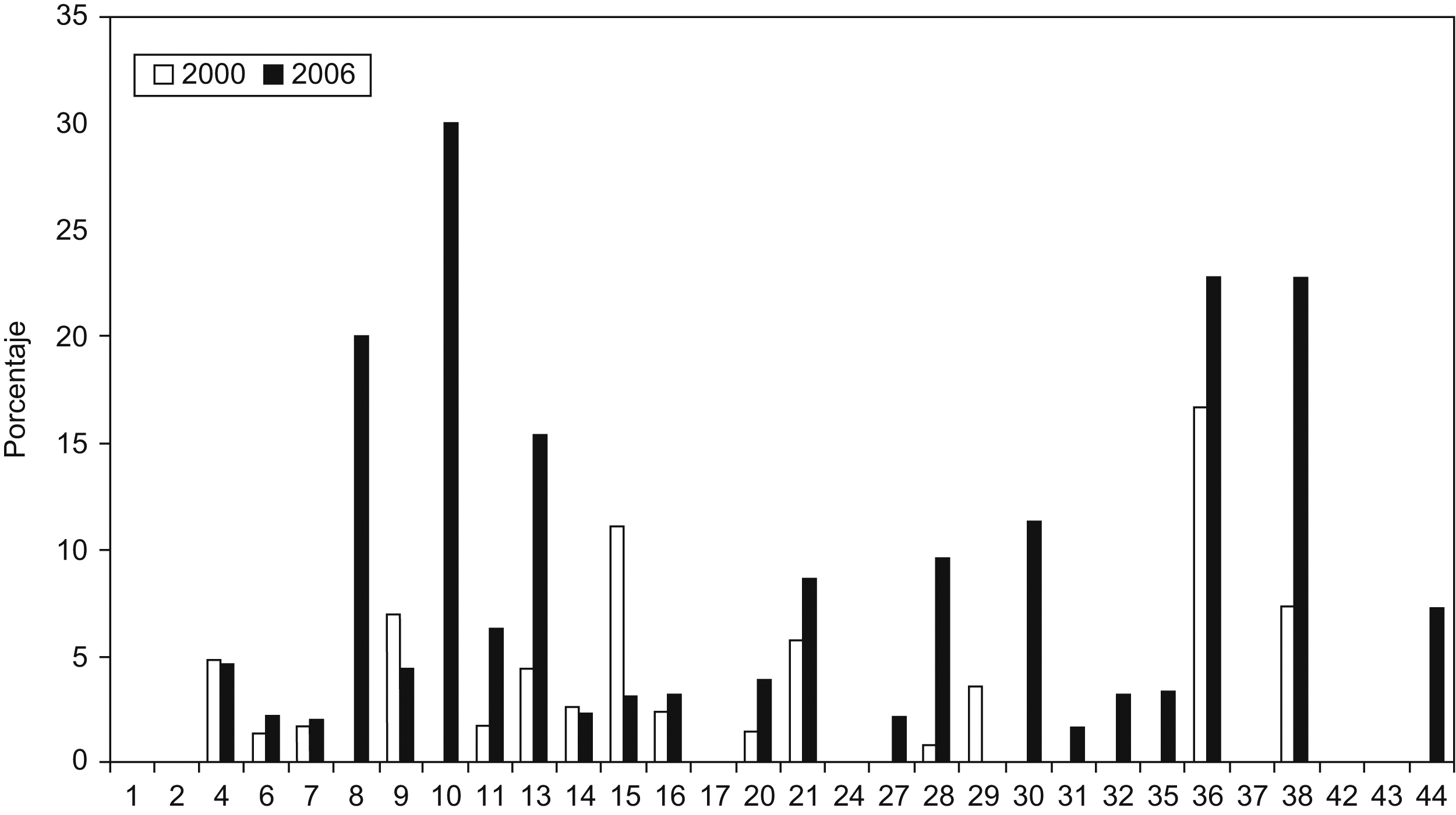
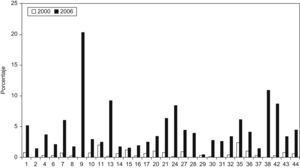
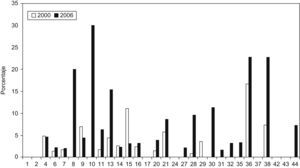
Se aislaron cepas de E. coli productoras de BLEE en todos los hospitales participantes, y cepas de K. pneumoniae productoras de BLEE en 33 de los 44 hospitales (75%). Las cepas de E. coli productora de BLEE supusieron el 4,04% (rango de 0,4 a 20,3%) del total de E. coli aisladas en todos los centros (tabla 1). Cabe destacar el porcentaje elevado de cepas de E. coli productora de BLEE del Hospital Puerta del Mar de Cádiz con una frecuencia del 20,3% y del Hospital Parapléjicos de Toledo con una frecuencia del 10,9%. En el límite inferior, la frecuencia del Complejo Asistencial de León fue del 0,5% y la frecuencia del Hospital de Navarra fue del 0,4%. En el caso de K. pneumoniae el porcentaje fue del 5,04% (rango de 0 a 30%), con una diferencia importante de porcentaje entre hospitales, de tal forma que en 10 hospitales no se aislaron K. pneumoniae productoras de BLEE y hay 9 hospitales en los que más del 10% de las cepas de K. pneumoniae fueron productoras de BLEE. Los porcentajes de E. coli y de K. pneumoniae productoras de BLEE de los hospitales comunes de este estudio y del estudio realizado en el año 2000 se comparan en las figura 2,figura 3.
Tabla 1. Porcentaje de aislados de Escherichia coli y Klebsiella pneumoniae productores de betalactamasas de espectro extendido e incidencia de colonización/infección por estos microorganismos en los hospitales participantes
| No | Hospital | Ciudad | Escherichia coli productora de BLEE | Incidencia de Klebsiella pneumoniae productora de BLEE b | ||||
| n | % a | n | % a | |||||
| 1 | Marina Baixa | Villajoyosa | 18 | 5,1 | 0 | 0,0 | 4,6 | 0,0 |
| 2 | Severo Ochoa | Cangas del Narcea | 1 | 1,4 | 0 | 0,0 | 1,4 | 0,0 |
| 3 | Infanta Cristina | Badajoz | 7 | 3,6 | 8 | 12,7 | NM | NM |
| 4 | Bellvitge | Barcelona | 19 | 3,7 | 4 | 4,6 | 0,7 | 0,2 |
| 5 | Sant Pau | Barcelona | 22 | 5,4 | 5 | 12,2 | NM | NM |
| 6 | Vall d′Hebron | Barcelona | 21 | 2,1 | 3 | 2,2 | 2,3 | 0,3 |
| 7 | Clínico | Barcelona | 24 | 6,0 | 1 | 2,0 | 2,7 | 0,1 |
| 8 | General Yagüe | Burgos | 9 | 1,6 | 7 | 17,5 | 1,3 | 1,0 |
| 9 | Puerta del Mar | Cádiz | 27 | 20,3 | 4 | 4,4 | 1,2 | 0,2 |
| 10 | La Mancha Centro | Alcázar de San Juan | 10 | 2,9 | 3 | 30,0 | 2,2 | 0,7 |
| 11 | Reina Sofía | Córdoba | 14 | 2,5 | 9 | 6,3 | 1,4 | 0,9 |
| 12 | Figueras | Figueras | 3 | 0,9 | 0 | 0,0 | NM | NM |
| 13 | Doctor Negrín | Gran Canaria | 31 | 9,2 | 6 | 15,4 | 3,3 | 0,6 |
| 14 | San Cecilio | Granada | 8 | 1,7 | 1 | 2,3 | 1,1 | 0,1 |
| 15 | General Ciudad de Jaén | Jaén | 14 | 1,5 | 4 | 3,1 | 2,3 | 0,6 |
| 16 | Juan Canalejo | La Coruña | 18 | 1,9 | 3 | 3,2 | 1,8 | 0,3 |
| 17 | Arquitecto Marcide | Ferrol | 13 | 2,5 | 0 | 0,0 | 3,1 | 0,0 |
| 18 | Complejo Asistencial de León | León | 3 | 0,5 | 0 | 0,0 | 0,4 | 0,0 |
| 19 | Complejo Hospitalario San Millán y San Pedro | Logroño | 13 | 2,0 | 0 | 0,0 | NM | NM |
| 20 | Ramón y Cajal | Madrid | 45 | 3,4 | 7 | 3,8 | 4,2 | 0,6 |
| 21 | Gregorio Marañón | Madrid | 52 | 6,3 | 11 | 8,7 | NM | NM |
| 22 | 12 de Octubre | Madrid | 35 | 5,7 | 1 | 1,3 | NM | NM |
| 23 | Clínico San Carlos | Madrid | 70 | 4,5 | 4 | 1,4 | 6,8 | 0,4 |
| 24 | De Alcorcón | Alcorcón | 60 | 8,4 | 0 | 0,0 | 12,0 | 0,0 |
| 25 | Morales Meseguer | Murcia | 37 | 7,4 | 2 | 2,4 | NM | NM |
| 26 | Santa María Nai | Orense | 22 | 3,3 | 2 | 4,0 | 4,2 | 0,4 |
| 27 | Central de Asturias | Oviedo | 26 | 4,4 | 1 | 2,2 | NM | NM |
| 28 | Son Dureta | Palma de Mallorca | 30 | 3,9 | 9 | 9,6 | 5,8 | 1,7 |
| 29 | De Navarra | Pamplona | 1 | 0,4 | 0 | 0,0 | NM | NM |
| 30 | Provincial de Pontevedra | Pontevedra | 18 | 2,8 | 7 | 11,3 | 3,1 | 1,2 |
| 31 | Clínico de Salamanca | Salamanca | 14 | 2,6 | 1 | 1,6 | NM | NM |
| 32 | Marqués de Valdecilla | Santander | 31 | 3,4 | 3 | 3,2 | 5,2 | 0,5 |
| 33 | Clínico Universitario de Santiago | Santiago de Compostela | 23 | 3,4 | 3 | 6,5 | 2,6 | 0,3 |
| 34 | Virgen Rocío | Sevilla | 70 | 6,2 | 8 | 3,5 | 6,0 | 0,7 |
| 35 | Virgen Macarena | Sevilla | 34 | 6,1 | 2 | 3,3 | 3,1 | 0,2 |
| 36 | Virgen Candelaria | Tenerife | 15 | 4,1 | 16 | 22,9 | NM | NM |
| 37 | Hospital de Alcañiz | Teruel | 4 | 1,4 | 0 | 0,0 | 2,7 | 0,0 |
| 38 | Parapléjicos | Toledo | 17 | 10,9 | 13 | 22,8 | NM | NM |
| 39 | Clínico de Valencia | Valencia | 20 | ND | 0 | ND | ND | ND |
| 40 | La Fé | Valencia | 53 | 6,1 | 4 | 2,9 | 7,8 | 0,6 |
| 41 | Clínico de Valladolid | Valladolid | 10 | 3,2 | 5 | 16,1 | 1,9 | 1,0 |
| 42 | Xeral Cies | Vigo | 13 | 8,7 | 0 | 0,0 | 2,6 | 0,0 |
| 43 | Txagorritxu | Vitoria | 14 | 3,3 | 0 | 0,0 | 3,5 | 0,0 |
| 44 | Lozano Blesa | Zaragoza | 32 | 4,5 | 5 | 7,2 | 5,7 | 0,9 |
| TOTAL | 5,04 | – | – | |||||
BLEE: betalactamasas de espectro extendido; ND: no determinado (por no disponer de los datos de aislados totales); NM: no recibe todas las muestras del área.
a Datos expresados como porcentajes sobre el total de cepas aisladas en cada hospital durante el período de estudio.
b Casos cada 100.000 habitantes por mes.
Figura 2. Porcentaje de aislados productores de betalactamasas de espectro extendido respecto del total de Escherichia coli en el año 2000 en comparación con el año 2006. La correspondencia de los números de los hospitales se detalla en la tabla 1 .
Figura 3. Porcentaje de aislados productores de betalactamasas de espectro extendido respecto del total de Klebsiella pneumoniae en el año 2000 en comparación con el año 2006. La correspondencia de los números de los hospitales se detalla en la tabla 1 .
Los resultados de los cálculos de la incidencia de cada hospital (expresada en casos por cada 100.000 habitantes por mes) de los aislados de E. coli y de K. pneumoniae productoras de BLEE se muestran en la tabla 1. La incidencia osciló entre 0,2 y 12 en el caso de E. coli productora de BLEE y entre 0 y 1,7 en el caso de K. pneumoniae productora de BLEE.
En la tabla 2 se muestran las características demográficas y epidemiológicas de los pacientes en los que se aisló E. coli y K. pneumoniae productoras de BLEE. En cuanto al sexo, el masculino predominó entre los pacientes con K. pneumoniae y el femenino entre aquéllos con E. coli. La edad inferior a un año y entre 14 y 60 años fue más frecuente en K. pneumoniae, mientras que la edad superior a 60 años fue más frecuente en E. coli. Ambos microorganismos se aislaron más frecuentemente de muestras de orina, pero la frecuencia fue mayor en E. coli que en K. pneumoniae, mientras que ocurrió lo contrario con exudados, sangre y muestras respiratorias. La adquisición comunitaria estricta y la adquisición relacionada con los cuidados sanitarios fue más frecuente en E. coli y la adquisición nosocomial fue más frecuente en K. pneumoniae. Entre los casos nosocomiales predominaron las adquisiciones en unidad de cuidados intensivos (UCI) en el caso de K. pneumoniae y en servicios médicos en el caso de E. coli.
Tabla 2. Datos demográficos y epidemiológicos de los sujetos con aislado de Escherichia coli y Klebsiella pneumoniae productores de betalactamasas de espectro extendido
| Escherichia coli (n=1.021) | Klebsiella pneumoniae (n=162) | OR (IC del 95%) | p | |
| Edad | ||||
| Mediana en años (rango intercuartílico) | 70 (53–80) | 59 (31–75) | – | <0,001 |
| <1 año | 21 (2,1) | 26 (16,4) | 0,1 (0,06–0,2) | <0,001 |
| 1 a 13 años | 40 (4,1) | 3 (1,9) | 2,1 (0,6–8,8) | 0,1 |
| 14 a 60 años | 271 (27,6) | 56 (35,2) | 0,6 (0,4–0,9) | 0,03 |
| >60 años | 649 (66,2) | 74 (46,5) | 2,0 (1,4–2,9) | <0,001 |
| Sexo | ||||
| Varones | 405 (39,7) | 108 (66,7) | 0,3 (0,2–0,4) | <0,001 |
| Mujeres | 610 (59,7) | 53 (32,7) | 3,0 (2,1–4,4) | <0,001 |
| Desconocido | 6 (0,6) | 1 (0,6) | 0,9 (0,1–21,1) | 1,0 |
| Muestras | ||||
| Orina | 786 (77) | 78 (48,2) | 3,6 (2,5–5,1) | <0,001 |
| Exudado de herida | 88 (8,6) | 24 (14,8) | 0,5 (0,3–0,9) | <0,001 |
| Sangre | 57 (5,6) | 19 (11,7) | 0,4 (0,2–0,8 | <0,001 |
| Muestras respiratorias | 34 (3,4) | 28 (17,3) | 0,1 (0,09–0,2) | <0,001 |
| Otras | 56 (5,4) | 13 (8) | 0,6 (0,3–3,0) | 0,2 |
| Adquisición | ||||
| Comunitaria estricta | 322 (31,5) | 17 (10,5) | 3,9 (2,2–6,8) | <0,001 |
| Relacionada con la asistencia sanitaria | 364 (35,7) | 29 (17,9) | 2,5 (1,6–3,9) | <0,001 |
| Nosocomial | 303 (29,7) | 111 (68,5) | 0,1 (0,1–0,2) | <0,001 |
| Desconocida | 32 (3,1) | 5 (3,1) | 1,0 (0,3–3,0) | 0,9 |
| Tipo de servicio * | ||||
| Médicos | 145 (47,9) | 34 (30,6) | 2,0 (1,2–3,3) | 0,001 |
| Quirúrgicos | 107 (35,3) | 26 (32,4) | 1,7 (1,0–3,0) | 0,02 |
| UCI | 49 (16,2) | 51 (46) | 0,2 (0,1–0,3) | <0,001 |
| Desconocido | 2 (0,6) | 0 (0) | – | 0,5 |
Los datos se presentan como número de casos (porcentaje), excepto donde se especifica.
IC: intervalo de confianza; OR: odds ratio 'oportunidad relativa'; UCI: unidad de cuidados intensivos.
* Sólo casos nosocomiales.
La aparición de enterobacterias resistentes a cefalosporinas de amplio espectro y a aztreonam se ha convertido en un gran problema de salud pública mundial. En los últimos años se ha producido un aumento en la incidencia de enterobacterias productoras de BLEE (principalmente E. coli) y se ha encontrado una epidemiología que difiere en líneas generales de la de K. pneumoniae. Hasta hace algunos años se caracterizaba por un comportamiento predominantemente no clonal11,12, aunque recientemente se están describiendo brotes por E. coli productora de BLEE en hospitales o áreas sanitarias debido a una única cepa clonal13.
Hace 2 décadas, la mayoría de los microorganismos productores de BLEE eran K. pneumoniae, poseían enzimas de las familias SHV y TEM y se asociaban a brotes nosocomiales epidémicos. Se aislaban con más frecuencia en las UCI (tanto de adultos como neonatales) y como factores de riesgo asociados a infecciones por estas cepas estaba el ingreso en UCI, la cirugía reciente, el cateterismo, el sondaje urinario, la hospitalización prolongada y la utilización previa de cefalosporinas y aminoglucósidos2,14. Sin embargo, este panorama ha cambiado y en la actualidad la mayoría de los aislados con BLEE expresa enzimas de tipo CTX-M; éstas se reconocen con mayor frecuencia en E. coli que en el resto de las enterobacterias, incluida K. pneumoniae15,16. En general, los aislados que expresan las enzimas CTX-M en este medio no suelen diseminarse clonalmente, aunque se ha reconocido una clara asociación a determinados tipos de plásmidos y elementos genéticos de transmisión14. Recientemente se ha constatado en varios continentes la expansión de un clon virulento de E. coli (O25:H4ST131) productor de CTX-M-1517.
Durante los meses de marzo a junio de 2000 se llevó a cabo un estudio multicéntrico (en el que participaron 40 hospitales de todo el ámbito nacional español) que mostró una frecuencia de producción de BLEE en E. coli y K. pneumoniae productoras de BLEE del 0,5 y el 2,7% respectivamente, y la presencia de aislados productores de BLEE en el 90% de los centros que participaron en el estudio. Asimismo, la mayoría de las cepas de K. pneumoniae (93%) se detectaron en pacientes hospitalizados, mientras que el 51% de los aislados de E. coli procedían de pacientes extrahospitalarios8. El presente estudio se diseñó de tal forma que fuera lo más parecido al estudio realizado en el año 2000, con el fin de que la comparación de los resultados fuera también lo más fiable posible. Sin embargo, el número elevado de aislados recibidos obligó a acortar la duración en 2 meses.
En este trabajo, la frecuencia global de producción de BLEE en E. coli y K. pneumoniae fue del 4,04 y del 5,04% (0,5 y 2,7%, en el año 2000) respectivamente, lo que supone que los aislados de E. coli y de K. pneumoniae productoras de BLEE se han multiplicado por 8 y por 2, respectivamente, en 6 años. Este aumento se ha constatado en diferentes estudios multicéntricos europeos. Los datos del estudio EARSS (European Antimicrobial Resistance Surveillance System) del año 2005 muestran, en algunos países, aumentos considerables de aislados de E. coli con resistencia a cefalosporinas de amplio espectro; así pues se han observado cifras del 12% en Portugal, del 16% en Chipre y Rumania y hasta del 28% en Bulgaria18. Asimismo, entre 1997 y 2004 en el programa MYSTIC (Meropenem Yearly Susceptibility Test Information Collection) se evidenció un aumento importante en la prevalencia de E. coli y de K. pneumoniae productoras de BLEE, que pasó del 2,1 al 10,8% y del 9,0 al 13,6%, respectivamente. Estos datos observados en Europa difieren sustancialmente de los datos observados en EE. UU., e incluso se puede apreciar una disminución considerable tanto en E. coli (del 5,1 al 1,4%) como en K. pneumoniae (del 7,2 al 4,4%)19.
En todos los hospitales que han participado en el presente estudio se ha constatado en mayor o menor grado un aumento en la prevalencia de E. coli productora de BLEE respecto a los datos que se observaron en el año 2000. En algunos hospitales se han apreciado aumentos del 0 al 20%. En el caso de K. pneumoniae productora de BLEE se han observado diferencias más variables de unos hospitales a otros; así pues, mientras en un hospital se ha incrementado de un 0,0% a un 30,0% en otros ha disminuido de un 11,1% a un 3,1%. Estos resultados probablemente se deban a que K. pneumoniae presenta un comportamiento epidémico debido a la presencia habitual de uno o de escasos clones que se diseminan en un mismo hospital, entre hospitales o áreas sanitarias20 y, por el contrario, E. coli presenta una distribución más uniforme, que responde más bien a un comportamiento epidémico policlonal o alodémico21. El estudio de clonalidad de los aislados y caracterización de las enzimas está actualmente en evaluación.
Se están detectando en diferentes áreas del mundo y cada vez con más frecuencia, infecciones comunitarias por E. coli productora de estas enzimas8,11,22,23,24,25,26. En el estudio aquí descrito, el 67,2% de las cepas de E. coli productora de BLEE son de origen comunitario, porcentaje aún superior al observado en el año 2000 (51%). Cabe destacar que de todos los casos de origen comunitario, el 53,1% tuvo alguna relación con la asistencia sanitaria, lo que supone que el 31,5% del total de E. coli productora de BLEE son casos puramente comunitarios. Además, es importante remarcar que el 3,9% de las cepas de E. coli productora de BLEE comunitarias se han aislado de muestras de sangre, cifra nada desdeñable si se tiene en cuenta la morbimortalidad elevada que conlleva este tipo de infecciones, como muestra un estudio reciente27. Los resultados obtenidos en ese estudio muestran que el 8,8% de las bacteriemias por E. coli se originaron por cepas productoras de BLEE; el 49% de esas bacteriemias fueron nosocomiales; el 32% se relacionaba con la asistencia sanitaria, y el 19% eran estrictamente comunitarias. La tasa bruta de mortalidad fue del 21%. Esta situación es preocupante, ya que la mayoría de estas infecciones de la comunidad se tratan con antimicrobianos que no son activos frente a estas cepas, lo que se asocia a una mayor mortalidad. Esto obliga a reconsiderar el tratamiento empírico de los cuadros de sepsis que se sospechan producidos por E. coli productora de BLEE, sobre todo en zonas con alta prevalencia y en pacientes con determinados factores de riesgo, como son el uso de quinolonas o cefalosporinas en los 2 meses previos, enfermedades de base y obstrucción de vías urinarias u obstrucción biliar28.
K. pneumoniae productora de BLEE ha sido considerada un patógeno casi exclusivamente hospitalario, debido a su comportamiento epidemiológico. Recientemente, diversos estudios han mostrado cómo K. pneumoniae productora de BLEE, además de seguir siendo un agente causal importante de infecciones hospitalarias, aparece implicado en procesos de origen comunitario. En un estudio de casos y controles realizado en 2006 en Taiwán29, en el que se comparan las características clínicas de 54 niños con infección por K. pneumoniae productora de BLEE frente a 54 niños con infección por K. pneumoniae no productora de BLEE, se observó que el 20,4% de las infecciones producidas por K. pneumoniae productora de BLEE son de adquisición comunitaria. En otro estudio reciente realizado en el Hospital Ramón y Cajal de Madrid30 analizaron todas las cepas de K. pneumoniae productoras de BLEE recuperadas desde 2001 a 2004, y compararon los datos de este período con otro estudio realizado en el mismo hospital durante el período de 1989 a 20006. Entre los resultados obtenidos, cabe destacar que el 31% de los casos del período de 2001 a 2004 son extrahospitalarios en comparación con el 7% encontrado en el período de 1989 a 2000.
En el estudio aquí descrito, 46 cepas (28,4%) de K. pneumoniae fueron de origen comunitario (7% en el año 2000) y el 63% de éstas había tenido alguna relación con la asistencia sanitaria, lo que supone que el 10,5% del total de K. pneumoniae eran estrictamente comunitarias. En el estudio del año 2000 no se investigaron factores relacionados con la asistencia sanitaria, por lo que se desconoce qué porcentaje de cepas fueron estrictamente comunitarias.
Como se ha comentado, los resultados del presente estudio reflejan las importantes diferencias epidemiológicas entre E. coli y K. pneumoniae productoras de BLEE. Si bien las diferencias encontradas pueden deberse en gran parte a las diferencias intrínsecas entre ambos microorganismos (independientemente de la producción de BLEE), este hecho debe tenerse en cuenta para la investigación de los factores de riesgo o pronósticos asociados a la producción de BLEE, de manera que los estudios que incluyen ambos microorganismos de forma conjunta, que han sido y siguen siendo frecuentes, deben interpretarse con precaución.
El presente estudio tiene algunas limitaciones. En primer lugar, aunque el número de hospitales es elevado y se seleccionaron para reflejar adecuadamente todo el territorio español, los resultados obtenidos no tienen por qué reflejar exactamente la situación en España. En segundo lugar, el número de hospitales en el presente estudio no coincide exactamente con los del estudio realizado en el año 2000 y, adicionalmente, las características de muchos de estos centros pueden haber cambiado de manera sustancial en 6 años. En tercer lugar, las estimaciones de las incidencias presentan limitaciones considerables al haberse calculado con un estudio de sólo 2 meses y en base a las poblaciones de referencia de los centros, que pueden no reflejar adecuadamente a la población en riesgo. A pesar de estas limitaciones, los resultados globales del estudio sí reflejan, al menos, las tendencias en cuanto a la evolución del problema.
El análisis conjunto de estos datos, de las características clínicas de los pacientes y la caracterización de las BLEE ayudarán a conocer mejor la epidemiología local tanto de K. pneumoniae como de E. coli productoras de BLEE, para poder establecer recomendaciones terapéuticas y medidas de control con el fin de asegurar el uso adecuado de los antimicrobianos de los que se dispone para hacer frente a estos microorganismos (datos actualmente en evaluación).
Como conclusión, puede decirse que en España desde el año 2000 el porcentaje de aislados de E. coli y de K. pneumoniae productoras de BLEE se ha multiplicado por 8 y por 2, respectivamente, que E. coli y K. pneumoniae productoras de BLEE se aislaron en el 100 y el 75% de los centros participantes, respectivamente, y que el aumento de E. coli productora de BLEE en España se debe principalmente a cepas aisladas de pacientes no hospitalizados, en su mayoría de origen urinario.
Agradecimientos
Este estudio se ha realizado con el auspicio científico de la Red Española de Investigación en Patología Infecciosa (REIPI RD06/0008, Ministerio de Sanidad y Consumo, Instituto de Salud Carlos III). Este proyecto ha sido parcialmente financiado por Laboratorios Wyeth y por el proyecto FIS PI070190. Los autores de este artículo agradecen al Grupo de Estudio de Infección Hospitalaria (GEIH) de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) la colaboración prestada para el desarrollo de este proyecto.
Participantes del GEIH de la SEIMC: Carmen Martínez Peinado (Villajoyosa, Alicante); José Francisco Ordás (Cangas de Nancea, Asturias); Eugenio Garduño (Badajoz); María Ángeles Domínguez (Barcelona); Ferrán Navarro (Barcelona); Guillermo Prats (Barcelona); Francesc Marco (Barcelona); Eva Ojeda (Burgos); Pilar Marín (Cádiz); Rafael Carranza (Alcazar de San Juan, Ciudad Real); Fernando Rodríguez (Córdoba); Carlos García Tejero (Figueras, Gerona); Fernando Artiles (Gran Canaria); Begoña Palop (Granada); Inocente Cuesta (Jaén); Mónica Cartelle (A Coruña); María Dolores Rodríguez (Ferrol, A Coruña); Isabel Fernández (León); Estíbaliz Ugalde (Logroño); Rafael Cantón (Madrid); Emilia Cercenado (Madrid); Fernando Chaves (Madrid); Juan José Picazo (Madrid); Alberto Delgado (Alcorcón, Madrid); Carmen Guerrero (Murcia); Begoña Fernández (Orense); Ana Fleites (Oviedo); Antonio Oliver (Palma de Mallorca); José J. García (Pamplona); Marta García (Pontevedra); José Elías (Salamanca); Luis Martínez (Santander); Mercedes Treviño (Santiago de Compostela); Maite Ruiz (Sevilla); Miguel Ángel Díaz (Sevilla); Magdalena Lara (Tenerife); Luis Torres (Teruel); Eugenia García (Toledo); David Navarro (Valencia); Miguel Gobernado (Valencia); Alberto Tenorio (Valladolid); Isabel Otero (Vigo); Lourdes Michaus (Vitoria), y Javier Castillo (Zaragoza).
Recibido 30 Junio 2008
Aceptado 3 Septiembre 2008
Autor para correspondencia. diaz.guerrero.miguel@gmail.com