El mecanismo de resistencia a beta-lactámicos más importante en Staphylococcus es la resistencia a meticilina relacionada con el gen mecA, que implica resistencia a todos los beta-lactámicos con la excepción de las 2 nuevas cefalosporinas ceftobiprol y ceftarolina. Los puntos de corte para interpretar este mecanismo varían según se trate de Staphylococcus aureus o de especies coagulasa negativa. En cuanto a macrólidos-lincosamidas-estreptograminas B (MLSB), lo más habitual entre las cepas resistentes es la expresión de metilasas (genes erm). Las alteraciones en las topoisomerasas por mutaciones puntuales y la expresión de la bomba de expulsión NorA causan resistencia a quinolonas, pero hay notables diferencias sobre la actividad de diferentes compuestos, lo que dificulta el análisis interpretado. Se han descrito cepas de S. aureus con sensibilidad intermedia a glicopéptidos (cepas GISA) y también cepas con el mecanismo vanA (alta resistencia). En nuestro país existe un alto porcentaje de cepas de Streptococcus pneumoniae intermedias o resistentes a penicilina y un bajo porcentaje de cepas intermedias o resistentes a cefalosporinas de tercera generación, por alteraciones en los genes que codifican proteínas fijadoras de penicilinas. El fenotipo de resistencia más frecuente en esta especie para MLSB es también la producción de metilasas. La resistencia a quinolonas, aún poco frecuente, se relaciona principalmente con mutaciones en parC/parE (bajo nivel) y en gyrA. Es importante la detección de la resistencia de bajo nivel por su implicación clínica. No se han descrito aún cepas de Streptococcus pyogenes resistentes a penicilina. En España el fenotipo de resistencia a macrólidos en S. pyogenes más frecuente está causado por bombas de expulsión activa (genes mef) que afectan a macrólidos de 14 y 15 átomos. Enterecoccus faecalis suele ser sensible a ampicilina, a diferencia de lo observado en Enterococcus faecium. Los enterococos tienen resistencia intrínseca de bajo nivel a aminoglucósidos, pero son sensibles a la combinación de estos compuestos con agentes activos en la pared. Las cepas que expresan distintas enzimas modificantes de aminoglucósidos (resistencia de alto nivel) son resistentes también a la citada combinación. En España el porcentaje de enterococos resistentes a vancomicina es bajo, aunque se han comunicado brotes en distintos hospitales debidos al genotipo vanA y casos esporádicos por el genotipo vanB2.
Resistance to methicillin in Staphylococcus is related to the expression of the mecA gene, and involves resistance to all beta-lactams, with the exception of the new cephalosporins, ceftobiprole and ceftaroline. Breakpoints for interpretation of this mechanism differ in S. aureus and in coagulase-negative species. For macrolides-lincosamides-streptogramins B, (MLSB) the most frequent mechanism among resistant strains is expression of methylases (erm genes). Topoisomerase changes caused by point mutations and expression of the efflux pump NorA determine resistance to quinolones, but there are great differences in the activity of different compounds, which makes interpretative reading difficult. Strains of S. aureus with intermediate susceptibility to glycopeptides (GISA strains) have been described, as well as highly-vancomycin-resistant isolates (vanA isolates). In Spain, there is a high percentage of S. pneumoniae strains intermediate or resistant to penicillin, and a low percentage of strains intermediate or resistant to third generation cephalosporins, due to mutations in genes encoding penicillin-binding proteins. The most frequent phenotype of resistance to MLSB in this species is caused by methylase production. Resistance to quinolones is still uncommon, and is mainly related to mutations in parC/parE (low level) and in gyrA. It is important to detect low level resistance due to its clinical implications. No strains of S. pyogenes resistant to penicillin have yet been described. In Spain the most common phenotype of resistance to macrolides in S. pyogenes is determined by efflux pumps (mef genes), affecting 14- and 15-membered macrolides. E. faecalis is usually susceptible to ampicillin, in contrast to E. faecium. Enterococci show intrinsic low-level resistance to aminoglycosides, but still remain susceptible to the combination of these antimicrobials and cell-wall active agents. Strains expressing different aminoglycoside-modifying enzymes (high-level resistance) became resistant to the combination. Glycopeptide-resistant strains of enterococci are uncommon in Spain, but nosocomial outbreaks due to vanA enterococci and case reports due to vanB2 enterococci have been recently reported.
En este artículo se analizarán los fenotipos de resistencia a distintos antibióticos en los géneros Staphylococcus, Streptococcus y Enterococcus así como los mecanismos que pueden estar relacionados con los mismos y en algunos casos, se valorarán los métodos más adecuados para su detección.
Género StaphylococcusEn la tabla 1 se presentan los fenotipos y mecanismos de resistencia a antibióticos en este género.
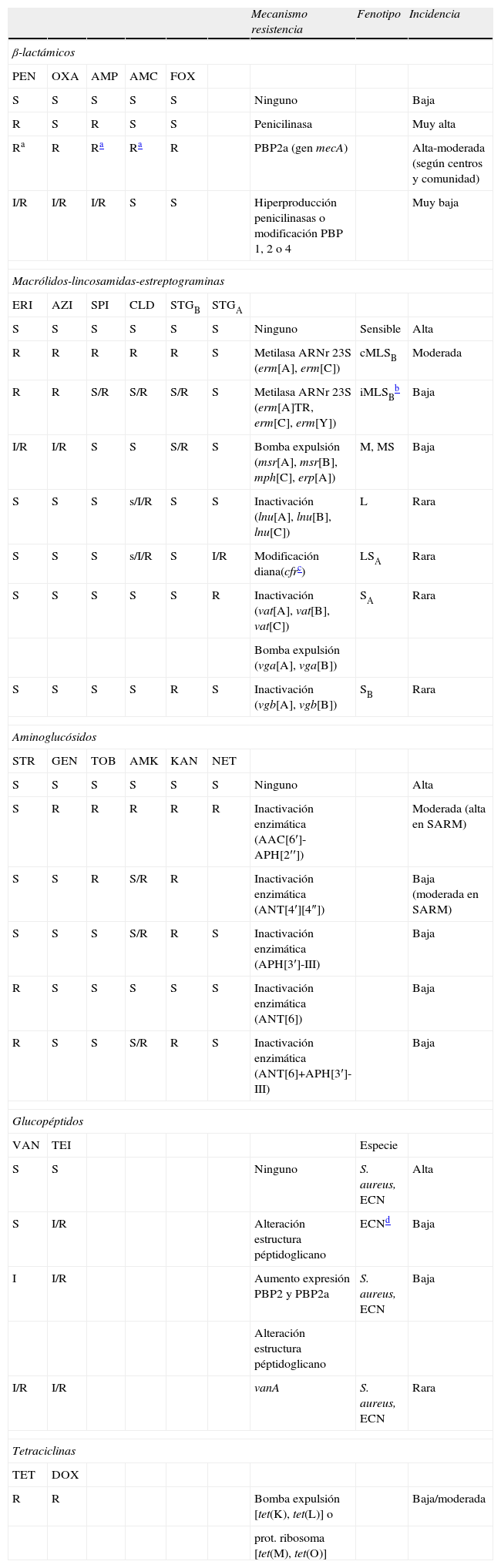
Fenotipos y mecanismos de resistencia a antibióticos en Staphylococcus
| Mecanismo resistencia | Fenotipo | Incidencia | ||||||
| β-lactámicos | ||||||||
| PEN | OXA | AMP | AMC | FOX | ||||
| S | S | S | S | S | Ninguno | Baja | ||
| R | S | R | S | S | Penicilinasa | Muy alta | ||
| Ra | R | Ra | Ra | R | PBP2a (gen mecA) | Alta-moderada (según centros y comunidad) | ||
| I/R | I/R | I/R | S | S | Hiperproducción penicilinasas o modificación PBP 1, 2 o 4 | Muy baja | ||
| Macrólidos-lincosamidas-estreptograminas | ||||||||
| ERI | AZI | SPI | CLD | STGB | STGA | |||
| S | S | S | S | S | S | Ninguno | Sensible | Alta |
| R | R | R | R | R | S | Metilasa ARNr 23S (erm[A], erm[C]) | cMLSB | Moderada |
| R | R | S/R | S/R | S/R | S | Metilasa ARNr 23S (erm[A]TR, erm[C], erm[Y]) | iMLSBb | Baja |
| I/R | I/R | S | S | S/R | S | Bomba expulsión (msr[A], msr[B], mph[C], erp[A]) | M, MS | Baja |
| S | S | S | s/I/R | S | S | Inactivación (lnu[A], lnu[B], lnu[C]) | L | Rara |
| S | S | S | s/I/R | S | I/R | Modificación diana(cfrc) | LSA | Rara |
| S | S | S | S | S | R | Inactivación (vat[A], vat[B], vat[C]) | SA | Rara |
| Bomba expulsión (vga[A], vga[B]) | ||||||||
| S | S | S | S | R | S | Inactivación (vgb[A], vgb[B]) | SB | Rara |
| Aminoglucósidos | ||||||||
| STR | GEN | TOB | AMK | KAN | NET | |||
| S | S | S | S | S | S | Ninguno | Alta | |
| S | R | R | R | R | R | Inactivación enzimática (AAC[6′]-APH[2′′]) | Moderada (alta en SARM) | |
| S | S | R | S/R | R | Inactivación enzimática (ANT[4′][4″]) | Baja (moderada en SARM) | ||
| S | S | S | S/R | R | S | Inactivación enzimática (APH[3′]-III) | Baja | |
| R | S | S | S | S | S | Inactivación enzimática (ANT[6]) | Baja | |
| R | S | S | S/R | R | S | Inactivación enzimática (ANT[6]+APH[3′]-III) | Baja | |
| Glucopéptidos | ||||||||
| VAN | TEI | Especie | ||||||
| S | S | Ninguno | S. aureus, ECN | Alta | ||||
| S | I/R | Alteración estructura péptidoglicano | ECNd | Baja | ||||
| I | I/R | Aumento expresión PBP2 y PBP2a | S. aureus, ECN | Baja | ||||
| Alteración estructura péptidoglicano | ||||||||
| I/R | I/R | vanA | S. aureus, ECN | Rara | ||||
| Tetraciclinas | ||||||||
| TET | DOX | |||||||
| R | R | Bomba expulsión [tet(K), tet(L)] o | Baja/moderada | |||||
| prot. ribosoma [tet(M), tet(O)] | ||||||||
AMC: amoxicilinaácido clavulanico; AMK: amikacina; AMP: ampicilina; AZI: azitromicina; CEF: cefazolina; CLD: clindamicina; CTX: cefotaxima; DOX: doxiciclina; ECN: Stapylococcus coagulasa negativo; ERI: eritromicina; FOX: cefoxitina; GEN: gentamicina; I: intermedio; KAN: kanamicina; NET: netilmicina; OXA: oxacilina; PEN: penicilina; R: resistente; SPI: espiramicina; S: sensible; s: sensibilidad disminuida; STGA: estreptogramina del grupo A; STGB: estreptogramina del grupo B; STR: estreptomicina; TEI: teicoplanina; TET: tetraciclina; TOB: tobramicina; VAN: vancomicina.
En algunos casos el mecanismo de resistencia a la oxacilina puede no afectar sustancialmente al resto de los β-lactámicos. Con independencia de este hecho, las cepas de estafilococo resistentes a la oxacilina o a la cefoxitina deben considerarse siempre resistentes a todos los β-lactámicos (excepciones: ceftobiprol y ceftarolina). La cefoxitina es buen predictor de la resistencia a la oxacilina.
En las cepas con el fenotipo MLSB inducible, la eritromicina induce el mecanismo de resistencia lo que implica resistencia a todos los antibióticos del grupo MLSB. Estas cepas se deben considerar como resistentes a los antibióticos MLSB.
Beta-lactámicos. Un porcentaje muy reducido de cepas de Staphylococcus son sensibles en la actualidad a la penicilina. El fenotipo de resistencia más frecuente en este género incluye resistencia a penicilina y a ampicilina por producción de penicilinasa. Esta beta-lactamasa de clase A se inhibe por inhibidores de beta-lactamasas (ácido clavulánico, tazobactam, sulbactam) por lo que estas cepas son sensibles a las asociaciones de beta-lactámicos con inhibidores de beta-lactamasa. Las penicilinasas no hidrolizan a las penicilinas semisintéticas, como la oxacilina o la meticilina, ni tampoco a las cefalosporinas ni a las carbapenemas.
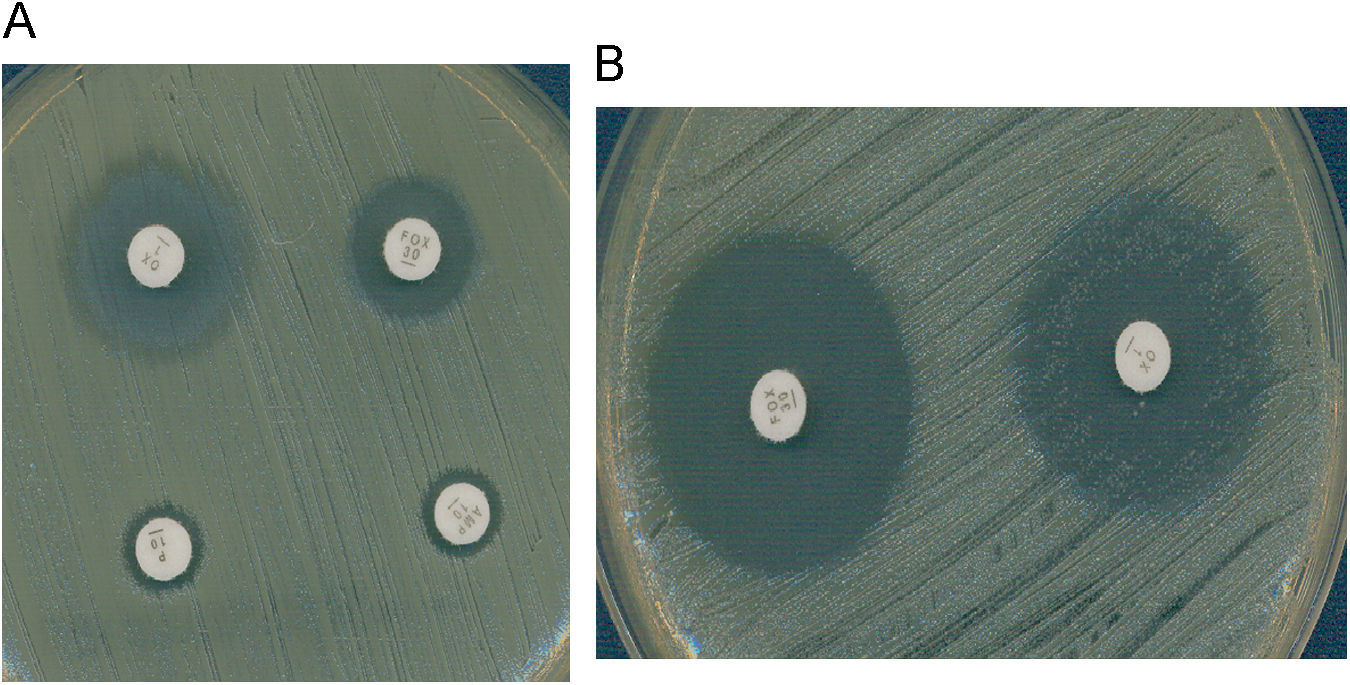
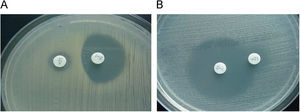
Es también muy frecuente en Staphylococcus el fenotipo de resistencia a la meticilina (y a la oxacilina) por la adquisición del gen mecA que codifica la proteína fijadora de penicilina (PBP) PBP2a, que posee baja afinidad por los beta-lactámicos. La resistencia a la meticilina en estafilococos mediada por el gen mecA implica resistencia a todas las penicilinas, cefalosporinas (con la excepción de las dos nuevas cefalosporinas, ceftobiprole y ceftarolina)1,2, carbapenemas y asociaciones de beta-lactámico con inhibidor de beta-lactamasa. Este mecanismo de resistencia se detecta en el laboratorio utilizando discos de cefoxitina de 30μg. En el caso de S. aureus y de S. lugdunensis, un halo de ≤21mm indica la presencia del gen mecA. En el caso de otros estafilococos coagulasa negativa (ECN), un halo de ≤24mm indica la presencia de este gen3. La expresión fenotípica de la resistencia a meticilina puede ser heterogénea (CMI de oxacilina: 1–16μg/ml) u homogénea (CMI >16μg/ml). Las cepas con expresión heterogénea se caracterizan porque solo una pequeña proporción de la población (≤0,1%) sobrevive con concentraciones de oxacilina superiores a 10μg/ml, mientras que la mayor parte de la población muere con bajas concentraciones del antibiótico (1–5μg/ml). Estas cepas se caracterizan porque presentan gran heterogeneidad en el tamaño de las colonias cuando crecen en agar. En las cepas con expresión homogénea, la mayor parte de la población expresa la resistencia y el tamaño de las colonias es también homogéneo (fig. 1). Se ha demostrado que es posible la transformación de una expresión heterogénea en una expresión homogénea de la resistencia a meticilina, fenómeno que se asocia a la selección de mutaciones cromosómicas y de reorganizaciones genéticas o a un incremento en la producción de la PBP2a. En ocasiones, las cepas con resistencia heterogénea se manifiestan como resistentes a oxacilina pero sensibles a otros antibióticos beta-lactámicos in vitro. Sin embargo, debido a la resistencia cruzada con otros beta-lactámicos, estas cepas deben considerarse e informarse como resistentes a todos ellos4. La actividad de las nuevas cefalosporinas, ceftobiprol y ceftarolina, frente a cepas de estafilococo resistentes a la oxacilina (mecA positivas) se debe a su gran afinidad por la PBP2a1,2. Existen cepas de S. aureus con resistencia de bajo nivel o resistencia borderline a la oxacilina (borderline-oxacillin-resistant S. aureus o BORSA) que se caracterizan por presentar una resistencia intermedia a la oxacilina y valores de CMI de este antibiótico en el rango 1–8μg/ml. Si estas cepas son resistentes a cefoxitina (y mecA positivas), entonces se deben considerar resistentes a todos los beta-lactámicos, con las excepciones anteriormente citadas. Si, por el contrario, estas cepas son sensibles a la cefoxitina (y mecA negativas), el mecanismo probablemente sea debido a la hiperproducción de la beta-lactamasa estafilocócica o a la modificación (hiperproducción o alteración) de las PBP 1, 2 o 4 de S. aureus. Aunque, a priori, la oxacilina es eficaz en el tratamiento de infecciones causadas por cepas borderline mecA negativas, la eficacia se ha demostrado solamente en aquellas cuya CMI no es superior a 2μg/ml. En un estudio reciente5 se observa su baja eficacia en el caso de que las CMI de oxacilina sean ≥4μg/ml.
Cefoxitina como marcador de resistencia mediada por mecA. A) S. aureus con resistencia heterogénea a la oxacilina (mecA+); CMI oxacilina 4μg/ml. Se observa resistencia a la cefoxitina. B) Borderline oxacillin-resistant S. aureus (BORSA) (mecA-); CMI oxacilina 4μg/ml. Se observa sensibilidad a la cefoxitina.
El CLSI ha establecido un punto de corte de resistencia de S. aureus y S. lugdunensis para la oxacilina (CMI ≥4μg/ml) diferente al de otros ECN (CMI ≥0,5μg/ml)3. En la actualidad, el CLSI recomienda determinar la sensibilidad (dilución o difusión con discos) a la cefoxitina y a la oxacilina. Como ya se ha indicado anteriormente, la cefoxitina es un marcador de la presencia del gen mecA ya que es un inductor más potente del sistema de regulación de mecA que las penicilinas con lo cual mejora la expresión del gen y permite detectar mejor esta resistencia, especialmente en cepas heterorresistentes. Las cepas de S. aureus y S. lugdunensis se consideran sensibles a la cefoxitina (y por tanto, a la oxacilina) si la CMI de cefoxitina es ≤4μg/ml o el diámetro del halo de cefoxitina es ≥22mm y resistentes, si la CMI es ≥8μg/ml o el halo es ≤21mm. En el caso de otros ECN, los puntos de corte para la difusión con el disco de cefoxitina son diferentes y se consideran sensibles si el halo es ≥25mm, y resistentes si es ≤24mm3. La utilización del disco de cefoxitina tiene una mayor especificidad e igual sensibilidad que el disco de oxacilina en ECN. Por último, el uso de medios cromogénicos selectivos para el aislamiento de S. aureus resistente a la meticilina ha demostrado elevada sensibilidad y especificidad y son de utilidad en los estudios epidemiológicos.
Macrólidos, lincosamidas y estreptograminas B (MLSB). Los antibióticos del grupo MLS presentan diferencias estructurales, pero poseen mecanismos de acción y de resistencia muy relacionados. En bacterias grampositivas, se han descrito 4 mecanismos de resistencia a antibióticos MLS:
1) modificación de la diana (ARNr 23S) por la acción de metilasas codificadas por genes erm principalmente (y en raras ocasiones por el gen cfr); 2) expulsión activa del antibiótico relacionado con diferentes genes (mef[A], mef[E], msr[A], msr[B], erp[B]); 3) inactivación del antibiótico (genes lnu[A], lnu[B], lnu[C], vat, vgb, y mph[C]), y 4) modificación de la diana por mutación del ARNr 23S y/o proteínas ribosomales.
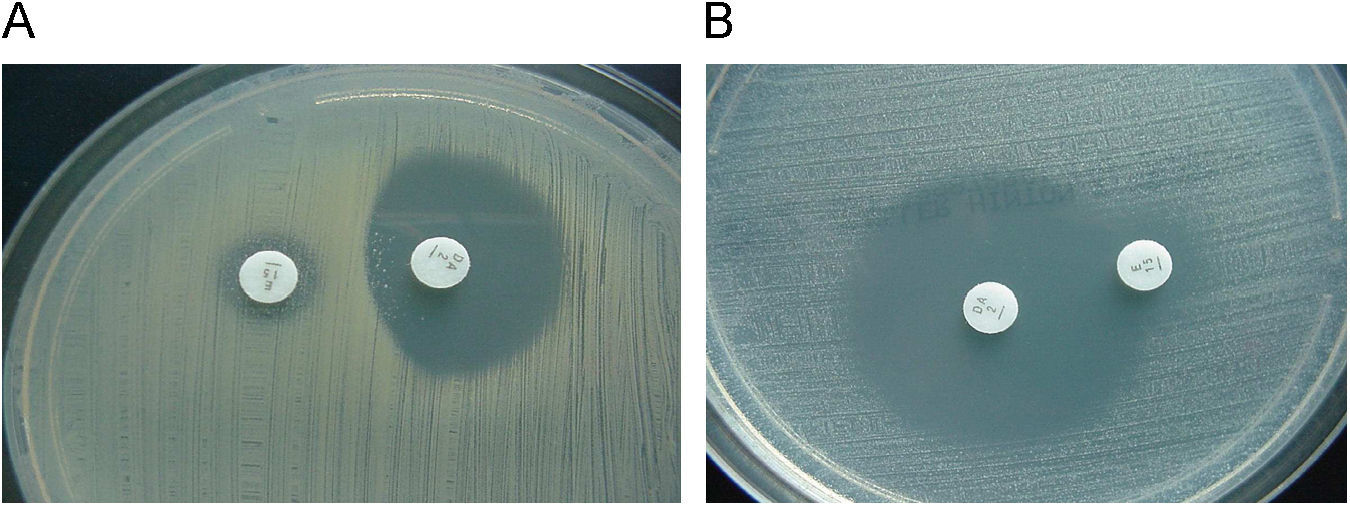
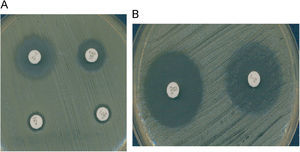
La presencia de genes erm generalmente confiere un fenotipo de resistencia denominado MLSB (resistencia a macrólidos de 14, 15 y 16 átomos, lincosamidas y estreptograminas del grupo B) y este fenotipo puede ser de expresión constitutiva o inducible (cMLSB o iMLSB). En las cepas con fenotipo iMLSB, la eritromicina induce la expresión del mecanismo de resistencia. Por ello, si se estudia la sensibilidad de estas cepas a macrólidos de 16 átomos, clindamicina y estreptograminas del grupo B en ausencia de eritromicina, se manifestarán como sensibles a estos antibióticos, pero deben informarse como resistentes, ya que poseen el mecanismo de resistencia que se puede inducir in vivo y conducir a fracasos terapéuticos, como se ha demostrado con la utilización de clindamicina en cepas con este mecanismo de resistencia. La inducción de la resistencia por la eritromicina se puede detectar en el laboratorio mediante el test del doble disc o con eritromicina y clindamicina (D-test) a una distancia de 15 o 20 mm de modo que se observe un achatamiento del halo de inhibición (fig. 2). También se puede detectar esta inducción por el método de microdilución utilizando la combinación en el mismo pocillo de eritromicina (4μg/ml )+clindamicina (0,5μg/ml) y realizar la lectura tras una incubación de 18h6. El fenotipo de resistencia a macrólidos más frecuente en Staphylococcus es el iMLSB, y con menor frecuencia el fenotipo cMLSB, cuyos perfiles de resistencia son similares a los que se describen en Streptococcus (ver más adelante). El fenotipo MLSB en Staphylococcus está relacionado con la expresión del gen erm(A), aunque también se han descrito cepas con fenotipo MLSB portadoras del gen erm(B) y erm(C) y ocasionalmente con los genes erm(Y) o erm(TR) (subtipo del erm(A)). Otro fenotipo que se puede detectar en las cepas de S. aureus es el denominado MS (resistencia a macrólidos de 14 y 15 átomos y a estreptograminas B pero no a clindamicina ni a macrólidos de 16 átomos), debido a un mecanismo de expulsión activa codificado principalmente por el gen msr(A) y en menor frecuencia por los genes msr(B) o erp(A). Fenotipos que se pueden detectar, pero que son infrecuentes son: L, LSA, SA y SB (resistencia a lincosamidas y estreptograminas del grupo A y B, respectivamente) por mecanismos de inactivación, por mecanismos de expulsión activa del antibiótico o por modificación de la diana. La inactivación se debe principalmente a lincosamida-nucleotidiltranferasas codificadas por 3 genes lnu(A), lnu(B) y lnu(C), mientras que la modificación de la diana se debe a una metilasa codificada por el gen cfr que conduce a una resistencia combinada a clindamicina, cloranfenicol o florfenicol y a oxazolidinonas7 (tabla 1).
Staphylococcus: resistencia a macrólidos y clindamicina. A) Estafilococo con resistencia inducible a la clindamicina (D-test positivo). Esta cepa se debe informar como resistente a la clindamicina o indicar que se trata de resistencia inducible. B) Estafilococo con resistencia mediada por una bomba de expulsión activa (D-test negativo). Sensible a la clindamicina y resistente a la eritromicina.
Aminoglucósidos. El fenotipo sensible es el más frecuente en Staphylococcus. Los fenotipos de resistencia coinciden bastante bien con los fenotipos que posteriormente se comentarán al considerar la resistencia de alto nivel en Enterococcus aunque en Staphylococcus no se han detectado las enzimas APH(2″)-Ib, Ic y Id (tabla 1). Entre los mecanismos de resistencia a aminoglucósidos, el más frecuente es el mediado por el gen aac(6′)-aph(2″) que se detecta principalmente en cepas de S. aureus resistentes a la meticilina. Este gen proporciona resistencia a todos los aminoglucósidos utilizados generalmente en la práctica clínica con la excepción de la estreptomicina. En presencia de este gen, muy frecuentemente las cepas aparecen como resistentes a la gentamicina y a la tobramicina y sensibles a la amikacina cuando se realiza un antibiograma por difusión con discos. Del mismo modo, los valores de CMI de gentamicina suelen ser superiores a los de tobramicina y en ocasiones pueden aparecer CMI de amikacina y netilmicina en el rango de sensibilidad, pero deben considerarse e informarse como resistentes. Otro mecanismo de resistencia bastante frecuente en las cepas de S. aureus resistente a la meticilina aisladas en los hospitales españoles es el mediado por la enzima ANT(4′) (4″). Se trata de cepas sensibles a la gentamicina y resistentes a la amikacina, tobramicina y kanamicina. En el antibiograma, el mejor marcador para detectar la producción de esta enzima es determinar la sensibilidad a la tobramicina ya que estas cepas pueden aparecer como intermedias o sensibles a la amikacina tanto por la técnica de difusión con discos como por la de dilución. Tanto en el caso de la enzima bifuncional AAC(6′)-APH(2″) como de la enzima ANT(4′)(4″), las cepas deben informarse siempre como resistentes a la tobramicina y a la amikacina. Las cepas de Staphylococcus también pueden presentar resistencia a estreptomicina (por la enzima ANT[6]) o bien a kanamicina y amikacina (por la enzima APH[3′]-III).
Quinolonas. El principal mecanismo de resistencia a fluoroquinolonas en Staphylococcus consiste en mutaciones en las dianas de acción del antibiótico, en concreto en la ADN topoisomerasa IV (GrlA y GrlB) y en la ADN-girasa (GyrA y GyrB). Asimismo, la resistencia puede estar ocasionada por mutaciones en el gen norA, responsable de un mecanismo de expulsión activa. Existen importantes diferencias en la actividad de las distintas fluoroquinolonas frente a Staphylococcus. No todos los compuestos tienen la misma potencia frente a la ADN-girasa y la topoisomerasa IV. Las mutaciones responsables de la resistencia se suelen producir primero en los genes que codifican la diana primaria de Staphylococcus (para la mayoría de compuestos la topoisomerasa IV, GrlA) y a continuación la diana secundaria (habitualmente la ADN-girasa, GyrA), contribuyendo estas últimas a incrementar el nivel de resistencia. Entre las fluoroquinolonas disponibles las menos activas son norfloxacino y ciprofloxacino, seguidas de ofloxacino, levofloxacino y esparfloxacino y de moxifloxacino y gemifloxacino, siendo estas 2 últimas las que presentan mayor actividad frente a estafilococos.
Glucopéptidos. Las cepas de Staphylococcus han mantenido en general una elevada sensibilidad a los glucopéptidos, de manera que lo más frecuente es detectar cepas sensibles a vancomicina y a teicoplanina. Sin embargo, en 1997 se describió en Japón la presencia de cepas de S. aureus con sensibilidad disminuída a vancomicina (CMI en el rango 4–8μg/ml) y este tipo de cepas se han aislado posteriormente en otros lugares geográficos (Estados Unidos, Europa, Hong Kong, Corea y España). Estas cepas se denominaron vancomycin-intermediate S. aureus (VISA). Las cepas VISA presentan también sensibilidad disminuida o resistencia a la teicoplanina, por lo que hoy en día suele utilizarse el término de glycopeptide- intermediate S. aureus (GISA, ‘S. aureus con sensibilidad intermedia a glicopéptidos’). Las cepas GISA se aíslan con una frecuencia muy baja y generalmente después de un tratamiento prolongado con glucopéptidos. Se han observado 2 tipos de expresión de la resistencia a glucopéptidos en Staphylococcus: a) expresión homogénea (CMI de vancomicina 8–16μg/ml), y b) expresión heterogénea (CMI 1–4μg/ml). Con los puntos de corte establecidos por el CLSI para la detección de la resistencia3, algunas de estas cepas quedarían clasificadas como sensibles a glucopéptidos y, a lo sumo, como intermedias a vancomicina y a teicoplanina. La técnica del antibiograma por difusión con discos no permite diferenciar cepas S. aureus sensibles a vancomicina de cepas VISA ni tampoco distinguir cepas de ECN resistentes a glucopéptidos, por lo que es recomendable siempre realizar un antibiograma por microdilución o mediante Etest, aunque hay que tener en cuenta que las CMI obtenidas mediante Etest suelen ser una dilución superior a las obtenidas por microdilución. Las cepas hetero-GISA son más frecuentes que las que poseen una expresión homogénea. Se ha documentado la escasa estabilidad del fenotipo GISA en ausencia de glucopéptidos, de manera que, con frecuencia, las cepas GISA revierten al fenotipo sensible tras sucesivos subcultivos en medios no suplementados con glucopéptidos. El mecanismo de resistencia en las cepas GISA se debe a una alteración de la estructura del peptidoglicano y un engrosamiento de la pared celular que determina un secuestro del glucopéptido, impidiendo su unión sobre los restos de D-alanina-D-alanina, diana de actuación de este grupo de antibióticos. Asimismo, se ha observado que los aislamientos GISA presentan un aumento de la expresión de PBP2 y/o PBP2a. La daptomicina en principio es activa frente a cepas GISA ya que su diana es la membrana citoplasmática; sin embargo, se observa una disminución de la sensibilidad a la daptomicina en cepas GISA debido probablemente a la dificultad para alcanzar su diana de acción.
En el año 2002, se detectó la primera cepa de S. aureus resistente a vancomicina por el mecanismo transferible vanA8 y posteriormente ha habido alguna descripción más de este tipo de cepas en EEUU y Asia. Por el momento, las cepas de S. aureus resistente a vancomicina por el mecanismo vanA son excepcionales, aunque dada su relevancia clínica, hay que estar alerta ante la posible emergencia de las mismas. Las cepas con este mecanismo de resistencia son sensibles a la daptomicina. Finalmente, no todas las cepas de S. aureus resistente a vancomicina detectadas hasta ahora portan el gen vanA. Hay hipótesis que sugieren que el responsable de la resistencia a vancomicina en estos casos es el engrosamiento de la pared celular.
Mupirocina. El CLSI no define puntos de corte para interpretar la sensibilidad a este antibiótico. Se pueden distinguir 2 fenotipos de resistencia: 1) resistencia de bajo nivel (CMI 8–256μg/ml) producida por mutaciones en el gen nativo ileS; 2) resistencia de alto nivel (CMI ≥512μg/ml) por adquisición de un plásmido que contiene el gen mupA. En el primer caso, aunque inicialmente se consideró que es una resistencia clínicamente irrelevante, hay que tener en cuenta que estas cepas sí que presentan problemas a la hora de utilizar la mupirocina para descolonización nasal. En cuanto a la resistencia de alto nivel, este antibiótico resulta totalmente ineficaz. Para diferenciar entre estos 2 fenotipos preferentemente se debe determinar la CMI. Para la detección de la resistencia a mupirocina con la técnica de disco-placa se utilizan discos de 5μg (sensible halo ≥14mm; resistente halo <14mm). La utilización de discos de 20μg permite diferenciar de un modo bastante fiable las cepas sensibles (halo ≥17mm) de las que presentan resistencia de bajo nivel (halo 6–16mm) y de las que presentan resistencia de alto nivel (halo 0mm). La utilización de discos de 200μg no permite diferenciar entre cepas sensibles o con resistencia de bajo nivel9.
Tetraciclina. La resistencia a tetraciclina y doxiciclina en Staphylococcus es bastante frecuente y puede ser debida a 2 mecanismos: aumento de la expulsión activa y protección del ribosoma. El primer mecanismo está codificado por los genes tetK y tetL y el segundo por los genes tetM y tetO. La resistencia mediada por tetK afecta solo a la tetraciclina, mientras que la mediada por tetM implica resistencia cruzada a tetraciclina, doxiciclina y minociclina, por lo que la resistencia a tetraciclina no siempre implica resistencia a otras tetraciclinas y no se puede utilizar como marcador de resistencia a todo el grupo.
Linezolid. La resistencia a este antibiótico se ha observado tanto in vivo como in vitro en Staphylococcus aunque todavía se trata de un fenómeno muy poco frecuente que generalmente se ha producido en pacientes con tratamientos prolongados con este antimicrobiano, por diseminación de clones resistentes en unidades hospitalarias, o por diseminación de transposones o plásmidos que contienen el gen cfr. Se han descrito 3 tipos de resistencia a oxazolidinonas: a) mutaciones nucleotídicas en el dominio V del ARNr 23S (muy diversas, pero fundamentalmente Gly2447Thr, Thr2500Ala y Gly2576Thr, siendo esta última la más frecuente). Este es también el mecanismo de resistencia más frecuente y los niveles de resistencia aumentan en función del número de copias del gen ARNr 23S afectadas; b) la adquisición del gen cfr que codifica la producción de una metiltransferasa ribosómica, y que confiere resistencia a 5 clases de antimicrobianos (fenicoles, lincosamidas, oxazolidinonas, pleuromutilinas y estreptogramina A); y c) mutaciones en los genes que codifican las proteínas L3 y L4 de la subunidad ribosómica 50S, que son poco frecuentes7,10,11. En el primer caso generalmente se observan elevadas CMIs de linezolid (>32μg/ml), pero en el caso de la resistencia mediada por el gen cfr algunas cepas pueden presentar CMI en el rango de sensibilidad (4μg/ml); por ello, siempre que se sospeche la resistencia a linezolid es necesario analizar conjuntamente los resultados de sensibilidad al resto de antimicrobianos afectados por este mecanismo de resistencia.
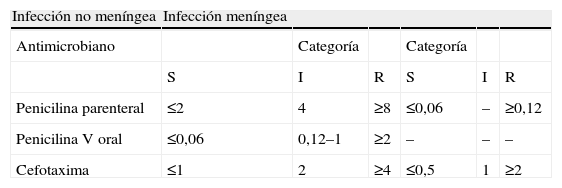
Género StreptococcusStreptococcus pneumoniae (tablas 2a y b).Beta-lactámicos. Con respecto a los beta-lactámicos, los fenotipos más frecuentes en S. pneumoniae son los siguientes (tabla 2a): A) Sensibilidad a todos los antibióticos β-lactámicos, en cuyo caso no existe ningún mecanismo de resistencia; B) Sensibilidad disminuida a penicilina (CMI 0,12–1μg/ml, categoría intermedia) y sensibilidad a cefotaxima (CMI ≤0,5μg/ml); C) Resistencia a penicilina (CMI ≥2μg/ml) y sensibilidad a cefotaxima (CMI ≤0,5μg/ml); D) Resistencia a penicilina (CMI ≥2μg/ml) y sensibilidad disminuida o resistencia a cefotaxima (CMI 1–≥2μg/ml); y E) Sensibilidad o sensibilidad disminuída a penicilina (CMI 0,12–0,5μg/ml) y resistencia a cefotaxima (CMI ≥4μg/ml). La utilización de un disco de oxacilina de 1μg permite diferenciar entre el fenotipo sensible y los restantes, de modo que cuando el halo de inhibición es ≥20mm (sensible) no existe ningún mecanismo de resistencia y cuando este es ≤19mm (resistente), indica la presencia de algún mecanismo de resistencia (fenotipos B, C, D o E). No obstante, aunque el disco de oxacilina sirve como marcador de sensibilidad a los beta-lactámicos, no se debe utilizar como marcador de resistencia clínica ya que según el reciente cambio realizado por el CLSI3, en los puntos de corte de los beta-lactámicos frente a neumococo cuando la CMI de penicilina es ≤2μg/ml, las cepas se consideran sensibles y se pueden tratar por vía parenteral con penicilina (12 millones de unidades por día), además de considerarse también sensibles a ampicilina (parenteral), amoxicilina, amoxicilina-clavulánico, cefotaxima, ceftriaxona, cefepima y ertapenem y estas cepas serían resistentes a la oxacilina. Sin embargo, en el caso de los neumococos aislados de líquido cefalorraquídeo, la utilización del disco de oxacilina sirve como marcador de sensibilidad y también de resistencia clínica ya que en este caso se consideran cepas con sensibilidad intermedia a la penicilina aquellas frente a las cuales la CMI de penicilina es de 0,12–1μg/ml y serían resistentes a la oxacilina. Del mismo modo, la CMI de penicilina predice la sensibilidad del neumococo a otros beta-lactámicos siempre que no sean cepas aisladas de líquido cefalorraquídeo. Así, cuando esta es de ≤0,06μg/ml indica sensibilidad a todos los beta-lactámicos. En cualquier caso, siempre que exista resistencia a la oxacilina por difusión con disco de 1μg (halo ≤19mm) se deben determinar al menos las CMI de penicilina y cefotaxima mediante microdilución o mediante Etest. No obstante, es preferible utilizar el método de microdilución y tener en cuenta que cuando se determinan las CMI por el método de Etest, las CMI de penicilina y cefotaxima obtenidas suelen ser una dilución más baja que las obtenidas por el de microdilución que es el método de referencia. En los neumococos aislados de sangre o de otros orígenes, se debe informar la sensibilidad utilizando los criterios no meníngeos y además se debe añadir al informe una nota en la que se indique la sensibilidad de la cepa por criterios meníngeos (tabla 2b) para poder aplicarlos en caso de que el paciente desarrollara una meningitis en el curso de otra infección neumocócica extrameníngea.
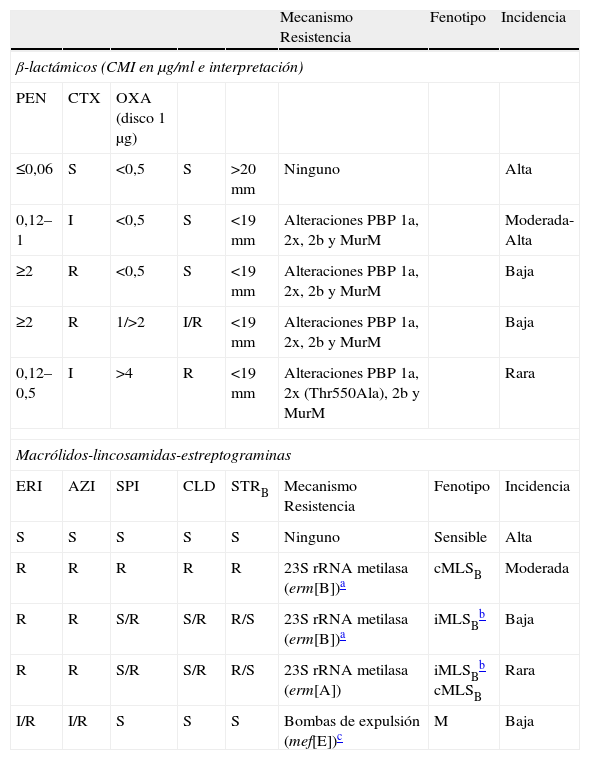
Fenotipos y mecanismos de resistencia en Streptococcus pneumoniae
| Mecanismo Resistencia | Fenotipo | Incidencia | |||||
| β-lactámicos (CMI en μg/ml e interpretación) | |||||||
| PEN | CTX | OXA (disco 1μg) | |||||
| ≤0,06 | S | <0,5 | S | >20mm | Ninguno | Alta | |
| 0,12–1 | I | <0,5 | S | <19mm | Alteraciones PBP 1a, 2x, 2b y MurM | Moderada-Alta | |
| ≥2 | R | <0,5 | S | <19mm | Alteraciones PBP 1a, 2x, 2b y MurM | Baja | |
| ≥2 | R | 1/>2 | I/R | <19mm | Alteraciones PBP 1a, 2x, 2b y MurM | Baja | |
| 0,12–0,5 | I | >4 | R | <19mm | Alteraciones PBP 1a, 2x (Thr550Ala), 2b y MurM | Rara | |
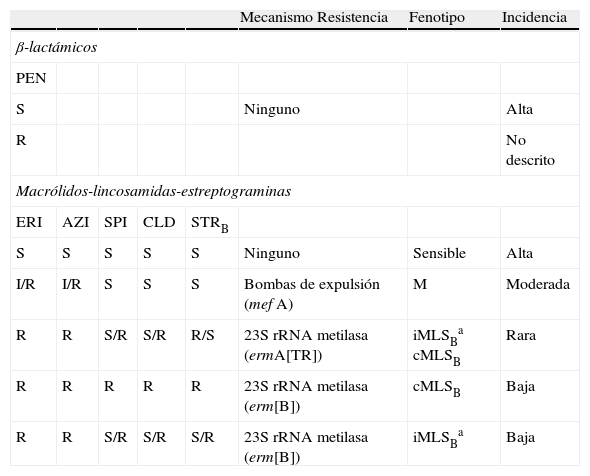
| Macrólidos-lincosamidas-estreptograminas | |||||||
| ERI | AZI | SPI | CLD | STRB | Mecanismo Resistencia | Fenotipo | Incidencia |
| S | S | S | S | S | Ninguno | Sensible | Alta |
| R | R | R | R | R | 23S rRNA metilasa (erm[B])a | cMLSB | Moderada |
| R | R | S/R | S/R | R/S | 23S rRNA metilasa (erm[B])a | iMLSBb | Baja |
| R | R | S/R | S/R | R/S | 23S rRNA metilasa (erm[A]) | iMLSBb cMLSB | Rara |
| I/R | I/R | S | S | S | Bombas de expulsión (mef[E])c | M | Baja |
AMC: amoxicilinaácido clavulanico; AMK: amikacina; AMP: ampicilina; AZI: azitromicina; CEF: cefazolina; CLD: clindamicina; CTX: cefotaxima; DOX: doxiciclina; ECN: Stapylococcus coagulasa negativo; ERI: eritromicina; FOX: cefoxitina; GEN: gentamicina; I: intermedio; KAN: kanamicina; NET: netilmicina; OXA: oxacilina; PEN: penicilina; R: resistente; SPI: espiramicina; S: sensible; s: sensibilidad disminuida; STGA: estreptogramina del grupo A; STGB: estreptogramina del grupo B; STR: estreptomicina; TEI: teicoplanina; TET: tetraciclina; TOB: tobramicina; VAN: vancomicina.
Interpretación de las CMI de penicilina y cefotaxima (μg/ml) para S. pneumoniae según criterios del Clinical and Laboratory Standards Institute (CLSI 2009)
| Infección no meníngea | Infección meníngea | |||||
| Antimicrobiano | Categoría | Categoría | ||||
| S | I | R | S | I | R | |
| Penicilina parenteral | ≤2 | 4 | ≥8 | ≤0,06 | – | ≥0,12 |
| Penicilina V oral | ≤0,06 | 0,12–1 | ≥2 | – | – | – |
| Cefotaxima | ≤1 | 2 | ≥4 | ≤0,5 | 1 | ≥2 |
En S. pneumoniae, la sensibilidad disminuida y la resistencia a los betalactámicos están relacionadas con mutaciones en los genes que codifican las PBP. Las alteraciones de las PBP 1a, 2x y 2b son las que tienen mayor implicación en el desarrollo de resistencia. Las producidas en la PBP2b son las responsables de la resistencia a penicilina, mientras que las modificaciones en la PBP1a y PBP2x están más relacionadas con la resistencia a las cefalosporinas. La expresión de esta resistencia requiere la presencia de un gen murM funcional involucrado en la síntesis de un sustrato fisiológico alternativo para las PBPs12. En los últimos años, se ha observado en España una cierta disminución de la resistencia a los beta-lactámicos debido probablemente en parte a la introducción de la vacuna heptavalente neumocócica. Durante el periodo 2004–2007, el 24,7% de las 7.417 cepas invasivas de neumococo analizadas en el centro de referencia de neumococos fueron no sensibles a la penicilina (CMI ≥0,12μg/ml). Entre estas, el 67,7% pertenecían a los serotipos incluidos en la vacuna heptavalente neumocócica13. En un estudio multicéntrico realizado en nuestro país en 2004 en el que participaron 147 centros, el 42% de las cepas de S. pneumoniae fueron no sensibles a la penicilina (aplicando los puntos de corte para meningitis, 23% intermedias y 19% resistentes). Sin embargo, utilizando los criterios de punto de corte no meníngeos (CMI ≤2μg/ml sensible), menos del 10% de las cepas fueron resistentes a la penicilina y entre las cepas invasivas el 98% fueron sensibles a la penicilina y el 100% fueron sensibles a la cefotaxima (CMI ≤1μg/ml). Actualmente, son muy poco frecuentes las cepas invasivas con CMI de penicilina >2μg/ml14. En este estudio, los serotipos más frecuentemente aislados fueron el 3, 19F y 19A y las cepas no sensibles a la penicilina generalmente estaban asociadas a los serotipos 6B, 9V, 14, 19A, 19F, 23F y 35B.
MLSB. La resistencia de S. pneumoniae a macrólidos, lincosamidas, y estreptograminas se debe a: A) modificación enzimática de la diana ribosómica (genes erm, que codifican la producción de metilasas que metilan el 23S ARNr e impiden la unión de estos antibióticos a su diana); B) la presencia de bombas de expulsión activa codificadas por los genes mef (mefE, mefA y mefL) que disminuyen la concentración intracitoplasmática del antibiótico; y C) modificación de la diana ribosómica debido a mutaciones en los genes que codifican las proteínas ribosómicas L4 y L22 o por alteraciones en el ARNr, mecanismo que es muy poco frecuente y que confiere resistencia elevada a eritromicina y a clindamicina. En el primer caso se han descrito 2 tipos de metilasas en neumococo, la ErmB (que es el mecanismo de resistencia a macrólidos más frecuente en nuestro país) y la ErmA (muy poco frecuente). Estas metilasas confieren el fenotipo de resistencia MLSB que puede ser constitutivo o inducible. Ambos fenotipos implican resistencia a todos los macrólidos, lincosamidas y estreptograminas B, pero mientras que en el fenotipo constitutivo se observa resistencia a todos los macrólidos, lincosamidas y estreptograminas B en el antibiograma, en el inducible las cepas aparecen falsamente sensibles a macrólidos de 16 átomos de carbono y a clindamicina. Por ello, siempre que se observe este patrón es necesario realizar un antibiograma mediante la técnica de difusión con disco colocando los discos de eritromicina y clindamicina enfrentados y separados una distancia aproximada de 12mm o mediante tiras de Etest de eritromicina y clindamicina ligeramente separadas para observar la inducibilidad de la resistencia a clindamicina en presencia de eritromicina. La inducibilidad demuestra la presencia de genes erm y por tanto, implica resistencia de tipo MLSB (fig. 2 de Staphylococus).
La presencia de un sistema de expulsión activa confiere el fenotipo de resistencia denominado M que se caracteriza por resistencia a macrólidos de 14 y 15 átomos (eritromicina, claritromicina y azitromicina), pero sensibilidad a macrólidos de 16 átomos (espiramicina, josamicina, entre otros), lincosamidas, estreptograminas y cetólidos. En este caso no se observa inducibilidad de la resistencia a clindamicina en presencia de eritromicina. En neumococo la bomba de expulsión más frecuente es la mediada por mefE, pero las CMIs de eritromicina son más elevadas cuando la bomba está codificada por el gen mefA. En general, en las cepas con fenotipo MLSB las CMIs de eritromicina son superiores que en cepas con fenotipo M.
En España, la frecuencia de cepas resistentes a macrólidos ha ido aumentando en las 2 últimas décadas hasta el 35–50% en cepas no invasivas y hasta el 20–30% en cepas invasivas y se ha asociado con un aumento en el consumo de macrólidos aunque también a la diseminación de la resistencia mediante transposones conjugativos. No obstante, en el periodo 2004–2007 se ha observado una disminución de la frecuencia de cepas invasivas con resistencia a macrólidos13,14.
Las distintas especies de Streptococcus presentan diferencias en cuanto a la frecuencia de los fenotipos MLSB y M y también en cuanto a los genes de resistencia relacionados con estos fenotipos. En España, el fenotipo de resistencia más frecuente en S. pneumoniae es el MLSB asociado generalmente al gen erm(B). En un estudio multicéntrico publicado recientemente, el 35% de las cepas de neumococo fueron resistentes a la eritromicina y el 87,2% presentaron el fenotipo MLSB (94,5% contenían el gen erm(B) y 5,5% los genes erm(B) y mef(E)). En el mismo estudio, el 12,8% de las cepas presentaban el fenotipo M (87,5% con el gen mef(E) y 12,5% el gen mef(A)15.
Es de destacar que en los últimos años se ha producido un aumento significativo del fenotipo M ya que en la década anterior solamente presentaban este fenotipo un 3–5% de las cepas de neumococo, mientras que actualmente las cifras oscilan entre el 10–15%, cifras similares a las observadas en EE.UU, donde un porcentaje relativamente elevado de cepas de S. pneumoniae resistentes a eritromicina presentan el fenotipo de resistencia M.
Quinolonas. En S. pneumoniae, la resistencia a quinolonas se debe principalmente a mutaciones producidas en las regiones determinantes de la resistencia a quinolonas y concretamente a mutaciones en los genes que codifican la topoisomerasa IV (parC y parE) y en los que codifican la ADN girasa (gyrA y gyrB) (ver anteriormente, Staphylococcus). Además, en esta especie se han descrito también bombas de expulsión activa que proporcionan un bajo nivel de resistencia y cuya expresión afecta más significativamente a las quinolonas hidrófilas. En cepas de S. pneumoniae, se recomienda determinar la sensibilidad a norfloxacino mediante difusión con disco de 10μg como método de cribado para detectar mutaciones de resistencia. Si el diámetro del halo de inhibición es inferior a 10mm o la CMI de norfloxacino es ≥16μg/ml, implica la presencia de mutaciones en parC/parE. Del mismo modo, la sensibilidad a este antimicrobiano implica sensibilidad a todas las fluoroquinolonas16. Así, se pueden encontrar 3 fenotipos de sensibilidad/resistencia a quinolonas: a) El fenotipo sensible en el que las cepas son sensibles a norfloxacino, ciprofloxacino y levofloxacino y que implica sensibilidad a todas las nuevas fluoroquinolonas; b) El fenotipo con bajo nivel de resistencia a fluoroquinolonas, en el que las cepas son resistentes a norfloxacino, presentan cierta sensibilidad o son resistentes a ciprofloxacino (CMI ≥4μg/ml) y son sensibles a levofloxacino (CMI ≤2μg/ml). En este caso, se debe alertar en el informe del antibiograma sobre el elevado riesgo de selección de mutantes de alta resistencia durante el tratamiento e indicar que no se deben utilizar fluoroquinolonas ya que, aunque las cepas sean sensibles a levofloxacino, existe alta posibilidad de fracaso terapéutico17, y c) El fenotipo con alto nivel de resistencia a fluoroquinolonas en el que se observa resistencia a norfloxacino, ciprofloxacino y levofloxacino y por tanto, las cepas son resistentes a todas las fluoroquinolonas. La resistencia de bajo nivel a ciprofloxacino (CMI 4–16μg/ml) se debe a mutaciones puntuales principalmente en parC, o también en parE, aunque también puede ser debida a la expresión de bombas de expulsión activa como se indicó anteriormente; mientras que la resistencia de alto nivel (CMI ≥32μg/ml) se debe a mutaciones en la topoisomerasa IV y ADN girasa. En España, la frecuencia de resistencia a fluoroquinolonas en neumococo se sitúa entre el 3–5%14. Recientemente se ha descrito una elevada incidencia de resistencia a fluoroquinolonas (10,5%) en cepas invasivas procedentes de pacientes infectados por el VIH y pertenecientes en su mayoría al serotipo 818.
Streptococcus pyogenes (tabla 3).Hasta la fecha no se ha descrito ninguna cepa de S. pyogenes con resistencia a penicilina ni tampoco a cefalosporinas ni carbapenemas. Por lo tanto, si se detecta una cepa resistente, debe confirmarse tanto la identificación del microorganismo como su sensibilidad y en caso de confirmación, remitirla a un centro de referencia.
Fenotipos y mecanismos de resistencia en Streptococcus pyogenes
| Mecanismo Resistencia | Fenotipo | Incidencia | |||||
| β-lactámicos | |||||||
| PEN | |||||||
| S | Ninguno | Alta | |||||
| R | No descrito | ||||||
| Macrólidos-lincosamidas-estreptograminas | |||||||
| ERI | AZI | SPI | CLD | STRB | |||
| S | S | S | S | S | Ninguno | Sensible | Alta |
| I/R | I/R | S | S | S | Bombas de expulsión (mef A) | M | Moderada |
| R | R | S/R | S/R | R/S | 23S rRNA metilasa (ermA[TR]) | iMLSBa cMLSB | Rara |
| R | R | R | R | R | 23S rRNA metilasa (erm[B]) | cMLSB | Baja |
| R | R | S/R | S/R | S/R | 23S rRNA metilasa (erm[B]) | iMLSBa | Baja |
AMC: amoxicilinaácido clavulanico; AMK: amikacina; AMP: ampicilina; AZI: azitromicina; CEF: cefazolina; CLD: clindamicina; CTX: cefotaxima; DOX: doxiciclina; ECN: Stapylococcus coagulasa negativo; ERI: eritromicina; FOX: cefoxitina; GEN: gentamicina; I: intermedio; KAN: kanamicina; NET: netilmicina; OXA: oxacilina; PEN: penicilina; R: resistente; SPI: espiramicina; S: sensible; s: sensibilidad disminuida; STGA: estreptogramina del grupo A; STGB: estreptogramina del grupo B; STR: estreptomicina; TEI: teicoplanina; TET: tetraciclina; TOB: tobramicina; VAN: vancomicina.
aEn los aislamientos con el fenotipo MLSB inducible, la eritromicina induce el mecanismo de resistencia lo que implica resistencia a todos los antibióticos del grupo MLSB. Estas cepas se deben considerar resistentes a los antibióticos MLSB.
Los fenotipos de resistencia en S. pyogenes para MLS son similares a los descritos para S. pneumoniae y su detección se realiza del mismo modo que en el caso del neumococo. Los dos genes responsables de la resistencia de tipo MLSB, el gen ermB y el ermA(TR) (resistencias constitutiva e inducible, respectivamente), se encuentran en transposones conjugativos. Las cepas con el gen ermB muestran alto nivel de resistencia a macrólidos y clindamicina y resistencia moderada a telitromicina, mientras que en las que presentan el gen ermA el nivel de resistencia a macrólidos es menor. En nuestro país, el fenotipo MLSB es mucho menos frecuente que el fenotipo M (asociado generalmente al gen mef[A]) por lo que las infecciones producidas por cepas con este fenotipo se pueden tratar con clindamicina o con macrólidos de 16 átomos de carbono. En el estudio nacional anteriormente indicado, el 20% de las cepas de S. pyogenes fueron resistentes a eritromicina y el 90% de estas presentaron el fenotipo M, a diferencia de lo que sucede en S. pneumoniae19. En S. pyogenes la resistencia a fluoroquinolonas se debe a los mismos mecanismos descritos en el caso de S. pneumoniae, siendo más frecuente la resistencia de bajo nivel a ciprofloxacino (CMI 2–8μg/ml) debido a mutaciones en parC, que la de alto nivel (CMI ≥16μg/ml) que es muy rara y es el resultado de mutaciones adicionales en gyrA. La utilización del disco de norfloxacino de 10μg permite detectar la resistencia de bajo nivel (halo <10mm). La contribución de la actividad de bombas de expulsión activa a la resistencia a fluoroquinolonas es mínima. En España, se ha descrito un aumento de la resistencia de bajo nivel a fluoroquinolonas en S. pyogenes (del 1,9% en 2005 al 30,8% en 2007) debido a la diseminación del clon emm6.4/T6/ST38220.
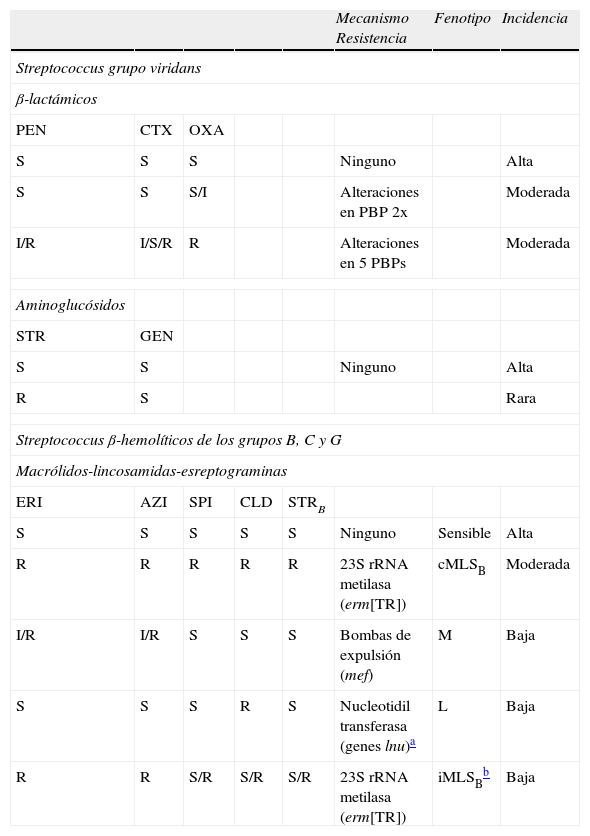
Otros StreptococcusCon respecto a los ß-lactámicos, el fenotipo más frecuente tanto en los estreptococos β-hemolíticos de los grupos B, C y G como en los estreptococos del grupo viridans, es el de sensibilidad a todos ellos. La sensibilidad a penicilina en estos estreptococos implica sensibilidad a todas las penicilinas, cefalosporinas y carbapenemas. Recientemente se han descrito cepas de S. agalactiae con resistencia a la penicilina (CMI 0,25–1μg/ml), la ampicilina, la cefotaxima (CMI 0,12–1μg/ml) y a otras cefalosporinas, debida a alteraciones en la PBP2x. Estas cepas se pueden detectar en el laboratorio utilizando discos de 30μg de ceftibuteno (<20mm, resistente)21. En los estreptococos del grupo viridans son también relativamente frecuentes los fenotipos que se detallan en la tabla 4. En este caso, se puede utilizar el disco de oxacilina de 1μg como marcador de sensibilidad (halo ≥20mm) a todos los β-lactámicos, pero no de resistencia ya que cepas resistentes a la oxacilina pueden ser sensibles a la penicilina.
Fenotipos y mecanismos de resistencia en otros Streptococcus
| Mecanismo Resistencia | Fenotipo | Incidencia | |||||
| Streptococcus grupo viridans | |||||||
| β-lactámicos | |||||||
| PEN | CTX | OXA | |||||
| S | S | S | Ninguno | Alta | |||
| S | S | S/I | Alteraciones en PBP 2x | Moderada | |||
| I/R | I/S/R | R | Alteraciones en 5 PBPs | Moderada | |||
| Aminoglucósidos | |||||||
| STR | GEN | ||||||
| S | S | Ninguno | Alta | ||||
| R | S | Rara | |||||
| Streptococcus β-hemolíticos de los grupos B, C y G | |||||||
| Macrólidos-lincosamidas-esreptograminas | |||||||
| ERI | AZI | SPI | CLD | STRB | |||
| S | S | S | S | S | Ninguno | Sensible | Alta |
| R | R | R | R | R | 23S rRNA metilasa (erm[TR]) | cMLSB | Moderada |
| I/R | I/R | S | S | S | Bombas de expulsión (mef) | M | Baja |
| S | S | S | R | S | Nucleotidil transferasa (genes lnu)a | L | Baja |
| R | R | S/R | S/R | S/R | 23S rRNA metilasa (erm[TR]) | iMLSBb | Baja |
AMC: amoxicilinaácido clavulanico; AMK: amikacina; AMP: ampicilina; AZI: azitromicina; CEF: cefazolina; CLD: clindamicina; CTX: cefotaxima; DOX: doxiciclina; ECN: Stapylococcus coagulasa negativo; ERI: eritromicina; FOX: cefoxitina; GEN: gentamicina; I: intermedio; KAN: kanamicina; NET: netilmicina; OXA: oxacilina; PEN: penicilina; R: resistente; SPI: espiramicina; S: sensible; s: sensibilidad disminuida; STGA: estreptogramina del grupo A; STGB: estreptogramina del grupo B; STR: estreptomicina; TEI: teicoplanina; TET: tetraciclina; TOB: tobramicina; VAN: vancomicina.
Tanto en S. agalactiae como en estreptococos de los grupos C, G y viridans el fenotipo más frecuente de resistencia a MLS es el MLSB asociado generalmente al gen erm(TR)22. En S. agalactiae recientemente se está observando un aumento del fenotipo de sensibilidad a macrólidos y estreptograminas B, pero resistencia a las lincosamidas por inactivación enzimática debida a nucleotidiltransferasas codificadas por los genes lnu. En cuanto a la resistencia a las fluoroquinolonas en S. agalactiae y estreptococos del grupo viridans, los fenotipos y mecanismos de resistencia son los mismos que los descritos en el caso de S. pyogenes y S. pneumoniae y se ha sugerido que los genes de resistencia a fluoroquinolonas en S. pneumoniae proceden de cepas de estreptococos del grupo viridans.
Se han descrito cepas de S. agalactiae y Streptococcus del grupo viridans con resistencia de alto nivel a estreptomicina y también cepas de Streptococcus beta-hemolítico del grupo G con resistencia de alto nivel a todos los aminoglucósidos de interés clínico; en estas cepas se han detectado los genes de las enzimas ANT(6), AAC(6′)-APH(2″) y APH(3′)-III.
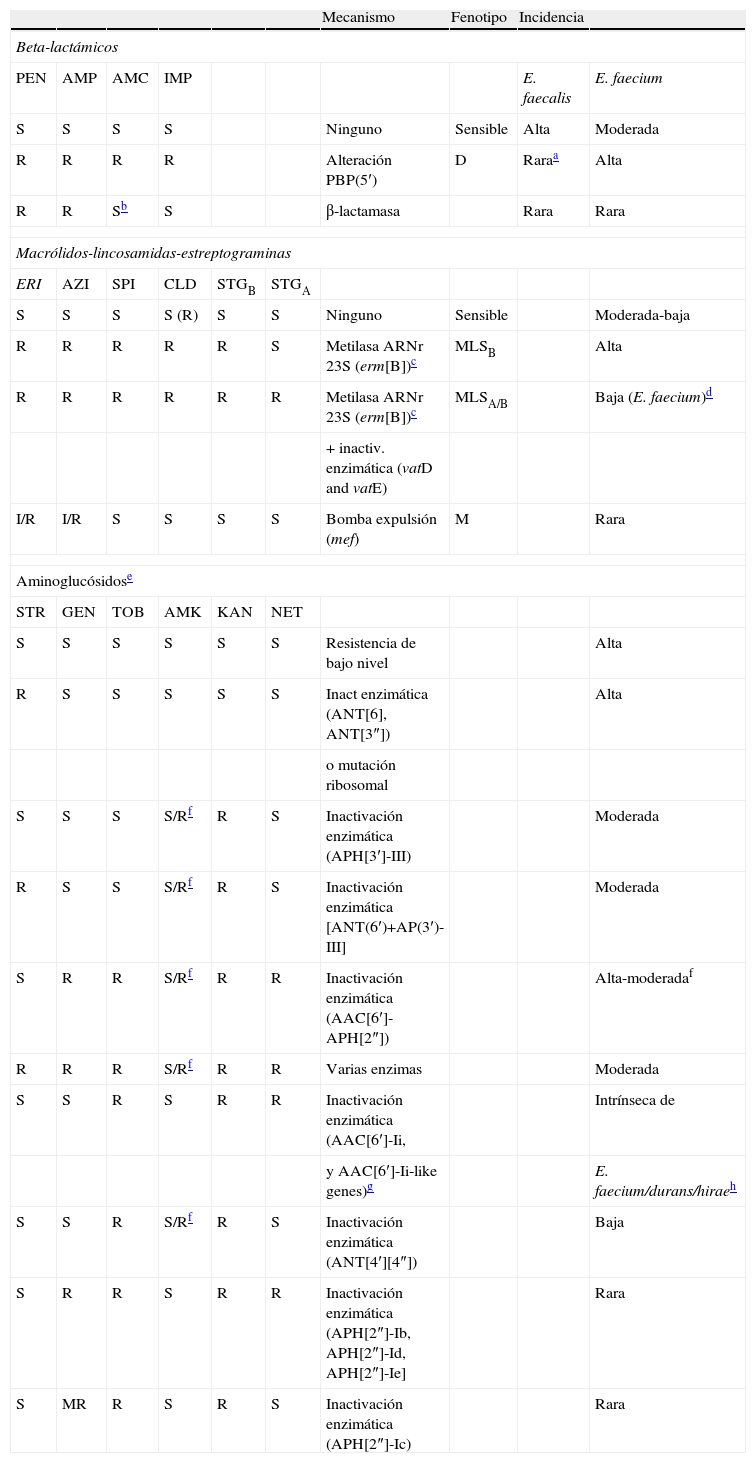
Género EnterococcusEn la tabla 5 se presentan los fenotipos y mecanismos de resistencia a antibióticos que se pueden detectar en este género bacteriano y su frecuencia de aparición.
Fenotipos y mecanismos de resistencia a antibióticos en Enterococcus
| Mecanismo | Fenotipo | Incidencia | |||||||
| Beta-lactámicos | |||||||||
| PEN | AMP | AMC | IMP | E. faecalis | E. faecium | ||||
| S | S | S | S | Ninguno | Sensible | Alta | Moderada | ||
| R | R | R | R | Alteración PBP(5′) | D | Raraa | Alta | ||
| R | R | Sb | S | β-lactamasa | Rara | Rara | |||
| Macrólidos-lincosamidas-estreptograminas | |||||||||
| ERI | AZI | SPI | CLD | STGB | STGA | ||||
| S | S | S | S (R) | S | S | Ninguno | Sensible | Moderada-baja | |
| R | R | R | R | R | S | Metilasa ARNr 23S (erm[B])c | MLSB | Alta | |
| R | R | R | R | R | R | Metilasa ARNr 23S (erm[B])c | MLSA/B | Baja (E. faecium)d | |
| + inactiv. enzimática (vatD and vatE) | |||||||||
| I/R | I/R | S | S | S | S | Bomba expulsión (mef) | M | Rara | |
| Aminoglucósidose | |||||||||
| STR | GEN | TOB | AMK | KAN | NET | ||||
| S | S | S | S | S | S | Resistencia de bajo nivel | Alta | ||
| R | S | S | S | S | S | Inact enzimática (ANT[6], ANT[3″]) | Alta | ||
| o mutación ribosomal | |||||||||
| S | S | S | S/Rf | R | S | Inactivación enzimática (APH[3′]-III) | Moderada | ||
| R | S | S | S/Rf | R | S | Inactivación enzimática [ANT(6′)+AP(3′)-III] | Moderada | ||
| S | R | R | S/Rf | R | R | Inactivación enzimática (AAC[6′]-APH[2″]) | Alta-moderadaf | ||
| R | R | R | S/Rf | R | R | Varias enzimas | Moderada | ||
| S | S | R | S | R | R | Inactivación enzimática (AAC[6′]-Ii, | Intrínseca de | ||
| y AAC[6′]-Ii-like genes)g | E. faecium/durans/hiraeh | ||||||||
| S | S | R | S/Rf | R | S | Inactivación enzimática (ANT[4′][4″]) | Baja | ||
| S | R | R | S | R | R | Inactivación enzimática (APH[2″]-Ib, APH[2″]-Id, APH[2″]-Ie] | Rara | ||
| S | MR | R | S | R | S | Inactivación enzimática (APH[2″]-Ic) | Rara | ||
AMC: amoxicilinaácido clavulanico; AMK: amikacina; AMP: ampicilina; AZI: azitromicina; CEF: cefazolina; CLD: clindamicina; CTX: cefotaxima; DOX: doxiciclina; ECN: Stapylococcus coagulasa negativo; ERI: eritromicina; FOX: cefoxitina; GEN: gentamicina; I: intermedio; KAN: kanamicina; NET: netilmicina; OXA: oxacilina; PEN: penicilina; R: resistente; SPI: espiramicina; S: sensible; s: sensibilidad disminuida; STGA: estreptogramina del grupo A; STGB: estreptogramina del grupo B; STR: estreptomicina; TEI: teicoplanina; TET: tetraciclina; TOB: tobramicina; VAN: vancomicina.
MR: resistencia moderada; IMP: imipenem.
Se han descrito cepas de E. faecalis resistentes a ampicilina y a imipenem por mutaciones en la PBP4.
La confirmación de este fenotipo requiere la detección de la β-lactamasa mediante ensayo con nitrocefín, ya que generalmente aparecen como sensibles en el antibiograma. Este tipo de cepas resistentes no han sido detectadas en España ni en Europa.
E. faecalis es intrínsecamente resistente a estreptograminas (ejemplo: quinupristina/dalfopristina).
Las cepas con este mecanismo de resistencia pueden presentar o no RAN a AMK. Sin embargo, serán resistentes al efecto sinérgico de la asociación de penicilina o ampicilina con amikacina.
Beta-lactámicos. El fenotipo más frecuente en E. faecalis, pero cada vez menos frecuente en E. faecium, incluye sensibilidad a penicilina, a ampicilina y a imipenem. Los enterococos pueden adquirir resistencia de alto nivel a los beta-lactámicos por modificación de las PBPs o, con menor frecuencia, por producción de una beta-lactamasa similar a la descrita en S. aureus. En cepas de enterococo no productoras de beta-lactamasa, la sensibilidad a ampicilina se puede utilizar para predecir la sensibilidad al resto de las penicilinas y en E. faecalis, predice además la sensibilidad a imipenem. En E. faecium es relativamente frecuente encontrar cepas resistentes a penicilina, ampicilina, amoxicilina-ácido clavulánico e imipenem por modificaciones en la PBP5, bien por un incremento en su expresión o por mutaciones en el gen pbp5 que impliquen una menor afinidad por la ampicilina23. Se han descrito escasas cepas E. faecalis con este fenotipo de resistencia, en las que el mecanismo implicado es también la hiperproducción de la PBP5 o modificaciones en la PBP4 (cambios aminoacídicos)24. En algunos países como EE.UU, Canadá, Argentina, Líbano o India, se han detectado cepas de E. faecalis productoras de beta-lactamasa, pero este tipo de cepas son infrecuentes y no se han comunicado por el momento en Europa. Asimismo, se ha detectado de manera excepcional una cepa de E. faecium productora de beta-lactamasa en EE.UU25,26. Las cepas productoras de beta-lactamasas se caracterizan por ser resistentes a penicilina, aminopenicilinas (ampicilina) y ureido-penicilinas (piperacilina) siendo sensibles a imipenem y a las combinaciones de beta-lactámicos con inhibidores de beta-lactamasas (ácido clavulánico, tazobactam, sulbactam). En los enterococos la ampicilina tiene mayor actividad intrínseca que la penicilina, observándose con frecuencia una o dos diluciones menores en los valores de CMI de ampicilina respecto a penicilina. En aquellos aislamientos en los que se demuestre una disminución de la sensibilidad de la ampicilina o bien cierta actividad de los inhibidores de betalactamasa, se debe descartar la producción de beta-lactamasa. Para ello, debe incrementarse el inóculo en las pruebas de sensibilidad (107UFC/ml). En los aislamientos procedentes de sangre y de LCR siempre debe realizarse la prueba de la nitrocefina, a fin de detectar la posible presencia de beta-lactamasa, ya que las cepas productoras de beta-lactamasa generalmente aparecen como sensibles en el antibiograma tanto si se realiza por difusión con discos como por microdilución.
Los enterococos son intrínsecamente resistentes a todas las cefalosporinas. Sin embargo, se ha descrito la existencia de efecto sinérgico de ampicilina con algunas cefalosporinas (como la ceftriaxona) tanto in vitro como in vivo en E. faecalis, inclusive en cepas con alta resistencia a aminoglucósidos27.
Teniendo en cuenta los fenotipos de resistencia a betalactámicos más frecuentes en Enterococcus en nuestro país, si se detecta en el laboratorio una cepa de E. faecalis resistente a ampicilina, se debe: 1) reconfirmar la identificación a nivel de especie ya que a veces se trata de una cepa de E. faecium mal identificada; 2) estudiar la producción de beta-lactamasa utilizando un alto inóculo del microorganismo. Si se tratase de una cepa de E. faecalis productora de beta-lactamasa, se debe informar y remitir a un centro de referencia.
De igual modo, en el caso de cepas de E. faecium resistentes a ampicilina y sensibles a amoxicilina-clavulánico siempre debe estudiarse la producción de beta-lactamasa mediante la prueba de la nitrocefina.
MLS. Los enterococos son intrínsecamente resistentes a la clindamicina, y frecuentemente son resistentes a los macrólidos con el fenotipo MLSB. El mecanismo de resistencia en estas cepas se debe a modificación de la diana en el ribosoma, generalmente por expresión del gen erm(B), localizado en gran variedad de elementos transferibles (transposones y plásmidos), aunque también puede ser debido a la expresión de los genes erm(A) y erm(C)28. Es también frecuente detectar cepas sensibles a los macrólidos, pero hay que tener en cuenta que en muchos casos pueden presentar el fenotipo MLSB inducible y estos antibióticos no deben utilizarse ya que pueden aparecer resistencias durante el tratamiento. E. faecalis presenta resistencia intrínseca a las estreptograminas como quinupristina/dalfopristina, constituídas por las subunidades A y B (STGA y STGB) que actúan sinérgicamente. En el caso de E. faecium también es relativamente frecuente la resistencia a ambas estreptograminas [STGA por enzimas acetiltrasferasas,VatD y VatE; STGB bien por el gen erm(B) que confiere el fenotipo MLSB o por expresión del gen vgbA que codifica una lactonasa de tipo estafilocócico]. De forma muy esporádica, se han referido cepas con el fenotipo de resistencia M por expresión de bombas de expulsión activa (genes mef).
Aminoglucósidos. El género Enterococcus presenta de forma intrínseca un mecanismo de resistencia de bajo nivel a aminoglucósidos por un transporte deficiente del aminoglucósido al interior de la bacteria. Se caracteriza por presentar valores de CMI que oscilan entre 4–64μg/ml para la gentamicina y entre 16–256μg/ml para la estreptomicina. Pero cuando se asocia un aminoglucósido con otro antibiótico que actúe en la pared celular (beta-lactámico o glucopéptido), se produce un efecto sinérgico con esta asociación por lo que la misma se debe utilizar siempre en el tratamiento de infecciones graves por este microorganismo (bacteriemia, endocarditis y meningitis). Sin embargo, el género Enterococcus puede presentar un mecanismo de resistencia adquirida a los aminoglucósidos que suele asociarse a la producción de enzimas modificantes (acetiltransferasas [AAC], nucleotidiltransferasas [ANT] o fosfotransferasas [APH]) y que produce una resistencia de alto nivel (RAN), perdiéndose el efecto sinérgico en asociación con agentes activos en la pared celular. En el caso de existir este mecanismo de resistencia no se deben utilizar en asociación. En la tabla 5 se presentan los distintos fenotipos de RAN a aminoglucósidos que se pueden detectar en Enterococcus, los mecanismos de resistencia asociados y la frecuencia con la que se producen.
Los fenotipos y mecanismos de RAN más frecuentes en Enterococcus son29:
- A.
Resistencia a estreptomicina (STRR) generalmente asociada a la producción de las enzimas ANT(6) y ANT(3″) y en ocasiones también por mutaciones en el ribosoma.
- B.
Resistencia a kanamicina y amikacina (KANR, AMKR) por la acción de la enzima APH(3′)-III.
- C.
Resistencia a gentamicina, tobramicina, kanamicina, amikacina y netilmicina (GENR-TOBR-KANR-AMKR-NETR) por la acción de la enzima bifuncional AAC(6′)-APH(2″).
- D.
Resistencia a tobramicina-amikacina y kanamicina (TOBR-AMKR-KANR) debido a la expresión de la enzima ANT(4′)(4″). La frecuencia de detección de este fenotipo es baja.
- E.
Con cierta frecuencia estas enzimas están asociadas pudiéndose detectar RAN frente a todos los aminoglucósidos de interés clínico (STRR-GENR-TOBR-KANR-AMKR-NETR).
- F.
La especie E. faecium posee un gen intrínseco aac(6′)-Ii que codifica la enzima AAC(6′)-Ii, que se expresa débilmente y que modifica TOB y KAN, provocando la ausencia de efecto sinérgico de estos aminoglucósidos con betalactámicos (a pesar de que a veces se manifiestan con ausencia de RAN a estos aminoglucósidos). Las especies E. durans y E. hirae también presentan genes intrínsecos con similares características a los de E. faecium (aac(6′)-Iid y aac(6′)-Iih, respectivamente30.
Existen otros fenotipos de resistencia, muy poco frecuentes por el momento y que se asocian a la expresión de nuevas enzimas (APH[2″]-Ib, APH[2″]-Ic, APH[2″]-Id, y APH[2″]-Ie) que modifican GEN, KAN y TOB, pero no AMK. Las enzimas (APH[2″]-Ib, APH[2″]-Id y APH[2″]-Ie) están relacionadas con RAN a GEN, TOB, KAN y NET, por lo cual habría efecto sinérgico de un beta-lactámico con AMK y con STR, pero no con el resto de los aminoglucósidos. Por último, la enzima APH(2″)-Ic se caracteriza por conferir un nivel «intermedio» de sensibilidad a la gentamicina (256μg/ml); esta enzima confiere resistencia a la sinergia de GEN, TOB, y KAN con beta-lactámicos, pero no afecta a AMK, NET y STR. Además, cambios aminoacídicos en la proteína APH(2″)-Ic se asocian con incrementos en la CMI de la gentamicina31.
Con todo lo anterior pueden obtenerse las siguientes conclusiones:
- A)
La RAN a la estreptomicina está causada por un mecanismo independiente al resto de los aminoglucósidos por lo que no existen resistencias cruzadas.
- B)
Las enzimas APH(3′)-III, AAC(6′)-APH(2″) y ANT(4′)(4″) modifican débilmente a la amikacina por lo que fenotípicamente pueden no manifestar RAN a este antibiótico; sin embargo, las cepas presentan resistencia a la sinergia AMK-betalactámico.
- C)
Cuando una cepa presenta RAN a gentamicina, esto suele asociarse con frecuencia a RAN al resto de los aminoglucósidos (excepto la estreptomicina) y en definitiva con resistencia a la sinergia con beta-lactámicos. Sin embargo, existen excepciones. Se han descrito enzimas que modifican GEN pero que no confieren resistencia a la sinergia AMK-beta-lactámico [(APH(2″)-Ib, APH(2″)-Ic, APH(2″)-Id, y APH(2″)-Ie] y, en algún caso, también permiten la sinergia beta-lactámico-NET (por el momento poco frecuentes). Hay que ser capaces de detectar este tipo de cepas ya que a pesar de la resistencia a GEN pueden existir otras alternativas terapéuticas.
- D)
Los métodos de detección actualmente aceptados para la RAN a la GEN pueden no detectar ciertas cepas con la enzima APH(2″)-Ic que puede conferir una CMI de GEN del orden de 256μg/ml. Para detectar estas cepas habría que reducir el contenido de GEN de las placas de cribado o bien detectar el gen aph(2″)-Ic (por reacción en cadena de la polimerasa [PCR] o hibridación) o realizar curvas de muerte betalactámico-GEN. Es posible que en un futuro se revisen y modifiquen los puntos de corte para la RAN a GEN.
Las curvas de letalidad se consideran el método de referencia para el estudio de la sinergia entre beta-lactámicos y aminoglucósidos. Su realización rutinaria no es práctica por lo que se recurre a otros métodos más sencillos. En la tabla 6 se señalan los métodos recomendados por el CLSI para detectar RAN a STR y GEN en Enterococcus. En definitiva, y aunque como se ha indicado anteriormente hay excepciones, la RAN a estreptomicina (CMI >1.000μg/ml) implica solamente resistencia a este antimicrobiano, mientras que la RAN a gentamicina (CMI >500μg/ml) implica RAN al resto de los aminoglucósidos más frecuentemente utilizados en clínica con la excepción de la estreptomicina.
Detección de la resistencia de alto nivel a aminoglucósidos en Enterococcus
| Método | Medio | Inóculo | Incubación | Resultados |
| Screening en agar | BHI agar+GEN (500μg/ml)a | Depositar 10μl de suspensión 0,5 McFarland en la placa | 35°C, 24h para GEN y 24–8h para STR | >1 colonia: resistente a la sinergia |
| BHI agar+STR (2.000μg/ml) | ||||
| Screening medio líquido | BHI caldo+GEN (500μg/ml)a | 5×105UFC/ml | 35°C, 24h para GEN y 24–8h para STR | Cualquier crecimiento: resistente a la sinergia |
| BHI caldo+STR (1.000μg/ml) | ||||
| Disco-placa | Agar Mueller-Hinton | Suspensión 0,5 | 35°C, 16–18h | Halo de inhibición en mm |
| STR (300μg) | McFarland | ≥10 (Sensible a la sinergia) | ||
| GEN, KAN, TOB, NET (120μg) | 7–9 (indeterminado. Realizar otra técnica) | |||
| 6 (resistente a la sinergia) |
AMC: amoxicilinaácido clavulanico; AMK: amikacina; AMP: ampicilina; AZI: azitromicina; CEF: cefazolina; CLD: clindamicina; CTX: cefotaxima; DOX: doxiciclina; ECN: Stapylococcus coagulasa negativo; ERI: eritromicina; FOX: cefoxitina; GEN: gentamicina; I: intermedio; KAN: kanamicina; NET: netilmicina; OXA: oxacilina; PEN: penicilina; R: resistente; SPI: espiramicina; S: sensible; s: sensibilidad disminuida; STGA: estreptogramina del grupo A; STGB: estreptogramina del grupo B; STR: estreptomicina; TEI: teicoplanina; TET: tetraciclina; TOB: tobramicina; VAN: vancomicina.
Glucopéptidos. En el año 1989 se describió por primera vez la resistencia a vancomicina en Enterococcus y desde entonces, se ha observado un aumento importante de este tipo de cepas resistentes entre los aislados clínicos, principalmente en Estados Unidos y, sobre todo, en pacientes de UCI. El porcentaje de enterococos resistentes a vancomicina entre los aislados clínicos en Europa es mas bajo, aunque variable según los países32. De acuerdo con los datos publicados por el European Antimicrobial Resistance Surveillance System para 2008, en el caso de España la resistencia oscila entre 1–5% para los aislados de E. faecium invasivos (siendo los mecanismos detectados vanA o vanB2), aunque hay países como Portugal, Irlanda o Inglaterra donde los porcentajes son superiores (10–50%)33. La resistencia a vancomicina ha sido detectada con cierta frecuencia en aislados de enterococos procedentes de orígenes no clínicos (muestras intestinales de animales y de humanos sanos en alimentos y en aguas residuales). Es interesante destacar el hecho de que las cepas de E. faecium resistentes a vancomicina aisladas del medio hospitalario pertenecen, mayoritariamente, al Complejo Clonal de Alto Riesgo Hospitalario 17 que se encuentra diseminado globalmente. En las tablas 7 y 8 se presentan los fenotipos de resistencia a glucopéptidos que se pueden detectar en Enterococcus y sus características diferenciales. Hay 2 tipos de resistencia:
- A)
Adquirida. Fenotipos VanA, VanB, VanD, VanE, VanG, y VanL mediados por los cluster de genes de resistencia vanA, vanB, vanD, vanE, vanG y vanL respectivamente.
- B)
Intrínseca. Ligada a las especies E. gallinarum (gen vanC-1), E. casseliflavus (gen vanC-2) y E. flavescens (vanC-3).
Fenotipos de resistencia a glicopéptidos en Enterococcus
| VAN | TEI | Mecanismo | Especie | Frecuencia |
| S | S | Ninguno | Todas las especies | Alta |
| R | R | vanA | Todas las especies | Bajaa (pero variable según centros) |
| I/R | S | vanBb | E. faecium, E. faecalis | Baja (pero variable según centros) |
| E. durans, E. gallinarum | ||||
| I/R | S | vanD, vanE, vanG, vanL | E. faecalis, E. faecium | Raro |
| S/I/R | S | vanC-1c | E. gallinarum | Intrínseco en E. gallinarum |
| S/I/R | S | vanC-2c | E. casseliflavus | Intrínseco en E. casseliflavus |
| S/I/R | S | vanC-3c | E. flavescens | Intrínseco en E. flavescens |
| S | R | No descrito |
AMC: amoxicilinaácido clavulanico; AMK: amikacina; AMP: ampicilina; AZI: azitromicina; CEF: cefazolina; CLD: clindamicina; CTX: cefotaxima; DOX: doxiciclina; ECN: Stapylococcus coagulasa negativo; ERI: eritromicina; FOX: cefoxitina; GEN: gentamicina; I: intermedio; KAN: kanamicina; NET: netilmicina; OXA: oxacilina; PEN: penicilina; R: resistente; SPI: espiramicina; S: sensible; s: sensibilidad disminuida; STGA: estreptogramina del grupo A; STGB: estreptogramina del grupo B; STR: estreptomicina; TEI: teicoplanina; TET: tetraciclina; TOB: tobramicina; VAN: vancomicina.
Este tipo de aislamientos son frecuentes en EE.UU. en pacientes hospitalizados en UCI. En Europa es poco frecuente y cuando aparecen generalmente se asocian a brotes hospitalarios. No obstante, se está observando un aumento en los últimos años y además se han aislado con cierta frecuencia en muestras intestinales de animales y humanos sanos, en alimentos y en aguas residuales.
Las cepas de Enterococcus con fenotipo VanB son sensibles a teicoplanina, pero se ha documentado el desarrollo de resistencia a este antibiótico tanto in vivo como in vitro y por tanto, no se debe utilizar teicoplanina para el tratamiento de infecciones por cepas con este fenotipo.
Cepas con estos genes de resistencia presentan a veces valores de CMI de vancomicina bajos, por lo que serían informadas como sensibles si no se realiza una correcta detección e identificación (detección del gen vanC o identificación microbiológica: prueba de movilidad positiva en las especies E. gallinarum, E. casseliflavus, E. flavescens).
Fenotipos de resistencia a los glicopéptidos en Enterococcus spp.
| Resistencia adquirida | Resistencia intrínseca | ||||||
| Fenotipo | VanA | VanB | VanD | VanE | VanG | VanLa | VanC |
| CMI vancomicina (μg/ml) | 16–>1.024 | 4–32 (1.024) | 16–128 | 8–32 | 16 | 8 | 2–32 |
| CMI teicoplanina (μg/ml) | 16–512 | 0,25–2b | 2–4 (64) | 0,5 | 0,5 | 0,5 | 0,12–2 |
| Expresión de la resistencia | Inducible | Inducible | Constitutiva | Inducible | ND | Inducible | Constitutiva o inducible |
| Resistencia transferible | Sí | Sí | No | No | ND | ND | No |
| Gen responsable de la resistencia (ligasa) | vanA | vanBc | vanDc | vanE | vanG | VanL | vanC-1, vanC-2, vanC-3 |
| Especies en las que se ha detectado | E. faecium | ||||||
| E. faecalis | |||||||
| E. avium | |||||||
| E. durans | E. faecium | E. faecium | E. gallinarum (vanC-1) | ||||
| E. hirae | E. faecalis | E. faecalis | E. faecalis | E. faecalis | E. faecalis | E. casseliflavus (vanC-2) | |
| E. mundtii | E. durans | E. raffinosus | E. flavescens (vanC-3) | ||||
| E. raffinosus | E. gallinarum | ||||||
| E. gallinarum | |||||||
| E. casseliflavus | |||||||
CMI: concentración mínima inhibitoria; ND: no determinado.
La daptomicina es activa frente a los enterococos que presenten cualquiera de los fenotipos-genotipos anteriormente indicados.
El fenotipo VanA se caracteriza por presentar elevados niveles de resistencia a vancomicina y a teicoplanina, y ha sido el más frecuente entre los aislados clínicos de Enterococcus resistentes a vancomicina. En los últimos años se está observando la emergencia del fenotipo VanB (concretamente el mediado por el cluster de genes vanB2)34 que se está detectando en varios hospitales españoles con una frecuencia similar al VanA. Este fenotipo se caracteriza por presentar moderados o elevados niveles de resistencia a la vancomicina y sensibilidad a la teicoplanina. Los fenotipos mediados por los genes vanC, vanD, vanE, vanG y vanL se caracterizan por conferir bajos niveles de resistencia a vancomicina y sensibilidad a la teicoplanina. Se ha descrito la selección de resistencia a teicoplanina en cepas de Enterococcus con el mecanismo vanB en el curso de tratamiento con glucopéptidos. En ocasiones se han detectado discrepancias fenotipo-genotipo en la resistencia a la vancomicina (por ejemplo genotipo vanA y fenotipo VanB/VanD) relacionada con modificaciones en el sistema regulación del clúster de genes vanA o bien a nivel del gen vanY. En el laboratorio es fácil la detección del fenotipo VanA, sin embargo, existen algunos problemas para la detección de los otros fenotipos de resistencia por los bajos niveles de resistencia a vancomicina que pueden conferir. Los métodos que pueden utilizarse para detectar la resistencia a glucopéptidos en Enterococcus incluyen: a) Difusión con discos. Este método tiene un bajo poder discriminatorio, sobre todo con los valores de CMI intermedios (8–16μg/ml) y debe evitarse su realización siempre que sea posible. La lectura de la placa ha de hacerse a las 24h de incubación y con luz transmitida, considerando como resistente la presencia de cualquier velo o crecimiento dentro del halo de inhibición. En caso de duda, debe realizarse la determinación de las CMI de vancomicina y teicoplanina mediante métodos de dilución o mediante Etest; b) Microdilución y dilución en agar. Se utilizará medio Mueller-Hinton suplementado con cationes, inóculo estándar e incubación de 24h a 35°C; c) Método de cribado. El CLSI recomienda el uso de una placa de agar BHI suplementada con 6μg/ml de vancomicina, un inóculo de 105–106 UFC/depósito y una incubación de 24h a 35°C. La detección de más de una colonia, o ligero o claro crecimiento son indicativos de resistencia a vancomicina. y d) Existen medios de agar cromogénico comercializados para el aislamiento selectivo de cepas de enterococo resistente a vancomicina que permiten realizar estudios de vigilancia epidemiológica.
Quinolonas. La resistencia de alto nivel a fluoroquinolonas en Enterococcus es relativamente frecuente y en general se relaciona con cambios aminoacídicos en la ADN girasa (casi siempre en la posición Ser83) y en la topoisomerasa IV (casi siempre en la posición Ser80). Los métodos de detección serían los mismos que los indicados en el caso de S. pneumoniae.
Nota: sección acreditada por el SEAFORMEC. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion