Se estudiaron los grupos genéticos (genotipos) de Giardia duodenalis circulantes en las áreas sanitarias de 2 hospitales de Zaragoza y León (España).
MétodosSe genotiparon 211 muestras de Giardia mediante PCR del gen tpi.
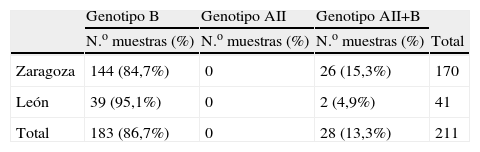
ResultadosEl genotipo B fue más prevalente tanto en Zaragoza (84,7%) como en León (95,1%). Los restantes aislados fueron identificados como AII+B.
ConclusionesPredominó G. duodenalis genotipo B en Zaragoza y León, con aumento de su prevalencia en Zaragoza respecto a estudios anteriores.
To study Giardia duodenalis assemblages circulating in the health areas of two hospitals in Zaragoza and León (Spain).
MethodsA total of 211 stool samples with Giardia were genotyped by PCR of the tpi gene.
ResultsAssemblage B was the most prevalent, both in Zaragoza (84,7%) and León (95,1%). The remaining isolates were identified as AII+B.
ConclusionsWe detected the spread of G. duodenalis assemblage B in Zaragoza and in León, with an increase in its prevalence in Zaragoza compared to previous studies.
La giardiosis, sintomática y asintomática, es un proceso de transmisión feco-oral transmitido por Giardia duodenalis, el protozoo flagelado intestinal más frecuentemente diagnosticado como productor de diarrea en humanos, tanto en países desarrollados como en vías de desarrollo. G. duodenalis presenta altos niveles de diversidad genética, habiéndose diferenciado 7 genotipos que se denominan A, B, C, D, E, F y G1–4. Los genotipos C y D tienen como hospedadores a perros y coyotes, el F se encuentra habitualmente en gatos y el G en ratas. Los genotipos A y B son los que normalmente se describen en humanos, así como en un amplio rango de hospedadores mamíferos3. Recientemente se han descrito en humanos otros genotipos, como el genotipo E, cuyo hospedador habitual es el ganado5. Por otra parte, el genotipo A se ha subdividido en 2 subgenotipos, el AI encontrado tanto en humanos como en animales y el AII que se considera específico del ser humano.
En un estudio previo realizado en España, con muestras de G. duodenalis obtenidas en el período 2002–2004 procedentes de hospitales de Zaragoza, se encontró la siguiente distribución de genotipos6: el genotipo AII se halló en un 39,8%, el genotipo B en un 56,5% y un genotipo mixto conteniendo ambos genotipos AII y B en un 3,7% de las muestras. Por otra parte, se comprobó una relación estadísticamente significativa entre genotipo y manifestaciones clínicas para pacientes menores de 5 años de edad, el genotipo AII se asoció con infección sintomática y el genotipo B con infección asintomática.
El objetivo fundamental de este estudio es determinar los genotipos de G. duodenalis presentes en Zaragoza y León, lo que, en futuros estudios, nos permitirá conocer posibles cambios en su distribución.
MétodosSe estudiaron 211 muestras fecales obtenidas, durante 2004–2007, de pacientes diagnosticados de giardiosis en el Hospital Clínico Universitario Lozano Blesa de Zaragoza y en el Hospital de León (tabla 1), mediante observación microscópica de preparaciones húmedas de los concentrados fecales obtenidos tras concentración con formalina-acetato de etilo. Alícuotas de muestras fecales sin conservantes se enviaron al Laboratorio de Parasitología del Departamento de Microbiología, Medicina Preventiva y Salud Pública de la Facultad de Medicina en la Universidad de Zaragoza donde se llevaron a cabo las técnicas de biología molecular. El ADN se extrajo a partir de las muestras fecales según el protocolo de Boom et al7. La PCR, para amplificar un fragmento del gen tpi se llevó a cabo con los cebadores y condiciones descritas por Amar8. La diferenciación de los subgenotipos AI y AII se realizó mediante RFLP con la enzima de restricción RsaI de los amplicones del genotipo A8.
Para estudiar la posible asociación entre genotipo y edad, se clasificaron los pacientes en clases de edad, con un rango de 5 años para cada clase, hasta los 46 años, y se calculó la significación estadística utilizando el test χ2 (SPSS v14.0, SPSS Inc. Chicago, IL, EE.UU.).
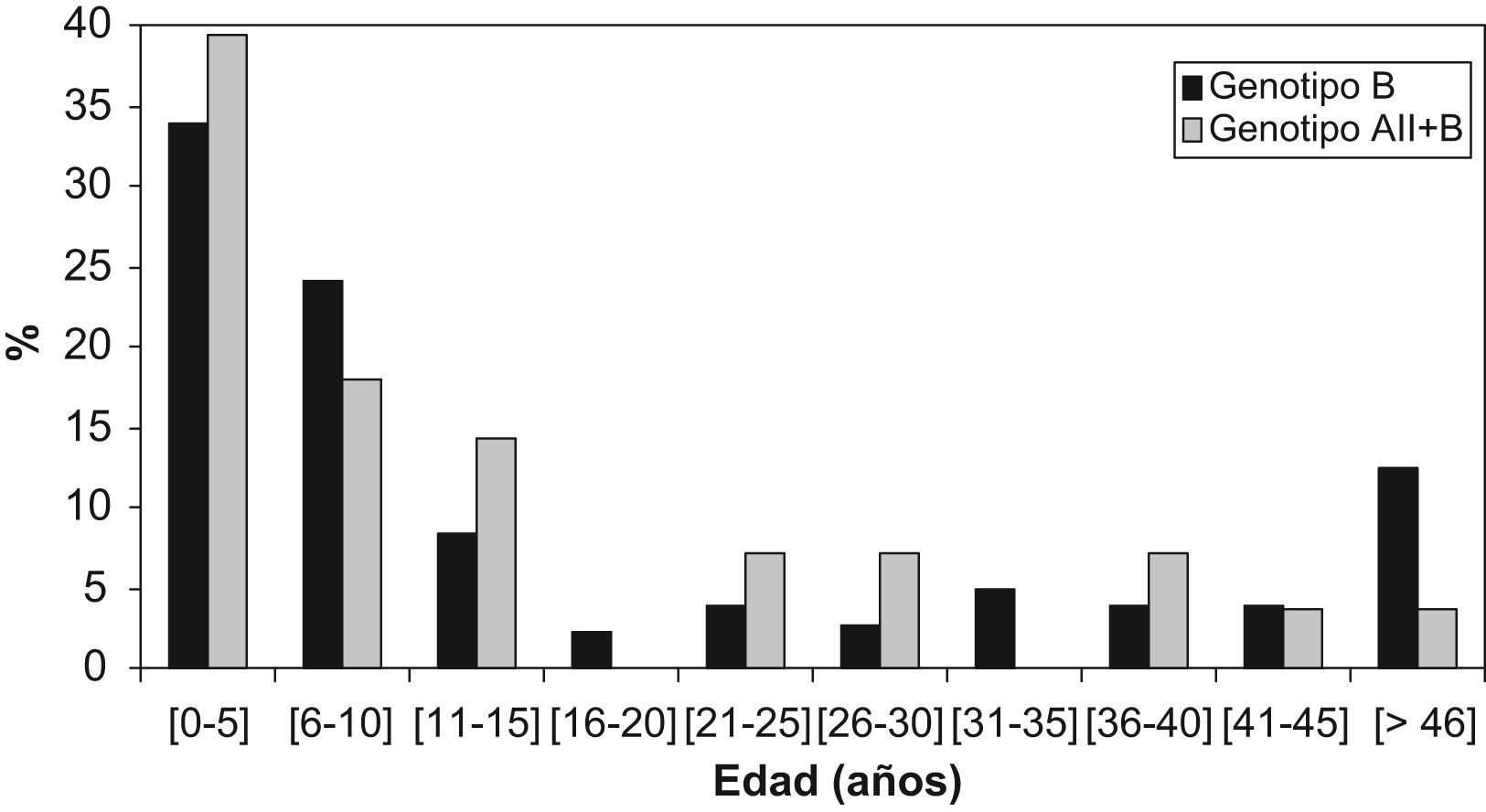
ResultadosLa distribución de genotipos obtenida se observa en la tabla 1. El genotipo A siempre apareció asociado al genotipo B. Todos los aislamientos del genotipo A correspondieron al subgenotipo AII. Para estudiar la distribución de genotipos por edad, los pacientes se agruparon en intervalos de 5 años. Como se puede observar en la figura1, la mayoría de los pacientes pertenecen al grupo de niños entre 0 y 5 años (34,5%), seguidos por los que están comprendidos entre los 6 y los 10 años y después por los que se encuentran entre los 11 y los 15 años de edad. Por localizaciones, el 78% de los pacientes procedentes de León se encuentran en el rango de edad de 0 a 15 años, mientras que en Zaragoza este grupo de edad supone el 63,5% de los pacientes estudiados. No se aprecia asociación estadísticamente significativa (p>0,05) entre edad y genotipo. En León sólo 2 de los aislamientos estudiados correspondieron a genotipo mixto, ambos procedentes de pacientes mayores de 16 años. En Zaragoza el grupo de aislamientos mixtos es mayor en los pacientes de 0–16 años (15,7%) que en los mayores de 16 años (6,5%).
DiscusiónLos resultados obtenidos en el presente estudio nos permiten conocer los genotipos prevalentes en León. En Zaragoza, al haber realizado un estudio previo, pudimos observar una variación de dichos genotipos en el tiempo. El genotipo AI no se encontró en ninguna de las zonas estudiadas. Lo mismo sucedió en el estudio anterior realizado en Zaragoza6.
De los 2 subtipos del genotipo A, es el AII el que se ha descrito con mayor frecuencia infectando humanos. El AI también se ha encontrado en algunas áreas determinadas, pero su ausencia no es un hecho inusual9,10.
Tanto en Zaragoza como en León el genotipo B es el prevalente, con un mayor porcentaje de genotipos mixtos en Zaragoza, lo que probablemente estará relacionado con un mayor número de muestras analizadas, respecto a las procedentes de León. Además, en Zaragoza el grupo de aislamientos mixtos es más prevalente en el rango de edad de 0–16 años que en los pacientes mayores de 16 años, lo que podría estar en concordancia con un posible origen medioambiental de la contaminación con genotipos mixtos. Sin embargo, la presencia del genotipo B en Zaragoza ha presentado un llamativo incremento en los últimos años, sugiriendo la posibilidad de que pueda estar mejor adaptado al hospedador humano o a las condiciones ambientales. Esto le proporcionaría ventajas para su supervivencia y diseminación frente al genotipo A, que se vería desplazado por el B. Un ejemplo de un fenómeno similar ocurre cuando se realizan cultivos axénicos in vitro y el genotipo A parece presentar ventajas competitivas frente al B3. Por otra parte, el genotipo B se había asociado únicamente con infecciones en humanos, hasta que recientemente se ha descrito en ganado, perros, caballos, conejos y ovejas11–15. También observamos un aumento de la presencia de genotipos mixtos con respecto al trabajo anterior.
Pocos estudios han descrito las consecuencias de una infección mixta, puesto que se han limitado a describir las interacciones competitivas con el hospedador16. Sería interesante profundizar en el estudio de las infecciones mixtas y de los síntomas que producen.
También son pocos los antecedentes sobre las variaciones de los genotipos en un área geográfica determinada. Así, el trabajo más destacado describe un brote en Noruega en el año 2004, en el que se diseminó solamente un genotipo BIII de Giardia. Seis meses antes del brote, los quistes de Giardia, que se encontraban en el agua no tratada, correspondían al genotipo A y 1 año después se encontró tanto el genotipo A como el BIII17. Estos resultados demostraban que después del brote, aunque los casos de giardiosis volvían a la prevalencia anterior, la composición genética de los parásitos se veía enormemente influenciada por los genotipos responsables del brote. En otros casos, como en estudios realizados en el sur de la India, se mantienen los porcentajes de los distintos genotipos descritos en épocas anteriores18. Se necesitan más estudios para confirmar si el aumento de la prevalencia del genotipo B que se ha encontrado en Zaragoza corresponde a un brote o se debe a la presencia de un clon muy resistente, con gran habilidad para sobrevivir en el medioambiente o con gran capacidad de adaptación al hospedador humano.
Si consideramos los resultados obtenidos por Sahagún et al6, y aceptamos que el genotipo B está relacionado con infección asintomática, en Zaragoza habría una tendencia hacia este tipo de infección. Además, la ausencia de síntomas puede favorecer la persistencia de la fuente de infección y la vía de transmisión directa. También implica un aumento de portadores sanos, mostrando síntomas sólo los pacientes más sensibles. Los síntomas, por otra parte, pueden ser más indefinidos, dificultando el diagnóstico.
FinanciaciónEste trabajo fue financiado por el Gobierno de Aragón, Grupos Consolidados B82. E. Aldana recibió una beca de la Fundación Carolina y de la Universidad San Carlos de Guatemala.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.