La evaluación de nuevos casos de infección por el virus de la inmunodeficiencia humana (VIH) es relativamente frecuente, ya que en España se diagnostican cada año varios miles de pacientes con nuevas infecciones. El 80% de los casos tienen una infección crónica por el VIH que puede ser sintomática (diagnóstico tardío) hasta en un 30% de pacientes. La evaluación clínica inicial de la infección por el VIH no está dirigida solo a conocer la situación clínica, virológica (carga viral del VIH, estudio de resistencias y tropismo viral) e inmunológica (cifra de linfocitos CD4) del VIH, sino que debe dirigirse también al estudio de las coinfecciones (virus de la hepatitis, tuberculosis) y comorbilidades (cardiovascular, hepática, renal y ósea) del paciente y al riesgo de transmisión del VIH con el fin de decidir si se debe iniciar o no el tratamiento antirretroviral y con qué fármacos antirretrovirales iniciarlo, la profilaxis de las infecciones oportunistas y el tratamiento de las coinfecciones y comorbilidades. La anamnesis, el examen físico y las pruebas complementarias nos ayudarán a decidir si el paciente es tributario de una intervención terapéutica. El nivel de linfocitos T CD4+, además de sugerir el momento de iniciar el tratamiento antirretroviral, indica la necesidad o no de instaurar profilaxis frente a las infecciones oportunistas, si existe una cifra de linfocitos CD4 menor de 200 cél/mm3, y en pacientes avanzados nos debe hacer sospechar la presencia de enfermedades oportunistas activas en los casos sintomáticos. El manejo del paciente con infección por VIH tiene que incluir también una oportuna educación sanitaria relativa a las vías de transmisión del virus y su prevención, explicar la historia natural del virus y como ésta se puede modificar con un correcto tratamiento antirretroviral; además tiene que promover un estilo de vida saludable. No menos importante es el apoyo psicológico para que el paciente aprenda a convivir con una infección crónica que puede controlarse adecuadamente y garantizar a largo plazo una buena calidad de vida.
The evaluation of new cases of HIV infection is relatively common in Spain, where several thousands of patients with new infections are diagnosed each year. Eighty per cent of them have a chronic HIV infection at the first clinical evaluation, which is symptomatic (late presenters) in up to 30% of patients. The initial evaluation of HIV infection is not only directed at determining the clinical, virological (plasma HIV RNA viral load, resistance test and viral tropism) and immunological (CD4+ T-cell cell count) situation of the patients, but must also address the study of their co-infections (hepatitis, tuberculosis) and comorbidities (cardiovascular, hepatic, renal and bone) and the risk of HIV transmission. This is needed in order to decide, whether or not to start antiretroviral treatment, and with which combined antiretroviral treatment to start with, the prophylaxis of opportunistic infections, and the treatment of coinfections and comorbidities. The past and current medical history, the physical examination and laboratory tests will help us decide if the patient is to receive therapeutic intervention. The level of CD4+ T-cell lymphocytes is the best marker to suggest when to start combined antiretroviral treatment, indicating whether or not to start prophylaxis against opportunistic infections (if patients have a CD4+ T-cell count below 200 cells/mm3), and in advanced patients should make us suspect the presence of active opportunistic diseases in symptomatic cases. The management of patients with HIV infection must also include appropriate health education on the modes of transmission and prevention of HIV infection, and also to explain its natural history and how it can be modified with proper antiretroviral treatment, as well as to promote a healthy life. No less important is the psychological support, as these patients must learn to live with a chronic infection, which managed properly can ensure a very good long-term prognosis and quality of life.
El manejo clínico inicial de los pacientes infectados por el virus de la inmunodeficiencia humana tipo 1 (VIH-1) incluye el diagnóstico precoz de la infección, la educación sanitaria y el consejo médico para evitar la transmisión de la infección por el VIH-1, una anamnesis y examen físico dirigidos a identificar complicaciones de la infección por el VIH-1 o comorbilidades, la realización de exámenes complementarios para evaluar el estado de salud del individuo y, según los resultados, evaluar el inicio del tratamiento antirretroviral (TARV) y otras intervenciones terapéuticas a fin de evitar la aparición o el empeoramiento de la infección por el VIH o de las comorbilidades1–7. En España se diagnostican como mínimo más de 2.200 nuevas infecciones por VIH al año8,9. Varios estudios realizados en España ponen de manifiesto que un 2% de los pacientes se encontraban en la fase de la primoinfección, un 20% tenía una infección reciente, un 50% una infección crónica asintomática y un 30% una infección crónica sintomática, teniendo criterios de sida un 20% de los pacientes10,11. Por otra parte, estos estudios han puesto de manifiesto que en nuestro país la infección por el VIH es fundamentalmente de adquisición sexual y que en una tercera parte de los casos la infección por el VIH se detectará en inmigrantes, con la posibilidad de que tengan infecciones latentes de sus áreas endémicas10,11.
En esta revisión se analizan los elementos que los médicos que atienden a estos pacientes deben tener en cuenta durante la primera evaluación de un paciente con un reciente diagnóstico de la infección por el VIH sea cual sea su estadio evolutivo12. Como el retraso diagnóstico de la infección por el VIH-1 es frecuente, se describirán las situaciones clínicas que deben hacer sospechar la infección por el VIH y ante las que debe solicitarse la serología del VIH. Una vez diagnosticada la infección por el VIH, se describen, desde una perspectiva integral, los puntos más importantes de la anamnesis y del examen físico, las pruebas complementarias que deberían solicitarse en la primera visita y durante el seguimiento, los factores que influyen en la evolución de la enfermedad y las intervenciones terapéuticas que se pueden implementar para el correcto manejo clínico de estos pacientes.
Control clínico del paciente seronegativo con riesgo de infección por VIH-1 y sospecha clinica de la infección por el VIHDada la frecuencia con la que muchos pacientes no conocen su estado de portadores de la infección, existen diversas situaciones clínicas ante las cuales se debería solicitar la serología de la infección por el VIH para realizar de este modo un cribado y evitar el retraso diagnóstico y la potencial transmisión de la infección por el VIH a otras personas por no tomar las medidas preventivas. Algunas de estas situaciones ante las cuales el personal sanitario debe solicitar la serología VIH son las siguientes2:
- 1.
Solicitud del cribado de la infección por el VIH por voluntad propia del individuo.
- 2.
Solicitud de cribado a los pacientes con conductas de riesgo de la infección por el VIH o en inmigrantes procedentes de áreas con prevalencia elevada de la infección por el VIH.
- 3.
Sospecha de sintomatología compatible con la primoinfección (tabla 1)13–15.
Tabla 1.Actitud clínica ante la sospecha de primoinfección sintomática por VIH-1
Manifestaciones clínicas (a las 2-6 semanas tras exposición, 1-3 semanas de duración) Fiebre (80%), astenia (70%), adelgazamiento (70%), síndrome linfadenopático (40-70%), faringitis (50-70%), exantema macropapular con lesiones de 5-10mm de distribución universal que respeta palmas y plantas (40-80%), artromialgias (50-70%), náuseas, vómitos y/o diarrea (30-60%), cefalea (30-70%), diaforesis nocturna (50%), hepatoesplenomegalia (10-15%), úlceras orales o genitales (10-20%), neuropatía (5-10%). Un 5-10% pueden presentar cefalea, meningitis aséptica o, más raramente, otros síntomas neurológicos (convulsiones, meningoencefalitis, mielitis o síndrome de Guillain-Barré). Manifestaciones de laboratorio Linfopenia seguida de linfocitosis (disminución de la cifra de linfocitos CD4+, aumento de los linfocitos CD8+ y linfocitosis reactiva) (40%), trombocitopenia (50%), alteración de las pruebas de función hepática (20%), aumento de LDH y CK. Diagnóstico específico – ELISA negativo con carga viral elevada (>10.000) o antígeno p24 positivo. – WB negativo o indeterminado. Si el paciente es evaluado después de un mes de iniciadas las manifestaciones clínicas, tanto la prueba de ELISA de cuarta generación como el Western-blot suelen ser positivos. En estos casos se puede realizar un test de ELISA dual o detuned ELISA que, en caso de ser discordante, indica una infección reciente (menos de 6 meses) por el VIH-1. Diagnóstico diferencial Mononucleosis lyke syndrome (infección por virus de Epstein-Barr, citomegalovirus o toxoplasmosis), faringitis estreptocócica, rubéola, hepatitis A y B, secundarismo luético, infección gonocócica diseminada, infección primaria por virus del herpes simple y otros virus herpes como el tipo 6 (HHV-6), influenza, reacciones tóxicas medicamentosas (toxicodermias), ricketsiosis (fiebre botonosa mediterránea) y meningitis virales entre otras infecciones comunitarias. Exploraciones que se deben solicitar Una analítica generala, y las siguientes pruebas microbiológicas: Monospotb, IgM anti-VCAc y serología para VIHd, CMV, HHV-6, VHA, VHB, ricketsias, Toxoplasma gondii y lues (VDRL y pruebas treponémicas), pruebas para detección de la carga viral VIH-1 (o antigenemia p24), hemocultivos y frotis cervical, uretral, faríngeo o rectal para gonococo y Chlamydia, si procede. Tratamiento empírico Tratamiento sintomático y reposo. Valorar iniciar TARVe. aLa presencia de linfocitosis con >10% de linfocitos reactivos se observa en la infección por VEB, CMV o toxoplasma.
bLa prueba de Monospot detecta la presencia de anticuerpos heterófilos en la infección por VEB (anticuerpos que reaccionan con antígenos de superficie de hematíes de carnero y caballo). Durante la segunda semana es positiva en aproximadamente el 90% de los casos. En cerca de un 10% de pacientes (sobre todo en niños) es persistentemente negativa.
cIgM frente al antígeno de la cápside del VEB. Tienen una sensibilidad cercana al 100% y desaparecen al cabo de dos meses.
dLa detección de anticuerpos mediante ELISA de cuarta generación puede ser negativa durante las primeras 4 semanas. El Western-blot puede mostrar un patrón indeterminado. VCA: anticuerpos anticápside viral; CMV: citomegalovirus; HHV-6: virus del herpes humano tipo 6; VEB: virus de Epstein-Barr; VHA: virus de la hepatitis A; VHB: virus de la hepatitis B.
- 4.
Manifestaciones clínicas relacionadas con la infección por el VIH y que ponen de manifiesto una alteración moderada de la inmunidad celular como son por ejemplo la candidiasis oral o vaginal sobre todo si se trata de casos recurrentes, la leucoplasia vellosa oral, el Molluscum contagiosum, la trombocitopenia o la linfopenia y plaquetopenia no explicadas por otros motivos, la dermatitis seborreica, episodios de herpes zóster, la linfadenopatía generalizada, episodios de neumonía neumocócica, tuberculosis, displasia o carcinoma cervical en cualquier estadio.
- 5.
En los pacientes con alguna de las 26 enfermedades definitorias de sida como debut de la enfermedad16.
- 6.
En pacientes que presenten cualquier infección de transmisión sexual.
Si una persona con conducta de riesgo para adquirir la infección por VIH-1 contacta con el sistema sanitario y presenta una sintomatología clínica compatible con primoinfección, manifestaciones clínicas relacionadas con una alteración de la inmunidad celular o enfermedades sugestivas de sida y es previamente seronegativo o desconoce si puede estar infectado, debe realizarse una prueba serológica con capacidad de detectar anticuerpos frente a todos los grupos de VIH-1 y VIH-2. Tan sólo las pruebas de 3a y 4a generación cumplen con estos requisitos. Se diferencian entre ellas en que las de 4a generación tienen la capacidad adicional de detectar el antígeno p24 de VIH-1 en la misma reacción, acortando el período ventana en una semana17. Sin embargo pueden llegar a presentar hasta un 2% de falsos positivos. Si una prueba de 4a generación es positiva, se debe confirmar la infección por el VIH mediante Western-blot o inmunoensayo en línea (LIA). Si el resultado es negativo, puede tratarse de un falso positivo en el ELISA de 4a generación o bien que la positividad en este último se haya producido por la presencia de antígeno p24 en ausencia de anticuerpos (periodo ventana)17. En esta situación la determinación de la carga viral del VIH-1 puede ser de ayuda debiéndose tener en cuenta las siguientes consideraciones17: se ha descrito hasta un 4% de falsos positivos en población sin riesgo de infección; no detecta el VIH-2 ni el grupo O del VIH-1 y puede tener problemas de detección con subtipos no B del grupo M, es decir un resultado negativo no descartaría la infección y finalmente es una prueba no homologada para el diagnóstico de infección, tan sólo la constatación de la presencia de anticuerpos es indicativo de infección por VIH. Si finalmente es seronegativo y continúa manteniendo las conductas de riesgo, debe seguir controles clínicos y serológicos periódicamente (semestrales) y se le debe indicar que utilice medidas preventivas (p.ej., uso de preservativos, no compartir jeringuillas, etc) para evitar la adquisición de la infección y su posible transmisión en caso de que se produzca la primera situación. Si la actividad de riesgo es única, y los controles serológicos son negativos se puede dar de alta a los 6 meses.
Infección aguda por el VIH-1 (primoinfección)Se denomina infección aguda o primoinfección por el VIH13–15 al período de tiempo que transcurre entre el momento del contagio y la aparición de anticuerpos frente al VIH (4 semanas). La infección por el VIH es reciente cuando se diagnostica en los primeros 180 días. A partir de esa fecha el paciente tiene una infección crónica por el VIH.
Si la sospecha de primoinfección es elevada, como aún no hay anticuerpos (período ventana) debe determinarse la CV del VIH-1 en plasma o la determinación del antígeno p24, que está incluida en la prueba de ELISA de cuarta generación17. La sensibilidad y la especificidad de la CV del ARN del VIH-1 en plasma son del 100 y del 97% respectivamente. La sensibilidad y la especificidad de la antigenemia p24 en plasma son del 89 y del 100% respectivamente. Debe tenerse en cuenta que durante la primoinfección se han descrito algunos falsos negativos en pacientes con una carga viral baja (<10.000 copias/ml). En general, la CV del ARN del VIH-1 en el plasma de estos pacientes es muy elevada (superior a un millón de copias/ml) y es positiva desde la primera semana de la exposición. Las manifestaciones clínicas suelen aparecer a las dos semanas y la seroconversión se detecta con la prueba de ELISA de cuarta generación en la primera o segunda semana después del inicio de los síntomas. Con la prueba de ELISA de primera y segunda generación se suele tardar varios meses en detectar anticuerpos, ya que son menos sensibles que los actuales. Este hecho se puede utilizar para conocer el tiempo de la infección por VIH-1 aplicando un cociente entre ambos tipos de ELISA (detuned ELISA o ELISA dual)17.
En todos estos casos se debe confirmar la infección por el VIH mediante una prueba de Western-blot17. En la fase inicial, el Western-blot puede ser negativo o mostrar solo alguna banda (indeterminado), por lo que debe repetirse unas semanas más tarde. Alrededor del 80% de los pacientes presentarán síntomas durante la primoinfección por el VIH-1. Las manifestaciones clínicas y el diagnóstico diferencial se describen en la tabla 113–15. Existe una correlación entre el número de síntomas y la carga viral del paciente, de forma que a mayor número de síntomas mayor carga viral plasmática tienen los pacientes. Se ha sugerido que el deterioro inmunológico y la progresión a sida son más rápidos en los pacientes con un período de incubación corto o con síntomas de primoinfección de duración prolongada (>15 días). Algunos pacientes con inmunosupresión severa pueden desarrollar eventos B o C. En caso de confirmarse la infección aguda por el VIH-1, el paciente debe acabar de evaluarse como se indica más adelante, y debe valorarse la administración o no del TARV en base a los criterios definidos por GESIDA/PNS7.
Control clínico del paciente con infección crónica por VIH-1: evaluación inicial y seguimiento del pacienteLa infección por el VIH-1 es un proceso crónico y estos pacientes deberán controlarse de por vida. La anamnesis, la exploración física y las pruebas complementarias son los instrumentos que permitirán conocer su estadio clínico e inmunológico inicial e indicarán cuándo debe instaurarse el TARV, la profilaxis frente a determinadas infecciones oportunistas y el manejo terapéutico de las comorbilidades1–7. En la tabla 2 se especifica cómo debe efectuarse la primera visita y las visitas de seguimiento de los adultos y adolescentes asintomáticos que acuden a la consulta con una serología positiva para el VIH. Además, como el TARV ha mejorado la supervivencia a largo plazo de estos pacientes, deben evaluarse simultáneamente otros problemas generales de salud, como la enfermedad hepática por los virus de la hepatitis B o C, el riesgo de enfermedad cardiovascular, el riesgo de nefropatía, o la osteoporosis/osteopenia que pueden agravarse por la infección por el VIH-1 o el propio TARV, otras enfermedades de órgano y también se valorará el riesgo de transmisión del VIH y en las mujeres en edad fértil el deseo de embarazo18.
Control de los adultos y adolescentes asintomáticos que acuden a la consulta con serología positiva para el VIH-1
| Primera visita |
| Anamnesis |
| - Fecha aproximada de la infección. |
| - Potencial fuente de contagio. |
| - Conducta de riesgo del paciente (hábito sexual, drogas) y riesgo de transmisión del VIH. |
| - País de origen, profesión, aficiones y animales domésticos. |
| - Residencia actual y previa y viajes efectuados. |
| - Antecedentes de transfusiones o de administración de derivados hemáticos. |
| - Alergias medicamentosas, vacunaciones previas, medicación concomitante. |
| - Procesos infecciosos previos y sintomatología relacionada con el VIH-1. |
| - Trastornos cognitivos y neurológicos (tablas 3 y 4). |
| - Calidad de vida del paciente (tabla 5). |
| - Antecedentes familiares de enfermedades metabólicas (dislipidemia, diabetes, cardiovasculares). |
| - Problemas de salud asociados (dislipemia, diabetes, enfermedad cardiovascular, hepatopatía, nefropatía, psiquiátricos). |
| Exploración física |
| - Peso, talla, índice de masa corporal (IMC), perímetro abdominal y tensión arterial. |
| - Examen por aparatos buscando signos clínicos de progresión (eccema seborreico, muguet, leucoplasia vellosa) o diagnósticos de sida (sarcoma de Kaposi, demencia). También debe evaluarse si existen signos clínicos de hepatopatía crónica avanzada en pacientes coinfectados. |
| - En la mujer debe efectuarse examen ginecológico con citología. |
| - En el varón homosexual debe realizarse un tacto rectal y exploración del canal anal (anoscopia). |
| Pruebas diagnósticas (tabla 7) |
| Decisiones terapéuticas |
| - Iniciar la profilaxis primaria frente a P. jiroveci con cotrimoxazol en espera de los análisis si existen signos clínicos de progresión, sarcoma de Kaposi o linfopenia. |
| - Iniciar TARV si existen enfermedades definitorias de sida. Si el paciente está asintomático y solo tiene una determinación de CD4+ o de CV del RNA del VIH-1, se recomienda repetirlas y valorar la adherencia y el inicio del TARV en la segunda visita en base a los resultados virológicos e inmunológicos, las comorbilidades y el riesgo de transmisión del VIH. |
| - Ofrecer soporte psicológico y consejos para prevenir la transmisión del VIH-1, indicar que debería descartarse en su/s pareja/s actual o previas la infección por VIH-1, normas para prevenir la adquisición de determinadas infecciones (tabla 13) a través de la profesión, aficiones, animales domésticos, alimentación y viajes, consejos sobre la dieta adecuada, evitar tabaco y alcohol, normas para evitar estímulos del sistema inmunológico, contraindicar inicialmente el embarazo a las mujeres y efectuar educación sanitaria y soporte psicológico para los convivientes (pareja, familia). |
| Segunda visita (a las dos semanas) y controles posteriores |
| Anamnesis y exploración física |
| - Identificar la sintomatología relacionada con el VIH-1. |
| - Valorar la calidad de vida del paciente. |
| - Control del peso y cambios de la grasa corporal. |
| - Buscar signos de progresión o diagnósticos de sida. |
| - Anualmente en la mujer debe efectuarse examen ginecológico con citología. |
| - Anualmente en el varón homosexual debe realizarse un tacto rectal, exploración del canal anal y citología. |
| - Anualmente valorar repetir las serologías para el PPD, la sífilis, el CMV, la toxoplasmosis y los virus de la hepatitis B y C si fueron negativas. |
| Decisiones terapéuticas |
| - Estadiar al paciente según la clasificación de la infección por VIH-1 (CDC, enero de 1993). |
| - En pacientes asintomáticos iniciar el TARV según el recuento de CD4, la CV VIH-1, las comorbilidades y el riesgo de transmisión del VIH. |
| - Iniciar o mantener la profilaxis primaria frente a P. jiroveci con cotrimoxazol. |
| - Dada la variabilidad de los resultados de las cifras de linfocitos CD4+ (tabla 11), en todos los casos deberán realizarse dos determinaciones de la cifra de CD4+ antes de tomar decisiones terapéuticas. |
| - Valorar inmunización para virus influenza anualmente, neumococo (cada 5 años) y virus VHB y VHA si la serología es negativa (siempre administrar después de la determinación de carga viral, dado que la carga viral plasmática del VIH-1 aumenta con los estímulos inmunológicos). |
| - Si el PPD o las pruebas de detección del gamma-interferón son positivas, se administrará quimioprofilaxis de la infección tuberculosa latente si no existe evidencia de enfermedad tuberculosa. |
| Periodicidad de los controles posteriores y pruebas diagnósticas |
| - Controles clínicos cada 3-6 meses. |
| - Controles analíticos según tabla 7. |
| - PPD/Pruebas de detección de gamma-interferón anualmente si fue negativo y mantiene exposición de alto riesgo. |
| - En los pacientes con una hepatitis crónica por los VHB o VHC solicitar una ecografía abdominal, elastografía hepática (Fibroscan®) y valorar una biopsia hepática según los resultados. |
| - Si hay dislipemia o hiperglicemia evaluar el riesgo de enfermedad cardiovascular y, si es necesario, iniciar dieta y/o medicación hipolipemiante-hipoglicemiante |
En relación con la infección por VIH-11–7
- 1.
Intentar conocer la fecha aproximada de la infección utilizando como referencia la fecha de inicio de la conducta de riesgo (drogadicción o relaciones sexuales) o la fecha de un cuadro clínico compatible con la primoinfección. Estos datos son importantes ya que los pacientes con primoinfección sintomática progresan con mayor rapidez y presentan una CV del ARN del VIH-1 en plasma más elevada, y en combinación con los datos clínicos y exámenes complementarios se podrá estratificar a estos pacientes como progresores rápidos, lentos o no progresores a largo plazo (LTNP).
- 2.
Intentar identificar a la persona que ha sido la fuente potencial de la infección para conocer si puede haber transmitido una cepa de VIH resistente, si estaba tomando TARV y tenía fracaso virológico, lo que puede cambiar el enfoque terapéutico. En todos los casos el estudio de resistencias está recomendando.
- 3.
Conocer la conducta de riesgo del paciente (p. ej., adicción a drogas por vía intravenosa o tipo de relaciones sexuales) ya que puede permitir identificar precozmente la afección específica asociada a dicha conducta de riesgo (p. ej., enfermedades de transmisión sexual o infección por virus de la hepatitis A, B y C) y el riesgo que existe de transmisión del VIH ya que puede condicionar el inicio del TARV. En los pacientes exdrogadictos debe preguntarse si están recibiendo terapia sustitutiva con metadona por las potenciales interacciones con algunos antirretrovirales.
- 4.
Conocer el país de origen, los países en los que ha residido y los viajes que ha efectuado el paciente, sobre todo a países en vías de desarrollo, con el fin de tener presentes los microorganismos endémicos de aquellas áreas geográficas (p. ej., histoplasmosis, estrongiloidiasis, tripanosomiasis, ciclosporidiasis o HTLV-1). Así mismo con el aumento de la inmigración y la facilidad para los viajes internacionales, están aumentando el número de infecciones por subtipos no-B del VIH-1, o por el VIH-29,17.
- 5.
Conocer la profesión, las aficiones y el tipo de alimentación del paciente, así como si posee animales o pájaros domésticos, ya que puede estar expuesto a determinados patógenos.
- 6.
Conocer las vacunaciones del adulto que ha recibido (antitetánica, antineumocócica, antihepatitis A y B o antigripal). Preguntar por antecedentes de transfusiones o derivados hemáticos.
- 7.
Valorar los antecedentes de alergia a medicamentos (p. ej., sulfamidas, rifampicina o penicilina), que se utilizarán con frecuencia para prevenir o tratar infecciones oportunistas.
- 8.
Conocer los eventos B y C del VIH que ha tenido el paciente. Esto puede permitir identificar procesos (p. ej., muguet o neumonía por Pneumocystis jiroveci, tuberculosis) que pueden reactivarse y ser tributarios de profilaxis antimicrobiana o de indicar el inicio del TARV1–7.
- 9.
Preguntar si tiene análisis previos, relacionados o no con su afección, ya que pueden ser de ayuda para conocer el estadio y la evolución de su infección (p. ej., linfopenia, plaquetopenia) y poner de manifiesto comorbilidades asociadas (p. ej., hiperglucemia, dislipemia, hepatopatía crónica o insuficiencia renal).
- 10.
Efectuar una anamnesis por sistemas con el fin de identificar síntomas actuales asociados a la infección por VIH-1 (p. ej., muguet, síntomas de órgano, síntomas constitucionales o trastornos cognitivos relacionados con la demencia asociada al sida) (tablas 3 y 4)19,20. Esta información puede permitir efectuar un diagnóstico y tratamiento precoz de las enfermedades diagnósticas de sida (infecciones oportunistas, neoplasias y demencia) e indicar el inicio del TARV.
Tabla 3.Evaluación de la demencia asociada al VIH en base a una escala internacional validada
Pedir al paciente antes de iniciar los tres ejercicios, que repita las 4 palabras (memoria) como por ejemplo las siguientes: perro, sombrero, judías y rojo. Las debe repetir de nuevo si no las recuerda hasta que las repita correctamente y decirle que las memorice, ya que las deberá recordar al final de los ejercicios: 1. Rapidez motora: pedir al paciente que realice una simulación de pinza con su primer y segundo dedo de la mano no dominante, tan amplio y rápido como sea posible. a) 15 pinzas en 5 segundos=4 puntos b) 11-14 pinzas en 5 segundos=3 puntos c) 7-10 pinzas en 5 segundos=2 puntos d) 3-6 pinzas en 5 segundos=1 punto e) 0-2 pinzas en 5 segundos=0 puntos 2. Rapidez psicomotriz: pedir al paciente que realice movimientos secuenciales y sucesivos de la mano no dominante tan rápido como sea posible, según el siguiente orden, primero mano extendida y palma hacia arriba, sobre una superficie plana (escritorio o la mesa de la evaluación); segundo, mano extendida y palma hacia abajo sobre la misma superficie plana y tercero mano extendida perpendicular a la misma superficie plana, con base en el quinto dedo. a) 4 secuencias en 10 segundos=4 puntos b) 3 secuencias en 10 segundos=3 puntos c) 2 secuencias en 10 segundos=2 puntos d) 1 secuencia en 10 segundos=1 punto e) no puede realizar la prueba=0 puntos 3. Memoria: pedir al paciente que recuerde las 4 palabras que memorizó previamente. a) 1 punto por cada palabra correcta que recuerde y medio punto si requirió ayuda semántica. Fuente: Sacktor NC19.
La puntuación máxima de los tres ejercicios es de 12 puntos (4 puntos por ejercicio). Todos los pacientes con 10 puntos o menos deberían estudiarse por si padecen una posible demencia asociada al VIH.
Tabla 4.Escala de gravedad del complejo de demencia del sida
Grado 0 (normal)* Exploración cognitiva y neurológica normales. Grado 1 (leve) EI paciente precisa alguna ayuda para ciertos aspectos de su vida cotidiana. Existe evidencia inequívoca de alteración motora o cognitiva. Puede andar sin ayuda. Grado 2 (moderado) Existen criterios moderados de demencia. Puede efectuar las actividades básicas de cuidado personal, pero sin mantener una actividad laboral y precisando ayuda en gran parte de las actividades cotidianas. Puede andar requiriendo ayuda ocasional. Grado 3 (grave) Incapacidad intelectual (bradipsiquia e imposibilidad de seguir el argumento de una conversación) o incapacidad motora (no puede deambular sin ayuda, precisa asistencia para su cuidado personal, bradicinesia marcada). Grado 4 (vegetativo) Las actividades sociales e intelectuales se encuentran en un nivel rudimentario. Existe alteración del habla hasta llegar al mutismo. Paraparético o parapléjico, con incontinencia esfinteriana. Fuente: Modificado de Price y Brew20.
*Si existe algún test neuropsicológico alterado, se puntúa 0,5.
- 11.
Evaluar el grado de autonomía del paciente mediante los tests apropiados (tabla 5).
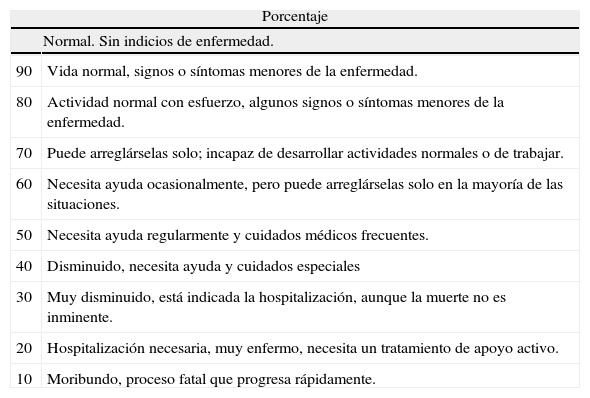
Tabla 5.Calidad de vida (índice de Karnofsky)
Porcentaje Normal. Sin indicios de enfermedad. 90 Vida normal, signos o síntomas menores de la enfermedad. 80 Actividad normal con esfuerzo, algunos signos o síntomas menores de la enfermedad. 70 Puede arreglárselas solo; incapaz de desarrollar actividades normales o de trabajar. 60 Necesita ayuda ocasionalmente, pero puede arreglárselas solo en la mayoría de las situaciones. 50 Necesita ayuda regularmente y cuidados médicos frecuentes. 40 Disminuido, necesita ayuda y cuidados especiales 30 Muy disminuido, está indicada la hospitalización, aunque la muerte no es inminente. 20 Hospitalización necesaria, muy enfermo, necesita un tratamiento de apoyo activo. 10 Moribundo, proceso fatal que progresa rápidamente.
En relación con problemas generales de salud1–7,18
- 1.
Enfermedad cardiovascular (tabla 6): se deberá conocer si existen antecedentes familiares o personales de uno o más de estos factores de riesgo: hipertensión arterial, diabetes mellitus, dislipemia o antecedentes de enfermedad cardiovascular. También se valorará la edad del paciente, si existe hábito tabáquico, obesidad o vida sedentaria. El riesgo cardiovascular se debe conocer mediante las ecuaciones de Framingham, SCORE u otras (Framingham Point Score: http://hp2010.nhlbihin.net/atpiii/calculator.asp; SCORE Risk Charts: http://www.escardio.org/communities/EACPR/toolbox/health-professionals/Pages/SCORE-Risk-Charts.aspx). En los varones se preguntará si consumen anabolizantes, ya que ello puede empeorar la dislipemia o alterar la función hepática, y en todos los pacientes por el consumo de cocaína, que aumenta el riesgo cardiovascular. Se comentará al paciente los factores que puede corregir, recomendándole dejar de fumar y realizar alguna actividad deportiva y se tendrán en cuenta dichos factores de riesgo al elegir el TARV y al evaluar la necesidad de iniciar un tratamiento hipolipemiante3.
Tabla 6.Actividades preventivas para el diagnóstico y seguimiento de los factores de riesgo cardiovascular
Hipertensión arterial Definición: presión arterial (PA) sistólica ≥140 y/o presión arterial diastólica ≥90mmHg. Metodología: si la primera toma es ≥140/90mmHg se debe medir la PA por lo menos en tres ocasiones separadas en el tiempo. En cada visita se tomará la PA como mínimo dos veces, separadas entre sí más de 1min. Recomendación: se recomienda tomar la PA al menos una vez hasta los 14 años de edad; cada 4 o 5 años desde los 14 hasta los 40 años de edad, y cada dos años a partir de los 40 años, sin límite superior de edad. Dislipemia Definición: cifras límite colesterol total entre 200 y 249 mg/dl. Se considera dislipemia cuando las cifras de colesterol total ≥250 mg/dl o las cifras de triglicéridos son >150 mg/dl. Metodología: concentraciones séricas, dos determinaciones separadas en el tiempo. Recomendación: se recomienda realizar una determinación de Col total sérico y Col-HDL al menos una vez en varones antes de los 35 años y en mujeres antes de los 45 años. Después, cada 5 o 6 años hasta los 75 años. En >75 años se realizará una determinación si no se les había practicado ninguna anteriormente. Diabetes Definición: glucemia basal ≥126 mg/dl, glicemia plasmática ≥200 mg/dl con sintomatología, HbA1c ≥6,5%. Recomendación: no se recomienda cribado poblacional, pero sí se recomienda cribado en personas con riesgo como antecedentes familiares de diabetes de primer grado, sobrepeso u obesidad, HTA, dislipemia, diabetes gestacional, glicemia basal alterada o tolerancia alterada a la glucosa o miembros de etnias de alta prevalencia. Si fuera normal, repetirlo cada tres años. Se recomienda ejercicio físico y modificaciones dietéticas como medidas para controlar el peso en pacientes con riesgo aumentado de DM-2. Obesidad Recomendación: se recomienda medir el perímetro abdominal a los pacientes que presenten un abdomen prominente de forma visual para determinar si tienen o no obesidad abdominal (perímetro abdominal >102cm en hombres y >88cm en mujeres). En caso positivo, intervenir sobre los estilos de vida, dieta y actividad física. Tabaco Recomendación: preguntar en cada visita por el consumo de tabaco a las personas mayores de 10 años y registrar el consumo en la historia clínica. La periodicidad mínima de esta detección debe ser de una vez cada dos años. No es necesario reinterrogar a las personas mayores de 25 años en las que se tenga constancia en la historia clínica que nunca han fumado. Se considera que una persona fuma cuando lo ha hecho diariamente durante el último mes, y esto incluye cualquier cantidad de cigarrillos, incluso uno. Todas las personas que fuman deben recibir un consejo claro y personalizado, debe ofrecérseles ayuda para dejar de fumar y se debe fijar un seguimiento mínimo durante las primeras semanas después de dejar de hacerlo. Durante el primer año después de dejar de fumar, las personas deben recibir consejos de refuerzo en cada visita. Se considera exfumadora a la persona que lleva al menos un año sin fumar. En estas personas es importante seguir preguntando por el consumo de tabaco al menos una vez cada dos años. Actividad física* Recomendaciones: 1) preguntar a los pacientes acerca de sus hábitos de actividad física. Esto se puede hacer con las preguntas sencillas y específicas que cada profesional sanitario considere oportunas o con algún cuestionario estandarizado; 2) valorar el hábito de actividad física del paciente: activo, si hace ejercicio o deporte regularmente, o alcanza un gasto calórico diario de 3.000 kcal; parcialmente activo, si realiza algún tipo de ejercicio o deporte esporádicamente; inactivo, si no realiza ningún tipo de ejercicio o deporte y su gasto calórico diario es <3.000kcal; 3) aconsejar que inicie, aumente o mantenga la práctica de algún ejercicio físico o deporte con los requisitos de duración, frecuencia e intensidad previamente definidos, y 4) repetir los pasos anteriores en los nuevos contactos con el paciente, siempre que sea posible, con una periodicidad no inferior a tres meses ni superior a dos años. * ÓPTIMA Ejercicio 30 minutos al día, más de 3 días a la semana o caminar 30-45 minutos cada día; MODERADA Ejercicio < 30 minutos al día, < de 3 días a la semana o caminar < 30 minutos al día; SEDENTARIO No actividad física. Fuente: Sociedad Española de Medicina de Familia y Comunitaria24.
- 2.
Enfermedad hepática21: en los pacientes con hipertransaminasemia deberá evaluarse si ésta es debida a una infección crónica por los virus de la hepatitis B, C y/o D y/o al abuso de alcohol. Si persiste la hipertransaminasemia (>6 meses), se recomendará la realización de pruebas complementarias para conocer el grado de afectación hepática (ecografía abdominal, elastografía o biopsia hepática). La coinfección por VIH y el consumo de alcohol o cannabis puede acelerar el curso natural de estas infecciones, y el TARV puede originar diversos grados de hepatotoxicidad. Se comentará al paciente los factores que puede corregir, recomendándole dejar de consumir alcohol y cannabis y evitar el uso de medicamentos potencialmente hepatotóxicos. Los pacientes cirróticos deben valorarse para trasplante hepático22.
- 3.
Nefropatía o insuficiencia renal, ya que puede indicar el inicio de TARV y condicionar el tipo de tratamiento. Los pacientes en terapia renal sustitutiva deben valorarse para trasplante renal22.
- 4.
Antecedentes psiquiátricos, ya que puede condicionar la selección del tipo de TARV.
- 5.
Otros procesos en varones: en los varones de más de 50 años de edad se preguntará por posibles antecedentes de síndrome prostático.
- 6.
Otros procesos en mujeres: a las mujeres en edad fértil se les preguntará por el deseo reproductivo o si están embarazadas, ya que debería iniciarse un TARV seguro para el feto para evitar la transmisión materno-fetal del VIH. Se preguntará si existen antecedentes familiares de neoplasia de mama o si han apreciado alguna tumoración durante la autoexploración y a las mayores de 50 años se recomendará la realización de una mamografía cada dos años. En las mujeres postmenopáusicas no se les recomendará la terapia hormonal sustitutiva por el riesgo de neoplasia de mama, enfermedad cardiovascular o tromboembólica3.
- 7.
A todos los pacientes se les preguntará por los tratamientos médicos que reciben y productos naturales que toman por las potenciales interacciones con los antirretrovirales, por la presencia de factores de riesgo de cáncer colorrectal y se tienen factores de riesgo de osteoporosis/osteopenia (mujeres postmenopáusicas mayores de 65 años o en más jóvenes y en toda persona con más de 50 años con uno o más de los siguientes factores de riesgo: raza blanca, vida sedentaria, tabaquismo, alcoholismo, tratamiento con fenitoína o esteroides, hiperparatiroidismo, déficit de vitamina D, enfermedades tiroideas e hipogonadismo)3. La edad mayor de 50-60 años puede ser un criterio por si mismo para el inicio del TARV. Es muy importante conocer todas estas comorbilidades ya que pueden influir en la elección de los medicamentos antirretrovirales que deben componer el primer régimen antirretroviral.
- 1.
En relación con el VIH-1: la infección por VIH puede afectar de forma directa o a través de un evento B o C a cualquier órgano o sistema. Debe describirse en cada control el estado general del paciente y conocerse su altura y peso con el fin de tener su índice de masa corporal (IMC), el perímetro abdominal y la presión arterial3. La exploración física por aparatos debe ser minuciosa, explorando de forma sistemática la piel, las regiones ganglionares palpables, la cavidad oral, los genitales, la región anal y el sistema nervioso, evaluando si existen trastornos cognitivos o alteraciones neurológicas que permitan identificar de forma precoz la demencia asociada al sida (tablas 3 y 4)19,20. Debe preguntarse si existen alteraciones visuales en pacientes avanzados (cifra de linfocitos CD4<50 cél/mm3) para descartar una retinitis por citomegalovirus. La presencia de visceromegalias (hepato y/o esplenomegalia) debe hacer descartar la existencia de una cirrosis por los virus de la hepatitis B y/o C, una infección por micobacterias o leishmania o una enfermedad hematológica. En la mujer debe efectuarse una exploración ginecológica para descartar úlceras genitales o condilomas y una citología cervical cada 6-12 meses para descartar una displasia o carcinoma de cérvix3. En los varones homosexuales debe realizarse un tacto rectal y una exploración del canal anal, recomendándose realizar citologías rectales con la misma periodicidad si existe riesgo de carcinoma rectal3. En ambas situaciones se hará un cribaje de la infección por papilomavirus humano. Si el examen físico es normal, se obtendrán unos datos básicos que servirán de referencia para futuros controles, y si existen anomalías, éstas pueden permitir identificar signos clínicos de progresión (p. ej., muguet, leucoplaquia vellosa o eccema seborreico) o diagnósticos de sida (p. ej., sarcoma de Kaposi).
- 2.
En relación con problemas generales de salud: en las mujeres mayores de 50 años se debe realizar una exploración mamaria anual3. En los varones mayores de 50 años debe considerarse la realización de un tacto prostático3.
En la tabla 7 se especifican los exámenes complementarios que deben efectuarse cuando un paciente infectado o con riesgo de infección por VIH-1 se visita por primera vez y en las visitas sucesivas3,4,7,18. Los exámenes complementarios buscan los siguientes objetivos:
- 1.
Confirmar la infección por VIH-1. Debe realizarse una prueba ELISA y si es positiva, confirmarse con un Western-blot17.
- 2.
Conocer su situación inmunológica y virológica. Se solicitarán las subpoblaciones linfocitarias CD4 y CD8, la carga viral del ARN del VIH-1 en plasma, un test genotípico de resistencias y el tropismo viral3,18. Esta información permitirá conocer: a) el riesgo que tiene un paciente de desarrollar sida; b) el momento de instaurar la profilaxis primaria frente a determinados microorganismos; c) el momento de iniciar el TARV en pacientes con una infección crónica por el VIH-1 y los antirretrovirales que podemos utilizar al conocer los resultados del test de resistencias; d) el subtipo viral (B frente a no-B) que nos puede indicar si la infección la ha transmitido un paciente no europeo; e) el tropismo viral (R5, X4, dual/mixto) que nos indicará si se pueden utilizar los inhibidores del CCR5 y el riesgo de progresión (más rápido cuando el tropismo no es R5). Además, se debe solicitar la determinación del HLAB57*01 si al paciente se le quiere administrar abacavir en el régimen de TARV ya que si el resultado es positivo existe un riesgo muy elevado de desarrollar una reacción de hipersensibilidad al abacavir4–7. Por otra parte, existen otras pruebas que actualmente no se hacen de forma rutinaria (como la determinación de la carga viral en secreciones genitales o en el líquido cefalorraquídeo, la detección de poblaciones de resistencia minoritarias, la replicación viral subyacente, los estudios del funcionalismo linfocitario en sangre periférica o en mucosa digestiva [GALT] o del timo y determinación de algunas citocinas) que en un futuro podrían ser necesarias para tener un mejor manejo clínico y/o terapéutico del paciente.
- 3.
Solicitar un hemograma, recuento de plaquetas, bioquímica completa en ayunas que incluya la glucemia basal, el perfil lipídico (colesterol, HLD, LDL y triglicéridos), creatinina, sodio, potasio, filtrado glomerular (mediante la ecuación de MDRD o la de Cockroft-Gault), calcio, fosfato, función hepática completa, LDH, sedimento de orina, proteinuria y glucosuria (mediante tira reactiva), las proteínas totales, la albúmina, las amilasas y lipasas, la CPK y las pruebas de coagulación, un ECG y una radiología de tórax basales, que sirvan de referencia para futuros controles3,18. Puede ser preciso determinar si existe déficit de glucosa-6-fosfato deshidrogenasa en algunas etnias o razas si se debe administrar dapsona, primaquina o sulfonamidas. También se realizará la prueba de embarazo en mujeres en edad fértil en las que se considere utilizar efavirenz18. La velocidad de sedimentación globular a la primera hora (VSG) suele aumentar a medida que progresa la infección por VIH-1, pero si el paciente tiene una VSG superior a 100mm se descartará un síndrome linfoproliferativo o una infección sistémica por micobacterias, hongos o citomegalovirus (CMV). El paciente puede presentar diversos grados de trombocitopenia en relación con la infección por VIH-1, la drogadicción o la coinfección por los virus de la hepatitis B y C. En fases avanzadas puede presentar una ligera a moderada pancitopenia. Si es muy acusada, debe sospecharse afectación de la médula ósea por un proceso infeccioso (micobacterias, hongos o leishmania), un síndrome linfoproliferativo o un hiperesplenismo secundario a hipertensión portal asociada a una cirrosis hepática y, con menor frecuencia, a un síndrome mielodisplásico. La función hepática puede estar alterada por coinfecciones por los virus de la hepatitis B o C, diversos procesos infecciosos (infecciones por micobacterias y Leishmania), neoplásicos o por toxicidad medicamentosa. Si los pacientes desarrollan una colostasis en fases avanzadas de la infección por VIH-1, debe descartarse la afectación hepatobiliar por citomegalovirus, Cryptosporidium o Microsporidium. En los drogadictos suele existir casi siempre, una hipertransaminasemia que refleja diversos grados de hepatitis crónica/cirrosis hepática por los virus B, C y el agente D. Las cifras de LDH suelen ser normales en los pacientes infectados por VIH-1. Su incremento se debe a necrosis celular y, en el contexto clínico adecuado, obliga a descartar la neumonía por P. jiroveci y el linfoma. La función renal y el sedimento de orina suelen ser normales, pero pueden alterarse por nefrotoxicidad medicamentosa, glomerulopatías en relación o no con el VIH-1 e infecciones. El ionograma puede modificarse en caso de insuficiencia suprarrenal por citomegalovirus o micobacterias o si el paciente tiene un proceso neurológico (p. ej., meningitis tuberculosa) y un síndrome de secreción inadecuada de hormona antidiurética (ADH). En fases avanzadas, también suele observarse hipocolesterolemia, hipertrigliceridemia, hipoalbuminemia e hipergammaglobulinemia. La infección por el VIH-1 puede originar hipogonadismo, por lo que en ocasiones puede ser útil la determinación de los niveles de testosterona. Finalmente no se recomienda determinar de forma rutinaria los niveles de ácido láctico.
- 4.
Realizar exámenes neuropsicológicos periódicos para detectar precozmente el deterioro cognitivo-motor menor asociado al VIH-13. Las alteraciones cognitivas, conductuales y/o motoras suelen ser la primera manifestación de la afectación neurológica por la infección por el VIH-1 (tablas 3 y 4)19,20.
- 5.
Identificar las infecciones latentes, con el fin de saber qué infecciones se pueden reactivar y se deben prevenir mediante la profilaxis con antimicrobianos o vacunaciones3,4,7,18. Para conocer si existe tuberculosis latente se efectuará una PPD con 5UT y las pruebas de detección de gamma-interferón (T-SPOT-TB® o Quantiferon-Gold Test in Tube®). En caso de que fueran positivos debe descartarse la enfermedad tuberculosa y administrar quimioprofilaxis. También se solicitarán las serologías para Toxoplasma gondii, citomegalovirus y virus de la varicela. En los pacientes con IgG positivo para citomegalovirus y una cifra de linfocitos CD4 menor de 50 céls/μl se solicitará el ADN del CMV en sangre periférica para descartar viremia y un examen ocular para descartar una retinitis por citomegalovirus. Se debe solicitar los marcadores serológicos de los virus de la hepatitis A (IgG-VHA), de la hepatitis B (HbsAg, anti-HBc y anti-HBs) y de la hepatitis C21. Si el paciente es portador del virus de la hepatitis B (HbsAg positivo) deben solicitarse además marcadores de replicación del virus B (antígeno e y ADN cualitativo o cuantitativo del VHB) y marcadores de infección por el virus delta (anticuerpos y antígeno delta). Si la serología de la hepatitis C es positiva deben realizarse la determinación de la carga viral (ARN cualitativo o cuantitativo del VHC) y si el resultado es positivo el genotipo del VHC. Estos marcadores permitirán determinar si los pacientes deben vacunarse frente al VHA y VHB o si existe una infección activa por los VHB o VHC. En todas las personas con antecedentes de promiscuidad sexual, y en particular en homosexuales y en trabajadoras del sexo, se debe solicitar la serología luética (pruebas reagínicas [VDRL o RPR] y pruebas treponémicas [TPHA]). Se realizará una punción lumbar para descartar neurosífilis si existen sintomatología neurológica u ocular, una sífilis de más de un año de duración, tienen una cifra de linfocitos CD4<350 cél/μl y un VDRL/RPR>1/321,23. También se recomienda realizar un frotis faríngeo, un frotis anal/vaginal y una muestra de orina para gonococo y Chlamydia y en las mujeres un examen de las secreciones vaginales para Trichomonas, ya que la infección puede ser oligosintomática3. Los pacientes infectados por el VIH y el papilomavirus humano tienen un mayor riesgo de displasia y cáncer anogenital3. Por ello, en las mujeres se debe efectuar una citología cervical cada 6-12 meses ya que pueden presentar displasia o un carcinoma cervical invasivo3. También se recomienda realizar una citología rectal a los varones homosexuales con riesgo de carcinoma anal3. A los varones homosexuales se debe solicitar un estudio de parásitos en heces para descartar una infección que se haya transmitido por vía fecal-oral. En los inmigrantes o personas que hayan vivido en áreas endémicas se deben descartar las infecciones por HTLV1, VIH-2, Trypanosoma cruzi (enfermedad de Chagas), histoplasmosis y Strongyloides stercolaris según el área geográfica de procedencia.
- 6.
Identificar problemas de salud asociados:
- a.
Alteraciones metabólicas3,24: como los inhibidores de la proteasa pueden originar resistencia a la insulina y dislipemia, se recomienda realizar basalmente y en ayunas una glucemia y un perfil lipídico que incluya la determinación de triglicéridos, colesterol total y sus fracciones (LDL/HDL). Si hay antecedentes de hiperglucemia (110-126mg/dl) se debe realizar una curva de sobrecarga de glucosa y, si existe diabetes (glucemia mayor 126mg/dl), se determinará la hemoglobina glicosilada (normal <6,5%) y se remitirá el paciente al endocrinólogo. Si existe hipercolesterolemia o hipertrigliceridemia se debe recomendar dieta hipolipemiante y valorar el inicio de un tratamiento hipolipemiante en base al riesgo que exista de enfermedad cardiovascular24.
- b.
Enfermedad hepática por VHB y/o VHC y/o alcohol21: en los pacientes con una hipertransaminasemia prolongada (>6 meses) y marcadores de infección activa por el VHB y/o VHC se recomendará la realización de una ecografía abdominal, una elastografía hepática (Fibroscan®) y una biopsia hepática que indicarán el grado de afectación hepática (hepatitis crónica frente a cirrosis hepática) y si existen criterios de tratamiento antiviral en la hepatitis crónica por los VHB o VHC. En los pacientes con cirrosis se debería realizar una fibrogastroscopia para detectar la presencia de varices esofágicas y semestralmente se debería repetir una ecografía abdominal y una determinación de alfa-fetoproteína con objeto de detectar precozmente la presencia de hepatocarcinoma. Los pacientes con cirrosis hepática deberían evaluarse para trasplante hepático22.
- c.
Drogadicción: si el paciente no sigue controles en un centro de deshabituación y existe el antecedente de drogadicción, se recomienda la monitorización toxicológica en orina y el seguimiento en un centro de drogodependencias.
- d.
Neoplasias3,24. Cáncer de mama: se recomienda realizar el cribado del cáncer de mama a las mujeres mayores de 50 años con mamografía cada dos años. Cáncer de pulmón: se recomienda realizar un consejo claro y personalizado para dejar de fumar. No hay datos suficientes para recomendar el cribado sistemático del cáncer de pulmón. Cáncer colorrectal (CCR): supone la segunda causa de muerte en el mundo occidental25. Se recomienda realizar una adecuada clasificación del grado de riesgo de CCR a través de una completa historia personal y familiar, que favorezca la búsqueda activa de las personas con factores de riesgo elevado. Se recomienda el cribado de CCR en las personas de riesgo medio a partir de los 50 años, con alguna de las siguientes estrategias: análisis de sangre oculta en heces cuantitativa con periodicidad anual o bienal y/o sigmoidoscopia cada 5 años o colonoscopia cada 10 años. Se recomienda establecer la coordinación necesaria con los programas poblacionales de cribado del CCR, allí donde se hayan implantado. En los individuos con pólipos adenomatosos esporádicos de riesgo se recomienda una colonoscopia a los tres años de la resección, y si ésta es negativa o únicamente se han hallado uno o dos adenomas tubulares de tamaño menor de10mm, la siguiente exploración puede realizarse al cabo de 5 años. Cáncer de próstata: no hay pruebas científicas suficientes para recomendar el cribado sistemático del cáncer de próstata en las personas asintomáticas. Los pacientes que soliciten ser cribados deben ser informados correctamente acerca de los beneficios y los riesgos del cribado y el tratamiento. El método utilizado es la determinación del PSA (antígeno prostático específico) en suero en los hombres de 50-70 años y en aquellos con factores de riesgo a partir de los 45 años24.
- e.
Otros procesos: en los varones homosexuales, si existe antecedente de rectorragias, deberá realizarse una rectoscopia con fines diagnóstico. En los pacientes con factores de riesgo de osteoporosis/osteopenia, se realizará una densitometría ósea (DEXA) basal3.
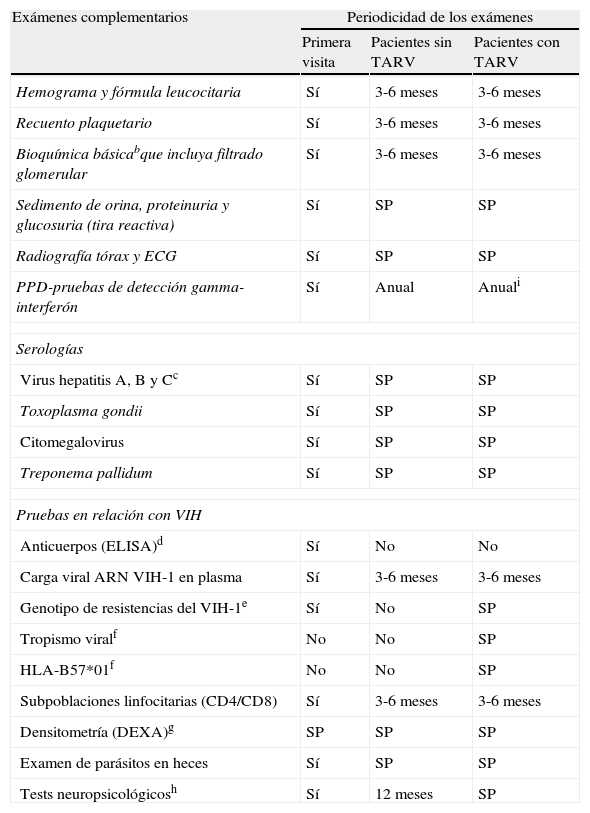
Pruebas complementarias que deben efectuarse a un paciente infectado por VIH-1a
| Exámenes complementarios | Periodicidad de los exámenes | ||
| Primera visita | Pacientes sin TARV | Pacientes con TARV | |
| Hemograma y fórmula leucocitaria | Sí | 3-6 meses | 3-6 meses |
| Recuento plaquetario | Sí | 3-6 meses | 3-6 meses |
| Bioquímica básicabque incluya filtrado glomerular | Sí | 3-6 meses | 3-6 meses |
| Sedimento de orina, proteinuria y glucosuria (tira reactiva) | Sí | SP | SP |
| Radiografía tórax y ECG | Sí | SP | SP |
| PPD-pruebas de detección gamma-interferón | Sí | Anual | Anuali |
| Serologías | |||
| Virus hepatitis A, B y Cc | Sí | SP | SP |
| Toxoplasma gondii | Sí | SP | SP |
| Citomegalovirus | Sí | SP | SP |
| Treponema pallidum | Sí | SP | SP |
| Pruebas en relación con VIH | |||
| Anticuerpos (ELISA)d | Sí | No | No |
| Carga viral ARN VIH-1 en plasma | Sí | 3-6 meses | 3-6 meses |
| Genotipo de resistencias del VIH-1e | Sí | No | SP |
| Tropismo viralf | No | No | SP |
| HLA-B57*01f | No | No | SP |
| Subpoblaciones linfocitarias (CD4/CD8) | Sí | 3-6 meses | 3-6 meses |
| Densitometría (DEXA)g | SP | SP | SP |
| Examen de parásitos en heces | Sí | SP | SP |
| Tests neuropsicológicosh | Sí | 12 meses | SP |
Fuente: Hammer SM1, Spach DH2, Aberg JA3, Clumeck N4, Panel de expertos de GESIDA y Plan Nacional sobre el Sida7 y Lozano F18.
aSi existe promiscuidad sexual, efectuar frotis cervical, faríngeo, rectal y anal para gonococo y Chlamydia. Solicitar anualmente, en mujeres citología cervical y en varones, rectal si existe riesgo de carcinoma de cérvix o anal (virus del papiloma humano). En los varones debe solicitarse el PSA a partir de los 50 años y en las mujeres una mamografía a partir de los 50 años. bLa bioquímica básica debe incluir la glucemia, colesterol, triglicéridos, HDL, LDL, triglicéridos, ácido úrico, creatinina, sodio, potasio, calcio, fosfato, filtrado glomerular (MDRD o Cockroft-Gault), función hepática completa, LDH, CPK, amilasas y lipasas. cSi el antígeno Australia (HbsAg) o la serología VHC son positivas, solicitar en plasma el ADN del VHB y ARN cuantitativo y genotipo del VHC. dSi el paciente solo tiene un examen previo, debe solicitarse otro test de ELISA o de Western-blot. eAl realizar el estudio genotípico se puede conocer el subtipo viral. fSolicitar el tropismo viral antes de administrar maraviroc y el HLA-B57*01 antes de administrar abacavir. gEn pacientes con factores de riesgo (ver texto). hCon el fin de detectar alteraciones cognitivas asociadas al VIH-1 (tabla 3). iSi el PPD o las pruebas de detección de gamma-interferón son negativas repetirlas anualmente.
SP: si precisa.
Desde el inicio de la epidemia se están efectuando numerosos estudios prospectivos para evaluar la tasa de progresión a sida de los pacientes infectados por VIH-1. Uno de los estudios más importante se realizó en homosexuales en San Francisco y tuvo un seguimiento de 15 años26. El 5-10% progresó rápidamente a sida, entre 3 y 5 años, siendo la tasa acumulada de sida, a los 15 años del 75%. Más de la mitad de los pacientes habían fallecido a los 12 años de seguimiento. Menos del 20% de homosexuales permanecía asintomático a los 15 años de seguimiento y solo el 8% presentaba más de 500 linfocitos CD4/mm3 sin haber recibido TARV. Los factores que influyen en la evolución a sida y en la velocidad de progresión se describen en otros capítulos de esta serie27.
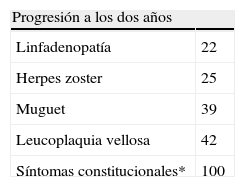
Marcadores clínicos de progresión a sidaLos pacientes con una primoinfección por VIH-1 sintomática progresan más rápidamente a sida y presentan una CV del ARN del VIH-1 en plasma más elevada. Los marcadores clínicos de progresión de la infección crónica por el VIH-1 a sida son la candidiasis oral, la leucoplasia vellosa y los síntomas constitucionales (fiebre, sudoración nocturna, astenia crónica, diarrea crónica y/o pérdida de más del 10% de peso)28 (tablas 8 y 9). La linfadenopatía persistente, que en un principio se consideró un factor predictor clínico, en la actualidad no se considera, ya que las tasas de progresión en pacientes con y sin linfadenopatías son similares. El herpes zóster es un marcador precoz, diagnosticado a los 2-7 años (media: 5 años) antes del sida, pero con escaso poder predictivo; la tasa de progresión a sida a los dos años es baja (25%). La candidiasis oral y la leucoplasia vellosa aparecen generalmente más tarde que el herpes zóster y la tasa de progresión a sida a los dos años es del 40%. Los síntomas constitucionales son las manifestaciones más tardías, e indican una inminente progresión a sida. Todos los pacientes que las presentan lo desarrollan en menos de dos años. En consecuencia, a todo paciente infectado por VIH-1 se debe preguntar, de forma sistemática, sobre esta sintomatología y se buscará de forma intencionada, en la exploración física la candidiasis oral y la leucoplasia vellosa, dos entidades características de la infección por VIH-1, que indican que la infección se encuentra en una fase intermedia o avanzada y que estos pacientes son candidatos al TARV.
Marcadores clínicos de progresión a sida
| Progresión a los dos años | |
| Linfadenopatía | 22 |
| Herpes zoster | 25 |
| Muguet | 39 |
| Leucoplaquia vellosa | 42 |
| Síntomas constitucionales* | 100 |
Fuente: Moss AR28.
*Fiebre, sudoración nocturna, diarrea, pérdida de peso, candidiasis oral y leucoplasia vellosa.
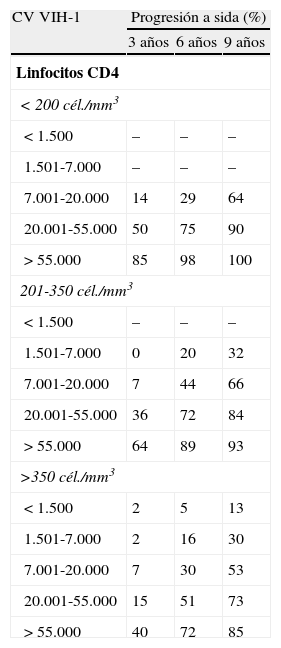
Riesgo de evolución a sida a los 3, 6 y 9 años de seguimiento en una cohorte de varones homosexuales infectados por el VIH-1 según la cifra basal de linfocitos CD4 y la carga viral plasmática (RT-PCR)
| CV VIH-1 | Progresión a sida (%) | ||
| 3 años | 6 años | 9 años | |
| Linfocitos CD4 | |||
| <200 cél./mm3 | |||
| <1.500 | – | – | – |
| 1.501-7.000 | – | – | – |
| 7.001-20.000 | 14 | 29 | 64 |
| 20.001-55.000 | 50 | 75 | 90 |
| >55.000 | 85 | 98 | 100 |
| 201-350 cél./mm3 | |||
| <1.500 | – | – | – |
| 1.501-7.000 | 0 | 20 | 32 |
| 7.001-20.000 | 7 | 44 | 66 |
| 20.001-55.000 | 36 | 72 | 84 |
| >55.000 | 64 | 89 | 93 |
| >350 cél./mm3 | |||
| < 1.500 | 2 | 5 | 13 |
| 1.501-7.000 | 2 | 16 | 30 |
| 7.001-20.000 | 7 | 30 | 53 |
| 20.001-55.000 | 15 | 51 | 73 |
| >55.000 | 40 | 72 | 85 |
Fuente: Mellors JW29.
La carga viral del VIH-1 en plasma y la cifra absoluta de linfocitos CD4 son los dos factores predictores independientes de progresión a sida (tablas 9 y 10) y muerte27. Se ha observado que cuanto mayor es la CV del ARN del VIH-1 en plasma en un determinado momento, mayor es el riesgo de progresión a sida y/o a la muerte29. Una CV del ARN del VIH-1 en plasma mayor de 100.000 copias/ml en pacientes con una infección crónica por el VIH puede ser un criterio de inicio de TARV independientemente de la cifra de linfocitos CD4. Las tasas de progresión a sida y de mortalidad a los 6 años en pacientes sin TARV que tenían una CV del VIH-1 en plasma <500, 501-3.000, 3.001-10.000, 10.001-30.000 y >30.000 copias/mL fueron del 5-1%, 17-6%, 32-18%, 55-35% y 80-70% (sida-muerte) respectivamente. También se ha observado que el tropismo viral del VIH (cepas X4 o duales/mixtas) y los pacientes que tienen infecciones por más de un virus de la inmunodeficiencia humana o superinfecciones tienen una progresión más rápida a sida. Por otra parte, la cifra absoluta de linfocitos CD4, nos indicará el momento de iniciar el TARV y la posibilidad de desarrollo y tipo de infecciones oportunistas que puede padecer el enfermo. Algunos autores también consideran el porcentaje de linfocitos CD4. Un porcentaje menor del 14% podría indicar el inicio de la profilaxis primaria frente a la neumonía por P. jiroveci y el inicio del TARV en pacientes con una cifra de linfocitos CD4 mayor de 500 cél/mm37. Finalmente, existen factores genéticos que pueden determinar una progresión más rápida o más lenta de la infección por el VIH a sida que quizás en un futuro puedan incluirse en la práctica clínica27,30.
Limitaciones de la carga viral en plasma del VIH y criterios de valoración
| 1. Variabilidad de los resultados (expresados en logaritmo decimal): |
| a) Fisiológica: 0,3 log10 copias ARN/ml. |
| b) Técnica; 0,1-0,2 log10 copias ARN/ml. |
| Por lo tanto, solo deben valorarse los cambios de magnitud importantes, de como mínimo 0,5 log10 copias ARN/ml (3-4 veces). |
| 2. Una determinación aislada en un paciente asintomático es útil. En los pacientes con una infección crónica por el VIH-1, un nivel de viremia mayor de 100.000 copias/mL puede indicar el inicio del TARV. |
| 3. Cada laboratorio debe estandarizar el proceso de las muestras a estudiar (utilizar el mismo tipo de tubo y anticoagulante, transporte rápido, separación del plasma y almacenamiento en un congelador en menos de 6 h) con el fin de evitar errores técnicos. No se recomienda tener la sangre total sin separar el plasma (aunque sea refrigerada) más de 24 h. Las determinaciones periódicas deben efectuarse por el mismo método. |
| 4. No debe efectuarse la CV del VIH a aquellos pacientes que hayan tenido un estímulo inmunológico* durante el mes previo, ya que se produce un aumento transitorio de la carga viral que en algunos casos puede llegar a ser de hasta 300 veces los valores basales, con un pico a las dos semanas. |
| 5. Las técnicas de laboratorio se basan en la amplificación de la secuencia (RT-PCR en tiempo real, NASBA y LCx) y detectan el subtipo B y los subtipos no-B circulantes más frecuentes del VIH-1. Todos tienen problemas para amplificar el grupo O. Ninguna amplifica el VIH-2. |
La determinación de la carga viral plasmática y la cifra de linfocitos CD4 tienen una serie de limitaciones, ya que pueden alterarse por diversas situaciones técnicas, fisiológicas y patológicas (tablas 10 y 11)17,31,32. Por ello, antes de tomar una decisión terapéutica importante se aconseja repetir estas determinaciones para asegurarse que los resultados son válidos. Es importante que los pacientes estén clínicamente estables, ni hayan tenido estímulos inmunológicos (vacunaciones previas al análisis) o enfermedades infecciosas intercurrentes.
Problemas en la interpretación de la cifra de linfocitos CD4+
| La cifra de linfocitos CD4+ de sangre periférica corresponde al 2% del total de linfocitos CD4+, que se localizan fundamentalmente en los órganos linfoides y el tejido intestinal. |
| Cálculo de la cifra de linfocitos CD4+ |
| Se obtiene multiplicando la cifra absoluta de leucocitos por ml o (×106/l) por el porcentaje de linfocitos y por el porcentaje de linfocitos CD4+. La cifra absoluta y porcentaje normales de CD4+ oscilan entre 600 y 1.200 céls/μL y 51±5%, respectivamente. Ejemplo: si un paciente tiene 10.000 leucocitos/μL, un 30% de linfocitos y el porcentaje de CD4+ es del 30%, la cifra absoluta de linfocitos CD4+ será: |
| 10.000 × 0,30=3.000 linfocitos/μL; 3.000 × 0,30=900 CD4+/μL |
| Relación entre la cifra absoluta y porcentaje de CD4+ |
| Existe una buena relación entre el número absoluto y el porcentaje de linfocitos CD4+ en los pacientes infectados por el VIH-1: los pacientes con menos del 14% de linfocitos CD4+ tienen menos de 200/μL; entre 14-28% tienen entre 200 y 500, y los pacientes con más del 28% tienen más de 500 linfocitos CD4+/μL. |
| Relación entre la cifra absoluta de linfocitos y de CD4+ |
| La sensibilidad y especificidad del recuento linfocitario menor de 1.000 céls/μL para predecir una cifra de linfocitos CD4<200 células/μL es del 45-55% y del 91-98% respectivamente. |
| Limitaciones |
| 1. La cifra de leucocitos y linfocitos es variable a distintas horas del día y de día a día y puede estar influenciada por numerosos factores. La variabilidad de la cifra de leucocitos utilizando métodos automatizados oscila entre 2-8%. La variabilidad de la cifra de linfocitos utilizando métodos automatizados o manuales oscila entre 2-5 y 12-27% respectivamente. |
| 2. La determinación del porcentaje de linfocitos CD4+ se realiza generalmente por citometría de flujo (FACS) utilizando anticuerpos monoclonales marcados con fluoresceína. Los resultados tienen una gran variabilidad entre distintos laboratorios sobre todo cuando la determinación no se efectúa diariamente ni se realizan controles de calidad. Los dos principales problemas técnicos que originan errores en los resultados son: |
| a) una demora superior a 24 h entre la obtención de la muestra y su procesamiento, y b) la refrigeración de la sangre, que origina una unión inespecífica de los anticuerpos monoclonales, dando como resultado porcentajes de CD4+ anormalmente altos. |
| Situaciones que originan alteraciones de la cifra de linfocitos y de las subpoblaciones linfocitarias |
| 1. Ejercicio intenso: disminuye la cifra de linfocitos y de los linfocitos CD4+. |
| 2. Variaciones diurnas: cambios de la cifra de linfocitos y de CD4+, con cifras más elevadas durante las primeras horas del día (50-150 cél./mm3). |
| 3. Tabaquismo: la nicotina disminuye la cifra de linfocitos, aunque algún artículo ha indicado que los fumadores pueden tener cifras elevadas de linfocitos y de CD4+. |
| 4. Corticoides: disminuyen la cifra de linfocitos y de CD4+. |
| 5. Bazo: en los pacientes esplenectomizados existe un aumento importante de la cifra de linfocitos y de CD4+. Por el contrario, en los pacientes cirróticos con hipertensión portal existe una moderada pancitopenia por hiperesplenismo y, por tanto, la linfopenia condiciona una cifra baja de CD4+. El porcentaje de CD4+ es el parámetro que debe utilizarse para el control clínico de estos pacientes. |
| 6. Las mujeres embarazadas tienen en el tercer trimestre una cifra absoluta de linfocitos CD4+ menor que a las 6 semanas del parto, aunque el porcentaje de linfocitos CD4+ es similar. |
| 7. En los procesos agudos de origen infeccioso o no (neumonía, pancreatitis, etc.) la cifra absoluta de CD4+ disminuye debido a que suele existir linfopenia. |
| 8. La coinfección con el virus HTLV-1 puede incrementar las cifras de linfocitos CD4 entre un 80 y un 180%. |
| 9. La raza puede modificar la cifra de linfocitos CD4. En comparación con europeos y americanos, los asiáticos tienen cifras más bajas y los africanos occidentales tienen cifras más elevadas. |
| Implicaciones |
| La determinación de linfocitos CD4 + debe realizarse cuando la situación clínica del paciente es asintomática. Aun así, debido a las situaciones previas la cifra de linfocitos CD4+ siempre debe interpretarse con cautela y para tomar decisiones terapéuticas en pacientes asintomáticos debe repetirse dos o tres veces para estar seguros. Estos cambios son de menor magnitud cuando la infección por VIH-1 es avanzada y la cifra de CD4+ baja. |
Fuente: Centers for Disease Control32.
Mediante la anamnesis, la exploración física y los exámenes complementarios que se han efectuado, se debe poder catalogar al paciente según la clasificación de la infección por VIH-1 (CDC, diciembre 2008)16, que indica en qué situación clínica e inmunológica se encuentra. La situación clínica, inmunológica y virológica del paciente nos indicará cuando debe iniciar el TARV y las profilaxis de las infecciones oportunistas4–7.
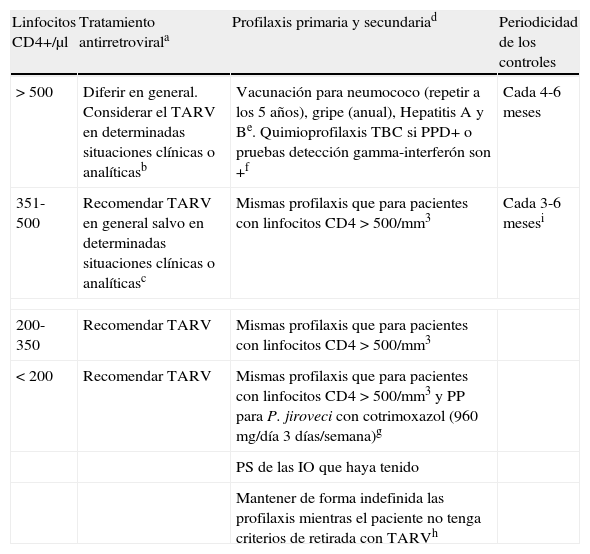
Inicio de la profilaxis de las infecciones oportunistas, inicio del TARV y periodicidad de los controlesBases de la profilaxis primaria y secundaria de las infecciones oportunistas33,34La inmunodepresión de la infección por VIH-1 es característicamente celular ya que produce una depleción crónica y progresiva del número de linfocitos CD4, apareciendo la mayoría de infecciones oportunistas cuando la inmunodepresión es avanzada. Su cronología dependerá del balance entre la virulencia del microorganismo y el grado de inmunosupresión del paciente.
Así, la tuberculosis y la candidiasis pueden observarse por encima de los 200 linfocitos CD4/μL, mientras que la neumonía por P. jiroveci y la toxoplasmosis cerebral se observan por debajo de 200 y 100 linfocitos CD4/μL, respectivamente y las infecciones por C. neoformans, M. avium-intracellulare y citomegalovirus aparecen por debajo de 50 linfocitos CD4/μL. Esto explica que la tuberculosis y la candidiasis aparezcan antes y que las infecciones por criptococo, M. avium-intracellulare y citomegalovirus se observen en fases más avanzadas de la infección.
El origen de estas infecciones oportunistas es el siguiente:
- 1.
Reactivación de una infección latente adquirida años antes. Es la causa más frecuente. Se caracterizan porque la primoinfección por estos microorganismos fue generalmente asintomática. Las infecciones por M. tuberculosis, T. gondii, P. jiroveci, virus del grupo herpes (citomegalovirus, virus de Epstein-Barr, herpes simple o herpes zoster) y otros virus (virus JC) son los procesos más comunes.
- 2.
Infección exógena. Estos pacientes pueden adquirir infecciones de novo por los mismos mecanismos que el huésped inmunocompetente. Se adquieren, por ejemplo, por vía digestiva las infecciones por Isospora belli, Cryptosporidium, Microsporidium y M. avium-intracellulare y por vía respiratoria, la criptococosis. La tuberculosis y la neumonía por P. jiroveci también se pueden adquirir por reinfecciones exógenas.
- 3.
Proliferación de microorganismos saprófitos de piel y mucosas. La candidiasis oral, esofágica y vaginal son los ejemplos más característicos de este mecanismo.
Dado que el mecanismo más frecuente por el que el paciente infectado por el VIH-1 tiene una infección es por reactivación de una infección latente adquirida años antes, se puede llegar a conocer qué infecciones ha tenido el paciente tal como se explica en el apartado de pruebas complementarias (tabla 7). El riesgo de reactivación aparecerá, a excepción de la infección por M. tuberculosis, cuando la inmunosupresión sea grave (en general, por debajo de 200 linfocitos CD4/μL), momento en que deberá instaurarse la profilaxis primaria para prevenir la reactivación de dichas infecciones33,34. Si un paciente desarrolla una infección oportunista, generalmente porque no toma profilaxis o porque desconoce que está infectado por el VIH-1, la respuesta al tratamiento durante la fase aguda de la misma suele ser buena. Sin embargo, puesto que en estos pacientes persiste la inmunodepresión celular y por las características de este tipo de microorganismos (gérmenes intracelulares, ausencia de fármacos activos frente a las formas quísticas de los protozoos y sobre el provirus integrado en el ADN celular), la tasa de recidivas es muy alta, lo que obliga a efectuar un tratamiento de mantenimiento (profilaxis secundaria) indefinido para evitar las recaídas. Con la introducción del TARGA en 1996, se ha comprobado que es posible restaurar el sistema inmunológico en los pacientes con sida y que se puede retirar la profilaxis de las infecciones oportunistas cuando la cifra de linfocitos CD4 está por encima de un determinado umbral (>200 céls/μL) de forma mantenida (más de 3-6 meses) y los pacientes tienen una carga viral del ARN del VIH-1 en plasma suprimida33,34. Este fenómeno tiene una base inmunológica, ya que el aumento de la cifra de linfocitos CD4 con TARGA se acompaña de una restauración de la respuesta proliferativa inmunoespecífica frente a dichos microorganismos (p. ej., citomegalovirus, T. gondii).
Se recomienda la vacunación frente al virus de la hepatitis A y B en las personas no inmunizadas, la vacunación frente al neumococo cada 5 años, frente al tétanos cada 10 y antigripal anual33,34. En pacientes seleccionados se puede realizar la vacunación frente al Heamophilus influenzae tipo B y virus de la varicela-zóster33,34. Las indicaciones de la vacunación frente al papilomavirus humanos seguirán las mismas recomendaciones que en la población general, aunque existe muy poca experiencia en pacientes infectados por el VIH.
Recomendaciones generales antes del inicio del TARVLa decisión de inicio de un TARV debe basarse en cinco elementos: la presencia o ausencia de sintomatología relacionada con el VIH-1, el recuento de linfocitos CD4, la carga viral del ARN del VIH-1 en plasma, la presencia de comorbilidades y el riesgo de transmisión de la infección por el VIH4–7. En los pacientes con una infección crónica por VIH-1 sintomática (eventos C de la clasificación de los CDC) se recomienda iniciar el TARV en todos los casos en las primeras dos semanas desde el diagnóstico del evento C salvo en los pacientes con tuberculosis y una cifra de linfocitos CD4 mayor de 50 cél/mm3 en los que se iniciará en la fase de manteniento (8 semanas). En los pacientes con una infección crónica por VIH-1 asintomática, el TARV se basará fundamentalmente en la cifra de linfocitos CD4 y, en menor medida, en la CV del ARN del VIH-1 en plasma, en las comorbilidades del paciente y el riesgo de transmisión del VIH. La CV del VIH-1 en plasma puede ser más baja en las mujeres que en los hombres con la misma cifra de linfocitos CD4; las mujeres suelen tener una cifra de linfocitos CD4 más alta que los hombres en el momento del diagnóstico de sida. Sin embargo, la mayoría de recomendaciones no indican que las mujeres deban tener niveles distintos de linfocitos CD4 o de CV del VIH-1 en plasma para iniciar el TARV. Los criterios de inicio y el tipo de TARV y los controles clínicos y analíticos que deben realizarse en los pacientes tratados se describen en otro capítulo de la serie18.
El inicio del TARV no es urgente en los pacientes con una infección crónica asintomática por el VIH-1. Dada la importancia que tiene realizar correctamente el primer TARV conviene, antes de iniciar el TARV, preparar al paciente, tratar de identificar las potenciales situaciones concomitantes que puedan dificultar una correcta adhesión y corregirlas18. Si el paciente no está preparado, en general es mejor retrasar el inicio del TARV. Es muy importante conocer los factores dependientes del paciente ya que en la actualidad existe ventaja con el elevado número de fármacos de que disponemos, por lo que se puede hacer un TARV a la medida de cada caso. Se debe preguntar al paciente qué tipo de vida realiza (si es activa o no; si puede tener privacidad o no para tomar la medicación) y los horarios de trabajo y de comidas (si son estables o no, si una eventual dosis al mediodía sería fácil o difícil de cumplir). También debe conocerse sus problemas de salud, problemas que por un lado pueden adelantar el inicio del TARV y por otro pueden contraindicar el uso de alguna familia de antirretrovirales. Si el paciente tiene problemas digestivos, diabetes mellitus, dislipemia, un hábito depresivo o si se trata de una mujer en edad fértil con deseo de quedar embarazada o ya lo está, debe adaptarse la elección de los fármacos antirretrovirales a esas situaciones. Finalmente, se tiene que conocer los productos naturales y la medicación concomitante que toma o que ha de tomar para evitar interacciones farmacocinéticas que potencien la toxicidad o disminuyan la eficacia de los fármacos que reciba4–7,18.
Si se decide que el paciente inicie el TARV, es imprescindible que en el momento de la prescripción y la dispensación de los fármacos se ofrezca una información detallada, soporte y accesibilidad en todos los aspectos relacionados con el TARV4–7,18. En este sentido, la utilización de un teléfono directo puede facilitar el contacto entre el paciente y los profesionales de este campo. Durante el TARV, la evaluación periódica de la adherencia es imprescindible y deberá tenerse en cuenta en la toma de decisiones terapéuticas. Al no existir un único método fiable, se recomienda utilizar varias técnicas como la entrevista y el cuestionario estructurado validado (SMAQ, SERAD), el recuento de la medicación sobrante y la asistencia a las citas de dispensación de fármacos junto con la evolución clínica y analítica del paciente. Para ello es indispensable que exista una buena coordinación entre todos los estamentos implicados y, en particular, entre clínicos y farmacéuticos. Si se detecta una falta de adhesión debe intervenirse de forma activa para corregirla, y en situaciones extremas puede valorarse la suspensión del tratamiento, ya que un TARV incorrecto favorecerá la aparición de resistencias y limitará las futuras opciones terapéuticas del paciente.
Con respecto a los efectos secundarios, una vez el paciente y el médico han convenido una determinada pauta de TARV, el médico deberá explicar detalladamente la manera o maneras potenciales de tomar cada fármaco, los fármacos intercurrentes a evitar, los potenciales efectos secundarios y la manera de prevenirlos4–7,18.
Periodicidad de los controlesUna vez iniciado el TARV, es recomendable efectuar un primer control a las 2-4 semanas para monitorizar la adhesión y los efectos secundarios inmediatos4–7,18. Se debe facilitar la accesibilidad del paciente al médico que le recomendó el TARV, bien de forma directa mediante una visita no programada o bien a través del teléfono. Si la adhesión es correcta y no existen efectos secundarios, estos aspectos deben monitorizarse y reforzarse cada 3-6 meses, coincidiendo con las visitas clínicas4–7,18. En las tablas 7 y 12 se especifican las pruebas complementarias que deben realizase y la periodicidad con que deben efectuarse los controles clínicos y analíticos de estos enfermos y cuándo debe instaurarse el tratamiento antirretroviral y la profilaxis primaria y secundaria de las infecciones oportunistas4–7,18,33,34. Si el paciente no tiene criterios de TARV o no desea tratarse, los controles de la infección por VIH-1 deben efectuarse cada 3-6 meses con la determinación de las subpoblaciones linfocitarias y la carga viral plasmática del VIH-1.
Tratamiento antirretroviral y profilaxis de las infecciones oportunistas y periodicidad de los controles
| Linfocitos CD4+/μl | Tratamiento antirretrovirala | Profilaxis primaria y secundariad | Periodicidad de los controles |
| >500 | Diferir en general. Considerar el TARV en determinadas situaciones clínicas o analíticasb | Vacunación para neumococo (repetir a los 5 años), gripe (anual), Hepatitis A y Be. Quimioprofilaxis TBC si PPD+ o pruebas detección gamma-interferón son +f | Cada 4-6 meses |
| 351-500 | Recomendar TARV en general salvo en determinadas situaciones clínicas o analíticasc | Mismas profilaxis que para pacientes con linfocitos CD4>500/mm3 | Cada 3-6 mesesi |
| 200-350 | Recomendar TARV | Mismas profilaxis que para pacientes con linfocitos CD4 > 500/mm3 | |
| <200 | Recomendar TARV | Mismas profilaxis que para pacientes con linfocitos CD4 > 500/mm3 y PP para P. jiroveci con cotrimoxazol (960 mg/día 3 días/semana)g | |
| PS de las IO que haya tenido | |||
| Mantener de forma indefinida las profilaxis mientras el paciente no tenga criterios de retirada con TARVh | |||
Fuente: Panel de Expertos de Grupo de Estudio del Sida y Plan Nacional sobre el Sida (GESIDA/PNS)7,33 y Kaplan JE34.
Notas: aSeguir las recomendaciones de GESIDA/PNS para las indicaciones de TARV7; brecomendar TARV en pacientes con cirrosis hepática o hepatitis crónica por los VHB o VHC, riesgo cardiovascular elevado, nefropatía, edad mayor de 55 años, parejas serodiscordantes con alto riesgo de transmisión, carga viral plasmática del VIH mayor 100.000 copias/mL o proporción de linfocitos CD4<14%; csi hay poca predisposición del paciente, cifra de linfocitos CD4 estable o carga viral del VIH en plasma baja; dseguir las recomendaciones de GESIDA/PNS para las indicaciones de las profilaxis, fármacos aconsejados y su posología33. eVacunar de forma sistemática frente al VHA y/o VHB a todos los pacientes que no tengan evidencia serológica de haberlas sufrido (IgG VHA y HBc y HBs negativos). fEn ausencia de tuberculosis activa, isoniacida 300 mg/día durante 9 meses. gEn los pacientes alérgicos al cotrimoxazol considerar la combinación dapsona (100 mg/día) sola, o asociada a la pirimetamina (25 mg/día) dos o tres veces por semana si existe una coinfección por Toxoplasma gondii. Si hay alergia a la dapsona considerar pentamidina inhalada (300 mg/mes) sola, o asociada a la pirimetamina 50 mg/día tres días por semana si existe una coinfección por T. gondii. La PP de la toxoplasmosis debe realizarse en los pacientes con serología positiva para T. gondii y cuando la cifra de linfocitos CD4 sea menor de 100 céls/μl. hSeguir las recomendaciones de GESIDA/PNS para los criterios de retirada de la PP y PS de las IO33. En general se pueden suprimir todas las profilaxis en los pacientes que reciben TARV y tienen una carga viral del VIH indetectable en plasma y una cifra de linfocitos CD4>200 céls/μl durante más de 3-6 meses. Si en los pacientes en los que se ha retirado la profilaxis la cifra de linfocitos CD4+ desciende por debajo de esos límites deberá reinstaurarse la misma; ien los pacientes que inician TARV o que están severamente inmunodeprimidos se recomiendan controles clínicos y analíticos trimestrales durante el primer año de seguimiento.
IO: infecciones oportunistas; PP: profilaxis primaria; PS: profilaxis secundaria; TARV: tratamiento antirretroviral.
Finalmente, todo paciente infectado por VIH-1, o con riesgo de serlo, debe ser informado de los siguientes temas1–3:
- 1.
Prevención de la transmisión del VIH-1. Se deben explicar los mecanismos de transmisión del VIH-1 y las medidas preventivas que debe realizar para evitar la reinfección o la transmisión de la infección e insistir en la importancia de adoptar determinados hábitos. En las relaciones sexuales debe conocer las prácticas de riesgo bajo o nulo y utilizar el preservativo. El preservativo puede prevenir otras enfermedades de transmisión sexual y, en pacientes infectados por el VIH-1, la transmisión de cepas de VIH-1 resistentes, el citomegalovirus y el HHV-8. Los drogadictos deben remitirse a un centro especializado para su deshabituación y, si persiste el consumo de drogas, insistir en la utilización de jeringuillas estériles y, sobre todo, no compartir el material de inyección. Estos pacientes deben saber que no pueden donar órganos, sangre o semen y que deben notificar su infección al personal sanitario que los atienda. También debe informarse a los pacientes de la importancia de notificar su infección a las personas que pudieran haber estado expuestas. El paciente puede asumir personalmente la responsabilidad de notificarlo a sus contactos; en ese caso se debe explicar al caso índice la información que debe transmitir. También se le puede sugerir que traiga a sus contactos con el fin de darles consejo sanitario y facilitar la realización de la serología del VIH. En el caso de que el paciente no quiera notificarlo, se le debe ofrecer la posibilidad de que el personal sanitario sea el que informe a sus contactos manteniendo el anonimato del caso índice. En todos los casos se debería asegurar que los contactos han sido identificados y que se les ha realizado la serología del VIH. Esto es importante ya que, entre los contactos de un paciente con un nuevo diagnóstico de infección por VIH, la prevalencia de infección no conocida en sus contactos oscila entre el 20 y 40%.
- 2.
Normas para la prevención de determinadas infecciones. Se aconsejará sobre normas de actuación en la vida diaria, para evitar en lo posible la exposición a patógenos oportunistas. En la tabla 13 se resumen las recomendaciones para evitar la exposición a patógenos oportunistas, si existe exposición sexual, ambiental o laboral, contacto con animales, exposición a determinado tipo de alimentos o bebidas y si se realizan viajes a países en vías de desarrollo.
Tabla 13.Consejos para evitar la exposición a patógenos oportunistas
Exposición sexual Relación sexual: se aconseja la utilización de preservativos para evitar la transmisión del VIH, otras enfermedades de transmisión sexual, citomegalovirus, herpes simple, papilomavirus. Exposición oral a las heces (contacto anal-oral): existe riesgo de infecciones intestinales como criptosporidiasis, shigellosis, giardiasis, hepatitis A, infección por Campylobacter. Exposición ambiental y laboral Trabajos en penitenciarias, hospitales y albergues: pueden tener riesgo de infección tuberculosa. Trabajadores de jardines de infancia o padres de niños que asisten a jardines de infancia: pueden adquirir infecciones por CMV, criptosporidiasis, hepatitis A, giardiasis. Veterinarios y granjeros: criptosporidiasis, toxoplasmosis, salmonelosis. Jardineros: criptosporidiasis. Contacto con animales Se debería evitar la limpieza de animales (sobre todo aquellos con menos de 6 meses y/o con diarrea) y la adquisición de nuevos animales de tiendas o granjas. Se debe hacer examinar por el veterinario para evitar infecciones como Cryptosporidium, Salmonella, Campylobacter. Los gatos pueden transmitir la toxoplasmosis a través de las heces, así como otros enteropatógenos. Se aconseja a los pacientes seronegativos para T. gondii no tener gatos para evitar la infección por toxoplasma. No es de utilidad examinar el gato para descartar toxoplasmosis. Existe riesgo a través de arañazos y heridas de infección por Bartonella. El examen de los pájaros sanos para descartar Cryptococcus neoformans o Mycobacterium avium no es de utilidad. Otras enfermedades transmitidas por animales: reptiles (salmonelosis), peces (Mycobacterium marinum), caballos (Rhodococcus equi). El uso de guantes, el lavado frecuente de manos y evitar las heces de los animales son las medidas más eficaces para aquellos que tratan de forma continua con animales. Alimentos y bebidas Evitar alimentos poco cocinados, huevos crudos, verduras y frutas no peladas, ya que existe peligro de infección por Cryptosporidium, Salmonella y Campylobacter. El agua debe ser siempre de fuentes de potabilidad conocida. Con la manipulación de alimentos no cocinados, se aconseja lavado repetido de las manos. Viajes a países en vías de desarrollo Planear el viaje consultando a un centro o profesional sanitario experto en medicina del viajero para realizar las profilaxis adecuadas. Las mismas medidas respecto a alimentos, bebidas y contacto con animales recomendadas previamentente son válidas para los viajeros. Las vacunas de virus vivos (p. ej., vacuna de la fiebre amarilla) no se deben usar por el riesgo de infección generalizada debido al déficit inmunológico del paciente. - 3.
Normas para evitar los estímulos del sistema inmunológico, que puedan ser cofactores de progresión de la infección (enfermedades de transmisión sexual [ETS], consumo de drogas, cannabis, tabaco o alcohol y malnutrición). Así mismo se potenciará que el paciente realice una dieta cardiosaludable y rica en fibra, realice ejercicio moderado de forma regular y abandone el hábito tabáquico, o pierda peso si su IMC es mayor de 301–3,24.
- 4.
Ofrecer soporte psicológico, si lo precisan. Los pacientes relativamente asintomáticos que reciben la noticia de que deben iniciar TARV precoz pueden presentar problemas emocionales por el cambio que comporta en su vida y los posibles efectos secundarios del tratamiento. Además, a menudo sufren discriminación familiar, social o laboral y esto puede originar síndromes depresivos.
- 5.
A las mujeres se les debe explicar que en la actualidad no existe una contraindicación del embarazo.
- 6.
Efectuar educación sanitaria entre las personas que conviven con el paciente. Deben saber que por convivir no se transmite la infección y que pueden compartir todos los utensilios habituales excepto aquellos que puedan contaminarse con sangre (cepillos de dientes y hojas de afeitar). La lejía (diluida al 1/10) es un buen desinfectante para limpiar superficies o utensilios contaminados con sangre. Los convivientes y familiares también pueden precisar soporte psicológico.
Dr. JM Miró tiene durante el año 2011 una beca (INT 10/219) de Intensificación de la Actividad Investigadora en el Sistema Nacional de Salud y del Departamento de Salud de la Generalitat de Cataluña (Programas I3 SNS y PRICS).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Nota: sección acreditada por el SEAFORMEC. Consultar preguntas de cada artículo en: http://www.elsevier.es/eimc/formacion.