Klebsiella pneumoniae (K. pneumoniae) productora de carbapenemasa tipo KPC (Kpn-KPC) representa un patógeno emergente, con elevada capacidad de diseminación nosocomial. El objetivo del presente estudio es describir las características clinicoepidemiológicas de un brote nosocomial por Kpn-KPC en Buenos Aires, Argentina.
MétodosEstudio descriptivo y prospectivo. Se registraron los aspectos clinicoepidemiológicos de pacientes con infección por Kpn-KPC (agosto de 2009 a julio de 2010). Se determinó la sensibilidad a los antimicrobianos mediante antibiograma por disco-difusión y por método automatizado (Vitek® 2C-bioMerieux). La búsqueda de carbapenemasa tipo KPC se realizó con la prueba de inhibición con 3-aminofenil-borónico (APB) y se confirmó su presencia por reacción en cadena de la polimerasa (PCR, por sus siglas en inglés). Se realizó tipificación molecular de las cepas aisladas por electroforesis en campo pulsado (PFGE, por sus siglas en inglés).
ResultadosSe registraron 27 casos de infección por Kpn-KPC (sala de cirugía general: n=8; clínica médica: n=6; unidad de cuidados intensivos: n=5; sala de emergencia: n=4; otras: n=4). Todos los aislamientos de Kpn-KPC pertenecieron a un mismo clon (ST258). Los sitios de infección fueron: tracto urinario (63%), tracto respiratorio (15%), abdomen (15%), sangre (7%) y hueso (4%). Todos los aislamientos de KPn-KPC fueron solamente sensibles a tigeciclina y colistina. Tratamiento empírico inadecuado: 63%. Tratamiento efectivo dirigido: colistina (74%), tigeciclina (4%), tigeciclina+colistina (22%). Mortalidad global: 59% (atribuible: 26%). Cultivos de vigilancia (hisopados) positivos: 7/70 (10%).
ConclusionesSe describe la emergencia de un brote nosocomial de Kpn-KPC en Buenos Aires, con alta capacidad de diseminación y elevada mortalidad. La implementación de medidas de control de infecciones es fundamental para reducir la transmisión nosocomial de Kpn-KPC.
KPC-producing Klebsiella pneumoniae (Kpn-KPC) is an emerging pathogen, with a high capacity of nosocomial spread. The aim of this study was to describe the clinical and epidemiological characteristics of a nosocomial outbreak of Kpn-KPC in Buenos Aires, Argentina.
MethodsProspective and descriptive study. We recorded clinical and epidemiological characteristics of patients with Kpn-KPC infection (august 2009 to july 2010). Antimicrobial susceptibility was performed by disk-diffusion antibiogram and an automated method (bioMerieux Vitek® 2C). Screening for K. pneumoniae carbapenemase (KPC) was performed with the 3-aminophenyl-boronic acid (APB) test inhibition and its presence was confirmed by PCR. Molecular typing of isolates was performed by pulsed field gel electrophoresis (PFGE).
ResultsTwenty seven patients were infected by KPC producing K. pneumoniae (surgical care unit: n=8; medical care unit: n=6; intensive care unit [ICU]): n=5; emergency care unit: n=4; and other: n=4). All Kpn-KPC isolates belonged to a single clonal type (ST258). Site of infection: urinary tract (63%), respiratory tract (15%), intra-abdominal (15%), bloodstream (7%) and bone (4%). All Kpn-KPC isolates were only susceptible to tigecycline and colistin. Inappropriate empirical treatment: 63%. Specific treatment for Kpn-KPC infection: colistin (74%), tigecycline (4%) and tigecycline+colistin (22%).Global mortality: 59% (attributable mortality: 26%). Positive surveillance cultures (swabs): 7/70 (10%).
ConclusionsWe described the emergence of a nosocomial outbreak of Kpn-KPC in Buenos Aires, with a high capacity for dissemination and a high mortality rate. The implementation of infection control measures is essential to reduce the nosocomial spread of Kpn-KPC.
Klebsiella pneumoniae (K. pneumoniae) ha sido asociada a un 2-5% de las infecciones nosocomiales.
La resistencia de esta especie a las cefalosporinas de tercera generación mediante la producción de betalactamasas de expectro extendido (BLEE) es frecuente, situando a los carbapenemes como el tratamiento de elección en las infecciones producidas por estos aislamientos1. Sin embargo, en 1996 se realizó el primer aislamiento clínico de K. pneumoniae resistente a carbapenemes, mediante la producción de producción de carbapenemasa tipo KPC en Carolina del Norte, Estados Unidos. A partir de este primer aislamiento, se reconocen brotes en diversas regiones del mundo identificándose un clon dominante a nivel mundial, el ST2582.
En Argentina, la primera detección de K. pneumoniae productora de carbapenemasa tipo KPC (Kpn-KPC) fue a finales de 2006. En el último año los aislamientos de Kpn-KPC se multiplicaron en forma exponencial, detectándose en al menos 30 centros asistenciales de Argentina3.
El objetivo del presente estudio es describir las características clínicas y epidemiológicas de un brote nosocomial por Kpn-KPC en pacientes internados en el Hospital General de Agudos «Dr. Cosme Argerich» de la ciudad de Buenos Aires, Argentina.
Material y métodosLugar de estudioEl Hospital «Dr. Cosme Argerich» es un hospital general de agudos ubicado en la ciudad de Buenos Aires, Argentina, y cuenta con 400 camas de internación distribuidas en áreas clínicas, quirúrgicas y de cuidados intensivos.
Período de estudioDesde la detección del caso índice en agosto de 2009 a julio de 2010.
Diseño del estudioEstudio observacional, descriptivo y prospectivo. Se registraron los aspectos clínicos, microbiológicos y epidemiológicos relevantes de los pacientes con infección (casos) por Kpn-KPC. Se definió como caso a todo paciente hospitalizado con aislamiento de Kpn-KPC de una muestra clínica más manifestaciones clínicas y de laboratorio de enfermedad. Se definió como colonización al aislamiento de este agente en muestras de hisopado rectal de vigilancia en pacientes sin manifestaciones clínicas ni de laboratorio de enfermedad.
Se definió a la evolución como: favorable (resolución de síntomas y signos de la infección), desfavorable atribuible (muerte en el contexto de infección activa más resultado de cultivo positivo) y desfavorable no atribuible. Se realizó un análisis estadístico descriptivo de las variables.
Estudio microbiológicoLa identificación bacteriana de los cultivos de muestras clínicas se realizó por métodos manuales y por el sistema automatizado Vitek® 2C (bioMerieux). Se determinó la sensibilidad a los antimicrobianos de las cepas obtenidas por el método de difusión y concentración inhibitoria mínima (CIM) por el sistema automatizado Vitek® 2C. Para tigeciclina se determinó la CIM por el método de E-test. Para la interpretación de los resultados se utilizaron los criterios del Clinical Laboratory Standards Institute (CLSI), excepto para colistina y tigeciclina para los cuales se utilizaron los siguientes criterios: para colistina, se utilizó el punto de corte para CIM propuesto por el European Committee on Antimicrobial Susceptibility Testing (EUCAST) (sensible ≤2μg/ml, resistente ≥4μg/ml), y para tigeciclina se utilizaron los criterios de la Food and Drug Administration (FDA) para difusión (sensible≥19mm), y los del EUCAST para CIM (sensible ≤1μg/ml, resistente ≥4μg/ml) (http://www.eucast.org/clinical_breakpoints/).
Todas las cepas de enterobacterias que mostraban un halo de inhibición a carbapenemes menor o igual a 21mm y resistencia o sensibilidad intermedia a cefalosporinas de espectro ampliado, se sometieron al test de inhibición con el disco de 3-aminofenil-borónico (APB). Aquellas cepas que presentaban sinergia con este disco, eran enviadas al Centro Nacional de Referencia (INEI) para la confirmación de la presencia del gen blaKPC por reacción en cadena de la polimerasa (PCR, por sus siglas en inglés) utilizando primers específicos. Se realizó además, la secuenciación de los genes amplificados y se estableció la relación clonal mediante la técnica de electroforesis en campo pulsado (PFGE, por sus siglas en inglés). Una muestra representativa de cepas fue analizada por medio de la técnica de secuenciación de múltiples alelos (MLST, por sus siglas en inglés).
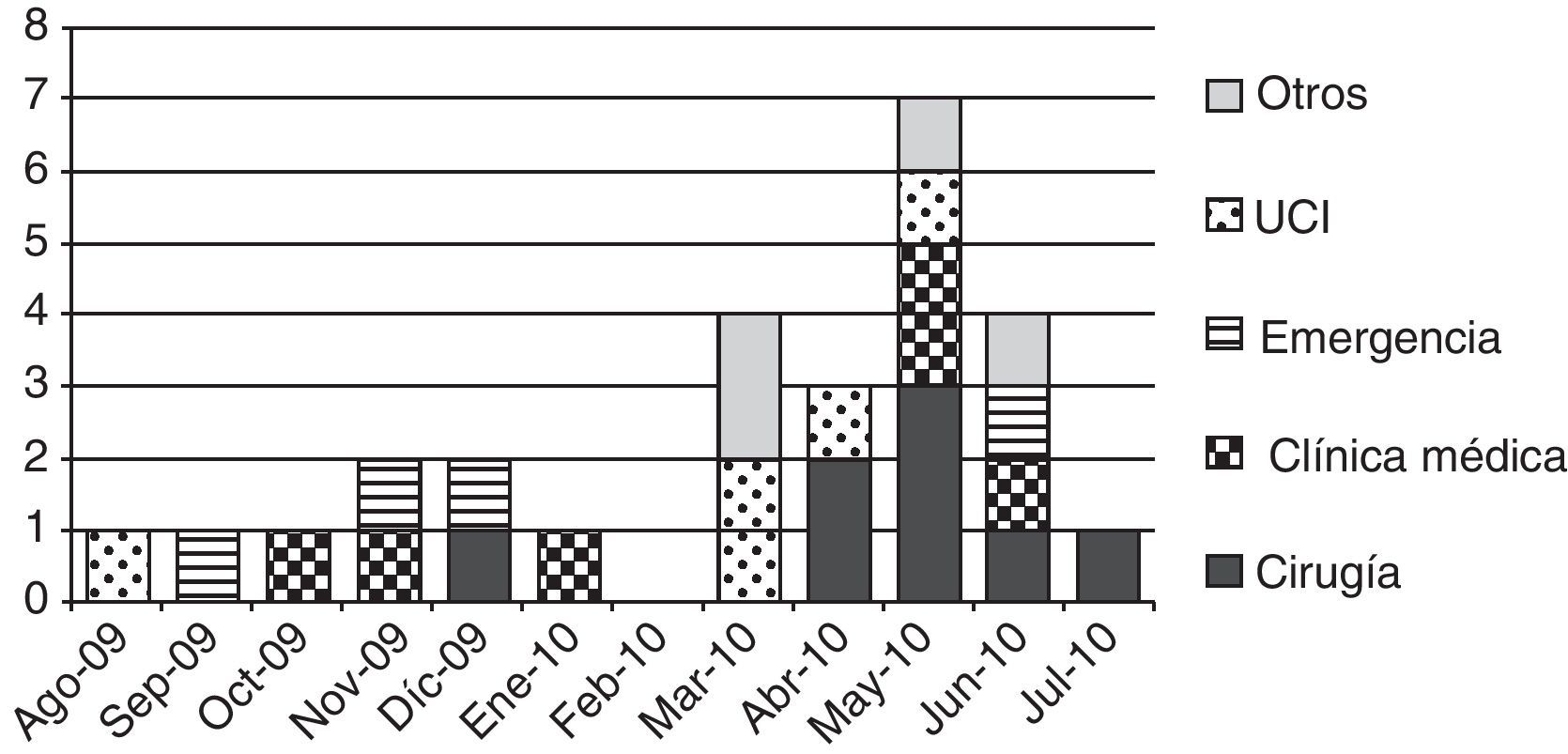
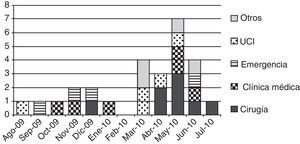
ResultadosDurante el período de estudio se documentaron 27 casos de infección por Kpn-KPC. Las características clínicas y evolución de los casos se describen en la tabla 1. El primer caso fue detectado en agosto de 2009 en la unidad de cuidados intensivos (UCI), en un paciente derivado de otro centro asistencial. La distribución temporal de los casos se muestra en la figura 1, donde se observa un nivel máximo de incidencia en mayo de 2010. Las salas de internación de los pacientes en el momento del diagnóstico de infección por Kpn-KPC fueron: sala de cirugía general: 8, clínica médica: 6, UCI: 5, sala de emergencia y otras: 4 cada una.
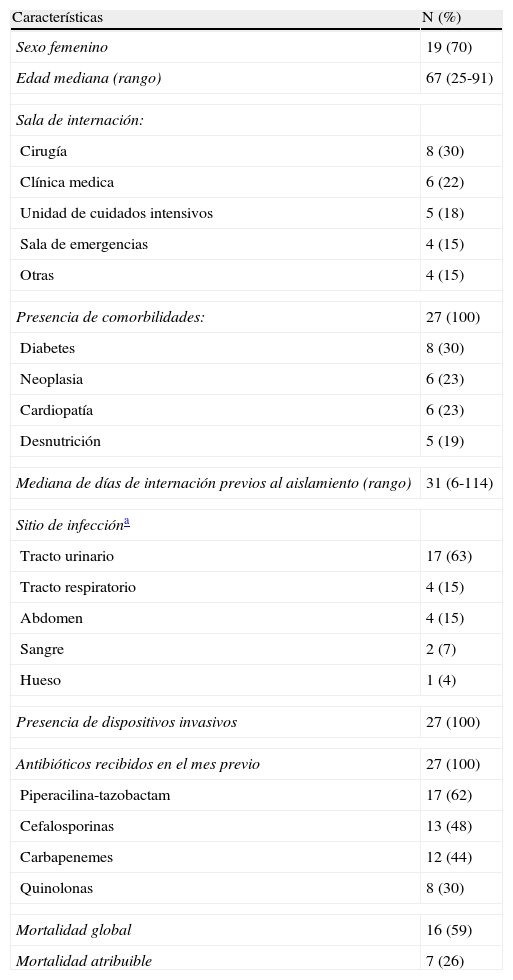
Características clínicas y epidemiológicas de 27 casos de infección por Klebsiella pneumoniae productora de KPC-2
| Características | N (%) |
| Sexo femenino | 19 (70) |
| Edad mediana (rango) | 67 (25-91) |
| Sala de internación: | |
| Cirugía | 8 (30) |
| Clínica medica | 6 (22) |
| Unidad de cuidados intensivos | 5 (18) |
| Sala de emergencias | 4 (15) |
| Otras | 4 (15) |
| Presencia de comorbilidades: | 27 (100) |
| Diabetes | 8 (30) |
| Neoplasia | 6 (23) |
| Cardiopatía | 6 (23) |
| Desnutrición | 5 (19) |
| Mediana de días de internación previos al aislamiento (rango) | 31 (6-114) |
| Sitio de infeccióna | |
| Tracto urinario | 17 (63) |
| Tracto respiratorio | 4 (15) |
| Abdomen | 4 (15) |
| Sangre | 2 (7) |
| Hueso | 1 (4) |
| Presencia de dispositivos invasivos | 27 (100) |
| Antibióticos recibidos en el mes previo | 27 (100) |
| Piperacilina-tazobactam | 17 (62) |
| Cefalosporinas | 13 (48) |
| Carbapenemes | 12 (44) |
| Quinolonas | 8 (30) |
| Mortalidad global | 16 (59) |
| Mortalidad atribuible | 7 (26) |
Todos los casos menos el índice tuvieron contacto previo con un paciente con infección y/o colonización con Kpn-KPC y una media de días de internación previo al aislamiento del microorganismo de 31 días (rango: 6-114 días). Los sitios de infección fueron: tracto urinario 17 (63%), tracto respiratorio 4 (15%), abdomen 4 (15%), sangre 2 (7%), y hueso 1 (4%). En un paciente se aisló simultáneamente en orina y líquido ascítico.
Los 27 aislamientos de Kpn-KPC mostraron sinergia con APB y el mismo patrón fenotípico de multirresistencia, evidenciándose resistencia a β-lactámicos, fluoroquinolonas, cotrimoxazol, aminoglucósidos y conservando sensibilidad solo a colistina y tigeciclina. Se detectó la presencia del gen blaKPC-2 en todos los casos y el análisis de electroforesis en campo pulsado mostró el mismo patrón de bandas, perteneciendo todas las cepas aisladas al mismo clon. Por MLST, el clon fue identificado como perteneciente al tipo de secuencia ST258.
Se observaron comorbilidades en todos los pacientes siendo las más frecuentes: diabetes mellitus (30%), neoplasia (23%), cardiopatía (23%) y malnutrición (19%). En todos los casos también se observó la presencia de dispositivos invasivos (sonda vesical: 93%; catéter venoso central: 35%; tubo endotraqueal: 30% y sonda nasogástrica: 15%).
Todos los casos recibieron al menos dos antimicrobianos previo a la infección por Kpn-KPC. Más aún, 10 (37%) pacientes recibieron tres antimicrobianos previos. La mediana de duración de los mismos fue de 20 días (rango: 11-54 días) y los más utilizados fueron: piperacilina-tazobactam (62%), cefalosporinas (48%), carbapenems (44%) y quinolonas (30%).
El tratamiento empírico utilizado en los pacientes con infección Kpn-KPC fue inadecuado en 17 pacientes (63%). Los antibióticos utilizados a continuación del diagnóstico de infección por Kpn-KPC fueron: colistina en 20 pacientes (74%), tigeciclina en uno (4%) y la combinación de ambos en 6 (22%).
La mortalidad global fue del 59%, mientras que la mortalidad atribuible a la infección por Kpn-KPC fue del 26% de los casos.
Dentro de las estrategias implementadas para el control del brote se realizaron hisopados de vigilancia en 70 pacientes, de los cuales 7 (10%) resultaron colonizados. Se realizaron además cultivos de muestras ambientales (colchones/ropa de cama, líquidos desinfectantes, instrumental médico y superficies de mobiliarios) resultando todos negativos. Otras medidas consistieron en reforzar las precauciones estándares, notificación inmediata del laboratorio de microbiología de los aislamientos de K. pneumoniae que presentaban inhibición con ácido borónico e implementación de aislamiento de contacto de los casos sospechosos, contactos de los mismos y/o colonizados en habitaciones individuales (cuando esto era posible) o en grupos de cohortes hasta su confirmación por PCR. Además, se realizó educación del paciente y del personal de salud, y se intensificó el control del cumplimiento de las medidas de aislamiento (lavado de manos, utilización de guantes y camisolín). Estas medidas implementadas fueron efectivas en controlar el brote. A partir de ese momento, solo se registraron casos esporádicos de infección por Kpn-KPC principalmente en pacientes internados en UCI.
DiscusiónSe describe la emergencia de un brote de Kpn-KPC con una alta capacidad de diseminación. La mayoría de los casos de nuestro estudio presentaron comorbilidades y factores de riesgo como internación prolongada y administración previa de antimicrobianos. Estos hallazgos coinciden con estudios previos que evaluaron factores de riesgo para la adquisición de infecciones por Kpn-KPC. En uno de ellos, la presencia de enfermedad severa y el uso previo de antimicrobianos principalmente cefalosporinas y quinolonas fueron identificados como factores de riesgo4.
El PFGE reveló la presencia de bandas idénticas, estableciendo la relación clonal de las cepas aisladas. Esto, sumado al antecedente de contacto previo con otros pacientes infectados o colonizados con Kpn-KPC en todos los casos excepto en el caso índice, hace presumir que el principal mecanismo de diseminación en nuestra institución fue la transmisión de paciente a paciente. A su vez, este clon fue identificado por MLST como perteneciente al tipo de secuencia ST258 predominante en la mayoría de los aislamientos de Kpn-KPC en Argentina y que se caracterizó por una abrupta y rápida diseminación por todo el país3. Este perfil epidemiológico se asemeja a brotes de Kpn-KPC previamente descritos en Estados Unidos y Grecia5,6.
El perfil de sensibilidad de los aislamientos de Kpn-KPC durante el brote limitó dramáticamente las opciones terapéuticas, siendo inadecuado el tratamiento empírico en una gran proporción de los casos. El tratamiento óptimo para infecciones causadas por Kpn-KPC no está establecido, más aún los datos clínicos son muy limitados y se basan principalmente en reportes de casos o en pequeñas series de casos2. Colistina fue el antimicrobiano más frecuentemente utilizado en nuestra cohorte, debido principalmente a que más de la mitad de los casos fueron infecciones del tracto urinario. Esto imposibilitó el uso de tigeciclina que tiene escasa concentración en orina con las dosis habituales.
A pesar de que todos los pacientes recibieron un tratamiento antibiótico dirigido adecuado, la mortalidad global fue elevada. Esto podría explicarse en parte a que además del uso de un antibiótico empírico inadecuado, existen otros factores de riesgo de mortalidad como la edad y un score Apache II elevado al momento de la infección por Kpn-KPC7. Esta última variable también ha sido descrita como un factor de riesgo para la infección por Kpn-KPC8. Por otra parte, la mortalidad atribuible en nuestro estudio fue de un 26%, similar a la reportada en Grecia y menor que la reportada en brotes de Estados Unidos e Israel9.
Las estrategias utilizadas para el control de las infecciones por Kpn-KPC como el aumento de la limpieza ambiental, cultivos de vigilancia, precauciones de contacto y uso prudente de antimicrobianos, fueron necesarias para controlar el brote. La implementación de hisopados de vigilancia permitió identificar a pacientes con colonización con Kpn-KPC, los cuales son una fuente importante de transmisión durante brotes nosocomiales10. En nuestro estudio se identificó un 10% de pacientes colonizados con Kpn-KPC.
Finalmente, es importante remarcar que el equipo de salud debe estar alerta para identificar los factores de riesgo de infección por Kpn-KPC, y así mejorar la detección de los probables casos e instaurar un tratamiento antibiótico empírico adecuado. De esta forma, además se podrían tomar medidas preventivas más tempranamente y así evitar la diseminación paciente a paciente de esta amenazante bacteria.
AgradecimientosA todo el personal del hospital que participó en la atención y diagnóstico de los pacientes durante el brote.
Conflicto de interésLos autores declaran no tener ningún conflicto de intereses.