La aspergilosis invasiva junto con la aspergilosis crónica pulmonar y la aspergilosis broncopulmonar alérgica, constituyen las formas clínicas de aspergilosis. Aunque el número de especies de Aspergillus spp. es muy numeroso, Aspergillus fumigatus-complex es el agente etiológico más frecuente, independientemente de la forma clínica y la afección de base del paciente. El incremento de los diferentes tratamientos inmunosupresores y el mayor uso de corticoides en pacientes con enfermedad obstructiva crónica han condicionado un mayor protagonismo de la aspergilosis en los últimos años. El uso de galactomanano y las pruebas de imagen complementan las limitaciones microbiológicas en el diagnóstico de estos pacientes. Voriconazol y anfotericina liposomal constituyen la base del tratamiento en todas las formas de aspergilosis, y posaconazol, itraconazol, caspofungina y otras equinocandinas son alternativas eficaces. El pronóstico depende de la forma clínica y las características del huésped, pero es sombrío fundamentalmente en las formas invasivas diseminadas.
Invasive aspergillosis, chronic pulmonary aspergillosis and allergic bronchopulmonary aspergillosis are the clinical forms of aspergillosis. Although there is a great number of Aspergillus species, Aspergillus fumigatus-complex is the more frequent aetiological agent, regardless of clinical form or baseline condition. The increase in immunosuppressive agents and the higher use of corticosteroids in chronic obstructive pulmonary disease have led to aspergillosis becoming more prominent in recent years. Galactomannan detection and radiological diagnostic images complement the limitations of microbiology cultures in these patients. Voriconazole and liposomal amphotericin B are the gold standard in patients requiring therapy, and posaconazole, itraconazole, caspofungin and other echinocandins are effective alternatives. The prognosis depends of clinical forms and characteristics of the host, but it is particularly poor in the disseminated invasive forms.
Desde un punto de vista clínico, el término aspergilosis incluye enfermedades de diferente patogenia, como son la aspergilosis broncopulmonar alérgica (ABPA), las formas pulmonares crónicas no invasivas o semi-invasivas, las formas invasivas de la vía aérea, las formas cutáneas y las formas extrapulmonares y/o diseminadas. Todas ellas producidas por diferentes especies de Aspergillus, mayoritariamente A. fumigatus, A. flavus y A. terreus. Aspergillus es ubicuo en la naturaleza y la inhalación de conidias es un fenómeno habitual. Sin embargo, la invasión tisular es infrecuente y ocurre fundamentalmente en pacientes neutropénicos o sometidos a algún grado de inmunosupresión celular. La mortalidad de las formas invasivas depende de la forma clínica y el tipo de huésped, pero suele ser superior al 50%1.
PatogeniaLa eliminación de conidias inhaladas tiene lugar por células epiteliales de la vía aérea y fundamentalmente por macrófagos alveolares. Éstos realizan el aclaramiento de las conidias y tras reconocer determinados antígenos fúngicos de la pared celular, secretan mediadores inflamatorios que favorecen el reclutamiento de neutrófilos y la activación de la inmunidad celular, determinantes en la eliminación de hifas y en la constitución de la respuesta inmunológica1.
Desde un punto de vista histológico, la aspergilosis invasiva (AI) produce disrupción de planos tisulares e invasión vascular por adhesión de componentes de la superficie celular fúngica a los componentes de la pared vascular, incluida la membrana basal, la matriz extracelular y los constituyentes celulares. Ello produce infarto e isquemia de estructuras distales.
La patogénesis de la ABPA es una reacción compleja de hipersensibilidad, observada en algunos pacientes con asma o fibrosis quística. Se produce cuando el árbol bronquial es colonizado por Aspergillus spp. y conlleva episodios repetidos de obstrucción bronquial, inflamación e impacto mucoso, que pueden provocar bronquiectasias, fibrosis y compromiso respiratorio. En estos pacientes existe un incremento en la respuesta Th2 de los linfocitos CD4 como respuesta a los antígenos de Aspergillus spp. a nivel broncoalveolar y sistémico, con un incremento de la producción de interleucinas 4, 5 y 13. Esto conlleva un incremento de la eosinofilia y de los niveles séricos de IgE2.
MicrobiologíaHasta hace poco tiempo se han utilizado las características fenotípicas para identificar las diferentes especies de Aspergillus spp. En la actualidad, el uso de técnicas moleculares ha completado esta identificación y ha incrementado el número de especies y subespecies conocidas. Algunas de estas especies no son distinguibles por métodos fenotípicos. Dada la complejidad de algunos de estos esquemas de clasificación y la ausencia de una estandarización del diagnóstico molecular, se ha sugerido que algunos aislados sean calificados como miembros de «especies-complex»3. Con el reciente uso de técnicas de diagnóstico molecular, basadas en la amplificación de la región ITS, la caracterización de agentes patógenos se ha incrementado dramáticamente para incluir más de 250 especies en 7 subgéneros y en múltiples secciones.
De la mayoría de las especies de Aspergillus spp. se conoce su forma asexuada, pero para algunas especies se conoce también la forma teleomórfica (sexuada), incluyendo formas patógenas como Aspergillus nidulans (teleomórfica: Emericella nidulans), Aspergillus amstelodami (teleomórfica: Eurotium amstelodami) o recientemente, el agente más común Aspergillus fumigatus (teleomórfica: Neosartorya fumigata)4 y otros. En un intento de simplificar la nomenclatura el nombre Aspergillus se mantiene de forma generalizada.
La mayoría de las formas invasivas están producidas por A. fumigatus-complex, el agente más común de la sección Fumigati (donde se incluyen numerosos agentes, como A. fumigataffinis o A. lentulus, entre otros), seguido de A. flavus, A. niger y A. terreus. Con el incremento de inmunosupresión la lista de especies patógenas se ha ampliado, incluyendo A. nidulans, A. sydowii, A. alliaceus, A. avenaceus, A. calidoustus y otros.
Formas clínicasAspergilosis broncopulmonar alérgicaLa sintomatología clínica de la ABPA conlleva episodios recurrentes de obstrucción bronquial en pacientes asmáticos, con fiebre, malestar, expectoración de moldes mucosos oscuros, eosinofilia y en ocasiones hemoptisis. Los hallazgos radiológicos suelen mostrar infiltrados parenquimatosos (habitualmente en lóbulos superiores), atelectasias por impacto mucoso y signos característicos de bronquiectasias. Los pacientes muestran signos de obstrucción de la vía aérea, con atrapamiento aéreo y disminución de FEV1 e incremento del volumen residual.
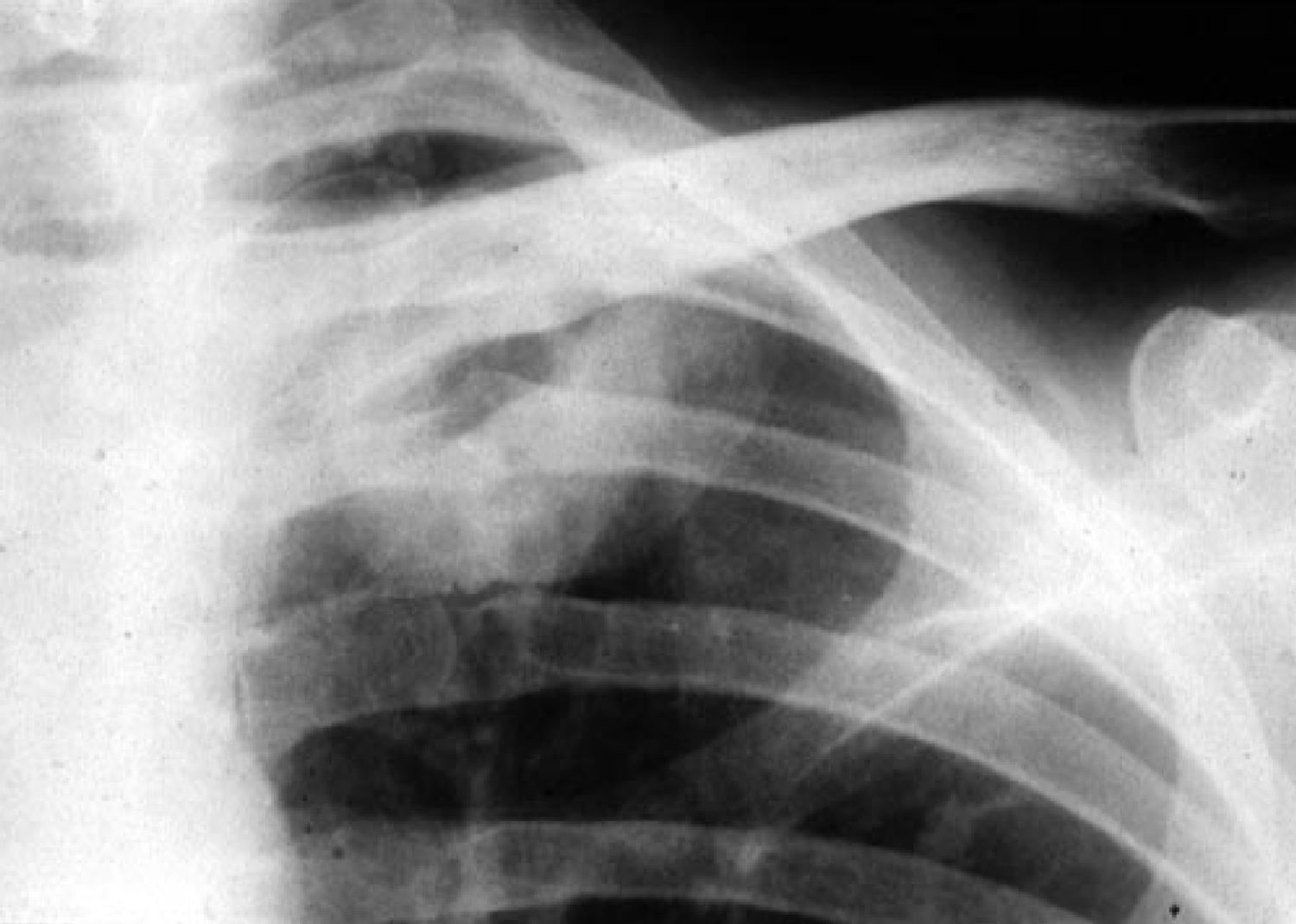
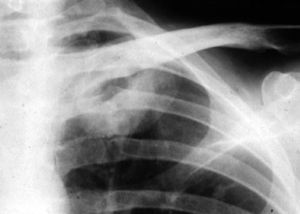
Aspergilosis pulmonar crónicaLa aspergilosis pulmonar crónica incluye varios cuadros clínicos, como el aspergiloma, la aspergilosis crónica cavitada, la aspergilosis crónica fibrosante y la aspergilosis crónica necrotizante. La duración de los síntomas en estos cuadros es, a diferencia de la aspergilosis pulmonar aguda, superior a tres meses. Suelen afectar a pacientes inmunocompetentes o con inmunosupresión débil, por lo que es bastante característico que presentan en suero precipitinas positivas frente a Aspergillus spp., a diferencia de los pacientes con aspergilosis invasiva, severamente inmunodeprimidos. El aspergiloma o aspergiloma simple es una pelota fúngica compuesta por hifas, fibrina, moco y detritus celulares que anidan o colonizan una cavidad pulmonar previa. La aspergilosis crónica cavitada (anteriormente denominado aspergiloma complicado) afecta a pacientes inmunocompetentes que desarrollan una o más cavidades durante varios meses, habitualmente en lóbulos superiores y si progresan pueden llegar a desarrollar formas crónicas fibrosantes. Estas formas clínicas de aspergilosis se suelen observar en pacientes con tuberculosis, ABPA (ver más adelante), cáncer de pulmón resuelto, neumotórax con formación de bullas, enfermedad pulmonar obstructiva crónica (EPOC) y sarcoidosis fibro-cavitada. La aspergilosis crónica necrotizante suele afectar a pacientes con algún grado de compromiso inmunológico, como diabetes, alcoholismo, corticoterapia y algunos pacientes con SIDA (fig. 1). Presentan una clínica no tan crónica (semanas más que meses), por lo que algunos prefieren denominarla como aspergilosis pulmonar subaguda.
Aspergilosis invasivaLas formas clínicas locales más frecuentes de aspergilosis invasiva (AI) tienen lugar a nivel pulmonar y en los senos paranasales, aunque también pueden afectar al tracto gastrointestinal o a la piel, por inoculación directa.
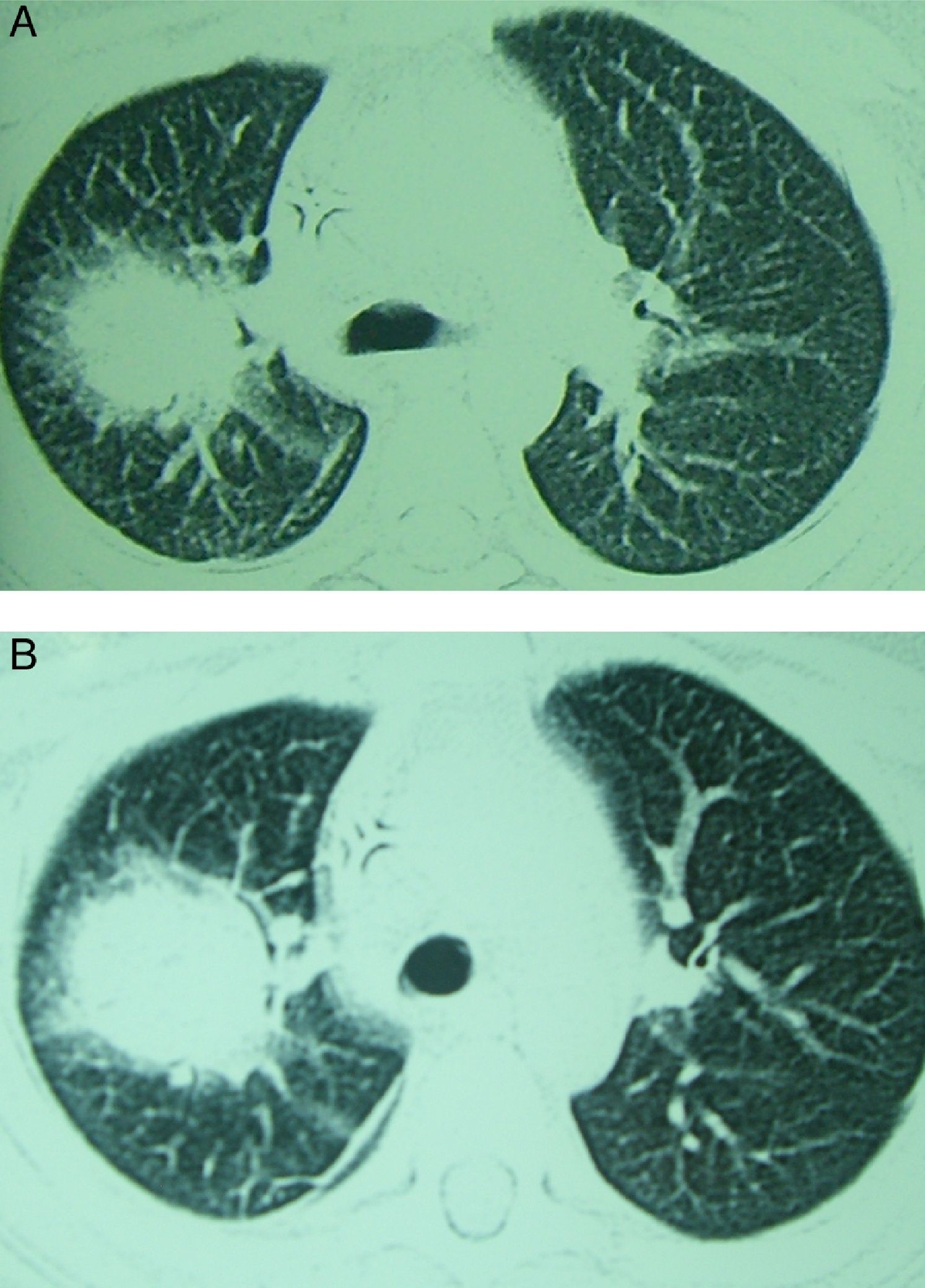
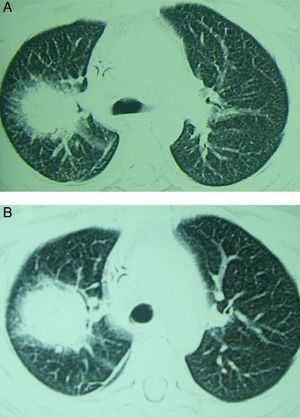
La aspergilosis pulmonar puede cursar con una sintomatología inespecífica. La clásica triada descrita en pacientes neutropénicos asocia: fiebre, dolor pleurítico y hemoptisis. No obstante, en cualquier paciente con factores de riesgo (ver más adelante) la presencia de síntomas respiratorios junto a la presencia de nódulos o infiltrados pulmonares deben hacer pensar en una aspergilosis pulmonar. La radiografía de tórax no es específica, pero la tomografía computarizada (TC) puede mostrar lesiones focales características. La aspergilosis pulmonar suele presentar uno o múltiples nódulos, con o sin cavitación, con consolidación segmentaria o infiltrado peribronquial o derrame pleural. Al igual que las manifestaciones clínicas, los hallazgos radiológicos dependen de las características del huésped. La progresión radiológica en la aspergilosis pulmonar ha sido más estudiada en pacientes neutropénicos. En estos pacientes, los hallazgos iniciales suelen incluir nódulos con un contorno atenuado a su alrededor (signo del halo) (fig. 2A), que refleja hemorragia y edema circundante a la lesión. Con el tratamiento y evolución favorable estos nódulos aumentan, pueden necrosarse en su parte central, lo cual hace disminuir su densidad y favorecer el atrapamiento aéreo (signo del meniscos aéreo o media luna) (fig. 2B).
La traqueobronquitis constituye la forma clínica más frecuente en pacientes con trasplante de pulmón y, en menor medida, en pacientes con SIDA. Predomina el componente de disnea, tos y expectoración de moldes mucosos. La radiografía de tórax y TC pueden ser normales o mostrar engrosamiento de la vía aérea, infiltrados parcheados o nódulos centrolobulares. Se han descrito diferentes patrones: la aspergilosis bronquial obstructiva se asocia con la producción de tapones mucosos producidos por crecimiento de hifas en la vía aérea, pero con poca afectación mucosa o invasión; la traqueobronquitis ulcerativa expresa una invasión focal de la mucosa traqueobronquial y/o cartílago por hifas; la traqueobronquitis pseudomembranosa se caracteriza por una extensa inflamación e invasión del árbol traqueobronquial con presencia de pseudomembranas y detritus necróticos sobre la mucosa bronquial. Los pacientes con trasplante pulmonar pueden desarrollar aspergilosis traqueobronquial como infección del material de sutura. Esta complicación puede reducirse si se utilizan suturas de monofilamentos de nylon en lugar de sedas. También se pueden observar formas traqueobronquiales en pacientes con neoplasias hematológicas, trasplante de progenitores5 y EPOC.
Si existe angio-invasión, Aspergillus spp. se puede diseminar más allá del tracto respiratorio y afectar piel, sistema nervioso central (SNC), ojos, hígado, riñones y otras estructuras. A nivel de senos paranasales, Aspergillus spp. puede presentarse de forma similar a la mucormicosis. Las formas localizadas, más indolentes y de curso subagudo se pueden ver en pacientes con grados de inmunosupresión menor, sin embargo la extensión rino-orbitaria suele ser característica de pacientes con neutropenias prolongadas. En éstos, la neutropenia puede justificar una ausencia de reacción inflamatoria y predominar los fenómenos necróticos. No obstante, fiebre, congestión nasal, dolor facial y periorbitario suelen estar presentes. Si se afecta la órbita pueden asociarse síntomas oculares (visión borrosa, proptosis, equimosis, parálisis oculomotora o ceguera por trombosis de la arteria central de la retina). La infección puede extenderse al seno cavernoso, produciendo trombosis del mismo y extensión al SNC. El diagnóstico por imagen mediante TC o resonancia magnética (RM) puede confirmar lesiones focales, erosión ósea, o engrosamientos de la mucosa sinusal6. Para el diagnóstico suele ser necesaria la obtención de múltiples biopsias.
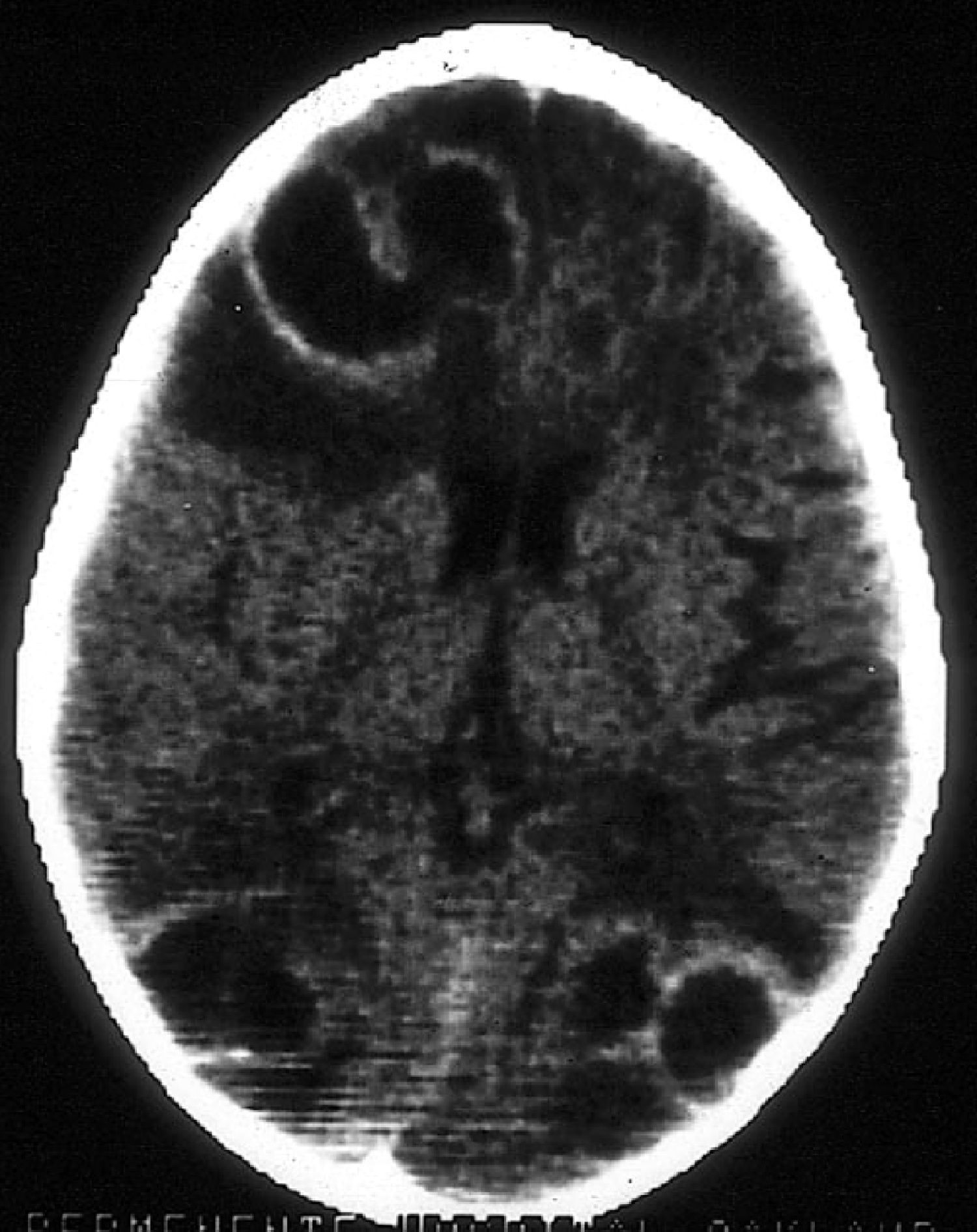
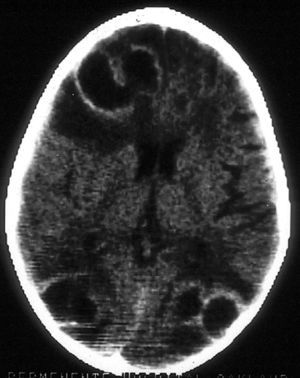
La aspergilosis del SNC puede observarse en el contexto de enfermedad diseminada o como extensión desde una aspergilosis sinusal. La clínica neurológica puede conllevar deterioro cognitivo, déficit focal o crisis comiciales. La TC o RM suele poner en evidencia alguno de estos patrones: lesiones en anillo compatibles con abscesos cerebrales; infartos corticales o subcorticales con o sin hematomas asociados; o engrosamiento de mucosa sinusal con engrosamiento dural por extensión (fig. 3). La aspergilosis del SNC se asocia con una mortalidad superior al 80%1.
La endoftalmitis ocular se puede observar en el seno de una aspergilosis diseminada o por extensión corneal secundaria a heridas traumáticas contaminadas. La infección invasiva provoca destrucción de estructuras oculares y grandes déficits funcionales que en ocasiones obligan a la enucleación.
La endocarditis por Aspergillus spp es menos frecuente que la producida por Candida spp. y suele asentar sobre válvulas protésicas. Habitualmente ocurre como consecuencia de contaminación en el acto quirúrgico de la cirugía valvular7. También pueden observarse como complicación de infecciones de catéteres endovasculares o en pacientes adictos a drogas intravenosas. De forma característica los pacientes presentan fiebre y embolismos sépticos. A pesar de tratarse de una infección endovascular, los hemocultivos rara vez son positivos, como en todas las formas de aspergilosis. El pronóstico es sombrío, incluso en presencia de tratamiento combinado médico-quirúrgico.
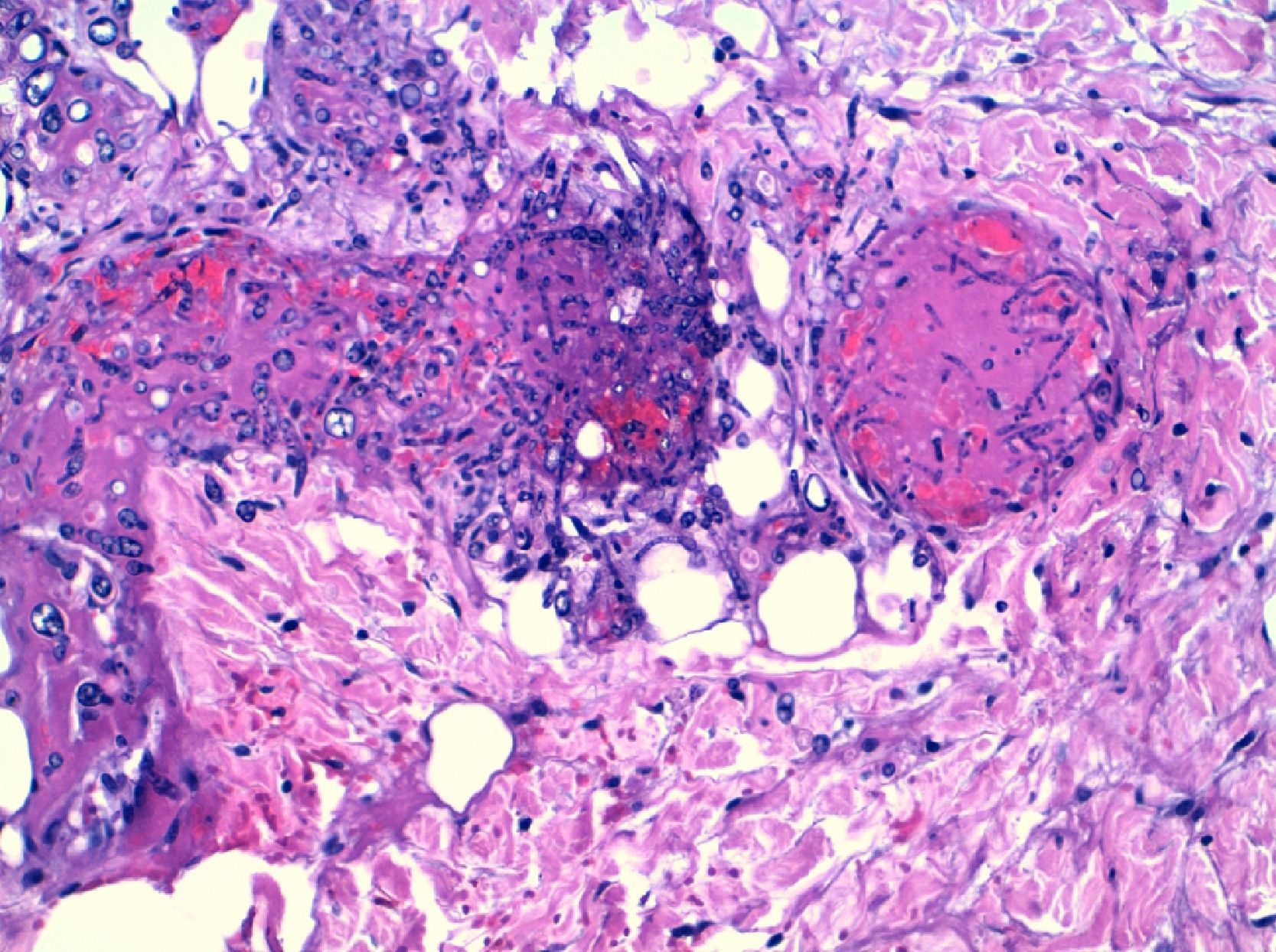
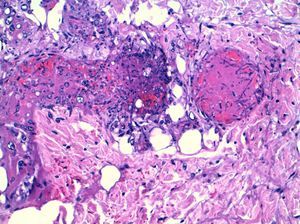
La aspergilosis cutánea suele ser primaria, tras inoculaciones locales, traumatismos abiertos, catéteres vasculares, quemaduras, vendajes contaminados, etc.; y más rara vez se produce en el contexto de infecciones diseminadas. La angio-invasividad de Aspergillus spp. hace que estas lesiones sean frecuentemente necróticas y para su diagnóstico sea necesario una biopsia profunda, con extensión subcutánea y confirmación de invasión tisular por hifas (fig. 4).
La aspergilosis gastrointestinal puede producir invasión local y expresarse como tiflitis, úlceras colónicas, dolor abdominal, y/o sangrado intestinal8.
Factores de riesgoAquellas condiciones que comprometen la respuesta inmune a nivel pulmonar y sistémico ante la inhalación de esporas son consideradas como factores de riesgo. La invasión es favorecida tras la inhalación de grandes cantidades de conidias (p. ej. construcciones o demoliciones), o cuando las características del paciente no permiten un aclarado adecuado de las mismas.
Los factores de riesgo clásico incluyen: neutropenia profunda y mantenida y recibir dosis altas de corticosteroides u otras drogas que produzcan inmunodeficiencia celular severa. No obstante, en los últimos años estamos atendiendo a un creciente número de formas invasivas de aspergilosis en pacientes con menor grado de inmunosupresión, como son los pacientes ingresados en unidades de cuidados intensivos (UCI), especialmente en aquellos con EPOC, que reciben terapia corticoidea inhalada o sistémica9.Las mayores incidencias de AI se observan en los pacientes con enfermedades hematológicas. Entre éstos, son habitualmente considerados de alto riesgo los siguientes: neutropenias profundas (neutrófilos<100/mm3) y prolongadas (>14 días) o si existe un déficit importante de la inmunidad celular a consecuencia de la quimioterapia, radioterapia, infección por citomegalovirus (CMV), enfermedad del injerto contra el huésped (EICH) o el tratamiento con corticoides, anti-TNF o alemtuzumab9,10. En este grupo se incluye el trasplante de progenitores hematopoyéticos (TPH) alogénico de sangre de cordón o con disparidad HLA, el TPH con EICH y las leucemias agudas (mieloblástica o linfoblástica) y síndromes mielodisplásicos (SMD) en inducción, reinducción o rescate. En los últimos años se han identificado otros factores de riesgo de AI relacionados con la comorbilidad, el tratamiento inmunosupresor, el grado de contaminación del aire ambiental y cierta predisposición genética. Con respecto a esta última, se ha puesto de manifiesto la importancia de diferentes polimorfimos genéticos (lectina de unión a manosa [Mannose-binding lectin –MBL–, Toll-like receptor [TLR4-2], dectina-1, plasminógeno, inteleucina-10, surfactante pulmonar, etc.11,12).
En los receptores de un trasplante hepático, la incidencia de AI se estima entre el 1 y el 9%9,13. En esta población se han caracterizado una serie de factores específicos que elevan significativamente el riesgo de padecer una AI. Tanto el retrasplante como la insuficiencia renal se colocan entre los factores de riesgo más importantes14,15. Otros factores asociados a la aparición de una AI son la necesidad de trasplante por insuficiencia hepática fulminante, la infección por CMV y una estancia prolongada en la UCI.
La incidencia de la AI en el trasplante pulmonar es la más elevada entre los receptores de TOS y se sitúa entre el 4 y el 23,3%. La colonización de la vía aérea por Aspergillus spp. durante los 6 primeros meses tras el trasplante aumenta en 11 veces el riesgo de padecer la enfermedad. Otros factores que confieren un mayor riesgo a esta población son la isquemia de la anastomosis bronquial, el trasplante unipulmonar, la hipogammaglobulinemia, la colocación de una prótesis bronquial y la infección por CMV9,16. La mortalidad de la AI en el trasplante pulmonar depende de la presentación clínica. Los pacientes que padecen una traqueobronquitis tienen una mortalidad alrededor del 25% mientras, que en los que sufren una enfermedad pulmonar invasora es del 67 al 82%16.
La incidencia de AI en pacientes ingresados en la UCI varía del 0,3 hasta el 5,8%9,17–19 y la infección se asocia a una mortalidad global que puede exceder el 80%, con una mortalidad atribuible del 20%. Garnacho-Montero et al.17 en un estudio prospectivo multicéntrico llevado a cabo en 73 UCI en España confirmaron el aislamiento de Aspergillus spp. en 36 (2%) de 1.756 pacientes, con confirmación de invasión en el 55%. La EPOC y el tratamiento con corticosteroides se identificaron mediante un análisis multivariante como los únicos factores asociados con el aislamiento de Aspergillus spp. La mortalidad fue del 50% en los pacientes colonizados y alcanzó el 80% en el grupo de pacientes con AI.
Los pacientes pediátricos con riesgo más elevado para padecer una AI son los receptores de trasplante de órgano sólido (TOS), los sometidos a trasplante de progenitores hematopoyéticos (TPH), con neoplasias hematológicas y los que padecen inmunodeficiencias primarias o adquiridas. Además, existen enfermedades raras con una mayor incidencia de AI, como son la enfermedad granulomatosa crónica o el déficit de lectina unida a manosa20.
DiagnósticoEl diagnóstico de AI es dificultoso debido al riesgo de colonización y contaminación y al bajo valor predictivo de los cultivos de muestras respiratorias, fundamentalmente esputo. La Organización Europea para la Investigación y Tratamiento del Cáncer (EORTC) y el Grupo de Estudio de Micosis Americano (MSG) elaboraron unas recomendaciones diagnósticas para infección fúngica invasiva21, que han sido recientemente revisadas22. Estas recomendaciones establecen tres criterios de diagnóstico: infección probada, infección probable o infección posible (tabla 1). Estas tres categorías se establecen tras analizar tres características en los pacientes: a) la afección de base, b) la presentación clínica, incluyendo la imagen radiológica, y c) la documentación microbiológica o histológica. La detección de galactomanano (GM) es, junto con la TC las pruebas no basadas en cultivo que más contribuyen al diagnóstico de AI. Su aplicación ha mostrado su máxima utilidad en la monitorización de pacientes oncohematológicos23. Nuestro grupo confirmó una sensibilidad del 56% en el diagnóstico de AI en trasplantados hepáticos24. La especificidad de GM se ve reducida por la posibilidad de falsos positivos, habitualmente asociados al uso de β-lactámicos25,26.
Criterios considerados en el diagnóstico de infección fúngica invasiva
| A) Patología de base |
| – Episodio reciente de neutropenia (<500/mm3) durante más de 10 días |
| – Trasplante alogénico de médula ósea |
| – Uso prolongado de esteroides a dosis medias >0,3mg/kg/día de equivalente de prednisona durante más de tres semanas (excepto aspergilosis broncopulmonar alérgica) |
| – Tratamiento con inmunosupresores de células T, como ciclosporina, tacrólimus, bloqueantes de TNF-α, anticuerpos monoclonales específicos (como alentuzumab) o análogos de nucleósidos, durante los últimos 90 días |
| – Inmunodeficiencia severa innata (como enfermedad granulomatosa crónica o inmunodeficiencia severa combinada) |
| B) Criterios clínicos y radiológicos |
| – Infección del tracto respiratorio inferior con presencia de uno de los siguientes signos: |
| • Lesiones densas, bien delimitadas (con o sin signo del halo) |
| • Signo de atrapamiento aéreo |
| • Cavitación |
| – Traqueobronquitis (úlcera, nódulo, pseudomembrana, placa o erosión en estudio broncoscópico) |
| – Infección senos paranasales, en asociación a uno de los siguientes signos: |
| • Dolor agudo localizado |
| • Úlcera nasal con escara negra |
| • Rotura de barrera ósea, incluyendo órbita |
| – Infección del sistema nervioso central, con presencia de uno de los siguientes signos: |
| • Lesión focal en las pruebas de imagen |
| • Engrosamiento meníngeo (tomografía computarizada o resonancia magnética) |
| C) Criterios microbiológicos (micológicos) |
| – Análisis directos (citología, microscopía directa o cultivo) |
| – Hongo filamentoso en esputo, lavado broncoalveolar, cepillado bronquial o aspirado de senos paranasales, indicado por: |
| • Presencia de hifas |
| • Cultivo de hongo filamentoso (p. ej. Aspergillus spp., Fusarium, Zygomycetes o Scedosporium species) |
| – Análisis indirectos (detección de antígenos) |
| – Aspergilosis: galactomanano en suero, plasma, lavado broncoalveolar o líquido cefalorraquídeo |
| – Infección fúngica invasiva (no criptocócica o mucoral): β-D-glucano en suero |
Infección probada: confirmación por histología o por cultivo de tejido estéril.
Infección probable: A+B+C (al menos un factor de cada grupo).
Infección posible: A+B (al menos un factor de cada grupo).
Fuente: Modificado de De Pauw B et al.22.
El diagnóstico diferencial es de interés en estos pacientes. Diferentes hongos filamentosos pueden producir infecciones similares, casi indistinguibles, a las producidas por Aspergillus spp. Los factores de riesgo para estos hongos son también similares a los de aspergilosis. Sin embargo, su confirmación microbiológica puede ser determinante a la hora de establecer un tratamiento adecuado. Entre los otros hongos que pueden producir cuadros clínicos y radiológicos similares a la asperglosis pulmonar invasiva están: los agentes productores de mucormicosis, Fusarium spp., Scedosporium apiospermum (o Pseudallescheria boydii) y Scedosporium prolificans. El efecto de halo se puede observar en infecciones por otros hongos y en infecciones por Pseudomonas aeruginosa1. Los hongos del orden mucorales (mucormicosis o zigomicosis) produce también rinosinusitis con extensión a SNC, con hallazgos clínicos y radiológicos similares. No obstante, la aspergilosis rinocerbral se suele ver en neutropenias prolongadas, y este tipo de mucormicosis, aunque también presente en pacientes neutropénicos, suele ser más frecuente en diabetes con descompensación. También las formas cerebrales pueden observarse en infecciones por otros hongos, incluyendo mucorales, Fusarium spp., Scedosporium spp. y hongos dematiaceos (o feohifomicosis)9.
El diagnóstico de ABPA conlleva criterios clínicos, radiológicos e inmunológicos. La tabla 2 incluye los criterios diagnósticos de ABPA2,27.
Criterios diagnósticos de aspergilosis broncopulmonar alérgica
| – Antecedentes de asma |
| – Pruebas cutáneas de reactividad inmediata a antígenos de Aspergillus spp. |
| – Precipitinas en suero frente a Aspergillus spp. |
| – Concentraciones séricas de IgE >417 IU/ml |
| – Eosinofilia periférica >500 cel/mm3 |
| – Infiltrados pulmonares en radiografía de tórax o tomografía computarizada |
| – Bronquiectasias centrales en tomografía computarizada |
| – Elevación específica de IgE e IgG frente a Aspergillus fumigatus en suero |
Además de la sospecha clínica y los hallazgos radiológicos, el diagnóstico de la aspergilosis pulmonar crónica conlleva la presencia de precipitinas en suero positivas y el aislamiento microbiológico (o citohistológico) en las muestras pulmonares. En ocasiones suelen cursar con GM en suero positivo, sobre todo las formas necrotizantes. Más de la mitad de estos pacientes tienen títulos positivos de IgE frente a Aspergillus spp. y algunos presentan IgE total elevada, sin tener diagnóstico de ABPA. En un 10-40% de los casos de aspergilosis pulmonar crónica, el esputo muestra la presencia de Aspergillus en cultivo, y la cifra es más elevada si se realiza reacción en cadena de la polimerasa (del inglés, polymerase chain reaction [PCR]) (70%). El papel de GM y B-D-glucano no es claro en estos pacientes. En una serie retrospectiva que incluía 48 pacientes con aspergiloma, la determinación de GM tuvo una sensibilidad del 38% en suero y del 92% en lavado broncoalveolar28.
Tratamiento de las infecciones por Aspergillus spp.Aspergillus fumigatus-complex produce más del 50% de los casos de AI y es habitualmente sensible a anfotericina B, voriconazol, itraconazol, posaconazol y equinocandinas. A. terreus y A. nidulans son resistentes a anfotericina B. Dentro de la sección Fumigati existen especies resistentes a anfotericina B y voriconazol como A. lentulus y A. fumigataffiinis29. También las cepas de A. calidoustus se suelen mostrar resistentes a los azoles. Pero quizás lo más preocupante es la aparición en los últimos dos años de cepas de A. fumigatus resistentes a voriconazol e itraconazol, fundamentalmente en Holanda y el norte de Europa30. Aunque no está claro su origen, se le atribuye una posible fuente ambiental en relación con los abonos de jardinería y se asocian con un mecanismo de resistencia asociado a la mutación TR-L98H del gen que codifica cyp51A y que le confiere un carácter de clonalidad31, aunque también se han documentado desarrollo de resistencias adquiridas a voriconazol en tratamientos prolongados32.
Tratamiento de inicio en la aspergilosis invasivaRecientemente se han publicado diferentes guías para el manejo de la AI9,33. Existe un amplio consenso para considerar voriconazol el tratamiento de elección de AI, en consecuencia con un estudio que mostró superioridad sobre anfotericina B convencional, donde consiguió una respuesta del 53 vs. 32% y un aumento de supervivencia a las 12 semanas (71 vs. 58%)34. Voriconazol puede presentar limitaciones para su uso en presencia de daño hepático o en pacientes que reciben fármacos con riesgo de interacción, fundamentalmente agentes calcineurínicos en los pacientes trasplantados. Anfotericina B liposomal también ha confirmado su eficacia en tratamiento de inicio de AI con resultados similares a los obtenidos con voriconazol35. En este estudio la dosis de 10mg/kg/d no supuso ninguna mejora sobre la dosis de 3mg/kg/d (∼50% eficacia en ambas ramas) y fue peor tolerada. En un estudio analizando el uso de caspofungina en el tratamiento de primera línea de AI en pacientes neutropénicos de alto riesgo, ésta no alcanzó los resultados esperados, mostrando una eficacia (33%) inferior a la deseada36. No obstante, a diferencia de los estudios de voriconazol34 y AmB-L35, en el estudio de caspofungina36 solo se incluyeron pacientes con AI probada o probable, lo que condicionó un reclutamiento de pacientes con un estado de enfermedad más avanzado. Un estudio en receptores de TPH fue suspendido antes de tiempo debido al bajo reclutamiento del mismo37. Sin embargo, pese al menor número de pacientes incluidos de los previstos, y a diferencia de lo ocurrido en el estudio en pacientes no trasplantados36, se cumplieron los objetivos marcados y se consideró que la caspofungina fue eficaz y segura en el tratamiento de la AI microbiológicamente confirmada. No existen estudios suficientemente contrastados con la utilización de micafungina, anidulafungina o posaconazol en AI en primera línea.
Tratamiento de rescate y combinación en la aspergilosis invasivaComo tratamiento de rescate en casos refractarios o intolerantes se pueden usar las formulaciones lipídicas de AmB o voriconazol (si no se ha usado como primera línea), caspofungina38, posaconazol39 y micafungina40; todos ellos poseen una frecuencia de respuesta en esta indicación del 40-50%. Itraconazol, aunque presenta experiencias favorables su uso no es recomendado dado que el mecanismo de acción es similar a voriconazol, pero posee peor biodisponibilidad. En general, en el tratamiento de rescate es recomendable cambiar de grupo terapéutico o utilizar tratamiento de combinación. Se han comunicado respuesta favorables con combinación de voriconazol y caspofungina en pacientes oncohematológicos41 y en trasplantados42, o con ambisome-caspofungina43. Un estudio prospectivo con voriconazol vs. voriconazol-anidulafungina en tratamiento de inicio de AI en pacientes con neoplasia hematológica está en marcha. Desde un punto de vista teórico, no contrastado en estudios clínicos controlados, el tratamiento de combinación puede estar indicado en el tratamiento de rescate y en pacientes graves, con enfermedad diseminada y en aquellos con afectación del SNC44.
Duración del tratamiento y medidas complementarias en la aspergilosis invasivaNo se pueden emitir recomendaciones generales sobre la duración del tratamiento y se deberá individualizar en cada caso según sea la evolución clínica y radiológica. Se recomienda mantener el tratamiento hasta la desaparición de los signos radiológicos, habitualmente con un mínimo de 6 a 12 semanas. Puede ser recomendable prolongar el tratamiento con voriconazol oral durante varias semanas para tratar la existencia de posibles microfocos residuales de aspergilosis. La monitorización de los niveles séricos de GM, aunque útiles en predecir la respuesta inicial no son útiles para determinar la duración del tratamiento.
Las indicaciones quirúrgicas de la AI se van reduciendo a medida que mejora el pronóstico con el tratamiento médico. Si la situación hematológica lo permite, fundamentalmente el recuento plaquetario, se recomienda la resección quirúrgica en los casos de hemoptisis, cuando sea masiva o secundaria a una lesión que se localice cerca de los grandes vasos, en la enfermedad sinusal, en la infiltración del pericardio, grandes vasos, hueso, tejido subcutáneo o SNC durante el tratamiento, si las lesiones son aisladas. Un estudio con un reducido número de pacientes con AI del SNC en tratamiento con voriconazol confirmó una mejor evolución en los pacientes sometidos a cirugía45; no obstante, hay pacientes que responden al tratamiento médico en esta situación en ausencia de cirugía. Se puede considerar la cirugía de lesiones residuales antes de someterse a nuevo episodio de riesgo, tipo quimioterapia intensiva o TPH. También debe ser valorada la cirugía en lesiones pulmonares cavitadas residuales, en presencia de hemoptisis recurrente o amenazante o con episodios de sobreinfección bacteriana grave1. En los casos de endocarditis, dado el mal pronóstico del tratamiento médico en solitario, se hace recomendable la cirugía y sustitución valvular o de los tejidos afectos para el manejo de esta forma de enfermedad. Las indicaciones y el tipo de cirugía en el manejo de la AI se resumen en la tabla 3.
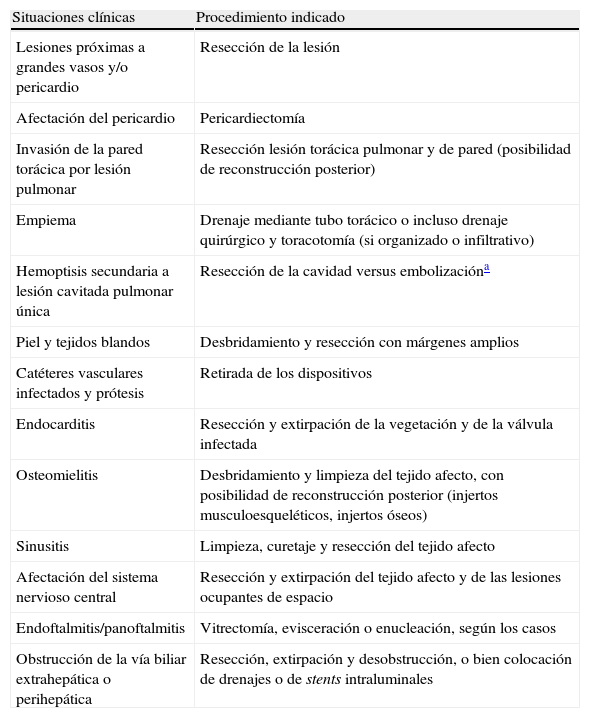
Indicaciones de cirugía en aspergilosis invasiva
| Situaciones clínicas | Procedimiento indicado |
| Lesiones próximas a grandes vasos y/o pericardio | Resección de la lesión |
| Afectación del pericardio | Pericardiectomía |
| Invasión de la pared torácica por lesión pulmonar | Resección lesión torácica pulmonar y de pared (posibilidad de reconstrucción posterior) |
| Empiema | Drenaje mediante tubo torácico o incluso drenaje quirúrgico y toracotomía (si organizado o infiltrativo) |
| Hemoptisis secundaria a lesión cavitada pulmonar única | Resección de la cavidad versus embolizacióna |
| Piel y tejidos blandos | Desbridamiento y resección con márgenes amplios |
| Catéteres vasculares infectados y prótesis | Retirada de los dispositivos |
| Endocarditis | Resección y extirpación de la vegetación y de la válvula infectada |
| Osteomielitis | Desbridamiento y limpieza del tejido afecto, con posibilidad de reconstrucción posterior (injertos musculoesqueléticos, injertos óseos) |
| Sinusitis | Limpieza, curetaje y resección del tejido afecto |
| Afectación del sistema nervioso central | Resección y extirpación del tejido afecto y de las lesiones ocupantes de espacio |
| Endoftalmitis/panoftalmitis | Vitrectomía, evisceración o enucleación, según los casos |
| Obstrucción de la vía biliar extrahepática o perihepática | Resección, extirpación y desobstrucción, o bien colocación de drenajes o de stents intraluminales |
Fuente: Tomado de Fortún J et al.9.
Siempre que sea posible, se debe reducir el factor de riesgo asociado. Así se deberán retirar (si es posible) o disminuir las dosis de los agentes inmunosupresores y especialmente de los esteroides. Es frecuente la utilización de factor estimulante de granulocitos o de granulocitos y macrófagos en pacientes neutropénicos para acelerar su recuperación46. También se ha utilizado el interferón (IFN) gamma en alguno de estos pacientes. Sin embargo, no existe evidencia de que estas medidas se asocien con una reducción de la mortalidad.
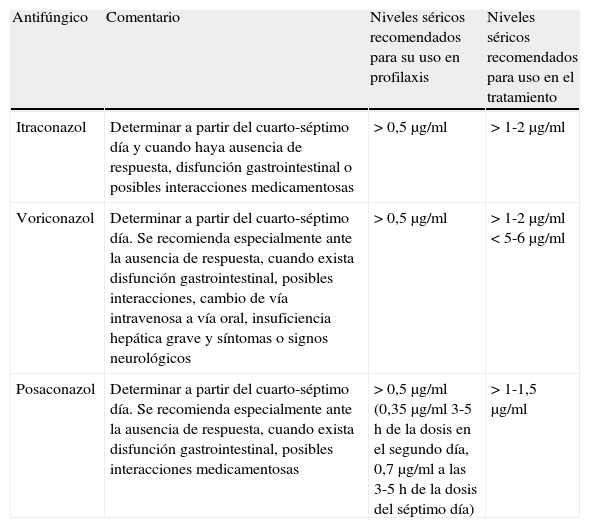
Tratamiento de aspergilosis invasiva en poblaciones especialesLa utilización de voriconazol (o posaconazol o itraconazol) en la AI debe ser siempre monitorizada con determinación de niveles séricos, dada la variabilidad de absorción y metabolización de los mismos y las posibles interacciones medicamentosas. La tabla 4 ilustra los niveles séricos recomendados en la utilización de triazoles. El tratamiento de la AI en otro tipo de pacientes inmunodeprimidos, no hematológicos, puede tener algunas características diferenciales. Los triazoles son unos inhibidores muy potentes de los isoenzimas del complejo CYP34A hepático, por lo que incrementan de forma considerable las concentraciones séricas de los principales inmunosupresores (inhibidores de la calcineurina-inhibidores de la enzima m-TOR; everolimus, sirolimus)47. El itraconazol incrementa la concentración sérica de CsA o tacrolimus entre un 40-83%. En el caso de administrar voriconazol se debe disminuir la dosis del inhibidor calcineurínico entre un 50-60%. La coadministración de voriconazol y sirolimus está formalmente contraindicada aunque algunos autores lo han utilizado reduciendo la dosis de sirolimus entre un 75 y un 90%48. La utilización de posaconazol obliga a disminuir la dosis de tacrolimus o CsA entre un 60 y un 75%. Las equinocandinas tienen pocas interacciones farmacológicas, siendo la caspofungina la más dependiente, mientras que anidulafungina es la que tiene menos interacciones. La administración de caspofungina reduce la concentración de tacrolimus en cerca del 20% y la CsA puede incrementar alrededor del 35% la concentración de caspofungina49. La micafungina es un inhihidor leve del enzima CYP3A, con lo que puede incrementar las concentraciones de sirolimus un 20%50. Los estudios farmacocinéticos de anidulafungina han demostrado que no necesita ajuste en su dosis cuando se administra con otros fármacos inmunosupresores. La profilaxis de la infección fúngica invasiva, incluida la AI en el paciente sometido a TOS es mencionado en otro trabajo de esta monografía.
Niveles séricos de triazoles recomendables para el tratamiento de infección fúngica
| Antifúngico | Comentario | Niveles séricos recomendados para su uso en profilaxis | Niveles séricos recomendados para uso en el tratamiento |
| Itraconazol | Determinar a partir del cuarto-séptimo día y cuando haya ausencia de respuesta, disfunción gastrointestinal o posibles interacciones medicamentosas | >0,5μg/ml | >1-2μg/ml |
| Voriconazol | Determinar a partir del cuarto-séptimo día. Se recomienda especialmente ante la ausencia de respuesta, cuando exista disfunción gastrointestinal, posibles interacciones, cambio de vía intravenosa a vía oral, insuficiencia hepática grave y síntomas o signos neurológicos | >0,5μg/ml | >1-2μg/ml<5-6μg/ml |
| Posaconazol | Determinar a partir del cuarto-séptimo día. Se recomienda especialmente ante la ausencia de respuesta, cuando exista disfunción gastrointestinal, posibles interacciones medicamentosas | >0,5μg/ml (0,35μg/ml 3-5h de la dosis en el segundo día, 0,7μg/ml a las 3-5h de la dosis del séptimo día) | >1-1,5μg/ml |
Fuente: Tomado de Fortún J et al.9.
El número de estudios clínicos bien controlados en el tratamiento de infecciones por hongos filamentosos en pediatría es reducido. Los niños, especialmente los neonatos, toleran mejor que los adultos la anfotericina B convencional (deoxicolato). Las formulaciones lipídicas de anfotericina B son preferidas en niños más mayores y cuando es previsible un período prolongado de tratamiento. La cinética del metabolismo de voriconazol es lineal en los niños, a diferencia del adulto, precisándose dosis más altas en niños para conseguir niveles terapéuticos, si bien los niveles plasmáticos son muy variables. Recientes evidencias sugieren que la biodisponibilidad del voriconazol administrado por vía oral se sitúa entre el 45-81% en pacientes menores a 12 años, lo cual se aleja mucho del 96% estimado en adultos51. Los datos actuales sobre el uso de posaconazol y otros nuevos azoles en niños menores a 13 años de edad son limitados, pero parecen indicar que la farmacodinamia y el perfil de toxicidad son bastante similares a los observados en adultos. Aunque no se dispone de ensayos clínicos aleatorizados comparando antifúngicos en pediatría para la AI, los estudios abiertos prospectivos han mostrado tasas de respuesta con voriconazol en el tratamiento de casos pediátricos similares a las de los adultos tratados con voriconazol o anfotericina B liposomal52.
Tratamiento de la aspergilosis crónica pulmonar53Es necesaria la individualización de estos pacientes. En los casos de aspergiloma simple solo es recomendable la resección quirúrgica en los casos sintomáticos, especialmente si existe hemoptisis. En estos pacientes puede ser necesario el tratamiento antifúngico si la cirugía no es posible y existe progresión clínica o radiológica. En casos con hemoptisis amenazante e imposibilidad quirúrgica, puede ser apropiada la embolización. No es recomendable el tratamiento (médico ni quirúrgico) de aspergilomas asintomáticos, sin progresión radiológica. El pronóstico de la aspergilosis crónica cavitada o fibrosante en ausencia de tratamiento conlleva una mortalidad a tres y 7 años del 25 y 70%, respectivamente. Por tanto, es recomendable su tratamiento con voriconazol (200mg/12h) o itraconazol (200mg/12h) y monitorización de niveles séricos. También se ha utilizado posaconazol con buenos resultados. La duración requerida suele ser de por vida. En los pacientes con mayor gravedad se puede iniciar tratamiento intravenoso con voriconazol o anfotericina. También se ha utilizado en algunos de estos casos micafungina con resultados similares. En los pacientes con formas necrotizantes también se recomienda una actitud terapéutica similar, dado que estas formas clínicas son más agresivas.
Tratamiento de la aspergilosis broncopulmonar alérgica2El tratamiento de ABPA persigue controlar los episodios inflamatorios y limitar la progresión del daño pulmonar. Los corticoides son la base del tratamiento, pero hay evidencia del beneficio del tratamiento combinado con itraconazol o voriconazol. El episodio agudo (estadio I) o las exacerbaciones recurrentes (estadio III) son tratados con 0,5 a 1mg/kg/día de prednisona durante 14 días, con reducción paulatina hasta la suspensión en 3-6 meses. El estadio II (remisión) y estadio V (fibrosis pulmonar) no requieren corticoides. En el estadio IV (asma dependiente de corticoides), en casos de altos requerimientos de corticoides o en casos de recidivas frecuentes es recomendable el tratamiento con itraconazol o voriconazol durante 16 semanas. Omalizumab es un anticuerpo monoclonal humanizado frente a IgE. En un estudio con 7 niños con fibrosis quística y ABPA pobremente controlados con corticoides, la administración de omalizumab (300 a 375mg subcutáneos cada dos semanas, permitió la mejoría clínica y suspensión de corticoides en todos los niños con un seguimiento de 11 semanas a 18 meses54. Otro estudio abierto en 16 adultos con ABPA, sin fibrosis quística, el uso de omelizumab durante un año también se asoció a una reducción de exacerbaciones y al uso de corticoides en relación a los episodios del año anterior en ausencia de omelizumab55.
Nota: sección acreditada por el SEAFORMEC. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion