Las micobacterias de crecimiento rápido (MCR) son ubicuas en la naturaleza y están distribuidas ampliamente en el agua, suelo y animales. Durante las últimas 3 décadas se ha observado un notable incremento de las infecciones causadas por MCR, tanto localizadas como diseminadas, así como de los brotes nosocomiales por contaminación de equipos médicos. El diagnóstico microbiológico de las infecciones por MCR incluye la observación directa al microscopio y el cultivo. La identificación taxonómica se realiza mediante técnicas fenotípicas, bioquímicas, cromatográficas y de biología molecular. El tratamiento difiere del de la tuberculosis y otras micobacteriosis, debido a la variable sensibilidad in vitro de las especies de este grupo. Las MCR son resistentes a los fármacos antituberculosos convencionales, pero pueden ser sensibles a antimicrobianos de amplio espectro. En este trabajo comentamos aspectos relevantes de las infecciones por MCR, incluyendo su biología, epidemiología, patología, diagnóstico microbiológico, identificación taxonómica, sensibilidad a los antimicrobianos y tratamiento.
Rapidly growing mycobacteria (RGM) are ubiquitous in nature and widely distributed in water, soil and animals. During the past three decades we have observed a notable increment of infections caused by RGM, both localized and disseminated, as well as nosocomial outbreaks of contaminated medical equipment. The microbiological diagnosis of RGM infections includes direct microscopic observation and culture. The taxonomic identification is performed by phenotypic, biochemical, chromatographic and molecular biology techniques. The treatment differs from that of other mycobacteriosis like tuberculosis, owing to the variable in vitro susceptibility of the species of this group. The RGM are resistant to conventional antituberculous drugs, but can be susceptible to broad spectrum antimicrobial agents. In this study we comment on the significant aspects of human infections by RGM, including their biology, epidemiology, pathology, microbiological diagnosis, taxonomic identification, antimicrobial susceptibility and treatment.
Las micobacterias se incluyen en la familia Mycobacteriaceae y en el orden Actinomycetales, fenotípicamente relacionado con los géneros Nocardia, Rhodococcus y Corynebacterium. El género Mycobacterium está representado por bacilos pleomórficos, grampositivos, no esporulados, aerobios e inmóviles, intracelulares y resistentes a las condiciones ambientales. Su pared celular posee un alto contenido lipídico, cerca del 40% del peso seco de la bacteria, responsable de la propiedad de ácido-alcohol resistencia. En 1950, Timpe y Runyon propusieron una clasificación de las micobacterias en 4 grupos de acuerdo con la velocidad de crecimiento (lento ≥ 7 días y rápido ≤ 7 días) y la producción de pigmento en presencia o ausencia de luz (fotocromógenas, escotocromógenas y no cromógenas). A estos grupos se podría añadir uno nuevo constituido por aquellas especies con exigencias especiales de cultivo o que, hasta la fecha, no han podido cultivarse in vitro1.
Históricamente, la taxonomía de las micobacterias se ha basado en características fenotípicas, homología ADN-ADN y análisis de los ácidos grasos por cromatografía. Sin embargo, en las últimas 2 décadas, la comparación de la relación de las secuencias genéticas del 16S ARNr se ha convertido en el estándar para la identificación de especies. Se trata de una secuencia de aproximadamente 1.500 nucleótidos, altamente conservada en el genoma de las micobacterias, con segmentos variables entre las especies. Una porción de este gen, una secuencia de 441 pb, es de gran utilidad para diferenciar entre la mayoría de las especies de micobacterias2.
Se agrupan bajo el nombre de micobacterias atípicas todas aquellas especies que no forman parte del complejo Mycobacterium tuberculosis y M. leprae. Al microscopio pueden aparecer con una morfología idéntica a M. tuberculosis, pero muestran una serie de diferencias en cuanto a su crecimiento en los medios de cultivos, constituyentes lipídicos y perfil bioquímico, antigénico y genético. No hay acuerdo en la denominación de estas micobacterias, para las que se han propuesto diferentes nombres: bacilos seudotuberculosos, bacilos paratuberculosos, micobacterias anormales, micobacterias inclasificadas, MOTT (Mycobacteria other than tubercle bacilli), PPEM (Potentialiy pathogenic enviromental mycobacteria), micobacterias oportunistas, micobacterias no tuberculosas, micobacterias ambientales. El vocablo de micobacterias atípicas es el que se utiliza universalmente.
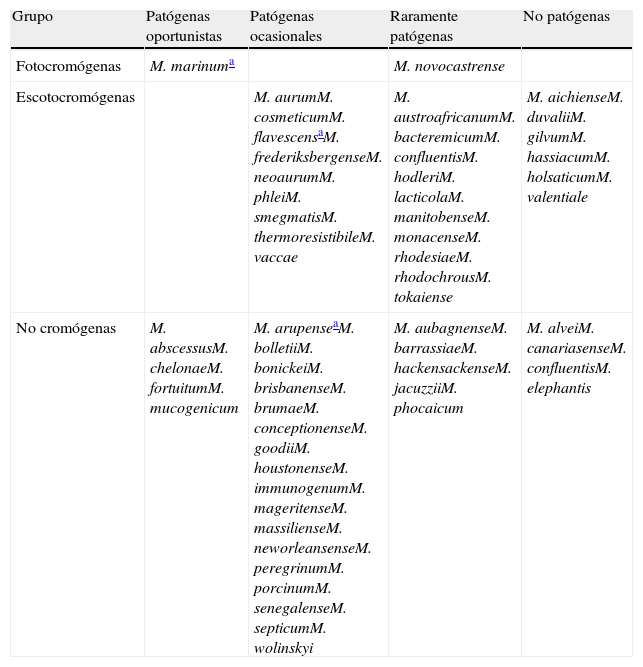
Las micobacterias atípicas de crecimiento rápido (MCR) son un grupo muy ubicuo en la naturaleza y ampliamente distribuido en el agua, suelo, aves y animales. Estas micobacterias pueden sobrevivir en ausencia de nutrientes y en un amplio margen de temperaturas; son capaces de formar biopelículas y son relativamente resistentes a los desinfectantes clorados y al glutaraldehído3. Cada año se describen nuevas especies implicadas infecciones nosocomiales, así como en infecciones en pacientes inmunocompetentes e inmunocomprometidos, gracias al desarrollo de los modernos sistemas de diagnóstico molecular. Esta tecnología ha permitido la identificación de un buen número de especies nuevas, algunas de ellas de difícil crecimiento en medios convencionales sólidos y de compleja tipificación con los métodos bioquímicos clásicos. La cromatografía líquida de alta resolución (HPLC) y la tecnología genética de amplificación han contribuido de manera importante a la identificación y reclasificación de nuevas especies1–6. De esta manera se ha confirmado que el grupo Mycobacterium fortuitum incluye a M. fortuitum, M. peregrinum, M. mucogenicum, M. senegalese, M. mageritense y varias especies descritas recientemente, como M. septicum, M. alvei, M. houstonense, M. boenickei, M. conceptionense, M. porcinum, M. neworleansense y M. brisbanense; el grupo Mycobacterium chelonae incluye a M. chelonae y M. abscessus; el grupo Mycobacterium mucogenicum incluye a M. mucogenicum, M. aubagnense y M. phocaicum; y el grupo Mycobacterium smegmatis incluye a M.smegmatis, M. goodii y M. wolinskyi7,8. Actualmente hay descritas más de 80 especies de MCR, de las que alrededor de 50 se han relacionado con infecciones humanas. En la tabla 1 se relacionan estas MCR clasificadas de acuerdo con la producción de pigmento y su importancia clínica, excluyendo aquellas especies que se han aislado en muestras ambientales pero no en seres humanos.
Micobacterias de crecimiento rápido: clasificación de acuerdo con la producción de pigmento y su importancia clínica
| Grupo | Patógenas oportunistas | Patógenas ocasionales | Raramente patógenas | No patógenas |
| Fotocromógenas | M. marinuma | M. novocastrense | ||
| Escotocromógenas | M. aurumM. cosmeticumM. flavescensaM. frederiksbergenseM. neoaurumM. phleiM. smegmatisM. thermoresistibileM. vaccae | M. austroafricanumM. bacteremicumM. confluentisM. hodleriM. lacticolaM. manitobenseM. monacenseM. rhodesiaeM. rhodochrousM. tokaiense | M. aichienseM. duvaliiM. gilvumM. hassiacumM. holsaticumM. valentiale | |
| No cromógenas | M. abscessusM. chelonaeM. fortuitumM. mucogenicum | M. arupenseaM. bolletiiM. bonickeiM. brisbanenseM. brumaeM. conceptionenseM. goodiiM. houstonenseM. immunogenumM. mageritenseM. massilienseM. neworleansenseM. peregrinumM. porcinumM. senegalenseM. septicumM. wolinskyi | M. aubagnenseM. barrassiaeM. hackensackenseM. jacuzziiM. phocaicum | M. alveiM. canariasenseM. confluentisM. elephantis |
Desde el punto de vista clínico, las micobacterias atípicas implicadas en infecciones se clasifican en 2 grupos: patógenas estrictas, que originan infecciones graves, a veces de curso mortal, con elevada transmisión por el aire y riesgo variable para la comunidad, y patógenas oportunistas, con riesgo individual moderado y de gravedad variable para la comunidad. A su vez, las especies patógenas oportunistas, entre las que se encuentran las MCR, se consideran oportunistas mayores u oportunistas menores según la mayor o menor incidencia en enfermedad humana; un tercer grupo encuadra las micobacterias que nunca o excepcionalmente han sido descritas como causa de infección, denominadas también saprofitas.
Durante las 3 últimas décadas se ha observado un notable incremento de las infecciones por MCR en todo el mundo, principalmente de infecciones postraumáticas y posquirúrgicas, y, en los últimos años, infecciones localizadas y diseminadas, y brotes de infección por contaminación de equipos médicos. Pero a pesar de este resurgir de las MCR como patógenas emergentes, para considerar la posible patogenicidad de una determinada especie es preciso constatar los datos clínicos del paciente, la fuente de aislamiento, las características microbiológicas del cultivo y la presencia de la misma cepa en otras muestras o en cultivos repetidos de la misma muestra. También es importante considerar la evolución del paciente tras el tratamiento específico, según las indicaciones del antibiograma.
Los diferentes hábitats acuáticos y el suelo son las principales fuentes de contagio en las infecciones humanas. La resistencia de las MCR a los desinfectantes contribuye a explicar su presencia en los ambientes hospitalarios3, y su capacidad de formar biopelículas es una estrategia de supervivencia frecuente que dificulta su erradicación9; la dispersión de las biopelículas puede constituir un importante mecanismo de infección10. La mayoría de infecciones humanas son debidas a inoculación tras un traumatismo accidental, cirugía o inyección, y se han descrito generalmente en el ámbito médico o paramédico1,3,4,11. Las infecciones se pueden agrupar en:
- •
Infecciones asociadas a catéteres. Los catéteres de acceso venoso, derivaciones vasculares, catéteres epidurales y catéteres de Tenckhoff, asociados a inmunosupresión, larga duración de la cateterización y tratamiento antibiótico previo, son causa de bacteriemia, infección del túnel del catéter, meningitis y peritonitis. En estos pacientes es fundamental la retirada de cualquier dispositivo para posibilitar la erradicación de la infección12–23.
- •
Infecciones tras traumatismo o inyección. Los traumatismos, las soluciones de anestésicos locales contaminadas, los corticoides en viales multiuso, las inyecciones en la corteza suprarrenal en individuos que siguen programas de pérdida de peso o de naturopatía, y las agujas reutilizadas o enjuagadas con agua del grifo empleadas en diversos procedimientos de mesoterapia, son causa de infecciones de piel y tejidos blandos que, no obstante, también pueden producirse en el contexto de una infección diseminada, especialmente en pacientes inmunodeprimidos7,24–37.
- •
Infecciones relacionadas con cirugía. Los instrumentos quirúrgicos, implantes, prótesis valvulares, tubos de timpanostomía, material de sutura o soluciones, así como la cirugía láser de corrección de la visión, procedimientos faciales, abdominoplastia, liposucción, reducción o aumento de mamas y perforación para colocación de piercing se consideran causas de infección posquirúrgica, especialmente cuando la cirugía se realiza en condiciones no controladas correctamente15,38–52.
- •
Infecciones pulmonares. La infección pulmonar se origina por aspiración o por vía hematógena, pero no se dispone de evidencias de transmisión de persona a persona. Puede estar asociada con enfermedad pulmonar estructural y alteración en la eliminación de los organismos, como sucede en pacientes con fibrosis quística, bronquiectasias y vómitos crónicos. Clínicamente puede variar desde una enfermedad asintomática a bronquiectasia grave y enfermedad pulmonar cavitaria. La neumonitis por hipersensibilidad se considera sobre todo en las personas que trabajan con metales líquidos contaminados con micobacterias, aunque también puede ocurrir después del contacto con jacuzzis, spas y piscinas16,53–62.
- •
Infecciones diseminadas. Se caracteriza por la presencia de lesiones nodulares múltiples no contiguas, generalmente en las extremidades, a veces acompañada de fiebre, pero rara vez afecta a órganos. El hallazgo de una enfermedad diseminada debe alertar sobre una inmunodeficiencia, tal como tumor maligno, trasplante, infección por el VIH, defecto de la inmunidad mediada por células, linfoma, leucemia, tratamiento con corticoides, insuficiencia renal crónica, enfermedad vascular del colágeno o deficiente regulación de citocinas63–73.
Otros síndromes clínicos causados por MCR incluyen: queratitis, endoftalmitis, artritis supurativa, osteomielitis, endocarditis, linfadenitis, infección urinaria crónica, otitis media, mastoiditis y pleuritis74–82.
Micobacterias de crecimiento rápido de interés clínicoLas micobacterias de crecimiento rápido predominantes en las infecciones humanas son las de los grupos Mycobacterium fortuitum, M. chelonae, M. mucogenicum y M. smegmatis; el resto de especies son minoritarias y solamente se describen en infecciones ocasionales. Las especies consideradas como patógenas oportunistas mayores son las siguientes:
- •
M. abscessus es una micobacteria no cromógena presente en diferentes hábitats acuáticos y el suelo. Puede contaminar los suministros de agua, reactivos y soluciones de lavado de los hospitales, dada su capacidad de sobrevivir en ausencia de nutrientes y en un amplio rango de temperaturas. A menudo causa infecciones pulmonares crónicas e infecciones de heridas quirúrgicas, así como infecciones relacionadas con mesoterapia, catéteres, dispositivos de hemodiálisis y cirugía láser, endocarditis, otitis media crónica e infección diseminada en pacientes inmunodeprimidos12,25,26,38,39,74,83.
- •
M. chelonae es una de las micobacterias más frecuente en pacientes inmunocomprometidos y muestra una mayor resistencia a los antibióticos. La infección cutánea es el cuadro clínico más habitual, a veces con diseminación en pacientes con terapia inmunosupresora por trasplante de órgano sólido, artritis reumatoide u otras enfermedades autoinmunes. Puede causar también infecciones traumáticas localizadas (celulitis, abscesos y osteomielitis) y, en menor proporción, infecciones relacionadas con heridas quirúrgicas y catéteres intravasculares24,27,38–40,64.
- •
M. fortuitum se ha encontrado en infecciones de heridas, abscesos producidos por inyección, infecciones tras cirugía plástica, osteomielitis traumática, celulitis, mastitis, peritonitis e infecciones relacionadas con catéteres intravenosos. Las infecciones pulmonares y diseminadas son poco frecuentes13,14,25,28,39,64,83.
- •
M. marinum crece de manera óptima a 30°C, a menudo dentro del rango de tiempo considerado para definirla como micobacteria de crecimiento rápido, pero si el cultivo se incuba a 37°C podría considerarse de crecimiento lento. M. marinum causa una lesión cutánea granulomatosa que puede evolucionar a fístula, llamada granuloma de las piscinas o acuarios, debida a antecedentes epidemiológicos de contacto con agua contaminada desde donde la micobacteria penetra a través de la piel. También se asocia con infecciones óseas y articulares (tenosinovitis, artritis, osteomielitis), aunque más raramente. Las infecciones diseminadas son excepcionales29,66,84.
- •
M. mucogenicum se encuentra con frecuencia en el agua potable, se ha demostrado su capacidad patógena y se ha asociado con brotes de infección nosocomial en pacientes que reciben diálisis, con infecciones relacionadas con catéteres intravenosos, infecciones del sistema nervioso central, respiratorias o de piel y tejidos blandos, bacteriemia e infección diseminada25,54,63,67.
La implicación como patógenas oportunistas de otras micobacterias de crecimiento rápido se reduce a casos aislados, sobre todo las especies productoras de pigmento que se describen de forma esporádica:
- •
M. aurum agente causal de bacteriemia relacionada con el catéter en pacientes inmunocompremetidos y neumonía bilateral55,68.
- •
M. arupense implicado en tenosinovitis e infección pulmonar56,75.
- •
M. bolletii descrito en infección respiratoria, infecciones tras cirugía laparoscopia y cosmética, e infección diseminada41,57,69.
- •
M. bonickei causante de infecciones de heridas quirúrgicas y traumáticas, y osteomielitis8.
- •
M. brisbanense, relacionado con infecciones quirúrgicas y traumáticas, osteomielitis y bacteriemia relacionada con catéteres8,25.
- •
M. brumae aislado en bacteriemia asociada a catéter25.
- •
M. cosmeticum encontrado en lesiones granulomatosas subdérmicas en pacientes tratadas con mesoterapia30.
- •
M. conceptionense descrito en infección por tratamiento de rejuvenecimiento facial, infección después de cirugía de implantes mamarios, abscesos subcutáneos y osteítis postraumática31,42,43.76.
- •
M. flavescens, clasificado de crecimiento lento o rápido, responsable de infecciones pulmonares, queratitis, osteomielitis, absceso de glúteo e infección diseminada después de inyección77,85.
- •
M. frederiksbergense causa de infección en pacientes tratados con mesoterapia27.
- •
M. goodii implicado en celulitis, bursitis, osteomielitis, infección de heridas traumáticas y quirúrgicas, e infección pulmonar44,78.
- •
M. houstonense encontrado en infecciones de heridas quirúrgicas y traumáticas, y osteomielitis8.
- •
M. immunogenum causante de infecciones relacionadas con catéteres, infecciones de la piel, queratitis, infección respiratoria, artritis e infección diseminada32,53,79.
- •
M. mageritense responsable de infección quirúrgica, infección relacionada con catéteres y sinusitis15.
- •
M. massiliense descrito en infecciones después de cirugía laparoscópica y procedimientos cosméticos, infección cutánea en un «spa caliente» y neumonía33,41,45.
- •
M. neoaurum referido en bacteriemia relacionada con catéteres, endocarditis y meningoencefalitis25,70–72.
- •
M. neworleansense relacionado con infecciones de heridas quirúrgicas y traumáticas, y osteomielitis8.
- •
M. peregrinum informado en infección pulmonar, esternal, cutánea, e infección de herida quirúrgica y por catéter16,46.
- •
M. phlei señalado como causante de peritonitis en pacientes que reciben diálisis peritoneal, artritis séptica, infección de un pie e infección relacionada con dispositivo cardiaco17,47.
- •
M. porcinum responsable de peritonitis en pacientes con diálisis, osteomielitis y bacteriemia asociada al catéter8,18,25,48.
- •
M. senegalense causa de bacteriemia por catéter19,25.
- •
M. septicum aislado en bacteriemia asociada a catéter y neumonía20,25,58.
- •
M. smegmatis agente causal de enfermedad pulmonar, bacteriemia por catéter, endocarditis, artritis, osteomielitis, linfadenitis, infecciones de piel y tejidos blandos e infección diseminada21,34,59.
- •
M. thermoresistibile es una especie capaz de crecer a 52°C. Ha sido considerado productor de infección pulmonar, así como infecciones de piel y tejidos blandos relacionadas con cirugía49,50.
- •
M. vaccae causa de infección cutánea y pulmonar60.
- •
M. wolinskyi asociado con celulitis, osteomielitis, e infección de herida tras cirugía plástica facial7,22,73.
Las micobacterias de crecimiento rápido que se han descrito excepcionalmente como causa de infección son las siguientes:
- •
M. aubagnense en infección respiratoria y sepsis67.
- •
M. austroafricanum en un paciente con artritis80.
- •
M. bacteremicum en bacteriemia72.
- •
M. barrassiae en un paciente con neumonía crónica61.
- •
M. hackensackense en un paciente con sepsis86.
- •
M. hodleri en un paciente con artritis reumatoide80.
- •
M. jacuzzi en infecciones tras implantes de mama51.
- •
M. lacticola en bacteriemia relacionada con catéter23.
- •
M. manitobense en infecciones de tejidos blandos35.
- •
M. monacense en infección cutánea e infección pulmonar52,62.
- •
M. phocaicum en bacteriemia asociada a catéter67.
- •
M. novocastrense en una lesión cutánea y en infección respiratoria36.
- •
M. rhodesiae en peritonitis en un paciente con diálisis peritoneal continua ambulatoria87.
- •
M. rhodochrous en infección cutánea y pericarditis37,81.
- •
M. tokaiense en un granuloma necrótico en el tallo hipofisiario82.
Otras especies de MCR han sido aisladas de muestras biológicas humanas pero no se han relacionado con infección88–94:
- •
M. achiense en un esputo.
- •
M. alvei en un esputo.
- •
M. canariasense en un hemocultivo.
- •
M. confluentis en un esputo.
- •
M. duvalii en lesiones de lepra.
- •
M. elephantis en secreciones respiratorias y un nódulo axilar.
- •
M. gilvum en un esputo y en líquido pleural.
- •
M. hassiacum en orina.
- •
M. holsaticum en esputo, orina y jugo gástrico.
- •
M. valentiale en un esputo.
El diagnóstico microbiológico de las infecciones por MCR incluye la observación microscópica directa de muestras clínicas, el cultivo de las mismas en medios selectivos y la identificación de las especies aisladas mediante técnicas fenotípicas, bioquímicas, cromatográficas y moleculares2,95,96.
El hallazgo de bacilos ácido-alcohol resistentes (BAAR) en extensiones teñidas mediante las técnicas de Ziehl-Neelsen o auramina es la primera evidencia de la presencia de MCR en una muestra clínica. En conjunción con los datos clínicos puede ayudar a establecer el diagnóstico presuntivo de micobacteriosis, aunque hay que tener en cuenta que las características morfológicas microscópicas no permiten establecer diferencias entre las distintas especies de micobacterias. El cultivo y la identificación son requisitos necesarios para el diagnóstico. La técnica clásica de Ziehl-Neelsen y la de fluorescencia con auramina son igualmente eficaces para el diagnóstico, pero alrededor del 30% de las MCR pueden presentar fluorescencia negativa en la tinción con auramina y requieren la tinción de Ziehl-Neelsen para su detección. Por eso, ante la sospecha de una infección por MCR debe realizarse directamente la tinción de Ziehl-Neelsen.
Estas micobacterias se aislaron tras cultivo en medio sólido de Lowenstein-Jensen y en medio líquido Middlebrook 7H9 procesado en el sistema automatizado Bactec MGIT 960 (Becton-Dickinson, Reino UnidLa identificación de las cepas se realizó mediante técnicas fenotípicas (temperatura de crecimiento, velocidad de crecimiento en medio sólido y formación de pigmento), técnicas bioquímicas (reducción de nitratos, producción de arilsulfatasa y ureasa, hidrólisis del tween 80, crecimiento en presencia de ClNa al 5% y en agar de Mac Conkey sin cristal violeta y utilización de manitol, inositol y sorbitol), y el método molecular INNO-LiPA Mycobacteria v2 (Innogenetics, Bélgica). El cultivo bacteriológico es mucho más sensible y rentable que el examen microscópico, y necesario para poder identificar los aislamientos a nivel de especie. Las muestras se pueden cultivar en medios sólidos y medios líquidos. El método tradicional de cultivo para micobacterias incluye la inoculación de un medio con base de huevo como el Löwenstein-Jensen, aunque también medios sin base de huevo, como los de Coletsos, Middlebrook 7H10 y 7H11. En la actualidad, se recomienda el cultivo primario de todas las muestras en medio líquido de Middlebrook 7H9, suplementado con sustratos de enriquecimiento (albúmina, dextrosa, estearato de polioxietileno, catalasa, ácido oleico) e inhibidores para bacterias y hongos (polimixina B, anfotericina B, ácido nalidíxico, trimetoprima, azlocilina). Los cultivos líquidos se procesan en sistemas de incubación y lectura automatizados: Bactec MGIT 960, MB/Bact Alert 3D, ESP Culture System II. Hay especies de MCR con requerimientos especiales de cultivo, como M. haemophilum que precisa un medio de cultivo con hemina (1% de citrato férrico amónico) e incubación a 30-32°C, o bien especies que crecen a temperaturas extremas, como M. thermorresistibile (52°C) y M. marinum (30°C).
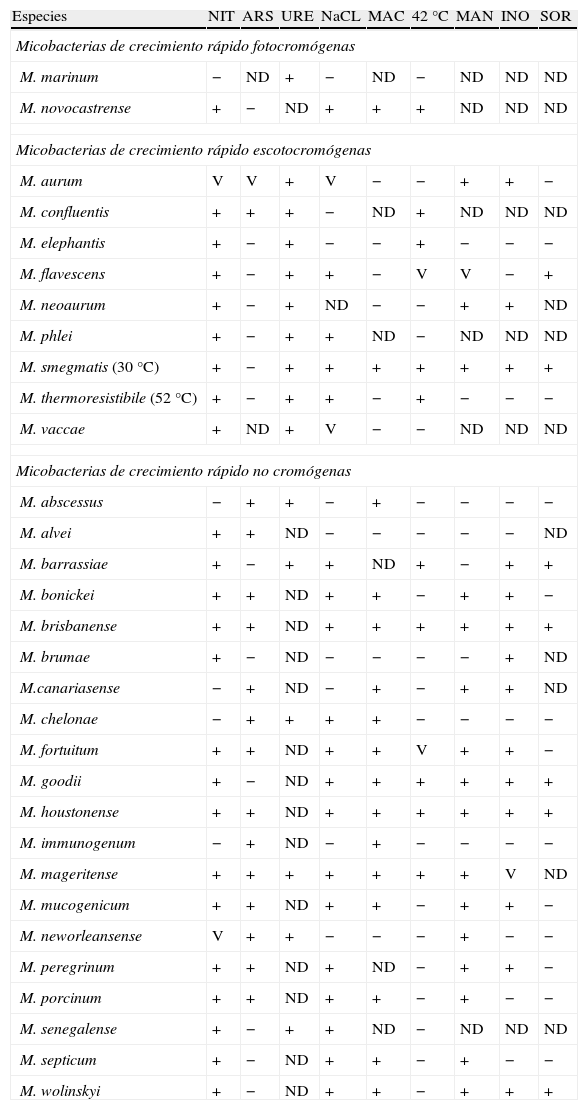
Durante muchos años la identificación de las MCR se ha llevado a cabo de acuerdo con las características fenotípicas (velocidad y temperatura de crecimiento, morfología de las colonias, producción de pigmento) y su comportamiento bioquímico (reducción de nitrato, producción de arilsulfatasa y ureasa, hidrólisis de tween 80, crecimiento en presencia de ClNa al 5% y en agar de Mac Conkey sin cristal violeta, reducción del citrato férrico amoniacal, utilización de manitol, inositol y sorbitol). En la tabla 2 se muestran las características bioquímicas de la mayoría de las especies de MCR de interés clínico.
Características bioquímicas de las micobacterias de crecimiento rápido de interés clínico2,6,61.
| Especies | NIT | ARS | URE | NaCL | MAC | 42°C | MAN | INO | SOR |
| Micobacterias de crecimiento rápido fotocromógenas | |||||||||
| M. marinum | − | ND | + | − | ND | − | ND | ND | ND |
| M. novocastrense | + | − | ND | + | + | + | ND | ND | ND |
| Micobacterias de crecimiento rápido escotocromógenas | |||||||||
| M. aurum | V | V | + | V | − | − | + | + | − |
| M. confluentis | + | + | + | − | ND | + | ND | ND | ND |
| M. elephantis | + | − | + | − | − | + | − | − | − |
| M. flavescens | + | − | + | + | − | V | V | − | + |
| M. neoaurum | + | − | + | ND | − | − | + | + | ND |
| M. phlei | + | − | + | + | ND | − | ND | ND | ND |
| M. smegmatis (30°C) | + | − | + | + | + | + | + | + | + |
| M. thermoresistibile (52°C) | + | − | + | + | − | + | − | − | − |
| M. vaccae | + | ND | + | V | − | − | ND | ND | ND |
| Micobacterias de crecimiento rápido no cromógenas | |||||||||
| M. abscessus | − | + | + | − | + | − | − | − | − |
| M. alvei | + | + | ND | − | − | − | − | − | ND |
| M. barrassiae | + | − | + | + | ND | + | − | + | + |
| M. bonickei | + | + | ND | + | + | − | + | + | − |
| M. brisbanense | + | + | ND | + | + | + | + | + | + |
| M. brumae | + | − | ND | − | − | − | − | + | ND |
| M.canariasense | − | + | ND | − | + | − | + | + | ND |
| M. chelonae | − | + | + | + | + | − | − | − | − |
| M. fortuitum | + | + | ND | + | + | V | + | + | − |
| M. goodii | + | − | ND | + | + | + | + | + | + |
| M. houstonense | + | + | ND | + | + | + | + | + | + |
| M. immunogenum | − | + | ND | − | + | − | − | − | − |
| M. mageritense | + | + | + | + | + | + | + | V | ND |
| M. mucogenicum | + | + | ND | + | + | − | + | + | − |
| M. neworleansense | V | + | + | − | − | − | + | − | − |
| M. peregrinum | + | + | ND | + | ND | − | + | + | − |
| M. porcinum | + | + | ND | + | + | − | + | − | − |
| M. senegalense | + | − | + | + | ND | − | ND | ND | ND |
| M. septicum | + | − | ND | + | + | − | + | − | − |
| M. wolinskyi | + | − | ND | + | + | − | + | + | + |
ARS: producción de arilsulfatasa; INO: utilización de inositol; MAC: crecimiento en agar de Mac Conkey agar sin cristal violeta; MAN: utilización de manitol; NIT: reducción de nitrato; NaCL: tolerancia a 5% NaCl; SOR: utilización de sorbitol; ND: no hay datos; URE: producción de ureaza; 42°C: crecimiento a 42°C;
La necesidad de identificar en la actualidad un mayor número de especies y la importancia de un diagnóstico precoz han motivado el desarrollo de nuevas técnicas más sensibles y específicas que sustituyen con ventaja a la microscopia, poco específica y sensible, y superan la lentitud o imposibilidad del cultivo.
Hoy día disponemos de técnicas como la cromatografía líquida de alta resolución (HPLC) y la cromatografía de gas-líquido (GLC), que analizan los ácidos micólicos y los ácidos grasos de la pared celular. Las técnicas cromatográficas permiten identificar la mayoría de las especies de MCR descritas en enfermedad humana, son rápidas, reproducibles y específicas, pero requieren cierta infraestructura difícilmente asequible a cualquier laboratorio97.
En la actualidad, la identificación genotípica es la mejor alternativa para la identificación de especies de MCR. Las técnicas de biología molecular reconocen bien proteínas o lipopolisacáridos específicos, bien determinadas secuencias de ADN, lo cual permite aumentar la sensibilidad de las pruebas convencionales empleadas en el diagnóstico microbiológico, identificar microorganismos imposibles de caracterizar por los métodos convencionales y detectar microorganismos en estado latente, pues analizan la información genética microbiana con independencia de la viabilidad. Estas técnicas requieren una amplificación de una zona de ADN concreta, mediante reacción en cadena de la polimerasa (PCR), y la detección de los fragmentos obtenidos mediante hibridación o restricción. Las zonas mejor estudiadas son el gen hsp65, que codifica la proteína micobacteriana de 65 KDa (heat shock) y las regiones genómicas de la subunidad 16S, un gen bien conservado pero con zonas variables de secuencias de nucleótidos específicas de género y especie, y la región intergenética 16S-23S del ARN ribosómico97,98.
Las técnicas de hibridación en fase sólida utilizan sondas cortas de ADN específicas de especie presentadas en microplacas, tiras de nitrocelulosa y otros soportes como los microchips o microarrays. Existen en el mercado 2 productos comerciales con tiras de nitrocelulosa: INNO-LiPA Mycobacteria y GenoType Mykobacterien. Ambos métodos se basan en la amplificación de una zona genética concreta (espacio intergenético 16S-23S para el INNO-LiPA y el 23S para el GenoType). Ambos métodos identifican solamente algunas especies de MCR, con ciertas diferencias: INNO-LiPA permite la detección de M. marinum, del complejo M. chelonae (grupo 1 y 2), del complejo M. fortuitum, sin diferenciar las especies que lo integran, y de M. smegmatis; GenoType identifica M. fortuitum, M. chelonae, M. abscessus, M. mucogenicum, M. goodii, M. smegmatis, M. phlei, M. peregrinum y M. marinum. Estas técnicas son útiles para la identificación de algunas especies de MCR y asequibles para la mayor parte de los laboratorios97,99,100.
La técnica PRA o PCR-RFLP (Restriction Fragment Length Polymorphism) se basa en la amplificación del gen hsp65 por PCR y el posterior análisis del polimorfismo de los fragmentos de restricción mediante 2 enzimas de restriccción (BstEII y HaeIII). Es una técnica compleja que consigue una identificación rápida y precisa de la mayoría de las especies de MCR97,101,102.
Tratamiento de las infecciones por micobacterias de crecimiento rápidoEl tratamiento de las infecciones por MCR es diferente al de la tuberculosis y otras micobacteriosis. Incluye la administración de antibióticos, de acuerdo con los patrones de sensibilidad, y la actuación quirúrgica en el caso de linfadenitis o infecciones de la piel y de tejidos blandos. Las MCR son resistentes a los fármacos antituberculosos convencionales pero pueden ser sensibles a otros antimicrobianos de amplio espectro, aunque las diferentes especies muestran una gran variabilidad en su respuesta a los de uso común en la práctica clínica. Este hecho motiva la necesidad de identificar correctamente cada aislado clínico y determinar su sensibilidad in vitro, si bien algunos estudios con un gran número de cepas permiten orientar una terapia empírica3,25,29,38,103–108.
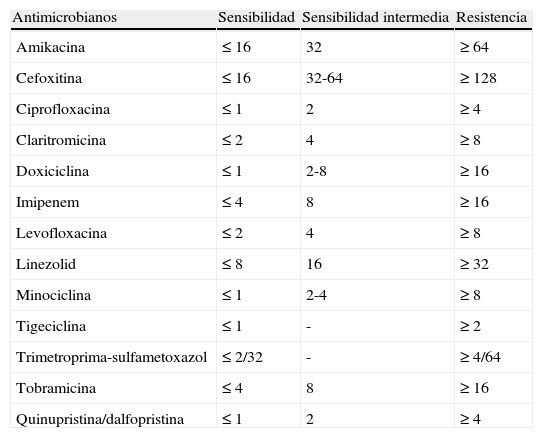
Para optimizar las pruebas de sensibilidad a antimicrobianos y facilitar la interpretación de los resultados, el National Committee for Clinical Laboratory Standards (NCCLS), conocido actualmente como Clinical and Laboratory Standards Institute (CLSI), publicó en 2003 las recomendaciones para las pruebas de sensibilidad de micobacterias no tuberculosas recogidas en el documento M24-A109,110. El documento contiene las directrices para las pruebas de sensibilidad del complejo M. tuberculosis y nuevas propuestas para micobacterias no tuberculosas, incluidas las micobacterias de crecimiento rápido (grupo M. fortuitum, M. chelonae y M. abscessus), M. avium complex, M. kansasii y M. marinum, así como especies de Nocardia y otros Actinomycetes aerobios. La técnica de microdilución en caldo es la recomendada por el CLSI para determinar la sensibilidad de MCR. Se realiza en caldo de Mueller-Hinton, con una concentración final del inóculo microbiano de 1 × 104 a 5 × 104 ufc/ml, incubación a 30°C y lectura a partir de las 72 h. Los antimicrobianos que se suelen ensayar incluyen macrólidos, aminoglucósidos, fluoroquinolonas, cefoxitina, imipenem, linezolid, tigeciclina, doxiciclina, minociclina y trimetoprima-sulfametoxazol. Como control de calidad se recomienda utilizar las cepas M. peregrinum ATCC 700686 y Enterococcus faecalis ATCC 29212. Los criterios de interpretación como cepas sensibles o resistentes son los recomendados por el CLSI, en el documento M24-A, y por el European Committee on Antimicrobial Susceptibility Testing (EUCAST) en el caso de tigeciclina109,111 (tabla 3).
Criterios de interpretación de sensibilidad a los antimicrobianos de micobacterias de crecimiento rápido (CMI en mg/l)
| Antimicrobianos | Sensibilidad | Sensibilidad intermedia | Resistencia |
| Amikacina | ≤ 16 | 32 | ≥ 64 |
| Cefoxitina | ≤ 16 | 32-64 | ≥ 128 |
| Ciprofloxacina | ≤ 1 | 2 | ≥ 4 |
| Claritromicina | ≤ 2 | 4 | ≥ 8 |
| Doxiciclina | ≤ 1 | 2-8 | ≥ 16 |
| Imipenem | ≤ 4 | 8 | ≥ 16 |
| Levofloxacina | ≤ 2 | 4 | ≥ 8 |
| Linezolid | ≤ 8 | 16 | ≥ 32 |
| Minociclina | ≤ 1 | 2-4 | ≥ 8 |
| Tigeciclina | ≤ 1 | - | ≥ 2 |
| Trimetroprima-sulfametoxazol | ≤ 2/32 | - | ≥ 4/64 |
| Tobramicina | ≤ 4 | 8 | ≥ 16 |
| Quinupristina/dalfopristina | ≤ 1 | 2 | ≥ 4 |
El método E-test también es de utilidad en la determinación de la sensibilidad de MCR. Se realiza a partir de un inóculo bacteriano en tampón fosfato pH 7,0 de 109 ufc/ml (turbidez igual 1,0 de la escala de Mac Farland), el cual es inoculado en la superficie de agar de Mueller-Hinton, donde se colocan tiras con concentraciones crecientes de antimicrobianos; las placas se incuban a 35°C durante 72 h o más, dependiendo de la especie de micobacteria, antes de determinar la concentración mínima inhibitoria (CMI) correspondiente al punto donde el área de inhibición del crecimiento intersecciona con la tira. Posiblemente el método E-test permita una aceptable diferenciación entre sensible y resistente, si bien su utilidad para evaluar la CMI es mucho más discutible106,112.
Otros métodos para determinar la sensibilidad de MCR incluyen el método Sensititre, la citometría de flujo y un método radiométrico, pero de ellos se tiene poca experiencia113. La difusión en agar con discos no es recomendable, ya que esta técnica no está bien estandarizada y los resultados no se correlacionan con los de la técnica de referencia.
La detección de mutaciones en determinados genes que confieren resistencia a antimicrobianos no es de mucha utilidad en el caso de las MCR. Solamente en el caso de los macrólidos se han detectado mutaciones específicas en la región peptidiltransferasa del gen 23S del ribosoma114.
Aunque no hay un acuerdo unánime sobre las indicaciones para la realización de los estudios de sensibilidad de MCR, se recomienda en algunas situaciones:
- –
Aislamientos significativos en pacientes tratados con macrólidos.
- –
Bacteriemia en pacientes que reciben profilaxis con macrólidos.
- –
Aislamientos en pacientes que recaen durante el tratamiento con macrólidos.
- –
Primer aislamiento en pacientes con enfermedad diseminada o respiratoria diagnosticada con certeza.
Pero dada la variable sensibilidad de las MCR, sería prudente la realización de un estudio de sensibilidad en todos los aislados significativos, con independencia de constatar el tratamiento con macrólidos.
De los antimicrobianos disponibles para el tratamiento de las infecciones producidas por las MCR más frecuentes, los aminoglucósidos son antibióticos parenterales de gran utilidad, y amikacina es el más eficaz; con respecto a tobramicina, se ha comprobado que M. chelonae es sensible (CMI≤4mg/L) y M. abscessus, resistente (CMI>8mg/l). Entre los macrólidos, claritromicina y azitromicina tienen buena actividad frente a la mayoría de las MCR habituales25,104–106. En cuanto a las fluoroquinolonas, los miembros del grupo M. fortuitum son generalmente sensibles a ciprofloxacina y ofloxacina, mientras que M. chelonae y M. abscessus pueden ser resistentes25,38,106,108. En el caso de imipenem y cefoxitina, debe comprobarse la sensibilidad de cada cepa; M. chelonae suele presentar CMI altas a cefoxitina (CMI>64mg/l) al contrario que M. abscessus, con CMI bajas (CMI≤64mg/l)25,104–106.
La sensibilidad de las especies del grupo M. smegmatis es bastante uniforme: son sensibles a amikacina, quinolonas, imipenem, tetraciclinas y trimetoprima-sulfmetoxazol, y muestran sensibilidad variable a cefoxitina7. Las especies del grupo M. mucogenicum suelen ser sensibles a amikacina, claritromicina, cefoxitina, quinolonas, imipenem y linezolid54. Mycobacterium marinum es sensible a rifampicina, etambutol, amikacina, claritromicina, quinolonas, imipenem, trimetoprima-sulfametoxazol, minociclina, doxiciclina y linezolid107.
Las especies de MCR ocasionales en infecciones humanas suelen ser sensibles a amikacina, fluoroquinolonas y claritromicina25,106, pero se ha detectado resistencia intrínseca a macrólidos en algunas, como M. boenickei, M. goodii, M. houstonense, M. mageritense, M. neworleansense, M. porcinum, M. smegmatis y M. wolinskyi, por lo que no se recomienda el uso de estos antimicrobianos en monoterapia cuando las CMI a alcanzan valores de 4-8mg/l25,115. Se han detectado igualmente resistencias a cefoxitina en M. brisbasense, M. brumae y M. senegalesnse, y a imipenem en M. brisbasense y M. brumae25,106.
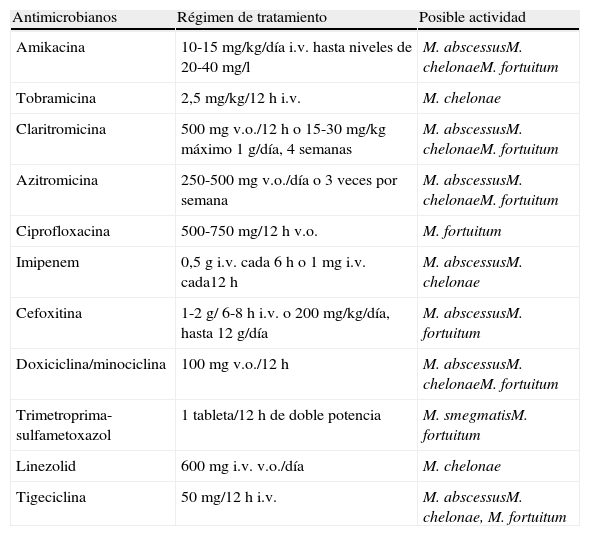
La elección de un tratamiento varía en función de 3 factores principales: la presentación clínica, la especie de micobacteria responsable de la infección y el estado inmunológico del paciente. Un aspecto de especial relevancia a la hora de tratar a los pacientes es la necesidad de retirar cualquier cuerpo extraño presente. Estas micobacterias son capaces de producir biopelículas, lo que facilita la resistencia a los antimicrobianos y obliga a retirar el material si se desea conseguir la curación definitiva del paciente112. La variable sensibilidad de la mayoría de las especies de MCR justifica la necesidad de utilizar diversos antimicrobianos, pero no hay ensayos clínicos que comparen diferentes regímenes de tratamiento. En la tabla 4 se recogen los antimicrobianos utilizados habitualmente en el tratamiento de las infecciones por las especies de MCR más usuales.
Antimicrobianos utilizados en el tratamiento de las infecciones causadas por micobacterias de crecimiento rápido
| Antimicrobianos | Régimen de tratamiento | Posible actividad |
| Amikacina | 10-15 mg/kg/día i.v. hasta niveles de 20-40 mg/l | M. abscessusM. chelonaeM. fortuitum |
| Tobramicina | 2,5 mg/kg/12 h i.v. | M. chelonae |
| Claritromicina | 500mg v.o./12 h o 15-30 mg/kg máximo 1 g/día, 4 semanas | M. abscessusM. chelonaeM. fortuitum |
| Azitromicina | 250-500mg v.o./día o 3 veces por semana | M. abscessusM. chelonaeM. fortuitum |
| Ciprofloxacina | 500-750 mg/12 h v.o. | M. fortuitum |
| Imipenem | 0,5g i.v. cada 6 h o 1mg i.v. cada12 h | M. abscessusM. chelonae |
| Cefoxitina | 1-2 g/ 6-8 h i.v. o 200 mg/kg/día, hasta 12 g/día | M. abscessusM. fortuitum |
| Doxiciclina/minociclina | 100mg v.o./12 h | M. abscessusM. chelonaeM. fortuitum |
| Trimetroprima-sulfametoxazol | 1 tableta/12 h de doble potencia | M. smegmatisM. fortuitum |
| Linezolid | 600mg i.v. v.o./día | M. chelonae |
| Tigeciclina | 50 mg/12 h i.v. | M. abscessusM. chelonae, M. fortuitum |
Modificada de De Groote MA y Huitt G.3
Las infecciones de la piel generalmente se resuelven de forma espontánea o, a veces, después de desbridamiento quirúrgico, o bien con claritromicina; para casos complicados se recomienda añadir amikacina y cefoxitina. La ciprofloxacina y el imipenem son una alternativa razonable a cefoxitina si la especie es resistente a este antimicrobiano. En infecciones graves el tratamiento debe prolongarse un mínimo de 4 meses, y hasta 6 meses en de infecciones óseas. La infección pulmonar puede tratarse con la asociación de claritromicina, amikacina y cefoxitina, o imipenem en caso de resistencia a cefoxitina, prolongando el tratamiento hasta 6-12 meses3. El tratamiento de las infecciones por M. marinum se lleva a cabo mediante la exéresis quirúrgica de la lesión, en infecciones profundas o extensas, o con diversas pautas antibióticas: antituberculosos clásicos, como rifampicina o etambutol, claritromicina o levofloxacina, durante 1-2 meses (habitualmente 3-4 meses). Algunos aislados son resistentes a ciprofloxacina, y la monoterapia con fluoroquinolonas puede facilitar el desarrollo de mutantes resistentes107.
En publicaciones recientes se postula la utilización de nuevos fármacos para el tratamiento de las infecciones por MCR, incluyendo las 8-metoxi-fluroquinolonas (gatifloxacina, moxifloxacina), linezolid, tigeciclina, telitromicina o isepamicina. La actividad in vitro de estos fármacos parece buena pero la experiencia clínica aún es limitada. Gatifloxacina parece tener buena actividad frente a M. fortuitum, pero no frente a M. abscessus y M. chelonae116; la actividad de linezolid es variable frente a las 3 especies, con una sensibilidad intermedia106,116,117; mientras que telitromicina ha resultado ser poco efectiva118,119. Sin embargo, los ensayos publicados sobre tigeciclina e isepamicina confieren a estos antimicrobianos una actividad similar a la de amikacina para un gran número de especies de MCR, incluidas las más habituales106,119,120.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.