El microorganismo más frecuentemente implicado en las infecciones por hongos en pacientes críticos es Candida spp. siendo C. albicans la especie que causa el mayor número de episodios. En pacientes críticos, Candida spp. es frecuentemente aislada en sitios no estériles. La colonización por Candida se documenta en casi el 60% de los pacientes críticos no neutropénicos que permanecen más de una semana en la UCI. Sin embargo, solo el 5% de ellos desarrollarán candidiasis invasiva. El diagnóstico de la candidiasis invasiva no candidémica sigue siendo problemático en la mayoría de los pacientes. El aislamiento de Candida en hemocultivo nunca debe ser interpretado como un contaminante y obliga a instaurar tratamiento. Los pacientes con colonización multifocal y con una puntuación de Candida score > 3 también deben recibir terapia antifúngica. El fluconazol está indicado en episodios sin criterios de gravedad y sin exposición reciente a azoles. El uso de una equinocandina se recomienda para pacientes hemodinámicamente inestables o con antecedentes de exposición reciente al fluconazol.
The most common organism implicated in fungal infections in the critically ill patients is Candida spp. C. albicans continues to be the species that causes the largest number of invasive candidiasis. In critically ill patients, Candida spp. are frequently isolated in non-sterile sites. Candida colonization is documented in nearly 60% of non-neutropenic critically ill patients staying more than one week in the ICU. However, only 5% of colonized patients will develop invasive candidiasis. The diagnosis of invasive non-candidemic candidiasis remains elusive in the majority of the patients. Candida in a blood culture should never be viewed as a contaminant and should always prompt treatment initiation. Patients with multifocal colonization with a Candida score >3 should also receive antifungal therapy. Fluconazole is reserved for non-severely ill patients without recent exposure to azoles. The use of an echinocandin is recommended for hemodynamically unstable patients or with a history of recent fluconazole exposure.
Las infecciones fúngicas más frecuentes en los pacientes críticos son las causadas por el género Candida, situándose después a gran distancia las originadas por Aspergillus spp. Candida spp. puede originar un gran número de entidades clínicas, con manifestaciones variadas que dependen del lugar de la infección y del tipo de paciente. Por motivos epidemiológicos y didácticos pueden dividirse en 2 clases fundamentales: las infecciones superficiales, que engloban las infecciones de la piel, de las uñas y de las mucosas orofaríngea y vaginal, y las candidiasis invasivas, que son las que afectan a órganos, a la mucosa gastrointestinal o al torrente sanguíneo.
Epidemiología de la candidiasis invasiva en la unidad de cuidados intensivosLa incidencia de infección y/o colonización fúngica en pacientes gravemente enfermos ha aumentado en las últimas décadas. En Estados Unidos, la sepsis relacionada con infecciones fúngicas se ha incrementado en un 207%, desde algo más de 5.000 casos en 1979 hasta más de 16.000 episodios en el año 2000, siendo Candida spp. el microorganismo más frecuentemente identificado1. Más recientemente, en Europa, se ha observado un incremento de la tasa anual de candidemia2,3, lo cual también se ha constatado en los pacientes ingresados en las áreas de críticos4.
En 2 estudios de vigilancia realizados en España, la tasa de candidemia oscila entre 0,5-1,5 episodios por cada 1.000 ingresos5,6. Aproximadamente un tercio de las candidemias que se diagnostican en un hospital tienen lugar en pacientes ingresados en las unidades de cuidados intensivos (UCI), y este porcentaje ha aumentado en los últimos años7. En general, se admite que la incidencia en la UCI es 7-10 veces superior a la de las salas generales, médicas o quirúrgicas. En un estudio reciente sobre infecciones en la UCI realizado en los cinco continentes, la prevalencia de candidemia fue de 6,87 episodios por 1.000 ingresos en la UCI. Hay que resaltar que la supervivencia en la UCI de los pacientes con candidemia fue significativamente menor que en el caso de bacteriemia por bacterias gramnegativas o grampositivas8.
C. albicans continúa siendo la especie que origina un mayor número de candidiasis, y es responsable de más del 50% de todos los episodios. Le siguen por orden de frecuencia C. parapsilosis, C. tropicalis y C. glabrata. Otras especies, como C. krusei, C. lusitaniae, C. guilliermondii o C. dubliniensis, son menos frecuentes. En las distintas series que han evaluado la distribución de especies en episodios de candidemia/candidiasis invasiva ocurridos en pacientes ingresados en áreas de críticos con los ocurridos en otras áreas del hospital, no se han observado diferencias significativas9–11.
Debemos indicar que todas estas especies, conocidas como C. no-albicans, se aíslan cada vez con más frecuencia, superando ya en algunas series a C. albicans12,13. En nuestro medio, C. glabrata es responsable de aproximadamente el 15-20% de los aislamientos, lo cual tiene una gran repercusión en la terapéutica, dado que es una especie que puede ser resistente al fluconazol. De igual modo, C. krusei, que aparece en situaciones de inmunodepresión profunda como la que ocurre en pacientes con neoplasia hematológica, es intrínsecamente resistente al fluconazol.
Factores de riesgoCandida spp. forma parte de la flora de la piel, las mucosas, el tracto gastrointestinal y los aparatos genital y urinario del ser humano. Diversas son la puertas de entrada de la candidemia en un paciente hospitalizado. En base a estudios experimentales, epidemiológicos, y por medio de técnicas de biología molecular, se puede afirmar que los orígenes más frecuentes son el tracto gastrointestinal (por translocación bacteriana) y la piel (en pacientes críticos, el catéter venoso)14.
Se han realizado numerosos estudios que han tratado de relacionar la influencia de los distintos factores de riesgo con el desarrollo de la candidiasis invasiva. La colonización por Candida en focos no estériles ocurre en más del 50% de los pacientes ingresados más de una semana en la UCI, aunque solo el 5% desarrolla infección15. La colonización candidiásica, generalmente multifocal, es el primer estadio para la mayoría de los casos de candidiasis invasivas en el paciente crítico. De hecho, la colonización previa ha sido identificada como factor de riesgo independiente para el desarrollo de candidiasis invasiva15.
El lugar de la colonización puede también ser de ayuda para definir qué pacientes tienen un alto riesgo de desarrollar una candidiasis invasiva. Así, el aislamiento de Candida spp. en la orina o en el tracto digestivo se asocia a mayor probabilidad de infección invasiva16. En pacientes quirúrgicos se comprobó una mayor frecuencia de candidiasis invasiva en caso de colonización de orina respecto a los no colonizados (13,2% versus 2,8%), del tracto respiratorio (8,0% versus 1,2%) y de recto/ostomía (8,4% versus 0%). Es importante destacar que los pacientes con cultivo negativo de recto/ostomía o en la orina y el tracto respiratorio no desarrollaron enfermedad invasiva17.
En el caso de los enfermos críticos existen muchos factores que favorecen la colonización y posteriormente la infección, como la gravedad subyacente, la presencia de catéteres venosos, la nutrición parenteral, los antibióticos de amplio espectro, la transfusión, la pancreatitis aguda, la cirugía abdominal o las fístulas intestinales18,19.
El tratamiento previo con fluconazol se ha señalado como un factor de riesgo para el aislamiento de Candida no-albicans, aunque otros estudios no corroboran esta asociación5,20,21. Otros autores han analizado si el uso previo de fluconazol se asocia a una infección por Candida causada por una especie potencialmente resistente a fluconazol (C. glabrata o C. krusei). En un estudio que incluyó a 245 pacientes con candidemia, de los cuales el 60% estaban ingresados en la UCI, la exposición previa a fluconazol no fue una variable asociada con el aislamiento de C. glabrata o C. krusei10, lo cual coincide con los hallazgos de otro trabajo cuyo diseño fue el de un estudio de casos y controles22. Desde un punto de vista práctico, lo que nos interesa para elegir el antifúngico a emplear es conocer los factores de riesgo cuya presencia nos permita sospechar si un episodio de candidemia está causado por una especie con resistencia probada al fluconazol. Nuestro grupo ha demostrado recientemente que el empleo de fluconazol es un factor de riesgo para candidemia originada por especie con resistencia demostrada microbiológicamente al fluconazol, pero no para candidemia por Candida no-albicans o por especie potencialmente resistente13. La asociación entre empleo previo de azoles y candidemia por especies resistentes al fluconazol ha sido también demostrada en pacientes oncológicos23.
DiagnósticoLa candidemia es la entidad clínica mejor estudiada, ya que el diagnóstico está claramente estandarizado. Su presentación es tardía —alrededor de la tercera semana de estancia en el hospital24— y no hay ningún signo clínico ni de laboratorio que nos permita diferenciarla de una infección del torrente circulatorio causada por otro patógeno. Quizá pueda mencionarse que en el paciente no neutropénico la elevación de la procalcitonina sérica es menor que en caso de una bacteriemia25,26.
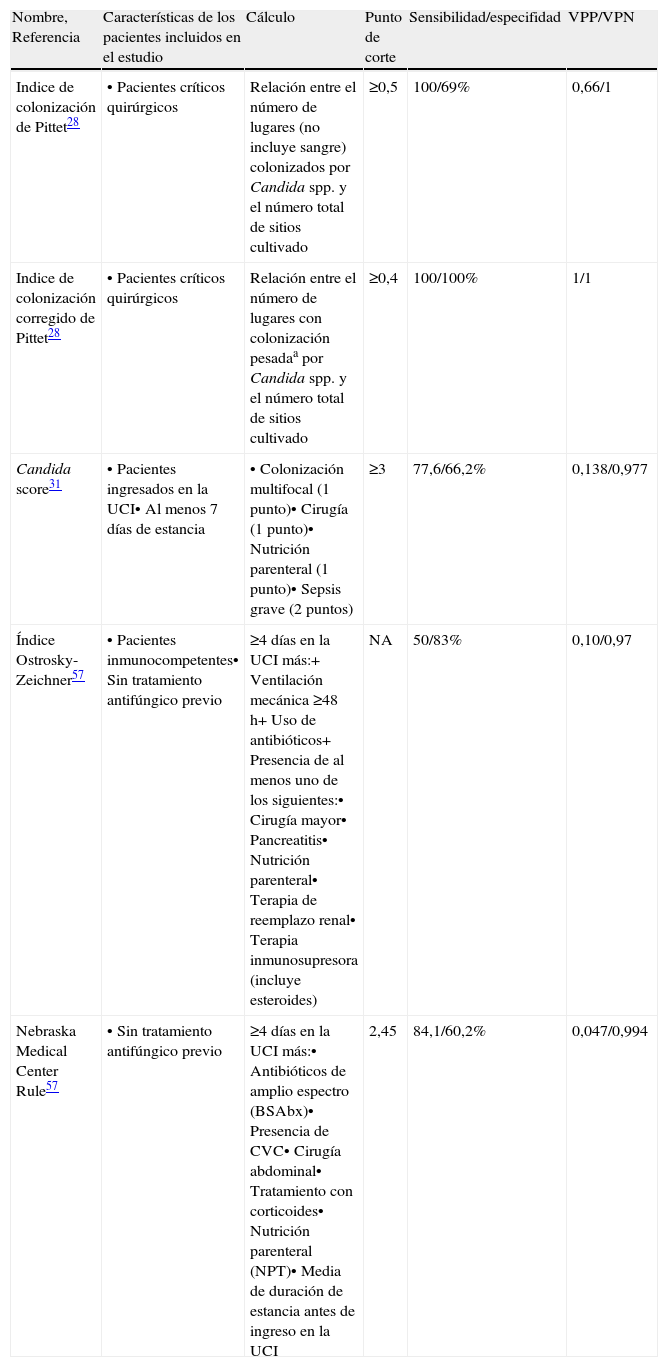
El diagnóstico de certeza de la candidiasis invasiva no candidémica es casi imposible en la práctica clínica diaria. Desde un punto de vista académico, requiere la identificación histológica de invasión tisular por Candida spp. Ello no es factible en la mayoría de pacientes ingresados y, si cabe, aún menos en el enfermo crítico. Por el contrario, un hecho muy frecuente es la aparición de colonización por Candida spp. en lugares no estériles. Ello no es suficiente para considerar un caso de infección y administrar tratamiento antifúngico, pero debe alertarnos de la posibilidad de estar ante una candidiasis diseminada, lo cual sí nos obliga a iniciar tratamiento. Debemos basarnos en algunas herramientas que nos ayuden a discernir qué paciente tienen una alta probabilidad de desarrollar una candidiasis invasiva y que, por tanto, se beneficiarán del tratamiento anticipado19,27. Para ello contamos especialmente con los índices clínicos predictores de candidiasis invasiva (tabla 1) y con la determinación de biomarcadores de Candida spp.
Diferentes índices clínicos descritos para determinar el riesgo de desarrollo de candidiasis invasiva
| Nombre, Referencia | Características de los pacientes incluidos en el estudio | Cálculo | Punto de corte | Sensibilidad/especifidad | VPP/VPN |
| Indice de colonización de Pittet28 | • Pacientes críticos quirúrgicos | Relación entre el número de lugares (no incluye sangre) colonizados por Candida spp. y el número total de sitios cultivado | ≥0,5 | 100/69% | 0,66/1 |
| Indice de colonización corregido de Pittet28 | • Pacientes críticos quirúrgicos | Relación entre el número de lugares con colonización pesadaa por Candida spp. y el número total de sitios cultivado | ≥0,4 | 100/100% | 1/1 |
| Candida score31 | • Pacientes ingresados en la UCI• Al menos 7 días de estancia | • Colonización multifocal (1 punto)• Cirugía (1 punto)• Nutrición parenteral (1 punto)• Sepsis grave (2 puntos) | ≥3 | 77,6/66,2% | 0,138/0,977 |
| Índice Ostrosky-Zeichner57 | • Pacientes inmunocompetentes• Sin tratamiento antifúngico previo | ≥4 días en la UCI más:+ Ventilación mecánica ≥48h+ Uso de antibióticos+ Presencia de al menos uno de los siguientes:• Cirugía mayor• Pancreatitis• Nutrición parenteral• Terapia de reemplazo renal• Terapia inmunosupresora (incluye esteroides) | NA | 50/83% | 0,10/0,97 |
| Nebraska Medical Center Rule57 | • Sin tratamiento antifúngico previo | ≥4 días en la UCI más:• Antibióticos de amplio espectro (BSAbx)• Presencia de CVC• Cirugía abdominal• Tratamiento con corticoides• Nutrición parenteral (NPT)• Media de duración de estancia antes de ingreso en la UCI | 2,45 | 84,1/60,2% | 0,047/0,994 |
VPP: valor predictivo positivo; VPN: valor predictivo negativo
a Colonización pesada: Crecimiento de Candida spp. ≥105 cfu/ml.
NMC Rule: (1.537 × BSAbxb)+(0,873 × CVCb)+(0,922 × TPNb)+(0,402 × esteroidesc)+(0,879 × cirugía abdominal)+(0,039 × Media de duración de estancia antes de ingreso en la UCI)
bDías 1 to 3 en UCI.
cDías -7 to 3 en UCI
Entre los primeros, el índice de Pittet fue descrito en pacientes quirúrgicos y puede ser de utilidad, pero requiere cultivos cuantitativos, lo que puede suponer una sobrecarga asistencial para un servicio de microbiología. Este estudio mostró que un índice de colonización corregido >0,4 tiene un valor predictivo positivo y un valor predictivo negativo del 100%28. Piarroux et al.29 publicaron los resultados de un estudio de intervención en pacientes con colonización candidiásica, con más de 5 días de estancia en la UCI, tratados con fluconazol, que presentaron un índice de colonización corregido >0,4 y compararon la incidencia de candidiasis invasiva en este grupo con otro grupo histórico no tratado. Demostraron que la tasa de candidiasis invasiva descendió del 7 al 3,8% (p=0,033) en el grupo tratado con azoles. El valor de estos índices para el diagnóstico y manejo clínico no ha sido establecido en pacientes médicos30.
En un estudio prospectivo llevado a cabo en 1.720 pacientes ingresados en la UCI durante más de 7 días se comparó a pacientes colonizados con aquellos con diagnóstico de certeza de infección fúngica invasiva por Candida y se construyó el denominado «Candida score». La puntuación >2,5 predice una infección por Candida con una sensibilidad del 81% y una especificidad del 74%31. Un estudio prospectivo posterior que incluyó a 1.107 pacientes críticos no neutropénicos confirmó la utilidad del Candida score ≥3 para discriminar la infección, y su sensibilidad, su especificidad y su valor predictivo positivo y negativo fueron superiores a los del índice de colonización de Pittet16. Dos estudios recientes ha corroborado la utilidad del Candida score para el diagnóstico de candidiasis invasiva en pacientes críticos de más de 5 días de estancia o en el momento de presentación de sepsis grave y shock séptico32,33. Por tanto, pensamos que los pacientes con un Candida score ≥3 (especialmente con 4 o 5 puntos) deben considerarse con alta sospecha de candidiasis invasiva (siempre y cuando esté presente la colonización multifocal) e iniciar tratamiento antifúngico anticipado. No obstante, no hay datos para afirmar que esta estrategia modifique el pronóstico.
En cuanto a los biomarcadores, el más analizado es el (1,3)-ß-D-glucano (BG), aunque con resultados no concluyentes. El BG es un componente de la pared celular del hongo que puede también detectarse en otras infecciones fúngicas (Aspergillus, Fusarium, Scedosporium, Pneumocystis jiroveci), y también se han descrito falsos positivos en caso de bacteriemia por grampositivos, hemodiálisis, uso de albúmina o inmunoglobulinas34. El uso de este biomarcador junto con el Candida score incrementa la rentabilidad diagnóstica al diferenciar la mera colonización de la candidiasis invasiva16. En 57 pacientes críticos quirúrgicos un test de BG positivo (punto de corte ≥80pg/ml) identificó la candidiasis invasiva con una especificidad del 73%, positivizándose 4 a 8 días antes del diagnóstico35.
Profilaxis en pacientes críticos de alto riesgoLas principales razones para el posible efecto beneficioso de la profilaxis con azoles de la infección fúngica en el paciente crítico de alto riesgo son la dificultad de establecer un diagnóstico de certeza, la nula especificidad de los signos de la infección fúngica invasora, el frecuente retraso del tratamiento antifúngico y la morbilidad y mortalidad asociadas a estas infecciones. Se han realizado diversos ensayos clínicos con fluconazol o ketaconazol que han sido analizados conjuntamente en 3 metaanálisis.
Shorr et al.36 y Vardakas et al.37 realizaron sendos metaanálisis de ensayos clínicos aleatorizados en los que se evaluaron la profilaxis con azoles en pacientes críticos quirúrgicos. Ambos concluyeron que existe una reducción de la incidencia de infecciones fúngicas, aunque sin impacto en la mortalidad. Por contra, un metaanálisis que incluyó 12 estudios que se llevaron a cabo en pacientes críticos no neutropénicos (8 con fluconazol y 4 con ketaconazol) concluyó que la profilaxis con azoles reducía la mortalidad (RR, 0,76; IC del 95%, 0,59-0,97) y la incidencia de infección fúngica invasiva (RR, 0,46; IC del 95%, 0,31-0,68)38. No obstante, hay que resaltar que con esta estrategia existe la posibilidad de un incremento de las resistencias a azoles o de desarrollo de infecciones por especies de no-albicans37.
Por tanto, la profilaxis antifúngica sistémica con fluconazol no está indicada en todo paciente que se encuentre en situación crítica por el impacto ecológico que puede ocasionar y porque su beneficio en términos de mortalidad es discutible. Por ello, quizá solo debe plantearse en pacientes de alto riesgo ingresados en unidades de críticos con elevada incidencia de infección fúngica39,40. Mención aparte requiere los trasplantes de órganos sólidos. En este caso no está indicada la profilaxis universal, pero sí se recomienda profilaxis con fluconazol en el caso de trasplante hepático de alto riesgo, definido con al menos 2 de los factores de riesgo que se muestran en la tabla 2. No obstante, un estudio multicéntrico español no comparativo ha demostrado la eficacia de la caspofungina en la profilaxis del trasplante hepático de alto riesgo41. Su empleo es razonable, dado que además de frente a Candida spp., es activa frente a Aspergillus spp., hongo que causa infecciones de muy elevada mortalidad en estos pacientes.
Factores de riesgo para desarrollo de candidiasis invasiva en trasplante hepático
| Retrasplante |
| Presencia de colédoco-yeyunostomía |
| Altos requerimientos de transfusión en quirófano (>40 U) |
| Disfunción renal (creatinina sérica >2mg/dl) |
| Colonización previa conocida por Candida spp. |
| Fallo hepático agudo como motivo del trasplante |
| Reintervención en los 5 primeros días |
Lo definimos como el inicio precoz de un tratamiento antifúngico en pacientes colonizados por Candida spp. junto con la presencia de factores de riesgo pero sin diagnóstico de candidemia u otra infección fúngica invasiva. El simple hecho de presentar colonización por Candida spp. no indica que debamos iniciar tratamiento, y ha de precisarse qué pacientes se beneficiarían de un tratamiento antifúngico anticipado.
Tratamiento de la candidemia/candidiasis invasivaEs cierto que algunos episodios de candidemia pueden ser transitorios y autolimitados, pero no existe posibilidad de discernir cuál de ellos se asociará con complicaciones tardías a distancia tales como endocarditis, osteomielitis o endoftalmitis. Por ello, debe tratarse por vía intravenosa a todos los pacientes críticos con candidemia, y su inicio debe ser precoz, dado que un retraso en el inicio del tratamiento se asocia con una mayor mortalidad42,43. Por otra parte, se sabe que la presencia de candidemia es un factor de riesgo para recibir un tratamiento empírico inadecuado en pacientes críticos con sepsis44, lo que pone de manifiesto que en la práctica diaria el inicio de tratamiento antifúngico en muchas ocasiones se retrasa hasta la confirmación de la candidemia, lo cual puede, al menos en parte, explicar la elevada mortalidad de este proceso. Aunque es un tema controvertido, en el paciente crítico se recomienda la retirada de los catéteres venosos en caso de candidemia.
Elección del antifúngicoExisten diversas opciones eficaces para el tratamiento de la candidemia. Estas pautas terapéuticas incluyen fluconazol, formulaciones lipídicas de anfotericina B, voriconazol o equinocandinas. En general, la elección de la terapia inicial cuando aún no se ha identificado la especie vendrá condicionada por la situación clínica y la exposición previa a fluconazol.
En la actualidad, las equinocandinas figuran como primera opción en el tratamiento de una candidemia o candidiasis invasiva de presentación grave, o si el enfermo ha recibido previamente fluconazol. Una vez que el paciente está estable y si se trata de Candida spp. sensible al fluconazol, pueden completarse los 14 días de tratamiento tras la negativización del hemocultivo con fluconazol39,40. El fluconazol es el fármaco de elección en cuadros no graves y siempre que el paciente no haya recibido recientemente este azol. La anfotericina B liposomal presenta la misma eficacia clínica que las equinocandinas, pero la tasa de efectos adversos (especialmente insuficiencia renal y reacciones relacionadas con la perfusión) es más elevada que con las candinas. En la actualidad no se recomienda el uso de asociaciones de antifúngicos para el tratamiento de la candidemia. El empleo de 2 antifúngicos podría considerarse en casos de mala evolución, con candidemia persistente después de la retirada del catéter venoso central, especialmente si el paciente está neutropénico.
Tres ensayos clínicos han evaluado las equinocandinas disponibles en la actualidad. El primero en publicarse comparó la caspofungina con la anfotericina B deoxicolato en 239 pacientes con candidiasis invasiva (81% de ellos con candidemia)45. En el análisis primario de eficacia (curación clínica y micológica al final del tratamiento intravenoso por intención de tratar modificado) la tasa de éxito fue similar en los dos brazos (73,4% versus 61,7%, respectivamente). Sin embargo, al evaluar los pacientes que habían recibido más de 5 días de tratamiento, la tasa de éxito fue significativamente superior con la caspofungina (80,7% versus 62,8%; p=0,03). Al analizar los resultados en los pacientes con candidemia se observó una tendencia a mayor curación con la caspofungina, que casi alcanza significancia estadística (71,7% versus 62,8%; p=0,06). Al analizar la seguridad, la tasa de complicaciones y el número de abandonos del tratamiento fue significativamente superior en el brazo de anfotericina B.
Posteriormente se publicó el ensayo clínico que comparó la micafungina con la anfotericina B liposomal (3mg/kg/día). Al igual que en el caso anterior, el análisis primario de eficacia (similar objetivo) demostró equivalencia de ambos tratamientos, tanto globalmente (71,6% versus 68,2%) como en los pacientes con candidemia (90,6% versus 90,8%). El deterioro de la función renal y el abandono del tratamiento por insuficiencia renal fue más frecuente en el grupo de anfotericina B liposomal, mientras que más pacientes con micafungina (7 frente a 3) tuvieron que abandonar el tratamiento por disfunción hepática46.
Por último vio la luz un ensayo clínico aleatorizado y doble ciego que comparó la anidulafungina frente al fluconazol en pacientes con candidiasis invasiva47. En él se incluyeron 245 pacientes, y la tasa de éxito en el análisis primario de eficacia (curación clínica y micológica al final del tratamiento intravenoso por intención de tratar modificado) fue significativamente superior en el grupo de la anidulafungina (75,6%) que con el fluconazol (60,2%) (IC del 95%, 3,9-27,0). Sin embargo, al retirar del análisis un centro que había incluido el 10% de los pacientes seleccionados, la eficacia continuaba siendo superior en el grupo de la anidulafungina, si bien no alcanzaba significación estadística (73,2% versus 61,1%).
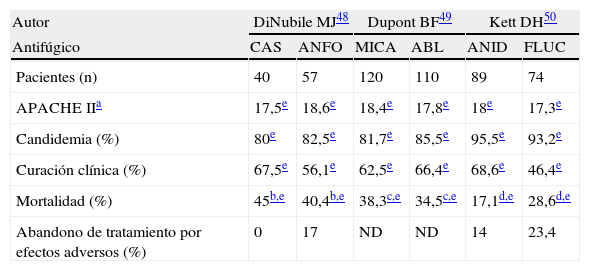
Posteriormente se han publicado análisis secundarios de estos 3 ensayos clínicos para evaluar los resultados en el subgrupo de pacientes ingresados en la UCI (tabla 3)48–50. En general se confirman los resultados obtenidos en la cohorte total, aunque con menor tasa de eficacia clínica en los enfermos críticos que en la población general.
Comparación de los subanálisis realizados en pacientes críticos de los ensayos clínicos que evaluaron la eficacia y la seguridad de las tres candinas en el tratamiento de la candidiasis invasiva
| Autor | DiNubile MJ48 | Dupont BF49 | Kett DH50 | |||
| Antifúgico | CAS | ANFO | MICA | ABL | ANID | FLUC |
| Pacientes (n) | 40 | 57 | 120 | 110 | 89 | 74 |
| APACHE IIa | 17,5e | 18,6e | 18,4e | 17,8e | 18e | 17,3e |
| Candidemia (%) | 80e | 82,5e | 81,7e | 85,5e | 95,5e | 93,2e |
| Curación clínica (%) | 67,5e | 56,1e | 62,5e | 66,4e | 68,6e | 46,4e |
| Mortalidad (%) | 45b,e | 40,4b,e | 38,3c,e | 34,5c,e | 17,1d,e | 28,6d,e |
| Abandono de tratamiento por efectos adversos (%) | 0 | 17 | ND | ND | 14 | 23,4 |
CAS: caspofungina: ANFO: anfotericina B deoxicolato; MICA: micafungina; ABL: anfotericina B liposomal; ANID: anidulafungina; FLUC: fluconazol; ND: no disponible.
Solo un ensayo clínico ha comparado 2 equinocandinas entre sí51. En este caso se evaluó la dosis estándar de caspofungina con 2 dosis de micafungina (100 o 150mg) en 595 pacientes con candidiasis invasiva. En este caso, la curación clínica y microbiológica fue similar en los 3 brazos del estudio, aunque con tendencia a peores resultados cuando se empleó 150mg de micafungina.
Situaciones especialesAislamiento de Candida spp. en orinaLa candiduria afecta hasta al 25% de los pacientes críticos con estancia superior a una semana en la UCI y se asocia con una mayor mortalidad. El riesgo de candiduria en pacientes críticos se relaciona con el sexo femenino, la edad superior a 65 años, el tiempo de estancia hospitalaria antes de ingreso en la UCI, la diabetes mellitus, la ventilación mecánica y el tratamiento antibiótico previo52. El 8% de los pacientes con candiduria desarrollan candidemia por la misma especie24. Hay que admitir que en la mayoría de los pacientes el aislamiento de Candida spp. en orina representa una mera colonización y solo de forma excepcional se trata de una verdadera infección ascendente o invasiva18.
La sola retirada del catéter urinario logra la erradicación de la candiduria en más del 40% de los pacientes. El fluconazol es el antifúngico que más altas concentraciones alcanza en orina. Tanto las formulaciones lipídicas de anfotericina B como las equinocandinas alanzan bajas concentraciones en orina39.
No se aconseja el tratamiento sistémico con antifúngicos de la candiduria asintomática en el paciente crítico no neutropénico, excepto en caso de manipulación de la vía urinaria y obstrucción urinaria. Tampoco está indicado el empleo de irrigaciones vesicales con anfotericina B. Si la candiduria es parte de una colonización multifocal y consideramos una alta probabilidad de candidiasis invasiva en base a las herramientas diagnósticas, utilizaremos tratamiento antifúngico sistémico según lo antes indicado39.
Aislamiento de Candida spp. en muestras respiratoriasUn hecho frecuente en el paciente crítico es el aislamiento de Candida spp. en muestras respiratorias, incluso las obtenidas por procedimientos invasivos. Una encuesta realizada entre intensivistas franceses puso de manifiesto la incertidumbre que crea entre los clínicos el aislamiento de Candida spp. en muestras respiratorias invasivas, y a menudo estos pacientes reciben tratamiento con azoles53. Sin embargo, diversos estudios han demostrado que en el paciente crítico no neutropénico dicho hallazgo no supone en absoluto el diagnóstico de neumonía54,55. Más recientemente, en un estudio prospectivo, ninguno de los 77 pacientes con aislamiento de Candida spp. en aspirado traqueal o lavado broncoalveolar presentaron datos histológicos de neumonía en la necropsia56. Por tanto, la positividad de los cultivos respiratorios para Candida spp. (incluso los obtenidos con técnicas invasivas y con elevado recuento de colonias) en pacientes no neutropénicos no debe hacernos establecer el diagnóstico de neumonía. No obstante, sí debe alertarnos de ser un marcador de candidiasis invasiva, especialmente si se demuestra este hongo en otras muestras no estériles, en cuyo caso debe actuarse como se discutió en el apartado correspondiente a la colonización multifocal.
Candida spp. en punta de catéterEs frecuente en pacientes críticos recibir un cultivo positivo para Candida spp. en punta de catéter sin candidemia concomitante. Este hecho genera siempre dudas sobre la actitud terapéutica a seguir, especialmente si el paciente está febril, no hay un foco definido y no responde a antibioterapia de amplio espectro.
Un estudio retrospectivo evaluó a 58 pacientes (91% en la UCI) con aislamiento de Candida spp. en punta de catéter, de los cuales 20 recibieron tratamiento antifúngico. No hubo diferencias en mortalidad entre los tratados y no tratados, y el análisis multivariante para ajustar por variables de confusión no demostró beneficio de la terapia antifúngica57. Por el contrario, en otro estudio retrospectivo el 11% de los pacientes con cultivo positivo de punta de catéter desarrollaron en el seguimiento una candidemia o posible candidiasis invasiva que se asoció a mayor mortalidad, por lo que los autores sugieren iniciar tratamiento antifúngico.
En la actualidad no podemos recomendar el inicio de tratamiento antifúngico en pacientes con positividad para Candida spp. en punta de catéter si no se demuestra candidemia. En el caso de coincidir con aislamiento de Candida spp. en fluidos no estériles, deberá manejarse como antes se indicó, empleando terapia antifúngica en caso de estar justificada por las puntuaciones clínicas o por los biomarcadores de Candida spp.
Conflicto de interesesEn los últimos cinco años, J.G.M. ha recibido fondos de investigación del Fondo de Investigación Sanitaria y ha participado en actividades promovidas por los laboratorios
Merck, Pfizer, Gilead Sciences y Astellas Pharma.
Sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion