La enfermedad de Chagas es causada por el parásito Trypanosoma cruzi. Esta enfermedad comprende una fase aguda y una crónica. El diagnóstico presenta limitaciones en las técnicas parasitológicas y en las inmunológicas. Las técnicas moleculares son una alternativa, pero estas deben ser evaluadas. El objetivo de este trabajo fue comparar la eficacia de las técnicas inmunológicas con la de las moleculares en el diagnóstico de la enfermedad de Chagas en las diferentes fases.
MétodosSe utilizaron las pruebas inmunológicas ELISA, HAI e IFI, y como ensayos moleculares las PCR para la amplificación de ADN de minicírculo de cinetoplasto y ADN satélite de T. cruzi. Se evaluaron 39 muestras de sangre de pacientes en fase aguda y 42 muestras de pacientes en fase crónica de la enfermedad. Además se analizaron 20 muestras de individuos sanos y 10 de pacientes con otras enfermedades.
ResultadosCon las técnicas inmunológicas resultaron positivas el 69,2% de las muestras de pacientes en fase aguda, mientras que en la fase crónica resultaron positivas el 95,2%. Con las pruebas moleculares resultaron positivas el 79,5% de las muestras de pacientes en fase aguda, mientras que con las muestras de pacientes en fase crónica resultaron positivas el 23,8%. Ninguna de las muestras de los individuos sanos resultó positiva por ninguna técnica, mientras que en las pruebas inmunológicas 2 muestras de pacientes con otras enfermedades resultaron positivas.
ConclusiónLa eficacia diagnóstica de las técnicas moleculares es elevada en la fase aguda, mientras que en la fase crónica son más eficaces los ensayos inmunológicos.
Chagas disease is caused by the parasite Trypanosoma cruzi. The disease involves an acute and chronic phases. The diagnosis has limitations, both in parasitological and immunological techniques. Molecular assays are an alternative, but these must be evaluated to determine its diagnostic usefulness. The aim of this study was to compare the effectiveness of immunological techniques with molecular assays in the diagnosis of Chagas disease in its different phases.
MethodsThe immunological techniques used were ELISA, HAI and IFI and the molecular techniques used were PCR for amplification of kinetoplast minicircles, and satellite DNA of T. cruzi. Thirty-nine blood samples from patients in the acute phase of Chagas disease, and 42 samples from patients in the chronic phase were evaluated. In addition, 20 samples from healthy individuals and 10 patients with other diseases were also studied.
ResultsWith immunological techniques were positive, 69.2% of samples from patients in the acute phase, while in the chronic phase were positive 95.2%. Using molecular techniques 79.5% of samples from patients in the acute phase were positive, while 23.8% of the samples from patients in the chronic phase were positive. None of the samples from healthy individuals was positive for any technique, while two samples from patients with other diseases were positive by the immunological assays.
ConclusionsThe diagnostic efficacy of molecular techniques is high in the acute phase of Chagas disease, while in the chronic phase the immunological techniques are more effective.
La enfermedad de Chagas es causada por el parásito Trypanosoma cruzi. Se estima que en el continente americano existen 10 millones de personas infectadas, y que 25 millones están en situación de riesgo de contraer la enfermedad1,2. Esta enfermedad comprende una fase aguda corta, caracterizada por una abundante parasitemia seguida de una recuperación completa o de la instauración de la fase crónica de la enfermedad, con una parasitemia escasa y un curso clínico impredecible, que va desde la ausencia de síntomas hasta una enfermedad grave con compromiso cardiovascular y/o gastrointestinal que puede ocasionar la muerte3.
En Venezuela, actualmente existe un repunte de la enfermedad de Chagas. Los recientes focos y brotes agudos por transmisión oral en la región capital4 y en el estado Vargas5, así como el reporte de casos agudos en los diferentes estados del país6-10 y el aumento de seropositivos en bancos de sangre11, indican el resurgimiento de la enfermedad en el país. La migración humana de otras áreas endémicas llevando reservorios domésticos y vectores infectados con T. cruzi, la urbanización desorganizada, la deforestación y la irrupción en ciclos silvestres son elementos de riesgo que explicarían la emergencia y re-emergencia de la enfermedad de Chagas en Venezuela6,7,9,12.
En general, el diagnóstico de la enfermedad se basa en los signos y síntomas clínicos, los datos epidemiológicos y los resultados de laboratorio, incluyendo pruebas parasitológicas, inmunológicas y moleculares. En relación con el diagnóstico inmunológico existe consenso en recomendar al menos 2 técnicas con la finalidad de tener un alto grado de confiabilidad, sugiriéndose una tercera prueba en caso de discrepancia entre ellas13. Las técnicas más comúnmente utilizadas incluyen hemaglutinación indirecta (HAI), inmunofluorescencia indirecta (IFI) y ensayos inmunoenzimáticos (ELISA). Aunado a estas técnicas, se han desarrollado herramientas moleculares como la reacción en cadena de la polimerasa (PCR), la cual ha contribuido a la obtención de un cribado más certero de la enfermedad14,15. En Venezuela el inmunodiagnóstico de la enfermedad de Chagas se realiza comúnmente en centros públicos y privados y principalmente se utilizan pruebas comerciales de varios laboratorios nacionales y extranjeros. En este aspecto, algunos investigadores han informado sobre resultados inconsistentes registrados en pacientes diagnosticados en estos centros cuando se comparan con los obtenidos en laboratorios especializados en el estudio de la enfermedad de Chagas11.
Entre los protocolos más utilizados para el diagnóstico molecular de la enfermedad de Chagas se encuentran la PCR para la detección de ADN satélite de T. cruzi16,17 y la PCR para la detección de ADN de las regiones variables de los minicírculos del cinetoplasto de T. cruzi18,19. Ambas técnicas se han aplicado en muestras de pacientes, reservorios y vectores y han sido estandarizadas y validadas en nuestro laboratorio20,21. Sin embargo, muchas veces no ha sido posible la confirmación por PCR de casos clínicos de Chagas y se han reportado valores de sensibilidad y especificidad muy diferentes en los distintos países17-19.
En Venezuela, las técnicas moleculares para el diagnóstico de la enfermedad de Chagas solo se utilizan en laboratorios de investigación, y en líneas generales no se conoce su eficacia diagnóstica, ya que no se ha realizado una valoración con respecto a las pruebas inmunológicas convencionalmente utilizadas. El propósito del siguiente trabajo fue comparar la eficacia diagnóstica de las técnicas inmunológicas con la de las moleculares en las diferentes fases de la enfermedad de Chagas.
MétodosMuestra biológicaSe evaluaron 39 muestras de sangre y suero de pacientes con enfermedad de Chagas en fase aguda, y 42 muestras de pacientes en fase crónica de la enfermedad, provenientes de diferentes zonas de Venezuela, confirmados previamente mediante diagnóstico clínico (realizado por cardiólogos especializados con experiencia en enfermedad de Chagas), inmunodiagnóstico (ELISA, HAI, IFI) y/o métodos parasitológicos (extendido de sangre coloreado, xenodiagnóstico y hemocultivo) (controles positivos). Además de 20 muestras de individuos sanos, las cuales fueron negativas a las técnicas inmunológicas convencionales y pertenecientes a donantes sin síntomas ni historia de contacto con la parasitosis en estudio (controles negativos) y 10 de pacientes con otras enfermedades relacionadas (leishmaniasis visceral y cutánea, toxoplasmosis, malaria). El protocolo de trabajo fue aprobado por el Comité de Bioética del BIOMED-UC.
Cultivo de parásitosLos parásitos T. cruzi TcDm28c22 se cultivaron in vitro en medio LIT (liver-infusion-tryptose) con suero fetal bovino (Internegocios S.A., Buenos Aires, Argentina) al 10%.
Preparación del antígeno de MaeckeltPreviamente se preparó el antígeno de Maeckelt de T. cruzi, a partir de los cultivos del parásito, los cuales se centrifugaron y se sometieron a 3 procesos de congelación-descongelación. Se hizo la deslipidación con benceno y se almacenó hasta su uso23.
Hemaglutinación indirectaSe trataron glóbulos rojos de carnero con ácido tánico y se sensibilizaron con el antígeno de Maeckelt de T. cruzi. La prueba se hizo en placa haciendo diluciones del suero del paciente con tampón fosfato salino (PBS, por sus siglas en inglés phosphate buffered saline) (1/25, 1/50 y 1/100). Se incubó a temperatura ambiente de 2-3h y se observó la formación de hemaglutinación24.
Inmunofluorescencia indirectaEn láminas para inmunofluorescencia se fijaron epimastigotas de T. cruzi y se dejaron secar. Posteriormente se colocaron los sueros (diluidos 1/50), se incubó a 37°C durante una hora, se lavó con PBS-Tween 20 y se le agregó anti-IgG humana marcada con fluoresceína (Sigma, St. Louis, MO, EE.UU.), se incubó durante 1h a 37°C en cámara húmeda y se observó al microscopio de fluorescencia25.
Inmunoensayo enzimáticoSe sensibilizaron placas con el antígeno de Maeckelt de T. cruzi y se bloquearon con BSA (Sigma, St. Louis, MO, EE.UU.) al 1% en PBS. Posteriormente se colocaron 100μl de cada suero (diluido 1/50) y se mantuvo 1h a 37°C. Luego se añadieron 100μl de conjugado anti-IgG humana acoplado a peroxidasa (Pierce, Thermo Fisher Scientific, Rockford IL, EE.UU.) y se incubó a 37°C durante 1h. Después se lavaron las placas. Se añadieron 100μl de sustrato ácido 2,2’ azo bis 3-etil-benzotioasoico (ABTS) (Sigma, St. Louis, MO, EE.UU.). Se incubó a 37°C durante 20min y se midió la densidad óptica a 405nm en un lector de ELISA (Dynatech MR5000, HiTech Trader, Mount Holly, NJ, EE.UU.)26.
Puntos de corteSe tomaron como puntos de corte los ya establecidos previamente en el laboratorio27: en el caso de HAI e IFI, la presencia de hemaglutinación y fluorescencia, respectivamente, a la dilución 1/50, y para ELISA lecturas superiores a 0,320 de densidad óptica (DO405nm) a la dilución 1/50.
Extracción de ADNSe realizó la extracción de ADN a partir de las muestras de sangre descritas anteriormente, utilizando la resina Chelex® 100 (BioRad, Hercules CA, EE.UU.). Se colocaron en un microtubo 200μl de sangre, se añadió agua destilada y se incubó durante 30min a temperatura ambiente, luego se centrifugó y se retiró el sobrenadante dejando 50μl, al cual se le añadieron 200μl de Chelex®100 (BioRad, Hercules, CA, EE.UU.) al 5% y se incubó a 56°C durante 30min. Posteriormente se agitó durante 10s, se incubó a 100°C durante 10min, se centrifugó durante 3min y se recogió el sobrenadante que contenía el ADN20.
Técnica de reacción en cadena de la polimerasa para la detección de ADN de minicírculo de kinetoplasto de T. cruziPara la detección de ADN de minicírculo de cinetoplasto de T. cruzi se utilizó el protocolo de Wincker et al.19, que amplifica una banda de 330 pares de bases (pb) empleando los cebadores 121 5′-AAATAATGTACGGGTGAGATGCATGA-3′ y 122 5′GGGTTCGATTGGGGTTGGTGT-3′. Dicho protocolo fue modificado para adaptarlo a las condiciones del laboratorio20. Las condiciones de reacción fueron: desoxinucleótidos tri-fosfato (dNTP) (Promega, Madison, EE.UU.) 200μM, cebadores 0,5μM, cloruro de magnesio 2mM y Taq polimerasa (Promega, Madison, EE.UU) 1U. La PCR se llevó a cabo mediante el siguiente programa: desnaturalización inicial a 94°C durante 10min, seguido de 30 ciclos de desnaturalización a 94°C durante 30s, hibridación a 63°C por 30s y extensión a 72°C durante 30s, terminando con una extensión final a 72°C durante 10min.
Técnica de reacción en cadena de la polimerasa para la detección de ADN satélite de T. cruziSe realizó la prueba de PCR para la detección de ADN satélite de T. cruzi según el protocolo descrito por Moser et al.16, empleando los cebadores específicos: TcZ1 (cebador directo) 5′-CGAGCTCTTGCCCACACGGGTGCT-3′ y TcZ2 (cebador reverso) 5′CCTCCAAGCAGCGGATAGTTCAGG-3′. Estos cebadores permiten la amplificación de una región repetida de 188pb del ADN satélite de T. cruzi. Las reacciones de amplificación se realizaron según el protocolo descrito, con modificaciones para adaptarlo a las condiciones del laboratorio20. Las condiciones de reacción fueron: desoxinucleótidos tri-fosfato (dNTP) (Promega, Madison, EE.UU.) 200μM, cebadores 0,5μM, cloruro de magnesio 2mM y Taq polimerasa (Promega, Madison, EE.UU.) 1U. La PCR se llevó a cabo mediante el siguiente programa: desnaturalización inicial a 94°C durante 10min, seguido de 30 ciclos de desnaturalización a 94°C durante 30s, hibridación a 55°C durante 30s y extensión a 72°C durante 30s, terminando con una extensión final a 72°C durante 10min.
Electroforesis de ADN en geles de agarosaLa electroforesis se realizó en geles de agarosa al 1%, utilizando como tampón TAE (Tris-Acetato 40mM, EDTA 1mM pH 8) y un sistema de electroforesis horizontal Minicell® (Thermo Scientific, Asheville, NC, EE.UU.). Los geles se tiñeron con bromuro de etidio (0,5g/ml). Las bandas de ADN se visualizaron con luz ultravioleta mediante el sistema Gel Doc 1000® de BioRad (Hercules, CA, EE.UU.).
Análisis de resultadosSe compararon los resultados obtenidos con las pruebas inmunológicas y los obtenidos con las técnicas moleculares, en las diferentes muestras de los grupos de individuos y en las diferentes fases de la enfermedad. Los resultados se ordenaron en una tabla de contingencia 2×2 y se calcularon los índices diagnósticos: sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN). Se determinó el índice de kappa de Cohen's calculado mediante el programa Stat Xact 8.0 para Windows, para evaluar la concordancia entre los resultados.
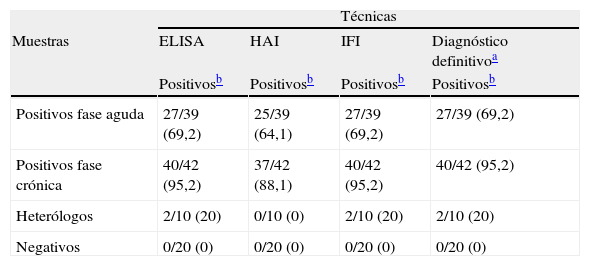
ResultadosLas técnicas de ELISA e IFI fueron las que mostraron mayor cantidad de positivos, tanto en la fase aguda como en la crónica (tabla 1). Por otro lado, estas 2 pruebas fueron las que presentaron 2 falsos positivos, que correspondieron a individuos con leishmaniasis visceral. La sensibilidad de las pruebas inmunológicas en fase aguda fue menor que en la fase crónica.
Detección de anticuerpos anti-Trypanosoma cruzi mediante ELISA, HAI e IFI en muestras de pacientes con enfermedad de Chagas en fase aguda y crónica, pacientes con otras enfermedades relacionadas (heterólogos) e individuos sanos
| Técnicas | ||||
| Muestras | ELISA | HAI | IFI | Diagnóstico definitivoa |
| Positivosb | Positivosb | Positivosb | Positivosb | |
| Positivos fase aguda | 27/39 (69,2) | 25/39 (64,1) | 27/39 (69,2) | 27/39 (69,2) |
| Positivos fase crónica | 40/42 (95,2) | 37/42 (88,1) | 40/42 (95,2) | 40/42 (95,2) |
| Heterólogos | 2/10 (20) | 0/10 (0) | 2/10 (20) | 2/10 (20) |
| Negativos | 0/20 (0) | 0/20 (0) | 0/20 (0) | 0/20 (0) |
a Según criterios de la OMS (2 positivas de las 3 realizadas).
b Muestras positivas/muestras analizadas (%).
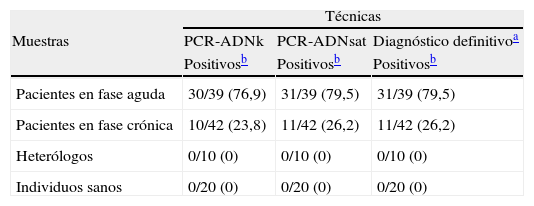
La mayoría de las muestras de pacientes en fase aguda de la enfermedad dieron positivo por PCR-ADN kinetoplasto y PCR-ADN satélite, mientras que en la fase crónica muy pocas muestras dieron resultados positivos (tabla 2). Aunque se observa una pequeña diferencia en los resultados de estas PCR, de hecho esta no fue estadísticamente significativa (p<0,05). Todos los individuos diagnosticados previamente como de otras enfermedades relacionadas, así como los individuos sanos, resultaron negativos en las 2 PCR (tabla 2). Por otro lado, se observó muy buena concordancia entre las 2 PCR evaluadas tanto con las muestras de la fase aguda como con las muestras de fase crónica, al obtenerse índices kappa de 0,94 y 0,89, respectivamente (IC95%).
Detección de ADN de Trypanosoma cruzi mediante PCR-ADNk y PCR-ADNsat en muestras de pacientes con enfermedad de Chagas en fase aguda y crónica, pacientes con otras enfermedades relacionadas (heterólogos) e individuos sanos
| Técnicas | |||
| Muestras | PCR-ADNk | PCR-ADNsat | Diagnóstico definitivoa |
| Positivosb | Positivosb | Positivosb | |
| Pacientes en fase aguda | 30/39 (76,9) | 31/39 (79,5) | 31/39 (79,5) |
| Pacientes en fase crónica | 10/42 (23,8) | 11/42 (26,2) | 11/42 (26,2) |
| Heterólogos | 0/10 (0) | 0/10 (0) | 0/10 (0) |
| Individuos sanos | 0/20 (0) | 0/20 (0) | 0/20 (0) |
ADNk: ADN de minicírculo de kinetoplasto; ADNsat: ADN satélite.
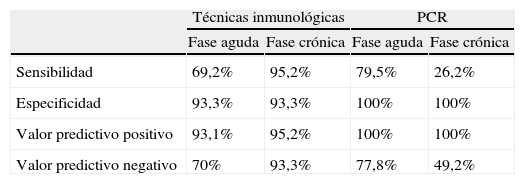
Al comparar los índices diagnósticos de las pruebas inmunológicas con los obtenidos con las técnicas moleculares se observa una mayor sensibilidad con las PCR en las muestras de pacientes en la fase aguda de la enfermedad. En cuanto a las técnicas inmunológicas, en la fase crónica se observó la mayor sensibilidad. Las especificidad de las técnicas moleculares fue del 100%, mientras que en las técnicas inmunológicas 2 de los individuos con otras enfermedades resultaron positivos, por lo que la especificidad fue del 93,3% (tabla 3). En cuanto a los VPP y VPN, en la fase aguda de la enfermedad fueron mayores para las técnicas moleculares, mientras que en la fase crónica fueron mayores en las técnicas inmunológicas (tabla 3). El índice kappa de 0,66 (IC95%) señala una buena concordancia entre los resultados de las técnicas inmunológicas y moleculares en la fase aguda de la enfermedad. En la fase crónica se obtuvo un índice kappa de 0,40 (IC95%), indicando que no hubo concordancia.
Comparación de los índices diagnósticos de las pruebas inmunológicas con los de las técnicas moleculares en las 2 fases de la enfermedad
| Técnicas inmunológicas | PCR | |||
| Fase aguda | Fase crónica | Fase aguda | Fase crónica | |
| Sensibilidad | 69,2% | 95,2% | 79,5% | 26,2% |
| Especificidad | 93,3% | 93,3% | 100% | 100% |
| Valor predictivo positivo | 93,1% | 95,2% | 100% | 100% |
| Valor predictivo negativo | 70% | 93,3% | 77,8% | 49,2% |
IC 95%.
En Venezuela, actualmente existe un repunte de la enfermedad de Chagas, evidenciado por los recientes focos y brotes agudos por transmisión oral4,5, el reporte de casos agudos en los diferentes estados del país6-10,12 y el aumento de seropositivos en bancos de sangre11. La discrepancia entre los resultados obtenidos en los diferentes centros de diagnóstico y los de los laboratorios especializados en el estudio de la enfermedad de Chagas en Venezuela11 señala la necesidad del análisis y de la comparación de la eficacia de las diferentes técnicas empleadas en diagnóstico.
Debido a los problemas comunes de sensibilidad y especificidad de los ensayos inmunológicos, para la confirmación de un caso agudo la OMS recomienda el uso de pruebas parasitológicas; para el cribado serológico se recomienda una prueba de sensibilidad elevada, y para el diagnóstico, el uso de al menos 2 pruebas de antígenos y principios distintos. Se recomienda el uso de una tercera técnica ante casos de discrepancia1,2,13.
En el presente trabajo, las técnicas inmunológicas que mostraron mayor cantidad de positivos, tanto en la fase aguda como en la crónica, fueron ELISA e IFI. Por otro lado, estas 2 pruebas fueron las que presentaron 2 falsos positivos, que correspondieron a individuos con leishmaniasis visceral. La técnica de HAI suele presentar menor sensibilidad que ELISA e IFI, como ha sido reportado por otros autores28,29; sin embargo, es una técnica económica y sencilla, ampliamente utilizada en Venezuela y que, junto con otras pruebas, es útil para la obtención de 2 pruebas coincidentes, como en este caso.
La sensibilidad de las pruebas inmunológicas en la fase aguda fue menor que en la fase crónica; esto puede deberse a que en la fase aguda temprana todavía no haya suficiente cantidad de anticuerpos para ser detectados por estas técnicas. Por otro lado, se ha reportado en la enfermedad de Chagas un porcentaje pequeño de individuos llamados «no respondedores», los cuales, a pesar de estar infectados, nunca desarrollan una respuesta de anticuerpos detectable30. En cuanto a la fase crónica, la sensibilidad de las pruebas inmunológicas fue elevada, como se ha descrito en varios estudios28,31; solo 2 pacientes dieron negativo, lo cual puede deberse a que eran pacientes crónicos de larga duración, en los cuales el título de anticuerpos podría haber disminuido con el tiempo.
La mayoría de las muestras de pacientes en fase aguda de la enfermedad dieron positivo por PCR-ADN de kinetoplasto y PCR-ADN satélite, observándose pequeñas diferencias en los resultados de estas técnicas, que no fueron estadísticamente significativas (p<0,05). Por otro lado, estas 2 PCR mostraron buena concordancia. Sin embargo, en otro trabajo se han reportado diferencias significativas con el uso de las PCR evaluadas21. Estas diferencias en sensibilidad podrían deberse a la variabilidad genética de los diferentes aislados parasitarios, ya que el número de copias de las repeticiones de las secuencias que se amplifican en las PCR varía dependiendo del aislado parasitario32,33, lo que genera variaciones en la sensibilidad del ensayo.
La mayor sensibilidad de las técnicas de PCR observada en muestras de pacientes de fase aguda era de esperar, ya que es la fase donde existe mayor parasitemia y, por lo tanto, se puede detectar el ADN parasitario. En la fase crónica, debido a la escasez de parásitos circulantes —ya que estos están confinados a tejidos—, las pruebas de PCR presentan menor sensibilidad18. Sin embargo, es importante resaltar que en la sensibilidad de la PCR influyen también el método de extracción de ADN y el volumen de sangre que se emplea para la extracción de ADN34. En el presente trabajo, el uso de una técnica de extracción de ADN rápida y que utiliza poco volumen de muestra pudo haber influido en la obtención de una sensibilidad muy baja (especialmente en la fase crónica) con respecto a la reportada por otros autores34-38. Así, se recomienda el uso de otras técnicas de extracción de ADN, principalmente para el diagnóstico en la fase crónica, donde estas técnicas de PCR han demostrado la presencia de ADN del parásito en muestras en las cuales no hay una parasitemia detectable, por lo que se han recomendado como ensayos complementarios para utilizar en conjunto con las técnicas inmunológicas17,18,31.
Todos los índices diagnósticos obtenidos con las técnicas moleculares fueron mayores que los de las pruebas inmunológicas en las muestras de pacientes en la fase aguda de la enfermedad. Resultados similares han sido reportados por otros investigadores y se corresponden con la dinámica de la enfermedad en sus diferentes fases, donde al principio existen parásitos circulantes en sangre, por lo que se puede detectar su ADN debido a la elevada sensibilidad de la PCR, aun cuando la parasitemia sea muy baja y las técnicas parasitológicas no la detecten14-19,21,31. En la fase crónica la mayoría de los parásitos se encuentran confinados en tejidos por lo que habrá poco ADN circulante, mientras que la respuesta de anticuerpos será mayoritaria31,39.
Existen varios trabajos que tratan de comparar técnicas inmunológicas con ensayos moleculares y que encuentran variabilidad al hacer pruebas de concordancia entre estas técnicas. Esta variabilidad se debe a que son pruebas de distinta naturaleza y detectan cosas diferentes, donde no necesariamente se encuentra concordancia19,31,40. La presencia de ADN parasitario en la muestra no siempre va acompañada de anticuerpos detectables, sino que existe una dinámica entre estos elementos que tiene que ver con las fases de la enfermedad y el tiempo de infección. Así, para hacer comparaciones sería aconsejable determinar los índices diagnósticos para cada fase de la enfermedad y, basándose en ellos, comparar la eficacia diagnóstica de cada prueba para cada fase, como ha sido realizado en algunos trabajos18,39.
La especificidad de las técnicas moleculares fue del 100%, mientras que por las técnicas inmunológicas la especificidad fue menor, como se ha descrito en numerosos trabajos16-19,21,31,36,39.
Las técnicas de PCR, como toda técnica, tienen sus limitaciones, y son menos sensibles en la fase crónica de la enfermedad. Por otra parte, su coste y su poca disponibilidad en los diferentes centros de diagnóstico de Venezuela hacen que actualmente no puedan usarse en todos los casos. Sin embargo, es una prueba que ofrece muchas ventajas en los casos en los que la parasitemia es baja, bien sea por estar en fase crónica o por infecciones que cursan con bajas parasitemias. Además, ayuda al diagnóstico de la enfermedad en pacientes inmunocomprometidos, en los cuales la producción de anticuerpos es deficiente y permite el seguimiento a los pacientes en tratamiento, donde los métodos inmunológicos no son adecuados17,40. Otra ventaja es el diagnóstico de Chagas congénito en recién nacidos, para el que las pruebas de PCR han demostrado alta sensibilidad14,34,41.
Todos los trabajos mencionados y el presente señalan la utilidad de los métodos moleculares en la fase aguda de la enfermedad y los métodos inmunológicos en la fase crónica de la enfermedad, aunque lo más recomendable, para garantizar un diagnóstico certero, es combinar el uso de las técnicas parasitológicas, inmunológicas y moleculares de acuerdo con la fase de la enfermedad que se sospecha.
FinanciaciónAyuda Menor CDCH-UC 0440-10, Universidad de Carabobo, y Ayuda Menor CDCH-UC-0450-10, Universidad de Carabobo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.