Existen pocos estudios epidemiológicos sobre candidemia en población pediátrica en España. Nuestro objetivo es conocer la epidemiología de candidemia en estos pacientes.
MétodosEstudio prospectivo, observacional, multicéntrico en 44 hospitales españoles sobre episodios de candidemia en población pediátrica desde 0 a 15 años de edad ocurridos entre enero de 2009 y febrero de 2010.
ResultadosSe estudiaron 197 episodios con 200 aislamientos de levaduras. La especie más frecuentemente aislada fue Candida parapsilosis sensu stricto (43%) seguida de C. albicans (36%), C. tropicalis (6%), C. orthopsilosis y C. glabrata (4% cada una). C. albicans predominó en neonatos, mientras que C. parapsilosis predominó en el resto de las edades. Por comunidades autónomas, en Baleares, Cataluña y Canarias se aisló más frecuentemente C. albicans, y en Andalucía, Castilla y León, Galicia, Madrid y Valencia fue más prevalente C. parapsilosis. El porcentaje de cepas resistentes al fluconazol fue del 1,5% (4,1% con los nuevos criterios especie específicos del CLSI). La resistencia al fluconazol fue menor en neonatos que en el resto de los grupos. Neonatología fue el área donde más frecuentemente se detectaron estos episodios (31,5%). La presencia de catéter y la prematuridad se asociaron, de manera independiente, con candidemia por C. albicans con un riesgo casi 6 y 2 veces mayor, respectivamente, en el análisis multivariante.
ConclusionesLa epidemiología de candidemia pediátrica varía entre las comunidades autónomas, pero globalmente C. parapsilosis y C. albicans son por este orden las especies más frecuentes y muestran unas tasas de resistencia al fluconazol inferiores al 5%.
There are few epidemiological studies on candidaemia in the paediatric population in Spain. We sought to determine the epidemiology of candidaemia in these patients.
MethodsProspective, observational and multicentre study in 44 Spanish hospitals. All candidaemia episodes in paediatric patients from 0 to 15 years old between January 2009 and February 2010 were studied.
ResultsThere were 197 episodes and 200 species were isolated. The most frequent species was Candida parapsilosis sensu stricto (43%), followed by C. albicans (36%), C. tropicalis (6%), C. orthopsilosis, and C. glabrata (4%) respectively. C. albicans was the most prevalent in newborns, and C. parapsilosis was most frequent in the other age groups. As regards the regions of Spain, C. albicans was most prevalent in patients from Catalonia, the Balearic Islands and Canary Islands, and C. parapsilosis in patients from Andalusia, Castilla-León, Galicia, Valencia, and Madrid. The rate of resistance to fluconazole was 1.5% (4.1% with the new species-specific Clinical and Laboratory Standards Institute [CLSI] criteria). Fluconazole resistance was lower in neonates than the other age groups. The Neonatal Wards were the areas with most episodes (31.5%). In the multivariate analysis, the variables associated independently with candidaemia due to C. albicans were: catheter (OR: 5.967; 95% CI: 1.614-22.057; P=.007) and prematurity (OR: 2.229; 95% CI: 1.141- 4.631; P=.020).
ConclusionsThe epidemiology of paediatric candidaemia varies between Spanish regions, but, globally, C. parapsilosis and C. albicans, are respectively, the first and second most frequently isolated species, and they show resistance rates to fluconazole of less than 5%.
La incidencia de candidemia ha aumentado durante los últimos años1, y los diferentes estudios poblacionales señalan una progresiva modificación en el patrón de especies aisladas, con un incremento gradual de especies distintas de Candida albicans2. Diversos estudios epidemiológicos han descrito el perfil de especie, sensibilidad y factores de riesgo en población adulta3-5; sin embargo, son escasos los datos referidos a población infantil6, especialmente en nuestro país, donde las revisiones epidemiológicas se centran fundamentalmente en neonatos7.
El objetivo del presente estudio fue determinar las características epidemiológicas y microbiológicas y la sensibilidad antifúngica de los 197 episodios de candidemias registrados en la población pediátrica del estudio epidemiológico FUNGEMYCA realizado en el año 2010, en el que tomaron parte 44 hospitales distribuidos por toda la geografía española.
Material y métodosTodos los episodios de candidemia ocurridos en los hospitales participantes se recogieron de forma prospectiva desde enero de 2009 a febrero de 2010. Cada episodio, pasados 30 días después del aislamiento inicial de Candida spp. en un mismo paciente, fue considerado como nuevo.
Datos microbiológicosSe recopilaron los datos microbiológicos del primer aislamiento de cada episodio que incluyeron identificación de la levadura aislada por los métodos habituales utilizados en cada centro y el estudio de sensibilidad a los antifúngicos utilizados habitualmente en la práctica pediátrica (fluconazol, voriconazol, micafungina, caspofungina y anfotericina B). La identificación de los aislamientos se realizó con métodos comerciales habituales: VITEK 1 o VITEK 2 (BioMerieux); Auxacolor System (Bio-RAD); API 20C AUX y API 32C (BioMerieux). La concentración mínima inhibitoria (CMI) de estos antifúngicos se determinó, en cada centro participante, mediante la técnica de microdilución colorimétrica SensititreYeastOne (SY-O9, TREK DiagnosticSystems, Reino Unido) siguiendo las instrucciones del fabricante. La sensibilidad de los aislamientos se interpretó según los criterios del Clinical and Laboratory Standards Institute (CLSI)8,9 y los específicos para cada especie recientemente publicados10,11. Según la CMI observada, se consideraron los siguientes puntos de corte para fluconazol: sensible (S)≤8mg/l; dosis dependiente (DDS) 16-32mg/l y resistente (R)>32mg/l; para voriconazol: S<2mg/l, DDS 2mg/l y R>2mg/l y para equinocandinas: S≤2mg/l y no sensible (NS)>2mg/l. Para anfotericina B se consideraron sensibles los aislados inhibidos con <2mg/l y resistentes los aislados inhibidos con ≥2mg/l. Los puntos de corte específicos aplicados para cada especie se detallan en la tabla 1.
Nuevos puntos de corte especie-específicos propuestos para cada especie (en μg/ml)
| CAS | MICA | FLU | VOR | |||||||||||||
| S | SDD | I | R | S | SDD | I | R | S | SDD | I | R | S | SDD | I | R | |
| C. albicans | ≤ 0,25 | – | 0,5 | ≥ 1 | ≤ 0,25 | – | 0,5 | ≥ 1 | ≤ 2 | 4 | – | ≥ 8 | ≤ 0,12 | – | 0,25-0,5 | ≥ 1 |
| C. parapsilosis | ≤ 2 | – | 4 | ≥ 8 | ≤ 2 | – | 4 | ≥ 8 | ≤ 2 | 4 | – | ≥ 8 | ≤ 0,12 | – | 0,25-0,5 | ≥ 1 |
| C. tropicalis | ≤ 0,25 | – | 0,5 | ≥ 1 | ≤ 0,25 | – | 0,5 | ≥ 1 | ≤ 2 | 4 | – | ≥ 8 | ≤ 0,12 | – | 0,25-0,5 | ≥ 1 |
| C. guilliermondii | ≤ 2 | – | 4 | ≥ 8 | ≤ 2 | – | 4 | ≥ 8 | – | – | – | – | – | – | – | – |
| C. glabrata | ≤ 0,12 | – | 0,25 | ≥ 0,5 | ≤ 0,06 | – | 0,12 | ≥ 0,25 | – | ≤ 32 | – | ≥ 64 | – | – | – | – |
| C. krusei | ≤ 0,25 | – | 0,5 | ≥ 1 | ≤ 0,25 | – | 0,5 | ≥ 1 | – | – | – | – | ≤ 0,5 | – | 1 | ≥ 2 |
CAS: caspofungina; FLU: fluconazol; I: intermedio; MICA: micafungina; R: resistente; S: sensible; SDD: densible dosis dependiente; VOR: voriconazol.
En total se recogieron 25 variables demográficas y clínicas mediante un cuestionario diseñado al efecto. Los pacientes se agruparon en 4 grupos de edad: neonatos, menos de un mes; lactantes, 1-24 meses; preescolares, 2-4años, y escolares, 5-15años.
Análisis estadísticoSe realizó mediante el paquete estadístico SPSS 17.0 (SPSS Inc., EE.UU.). En el análisis estadístico univariado se utilizó el test χ2 para las variables cualitativas y el multivariable se ajustó a un modelo de regresión logística. En los tests estadísticos se rechazó la hipótesis nula para un error α de 0,05. El riesgo relativo se estimó mediante la odds ratio (OR) con intervalo de confianza del 95% (IC95%).
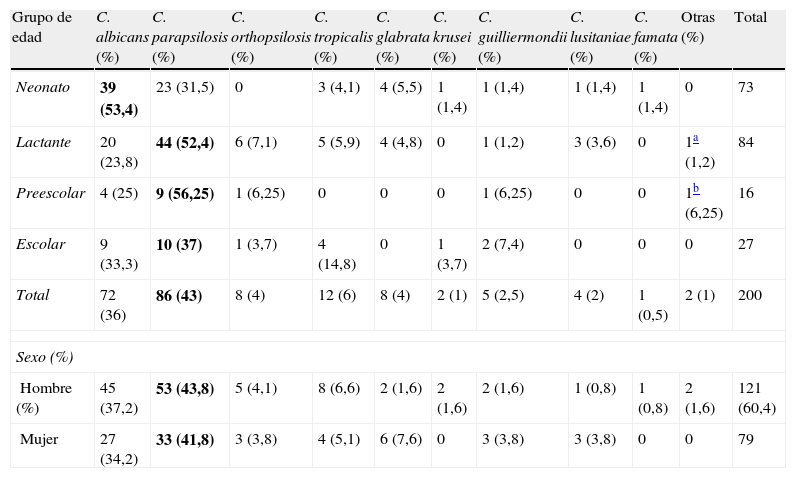
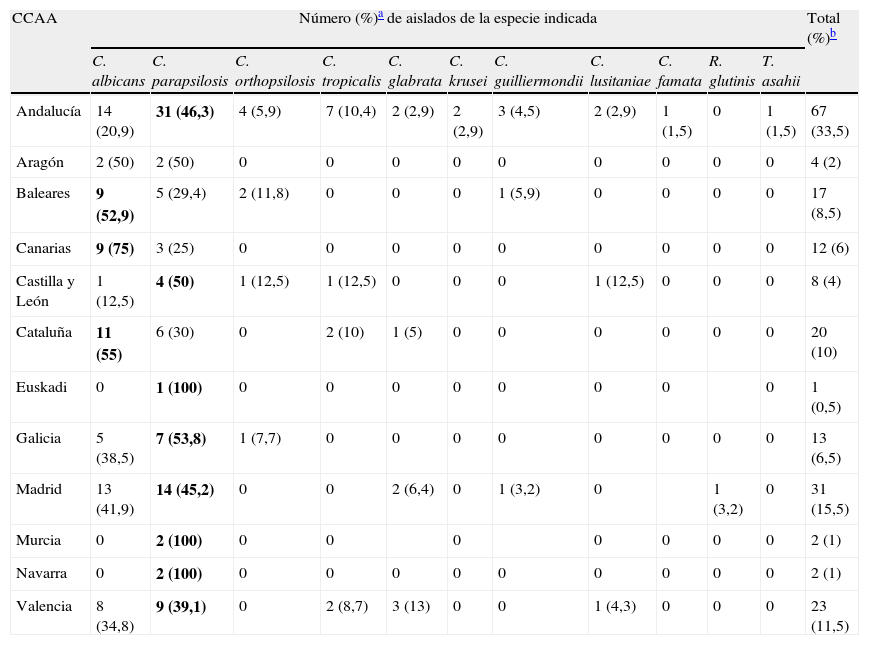
ResultadosDurante el periodo de estudio se incluyeron 197 episodios de candidemia con 200 aislamientos de levaduras. De las 15 comunidades autónomas (CCAA) inicialmente participantes en el estudio, en 12 de ellas se notificaron casos en población pediátrica. La candidemia infantil fue más frecuente en niños que en niñas (1,5/1). Globalmente, la especie más frecuentemente identificada fue C. parapsilosis sensu stricto, con 86 aislamientos (43%), seguida de C. albicans, con 72 (36%), C. tropicalis, con 12 (6%), C. orthopsilosis y C. glabrata, ambas con 8 aislamientos (4%), C. guilliermondii, con 5 (2,5%), Candida lusitaniae, con 4 (2%), C. krusei, con 2 (1%), y otras levaduras, con 3 aislamientos (1,5%) (tabla 2). C. albicans predominó en el grupo de neonatos, mientras que en lactantes, preescolares y escolares la especie más frecuente fue C. parapsilosis. En 86 casos de los 94 aislamientos de C. parapsilosis se pudo determinar la especie dentro del complejo. Se identificaron 78 como C. parapsilosis sensu stricto (90,7% de las C. parapsilosis caracterizadas), 8 C. orthopsilosis (10,2%) y ninguna C. metapsilosis. C. parapsilosis fue la especie más frecuente en Andalucía, Castilla-León, Valencia, Galicia y Madrid. Por el contrario, C. albicans fue la más frecuente en Baleares, Cataluña y Canarias (tabla 3). En preescolares y escolares no hubo diferencia significativa entre aislamientos de C. albicans y no C. albicans; sin embargo, la edad neonatal se asoció significativamente con candidemia por C. albicans (OR: 3,267; IC95%: 1,780-5,997; p<0,0001).
Distribución de las especies de Candida por grupos de edad y sexo
| Grupo de edad | C. albicans (%) | C. parapsilosis (%) | C. orthopsilosis (%) | C. tropicalis (%) | C. glabrata (%) | C. krusei (%) | C. guilliermondii (%) | C. lusitaniae (%) | C. famata (%) | Otras (%) | Total |
| Neonato | 39 (53,4) | 23 (31,5) | 0 | 3 (4,1) | 4 (5,5) | 1 (1,4) | 1 (1,4) | 1 (1,4) | 1 (1,4) | 0 | 73 |
| Lactante | 20 (23,8) | 44 (52,4) | 6 (7,1) | 5 (5,9) | 4 (4,8) | 0 | 1 (1,2) | 3 (3,6) | 0 | 1a (1,2) | 84 |
| Preescolar | 4 (25) | 9 (56,25) | 1 (6,25) | 0 | 0 | 0 | 1 (6,25) | 0 | 0 | 1b (6,25) | 16 |
| Escolar | 9 (33,3) | 10 (37) | 1 (3,7) | 4 (14,8) | 0 | 1 (3,7) | 2 (7,4) | 0 | 0 | 0 | 27 |
| Total | 72 (36) | 86 (43) | 8 (4) | 12 (6) | 8 (4) | 2 (1) | 5 (2,5) | 4 (2) | 1 (0,5) | 2 (1) | 200 |
| Sexo (%) | |||||||||||
| Hombre (%) | 45 (37,2) | 53 (43,8) | 5 (4,1) | 8 (6,6) | 2 (1,6) | 2 (1,6) | 2 (1,6) | 1 (0,8) | 1 (0,8) | 2 (1,6) | 121 (60,4) |
| Mujer | 27 (34,2) | 33 (41,8) | 3 (3,8) | 4 (5,1) | 6 (7,6) | 0 | 3 (3,8) | 3 (3,8) | 0 | 0 | 79 |
En negrita la especie más frecuente.
Distribución de especies por comunidad autónoma (CCAA)
| CCAA | Número (%)a de aislados de la especie indicada | Total (%)b | ||||||||||
| C. albicans | C. parapsilosis | C. orthopsilosis | C. tropicalis | C. glabrata | C. krusei | C. guilliermondii | C. lusitaniae | C. famata | R. glutinis | T. asahii | ||
| Andalucía | 14 (20,9) | 31 (46,3) | 4 (5,9) | 7 (10,4) | 2 (2,9) | 2 (2,9) | 3 (4,5) | 2 (2,9) | 1 (1,5) | 0 | 1 (1,5) | 67 (33,5) |
| Aragón | 2 (50) | 2 (50) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 4 (2) |
| Baleares | 9 (52,9) | 5 (29,4) | 2 (11,8) | 0 | 0 | 0 | 1 (5,9) | 0 | 0 | 0 | 0 | 17 (8,5) |
| Canarias | 9 (75) | 3 (25) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 12 (6) |
| Castilla y León | 1 (12,5) | 4 (50) | 1 (12,5) | 1 (12,5) | 0 | 0 | 0 | 1 (12,5) | 0 | 0 | 0 | 8 (4) |
| Cataluña | 11 (55) | 6 (30) | 0 | 2 (10) | 1 (5) | 0 | 0 | 0 | 0 | 0 | 0 | 20 (10) |
| Euskadi | 0 | 1 (100) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 (0,5) | |
| Galicia | 5 (38,5) | 7 (53,8) | 1 (7,7) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 13 (6,5) |
| Madrid | 13 (41,9) | 14 (45,2) | 0 | 0 | 2 (6,4) | 0 | 1 (3,2) | 0 | 1 (3,2) | 0 | 31 (15,5) | |
| Murcia | 0 | 2 (100) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 (1) | ||
| Navarra | 0 | 2 (100) | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2 (1) |
| Valencia | 8 (34,8) | 9 (39,1) | 0 | 2 (8,7) | 3 (13) | 0 | 0 | 1 (4,3) | 0 | 0 | 0 | 23 (11,5) |
En negrita la especie más frecuente.
Las diferentes especies causales de candidemia se aislaron uniformemente a lo largo del estudio, sin que se observaran diferencias significativas en las 4 estaciones del año.
El número de episodios de candidemia en función de las distintas unidades de hospitalización fue: neonatología, 63 episodios (31,5%); pediatría general, 50 (25%); UCI pediátrica, 38 (19%); UCI neonatal, 29 (14,5%); hematología, 11 (5,5%); cirugía, 5 (2,5%), y oncología, 4 (2%). En las áreas de cuidados intensivos (incluyendo UCI neonatal y pediátrica) C. albicans (46,3%) fue la especie causal de candidemia significativamente más frecuente (OR: 2,108; IC95%: 1,142-3,891; p=0,016).
Con los factores predisponentes de candidemia analizados (cirugía, quemaduras, VIH, neutropenia, trasplante de precursores hematopoyéticos [TPH], trasplante de órgano sólido [TOS], catéter intravenoso y prematuridad) se realizó un análisis univariante, seleccionando las variables significativas (p<0,05) y las clínicamente importantes para una regresión logística multivariante. La presencia de catéter y la prematuridad fueron los 2 únicos factores de riesgo que resultaron significativos tanto en el análisis univariante como en el multivariante y se asociaron, de manera independiente, con candidemia por C. albicans con un riesgo casi 6 y 2 veces mayor, respectivamente (OR: 5,967; IC95%: 1,614-22,057; p=0,007, y OR: 2,229; IC95%: 1,141-4,631; p=0,020).
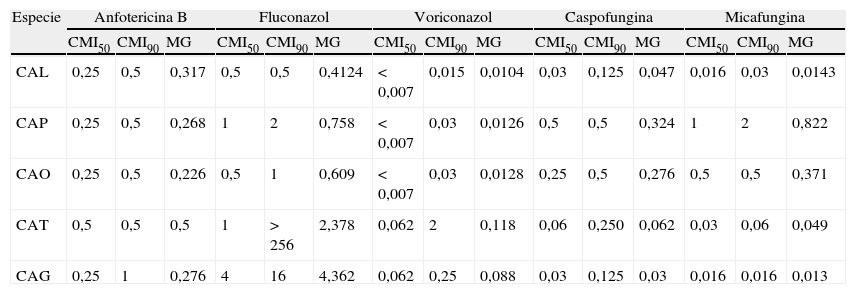
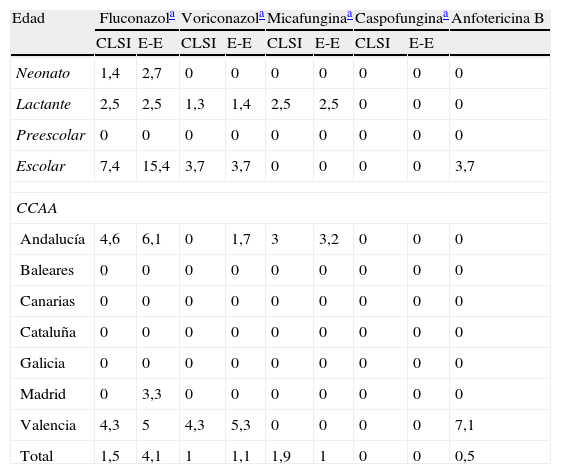
Con respecto a la sensibilidad de los aislamientos, la concentración de cada antifúngico, expresada en mg/l, que inhibió el 50 y el 90% de los aislamientos (CMI50 y CMI90) de cada especie y la media geométrica (MG), se muestran en la tabla 4. Al analizar los perfiles de resistencia a los antifúngicos utilizados en población pediátrica se observó que el porcentaje de resistencia global al fluconazol de las especies para las que se ha definido un nuevo punto de corte específico (C. albicans, C. parapsilosis sensu lato, C. glabrata, C. tropicalis y C. guilliermondii) pasó del 1,5% con los criterios vigentes al 4,1% con los nuevos criterios propuestos. Por edades, la proporción de resistentes fue menor en neonatos (1,4 o 2,7% con los nuevos puntos de corte propuestos) que en lactantes (2,5%) y en escolares (7,4 o 15,4% con los nuevos criterios). Las tasas globales de resistencia al voriconazol fueron del 1%, aunque ni en neonatos ni en preescolares se detectó ningún aislamiento resistente. Entre las equinocandinas utilizadas en pediatría no se encontraron resistencias a la caspofungina, mientras que hubo un aislamiento de C. parapsilosis sensu estricto, uno de C. tropicalis y otro de T. asahi, todos ellos en el grupo de lactantes, resistentes a la micafungina (CMI>2mg/l). La anfotericina B también fue muy activa: solo un aislado de C. tropicalis, en el grupo de escolares, que se inhibió con 2mg/l de este antifúngico. La distribución de resistencias por edades y CCAA con un número suficiente de casos se detalla en la tabla 5.
Actividad in vitro de los antifúngicos de uso pediátrico sobre las especies más frecuentes aisladas
| Especie | Anfotericina B | Fluconazol | Voriconazol | Caspofungina | Micafungina | ||||||||||
| CMI50 | CMI90 | MG | CMI50 | CMI90 | MG | CMI50 | CMI90 | MG | CMI50 | CMI90 | MG | CMI50 | CMI90 | MG | |
| CAL | 0,25 | 0,5 | 0,317 | 0,5 | 0,5 | 0,4124 | < 0,007 | 0,015 | 0,0104 | 0,03 | 0,125 | 0,047 | 0,016 | 0,03 | 0,0143 |
| CAP | 0,25 | 0,5 | 0,268 | 1 | 2 | 0,758 | < 0,007 | 0,03 | 0,0126 | 0,5 | 0,5 | 0,324 | 1 | 2 | 0,822 |
| CAO | 0,25 | 0,5 | 0,226 | 0,5 | 1 | 0,609 | < 0,007 | 0,03 | 0,0128 | 0,25 | 0,5 | 0,276 | 0,5 | 0,5 | 0,371 |
| CAT | 0,5 | 0,5 | 0,5 | 1 | > 256 | 2,378 | 0,062 | 2 | 0,118 | 0,06 | 0,250 | 0,062 | 0,03 | 0,06 | 0,049 |
| CAG | 0,25 | 1 | 0,276 | 4 | 16 | 4,362 | 0,062 | 0,25 | 0,088 | 0,03 | 0,125 | 0,03 | 0,016 | 0,016 | 0,013 |
CAG: C. glabrata; CAL: C. albicans; CAO: C. orthopsilosis; CAP: C. parapsilosis; CAT: C. tropicalis; CMI50 y CMI90: concentración que inhibe el 50 y el 90% de los aislados, respectivamente; MG: media geométrica.
Porcentaje de aislados resistentes a los antifúngicos de uso pediátrico en los distintos grupos de edad y comunidad autónoma (CCAA)
| Edad | Fluconazola | Voriconazola | Micafunginaa | Caspofunginaa | Anfotericina B | ||||
| CLSI | E-E | CLSI | E-E | CLSI | E-E | CLSI | E-E | ||
| Neonato | 1,4 | 2,7 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Lactante | 2,5 | 2,5 | 1,3 | 1,4 | 2,5 | 2,5 | 0 | 0 | 0 |
| Preescolar | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Escolar | 7,4 | 15,4 | 3,7 | 3,7 | 0 | 0 | 0 | 0 | 3,7 |
| CCAA | |||||||||
| Andalucía | 4,6 | 6,1 | 0 | 1,7 | 3 | 3,2 | 0 | 0 | 0 |
| Baleares | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Canarias | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Cataluña | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Galicia | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Madrid | 0 | 3,3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Valencia | 4,3 | 5 | 4,3 | 5,3 | 0 | 0 | 0 | 0 | 7,1 |
| Total | 1,5 | 4,1 | 1 | 1,1 | 1,9 | 1 | 0 | 0 | 0,5 |
Los porcentajes se han establecido con todas las especies de Candida al aplicar los criterios vigentes del CLSI y con las especies o grupos de especies seleccionadas para los que se han propuesto nuevos puntos de corte especie-específicos (E-E)10,11.
El presente estudio incluye los datos recogidos prospectivamente durante 13 meses de 197 episodios de candidemia en niños de 31 hospitales de 12 CCAA. Probablemente es una de las series más amplias de esta población, especialmente en nuestro país, donde los estudios más importantes se han enfocado en neonatos7. La incidencia global por sexos muestra un predominio en varones (60,4%) algo superior a lo publicado por otros autores, que oscila en torno al 53-55%12,13, aunque esta proporción se invierte en los episodios de candidemia por C. glabrata, C. guilliermondii y C. lusitaniae, en donde hay predominio femenino (tabla 2). Globalmente, la especie más frecuentemente aislada es C. parapsilosis sensu stricto (43%), seguida de C. albicans (36%) y, en mucha menor proporción, C. tropicalis (6%), C. glabrata (4%), C. orthopsilosis (4%) y C. krusei (1%). Esta distribución de especies es similar a la de otros estudios epidemiológicos pediátricos; sin embargo, el porcentaje de aislamientos de C. glabrata y C. krusei es inferior al notificado por Neu et al. (12,8 y 4,4%, respectivamente)12. El predominio de C. parapsilosis se mantiene en todas las CCAA excepto en Baleares, Canarias y Cataluña, donde C. albicans es la más frecuente. La proporción de aislamientos de C. parapsilosis es, al igual que ocurre en los adultos, 11 veces mayor que la de C. orthopsilosis14.
Analizando la distribución de especies por edades, destaca el predominio de C. albicans entre los neonatos, en contraste con lo publicado anteriormente, en donde C. parapsilosis siempre figura como la especie más frecuente7,12,13. Este fenómeno se repite en la mayor parte de las CCAA, y especialmente en las que más casos presentaron. Al agrupar todas las especies no C. albicans, se puede observar que el grupo de lactantes presenta menos riesgo para desarrollar candidemia por C. albicans (OR: 0,422; IC95%: 0,227-0,786; p=0,006) y que C. parapsilosis es la especie más frecuente en todos los grupos de edad, excepto en los neonatos.
Es bien conocida la importancia del clima y de la estacionalidad en la incidencia de algunos hongos. Algunos autores han postulado patrones estacionales en la candidiasis invasora15. En nuestra serie se agruparon los meses para buscar alguna tendencia estacional. El limitado periodo de tiempo del estudio (13 meses) impide apreciar claramente patrones estacionales; sin embargo, se puede observar un mayor número de aislamientos de especies no C. albicans en otoño, aunque faltan datos temporales para obtener conclusiones certeras sobre esta tendencia.
En nuestro país, neonatología es la unidad asistencial con mayor número de episodios de fungemia, con un tercio de todos los casos (31,5%). En la UCI pediátrica, la proporción de aislamientos de C. albicans y no C. albicans es similar, pero fuera de las áreas críticas hay más probabilidad de aislar una especie no C. albicans, fundamentalmente C. parapsilosis. Aunque otros autores han señalado que en áreas de cuidados críticos hay más riesgo de desarrollar candidemia por C. albicans16, en general la distribución de especies puede variar de unas áreas a otras dentro de un mismo hospital, reflejando su actividad17. Este hecho refuerza la necesidad de un conocimiento preciso de la epidemiología de las especies aisladas no solo de cada CCAA o cada hospital, sino también de cada unidad asistencial. Además, se han descrito ampliamente brotes nosocomiales por C. albicans o C. parapsilosis en unidades de neonatos que pueden condicionar el patrón local de distribución18,19.
En cuanto a los factores predisponentes para desarrollar candidemia, se ha analizado la posible asociación con la especie aislada. De todos los estudiados, la prematuridad y la presencia de catéteres se asocian con un mayor riesgo de candidemia por C. albicans. Otros estudios previos señalan la prematuridad como un factor predisponente para desarrollar candidemia13,20, ya que el prematuro tiene una inmadurez del sistema inmune y de la piel que no actúa como una barrera eficaz21, por lo que es muy frecuente la diseminación horizontal en este tipo de unidades. Una de las limitaciones de nuestra serie es la ausencia de un análisis de tipificación molecular que permita valorar si durante el periodo de estudio ha podido haber algún brote dentro de las unidades estudiadas que alterara el perfil epidemiológico habitual. La presencia de catéter intravascular también es un factor de riesgo conocido y estudiado por otros autores20; Rodríguez et al. observaron una mayor proporción de especies no C. albicans asociadas a catéter venoso central en 5 UCI neonatales en Barcelona7.
La mayor parte de los aislados fueron sensibles a los antifúngicos ensayados. Conviene destacar que los 8 aislamientos identificados como C. orthopsilosis no mostraron mayores niveles de resistencia que el resto del conjunto de C. parapsilosis. Globalmente, la tasa de resistencia al fluconazol osciló entre el 1,5 y el 4,1%, según se utilice el criterio vigente del CLSI o el específico para cada especie. Estas tasas son similares a las de otros estudios12,13 y similares a las recientemente publicadas en Andalucía22, en torno al 3%. El desglose por CCAA (en las que tuvieron un número suficiente de aislamientos) muestra diferencias entre ellas: no se detectan resistencias en Cataluña, Canarias, Galicia y Baleares, y se alcanzan tasas de resistencia del 4-6%, según el criterio aplicado, en Valencia (un aislamiento de C. tropicalis) y Andalucía (un aislamiento de C. tropicalis y 2 de C. krusei, y con los nuevos puntos de corte se añaden 2 aislamientos de C. guilliermondii). De la misma manera, el análisis por edades también revela una mayor tendencia a aislar Candida spp. resistentes a los antifúngicos en los niños de mayor edad (un aislamiento de C. krusei y uno de C. tropicalis, y aplicando los nuevos puntos de corte se añaden 2 aislamientos de C. guilliermondii), probablemente porque en estas edades hay más probabilidad de contacto previo con antifúngicos que en edades más tempranas. Otros estudios así parecen corroborarlo al señalar una mayor tasa de resistencia al fluconazol en adultos que en niños, y en estos que en neonatos13. Finalmente, todas las equinocandinas presentan una gran actividad frente a la mayor parte de las especies estudiadas. No se detecta resistencia a la caspofungina, pero un aislamiento de C. parapsilosis y otro de C. tropicalis, en lactantes andaluces, se inhibieron con 8μg/ml de micafungina. Por CCAA, solo Andalucía, Madrid y Valencia presentaron casos de resistencia a los antifúngicos utilizados en pediatría: Andalucía al fluconazol, al voriconazol (con los nuevos criterios) y a la micafungina; Madrid solamente al fluconazol, aplicando los nuevos criterios, y Valencia a los azoles. Estas diferencias geográficas pueden ser debidas a que estas CCAA fueron las que más casos recogieron, aunque se requiere un estudio más detallado que valore las diferencias en actividad, población y tratamientos antifúngicos utilizados que de alguna manera pudieran explicarlas.
En resumen, se trata de una de las series pediátricas de candidemia más extensas publicadas en nuestro país, que muestra un predominio de C. parapsilosis en niños mayores de un mes y C. albicans en neonatos. La prematuridad y la presencia de catéter intravenoso son factores de riesgo asociado al aislamiento de esta especie y con unas tasas de resistencia muy bajas a todos los antifúngicos, y especialmente a los de primera elección (fluconazol y equinocandinas).
Conflicto de interesesEl presente estudio forma parte del Proyecto FUNGEMYCA, financiado por Astellas Pharma, S.A.
Julio García Rodríguez ha colaborado como consultor para Gilead y ha recibido ayuda para proyectos de Pfizer, Gilead y Astellas. De igual forma, ha recibido ayuda para congresos de Gilead, Pfizer, Astellas y MSD.
Julia Alcoba, Hospital Universitario N. S. de la Candelaria, Tenerife. Josefina Ayats, Ciutat Sanitària i Universitària de Bellvitge, Hospitalet de Llobregat, Barcelona. Nuria Borrell, Hospital Son Dureta, Palma de Mallorca. Miguel Ángel Bratos, Hospital Clínico Universitario, Valladolid. Buenaventura Buendía, Hospital Universitario La Princesa, Madrid. Juan J. Camarena, Hospital Universitario Dr. Peset, Valencia. Isolina Campos-Herrero, Hospital de Gran Canaria Dr. Negrín, Las Palmas de Gran Canaria. Julia Echeverría, Hospital Donostia, San Sebastián. Juliana Esperalba, Hospital Puerta de Hierro, Majadahonda, Madrid. Isabel Fernández-Natal, Hospital General, León. Dionisia Fontanals, Servicio de Microbiología, Corporació Sanitària Parc Taulí, Sabadell, Barcelona. Inmaculada García-García, Hospital Clínico Universitario, Salamanca. Elia G.-de la Pedrosa, Hospital Ramón y Cajal, Madrid. Ana María García-Tapia, Hospital Universitario Puerta del Mar, Cádiz. Bárbara Gomila, Hospital General, Castellón. Jesús Guinea, Hospital Gregorio Marañón, Madrid. Remedios Guna, Hospital General, Valencia. María José Linares-Sicilia, Hospital Reina Sofía, Córdoba. Francesc Marco, Hospital Clínic, Barcelona. José Martínez-Alarcón, Hospital General, Ciudad Real. Paloma Merino, Hospital Clínico San Carlos, Madrid. Consuelo Miranda, Hospital Virgen de la Nieves, Granada. Carmen Pazos, Hospital S. Pedro de Alcántara, Cáceres. Luisa Pérez del Molino, Complejo Hospitalario, Santiago de Compostela, La Coruña. Aurelio Porras, Hospital Carlos Haya, Málaga. Eva María Roselló, Hospital Valle Hebrón, Barcelona. Carmen Rubio, Hospital Clínico Lozano Blesa, Zaragoza. María Teresa Ruiz-Pérez de Pipaon, Hospital Virgen del Rocío, Sevilla. Ferrán Sánchez-Reus, Hospital Universitari de la Santa Creu i Sant Pau, Barcelona. Anabel Suárez, Hospital Universitario Virgen de la Macarena, Sevilla. Luis Torroba, Hospital Virgen del Camino, Pamplona. David Velasco, Hospital Lucus Augusti, Lugo. Genoveva Yagüe, Hospital Virgen de la Arrixaca, Murcia.
Jesús Guinea (Hospital Universitario Gregorio Maranón, Madrid); Paloma Merino (Hospital Clínico San Carlos, Madrid); Maite Ruiz Pérez de Pipaon (Hospital Universitario Virgen del Rocío, Sevilla); Luisa Pérez del Molino (Complejo Hospitalario, Santiago de Compostela); María José Linares (Hospital Universitario Reina Sofía, Córdoba); Francesc Marco Reverté (Hospital Clínic, Barcelona); Julio García (Hospital Universitario La Paz, Madrid); Eva María Roselló Mayans (Hospital Universitario Vall d’Hebron, Barcelona); Rafael Cantón (Hospital Universitario Ramón y Cajal, Madrid); Nuria Borrell Solé (Hospital Universitario Son Dureta, Palma de Mallorca); Aurelio Porras (Hospital Universitario Carlos Haya, Málaga); J. Ruiz Gómez y Genoveva Yagüe (Hospital Universitario Virgen de la Arrixaca, Murcia); Inmaculada García García (Hospital Clínico, Salamanca); Remedios Guna Serrano (Hospital General, Valencia); Carmen Pazos Pacheco (Hospital San Pedro de Alcántara, Cáceres).