Analizar el estado vacunal de los niños diagnosticados de tos ferina y comparar las manifestaciones clínicas de los bien vacunados y de los no vacunados o con vacunación incompleta.
MétodosSe ha revisado la historia clínica y el carnet vacunal de los pacientes menores de 16años visitados en el servicio de urgencias del Hospital Universitario Vall d’Hebron de Barcelona con tos ferina confirmada por estudio microbiológico. El periodo de estudio comprende del 1 de enero de 2009 al 31 de diciembre de 2011.
ResultadosSe han investigado 212casos: 35 en 2009, 28 en 2010 y 149 en 2011. La reacción en cadena de la polimerasa en tiempo real (RT-PCR) fue positiva en 210pacientes, y el cultivo, en 73. Los lactantes menores de 6meses representan el 36,8% de los casos. No estaban vacunados 44 (21,5%) pacientes. Cuarenta y cuatro (21,5%) tenían entre 2 y 5meses de vida y habían recibido una o 2dosis de vacuna. Habían completado la primovacunación y las dosis de recuerdo (3 a 5dosis, según la edad) 117niños (57%); el 76,9% (90casos) había recibido la última dosis de vacuna hacía menos de 4años. Al comparar las manifestaciones clínicas de los pacientes con vacunación completa y con vacunación incompleta o no vacunados, solo la cianosis se ha presentado con más frecuencia en el segundo grupo (p<0,001). La probabilidad de hospitalización ajustada por la edad se asoció de forma significativa con la ausencia de vacunación (p=0,001). La letalidad en los pacientes hospitalizados fue del 1,3%.
ConclusionesEl número de casos de tos ferina atendidos en nuestro centro ha aumentado de forma importante en el último año. El 57% de los pacientes estaban bien vacunados y el 76,9% habían recibido la última dosis en los últimos 4años. Se necesitan otras estrategias de vacunación (adolescentes, adultos y embarazadas, y estrategia del nido) para proteger a los lactantes menores de 6meses de edad, así como vacunas más efectivas.
To analyse the vaccination status of children diagnosed with pertussis and to compare the clinical manifestations of fully vaccinated with unvaccinated, or incompletely-vaccinated, children.
MethodsThe clinical histories and vaccination cards of patients under 16years of age seen in the Emergency Room of the University Hospital Vall d’Hebron, Barcelona (Spain), for pertussis confirmed by a microbiological study were reviewed. The study period lasted from January 1, 2009 to December 31, 2011.
ResultsTwo hundred and twelve cases were studied: 35 in 2009, 28 in 2010 and 149 in 2011. RT-PCR was positive in 210 patients, and 73 had a positive culture. Infants under 6months of age account for 36.8% of all cases. Forty-four patients (21.5%) were not vaccinated. Forty-four (21.5%) children were between 2 and 5months of age and had received 1-2vaccine doses. One hundred and seventeen (57%) children were fully vaccinated; 76.9% (90cases) had received the last dose less than 4years ago. When clinical manifestations of the fully vaccinated patients were compared with those of the non-vaccinated or incompletely-vaccinated children, only cyanosis was found with a higher frequency in the latter group (P<.001). The age-adjusted probability of hospitalisation was significantly associated with non-vaccination (P=.001). The case mortality rate among inpatients was 1.3%.
ConclusionsThe number of pertussis cases seen in our centre has risen significantly in the last year. More than half (57%) of the patients were fully vaccinated, and 76.9% had received the last dose in the previous 4years. Other vaccination strategies, such as vaccination of adolescents, adults, and pregnant women, as well as a cocoon strategy are required to protect infants under 6months of age. More effective vaccines need to be developed.
Hace casi medio siglo (desde 1965) que la vacuna de la tos ferina está incluida en el calendario de vacunaciones infantil en España. A pesar de la importante disminución de la incidencia de esta enfermedad, al igual que ha ocurrido en otros países con altas coberturas vacunales, la reemergencia de la tos ferina es hoy un problema de salud pública1–4, con aparición de brotes epidémicos en muchos países, entre los que destacan Estados Unidos, Australia, Japón, Bélgica y Holanda5,6. El incremento se ha producido sobre todo en 2grupos de edad: los adolescentes y adultos, y los lactantes menores de 6meses. La mayor letalidad afecta a los menores de 4meses; en Estados Unidos representó el 90% de todas las muertes por tos ferina (175 del total de 194) en la primera década del siglo7.
En España, la pauta de vacunación frente a la tos ferina con la vacuna triple bacteriana con componente acelular de la tos ferina (DTPa) consiste en una primovacunación con 3dosis seguida de 2dosis de recuerdo entre los 15 y 18meses y los 4 y 6años de edad (esta última, en algunas comunidades autónomas con la vacuna dTpa [toxoide diftérico tipo adulto, toxoide tetánico y carga antigénica reducida de Bordetella pertussis]). Las vacunas acelulares, que se utilizan en España desde 1998, tienen una eficacia similar a la de la mayoría de las vacunas de células enteras según los ensayos clínicos precomercialización8,9, aunque trabajos recientes señalan una efectividad menor10. El mejor perfil de seguridad de las vacunas acelulares hace que su aceptación por parte de la población y el personal sanitario sea mayor, lo cual se refleja en las altas coberturas vacunales alcanzadas. Según datos del Ministerio de Sanidad, Servicios Sociales e Igualdad, las coberturas en 2011 para la primovacunación y las 2dosis de recuerdo fueron del 97,1, del 94,1 y del 81,1%, respectivamente11. Sin embargo, la inmunidad vacunal disminuye con el tiempo y desaparece entre 4 y 12años después de la última dosis, al igual que la que proporciona la enfermedad, aunque esta última es algo más duradera12.
El objetivo de este trabajo es analizar la historia vacunal de los niños diagnosticados de tos ferina en el servicio de urgencias de un hospital de tercer nivel en los últimos 3años, y comparar las manifestaciones clínicas y la necesidad de hospitalización de los pacientes bien vacunados y de los no vacunados o vacunados de forma incompleta. Además, se revisan las estrategias de vacunación recomendadas en la actualidad para intentar disminuir la reemergencia de la tos ferina.
MétodosEstudio retrospectivo observacional de los pacientes menores de 16años diagnosticados de tos ferina por B.pertussis entre el 1 de enero de 2009 y el 31 de diciembre de 2011 en el servicio de urgencias del Hospital Universitario Vall d’Hebron de Barcelona. Se incluyeron los pacientes con diagnóstico confirmado mediante reacción en cadena de la polimerasa en tiempo real (RT-PCR) comercial (Smart Bp/Bpp, Cepheid AB, Suecia) o cultivo de secreciones respiratorias obtenidas por aspiración nasofaríngea de aquellos con sospecha clínica de la enfermedad. La RT-PCR utilizada permite detectar los ácidos nucleicos, que fueron extraídos de forma automatizada de B.pertussis (región genómica IS481) y de B.parapertussis (región genómica IS1001) con sondas tipo molecular beacons13. El cultivo se realizó en medio de agar charcoal enriquecido con un 10% de sangre de caballo y 40mg/l de cefalexina, incubado en cámara húmeda durante 7días13.
Según el protocolo establecido en nuestro hospital, ingresaron todos los lactantes menores de 4meses, los pacientes inmunodeprimidos o afectos de una enfermedad de base con riesgo cardiopulmonar, y los que presentaron manifestaciones clínicas graves (apnea, dificultad respiratoria, cianosis, convulsiones, trastorno de la alimentación). Todos los pacientes se trataron con azitromicina durante 5días y se realizó quimioprofilaxis de los contactos14.
Se recogió información sobre las siguientes variables: edad, antecedentes vacunales, manifestaciones clínicas, hospitalización y letalidad. Para el análisis de la asociación entre hospitalización y estado vacunal solo se incluyeron los pacientes de edad igual o mayor a 4meses, dado que los menores de esta edad ingresaban todos según el protocolo del centro. La información vacunal se obtuvo en todos los casos a través del carnet vacunal o de la historia clínica del paciente. Se consideraron bien vacunados los niños que habían recibido entre 3 y 5dosis (según la edad), como no vacunados los que no habían recibido ninguna dosis, y con vacunación incompleta el resto.
Los datos se registraron en una base de datos Excel para su posterior análisis. Para la comparación de variables cualitativas se utilizó la prueba de ji al cuadrado (χ2) de Pearson, o la prueba exacta de Fisher si alguno de los efectivos esperados era inferior a 5. Para el cálculo de las variables cuantitativas se utilizaron la prueba t de Student o la U de Man-Withney, según el tipo de distribución. Para analizar la probabilidad de hospitalización y el tipo de manifestaciones clínicas según el estado vacunal se realizó un análisis multivariado mediante regresión logística binaria ajustado por la edad. Todos los análisis estadísticos se llevaron a cabo con el paquete de programas SPSS (PASW Statistics 18, versión 18.0.0). Se consideraron significativos valores de p<0,05.
ResultadosEn el periodo de estudio, en el servicio de urgencias de nuestro hospital se diagnosticaron 212casos de tos ferina por B.pertussis: 35 en 2009, 28 en 2010 y 149 en 2011. La RT-PCR se realizó en todos los pacientes y fue positiva en 210 (99%), y el cultivo se hizo en 153, con resultado positivo en 73 (47,7% de los pacientes).
Entre los meses de abril y septiembre se diagnosticaron 173pacientes (81,6%), con un pico máximo en julio (55pacientes, 26,4% de los casos). La mediana de edad fue de 1,4años (intervalo de 9días a 15años). Treinta y tres pacientes (15,6%) eran lactantes menores de 2meses, 45 (21,2%) tenían entre 2 y 5meses de edad, y 134 (63,2%) tenían 6meses o más. El 51% eran mujeres y el 49% hombres. Setenta y seis (35,8%) pacientes requirieron ingreso, de los cuales 33 (43,4%) eran menores de 2meses, 25 (32,9%) tenían entre 2 y 3meses de edad, 8 (10,5%) entre 4 y 5meses, 4 (5,3%) entre 6 y 11meses, 4 (5,3%) entre 1 y 3años, uno (1,3%) entre 4 y 9años y uno (1,3%) tenía más de 10años. La mediana de edad de los hospitalizados fue de 2,3meses (intervalo de 9días a 5,3años). Once (14,5%) ingresaron en la unidad de cuidados intensivos (UCI), con una mediana de edad de 1,3meses (intervalo de 23días a 15,7meses); la mediana de edad de los ingresados en las otras áreas de hospitalización fue de 2,5meses (intervalo de 9días a 5,3años). La estancia media hospitalaria fue de 7,3días (DE: 5,5días) y la estancia en la UCI de 7,9días (DE: 8,8días).
Los pacientes se clasificaron en 3grupos según los antecedentes vacunales: a)no vacunados, 44 (21,5%), de los cuales 33 eran lactantes menores de 2meses de edad que no habían iniciado la vacunación, 7 no vacunados por decisión de los padres (3,3% del total de los pacientes) y en los 4 restantes se retrasó el inicio de la vacunación (niños entre 60 y 75días de vida); b)con vacunación incompleta, 44 (21,5%), que eran lactantes entre 2 y 5meses de edad que no habían completado la serie primaria, y c)vacunados, 117 (57%). El 76,9% (90casos) había recibido la última dosis de vacuna hacía menos de 4años (43,3% en el último año), y en el 23,1% (27casos) habían transcurrido 4años o más.
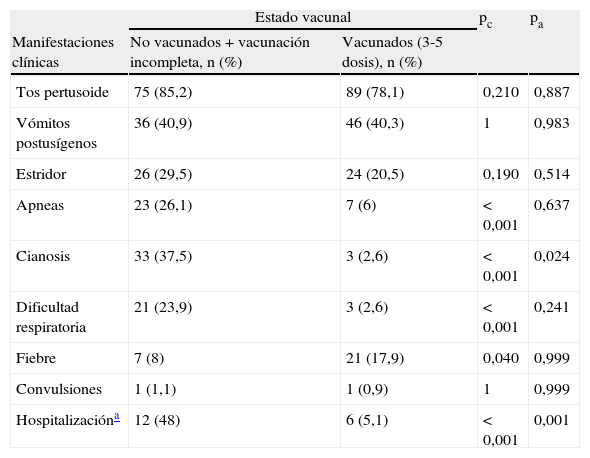
Ciento sesenta y ocho pacientes (81,2%) presentaron tos en accesos entre un día y 2meses antes del ingreso, con una mediana de 7días. De los 39casos restantes (18,8%), 16 se diagnosticaron en el estudio de contactos, 7 presentaron dificultad respiratoria o cianosis como única manifestación, 4 presentaron apneas, y el resto, otros síntomas. Las manifestaciones clínicas de los pacientes de los grupos de no vacunados y con vacunación incompleta, y las de los vacunados, se resumen en la tabla 1. El 92,1% de los pacientes ingresados pertenecían al primer grupo y solo 6 (7,9%) al segundo. Cuatro lactantes menores de 2meses se diagnosticaron de síndrome de tos ferina maligna (1,9%), y de ellos uno falleció (1,3% de los hospitalizados). Al comparar los casos con vacunación incompleta o no vacunados con el grupo de niños vacunados con 3 o más dosis, se observaron diferencias estadísticamente significativas en la frecuencia de cianosis (p<0,001), distrés respiratorio (p<0,001), apneas (p<0,001) y fiebre (p=0,040). En relación con la hospitalización (solo se incluyen los lactantes de 4 o más meses de edad) se han observado también diferencias estadísticamente significativas entre ambos grupos. Al ajustar por la edad solo se mantiene la asociación para las variables hospitalización (p<0,001) y cianosis (p=0,024).
Manifestaciones clínicas de los casos de tos ferina y riesgo de hospitalización según el estado vacunal
| Estado vacunal | pc | pa | ||
| Manifestaciones clínicas | No vacunados + vacunación incompleta, n (%) | Vacunados (3-5 dosis), n (%) | ||
| Tos pertusoide | 75 (85,2) | 89 (78,1) | 0,210 | 0,887 |
| Vómitos postusígenos | 36 (40,9) | 46 (40,3) | 1 | 0,983 |
| Estridor | 26 (29,5) | 24 (20,5) | 0,190 | 0,514 |
| Apneas | 23 (26,1) | 7 (6) | < 0,001 | 0,637 |
| Cianosis | 33 (37,5) | 3 (2,6) | < 0,001 | 0,024 |
| Dificultad respiratoria | 21 (23,9) | 3 (2,6) | < 0,001 | 0,241 |
| Fiebre | 7 (8) | 21 (17,9) | 0,040 | 0,999 |
| Convulsiones | 1 (1,1) | 1 (0,9) | 1 | 0,999 |
| Hospitalizacióna | 12 (48) | 6 (5,1) | < 0,001 | 0,001 |
pa: p ajustada por la edad; pc: p cruda.
La tos ferina es una enfermedad muy contagiosa, producida por B.pertussis, con una tasa de ataque secundaria que puede llegar al 80% en los contactos vacunados14. La Organización Mundial de la Salud estima que en el año 2008 hubo alrededor de 16millones de casos y 195.000muertes por tos ferina en el mundo, y más del 95% ocurrieron en países en desarrollo15. La tos ferina ocupa el quinto lugar, con el 11% del total, como causa de muerte por enfermedades prevenibles mediante vacunas en los niños menores de 5años, después de las infecciones neumocócicas, el sarampión, las gastroenteritis por rotavirus y las infecciones por Haemophilus influenzae tipo b16.
En los países desarrollados la tos ferina continúa siendo una enfermedad endémica, a pesar de la importante disminución de su incidencia debido a la vacunación sistemática del lactante y el preescolar. Además, en los últimos 25 a 30años se está observando una reemergencia de esta enfermedad en países que siempre han mantenido altas coberturas vacunales1–4. En España también se ha observado un incremento de la tasa de incidencia, desde cifras alrededor de un caso por 100.000habitantes en el periodo 2005-2009 hasta superar los 7casos por 100.000 en 2011 y 201217,18. Este aumento de la incidencia tiene una distribución por edades bipolar: los lactantes menores de 6meses, que por su edad no han iniciado la primovacunación (menores de 2meses) o no han completado la serie primaria (de 2 a 5meses), y los adolescentes y adultos por la disminución de su inmunidad con el tiempo transcurrido desde la inmunización o el padecimiento de la enfermedad.
En nuestro estudio se observa que el número de casos de tos ferina diagnosticados en 2011, como también ocurrió en toda España durante ese año, es muy superior al observado en 2009 y 2010, con un incremento de 4veces18. En la distribución por edades, 4 de cada 10pacientes eran menores de 6meses, y los ingresados en la UCI y el paciente que falleció también pertenecían a este grupo de edad. Hay que señalar que las coberturas vacunales se han mantenido altas, ya que solo el 3,3% (7pacientes) no estaban vacunados, por decisión de los padres, porcentaje similar (2,9%) al de toda España para la primovacunación, que tuvo una cobertura del 97,1% en 201111.
La reemergencia de la tos ferina se puede explicar por varios factores. Por una parte, el aumento de la población de adolescentes y adultos susceptibles, en relación con la disminución de la inmunidad vacunal con el tiempo12,19,20, y por otra, el descenso de la incidencia de la infección en el primer decenio de la vida, debido a las altas coberturas de vacunación, que ha originado una menor circulación de B.pertussis y, por tanto, la ausencia del efecto booster o de refuerzo que la infección natural induce en el adolescente y en el adulto. En un estudio clásico realizado por Lambert19 durante un brote de tos ferina ocurrido en Michigan, en 1962, se relacionaron la tasa de ataque de la infección y el tiempo transcurrido desde la última dosis de vacuna. En el grupo en que habían transcurrido más de 12años desde la última dosis la tasa de ataque fue del 95%, y en los que la habían recibido hacía menos de 4años fue del 21%. Jenkinson20, en 1988, concluyó que a los 7años de la inmunización la eficacia vacunal había disminuido al 46%. Posteriormente, en 2005, Wendelboe et al.12 mostraron que la inmunidad vacunal disminuye ya en los primeros 3años y desaparece transcurridos de 4 a 12años desde la quinta y última dosis, que actualmente en España se administra entre los 4 y los 6años de edad en la mayoría de las comunidades autónomas. En el brote ocurrido en California en 2010 se comprobó también esta duración limitada de la inmunidad vacunal, al observarse una pérdida de efectividad vacunal en relación con la fecha de la última dosis21–23. Aunque el diseño de nuestro estudio no permite estimar la duración de la inmunidad vacunal, hay que señalar que casi el 77% de los niños con tos ferina, bien vacunados según el calendario sistemático de nuestra comunidad autónoma, había recibido la última dosis hacía menos de 4años, y el 43% en los 12meses anteriores. Un paciente de 7meses de edad presentó la enfermedad un mes después de finalizada la primovacunación.
En segundo lugar, hay que tener en cuenta que las vacunas, tanto las de células enteras como las acelulares, tienen una efectividad limitada, no tan alta como la de otras vacunas sistemáticas24–26. La eficacia de las vacunas acelulares (DTPa) es variable, y oscila, según diversos ensayos clínicos24, entre el 74% (intervalo de confianza del 95% [IC95%]: 51-86%) y el 88,7% (IC95%: 76,6-94,6%), por lo que es posible observar casos de tos ferina en niños pequeños bien vacunados. Algunas vacunas de células enteras tienen una eficacia mayor, pero por la variabilidad entre ellas, según el tipo de vacuna, oscila entre el 38 y el 92%25. La menor efectividad de las vacunas acelulares podría explicar, en parte, el aumento actual de los brotes de tos ferina en los países industrializados, donde se utilizan estos preparados desde mediados de la década de 1990. Un trabajo realizado en Australia27, en el contexto del brote actual de tos ferina, muestra que las cohortes de lactantes que fueron vacunados con vacunas de células enteras tienen menor riesgo de desarrollar la enfermedad que los vacunados con vacunas acelulares (riesgo relativo: 3,29; IC95%: 2,44-4,46), y este riesgo se mantiene durante más de una década.
Por último, hay que tener en cuenta las variaciones y los cambios genéticos, así como las adaptaciones naturales que se han producido en las cepas circulantes de B.pertussis debido a la vacunación26,28. Recientemente, en la importante epidemia de Australia que se inició en 2008 se han demostrado alteraciones genéticas que afectan a la toxina pertúsica y la pertactina29. También se ha observado la emergencia de cepas con una mayor producción de toxina pertúsica30. La aparición de tos ferina en niños bien vacunados, fenómeno observado en España en el último año31, podría explicarse por la disminución de la efectividad vacunal debida a la divergencia antigénica entre las cepas circulantes de B.pertussis y los componentes de las vacunas actuales. Se requieren estudios de biología molecular en nuestro medio para demostrar este fenómeno. En una reciente revisión de Cherry32 se recogen todas estas posibles causas de fallos de la vacunación.
Otros factores que han contribuido al incremento de la incidencia del número de casos son el mayor índice de sospecha clínica (sobre todo en el adulto), la mejor vigilancia epidemiológica y de declaración de la enfermedad, y los avances en los métodos diagnósticos microbiológicos, de mayor sensibilidad y rentabilidad que el cultivo convencional, en especial la RT-PCR. En nuestra serie, la RT-PCR fue positiva prácticamente en todos los pacientes (99%) y el cultivo solo en el 47,7%, aunque en nuestro estudio se incluyen solo casos confirmados. No se han utilizado técnicas serológicas, ya que estas no son una prueba de rutina en nuestro centro. Clásicamente la serología se ha utilizado sobre todo en estudios de seroprevalencia e inmunogenicidad vacunal17, aunque trabajos recientes sugieren que el método más sensible para el diagnóstico de tos ferina es la combinación de la PCR con la serología33.
La gran proporción de niños bien vacunados en nuestra serie debe hacernos pensar en la posibilidad de que la menor efectividad vacunal se deba, más que a una disminución con el tiempo, a cambios antigénicos en la Bordetella circulante. Por otra parte, hay que destacar que casi el 38% estaban «bien vacunados» de acuerdo con la edad, con una o 2dosis en los lactantes de 2 a 5meses de edad o ninguna en los menores de 2meses. Para proteger a este grupo de pacientes «bien vacunados» para su edad se necesitan nuevas estrategias de vacunación basadas en protegerlos de la infección vacunando a sus posibles contactos.
La situación de riesgo que representa la tos ferina para el lactante pequeño, por su mayor gravedad y mortalidad, ha dado lugar, desde el año 2000, a la publicación de consensos y recomendaciones de distintas estrategias de vacunación con la finalidad de protegerlo34–39 del contagio a partir de convivientes domiciliarios, adolescentes y adultos, que casi siempre son el caso primario40,41. Las 3estrategias más recomendadas en esta última década son la vacunación sistemática del adolescente, la vacunación del adulto y la estrategia del nido (cocconing)38,42–44, es decir, la vacunación de los convivientes domiciliarios y no domiciliarios del lactante, que junto con otras posibles intervenciones preventivas se resumen en la tabla 2. La inmunización de la embarazada es la estrategia recomendada más recientemente38.
Nuevas estrategias de vacunación frente a la tos ferina
| • Vacunación sistemática del adolescente a los 11-12 años de edad: dTpa en lugar de dT |
| • Vacunación sistemática del adulto: dTpa en lugar de dT |
| • Estrategia del nido: precoz, al menos 15 días antes del contacto: |
| - Contactos domiciliarios familiares |
| - Contactos domiciliarios no familiares |
| - Estrategia ampliada: personal de guarderías y sanitario |
| • Vacunación de la embarazada entre la 27 y 36 semanas de gestación: |
| - Protección directa pasiva e indirecta del recién nacido |
| • Vacunación materna en el puerperio inmediato |
| • Vacunación pediátrica precoz: |
| - Neonatal: no hay vacunas monovalentes disponibles |
| - Lactante: vacunación precoz y rápida a las 6, 10 y 14 semanas de edad |
| • Vacunación con vacunas más efectivas y adaptadas a las cepas de B. pertussis circulantes: |
| - Vacuna monovalente para la embarazada, vacunas conjugadas y vivas atenuadas, nuevos adyuvantes y antígenos pertúsicos |
El objetivo primario de la vacunación sistemática del adolescente y del adulto con dTpa es la protección individual, y el secundario es disminuir el reservorio de B.pertussis en la comunidad y, con ello, la incidencia de tos ferina en otros grupos de edad, en especial en los lactantes menores de 6meses. La estrategia de vacunación frente a la tos ferina a partir de los 4-6años de edad, momento de la quinta y última dosis en los calendarios de inmunizaciones sistemáticas de España, creemos que debe proseguir con la vacuna dTpa en el adolescente. Solo las ciudades autónomas de Ceuta y Melilla han incluido una sexta dosis con vacuna dTpa a los 14años de edad, desde 2002 y 2008, respectivamente. La Comunidad de Madrid, a partir del 1 de junio de 2011, decidió sustituir la vacuna dT de los 14años de edad por la vacuna dTpa. El Comité Asesor de Vacunas de la Asociación Española de Pediatría incluyó la dosis del adolescente a los 13-16años de edad en el calendario de 2005, y a partir de 2012 en la franja de edad de 11 a 14años45. La inclusión de la vacuna dTpa en el calendario del adolescente es fácil y no tiene un coste elevado, ya que se trata de sustituir la vacuna dT. Esta estrategia está implantada en Australia, Canadá, Estados Unidos y varios países de Europa46.
Desde el primer consenso de vacunación frente a la tos ferina34 se ha destacado la importancia de la vacunación de los adultos, de forma prioritaria la de aquellos con más posibilidades de estar en contacto con lactantes, es decir, los padres, familiares y otros contactos domiciliarios, con la llamada estrategia del nido17,38,42,45,46. Aunque su impacto para la prevención de la tos ferina del lactante pequeño es evidente, existen una serie de limitaciones a tener en cuenta. Algunos trabajos recientes indican que para evitar una muerte es necesario vacunar por lo menos un millón de padres, y para evitar un ingreso hay que vacunar a más de 10.00047. Ciertos países que la han incorporado, como Estados Unidos y Francia, no han podido demostrar su impacto, ya que las coberturas vacunales alcanzadas han sido muy bajas. Una forma ampliada de esta estrategia es la que incluye al personal sanitario de áreas pediátricas y a los cuidadores de guarderías y de otras instituciones donde haya lactantes.
La vacunación del adulto con dTpa con dosis de recuerdo cada 10años, al igual que se hace con la difteria y el tétanos, es inmunógena y segura, como se ha demostrado en varios trabajos48,49, incluso en las personas mayores de 65años50. La ficha técnica de una de las especialidades farmacéuticas de esta vacuna recoge esta posibilidad de revacunar siguiendo las recomendaciones sanitarias, generalmente cada 10años51. La aplicación de esta estrategia en España actualmente es difícil, ya que la revacunación del adulto frente a la difteria y el tétanos no se recomienda con periodicidad decenal en la mayoría de comunidades.
La vacunación de la embarazada es la última estrategia recomendada, en octubre de 2011, para la protección del lactante pequeño38,52. La vacunación materna al final del segundo trimestre del embarazo, o durante el tercero, al igual que la vacuna antigripal, ofrece una doble protección al recién nacido: directa, por la transmisión pasiva de anticuerpos, e indirecta, mediante la estrategia del nido, que en este caso se realiza de manera precoz, antes del nacimiento. Más recientemente, el Advisory Committee on Immunization Practices de los Centers for Disease Control and Prevention de Estados Unidos, en su reunión de octubre de 2012, revisó y amplió esta recomendación a todas las embarazadas con independencia de sus antecedentes vacunales, incluyendo la vacunación en embarazos posteriores, y que se realice entre las semanas 27 y 36 de gestación53.
Un objetivo importante de futuro en la prevención de la tos ferina es la obtención de vacunas más efectivas, que se correspondan con las características antigénicas de las cepas circulantes de B.pertussis26–28,30,54.
Todas estas medidas ayudarán a un mejor control de la tos ferina, un reto importante en la prevención de una enfermedad infecciosa que se conoce desde hace siglos y que requiere el trabajo conjunto de muchos profesionales de la salud.
Conflicto de interesesFAML ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline y Sanofi Pasteur MSD, y como investigador en ensayos clínicos desarrollados por GlaxoSmithKline.
MCM ha colaborado en actividades docentes subvencionadas por GlaxoSmithKline y Sanofi Pasteur MSD, y como investigador en ensayos clínicos desarrollados por GlaxoSmithKline y Sanofi Pasteur MSD.
Al personal de los servicios de Pediatría, Microbiología y Medicina Preventiva y Epidemiología del Hospital Universitario Vall d’Hebron de Barcelona, por su colaboración en el estudio de los casos de este trabajo.