Analizar la utilidad y la capacidad de los biomarcadores (proteína C reactiva [PCR], región medial de la proadrenomedulina [MR-proADM], procalcitonina [PCT]) y lactato para pronosticar mortalidad a corto y medio plazo comparándolas con las escalas pronósticas de gravedad (EPG) habitualmente utilizadas en la neumonía adquirida en la comunidad (NAC) y para orientar la sospecha etiológica de Streptococcus pneumoniae y bacteriemia.
MétodosEstudio observacional, prospectivo y analítico de pacientes diagnosticados de NAC en un servicio de urgencias (SU). Se recogieron variables sociodemográficas, de comorbilidad, índice de Charlson, nivel de prioridad según el sistema español de triaje (SET), grados del Pneumonia Severity Index (PSI) y CURB-65 (acrónimo de confusión, urea, frecuencia respiratoria, presión arterial y edad ≥65 años), criterios de NAC grave, estudios microbiológicos, determinaciones analíticas y de los biomarcadores. Se realizó seguimiento durante 180días para calcular el poder pronóstico de mortalidad y el rendimiento diagnóstico de bacteriemia y etiológico.
ResultadosSe incluyeron 127pacientes. La mortalidad a los 30días fue del 10,3% (13) y a los 180 días de 22,6% (28). Los hemocultivos fueron positivos en 29casos (23%) y se diagnosticó S.pneumoniae como patógeno causante en 28 (22,2%). El lactato y la MR-proADM consiguen un área bajo la curva ROC (ABC-ROC) para predecir mortalidad a los 30días de 0,898 (IC95%: 0,824-0,973; p<0,0001) y de 0,892 (IC95%: 0,811-0,974; p<0,0001), respectivamente, y la MR-proADM, de 0,921 (IC95%: 0,874-0,968; p<0,0001) a los 180días. Para la predicción de bacteriemia la PCT obtiene un ABC-ROC de 0,952 (IC95%: 0,898-1; p<0,0001) y con un punto de corte PCT ≥0,95ng/ml, un valor predictivo negativo (VPN) del 97,8% y coeficiente de probabilidad positivo (CP+) de 9,03. Para predecir etiología por S.pneumoniae una PCT>0,85ng/ml obtiene un valor VPN del 96,6% y CP+ de 5,89.
ConclusionesEn los pacientes con NAC la MR-proADM y el lactato presentan una capacidad pronóstica de mortalidad intrahospitalaria a los 30días similar o superior al PSI, CURB-65, SET y criterios de NAC grave (p>0,05), mientras que para la predicción de mortalidad a 180días la MR-proADM es superior a las EPG y al resto de biomarcadores (p<0,05), y aumenta su ABC al combinarla con el PSI, CURB-65 y SET. Por otro lado, la PCT consigue un gran rendimiento diagnóstico para descartar bacteriemia y orientar la etiología por S.pneumoniae.
To analyse the usefulness and performance of several biomarkers [C-reactive protein (CRP), mid-regional pro-adrenomedullin (MR-proADM), procalcitonin (PCT)] and lactate in predicting short- and medium-term mortality compared with the prognostic severity scales (PSS) usually employed for community-acquired pneumonia (CAP) and in assessing the aetiological suspicion of infection by Streptococcus pneumoniae and bacteraemia.
MethodsObservational, prospective and analytical study was conducted on patients who were diagnosed with CAP in our emergency department (ED). The data collected included socio-demographic and comorbidity variables, Charlson index, priority level according to the Spanish Triage System (STS), stage in the Pneumonia Severity Index (PSI) and in the CURB-65 (confusion, urea, respiratory rate, blood pressure and age ≥65years), criteria of severe CAP, microbiological studies, and biomarkers determinations. The patients were followed-up for 180days to calculate the prognostic power and the diagnostic performance for bacteraemia and aetiology.
ResultsA total of 127patients were finally enrolled in the study. The 30-day mortality was 10.3% (13), and 22.6% (28) at 180 days. Blood cultures were positive in 29 patients (23%) and S.pneumoniae was identified as the responsible pathogen in 28 cases (22.2%). The area under the ROC curve (AUC-ROC) for lactate and MR-proADM to predict 30-day mortality was 0.898 (95%CI: 0.824-0.973; P<.0001) and 0.892 (95%CI: 0.811-0.974; P<.0001), respectively, and for MR-proADM at 180 days it was 0.921 (95%CI: 0.874-0.968; P<.0001). The AUC-ROC for PCT to predict bacteraemia was 0.952 (95%CI: 0.898-1.000; P<.0001) and, considering a cut-off value ≥0.95ng/ml, the negative predictive value (NPV) and the likelihood ratio (LR+) were 97.8% and 9.03, respectively. Using a PCT cut-off value >0.85ng/ml, the NPV and the LR+ were 96.6% and 5.89%, respectively, to predict a S.pneumoniae infection.
ConclusionsMR-proADM and lactate showed a similar or even better performance for 30-day intra-hospital mortality than PSI, CURB-65, STS and CAP severity criteria in patients diagnosed with CAP (P>.05). Furthermore, the MR-proADM capacity to predict 180-day mortality was higher than PSS and the rest of biomarkers (P>.05), and its AUC-ROC increased if it was used in combination with PSI, CURB65 and STS. The determination of PCT has a remarkable diagnostic performance to rule out bacteraemia and to orientate the aetiology towards a S.pneumoniae infection.
La neumonía adquirida en la comunidad (NAC) representa la principal causa de muerte por enfermedad infecciosa en los países occidentales (10-14%) y es el origen de la mayoría de sepsis graves (SG) y shock sépticos (SS) que se atienden en los servicios de urgencias (SU)1-3. Existe gran variabilidad en el manejo de todos los aspectos diagnóstico-terapéuticos de los pacientes con NAC, lo que constituye una de las razones que explican la existencia de diferencias llamativas en las tasas de ingreso (22-61%), la consecución de diagnóstico microbiológico, la solicitud de estudios complementarios, la elección de la pauta antimicrobiana o la intensidad de cuidados ofrecida4,5. El 75% de todas las NAC son atendidas en los SU en algún momento de su evolución1-3, de ahí el importante papel del médico de urgencias (MU) en el manejo inicial de estos procesos, hecho que podrá marcar su evolución y su morbimortalidad6. De las decisiones más importantes que debe tomar el MU, determinar la necesidad de ingreso del paciente, su ubicación adecuada y los cuidados que se precisan van a condicionar tanto el pronóstico (morbimortalidad) como la decisión de solicitud de pruebas de laboratorio, los estudios microbiológicos, la elección de la pauta antimicrobiana inicial o la intensidad de la observación clínica, que constituyen los factores más determinantes en la evolución y en la mortalidad de estos pacientes7,8.
En la búsqueda de herramientas objetivas de ayuda para el clínico para intentar establecer el diagnóstico precoz, el pronóstico, la gravedad, la sospecha de bacteriemia y la posible etiología bacteriana de la NAC, últimamente se han publicado estudios y revisiones que señalan la utilidad de los biomarcadores de respuesta inflamatoria e infección (BMRII) en los SU9-13 y especialmente en la NAC14-22, que han incluido, entre otros, a la proteína C reactiva (PCR), las interleucinas (IL) 6 y 8, la proendotelina-1, la copeptina, el dímeroD, el pro-péptido atrial natriurético (proANP), etc. Pero entre ellos destacan la región medial de la pro-adrenomedulina (MR-proADM)10,11,20,23-28, con resultados comparables a las escalas pronósticas de gravedad (EPG) en cuanto a la estimación de mortalidad a los 28-30, 90, 180 y 365días, y la procalcitonina (PCT), muy sensible y específica para predecir infección bacteriana y poder orientar hacia el patógeno causante de la NAC29-31, su evolución clínica (a SG-SS)32,33, la posibilidad de bacteriemia18,19, la mortalidad34,35 y para servir de guía del tratamiento antibiótico (AB) en la NAC11,36. El lactato, considerado el mejor marcador de hipoperfusión e hipoxia tisular, está incluido en todas las recomendaciones de valoración de los pacientes con SG y SS en los SU37,38. Sus valores >2,5mmol/l deben ser estrechamente vigilados y monitorizados clínicamente al ser un predictor independiente de gravedad (SG-SS), mala evolución clínica y mortalidad11. La PCR plantea bastantes limitaciones en su capacidad diagnóstica (de infección bacteriana, sepsis, SG-SS) y pronóstica (bacteriemia, mortalidad)10. La PCT es una proteína sintetizada primordialmente en la glándula tiroides y las células neuroendocrinas del pulmón, pero muchos otros tejidos pueden producir PCT en situaciones de infección bacteriana y sepsis y sus niveles tienen relación con la carga bacteriana y/o la concentración de endotoxina11. Como nuevo BMRII, desde hace unos años se utiliza la MR-proADM. Dado que la medición de adrenomedulina (ADM) es difícil (vida media corta y gran unión a receptores), se utiliza la MR-proADM, que tiene más estabilidad26. Su concentración aumenta en las situaciones de estrés celular y es reconocida como BMRII. La MR-proADM se ha mostrado superior respecto a la PCT en la capacidad predictiva de mortalidad a corto (7-30días) y medio plazo (90-180días), e incluso en estudios con seguimiento de un año7,10,23,25.
En cuanto a la orientación etiológica, se encuentra mayor inflamación sistémica y niveles más elevados de BMRII en las NAC con bacteriemia por Streptococcus pneumoniae que progresan a SG o SS. Este patógeno hay que sospecharlo si la PCT es >1-2ng/ml, y en esta situación habría que plantear el cubrir empíricamente la posibilidad de una NAC bacteriémica19,22,29,39.
Respecto a la valoración pronóstica de la NAC, la combinación de los BMRII (PCR, MRproADM o PCT) con las EPG ha demostrado aumentar la capacidad predictiva de estas y ser la asociación con mayor poder pronóstico por encima de cualquier estimación individual de una EPG o un BMRII15,25,28, por lo que si están disponibles en los SU podrían mejorar la adecuación de los ingresos en la NAC7, pero no debe olvidarse considerar si el paciente ha recibido tratamiento AB previamente, ya que los niveles de PCT, PCR y leucocitos se modifican y alteran su capacidad predictiva en pacientes que los recibieron en las 72h anteriores10.
Los objetivos de este trabajo fueron analizar y comparar la posible utilidad y capacidad predictiva de gravedad, mortalidad a corto y medio plazo, bacteriemia y posible etiología bacteriana (especialmente S.pneumoniae) en la NAC de algunos de los BMRII más utilizados y prometedores en los SU [PCR, MR-proADM, PCT, lactato] junto a otros parámetros analíticos, EPG y al sistema español de triaje (SET).
Pacientes y métodoSitio del estudioEl estudio se realizó en el Complejo Hospitalario de Toledo, un centro de tercer nivel de 780camas perteneciente al Servicio de Salud de Castilla-La Mancha (SESCAM) y con un área de referencia de 437.000personas.
Diseño del estudioEstudio observacional, prospectivo y analítico de pacientes diagnosticados de NAC en un SU. Se realizó un seguimiento del paciente durante 180días.
Periodos del estudio y población estudiadaDesde diciembre de 2011 hasta mayo de 2012 se incluyó de forma consecutiva a los pacientes adultos (≥14 años) diagnosticados de NAC en el SU. Se definió NAC ante la existencia de una clínica aguda compatible (tos, disnea, fiebre, dolor torácico pleurítico, alteración del nivel de consciencia, etc.) y su demostración radiológica (presencia de infiltrado/s pulmonar/es no conocidos previamente). Se excluyó a los pacientes inmunodeprimidos (con infección por el virus de la inmunodeficiencia humana, pacientes con trasplante de víscera sólida, esplenectomía, tratados con 10mg o más de prednisona al día o equivalentes durante más de 30días, o tratados con otros agentes inmunodepresores en el último año), los hospitalizados en los 30días previos, los pacientes con otro diagnóstico agudo cardiovascular o pleuropulmonar simultáneo con el de NAC, los que tuvieron un diagnóstico final de tuberculosis o absceso de pulmón y a los que no se mantuvo el diagnóstico de NAC o se cambió durante el tiempo que duró el estudio. Tampoco se incluyó en el estudio a los pacientes que fueron diagnosticados de un segundo episodio de NAC durante el periodo del mismo. El estudio cumplía las normas éticas de nuestro hospital y fue aprobado por el Comité Ético de Investigación Clínica de nuestro centro. Todos los datos codificados se manejaron con confidencialidad y con el único conocimiento del equipo investigador. El seguimiento de todos los pacientes se realizó a través de la historia clínica informatizada del SU, hospitalaria y de atención primaria y con contacto telefónico previo consentimiento cuando fue necesario confirmar algún dato de seguimiento. El estudio no supuso ninguna intervención terapéutica ni tuvo ninguna implicación clínica.
Variables recogidasEn todos los pacientes se realizó el protocolo de estudio establecido que incluía el cálculo del valor o grado y la recogida de todas las variables sociodemográficas, clínicas, exploratorias, analíticas y radiológicas incluidas en el Pneumonia Severity Index (PSI)40, en la escala CURB-65 (acrónimo de confusión, urea, frecuencia respiratoria, presión arterial y edad ≥65 años)41, en los criterios de ingreso en la unidad de cuidados intensivos (UCI) y NAC grave (NACG) del año 2007 de Infectious Diseases Society of America/American Thoracic Society (IDSA/ATS)3 y en los criterios de definición de sepsis, SG y SS según la conferencia de expertos de sepsis de 200142. Se calculó el valor del índice de Charlson43 original y ponderado por la edad y el nivel de prioridad y clasificación en el SU según el SET44 (sistema estructurado de priorización de la asistencia en el SU según estimación de gravedad clínica en el momento de la valoración del paciente). A estas variables se añadieron: la toma de tratamiento antimicrobiano previo (durante las 72h antes de su consulta en el SU), ser fumador, el número de comorbilidades incluyendo las recogidas en el PSI más diabetes y de enfermedad pulmonar obstructiva crónica (EPOC), tiempo de sintomatología previa, el tratamiento con oxígeno crónico domiciliario, el registro de pulsioximetría (saturación de O2), la solicitud y valores de PCR, PCT, lactato, recuento de leucocitos y proporción de cayados. Se reservó parte del plasma para la posterior determinación de la MR-proADM. Los estudios microbiológicos fueron sistemáticamente realizados (hemocultivos, antigenuria en orina, cultivo de esputo, serologías para virus y bacterias (segunda muestra a los 30días) y diagnóstico directo de virus (estos últimos ante la sospecha clínica). La mortalidad en los ingresados en planta y en la UCI y la global a los 30días (corto plazo) y a los 180días (medio plazo) se consideraron como las variables primarias, y como variables de resultado secundarias se incluyeron: tiempos de estabilización clínica según los criterios de Halm45 y de estancia hospitalaria, consecución de diagnóstico microbiológico y patógenos confirmados, existencia de bacteriemia, antigenuria positiva, destino del paciente (alta, observación, unidad de corta estancia, planta, UCI o fallecimiento en el SU).
Definiciones, técnicas y métodos establecidos para las muestrasSe definió como NACG y su necesidad de valoración por UCI cuando los pacientes cumplían un criterio mayor o 3 menores según la normativa IDSA/ATS de 20073. Para valorar el pronóstico de los pacientes con NAC y la decisión de ingreso se utilizó el PSI o índice de gravedad de la neumonía (IGN), cuyas clases de riesgo se crearon de acuerdo con las propuestas de los autores originales40. La priorización de la asistencia de los pacientes en el SU se realizó por el SET44 que clasifica a los pacientes en 5 niveles (i: prioridad absoluta con atención inmediata, ii: situaciones muy urgentes de riesgo vital o inestabilidad, iii: urgente pero estable hemodinámicamente con potencial riesgo vital que probablemente exige pruebas diagnósticas y/o terapéuticas, iv: urgencia menor, potencialmente sin riesgo vital para el paciente, y v: no urgencia). Las técnicas y métodos utilizados en las muestras se describen en la tabla 1.
Métodos y técnicas aplicadas en el procesamiento de las muestras
| PCR | Valores de referencia de nuestro laboratorio: PCR: 0-8mg/l. Método de determinación: inmunoanálisis enzimático cuantitativo (Slides VITROS CRP®). Sensibilidad: 1mg/l |
| PCT | Valores de referencia: <0,5ng/ml. Método: inmunoanálisis cuantitativo de electroquimioluminiscencia ELECSYS (BRAHMS PCT®). Sensibilidad: 0,02ng/ml |
| Lactato | Gasometría arterial y venosa (sangre total), valores de referencia: 5-20mg/dl (0,55-2,22mmol/l). Determinación por amperometría (electrodo selectivo). Sensibilidad: 0,3mmol/l |
| MR-proADM | Valores de referencia (mediana): <0,39nmol/l. Percentil 97,5%: <0,55nmol/l. Método inmunoanálisis de fluorescencia (TRACE) en muestras de plasma-EDTA (Kryptor, BRAHMS AG®, Hennigsdorf, Alemania) de valoración cuantitativa. Sensibilidad: 0,05nmol/l. Los reactivos para el presente estudio fueron suministrados por Thermo Scientific (BRAHMS Iberia S.L.). |
| Hemocultivos | Dos frascos aeróbicos y 2 anaerobios (BD BACTEC®) procesados mediante el sistema automático Bactec/Alert® (BioMérieux, Durham, N.C.) |
| Antigenuria para neumococo | Método de inmunocromatografía de membrana (Binax NOW®) |
| Antigenuria paraLegionella | Método de inmunocromatografía de membrana (Binax NOW®). Legionella pneumophila serogrupo 1 |
| Esputo | Cultivo con siembra directa cuando fueron adecuados (Legionella: inmunofluorescencia directa Ag. Legionella pneumophila) |
| Diagnóstico directo virus | -Pruebas de detección de antígeno en muestras respiratorias (exudado nasofaríngeo, aspirado nasofaríngeo, lavado broncoalveolar, aspirado bronquial): método inmunocromatografía para antígenos de virus respiratorio sincitial y virus influenza A y B-Pruebas de detección genómica en muestras respiratorias (exudado nasofaríngeo, aspirado nasofaríngeo, lavado broncoalveolar, aspirado bronquial). Método PCR tiempo real: ARN virus respiratorio sincitial, ARN virus influenza A y B, ADN citomegalovirus |
| Diagnóstico indirecto (serología) virus y bacterias | -Enzimoinmunoanálisis (EIA): anticuerpos IgM e IgG anti Clamydophila pneumoniae, anti Mycoplasma pneumoniae y anti citomegalovirus |
| -Inmunofluorescencia indirecta (IFI): anticuerpos IgG anti Legionella pneumophila serogrupos 1-6 | |
| -Fijación de complemento: anticuerpos totales anti virus respiratorio sincitial, anti virus influenza A, anti virus influenza B, anti virus parainfluenza y anti adenovirus |
MR-proADM: región medial de la pro-adrenomedulina; PCR: proteína C reactiva; PCT: procalcitonina.
Se utilizaron medias y sus desviaciones estándar (DE), rangos, medianas y porcentajes, según procediera, para describir las características demográficas, comorbilidades, clínicas y radiológicas. Además, para la estimación de los valores poblacionales se calcularon los límites de los intervalos de confianza (IC) al 95% de medias y porcentajes (binomiales exactos, en este caso). Para la comparación de la distribución de los biomarcadores, lactato y recuento de leucocitos entre los grupos formados según el PSI (i-iii frente a iv-v), la presencia o ausencia de bacteriemia, la etiología (neumococo frente al resto de patógenos), la existencia o no de SG y SS y la toma de AB previo se utilizaron las pruebas de ji al cuadrado o exacta de Fisher, la t de Student y la U de Mann-Whitney, según fueran aplicables. Se consideró como significativo un valor de p<0,05 y todos los contrastes fueron bilaterales. La eficacia de los distintos biomarcadores para el diagnóstico de bacteriemia y del S.pneumoniae como patógeno causal, y para la predicción de mortalidad intrahospitalaria, a los 30 y 180días se estudió mediante el análisis de las curvas ROC (receiver operating characteristic). Así, para la estimación del rendimiento diagnóstico poblacional se calculó el IC95% del área bajo la curva (ABC) de la curva ROC de cada marcador y se comparó frente al valor neutro (0,5). Los errores estándar de las ABC se calcularon por métodos no paramétricos. Además, se comparó la ABC-ROC del biomarcador con mayor rendimiento diagnóstico en cada uno de los resultados estudiados con las ABC del resto de BMRII mediante el método descrito por Hanley y McNeil46. Se determinaron los puntos de corte en los valores de los BMRII con mayor capacidad diagnóstica que maximizaba la diferencia entre la tasa de verdaderos positivos (VP) y falsos positivos (FP) mediante el índice de Youden. Se halló la sensibilidad (S), la especificidad (E), el valor predictivo positivo (VPP) y el valor predictivo negativo (VPN), el coeficiente de probabilidad positivo (CP+) y negativo (CP–) para cada resultado estudiado así como sus IC95% por métodos binomiales exactos y por el de Taylor para los CP. Para el estudio de la capacidad predictiva de mortalidad a los 30 y 180días de las combinaciones de la MR-proADM con las escalas PSI, CURB-65 y SET se elaboró un modelo de ajuste por regresión logística diferenciado en las variables independientes (MR-proADM y PSI, MR-proADM y CURB-65 y MR-proADM y SET). Las probabilidades así calculadas fueron sometidas a un análisis de curvas ROC y a los mismos procedimientos que los marcadores individuales. Para medir la correlación entre variables se usó el coeficiente de correlación de Pearson. El análisis estadístico se realizó con el programa SPSS 11 para Windows, MS-Excel y la calculadora para pruebas diagnósticas realizada elaborada por J. Zamora y V. Abraira, de la unidad de bioestadística del Hospital Ramón y Cajal (disponible en: http://www.hrc.es/investigacion/diag/herramientas.htm#soft).
ResultadosDurante los meses que duró el estudio se atendieron 465urgencias/día y la incidencia de la NAC en pacientes ≥14 años supuso el 0,96% de todos los enfermos vistos en el SU (3,5casos/1.000habitantes/año). Se incluyeron 165pacientes consecutivos que cumplían los criterios de inclusión, de los cuales 39 (23,6%) fueron excluidos durante el ingreso o el seguimiento por no confirmarse el diagnóstico de NAC o asociarse este a otros diagnósticos cardiovasculares agudos (no considerados como complicaciones de la propia NAC) que podrían interferir en los niveles de biomarcadores. Así, un total de 127pacientes se incorporaron al estudio. La edad media fue de 65,80±20,02años, y 74 de ellos eran hombres (58,3%).
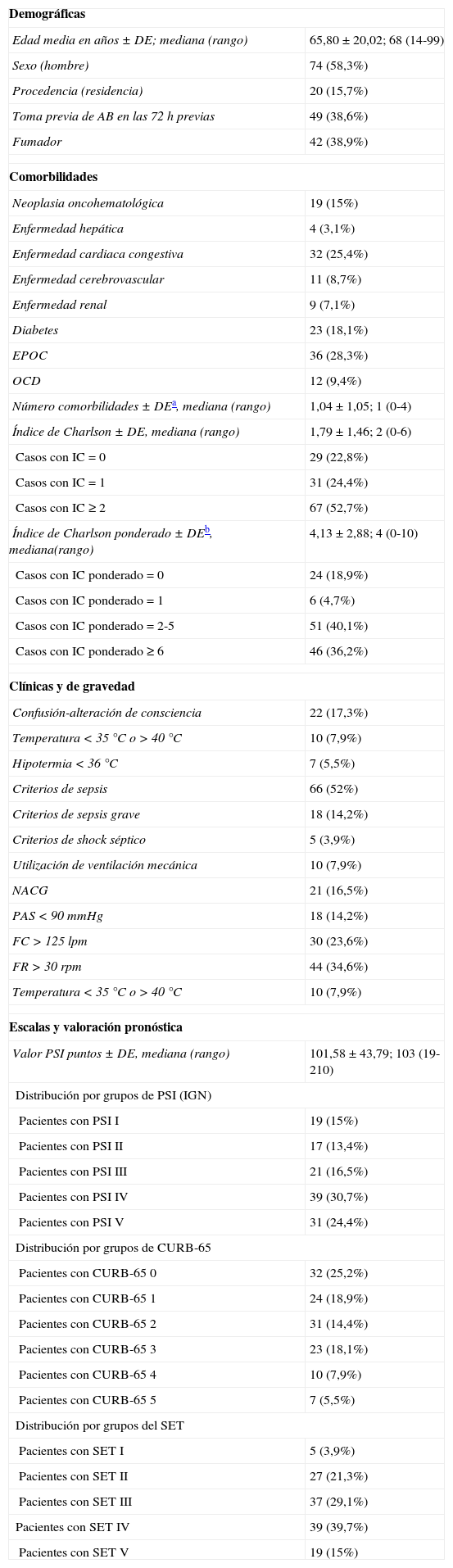
Las características sociodemográficas, clínicas y de gravedad, las comorbilidades (y el cálculo del índice de Charlson original y ponderado) y la distribución de los pacientes según la clasificación del PSI, escala CURB-65 y SET de todos los enfermos del estudio se muestran en la tabla 2.
Características sociodemográficas y clínicas de los pacientes con NAC (n=127)
| Demográficas | |
| Edad media en años±DE; mediana (rango) | 65,80±20,02; 68 (14-99) |
| Sexo (hombre) | 74 (58,3%) |
| Procedencia (residencia) | 20 (15,7%) |
| Toma previa de AB en las 72h previas | 49 (38,6%) |
| Fumador | 42 (38,9%) |
| Comorbilidades | |
| Neoplasia oncohematológica | 19 (15%) |
| Enfermedad hepática | 4 (3,1%) |
| Enfermedad cardiaca congestiva | 32 (25,4%) |
| Enfermedad cerebrovascular | 11 (8,7%) |
| Enfermedad renal | 9 (7,1%) |
| Diabetes | 23 (18,1%) |
| EPOC | 36 (28,3%) |
| OCD | 12 (9,4%) |
| Número comorbilidades±DEa, mediana (rango) | 1,04±1,05; 1 (0-4) |
| Índice de Charlson±DE, mediana (rango) | 1,79±1,46; 2 (0-6) |
| Casos con IC = 0 | 29 (22,8%) |
| Casos con IC = 1 | 31 (24,4%) |
| Casos con IC ≥ 2 | 67 (52,7%) |
| Índice de Charlson ponderado±DEb, mediana(rango) | 4,13±2,88; 4 (0-10) |
| Casos con IC ponderado=0 | 24 (18,9%) |
| Casos con IC ponderado=1 | 6 (4,7%) |
| Casos con IC ponderado=2-5 | 51 (40,1%) |
| Casos con IC ponderado ≥ 6 | 46 (36,2%) |
| Clínicas y de gravedad | |
| Confusión-alteración de consciencia | 22 (17,3%) |
| Temperatura <35°C o >40°C | 10 (7,9%) |
| Hipotermia <36°C | 7 (5,5%) |
| Criterios de sepsis | 66 (52%) |
| Criterios de sepsis grave | 18 (14,2%) |
| Criterios de shock séptico | 5 (3,9%) |
| Utilización de ventilación mecánica | 10 (7,9%) |
| NACG | 21 (16,5%) |
| PAS<90mmHg | 18 (14,2%) |
| FC>125 lpm | 30 (23,6%) |
| FR>30rpm | 44 (34,6%) |
| Temperatura <35°C o >40°C | 10 (7,9%) |
| Escalas y valoración pronóstica | |
| Valor PSI puntos±DE, mediana (rango) | 101,58±43,79; 103 (19-210) |
| Distribución por grupos de PSI (IGN) | |
| Pacientes con PSI I | 19 (15%) |
| Pacientes con PSI II | 17 (13,4%) |
| Pacientes con PSI III | 21 (16,5%) |
| Pacientes con PSI IV | 39 (30,7%) |
| Pacientes con PSI V | 31 (24,4%) |
| Distribución por grupos de CURB-65 | |
| Pacientes con CURB-65 0 | 32 (25,2%) |
| Pacientes con CURB-65 1 | 24 (18,9%) |
| Pacientes con CURB-65 2 | 31 (14,4%) |
| Pacientes con CURB-65 3 | 23 (18,1%) |
| Pacientes con CURB-65 4 | 10 (7,9%) |
| Pacientes con CURB-65 5 | 7 (5,5%) |
| Distribución por grupos del SET | |
| Pacientes con SET I | 5 (3,9%) |
| Pacientes con SET II | 27 (21,3%) |
| Pacientes con SET III | 37 (29,1%) |
| Pacientes con SET IV | 39 (39,7%) |
| Pacientes con SET V | 19 (15%) |
AB: antibiótico; CURB-65: acrónimo de confusión, urea ≥7mol/l, FR≥30, PAS<90mmHg o diastólica <60mmHg y edad ≥65 años; DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica; FC: frecuencia cardiaca; FR: frecuencia respiratoria; IC: índice de Charlson; IGN: índice de gravedad de la neumonía; NAC: neumonía adquirida en la comunidad; NACG: neumonía adquirida en la comunidad grave; OCD: oxígeno crónico domiciliario; PAS: presión arterial sistólica; PSI: Pneumonia Severity Index; SET: Sistema Español de Triaje.
Los porcentajes excluyen los datos perdidos si los hubiere.
Las características radiológicas, gasométricas, hallazgos de laboratorio y valores de los BMRII (PCR, PCT y MR-proADM) y lactato (valores globales y por grupos de gravedad estimada según el PSI) se muestran en la tabla 3. El número de leucocitos, una proporción de >10% de cayados y la PCR no se relacionaron significativamente con los niveles del PSI (p>0,05), pero sí existieron diferencias significativas entre grupos de PSI I-III y PSI IV-V en los valores medios de PCT (p=0,001), lactato (p<0,001) y MR-proADM (p<0,001).
Características radiológicas, gasométricas y hallazgos de laboratorio en los pacientes con NAC (n=127)
| Radiológicas y gasométricas | |
| Infiltrado unilobar/multilobar/bilateral [n (%)] | 87/27/13 (68,5-21,3-10,2%) |
| Derrame pleural | 25 (19,7%) |
| pH arterial<7,35 | 15 (12,7%) |
| PO2/FiO2<250 | 15 (12,2%) |
| PO2<60mmHg o SatO2<90mmHg | 59 (48%) |
| Hallazgos de laboratorio | |
| Urea>45mg/dl | 60 (47,2%) |
| Urea>64mg/dl o Cr>1,5mg/dl | 24 (18,9%) |
| Sodio<130mEq/l | 8 (6,3%) |
| Glucemia>250mg/dl | 9 (7,1%) |
| Hematocrito<30% | 17 (13,4%) |
| Leucocitosis >12.000/mm3 o >10% cayados | 66 (52%) |
| Leucopenia<4.000/mm3 | 7 (5,5%) |
| Trombocitopenia<100.000/mm3 | 7 (5,5%) |
| Bacteriemia confirmada | 29 (23%) |
| Antigenuria positiva | 25 (19,8%) |
| Número de plaquetas±DE, mediana (rango) | 226.817,32±104.367,34; 206.000 (78.000-832.000) |
| Pacientes PSI I-III | Pacientes PSI IV-V | Valor p | |
| Recuento de leucocitos y niveles de biomarcadores según IGN o PSI (I-III y IV-V) | |||
| Número de leucocitosa (mm3)±DE, mediana (rango)13.068,50±6.903,32; 12.400 (600-50.900) | 12.523,21±5.093,16 | 13.488,57±8.118,35 | 0,951 |
| Recuento>10% de cayadosa (bandas) n (%)22 (17,32%) | 6 (10,7%) | 16 (22,9%) | 0,076 |
| Lactatoa (mmol/l)±DE, mediana (rango)1,33±1,05; 1,32 (0,55-4,66) | 1,18±0,78 | 2,03±1,08 | <0,001 |
| Niveles PCRa (mg/l)±DE, mediana (rango)80,73±47,13; 88,50 (7-354) | 74,16±44,37 | 86,33±49,17 | 0,087 |
| Niveles PCTa (ng/ml)±DE, mediana (rango)4,11±14,72; 0,26 (0,02-100) | 3,07±12,14 | 5±16,63 | 0,001 |
| Niveles MR-proADMa (nmol/l)±DE, mediana (rango) 1,6825±1,8904 (0,0500-15,9700) 1,1710 | 0,889±0,640 | 2,320±2,296 | <0,001 |
DE: desviación estándar; IGN: índice de gravedad de la neumonía; MR-proADM: región medial de la pro-adrenomedulina NAC: neumonía adquirida en la comunidad; PCR: proteína C reactiva; PCT: procalcitonina; PSI: Pneumonia Severity Index.
Los porcentajes excluyen los datos perdidos si los hubiere.
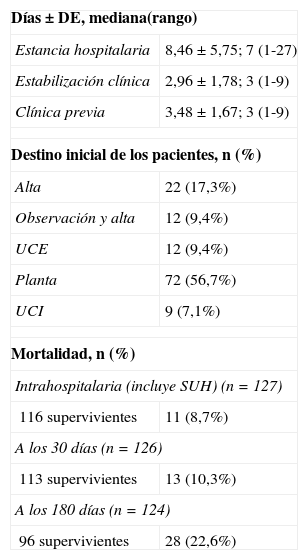
La mortalidad global intrahospitalaria fue del 8,3% (11), a los 30 días fue del 10,3% (13) y a los 180 días de 22,6% (28). El destino inicial de los pacientes desde el SU, los tiempos de estancia hospitalaria y de estabilización clínica se describen en la tabla 4.
Características de evolución y destino en los pacientes con NAC (n=127)
| Días±DE, mediana(rango) | |
| Estancia hospitalaria | 8,46 ± 5,75; 7 (1-27) |
| Estabilización clínica | 2,96 ± 1,78; 3 (1-9) |
| Clínica previa | 3,48 ± 1,67; 3 (1-9) |
| Destino inicial de los pacientes, n (%) | |
| Alta | 22 (17,3%) |
| Observación y alta | 12 (9,4%) |
| UCE | 12 (9,4%) |
| Planta | 72 (56,7%) |
| UCI | 9 (7,1%) |
| Mortalidad, n (%) | |
| Intrahospitalaria (incluye SUH) (n=127) | |
| 116 supervivientes | 11 (8,7%) |
| A los 30 días (n=126) | |
| 113 supervivientes | 13 (10,3%) |
| A los 180 días (n=124) | |
| 96 supervivientes | 28 (22,6%) |
DE: desviación estándar; NAC: neumonía adquirida en la comunidad; SUH: servicio de urgencias hospitalario; UCE: unidad de corta estancia; UCI: unidad de cuidados intensivos.
Los porcentajes excluyen los datos perdidos si los hubiere.
La identificación del patógeno causante de la NAC se realizó en 60 casos (46,8%), con la siguiente distribución: S.pneumoniae 24 (19%), Legionella sp. 6 (4,8%), Mycoplasma pneumoniae 4 (3,2%), Chlamydophila pneumoniae 4 (3,2%), Enterobacteriaceae sp. 4 (3,2%), Pseudomonas sp. 3 (2,4%), Haemophilus influenzae 2 (1,6%), Staphylococcus aureus 2 (1,6%), Moraxella catarrhalis 1 (0,8%), virales 5 (4%) y 4 mixtas (S.pneumoniae más virus o atípicas) (3,2%). En un caso se perdieron las muestras microbiológicas. De los 126hemocultivos realizados fueron positivos 29 (23%), en 23 de ellos (79,3%) se aisló S.pneumoniae, y de las 126muestras en orina, en 25 (19,8%) se obtuvo una antigenuria positiva: 20 para neumococo (80%) y 5 para Legionella (20%). En 12 de los 45cultivos de esputo sembrados se consiguió el diagnóstico microbiológico. Se procesaron 96muestras serológicas para virus y bacterias atípicas, resultando positivas 13, y el diagnóstico directo de virus influenza se realizó en 4ocasiones.
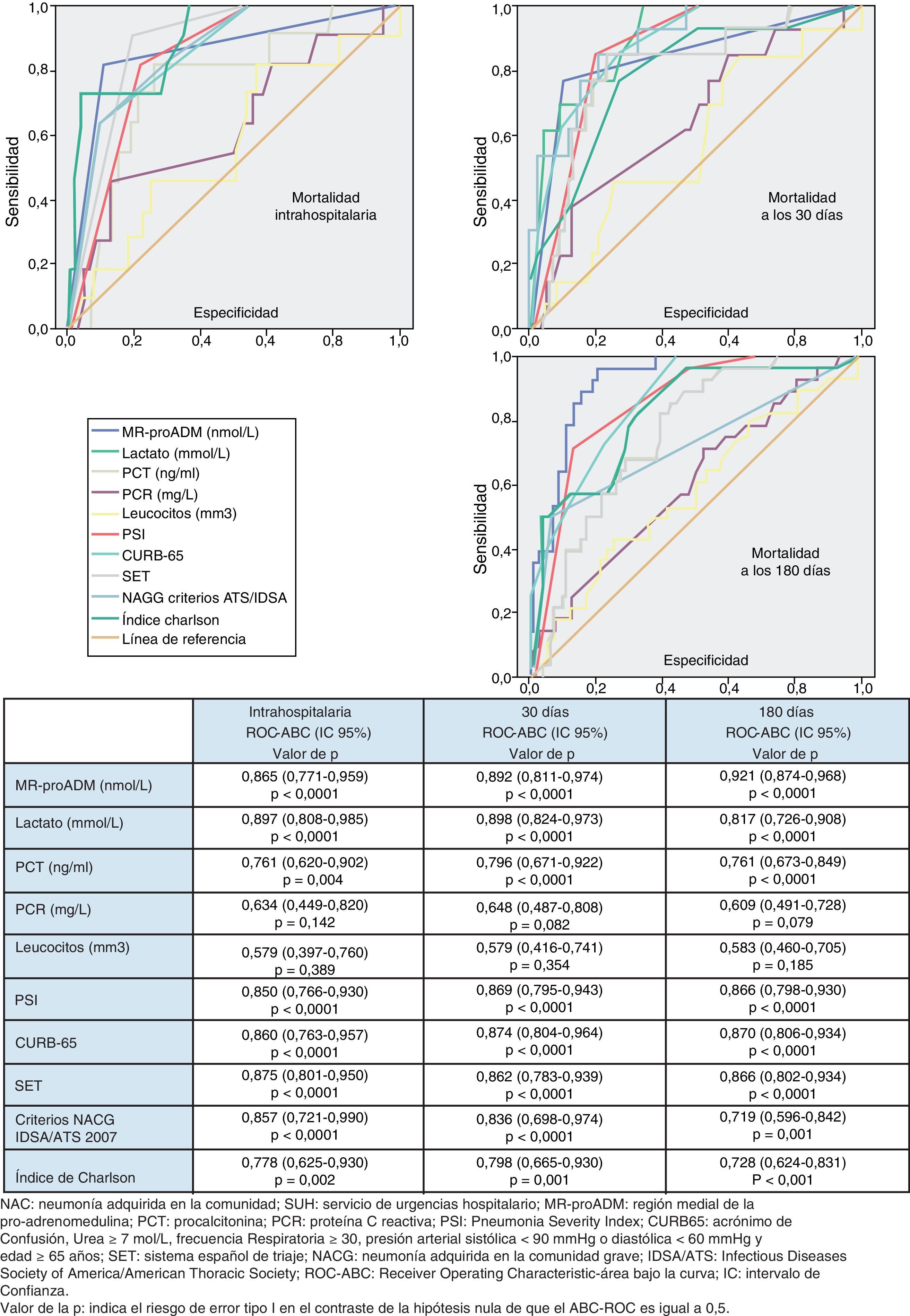
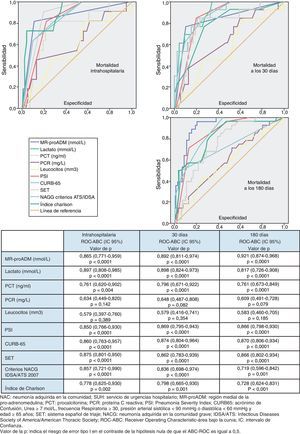
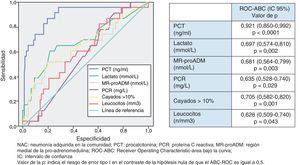
Utilidad y capacidad de los biomarcadores para pronosticar mortalidad y su rendimiento diagnósticoEn la figura 1 se describen los valores de ABC-curvas ROC de los BMRII (MR-proADM, PCT, PCR), lactato, recuento de leucocitos, PSI, CURB-65, SET, criterios NACG y del índice de Charlson para la capacidad de predicción de mortalidad intrahospitalaria a los 30 y 180días.
Para la predicción de mortalidad intrahospitalaria (en el SU o hasta el alta), tanto el lactato como la MR-proADM son los BMRII que consiguen los mejores resultados y superan ligeramente a la capacidad predictiva de mortalidad del PSI, CURB-65, SET o criterios de NACG. No existen diferencias significativas (p>0,05 en todos los casos) entre el ABC-ROC del lactato y las de MR-proADM, PSI, CURB-65, criterios NACG y SET. En cuanto a las escalas pronósticas, el SET consigue mejor ABC que el PSI, CURB-65 y criterios de NACG (p>0,05). La PCR, PCT y el recuento de leucocitos muestran menor capacidad predictiva que el lactato y MR-proADM. El índice de Charlson es menor que el resto de EPG y el SET (p>0,05).
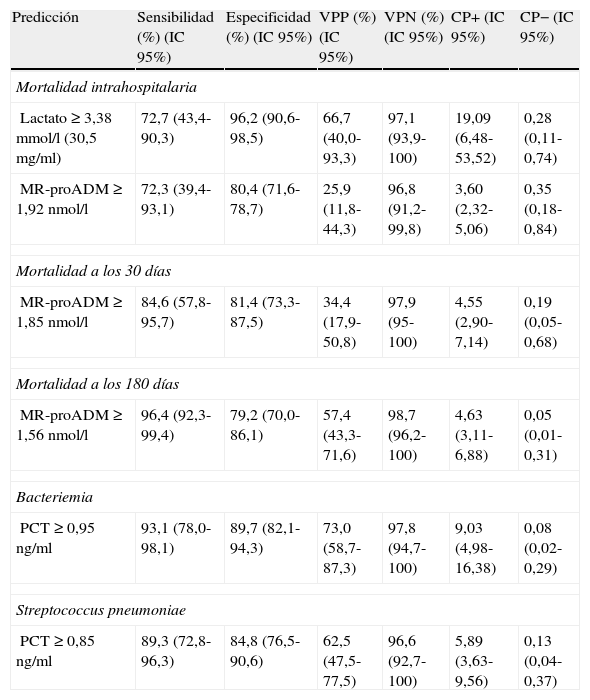
Para el lactato, el punto de corte (PC) con mayor capacidad diagnóstica encontrado fue de 3,38mmol/l (30,5mg/dl), y para la MR-proADM, de 1,92nmol/l (todos los valores de los rendimientos diagnósticos se muestran en la tabla 5).
Puntos de corte y rendimiento diagnóstico para la predicción de mortalidad, bacteriemia y Streptococcus pneumoniae como patógeno causal en la NAC
| Predicción | Sensibilidad (%) (IC95%) | Especificidad (%) (IC95%) | VPP (%) (IC95%) | VPN (%) (IC95%) | CP+ (IC95%) | CP− (IC95%) |
| Mortalidad intrahospitalaria | ||||||
| Lactato ≥3,38mmol/l (30,5mg/ml) | 72,7 (43,4-90,3) | 96,2 (90,6-98,5) | 66,7 (40,0-93,3) | 97,1 (93,9-100) | 19,09 (6,48-53,52) | 0,28 (0,11-0,74) |
| MR-proADM≥1,92nmol/l | 72,3 (39,4-93,1) | 80,4 (71,6-78,7) | 25,9 (11,8-44,3) | 96,8 (91,2-99,8) | 3,60 (2,32-5,06) | 0,35 (0,18-0,84) |
| Mortalidad a los 30 días | ||||||
| MR-proADM≥1,85nmol/l | 84,6 (57,8-95,7) | 81,4 (73,3-87,5) | 34,4 (17,9-50,8) | 97,9 (95-100) | 4,55 (2,90-7,14) | 0,19 (0,05-0,68) |
| Mortalidad a los 180 días | ||||||
| MR-proADM≥1,56nmol/l | 96,4 (92,3-99,4) | 79,2 (70,0-86,1) | 57,4 (43,3-71,6) | 98,7 (96,2-100) | 4,63 (3,11-6,88) | 0,05 (0,01-0,31) |
| Bacteriemia | ||||||
| PCT≥0,95ng/ml | 93,1 (78,0-98,1) | 89,7 (82,1-94,3) | 73,0 (58,7-87,3) | 97,8 (94,7-100) | 9,03 (4,98-16,38) | 0,08 (0,02-0,29) |
| Streptococcus pneumoniae | ||||||
| PCT≥0,85ng/ml | 89,3 (72,8-96,3) | 84,8 (76,5-90,6) | 62,5 (47,5-77,5) | 96,6 (92,7-100) | 5,89 (3,63-9,56) | 0,13 (0,04-0,37) |
CP+: cociente de probabilidad positivo o likelihood ratio (LR+); CP−: cociente de probabilidad negativo o likelihood ratio (LR–); IC: intervalo de confianza; MR-proADM: región medial de la pro-adrenomedulina; NAC: neumonía adquirida en la comunidad; PCT: procalcitonina; VPN: valor predictivo negativo; VPP: valor predictivo positivo.
En relación con la mortalidad a los 30 días los resultados son muy parecidos a los descritos para la mortalidad intrahospitalaria, con un ligero aumento de las ABC del PSI, CURB-65, PCT, PCR y MR-proADM). El ABC-ROC del lactato y la MR-proADM son casi superponibles con la misma relación comparativa con PSI, CURB-65, SET y criterios NACG. La PCR y el recuento de leucocitos no ofrecen un rendimiento diagnóstico significativo (p>0,05). A los 30días la MR-proADM es la variable que ofrece mayor ABC, aunque no con diferencias significativas (p>0,05 en todos los casos) frente al ABC del lactato y las de PSI, CURB-65, criterios NACG y SET.
El PC con mayor capacidad diagnóstica encontrado para la MR-proADM fue de 1,85nmol/l (todos los valores de los rendimientos diagnósticos se muestran en la tabla 5).
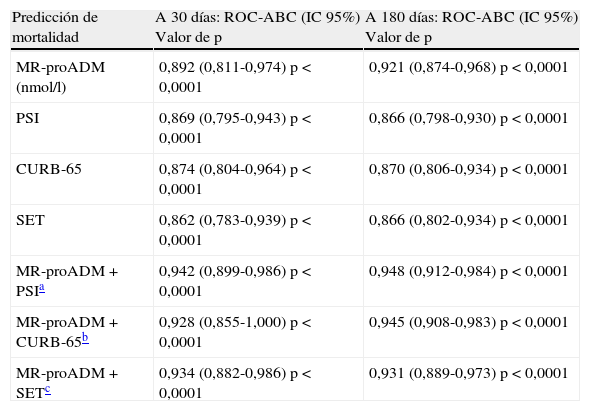
Por otro lado, en la tabla 6 se muestran los valores de los modelos combinando las respectivas ABC-ROC de MR-proADM con el PSI, CURB-65 y SET que obtienen un mayor poder pronóstico que estas de forma individual. No hay diferencias significativas al comparar las combinaciones de MR-proADM con PSI, CURB-65 y SET entre ellas (p<0,05). La combinación de MR-proADM+PSI tiene una S del 100%, una E del 79%, un VPN del 100% y un CP+ de 4,8.
Rendimientos al combinar la MR-proADM con el PSI, CURB-65 y SET
| Predicción de mortalidad | A 30 días: ROC-ABC (IC95%) Valor de p | A 180 días: ROC-ABC (IC95%) Valor de p |
| MR-proADM (nmol/l) | 0,892 (0,811-0,974) p<0,0001 | 0,921 (0,874-0,968) p<0,0001 |
| PSI | 0,869 (0,795-0,943) p<0,0001 | 0,866 (0,798-0,930) p<0,0001 |
| CURB-65 | 0,874 (0,804-0,964) p<0,0001 | 0,870 (0,806-0,934) p<0,0001 |
| SET | 0,862 (0,783-0,939) p<0,0001 | 0,866 (0,802-0,934) p<0,0001 |
| MR-proADM+PSIa | 0,942 (0,899-0,986) p<0,0001 | 0,948 (0,912-0,984) p<0,0001 |
| MR-proADM+CURB-65b | 0,928 (0,855-1,000) p<0,0001 | 0,945 (0,908-0,983) p<0,0001 |
| MR-proADM+SETc | 0,934 (0,882-0,986) p<0,0001 | 0,931 (0,889-0,973) p<0,0001 |
CURB65: acrónimo de confusión, urea≥7mol/l, frecuencia respiratoria ≥30, presión arterial sistólica <90mmHg o diastólica<60mmHg y edad ≥65años; IC: intervalo de confianza; MR-proADM: región medial de la pro-adrenomedulina; PSI: Pneumonia Severity Index o ING (índice de gravedad de la neumonía); ROC-ABC: receiver operating characteristic-área bajo la curva; SET: sistema español de triaje.
Para la predicción de mortalidad a 180días sí existen diferencias más evidentes en cuanto al poder de predicción, de manera que la MR-proADM se muestra claramente superior al resto de BMRII y a las escalas pronósticas y de gravedad, consiguiendo un ABC-ROC de 0,921 (IC95%: 0,874-0,968) a los 180días, claramente superior al resto. La PCR y los leucocitos tampoco alcanzan significación estadística (p>0,05) ni valor pronóstico útil (todos los resultados en la figura 1).
El PC con mayor capacidad diagnóstica encontrado de la variable con mayor poder pronóstico (MR-proADM) fue de 1,56nmol/l (los valores de los rendimientos diagnósticos se muestran en la tabla 5). Finalmente, en la tabla 6 se muestran los valores de los modelos combinando las respectivas ABC-ROC de MR-proADM con el PSI, CURB-65 y SET, que obtienen un mayor poder pronóstico que estas de forma individual. No hay diferencias significativas al comparar las combinaciones de MR-proADM con PSI, CURB-65 y SET entre ellas (p<0,05). La combinación de MR-proADM+PSI tiene una S del 100%, una E del 81%, un VPN del 100% y un CP+ de 5,2.
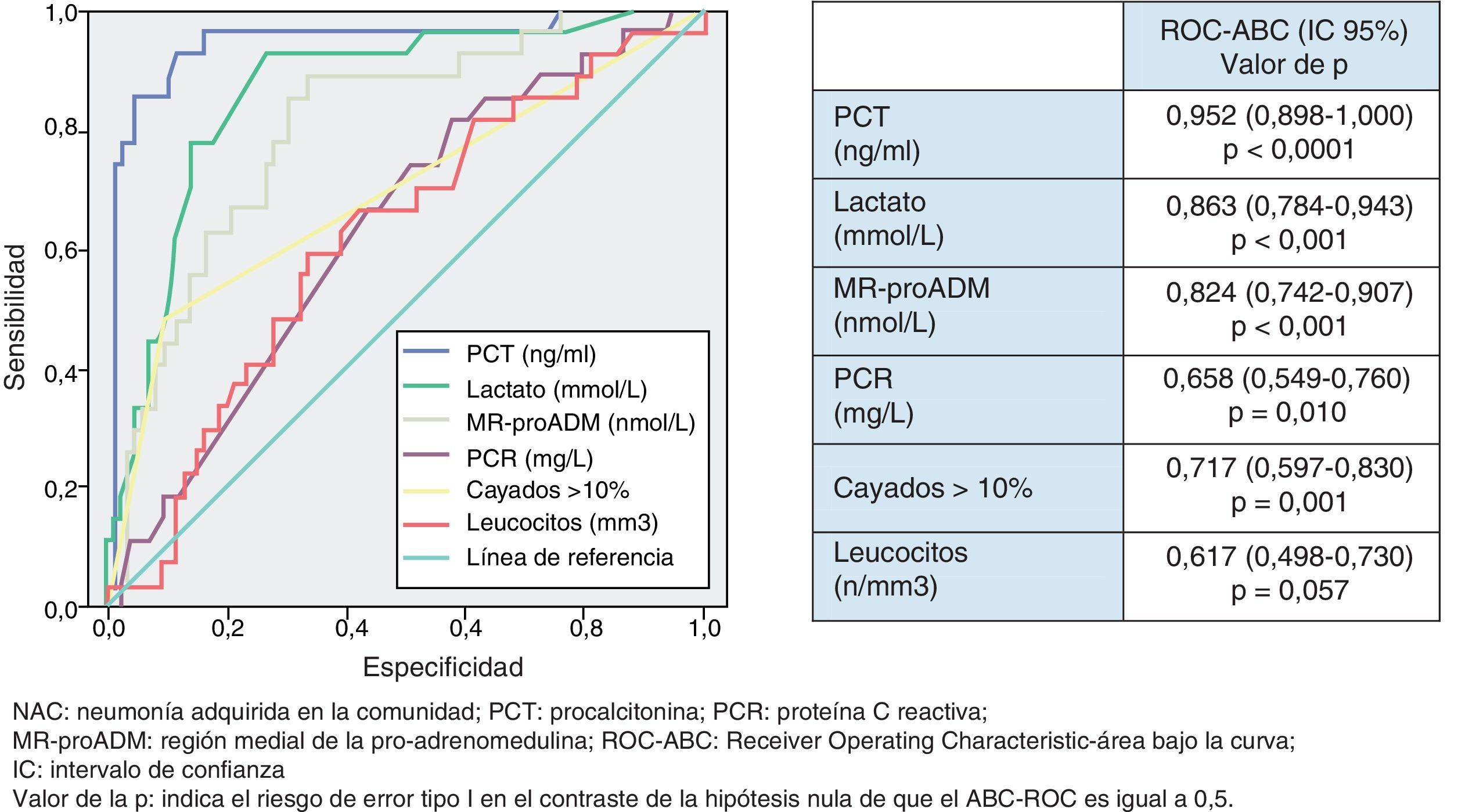
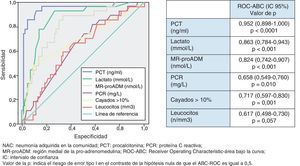
Utilidad y capacidad de los biomarcadores para pronosticar bacteriemia y etiología por Streptococcus pneumoniaeEn la figura 2 se describen los valores de ABC-ROC de los BMRII (MR-proADM, PCT, PCR), lactato, recuento de leucocitos y formas jóvenes (cayados) para predecir la existencia de bacteriemia en los pacientes con NAC. Aunque la ABC-ROC obtenida del lactato y de la MR-proADM son significativas, la PCT muestra una capacidad muy superior a estas y a la PCR, leucocitos o existencia >10% de cayados (en todos los casos con p<0,05). Los niveles medios de PCT comparando los grupos de NAC sin y con bacteriemia tienen diferencias muy significativas (1,37±9,92 vs 13,26±22,92ng/ml; p<0,0001). También existen diferencias entre los valores medios de lactato (1,34±0,82 vs 2,73±1,04mmol/l; p<0,01), de PCR (76,69±49,37 vs 93,75±37,58mg/l; p<0,01) y de MR-proADM (1,28±1,20 vs 3,03±2,93 nmol/l; p<0,01), pero el recuento de leucocitos no resultó significativo (p=0,057). El ABC de la PCT para predicción de bacteriemia es la mayor y ofrece un muy elevado rendimiento diagnóstico, con diferencias significativas con los otros BMRII (p<0,05). El PC con mayor capacidad diagnóstica encontrado para la PCT fue de 0,95ng/ml (los valores y rendimientos diagnósticos se muestran en la tabla 5).
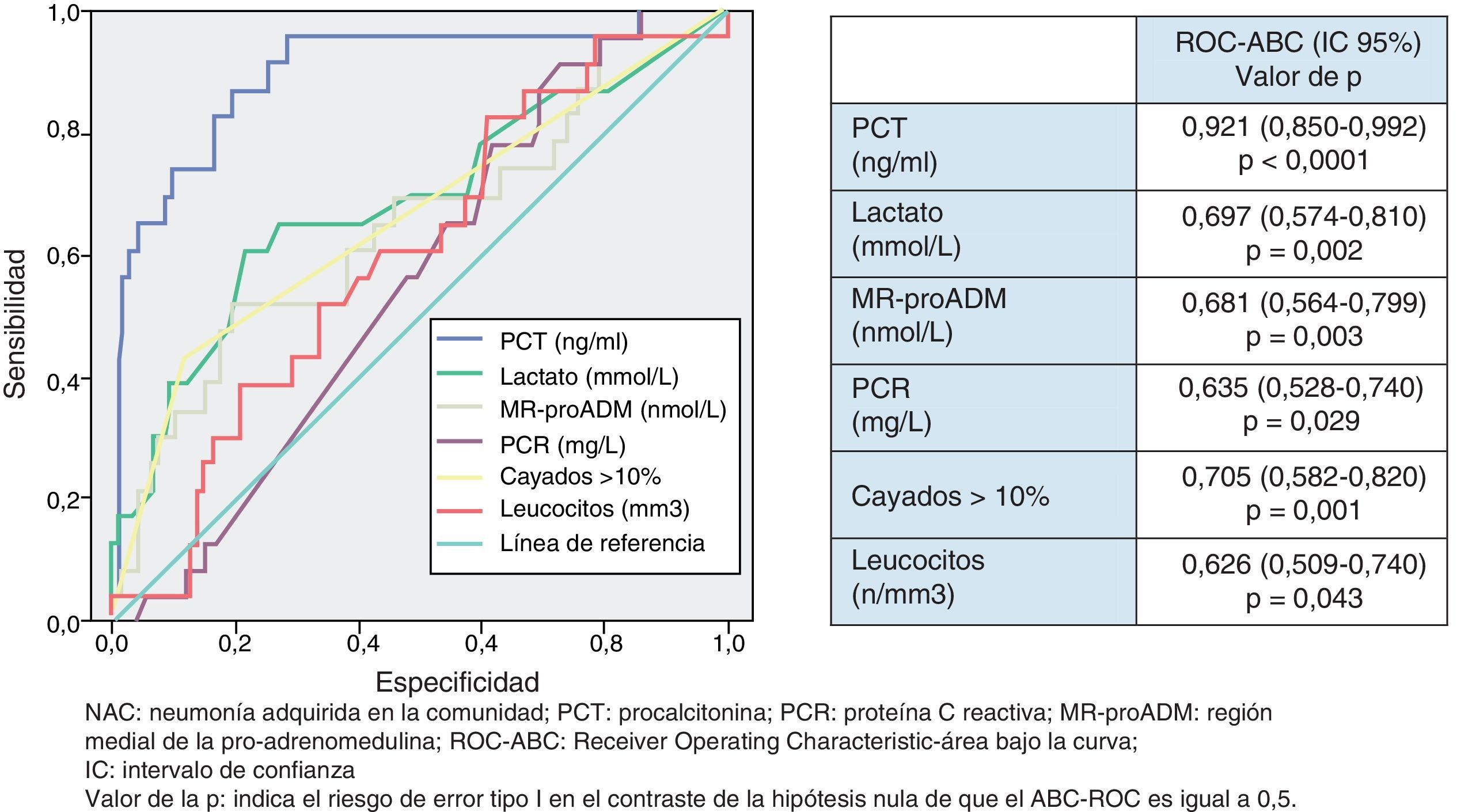
En la figura 3 se describen los valores de ABC-ROC de los BMRII, lactato, recuento de leucocitos y formas jóvenes (cayados) para predecir el diagnóstico de S.pneumoniae como patógeno de la NAC. Los niveles medios de PCT medidos en las NAC sin y con confirmación de S.pneumoniae tienen diferencias significativas (1,48±9,83 vs 14,80±25ng/ml; p<0,001). También el caso del lactato (1,49±0,90 vs 2,38±1,34mmol/l; p<0,01) y de MR-proADM (1,41±1,30 vs 2,76±3,21nmol/l; p<0,01), pero no ocurre así con los valores del recuento de leucocitos ni de la PCR (p=0,17 y p=0,12, respectivamente). Y como ocurre para la predicción de bacteriemia, la PCT es la única que ofrece una ABC-ROC con un rendimiento significativo y muy superior al resto de biomarcadores. El PC con mayor capacidad diagnóstica encontrado para la PCT fue de 0,85ng/ml (los valores y los rendimientos diagnósticos se muestran en la tabla 5). Para la PCT se profundizó el estudio (según patógenos confirmados) de los valores medios±DE y su significación estadística, de forma que no se hallaron diferencias significativas al comparar los valores encontrados en las NAC originadas por Legionella sp. (p=0,653) ni por otras bacterias (p=0,121) con el resto de casos, salvo al comparar los valores de las NAC por S.pneumoniae con el resto (14,80±25,00 vs 1,48±9,83; p<0,001), por bacterias atípicas con el resto (0,16±0,06 vs 4,34±15,12; p=0,015) y por virus y el resto de NAC (0,13±0,11 vs 4,28±15,00; p=0,033).
Biomarcadores y gravedad clínicaLos niveles de PCR, leucocitos y proporción >10% de cayados no consiguen ABC-ROC superiores a 0,700 al relacionarlos con las situaciones de gravedad en los pacientes con NAC: SG, SS o criterios de NACG. Sin embargo, tanto el lactato, la MR-proADM como la PCT sí obtienen resultados significativos (con p<0,05) y muy parecidos globalmente al comparar sus niveles en los casos de SG, SS y NACG con el resto de NAC. Respecto a las ABC-ROC para SG, los resultados son: lactato 0,837 (IC95%: 0,743-0,931), PCT 0,835 (IC95%: 0,723-0,947) y MR-proADM 0,832 (IC95%: 0,743-0,921). En relación con los casos de NAC con SS son: MR-proADM 0,911 (IC95%: 0,844-0,978), PCT 0,853 (IC95%: 0,779-0,926) y lactato 0,837 (IC95%: 0,678-0,997). Y para NACG: PCT 0,847 (IC95%: 0,748-0,946), MR-proADM 0,842 (IC95%: 0,760-0,923) y para el lactato 0,812 (IC95%: 0,699-0,925).
Correlación con la edad y la toma previa de antibióticoAl valorar la posible correlación de la edad (como posible factor de confusión) con los BMRII se encontró un coeficiente r de Pearson débilmente positivo para la MR-proADM de 0,232 y p<0,05. Para el resto (PCR, PCT y lactato) no fueron significativos (todos con valores <0,2 y p>0,05).
Al comparar los valores medios±DE de PCT, PCR, leucocitos, lactato y MR-proADM de los pacientes con NAC que recibieron AB previo frente a los que no lo tomaron, no se encontraron diferencias significativas en ninguno de ellos (p>0,05).
DiscusiónLos resultados confirman que los BMRII y el lactato poseen una estimable capacidad predictiva de gravedad, mortalidad a corto y medio plazo, existencia de bacteriemia y una razonable orientación del patógeno etiológico en la NAC. Así pueden convertirse en una eficaz herramienta de ayuda para orientar las decisiones que debe tomar el clínico en su valoración del paciente en el SU, como son el decidir el alta o ingreso, combinándose con las EPG y mejorando el poder predictivo de estas, la obtención de muestras microbiológicas (y especialmente los hemocultivos) y la administración inmediata del AB adecuado (en los pacientes más graves, donde será más determinante para el pronóstico vital del paciente)7,8. Es importante señalar que el papel de los BMRII es complementar, no sustituir, a la exploración física, el juicio clínico y las muestras microbiológicas indicadas11.
Creemos que el perfil del paciente (estancia media, estabilización, destino inicial) y microbiológico de nuestra muestra refleja el escenario habitual en relación a la NAC en los SU1-3. Con una mortalidad del 10% a los 30días y del 22,6% a los 180días, más alta que el de otras series recientes que analizan los BMRII23-25, el diagnóstico microbiológico conseguido en nuestro trabajo (46,8% con predominio de S.pneumoniae) es superior al comunicado en la mayoría de estudios realizados en los SU (<30%)1,47, aunque menor que los que emplearon un estudio sistemático exhaustivo en todos los enfermos (67,98%)25. Por otro lado se consiguió una considerable rentabilidad de los hemocultivos (positivos en el 23%), superior a la mayoría de estudios comparados19 y en clara relación con los pacientes con SG y SS.
En relación con las EPG, los niveles de lactato, MR-proADM y PCT mostraron diferencias significativas entre los grupos i-iii y iv-v del PSI (p<0,05), tal y como han comunicado otros autores14,15,21, así como una buena correlación con CRB-6535. Schuetz et al.14 encontraron que la MR-proADM tenía un gran poder discriminativo, mayor que el PSI y el CURB-65.
Nuestros resultados en relación con la capacidad predictiva de mortalidad de los BMRII y su comparativa con el recuento de leucocitos, el PSI, CURB-65, criterios de NACG, índice de Charlson y SET (hecho novedoso, porque aunque Herrero et al.27 estudiaron su relación con otro sistema de triaje, no se ha publicado nunca con el SET) sitúan al lactato y a la MR-proADM como los marcadores con mayor poder predictivo de mortalidad a corto plazo, con ABC para el lactato de 0,89 (intrahospitalaria y a los 30días) y para la MR-proADM de 0,86 y 0,89, respectivamente, de forma que ponen de relieve la confirmación de otros recientes estudios con la MR-proADM23-25 que obtienen similares rendimientos y refuerza el papel del lactato y su utilidad en los SU en los pacientes con NAC y SG o SS11,38,42. Es significativo que el SET sea la escala pronóstica y de clasificación (superior a PSI, CURB-65 y criterios de NACG) con mayor poder predictivo de mortalidad intrahospitalaria, y aunque es un resultado no explorado anteriormente y que habrá que contrastar en futuros estudios, refleja la relación entre la gravedad con la que acude el paciente al SU y su pronóstico vital. Para el lactato, el PC con mayor rendimiento encontrado para predecir mortalidad intrahospitalaria fue 3,38mmol/l, que ofrece un muy significativo VPN del 97,1% y un CP+ de 19,09, en consonancia con la importancia que le otorgan todas las recomendaciones para su uso en los pacientes graves en el SU11,38,42.
Para la predicción de mortalidad a los 30días (periodo de tiempo «estándar» para las EPG), tanto el lactato como la MR-proADM consiguen un ABC de 0,89, mayor que la obtenida por PSI, CURB-65, criterios NACG y SET. El PC de la MR-proADM con mayor rendimiento pronóstico fue 1,85nmol/l, que se asocia con un importante VPN de 97,9% y un aceptable CP+ de 4,5. Aunque a diferencia de otros estudios nuestro PC óptimo de MR-proADM de 1,85nmol/l fue mayor, posiblemente por lo limitado de nuestra muestra, Bello et al.25 proponen 1,06nmol/l, y Huang et al.23 1,3nmol/l.
Menéndez et al.15, Christ-Crain et al.24 y Bello et al.25, entre otros autores20, han demostrado recientemente que al añadir o combinar los BMRII a las EPG se aumenta el poder predictivo de ambos, consiguiendo ABC y rendimientos superiores a todos los conocidos para la predicción de mortalidad a 30 y 180días y similares a los nuestros. Con el mismo modelo que el empleado por los autores mencionados al combinar MR-proADM+PSI se aumenta el ABC a 0,94 para la predicción de mortalidad a los 30 y 180 días (con p<0,05 frente a ABC de 0,86 conseguida por PSI). De la misma manera se incrementa la capacidad del CURB-65 o SET. Albrich et al.28 proponen una nueva escala (CURB-65A) combinando la MR-proADM con el CURB-65 para establecer 3 grupos de riesgo basándose en puntos de corte establecidos que predicen mortalidad, complicaciones e indican el ingreso.
Respecto a la mortalidad a los 180días (medio plazo), la MR-proADM de forma individual se mostró claramente superior, con un ABC 0,92 a las EPG y al lactato, que disminuyó su poder respecto del pronóstico a corto plazo. En este caso el PC de MR-proADM más óptimo encontrado fue 1,56nmol/l, con un VPN con 98,7% y CP+ de 4,63, lo que sitúa a la MR-proADM como el mejor marcador pronóstico de mortalidad, como así han publicado otros autores20,25. En nuestro estudio, al combinar MR-proADM con PSI y CURB-65 se incrementó a 0,94 el ABC a los 180días.
En consonancia con distintos estudios que señalan a la PCT como el BMRII con mayor capacidad predictiva de bacteriemia en el SU10-12 y en la NAC18,19, nuestros resultados le otorgan una capacidad muy superior sobre el lactato, la MR-proADM y la PCR y no conceden ningún valor a la existencia de cayados ni al recuento de leucocitos totales. Aunque la diferencia de valores de PCR, lactato y MR-proADM es significativa ante la existencia de bacteriemia, esta seguramente esté en relación con la coexistencia en la mayoría de los casos de SG y SS. Con un ABC de 0,95 (p<0,0001) y un PC de 0,95ng/ml de PCT se obtiene un VPN de 97,8% y un CP+ de 9, lo que le concede una capacidad muy estimable para descartar la sospecha de bacteriemia en la NAC, con lo que esto supone a la hora de decidir el manejo diagnóstico-terapéutico8. Dada la trancendencia de la existencia de bacteriemia y con el objeto de disminuir al máximo los posibles falsos negativos, estimamos muy interesantes los resultados encontrados con el PC de PCT de 0,58ng/ml que aumenta la S al 97% y el VPN al 98,8%, con un CP+ de 6,7. En este sentido, en un reciente estudio, Müller et al.19 proponen extraer hemocultivos y sospechar bacteriemia en la NAC cuando la PCT sea superior a 0,25ng/ml. Tudela et al.10 y otros estudios18 y revisiones11-13 recientes coinciden en torno a 0,5-1ng/ml de PCT como el valor más preciso para sospechar bacteriemia e indicar la necesidad de hemocultivos, siempre que no se hayan tomado previamente AB, ya que habría que reconsiderar cada caso11,19.
A la hora de predecir la etiología bacteriana o viral y distinguir entre las bacterias atípicas, Legionella, S.pneumoniae y otras bacterias, se ha cuestionado y confirmado que solo la PCT posee capacidad discriminativa, o en su caso es muy superior a PCR y al resto de marcadores25,29-31. En nuestro estudio existen diferencias significativas entre los niveles de PCT al comparar los casos con confirmación microbiológica de S.pneumoniae (solo o en NAC mixta con virus o M.pneumoniae o C.pneumoniae) y el resto de NAC (con y sin diagnóstico microbiológico), y con un PC de 0,85ng/ml obtiene un VPN de 96,6% y un ABC de 0,91. Estos resultados, unidos al PC de PCT obtenido para bacteriemia en la NAC, nos obligarían a cubrir una muy probable NAC con bacteriemia por S.pneumoniae con un VPN>97% y CP+>6, lo que sin duda condicionaría el manejo y las decisiones de pauta de antimicrobianos en el SU1-3.
Finalmente, y aunque son circunstancias que se deberían considerar, no se ha estimado la edad como un factor de confusión11,26 al encontrar unos coeficientes de correlación sin significación o muy poco significativos (MR-proADM), ni la toma de AB previo al no encontrar diferencias significativas (p>0,05) en ningún BMRII entre el grupo que sí los había tomado y el que no, ni el tiempo de evolución clínica hasta su llegada al SU al no encontrarse tampoco diferencias al interpretar esta variable.
Nuestro estudio tiene distintas limitaciones que hay que considerar. Las más importantes son su carácter unicéntrico y el reducido tamaño de la muestra (no se puede excluir algún error tipo beta), que para algunas comparaciones resultó escasa y seguramente haya podido determinar que los puntos de corte y rendimientos obtenidos hayan podido maximizarse o minimizarse, sobre todo si se trataba de establecer comparaciones entre subgrupos según PSI o de gravedad clínica (sepsis, SG y SS). Otras limitaciones menores habrían podido producir algún sesgo o déficit de información al no haber tenido en cuenta la situación funcional, el análisis de las complicaciones o reingresos tras ser dados de alta los pacientes con NAC, y al no incluir la medición inicial de la temperatura como variable predictiva, aunque esta frecuentemente suele estar artefactada por la administración previa no solo de AB sino más aún de antipiréticos. Por otro lado, aunque la investigación microbiológica fue sistemática con hemocultivos y antigenuria y con cultivo de esputo en los ingresados, los casos de origen viral, por bacterias atípicas y mixtas estarían infradiagnosticados al no haber realizado su estudio en todos los casos, solo por la indicación o sospecha clínica.
A pesar de estas limitaciones, creemos que la validez interna del estudio y el reflejo de la realidad del papel que pueden jugar los BMRII y el lactato en la NAC en un SU son significativos y puede aportar datos novedosos y trascendentes para el manejo de estos enfermos tanto a su llegada al propio SU, relacionando los BMRII con el triaje, como en los pacientes ingresados o en los dados de alta.
En el futuro próximo se deberán validar y ajustar los resultados encontrados con estudios multicéntricos, con un mayor tamaño muestral para predecir mortalidad, bacteriemia y la orientación etiológica, lo que condicionará y cambiará el manejo de la NAC en los SU al mejorar la indicación y adecuación del tratamiento AB.
En conclusión, la implementación de los BMRII y el lactato en la valoración de la NAC en los SU tiene una utilidad evidente como herramienta de ayuda para pronosticar mortalidad a corto y a medio plazo (donde destacan el lactato y la MR-proADM), aunque sin diferencias significativas entre las EPG y los BMRII, mejorar significativamente el poder pronóstico de las escalas y modelos de predicción más utilizados al combinarse con ellas (MR-proADM junto a PSI, CURB-65 y criterios de NACG), sospechar o descartar la posibilidad de bacteriemia (PCT) y orientar el diagnóstico microbiológico (PCT).
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.
A los miembros de los Servicios de Análisis Clínicos y Bioquímica, Microbiología y Urgencias del Complejo Hospitalario de Toledo por su ayuda en la recogida de datos para la elaboración de este manuscrito.