Las infecciones más frecuentes en pacientes con trasplante de órgano sólido son las bacterianas, fundamentalmente durante el primer mes postrasplante, la mayoría adquiridas en el ámbito hospitalario. Las infecciones nosocomiales comportan una gran morbilidad y constituyen la causa más frecuente de mortalidad en ese periodo precoz del trasplante. Suelen ser infecciones a menudo por microorganismos multirresistentes, destacando fundamentalmente enterobacterias gramnegativas, bacilos gramnegativos no fermentadores, enterococos y estafilococos. Los pacientes más expuestos a padecer infección nosocomial por bacterias son los colonizados previamente durante la lista de espera con bacterias multirresistentes. Los focos más frecuentes son los relacionados con los catéteres intravasculares, la vía urinaria, el pulmón y la herida quirúrgica. Las medidas preventivas son las mismas que las aplicadas en los pacientes hospitalizados no inmunodeprimidos, salvo en caso de pacientes con riesgo elevado de desarrollar infección fúngica, a los que se han de administrar antifúngicos durante el tiempo de hospitalización y vacunar según recomendaciones a los pacientes en lista de espera como prevención de infección en el periodo precoz del trasplante. A pesar de que la morbimortalidad asociada a las infecciones en el trasplante de progenitores hematopoyéticos (TPH) ha disminuido considerablemente en los últimos años, estas continúan siendo una de las complicaciones más destacables en estos pacientes. Por otra parte, y al igual que en la población general, las infecciones nosocomiales han incrementado su incidencia en las diferentes fases del TPH. Es difícil establecer unas medidas preventivas generales en estos pacientes, ya que existen muchos factores que condicionan las infecciones nosocomiales: están sometidos a múltiples tratamientos antibióticos e intervenciones, el grado de neutropenia e inmunodepresión es variable de paciente a paciente y, finalmente, combinan constantemente la estancia hospitalaria y domiciliaria en el proceso del trasplante. Sin embargo, existen medidas que ayudan sin duda a mejorar la situación actual.
Bacterial infections are the most common infections in solid organ transplant recipients. These infections occur mainly in the first month after transplantation and are hospital-acquired. Nosocomial infections cause significant morbidity and are the most common cause of mortality in this early period of transplantation. These infections are caused by multi-drug resistant (MDR) microorganisms, mainly Gram-negative enterobacteria, non-fermentative Gram-negative bacilli, enterococci, and staphylococci. The patients at risk of developing nosocomial bacterial infections are those previously colonized with MDR bacteria while on the transplant waiting list. Intravascular catheters, the urinary tract, the lungs, and surgical wounds are the most frequent sources of infection. Preventive measures are the same as those applied in non-immunocompromised, hospitalized patients except in patients at high risk for developing fungal infection. These patients need antifungal therapy during their hospitalization, and for preventing some bacterial infections in the early transplant period, patients need vaccinations on the waiting list according to the current recommendations. Although morbidity and mortality related to infectious diseases have decreased during the last few years in haematopoietic stem cell transplant recipients, they are still one of the most important complications in this population. Furthermore, as occurs in the general population, the incidence of nosocomial infections has increased during the different phases of transplantation. It is difficult to establish general preventive measures in these patients, as there are many risk factors conditioning these infections. Firstly, they undergo multiple antibiotic treatments and interventions; secondly, there is a wide variability in the degree of neutropenia and immunosuppression among patients, and finally they combine hospital and home stay during the transplant process. However, some simple measures could be implemented to improve the current situation.
Las infecciones más frecuentes en pacientes con trasplante de órgano sólido son las bacterianas, fundamentalmente durante el primer mes postrasplante, la mayoría adquiridas en el ámbito hospitalario. Estas infecciones relacionadas con la estancia hospitalaria comportan una gran morbilidad y constituyen la causa más frecuente de mortalidad en ese periodo precoz. Suelen ser infecciones a menudo por microorganismos multirresistentes, destacando fundamentalmente enterobacterias gramnegativas, bacilos gramnegativos no fermentadores, enterococos y estafilococos. Los pacientes más expuestos a padecer infección nosocomial por bacterias son los colonizados previamente, durante la lista de espera, con bacterias multirresistentes: Staphylococcus aureus resistentes a la meticilina (SARM), enterococos resistentes a la vancomicina, bacterias gramnegativas multirresistentes, Clostridium difficile, especies de Candida resistentes al fluconazol y Aspergillus. Después del trasplante, estos microorganismos pueden causar neumonías, infecciones quirúrgicas o de catéteres, etc.1-4.
La incidencia de infección bacteriana en el postrasplante renal es de 23 casos por 100 trasplantes y año en Norteamérica5. Los trasplantes que con mayor frecuencia desarrollan infecciones bacterianas son los renales, los abdominales (hígado, páncreas e intestino) y los de pulmón, mientras que los cardiacos presentan menos complicaciones bacterianas. Los factores de riesgo para desarrollar una infección nosocomial son los secundarios a la cirugía (manipulación e implantación de los injertos) y el requerimiento de procedimientos relacionados con el postoperatorio inicial (catéteres intravasculares, urinarios, intubación orotraqueal). Entre los factores de riesgo más frecuentes para desarrollar una infección nosocomial en el primer mes postrasplante están: recibir un injerto de donante cadáver, en caso de trasplante hepático tener un MELD superior a 20 y/o anastomosis bilioentérica, hipoalbuminemia, necesidad de politransfusión y/o requerimiento de más de 12U de plasma, estancia en la UCI superior a 6días o en el hospital superior a 21días6.
La bacteriemia es la expresión más grave de la infección bacteriana7. La clínica varía desde ausencia de síntomas a sintomatología grave con complicaciones que amenazan la vida, tales como el shock séptico. La bacteriemia cursa con una mortalidad que oscila entre el 3 y el 33% en el trasplantado cardiaco, entre el 10 y el 27% en el hepático y entre el 2,5 y el 11% en el trasplantado renal. Casi el 15% de las bacteriemias en los receptores de trasplante de órgano sólido desarrollan shock séptico, que conllevará una mortalidad superior al 50%8. El riesgo de mortalidad está influido por varios factores. Entre los factores de riesgo que comportan una mayor mortalidad por bacteriemia están el foco pulmonar7,8, el desarrollo de shock séptico8, el deterioro de la función renal9 y el empleo de una terapia empírica inadecuada en caso de que se añada que los microorganismos puedan presentar resistencia a los antibióticos habitualmente usados10. El foco más frecuente de bacteriemia y que se asocia a menor mortalidad es el catéter intravascular, y los aislamientos más frecuentes son los estafilococos coagulasa negativos y Staphylococcus aureus11. Le sigue en frecuencia la orina, especialmente en los receptores de riñón y dobles trasplantes con participación renal (riñón y páncreas, hígado y riñón, corazón y riñón…). La bacteriemia en pacientes con ventilación mecánica puede ser secundaria a una infección pulmonar, aunque la tasa de bacteriemia por neumonía nosocomial en pacientes trasplantados es muy baja (3%)12. El riesgo de infección por bacterias oportunistas durante el primer mes es bajo.
Infecciones nosocomiales según focoUno de los focos relativamente frecuente de infección es el relacionado con la herida quirúrgica. La tasa de incidencia de esta infección en pacientes con trasplante de hígado es más alta que la registrada en otros trasplantes de órgano sólido. Las complicaciones derivadas incluyen abscesos y peritonitis. En un reciente estudio español la infección quirúrgica se produjo en casi el 9% de los receptores de trasplante hepático, con una mortalidad asociada del 10%. El agente etiológico más frecuente fue Enterococcusspp., seguido de Escherichia coli y S.aureus. Los factores de riesgo asociados a esta complicación fueron coledocoyeyunostomía o hepatoyeyunostomía, retrasplante y requerimiento de politransfusión13. En los pacientes con trasplante renal la incidencia de infección quirúrgica es de aproximadamente el 4%, y los microorganismos responsables son principalmente E.coli (32%), Pseudomonas aeruginosa (13%), Enterococcus faecalis (12%), Enterobacterspp. (10%) y estafilococos coagulasa negativos (8%). La diabetes previa al trasplante y el uso de inhibidores de mTOR como inmunosupresores se asocian a un aumento del riesgo de infección14. En los pacientes sometidos a trasplante doble de riñón y páncreas la incidencia de infección quirúrgica es muy elevada, y los principales patógenos responsables son bacilos gramnegativos. Los factores de riesgo para infección de la herida quirúrgica incluyen necrosis tubular aguda, el desarrollo de fístulas y el rechazo del injerto15. En los receptores de trasplante de corazón la incidencia de infección quirúrgica ocurre en el 5% de los pacientes, predominantemente cocos grampositivos, aunque en algunos casos se aíslan bacilos gramnegativos y Candidaspp.16. La complicación más grave en los receptores cardiacos y/o pulmonares es el desarrollo de mediastinitis, que ocurre en el 2 al 7% de los casos, con una mortalidad muy elevada17.
La infección pulmonar es una causa frecuente de morbimortalidad en los receptores de trasplante de órgano sólido (hasta el 30% cuando aparece en los primeros 3meses después del trasplante, y superior cuando acontece durante el primer mes)18,19. Si la infección pulmonar es de adquisición nosocomial, el pronóstico es peor12. En los trasplantados hepáticos, la etiología de los infiltrados pulmonares es infecciosa en el 48% de los casos, y los microorganismos responsables son predominantemente bacilos gramnegativos, en el periodo precoz postrasplante20. En los pacientes con trasplante renal los agentes causantes más frecuentes son S.aureus, P.aeruginosa, Acinetobacterspp. y Haemophilus influenzae21. En los receptores de trasplante de pulmón la incidencia general de neumonía es mayor que en otros receptores de trasplante de órgano sólido, alcanzando una tasa de incidencia de 72 casos por 100 trasplantes/año. El agente etiológico más frecuente es P.aeruginosa22. En los últimos años los bacilos gramnegativos multirresistentes se han convertido en agentes causantes de infecciones pulmonares nosocomiales en receptores de trasplante, sobre todo de hígado (especialmente en pacientes con encefalopatía), que requieren intubación orotraqueal prolongada y/o traqueostomía, y reintervención en el postrasplante precoz. Si la etiología es por bacilos gramnegativos multirresistentes, las tasas de mortalidad son más altas12,20,23.
La vía urinaria es la localización más frecuente de la infección en los receptores de trasplante renal. Los microorganismos responsables son las enterobacterias gramnegativas, especialmente E.coli y Klebsiellaspp., seguido de P.aeruginosa y Enterococcusspp. En los últimos años ha habido un aumento progresivo de las infecciones urinarias causadas por enterobacterias gramnegativas productoras de betalactamasas de espectro extendido (BLEE) (superior al 20% de las infecciones por E.coli y Klebsiellaspp.)24. El tratamiento antibiótico empírico de las infecciones urinarias en los receptores de trasplante de órgano sólido depende de las tasas de resistencia a los antibióticos en cada centro. A medida que la incidencia de la infección por BLEE es alta, se recomienda un fármaco activo, especialmente en el caso de infección grave. En general, se recomienda un régimen antibiótico activo frente a P.aeruginosa en etapas precoces (durante el primer mes después del trasplante).
La infección por catéter es muy frecuente y sus características no difieren de la población hospitalizada no trasplantada.
Infección por microorganismos resistentesLa infección por microorganismos resistentes a múltiples fármacos en receptores de trasplante puede tener varias implicaciones para el injerto y el paciente. Aproximadamente el 14% de los pacientes con trasplante renal van a desarrollar un episodio infeccioso causado por bacterias resistentes a múltiples fármacos en el periodo postrasplante (enterobacterias gramnegativas, bacilos gramnegativos no fermentadores, enterococos y estafilococos)25. Los factores de riesgo para desarrollar una infección por bacterias productoras de BLEE son el tratamiento previo de antibióticos, el trasplante doble de riñón y páncreas, el requerimiento de diálisis postrasplante y la presencia de obstrucción de la vía urinaria26. El desarrollo de esta complicación se asocia a peor pronóstico del injerto y del paciente. Otro hecho importante es que las cepas resistentes a múltiples fármacos tienen que ser tratadas con antibióticos de segunda o tercera línea que generalmente tienen considerables desventajas, destacando la mayor incidencia de efectos adversos (toxicidad renal en caso de aminoglucósidos y colistina, toxicidad neurológica con colistina, etc.) y la menor disponibilidad de formulaciones por vía oral que conlleva prolongación de la estancia hospitalaria. Si el tratamiento empírico no cubre eficazmente dichos microorganismos, la mortalidad puede elevarse25.
La mayoría de las infecciones con cepas multirresistentes se adquieren durante la hospitalización26. Sin embargo, la mayoría de los pacientes sometidos a trasplante de órgano sólido tienen enfermedades crónicas subyacentes que conducen a múltiples ingresos hospitalarios y un contacto continuo con los dispositivos de atención sanitaria antes del trasplante (p.ej., hemodiálisis, pacientes ambulatorios con tratamiento antimicrobiano parenteral, etc.), lo que aumenta el riesgo de infecciones asociadas al medio sanitario (similares a las nosocomiales). La colonización pretrasplante por cepas resistentes a múltiples fármacos (intestino, oral, etc.) puede representar un factor de riesgo de infección por bacterias multirresistentes en el periodo postrasplante1.
Las enterobacterias gramnegativas productoras de BLEE o betalactamasas cromosómicas representan una de las principales causas de infecciones hospitalarias,. E.coli y Klebsiella pneumoniae son los principales patógenos productores de BLEE, y Enterobacterspp., Citrobacter freundii y Morganella morganii suelen expresar betalactamasas cromosómicas inducibles (AmpC). Estas bacterias son resistentes a la penicilina y a las cefalosporinas y son susceptibles a los carbapenémicos. La tigeciclina, los aminoglucósidos y la colistina son eficaces contra estas bacterias. E.coli BLEE suelen ser susceptibles a nitrofurantoína; sin embargo, muchas cepas de Klebsiellaspp. son intrínsecamente resistentes a este antibiótico. El trasplante renal es un factor de riesgo independiente para el desarrollo de la infección bacteriémica por E.coli o Klebsiellaspp. BLEE. Los carbapenems son la piedra angular del tratamiento para estas infecciones, aunque se ha demostrado que su uso previo puede seleccionar enterobacterias multirresistentes27, al igual que ocurre con las fluoroquinolonas28. En pacientes hemodinámicamente inestables o en estado crítico la administración de un aminoglucósido puede estar indicada. Otras opciones terapéuticas incluyen tigeciclina y cotrimoxazol, quinolonas, nitrofurantoína y fosfomicina en el caso de susceptibilidad probada.
Las infecciones por bacilos gramnegativos no fermentadores son cada vez más frecuentes en el medio hospitalario. P.aeruginosa es el cuarto microorganismo en frecuencia que causa bacteriemia en el trasplante de órgano sólido y representa el 14% de las bacteriemias en pacientes con trasplante renal, el 6,5% con trasplante hepático, el 5% con trasplante pancreático y el 6% con trasplante de pulmón. Está presente en el 6% de las infecciones quirúrgicas y en el 18% de neumonías nosocomiales7. Acinetobacter baumannii multirresistente es una causa común de brotes epidémicos de infecciones graves en pacientes ingresados en la unidad de cuidados intensivos. Actualmente es la tercera causa de bacteriemia en pacientes trasplantados en España, y es responsable del 3% de las bacteriemias en trasplante renal, el 14% en trasplante hepático, el 16% en trasplante de páncreas, el 3% en el cardiaco y 12% en los trasplantados de pulmón7,22. Es una causa frecuente de infección quirúrgica en trasplantados hepáticos13. Stenotrophomonas maltophilia es la causa del 1% de bacteriemias en pacientes trasplantados de órgano sólido. Este microorganismo suele aparecer en pacientes críticos en tratamiento con carbapenémicos7. El fármaco de elección para el tratamiento de infecciones causadas por S.maltophilia es cotrimoxazol. S.aureus resistente a la meticilina (SARM) es la sexta causa en receptores de trasplante de órgano sólido, y junto a estafilococos coagulasa negativos, E.coli, A.baumannii, P.aeruginosa y Enterococcusspp. se asocia a una alta mortalidad en trasplantados hepáticos7. El foco más frecuente de las infecciones por SARM es la colonización nasal, presente en el 1,5-3% de la población general. En trasplantados de hígado, la incidencia de colonización nasal alcanza el 43-44% en algunos estudios29. En un estudio de vigilancia de trasplantados de hígado que tenían colonización nasal por SARM y que fueron tratados con mupirocina tópica, la infección se redujo del 40,4 al 4,1%, y la tasa de bacteriemia disminuyó del 25,5 al 4,1%30. Los enterococos son una causa infecciosa emergente en receptores de trasplante, y en particular los resistentes a vancomicina, por su difícil manejo y gravedad. Las opciones terapéuticas para el tratamiento de cepas resistentes de Enterococcus faecium son limitadas en muchos casos a linezolid o daptomicina31. Aunque la incidencia de infecciones por E.faecium resistente a la vancomicina en España es muy baja en la actualidad, es posible que aumente en un futuro próximo32.
Infecciones por Clostridium difficileLa incidencia de diarrea asociada a C.difficile en pacientes hospitalizados ha ido aumentando en los últimos años33. Se calcula unos 500.000 por año en Estados Unidos34. Es patente que también ocurre en los pacientes trasplantados de órgano sólido35. En un estudio de Boutros et al.36 sobre infección por C.difficile en pacientes trasplantados de órgano sólido la incidencia fue del 12,4%, aumentando en los últimos años, fundamentalmente en los primeros 15días postrasplante. La incidencia varía según el tipo de trasplante, oscilando entre el 3,5% en trasplantados renales37, del 7,4%38 al 22,5%39 en trasplantados de pulmón, el 8% en trasplantados hepáticos o el 16% en trasplantados pediátricos40, y el 9% en trasplantados de intestino41. Sin embargo, en España su incidencia en trasplantados de órgano sólido es baja (0,94%) y la mortalidad, nula42. Los factores de riesgo son fundamentalmente la ingesta de antibióticos de amplio espectro y de inhibidores de la bomba de protones, así como el aumento de la inmunosupresión43. Cuando la diarrea es grave, los factores de riesgo asociados son la leucocitosis (>25.000/μl) y la evidencia de pancolitis mediante una TAC36. Cuando el paciente trasplantado cursa con diarrea severa y/o colitis pseudomembranosa, la mortalidad es elevada (hasta el 20-30% cuando la cepa es del tipoiii ribotype O2744,45), así como la pérdida del injerto, que puede alcanzar hasta el 100%36. En estos casos de severidad la colectomía mejora la supervivencia (83%) y la pérdida del injerto (20%)36.
Infecciones fúngicasLos pacientes que reciben un trasplante de órgano sólido tienen un riesgo elevado de presentar infección fúngica invasora.
Infecciones por Candida spp. y AspergillusCandidaspp. es el responsable de la mayoría de casos46. En los últimos años la incidencia de candidiasis invasora en el trasplante de órgano sólido se ha reducido notablemente (alrededor del 2%, cifra inferior a la referida en décadas previas, que oscilaba entre el 4 y el 6%). Su incidencia varía según el órgano trasplantado, siendo especialmente elevada en los trasplantes de órganos abdominales (hepático, pancreático e intestinal). En estos pacientes la supervivencia global al año del trasplante es del 66%47. En un estudio reciente de casos y controles de trasplantados de órgano sólido en España (156 casos y 300 controles), más de la mitad de los casos (57%) ocurrían en el periodo precoz del postrasplante y, por ello, durante la hospitalización48. Los factores de riesgo para padecer infección nosocomial por infección fúngica invasora en el trasplantado son los relacionados con la intervención quirúrgica (presencia de colecciones, drenajes y catéteres), insuficiencia renal que requiera diálisis o hemofiltración, retrasplante, requerimiento transfusional importante, reintervención inmediata, trombosis del injerto, donante añoso, fistula de líquido pancreático al peritoneo y anastomosis vesical (en trasplante pancreático), hepatitis fulminante, coledocoyeyunostomía como anastomosis biliar (en trasplante hepático), colonización por Aspergillusspp. durante los 6meses previos al trasplante de pulmón49,50. También se han descrito infecciones fúngicas, como Histoplasma capsulatum, transmitidas por los injertos y procedentes del donante o de los líquidos de preservación51.
Las puertas de entrada más frecuentes en caso de Candidaspp. son la intestinal (colonización previa) y la relacionada con catéteres endovasculares y urinarios. La candidemia es la presentación más frecuente en las formas invasivas, y la mucocutánea, la orofaríngea y la vaginal son formas no invasivas muy frecuentes en pacientes hospitalizados47. La candidemia es una infección frecuente en las UCI, en pacientes con trasplantes de órganos abdominales, politraumatizados o grandes quemados52. Con frecuencia Candidaspp. ocupa el tercer lugar como causa de infección en la población de pacientes críticos (tras S.aureus y P.aeruginosa)53. Los pacientes con candidemia ingresados en una UCI tienen una tasa de mortalidad relacionada que oscila entre el 46 y el 56%54,55.
La infección por Aspergillus spp. ocurre con frecuencia durante la hospitalización, aunque en pacientes severamente inmunodeprimidos aumenta nuevamente su incidencia en el periodo tardío. Cuando el tejido (pulmonar y/o cutáneo) se infecta, invade el sistema vascular originando infartos, hemorragia y diseminación hematógena. La manifestación más frecuente es la pulmonar, aunque ocasionalmente puede presentarse como infección de la herida quirúrgica. No suele diferir de otros pacientes inmunodeprimidos no trasplantados. La mortalidad es elevada (alrededor del 50%)56.
Infecciones por Pneumocystis jiroveciiA pesar de que Pneumocystis es un microorganismo oportunista y por tanto produce infecciones a partir del primer mes en aquellos pacientes que no reciben profilaxis con cotrimoxazol, recientemente se han descrito brotes de transmisión nosocomial en pacientes sin profilaxis, demostrándose total homogeneidad en las secuencias del ADN de las muestras de Pneumocystis57-59. Los autores consideran que todos los pacientes trasplantados de órgano sólido deben recibir profilaxis al menos 6meses después del trasplante.
VirusLas infecciones por virus respiratorios comunes, como rinovirus (RV), metapneumovirus (MPV), adenovirus (ADV), parainfluenza (PIV), virus respiratorio sincitial (SRV), bocavirus (BV) y coronavirus (COV), aparecen a lo largo del año y algunos son estacionales, como el virus influenza (IV). Aunque la mayor parte de las veces producen infecciones comunitarias, también se han descrito como causantes de infección intrahospitalaria, a veces por transmisión nosocomial (a través de pacientes infectados o de personal sanitario) a partir de tejidos o sangre infectada, por eliminación prolongada del virus debido a la inmunosupresión farmacológica o por reactivación de virus latentes en el periodo precoz60-63.
Aunque los virus de la gripe afectan a los pacientes en el periodo tardío del trasplante, ocasionalmente son causa de infección precoz y, por tanto, de aparición durante la hospitalización. Su manifestación clínica más frecuente es la afectación pulmonar en forma de neumonía bilateral. En estos casos la morbimortalidad es elevada64,65.
Las infecciones por virus del herpes simplex (VHS) son frecuentes durante las primeras 2-3semanas postrasplante en pacientes sin profilaxis, ya que con la inmunosupresión el virus se reactiva rápidamente (fundamentalmente los pacientes con micofenolato mofetilo y con globulinas antitimocíticas) hasta en un 40-50%66. El efecto de otros fármacos, como alemtuzumab y basiliximab, no es bien conocido. Las manifestaciones más frecuentes son las mucocutáneas, al igual que en otros pacientes no trasplantados, aunque de duración más prolongada. En algunas ocasiones pueden diseminarse y provocar desde una esofagitis, afectación intestinal, pulmonar o una hepatitis grave con una mortalidad cercana al 60-80%67,68.
Otros virus de la familia herpes, como varicela-zoster (VVZ), no aparecen durante la hospitalización, ya que suelen reactivarse tardíamente. Muy rara vez puede aparecer precozmente por transmisión del donante69.
Otras infecciones por microorganismos, como protozoos o helmintos, son excepcionales como responsables de infección nosocomial, ya que se requiere la colonización previa.
Medidas preventivasCon respecto a las infecciones bacterianas, las medidas para prevenir la bacteriemia en pacientes con trasplante de órgano sólido son las mismas que en los pacientes hospitalizados no inmunodeprimidos. Con respecto a los catéteres, las medidas preventivas están relacionadas con la simple aplicación de las recomendadas por el CDC en el manejo de los catéteres intravasculares: lavado de manos, uso de métodos de barrera y evitar la canalización femoral como acceso venoso central, antisepsia de la piel con clorhexidina y eliminación de todos los catéteres innecesarios: de esta forma se reduce drásticamente la incidencia de bacteriemia relacionada con el catéter. En muchos pacientes, especialmente en los que reciben un trasplante renal, la sonda urinaria es también una fuente frecuente de bacteriemia, y la retirada temprana del sondaje urinario se asocia a una menor incidencia de infección urinaria y de recurrencias. Aunque la aparición de bacterias oportunistas no suele darse en el periodo precoz del trasplante, cuando el paciente está hospitalizado la administración de cotrimoxazol (para prevenir P.jirovecii) también previene infecciones por Listeria monocytogenes, Streptococcus pneumoniae, H.influenzae, Nocardia asteroides y algunas bacterias gramnegativas. Es recomendable hacer estudios de vigilancia para identificar colonización nasal por SARM y, en caso de positividad, tratar con mupirocina tópica. Con esta medida se ha demostrado que la infección por este microorganismo se reduce significativamente, así como la tasa de bacteriemia30. Es importante instaurar pautas de profilaxis antibiótica quirúrgica, así como acortar el tiempo en la UCI y de intubación traqueal.
La prevención de la infección por bacilos no fermentadores se basa siempre en las medidas de aislamiento y el lavado apropiado de manos. Para evitar la aparición de cepas multirresistentes se ha demostrado que el uso restringido de quinolonas y la rotación de antibióticos son medidas útiles en terapia intensiva.
La prevención de la infección por C.difficile no está bien establecida. Como medidas generales es muy importante aislar a los pacientes afectos desde el punto de vista entérico para prevenir transmisión entre pacientes durante el ingreso. El lavado de manos y el uso de guantes son muy importantes en el personal sanitario, con especial énfasis en los pacientes con diarrea.
Otras medidas más específicas serían ajustar la duración del tratamiento antibiótico y limitar su uso siempre que sea posible, y reducir o suprimir los fármacos inhibidores de la bomba de protones. Otras medidas en pacientes con factores de riesgo, como son la profilaxis primaria con metronidazol o la ingesta de probióticos, no están suficientemente demostradas35,70.
No existe una recomendación absoluta para la prevención de las infecciones fúngicas en los pacientes trasplantados. Existen pocos estudios aleatorizados, aunque se ha llegado a un consenso que los pacientes que tengan riesgo de infección fúngica invasora se benefician de profilaxis primaria. No se acepta la instauración universal de azoles, ya que puede seleccionar cepas de Candidaspp. con menor sensibilidad o resistencia a estos antifúngicos. Sin embargo, los pacientes de riesgo y los pacientes con trasplante pancreático, intestinal y pulmonar reciben profilaxis durante su hospitalización. Con respecto al trasplante hepático, una estrategia que se está llevando a cabo en la mayoría de los centros españoles es la de administrar profilaxis selectiva solo a los receptores con factores de riesgo de padecer infección fúngica invasora35,36. Para la profilaxis selectiva en estos pacientes de riesgo se ha utilizado y recomendado en las guías americanas sobre todo fluconazol y anfotericinas lipídicas (suponen un elevado riesgo de nefrotoxicidad para el paciente trasplantado), que en caso del pulmón pueden administrarse nebulizadas71. Recientemente se han realizado o se están llevando a cabo en el seno de GESITRA estudios que demuestran la eficacia de la profilaxis con candinas (caspofungina, anidulafungina y micafungina) durante la hospitalización, motivo por el que las recomendaciones españolas las han incorporado72-74.
La infección por P.jirovecii puede y debe prevenirse mediante profilaxis con trimetoprim-sulfametoxazol, iniciándose precozmente tras el trasplante, dado que no solo puede ocurrir en el periodo tardío sino que se han descrito brotes por transmisión de persona a persona y, por tanto, puede aparecer como neumonía nosocomial57-59.
Finalmente, con respecto a los virus, es recomendable que en los pacientes seropositivos frente a los virus herpes (VHS-1 y 2) y que no reciban profilaxis para CMV, y en los severamente inmunodeprimidos, pueda prevenirse su reactivación en el periodo precoz con aciclovir al menos un mes66,67,75. Con respecto al virus influenza, es recomendable la vacunación antes del trasplante (en lista de espera) con la finalidad de que no ocurra la infección en el postrasplante precoz.
Infecciones nosocomiales en el receptor de un trasplante de progenitores hematopoyéticosEl trasplante de progenitores hematopoyéticos (TPH), en sus 2 modalidades alogénico (aloTPH) y autólogo (TAPH), es una terapéutica ampliamente utilizada para el tratamiento de diversas hemopatías y tumores sólidos76. Anualmente se realizan en nuestro país más de 2.000 TPH. Cambios en la metodología del trasplante, que proporcionan una recuperación hematopoyética más rápida, han permitido la realización de TPH en pacientes de mayor riesgo por su edad y por la fase de la enfermedad. Además, el uso de agentes inmunosupresores cada vez más potentes y/o la depleción linfoide del inóculo han incrementado notablemente la ya de por sí elevada incidencia de complicaciones infecciosas que hoy en día constituyen la causa más importante de morbimortalidad en el TPH de donante no emparentado y de mortalidad precoz postrasplante en el autoTPH77,78.
La incidencia y la prevalencia de infecciones nosocomiales en pacientes sometidos a un TPH no están bien establecidas. La mayoría de estudios hacen referencia a la fase neutropénica, y las que ocurren después de más de 3meses postrasplante no han sido estudiadas. Se necesitan estudios en estos pacientes que combinen las etapas de hospitalización y no hospitalización pero relacionadas con el sistema sanitario que definen el manejo de estos pacientes.
Factores predisponentes y patrones de infecciónLos factores de riesgo relacionados con la infección son múltiples y pueden clasificarse en endógenos (relacionados con el huésped y enfermedad de base) y exógenos (relacionados con el tratamiento y el ambiente).
PretrasplanteLa mayoría de receptores de un TPH presentan inmunosupresión debido a la enfermedad de base y a los tratamientos recibidos. Las barreras mucocutáneas están a menudo comprometidas (mucositis, catéteres, sondas urinarias) y la flora bacteriana normal está comprometida por medicaciones previas. En esta fase la mayoría de infecciones se producen por flora endógena del paciente: el 47% de los pacientes están colonizados por microorganismos adquiridos de forma nosocomial, y predominan las infecciones por gramnegativos79,80.
PostrasplanteEl periodo de reconstitución inmunológica tras el TPH es muy variable y depende del tipo de trasplante, de la fuente de progenitores (sangre periférica o médula ósea), del régimen de acondicionamiento, del grado de histocompatibilidad entre donante y receptor, de la presencia de EICH y de su tratamiento81. Por ello, la incidencia de infecciones en el TAPH será mucho menor que en el aloTPH. Otros factores comunes a ambos tipos de trasplante son los mencionados en la fase pretrasplante. Además existe una alteración en la inmunidad celular, tanto en el número como en la función de los linfocitosT, durante 6meses tras el aloTPH y hasta 18meses si se trata de un aloTPH con depleción de linfocitos T (DLT) y entre 4-12meses en el TAPH que favorece la aparición de infecciones víricas. La inmunidad humoral está también alterada, la IgG está disminuida durante 9meses (18meses si es un aloTPH con DLT y 3-4meses en el TAPH). Si existe EICH crónica, esta inmunodeficiencia se mantiene mientras persiste dicha complicación, estando el paciente predispuesto a presentar infecciones por gérmenes encapsulados. El déficit persistente de IgA aumenta la susceptibilidad a infecciones de las barreras mucosas (p.ej., sinusitis e infecciones intestinales).
A partir del día del TPH (día0), en función de los factores de riesgo antes mencionados, y de la recuperación inmune, se distinguen 3 fases evolutivas en las que predominan determinados tipos de infección82 (tabla 1).
Riesgo de infección en el receptor de un TPH
| Periodo | Agentes infecciosos |
| Periodo neutropénico(días 0-30) | Bacterias: grampositivas, gramnegativas, C.difficileHongos: Candida spp., Aspergillus spp., Fusarium spp.Virus: VHS, VRSProtozoo: Toxoplasma gondii |
| Periodo intermedio (después del implante medular, días 30-100) | BacteriasVirus: CMV, VVZ, HHV-6, VRS, Adenovirus, BK virusHongos: Aspergillus spp., P.jiroveciProtozoo: Toxoplasma gondii |
| Periodo tardío (>100 días post-TPH) | Bacterias encapsuladas: S.pneumoniae, H.influenzae, C.difficileVirus:VVZ, CMV, VRSHongos: Aspergillus spp., P.jirovecciProtozoo: Toxoplasma gondii |
1. Período neutropénico. Días 0-30. La neutropenia es el principal factor de riesgo durante este período. El riesgo de infección aumenta con la severidad de la neutropenia (mayor si <100μl), la rapidez con que se produce y la duración de la misma. La duración media de la neutropenia es de 2-3semanas.
Los patógenos más frecuentes en esta fase son las bacterias (principalmente endógenas), Candidaspp. En fases más tardías de neutropenia pueden verse infecciones por microorganismos resistentes, diarreas por C.difficile y Aspergillusspp.83.
2. Período intermedio. Días 30-100. Es el periodo que sigue al implante medular, incluye el segundo y tercer mes post-TPH. La inmunodepresión y la EICH aguda son las responsable de las infecciones víricas y fúngicas en esta etapa. Destacan por su frecuencia la infección por CMV, cistitis hemorrágica por adenovirus o virus BK, candidiasis diseminada y aspergilosis, que aumentan de forma alarmante si el periodo de neutropenia ha sido prolongado84.
3. Período tardío (>100 días post-TPH). Después de los primeros 100días, el riesgo de infección depende de la rapidez en completar la recuperación del sistema inmune, de la coexistencia o no de EICH crónica y de la intensidad de su tratamiento. Las infecciones tardías suelen ser secundarias a bacterias encapsuladas (S.pneumoniae y H.influenza), Aspergillus, Pneumocystis jiroveci y VVZ83.
Microorganismos responsables de infecciones nosocomiales y manifestaciones clínicasBacteriasPatógenos bacterianos más comunes. Las infecciones bacterianas se presentan en el periodo inmediato postrasplante, suponen más del 90% de las infecciones observadas en la fase de neutropenia y cursan con bacteriemia en el 30% de los casos.
Tanto la sangre periférica como la médula ósea pueden estar contaminadas. En un estudio realizado, el 1% y el 6%, respectivamente, de las preparaciones presentaban cultivo positivo. Sin embargo, la significación clínica y la contribución a la sepsis de este hecho es insignificante80.
En los últimos años, debido a la mucositis y a las aplasias más severas, al empleo de sistemas de acceso venoso permanente y al uso de profilaxis antibiótica con fluoroquinolonas, se ha asistido a una disminución de las infecciones causadas por gramnegativos y a un aumento de las originadas por grampositivos (68% de los casos)81-83, y en particular estafilococos coagulasa-negativos, cuyo origen se encuentra en el catéter. Aunque es difícil definir la incidencia de la infección de catéter en estos pacientes, podría estar alrededor de 11,5 por cada 1.000 días de catéter. Estas infecciones presentan una escasa mortalidad (<5%), a diferencia de las producidas por S.viridans82-84.
Otras infecciones, como las producidas por L.monocytogenes y Nocardiaspp., son menos frecuentes debido al papel profiláctico combinado que ejerce el cotrimoxazol al ser utilizado para evitar la infección por Pneumocystis jirovecci.
Las infecciones por bacilos gramnegativos (E.coli, K.pneumoniae y P.aeruginosa) se originan en el tracto gastrointestinal del paciente y predominan en la fase neutropénica. En los últimos años, al igual que en la población general, y debido en parte al uso de las quinolonas como profilaxis, se detectan infecciones de gramnegativos resistentes a las mismas y por productores de BLEE79,80,84. En relación con el uso de carbapenemes se ha asistido, en muchos centros trasplantadores, a un incremento en el número de infecciones producidas por S.maltophilia.
Las infecciones por S.aureus están relacionadas en la mayoría de los casos con el uso del catéter. Los factores de riesgo para presentar una infección por SARM son las mismas que las presentadas por la población general y dependen mucho de la epidemiología de cada centro trasplantador.
Aproximadamente la mitad de los pacientes trasplantados presentan diarrea, y C.difficile es responsable del 15% de las mismas, habiéndose descrito brotes en unidades de trasplante79,80. No se ha descrito una mayor mortalidad en estos pacientes.
La incidencia de tuberculosis en el TPH en nuestro país es baja (0,3%), igual a la población general en el TAPH y unas 3-10 veces superior en el aloTPH (datos no publicados)83. Las infecciones por micobacterias no tuberculosas, aunque poco frecuentes, tienen su origen principalmente en el catéter.
Se ha descrito algún brote de infección por Legionella pneumophila y no pneumophila en receptores de un aloTPH en relación a contaminación de los sistemas de distribución del agua del hospital o de torres de frío o sistemas de aire acondicionado. La mortalidad en estos pacientes oscila entre el 40 y el 50%79. Sin embargo, los sistemas de control de infección que se realizan en estos pacientes ingresados habitualmente en áreas de aislamiento hacen que la incidencia de esta infección sea baja.
HongosLa prevalencia de infección fúngica invasiva demostrada en autopsias durante las 2 últimas décadas en estos enfermos oscila en torno al 31%, y la mayoría de ellas son un hallazgo necrópsico85. Los hongos aislados con mayor frecuencia son Candidaspp. y Aspergilusspp.85,86. Otros hongos que aparecen con menos frecuencia son Fusarium, Scedosporium, Mucorales y otros hongos emergentes, en relación probablemente con la selección de especies producida con el uso de los nuevos antifúngicos79,83,85,86. Son factores predisponentes la inmunosupresión, la administración de antibióticos de amplio espectro, el uso de CVC durante largos períodos de tiempo, la administración de nutrición parenteral, la desnutrición, la alteración de las barreras anatómicas (piel y mucosas) y la neutropenia prolongada83.
Candida spp. La incidencia de candidemia en el TPH es inferior al 5%, y aparece en el periodo de neutropenia. En los últimos años y en relación con el uso de fluconazol en profilaxis, las infecciones producidas por Candida no-albicans son las más frecuentes en estos pacientes86,87. Se ha documentado transmisión nosocomial de Candidaspp. por estudios de biología molecular, siendo el factor predisponente el contacto indirecto entre pacientes a través de las manos del personal del hospital. C.parapsilosis, por su implicación en la infección de catéter, ha sido la más frecuentemente aislada en estos casos79.
Aspergillus spp. La infección por Aspergillusspp. tiene una incidencia en nuestro país del 8,9% (datos RESITRA), similar a la observada en otras localizaciones85. La aspergilosis invasora sigue una distribución bimodal con un primer pico durante la fase de neutropenia y un segundo, cada vez más frecuente, alrededor del día +100 en los pacientes con EICH sometidos a tratamiento inmunosupresor83,86. Aspergillus fumigatus sensible a los antifúngicos habituales es la especie más frecuentemente aisladas en nuestro país88. La afectación más frecuente es la pulmonar, pudiendo diseminarse al sistema nervioso central o a cualquier otro órgano.
Dada la ubicuidad del hongo, el factor ambiental tiene claramente un impacto en el desarrollo de la infección. Durante la fase neutropénica, el no estar en zonas con filtros de alta eficacia (HEPA) incrementa en 10 veces la probabilidad de presentar una aspergilosis. Se han descrito brotes de infección nosocomial en relación con obras cercanas a las unidades de trasplante o en relación con la colonización de los sistemas del agua79.
Otros. En un estudio reciente realizado a través del GETH, el 1,3% de 557 aloTPH presentaron una infección por hongos filamentosos no-Aspergillus (datos no publicados). Clínicamente estas infecciones son difíciles de diferenciar de la infección aspergilar, y es necesario el diagnóstico microbiológico para establecer, si es posible, el tratamiento correcto.
La neumonía por P.jiroveci es infrecuente debido a la profilaxis con cotrimoxazol, pero puede aparecer en cualquier periodo postrasplante89. Se han demostrado casos de transmisión persona a persona, por lo podría estar indicado aislar a los pacientes79,80.
Protozoos y helmintosLa infección por parásitos es poco frecuente en el TPH, predomina en fases tardías y se trata habitualmente de una reactivación de infección latente (Toxoplasma gondii)90. Se han descrito casos de enfermedad de Chagas transmitida por el donante o por transfusiones sanguíneas, por lo que debe hacerse el cribado tanto del donante como del receptor de zonas endémicas o de pacientes con estancias prolongadas en dichas zonas80.
VirusLas infecciones víricas son frecuentes en los pacientes sometidos a un TPH, y podemos clasificarlas en las debidas a los virus del grupo herpes y las producidas por virus respiratorios.
En general, las infecciones por virus herpes (citomegalovirus, herpes simple, virus varicela-zoster, herpes virus humano 6, 7 y 8, virus Epstein-Barr) son reactivaciones de infecciones previas, y por tanto no son objeto de esta revisión. Se han descrito casos de transmisión nosocomial de virus del herpes simple y varicela-zoster por contacto directo y/o por vía aérea79.
Los virus respiratorios (Rhinovirus, Parainfluenza, Influenza, virus respiratorio Sincitial [VRS], etc.) tienen, la mayoría de ellos, un predominio estacional y constituyen un verdadero problema para los pacientes trasplantados. Habitualmente causan infecciones del tracto aéreo superior, pero pueden originar neumonías y asociarse a una elevada morbimortalidad, que puede oscilar entre el 30 y el 60%79,91,92. Se considera que aproximadamente la mitad de las infecciones respiratorias pueden ser adquiridas en el hospital79.
Otros virus, como Coxsackie y Rotavirus, pueden transmitirse por vía respiratoria o fecal/oral y pueden causar erupción, síntomas respiratorios y diarrea.
Medidas preventivas y estrategias de controlEs difícil establecer medidas preventivas generales, ya que existen muchos factores que condicionan las infecciones nosocomiales en estos pacientes. Además, son pacientes sometidos a múltiples tratamientos antibióticos e intervenciones (quimioterapia, factores estimulantes granulocíticos, transfusiones, etc.), el grado de neutropenia e inmunodepresión es variable de paciente a paciente y combinan constantemente la estancia hospitalaria y domiciliaria en el proceso del trasplante. Muchas de las prácticas instauradas en el hospital deben ser mantenidas en casa.Hablaremos, pues, de medidas generales y medidas farmacológicas.
Medidas preventivas generalesNo existen medidas de prevención y control de la infección específica para ser aplicadas de forma universal en las unidades de trasplante. Existen varias guías, con recomendaciones ambientales y de medidas que afectan al paciente, a sus cuidadores y a los familiares79.
Ambientales- -
Aire. Alrededor del 80% de los centros disponen de áreas de aislamiento con ambiente protegido con filtros HEPA que evitan la presencia bacterias y esporas de hongos en el aire. Existen recomendaciones de cómo deben ser estas unidades desde el punto de vista ambiental, y los controles y mantenimiento de estructuras que deben seguir93.
- -
Agua. Control y mantenimiento de los circuitos y depósitos de agua con descontaminación si es preciso93.
- -
Superficies y equipos. El ambiente inanimado que rodea al paciente puede jugar un papel en la transmisión de infecciones, y por lo tanto deben seguirse una serie de normas para su limpieza correcta93. Si no se está en situación de brote no se recomiendan cultivos medioambientales rutinarios.
El lavado correcto de las manos previene la infección nosocomial, y por lo tanto dicha técnica es de obligado cumplimiento por parte del personal sanitario y de los familiares y visitantes94. No se ha demostrado que el uso de gorro, guantes, mascarillas, batas y polainas al entrar a las unidades disminuya la incidencia de infección nosocomial; sin embargo, existen centros donde esta práctica es habitual. El uso de mascarillas puede estar recomendado en época invernal si el paciente sale de la zona de aislamiento o cuando el personal que le atiende y los familiares que le visitan pueden sufrir riesgo de presentar un virus respiratorio.
Medidas preventivas farmacológicas- -
Profilaxis antibacteriana. En este momento, la profilaxis con trimetoprim-sulfametoxazol (3 días a la semana) evita la infección por P.jiroveci y evita también otras infecciones bacterianas. No existe actualmente consenso respecto al uso de quinolonas u otros antibióticos en profilaxis en pacientes neutropénicos. Tampoco se recomienda el uso de antibióticos para la prevención de la infección de catéter.
En pacientes con EICH crónica en tratamiento inmunosupresor prolongado se aconseja la profilaxis antibiótica con el fin de evitar infecciones por bacterias encapsuladas80.
Se recomienda hacer una política de antibióticos correcta en estos pacientes, reducir el espectro y el tiempo de administración siempre que sea posible con el fin de evitar la aparición de patógenos resistentes y de C.difficile.
- -
Profilaxis antifúngica. La selección de un protocolo de profilaxis tendría que ir en función de la epidemiología de cada centro. En la actualidad el uso de los nuevos antifúngicos (posaconazol, voriconazol, micafungina, anfotericina liposomal) con actividad frente a hongos filamentosos en profilaxis en el aloTPH ha desplazado al uso de fluconazol en estos pacientes. Se recomienda la lectura de las guías ECIL para la elección del antifúngico en cada situación95.
- -
Profilaxis antivírica. Se realiza con aciclovir hasta el momento del implante o la recuperación de la mucositis. Para CMV puede hacerse profilaxis con valganciclovir/ganciclovir, aunque está mucho más estandarizada la práctica de determinación seriada de PCR para establecer en el caso de positividad un tratamiento anticipado de la infección.
- -
Inmunoglobulinas. No se ha evidenciado ningún efecto beneficioso con su uso. Por lo tanto, su indicación se somete a valoración individual en casos concretos de hipogammaglobulinemia con infecciones de repetición79,80,83.
- -
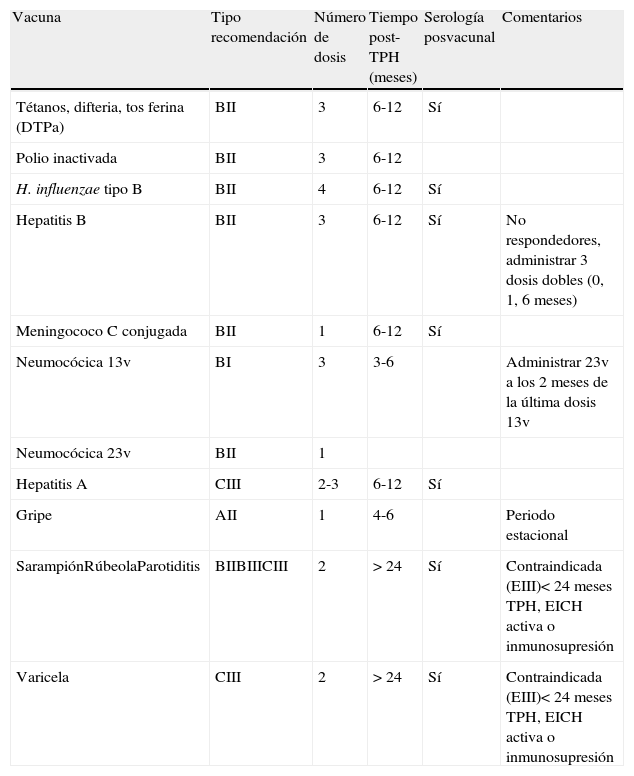
Inmunización activa. Se recomienda la reinmunización de todos los pacientes siguiendo el calendario vacunacional establecido (tabla 2). Se recomienda la vacunación de los familiares y del personal sanitario frente al virus de la gripe en época invernal.
Tabla 2.Vacunas recomendadas en niños >7años, adolescentes y adultos receptores de TPH (según nivel de evidencia)
Vacuna Tipo recomendación Número de dosis Tiempo post-TPH (meses) Serología posvacunal Comentarios Tétanos, difteria, tos ferina (DTPa) BII 3 6-12 Sí Polio inactivada BII 3 6-12 H.influenzae tipo B BII 4 6-12 Sí Hepatitis B BII 3 6-12 Sí No respondedores, administrar 3 dosis dobles (0, 1, 6meses) Meningococo C conjugada BII 1 6-12 Sí Neumocócica 13v BI 3 3-6 Administrar 23v a los 2meses de la última dosis 13v Neumocócica 23v BII 1 Hepatitis A CIII 2-3 6-12 Sí Gripe AII 1 4-6 Periodo estacional SarampiónRúbeolaParotiditis BIIBIIICIII 2 >24 Sí Contraindicada (EIII)<24meses TPH, EICH activa o inmunosupresión Varicela CIII 2 >24 Sí Contraindicada (EIII)<24meses TPH, EICH activa o inmunosupresión Fuente: Magda Campins, Xavier Martines, Yolima Cossio, José M. Bayas. Disponible en: http://www.sempsph.com/sempsph/index.php.
AII: siempre recomendada; BI: muy recomendada; BII: generalmente recomendada; CIII: opcional; EIII: contraindicada.
Serología posvacunal 1-3 meses tras vacunación.
Los autores declaran no tener ningún conflicto de intereses.
Nota: sección acreditada por el Consell Català de Formació Continuada de les Professions Sanitàries. Consultar preguntas de cada artículo en: http://www.eslevier.es/eimc/formacion