La osteogénesis imperfecta (OI) es una enfermedad genética que cursa con fragilidad ósea. Varios trabajos han demostrado la eficacia de los bisfosfonatos. El objetivo de este estudio es evaluar la evolución de la densidad mineral ósea (DMO) y parámetros bioquímicos de metabolismo óseo, en pacientes adultos con OI tratados con ácido zoledrónico iv.
Material y metodosEstudio prospectivo no aleatorizado con pacientes adultos con OI con osteoporosis u osteopenia, con T-score <2, e intolerancia o contraindicación de bisfosfonatos orales, a los que se administró ácido zoledrónico iv cada 6 meses.
Se realizó densitometría basal y cada año. Se determinaron basal y anualmente calcio total (Ca), fósforo (P), paratirina intacta (PTHi), 25 hidroxivitamina D (Vit D) y marcadores de remodelado óseo: fosfatasa alcalina ósea (FAO), telopéptido carboxiterminal del colágeno tipo I (ß cross-laps [CTX] y deoxipiridolina urinaria (DOP). Se registraron los efectos secundarios y la aparición de nuevas fracturas.
ResultadosSe trataron 10 pacientes, 2 hombres y 8 mujeres.
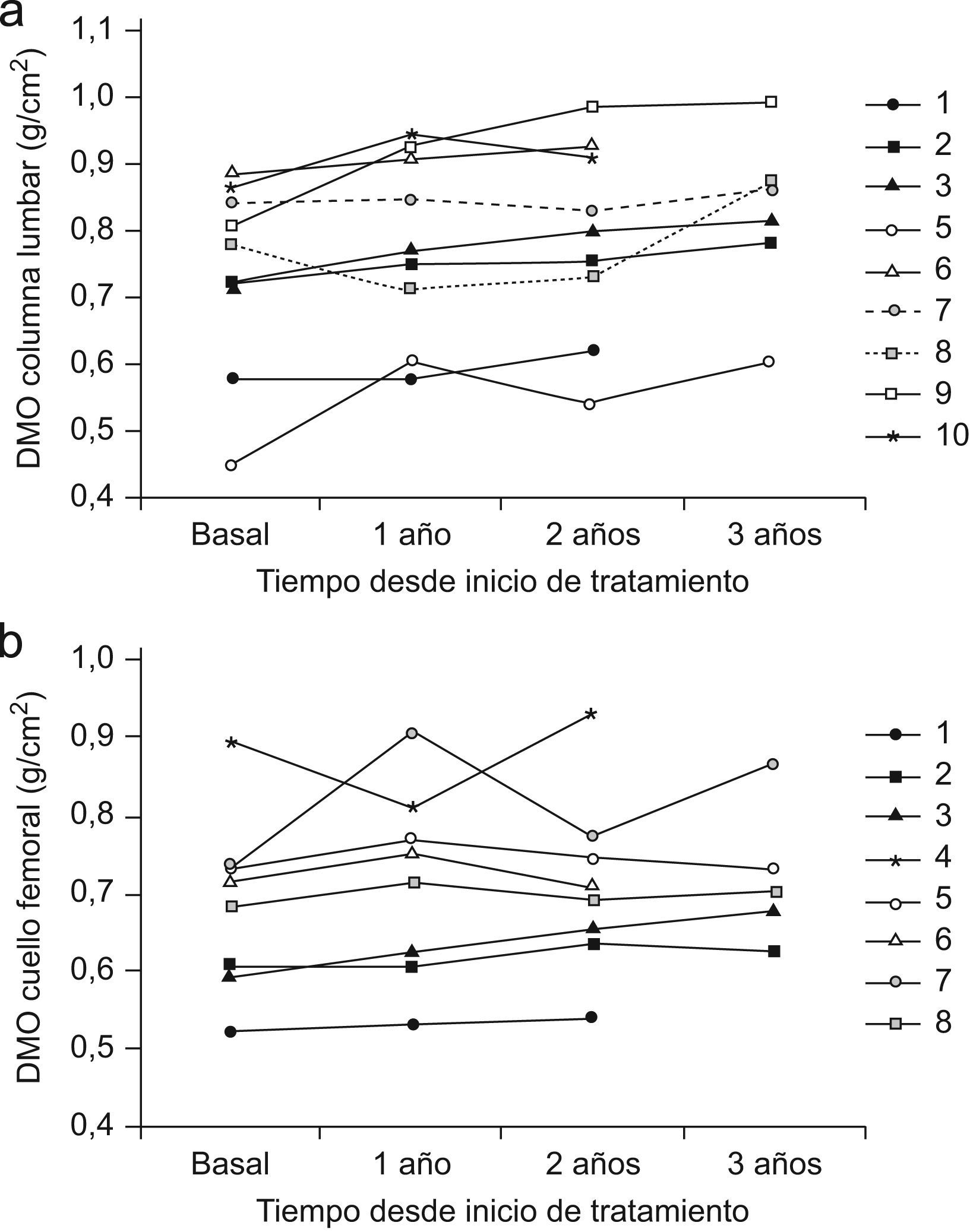
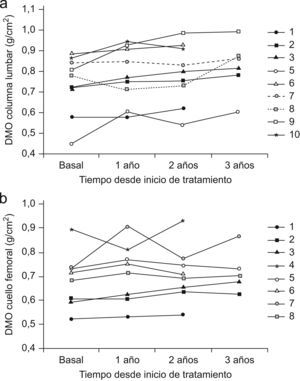
La DMO medida en columna lumbar mostró un aumento significativo a los 24 (0,738±0,141 vs 0,788±0,144g/cm2; p=0,048) y a los 36 meses (0,720±0,139 vs 0,820±0,128) con respecto a la basal. En cuello femoral se evidenció un incremento significativo de la DMO a los 24 meses: 0,677±0,121 vs 0,703±0,122g/cm2; p<0,016.
No se evidenciaron cambios significativos en las concentraciones de Ca, P, FAO y CTX a lo largo de seguimiento. La concentración de PTHi aumentó y la de Vit D descendió a los 36 meses. La excreción de DOP disminuyó significativamente a los 24 meses. Siete pacientes presentaron un cuadro pseudogripal leve en las primeras 24h tras la primera infusión. No se evidenciaron efectos secundarios graves.
Ningún paciente ha presentado nuevas fracturas.
ConclusionesEl ácido zoledrónico puede ser una alternativa cómoda, segura y eficaz para el tratamiento de la osteoporosis en pacientes adultos con OI.
Osteogenesis imperfecta (OI) is a genetic disorder that results in bone fragility. Several studies have demonstrated the effectiveness of bisphosphonate therapy. The aim of this study was to evaluate the effects of intravenous zoledronic acid on bone mineral density (BMD) and biochemical markers of bone turnover in adults with OI.
Material and methodsWe carried out a prospective non-randomized study in patients with osteoporosis or severe osteopenia (T score <−2) related to OI and intolerance or contraindication to oral bisphosphonates. The patients were treated with a zoledronic acid infusion every 6 months. Densitometry was carried out annually. Calcium (Ca), phosphate (P), intact parathormone (PTH), 25 hydroxyvitamin D and biochemical markers of bone turnover [bone alkaline phosphatase (BAP), beta-cross-laps (CTX) and urinary deoxypyridoxine (DOP)] were measured every year. Adverse events and new fractures were registered.
ResultsTen patients (2 men and 8 women) were treated. Treatment increased BMD measured in the lumbar spine after 24 (0.738±0.141 vs 0.788±0.144g/cm2; p=0.048) and 36 months (0.720±0.139 vs 0.820±0.128; p=0.01). Significant increases in BMD were also observed after 24 months in the femoral neck (0.677±0.121 vs 0.703±0.122g/cm2; p<0.016). Serum Ca, P, BAP and CTX concentrations remained unchanged. PTH concentrations increased and vitamin D concentrations decreased after 36 months of treatment. DOP excretion decreased significantly after 24 months. Seven patients had mild influenza-like symptoms occurring within the first 24h after the first infusion. No severe adverse events were observed. None of the patients had new fractures.
ConclusionZoledronic acid seems to be a safe and effective treatment option in adults with osteoporosis related to OI.
La osteogénesis imperfecta (OI) es una enfermedad genética rara debida a la mutación de los genes COL1A1 y COLA1A2 que intervienen en la formación del colágeno tipo 1, una proteína estructural que forma parte del hueso, la piel, dientes, tendones, ligamentos y escleróticas. Se hereda de forma autosómica dominante y su incidencia aproximada es de 1 caso por cada 20.000 nacimientos1,2.
La fragilidad ósea es una de las características principales de la OI, que determina la presencia de fracturas múltiples (en muchos casos, presentes al nacimiento) y las deformidades óseas progresivas3. La mayor parte de los pacientes adultos presentan osteoporosis y no está claramente establecido cuál debe ser el tratamiento de elección en estos casos. Sin embargo, varios estudios han mostrado efectos favorables de los bisfosfonatos administrados tanto por vía oral como iv sobre la densidad mineral ósea (DMO), parámetros de remodelado óseo e incluso histomorfometría, por lo que estos fármacos se consideran hoy en día la terapia más prometedora para el tratamiento de pacientes adultos con OI4–7.
El objetivo de este estudio es evaluar la evolución de la DMO y parámetros bioquímicos de metabolismo óseo en pacientes adultos con osteogénesis imperfecta que han sido tratados con ácido zoledrónico iv.
Material y métodosSe trata de un estudio prospectivo no aleatorizado en el que se han incluido pacientes adultos con OI (diagnosticados por la clínica) con osteoporosis u osteopenia, con T score a nivel de columna lumbar y/o de cuello femoral por debajo de -2, que hubieran presentado intolerancia a bisfosfonatos orales o bien estos estuvieran contraindicados, o no hubieran demostrado eficacia previamente (generalmente por falta de cumplimentación terapeútica) y que fueron tratados con ácido zoledrónico al menos durante un año. Siete pacientes tienen un periodo de seguimiento de 36 meses, 2 de 24 meses y 1 de 1 año.
Se recogieron datos referentes a la historia familiar y a fracturas previas. Se evaluó en cada caso la presencia de escleróticas azules, dentinogénesis imperfecta, talla baja, cifoescoliosis u otras deformidades óseas, e hipoacusia confirmada por audiometría. Cuatro pacientes con movilidad muy limitada se desplazaban habitualmente en silla de ruedas. En todos los pacientes se realizó un estudio hormonal para descartar otras causas de osteoporosis (hiperparatiroidismo, hipertiroidismo, déficit de hormona de crecimiento, hipogonadismo e hipercortisolismo). Todos firmaron un documento de consentimiento informado ante testigo, tramitándose la solicitud del fármaco (ácido zoledrónico) para uso compasivo, que fue aceptado en cada caso por las autoridades competentes. A las mujeres premenopausicas se les insistió en la toma de medidas anticonceptivas. Se les administró ácido zoledrónico (4mg iv en infusión continua durante al menos 15min) cada 6 meses, forzándose la ingesta hídrica durante las horas previas y posteriores a la administración del fármaco. Todos los pacientes recibían suplementos diarios de calcio (500–1.000mg) y vitamina D (400–800UI).
Se realizó densitometría radiológica de doble energía previa al inicio del tratamiento y posteriormente de forma anual con densitómetro Hologic en cuello femoral (coeficiente de variación 1,72%) y/o columna lumbar (L2–L4) (coeficiente de variación 1,37%). La medida de la DMO se expresa en gramos/cm2. Dos pacientes tenían prótesis femorales bilaterales por lo que en ellos solo pudo medirse DMO a nivel lumbar. Otra paciente portaba placas metálicas en columna por lo que en su caso solo se pudo medir la DMO en fémur.
Se determinaron basal y anualmente hemograma, calcio total (Ca), fósforo (P), paratirina intacta (PTHi) con inmunoensayo de quimioluminescencia, 25-hidroxi-vitamina D3 (Vit D) con inmunoensayo de quimioluminiscencia, fosfatasa alcalina ósea (FAO) mediante electroinmunoanálisis, y telopéptido carboxiterminal del colágeno tipo I (ß cross-laps [CTX]) con inmunoanálisis de electroquimioluminiscencia. Todas estas determinaciones se realizaron en ayunas, antes de la infusión del fármaco. Se determinó deoxipiridolina en la segunda muestra de orina de la mañana mediante quimioluminiscencia (DOP). Asimismo, 24 y 48h tras la 1.a infusión se realizaron controles de Ca, P, creatinina (Cr) y hemograma en ayunas. Se registraron los efectos secundarios después de cada dosis y la aparición de nuevas fracturas durante el seguimiento.
Los resultados se muestran como media±desviación estándar. Se aplicó el test estadístico T para muestras pareadas utilizando el paquete estadístico SPSS15.0. Dado el pequeño tamaño de la muestra se aplicó previamente el test de Kolmogorov-Smirnov, confirmándose que se ajustaba a distribución normal.
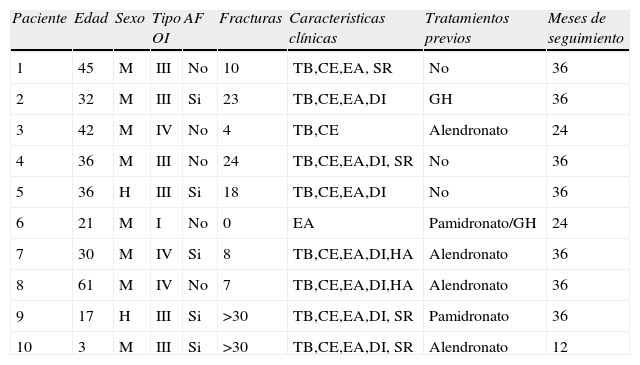
ResultadosSe trataron 10 pacientes (2 varones y 8 mujeres) con edades comprendidas entre 17–61 años (edad media 37±12 años). Solo una paciente presentaba una forma leve de la enfermedad (OI tipo I). El resto (90%) presentaban OI grave (tipos III-IV). Todas las mujeres, salvo una, eran premenopausicas. En todos se descartaron otras causas de osteoporosis. Las características clínicas de los 10 pacientes, los tratamiento previos y el tiempo de seguimiento se muestran en la tabla 1.
Características de los pacientes y seguimiento
| Paciente | Edad | Sexo | Tipo OI | AF | Fracturas | Caracteristicas clínicas | Tratamientos previos | Meses de seguimiento |
| 1 | 45 | M | III | No | 10 | TB,CE,EA, SR | No | 36 |
| 2 | 32 | M | III | Si | 23 | TB,CE,EA,DI | GH | 36 |
| 3 | 42 | M | IV | No | 4 | TB,CE | Alendronato | 24 |
| 4 | 36 | M | III | No | 24 | TB,CE,EA,DI, SR | No | 36 |
| 5 | 36 | H | III | Si | 18 | TB,CE,EA,DI | No | 36 |
| 6 | 21 | M | I | No | 0 | EA | Pamidronato/GH | 24 |
| 7 | 30 | M | IV | Si | 8 | TB,CE,EA,DI,HA | Alendronato | 36 |
| 8 | 61 | M | IV | No | 7 | TB,CE,EA,DI,HA | Alendronato | 36 |
| 9 | 17 | H | III | Si | >30 | TB,CE,EA,DI, SR | Pamidronato | 36 |
| 10 | 3 | M | III | Si | >30 | TB,CE,EA,DI, SR | Alendronato | 12 |
AF: antecedentes familiares; CE: cifoescoliosis; DI: dentinogénesis imperfecta; EA: escleras azules; GH: hormona de crecimiento; H: hombre; HA: hipoacusia; M: mujer; SR: silla de ruedas; TB: talla baja; OI: osteogénesis imperfecta.
Las concentraciones de Ca disminuyeron significativamente a las 48h de la primera infusión con respecto a los basales: Ca: 9,55±0,5mg/dl; a las 24h: 9,4±0,8mg/dl; a las 48h: 9,3±0,5mg/dl (p=0,035). Solo en 1 caso se objetivó un descenso por debajo del límite inferior de la normalidad en nuestro laboratorio (8,4, siendo el límite 8,5mg/dl), sin repercusión clínica, y con recuperación espontánea en las siguientes horas. Durante el seguimiento posterior no hubo cambios en la calcemia. La Cr en sangre se mantuvo sin cambios con respecto a la basal, a las 24 y 48h de la infusión (0,70±0,06, 0,67±0,05, y 0,68±0,08mg/dl, respectivamente). Tampoco variaron los niveles de P postinfusión. No hubo cambios significativos en los parámetros hematológicos (recuento de leucocitos, hematíes y plaquetas).
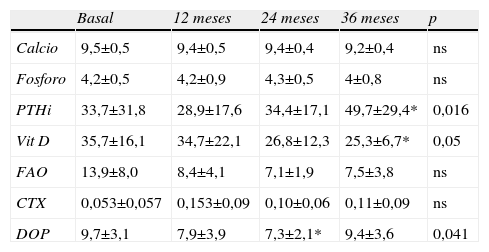
No se evidenciaron diferencias significativas en las concentraciones de Ca y P a lo largo del seguimiento. Las concentraciones de PTHi aumentaron significativamente a los 36 meses (33,7±31,8pg/ml vs 49,7±29,4pg/ml; p=0,016). Los valores de Vit D disminuyeron significativamente a los 36 meses (35,7±16,1ng/ml vs 25,3±6,7ng/ml; p=0,05).
La deoxipiridolina urinaria disminuyó significativamente a los 24 meses: 9,7±3,1 vs 7,3±2,1 nmol/mmol de Cr (valores normales en varones 2,3–7 y en mujeres 3–7,4). No se encontraron cambios significativos en FAO ni en CTX. La evolución de los parámetros bioquímicos se detallan en la tabla 2.
Marcadores bioquímicos
| Basal | 12 meses | 24 meses | 36 meses | p | |
| Calcio | 9,5±0,5 | 9,4±0,5 | 9,4±0,4 | 9,2±0,4 | ns |
| Fosforo | 4,2±0,5 | 4,2±0,9 | 4,3±0,5 | 4±0,8 | ns |
| PTHi | 33,7±31,8 | 28,9±17,6 | 34,4±17,1 | 49,7±29,4* | 0,016 |
| Vit D | 35,7±16,1 | 34,7±22,1 | 26,8±12,3 | 25,3±6,7* | 0,05 |
| FAO | 13,9±8,0 | 8,4±4,1 | 7,1±1,9 | 7,5±3,8 | ns |
| CTX | 0,053±0,057 | 0,153±0,09 | 0,10±0,06 | 0,11±0,09 | ns |
| DOP | 9,7±3,1 | 7,9±3,9 | 7,3±2,1* | 9,4±3,6 | 0,041 |
CTX: telopéptido carboxiterminal del colágeno tipo I (ß cross-laps); DOP: deoxipiridolina urinaria; FAO: fosfatasa alcalina ósea; ns: no significativo; PTHi: paratirina intacta; Vit D: 25-hidroxivitamina D3; ¿diferencia significativa con respecto a la medida basal.
La evolución de la DMO a nivel lumbar se muestra en la tabla 3. En los 9 pacientes analizados, la DMO basal fue 0,738±0,141g/cm2. A los 12 meses, se observó una tendencia a la mejoría sin significación estadística (0,781±0,134g/cm2; p=0,078). A los 24 meses de tratamiento, se objetivó un aumento significativo (0,788±0,144g/cm2; p=0,048, e incremento medio de 6,8%) con respecto a la basal. Cuando se analizan los 6 pacientes de los que se disponía de datos de seguimiento a 36 meses se objetivó un aumento significativo (0,720±0,139g/cm2 vs 0,820±0,128g/cm2; p=0,01) con incremento medio de 13,9%.
Densidad mineral ósea en columna lumbar (g/cm2)
| N | Basal | 12 meses | 24 meses | 36 meses | p | Incremento,% |
| 9 | 0,738±0,141 | 0,781±0,134 | p=0,078 | 5,8 | ||
| 9 | 0,738±0,141 | 0,788±0,144 | p=0,048 | 6,8 | ||
| 6 | 0,720±0,139 | 0,820±0,128 | p=0,01 | 13,9 |
N: n.° de pacientes que completaron el periodo de seguimiento indicado en la columna superior. Basal: indica la densitometría ósea inicial en el grupo de N pacientes.
Los resultados de DMO en cuello femoral se muestran en la tabla 4: solo pudo realizarse densitometría a este nivel en 8 pacientes. No hubo cambios significativos en el primer año de tratamiento: 0,683±0,114g/cm2 vs 0,713±0,120g/cm2. En 7 pacientes seguidos durante 24 meses se objetivó una mejoría densitométrica significativa (0,677±0,121g/cm2 vs 0,703±0,122g/cm2; p=0,016), con incremento medio de 3,8%. Se dispone de datos de la evolución de 5 pacientes tratados durante 36 meses con un incremento medio de 7,5% (0,668±0,066g/cm2 vs 0,719±0,09g/cm2; p=0,10). La evolución de la DMO en cada paciente se detalla en las figuras 1a y b.
Densidad mineral ósea en cuello femoral (g/cm2)
| N | Basal | 12 meses | 24 meses | 36 meses | p | Incremento,% |
| 8 | 0,683±0,114 | 0,713±0,120 | p=0,28 | 4,3 | ||
| 7 | 0,677±0,121 | 0,703±0,122 | p=0,016 | 3,8 | ||
| 5 | 0,668±0,066 | 0,719±0,09 | p=0,10 | 7,5 |
N: n.° de pacientes que completaron el periodo de seguimiento indicado en la columna superior. Basal: indica la densitometría ósea inicial en cada grupo de pacientes.
Siete pacientes (70%) presentaron un cuadro pseudogripal en las primeras 24h tras la primera infusión, que se trató sintomáticamente y se resolvió espontáneamente. No se evidenciaron otros efectos secundarios graves. Ningún paciente ha presentado nuevas fracturas durante el seguimiento.
DiscusiónLa síntesis anómala del colágeno tipo I en la OI condiciona la afectación de múltiples órganos: escleróticas azules, hipoacusia de transmisión, hiperlaxitud ligamentosa, dentinogénesis imperfecta, prolapso mitral y otros, aunque una de las características principales de esta enfermedad es la fragilidad ósea que determina fracturas frecuentes, espontáneas o tras traumatismos mínimos y múltiples deformidades, de ahí que se haya denominado también enfermedad de los huesos de cristal3. Clásicamente, se describen 4 tipos (I–IV) según la clasificación inicial de Sillence. El tipo I es la forma más leve de la enfermedad, el tipo II es frecuentemente letal intraútero o en el periodo neonatal. Los tipos III y IV son formas más graves estando los pacientes con tipo III más gravemente afectados8. Recientemente se han añadido los tipos V–VIII.
Actualmente el diagnóstico, sobre todo de las formas más graves, suele ser precoz y en niños y adolescentes los bisfosfonatos intravenosos han demostrado eficacia en la reducción de fracturas, mejoría de la movilidad, el dolor y en la talla final9–11. Sin embargo, muchos pacientes han llegado a la edad adulta sin ser diagnosticados y sin que en ningún momento se planteara un abordaje de los diferentes problemas derivados de su enfermedad. La mayoría de los pacientes adultos con OI tienen osteoporosis por varios motivos: no alcanzaron una masa ósea adecuada durante la infancia, han tenido periodos de inmovilización tras fracturas y, además, muchos de ellos han tenido y tienen una actividad física muy limitada. En esta serie, 4 pacientes se desplazaban en silla de ruedas.
Los bisfosfonatos son derivados del pirofosfato que se fijan a los cristales de hidroxiapatita en la matriz ósea. A nivel celular actúan sobre los osteoclastos disminuyendo su actividad y favoreciendo su apoptosis con la consecuente inhibición de la reabsorción ósea12. En estos pacientes no está definido el tratamiento de elección, aunque varios trabajos han demostrado la eficacia de estos fármacos tanto orales como intravenosos en el tratamiento de pacientes adultos con OI. En un estudio llevado a cabo por Saphiro et al se trataron 7 pacientes adultos con OI tipo I con pamidronato iv cada 3 meses. Objetivaron mejoría densitométrica a nivel lumbar a los 12 y 24 meses y en cuello de fémur a los 24 meses del inicio de tratamiento, reducción de los marcadores de reabsorción ósea y mejoría histomorfométrica5. En otros estudio, Adami et al realizaron un estudio aleatorizado controlado con placebo en el que incluyeron 54 pacientes adultos con OI. El eridronato administrado iv trimestralmente demostró su eficacia en mejorar DMO en columna lumbar y fémur a partir de los 12 meses de tratamiento6.
El acido zoledrónico es un bisfosfonato de 3.a generación con una gran potencia (100–1.000 veces superior a pamidronato) y una gran afinidad por el hueso, lo que permite una acción prolongada (6–12 meses en series de adultos)13. Ha demostrado su eficacia en osteoporosis postmenopausica (en administración anual de 5mg) y en osteoporosis secundaria a enfermedades hematológicas, tratamiento con glucocorticoides, hipogonadismos, pacientes transplantados, etc14–18. En nuestro estudio, a pesar del número limitado de casos, se evidencia un aumento significativo de la DMO en columna lumbar ya a los 2 años del inicio del tratamiento (incremento medio del 6,8%) con mejoría progresiva evidente a los 3 años (incremento medio 13,9%). En cuello de fémur también se objetivó una mejoría densitométrica a los 24 meses (incremento medio del 3,8%), con tendencia no significativa a seguir mejorando a los 36 meses. Sin embargo, este estudio no es válido para valorar la influencia del tratamiento sobre las fracturas, aunque cabe señalar que ningún paciente ha presentado nuevas fracturas desde el inicio.
Recientemente, se ha demostrado una eficacia y un perfil de seguridad del ácido zoledrónico similares a pamidronato en una serie de niños con OI19,20. Sus efectos secundarios son similares a los descritos para otros bisfosfonatos de uso endovenoso21. Los más frecuentes son reacciones de fase aguda en forma de cuadro seudogripal con febrícula, astenia, cefalea o mialgias que aparecen en las primeras 24–72h tras la infusión y que desaparecen en menos de 3 días. El 70% de los pacientes de este estudio presentaron alguno de éstos síntomas en grado leve. La frecuencia de aparición disminuye con las siguientes dosis. Puede aparecer hipocalcemia transitoria. Nosotros evidenciamos una disminución de los niveles de calcio a las 48h de la primera infusión aunque solo un paciente presentó hipocalcemia bioquímica leve sin repercusión clínica y con recuperación espontánea. También se han descrito aumentos transitorios de la creatinina en un 1,2% de pacientes tratados con zolendronato14. En todos nuestros pacientes se forzó la ingesta hídrica pre y postinfusión, sin que se evidenciara deterioro de la función renal en ningún caso. Tampoco se objetivaron alteraciones en los recuentos hematológicos.
El ácido zoledrónico puede ser una alternativa cómoda, segura y eficaz para el tratamiento de la osteoporosis en pacientes adultos con OI que no toleran o en los que están contraindicados los bisfosfonatos orales. La dosis óptima, el intervalo entre dosis, la duración del tratamiento y la seguridad a largo plazo están por establecer. Son necesarios estudios con mayor número de pacientes y a largo plazo que permitan confirmar nuestros hallazgos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.