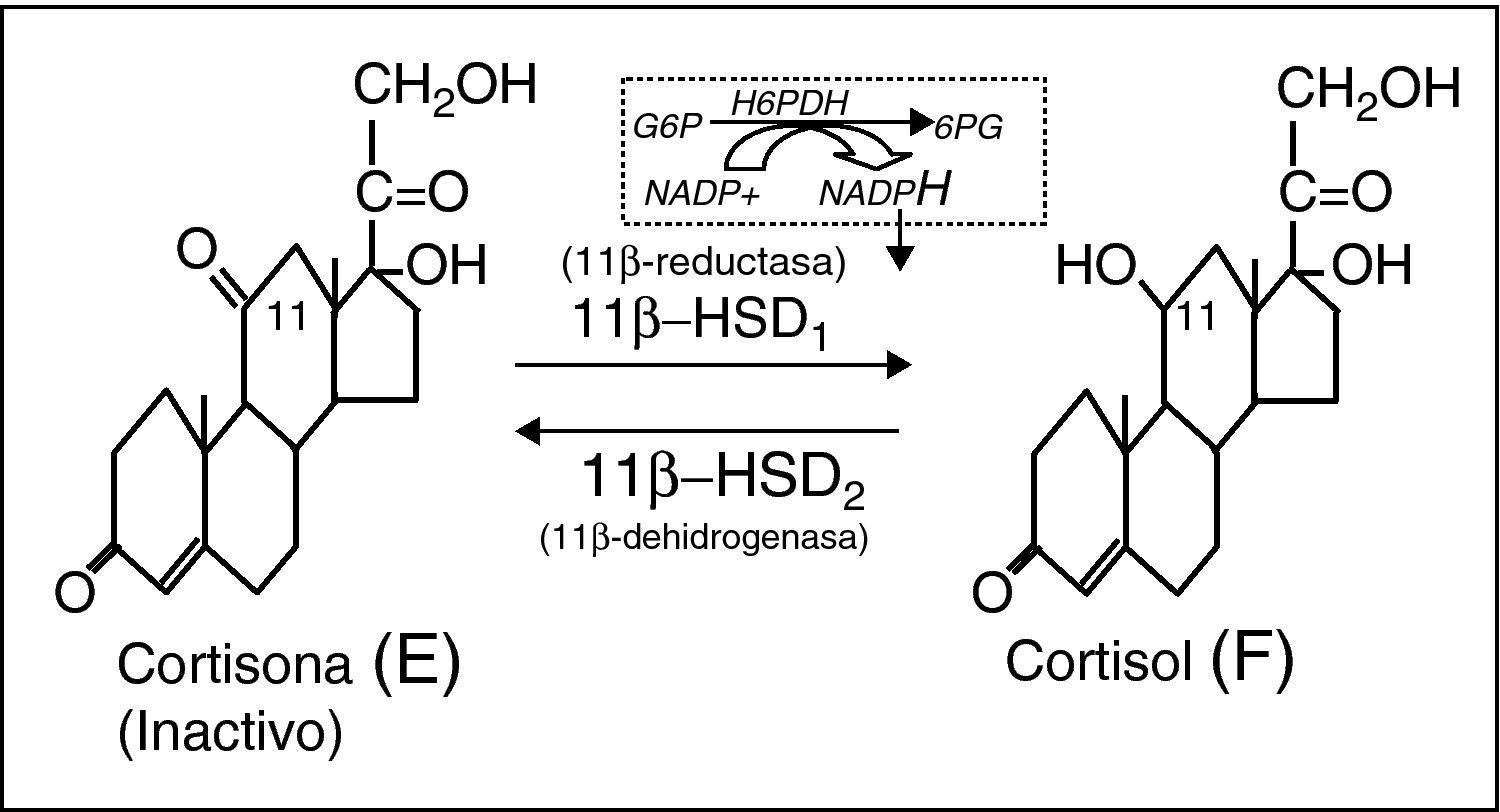
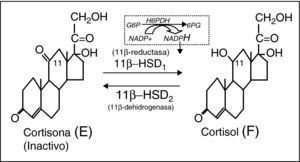
La analogía del síndrome metabólico de la obesidad común (idiopática) con el síndrome de Cushing, ha suscitado la hipótesis de que cierto grado de hipercortisolismo subyacería a la concurrencia de alteraciones metabólicas e hipertensión arterial del síndrome metabólico1. En efecto, una serie de parámetros indicadores del metabolismo del cortisol se correlacionan positivamente con componentes del síndrome metabólico. Así, la cortisolemia basal se correlaciona con la cintura, presión arterial, glucemia, resistencia a insulina y concentraciones de triglicéridos. La cortisoluria libre también se correlaciona con la cintura, triglicéridos e, inversamente, con las concentraciones de cHDL. Por otro lado, la obesidad visceral se correlaciona con resistencia a la supresión con dosis bajas de dexametasona, alteración del ritmo circadiano y respuesta del cortisol a la ingesta. Sin embargo, la dinámica general del eje corticosuprarrenal es básicamente normal en el síndrome metabólico2. Entonces, ¿dónde se ubicaría este supuesto hipercortisolismo del síndrome metabólico? Estudios sofisticados en perros3 y en humanos obesos4 mediante la infusión de cortisol tetramarcado con deuterio (F-4D), han evidenciado que más del 50% de la producción diaria de cortisol procede de la activación de cortisona por la acción de la 11β-hidroxi-esteroide dehidrogenasa tipo 1 (11β-HSD1) extra-suprarrenal, básicamente hepática. Las 11β-HSD son un dúo enzimático intracelular que modula la acción glucocorticoide a nivel prereceptor5. La 11β-HSD1 reduce la cortisona (E) (inactiva) a cortisol (F), actuando como amplificadora intracelular de la acción glucocorticoide. La 11β-HSD2, por el contrario, oxida F a E, inactivándolo (fig. 1). Ambas enzimas están codificadas por dos genes distintos, clonados y bien caracterizados. La expresión de 11β-HSD1 es muy ubicua6,7, en consonancia con la universalidad de las células diana de F, siendo máxima en el hígado8, seguida del tejido adiposo visceral (alrededor de 10 veces menor). También se expresa notablemente en tejido adiposo subcutáneo, músculo y célula beta pancreática, todos ellos tejidos muy relacionados con el metabolismo energético9. La actividad reductora de 11β-HSD1 es totalmente dependiente del cofactor NADPH10, obtenido por la acción de la hexosa-6-fosfato deshidrogenasa, enzima de inicio de la vía de las pentosas, y co-localizada con 11β-HSD1 en la cara interna del retículo endoplásmico11. La expresión de la 11β-HSD2 es máxima en la nefrona distal en donde inactiva F a E, protegiendo al receptor mineralocorticoide de la ocupación ilícita por cortisol12.
Numerosísimos trabajos experimentales13 y en humanos2,9 vinculan a la 11β-HSD1 con el síndrome metabólico. Los ratones con eliminación del gen 11β-HSD1 mediante manipulación genética (knock out) exhiben un fenotipo delgado y con resistencia al desarrollo del síndrome metabólico. Además, los inhibidores específicos de 11β-HSD1 mejoran el síndrome metabólico y previenen aterosclerosis. Por el contrario, la sobrexpresión selectiva de 11β-HSD1 en tejido adiposo mediante transgenización, genera animales con obesidad y síndrome metabólico. Por otro lado, la sobreexpresión selectiva hepática de 11β-HSD1 produce un fenotipo de animal delgado, pero con síndrome metabólico. Además, ensayos en humanos con inhibidores específicos de 11β-HSD1 demuestran una mejoría en el control glucémico y lipídico de pacientes con diabetes mellitus tipo 2 (DM2)14.
En la última década se han publicado numerosos trabajos, sugiriendo que la expresión/actividad de 11β-HSD1 está disregulada en obesidad y DM2 en humanos, en diferentes tejidos: hígado, grasa visceral y subcutánea, y músculo esquelético. Sin embargo, la dirección de esta disregulación no está clara o es inconsistente y tampoco está bien definido el papel de las alteraciones de 11β-HSD1 en cada tejido. En general, existe consenso en cuanto a que la actividad global 11β-HSD1, que refleja fundamentalmente la actividad hepática, está reducida en obesos en relación con delgados15–18. A favor de ello también está el hecho de que la pérdida de peso aumenta la actividad de este enzima19. No obstante, en algún estudio no se observó cambio en la actividad 11β-HSD1 en obesos en comparación con delgados20. En los obesos diabéticos la actividad global de 11β-HSD1 no está reducida, manteniéndose en grados similares a la de delgados18. No existen apenas datos publicados acerca de la expresión del gen y la actividad directa de 11β-HSD1 en tejido hepático en obesos frente a delgados y en obesos con alteraciones metabólicas frente a los que no las tienen. Más conflictivos son los resultados de los trabajos de regulación de 11β-HSD1 en tejido graso, visceral y subcutáneo. En grasa visceral se ha publicado aumento de la expresión21,22 y de la actividad enzimática23 en obesos, pero también no diferencias en la expresión génica ni en actividad enzimática24. En otros trabajos se ha observado aumento de ARNm de 11β-HSD1 en adipocitos viscerales de pacientes diabéticos in vitro25, pero no diferencias en la cantidad de ARNm en tejido graso visceral entre obesos mórbidos con y sin síndrome metabólico26. En cuanto al tejido graso subcutáneo de obesos también se han publicado datos discordantes, con aumento27–30 y no cambios20,24 en ARNm y aumento20,30,31, pero también no cambios24 en la actividad enzimática. En otros estudios se observó que la pérdida de peso en obesos aumentaba la expresión del ARNm de 11β-HSD1 en adipocitos aislados de grasa subcutánea19. En obesos con DM2 se ha publicado aumento de ARNm25 en grasa subcutánea en relación con no diabéticos. También se ha observado aumento de ARNm32,33 y de actividad enzimática32 en grasa subcutánea en aquellos obesos con intolerancia hidrocarbonada y resistencia a insulina. Además los miotubos de diabéticos tipo 2 in vitro muestran mayor expresión de 11β-HSD1 que controles con obesidad leve34. Estas diferencias en los resultados de diferentes trabajos, sobre todo en lo que respecta a la expresión en tejido adiposo, pueden deberse a la heterogeneidad de las poblaciones y modelos estudiados: sexos, edades, tipos de tejidos, actividad enzimática, tisular o global y expresión génica, in vitro o in vivo.
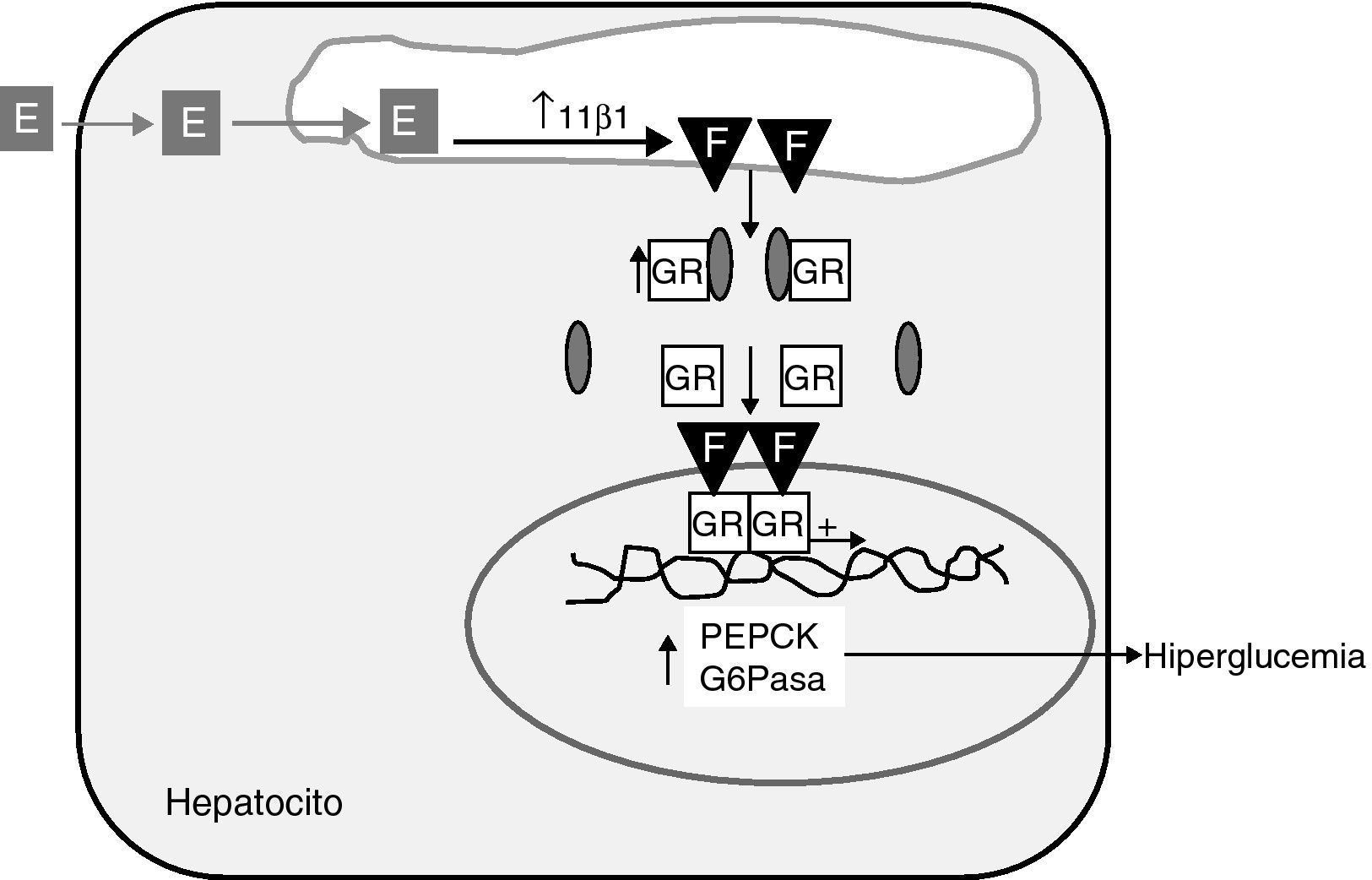
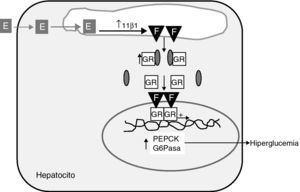
En algún estudio reciente, comunicado como póster, se ha descrito que los obesos mórbidos con síndrome metabólico tienen una mayor expresión hepática de 11β-HSD1 y del receptor glucocorticoide, que los obesos mórbidos sin síndrome metabólico35. Además, esta sobreexpresión se correlaciona positivamente con el número de componentes del síndrome metabólico presentes y está ausente en el tejido graso. El hepatocito alberga todo el repertorio de expresión de genes relacionados no sólo con la regeneración de cortisol, sino también del receptor glucocorticoide y de genes diana de su acción como los genes clave de la neoglucogénesis, la fosfoenolpiruvato carboxiquinasa (PEPCK) y la glucosa-6-fosfatasa (G-6Pasa) (fig. 2). Los resultados de estudios en perros demostrando que la administración oral de un inhibidor específico de 11β-HSD1 reprime la expresión hepática de PEPCK y G-6Pasa36 apoyan el nexo causal entre 11β-HSD1 y la neoglucogénesis hepática. Más aún, trabajos muy recientes de Rosenstock et al demuestran que la adición de un inhibidor específico de 11β-HSD1 a pacientes con DM2 en mal control glucémico en monoterapia con metformina, tiene un efecto hipoglucemiante sumatorio14, lo cual sugiere, que 11β-HSD1 participaría en la patogenia de la hiperglucemia de la DM2. En conjunto estas evidencias apoyan la hipótesis de Iwasaki et al37 de que el síndrome metabólico podría tratarse de un “estado de Cushing intracelular”37. Este concepto está basado en estudios de regulación en una línea celular de hepatoma humano con transfección estable del promotor de 11β-HSD1. Los datos preliminares de mayor expresión hepática en obesos con síndrome metabólico favorecen el concepto del síndrome metabólico como hipercortisolismo intrahepático.
El aumento de la producción hepática de cortisol en los obesos con síndrome metabólico no se acompaña de hipercortisolismo sistémico, porque ambos orígenes del cortisol circulante, suprarrenal y hepático, están en equilibrio dinámico y el aumento de producción hepática se ve compensado por un mayor catabolismo hepático del cortisol y una menor actividad del eje corticosuprarrenal, como se demuestra por el aumento de ACTH dosis dependiente en respuesta al tratamiento con inhibidores específicos de 11β-HSD114.
En síntesis, la regulación a la baja de 11β-HSD1, sobre todo hepática, en la obesidad actuaría como mecanismo de protección frente a la aparición de alteraciones metabólicas asociadas a la misma. La ausencia de este mecanismo de compensación, crearía un estado de hipercortisolismo local –Cushing intracelular– relativo, favorable a la aparición de las alteraciones metabólicas asociadas a la obesidad. Además, 11β-HSD1 se convierte en una potencial diana para el tratamiento farmacológico del síndrome metabólico.
Los autores agradecen el soporte financiero de la Fundación Mutua Madrileña y de la Sociedad Madrileña de Endocrinología, Nutrición y Diabetes.