Proporcionar recomendaciones prácticas y actualizadas para la evaluación, diagnóstico diferencial y tratamiento del prolactinoma y la hiperprolactinemia en diversos contextos clínicos.
ParticipantesMiembros del Grupo de Neuroendocrinología de la Sociedad Española de Endocrinología y Nutrición.
MétodosLas recomendaciones se formularon de acuerdo al sistema Grading of Recommendations, Assessment, Development, and Evaluation (GRADE) para establecer tanto la fuerza de las recomendaciones como el grado de evidencia. Se realizó una búsqueda sistemática en Medline (Pubmed) para cada apartado, y se añadieron consideraciones de los autores en los aspectos en los que la bibliografía ofrece escasa evidencia. Tras la formulación de las recomendaciones estas se discutieron de forma conjunta en el Grupo de Trabajo.
ConclusionesEl documento establece unas recomendaciones prácticas y actualizadas del diagnóstico y tratamiento de la hiperprolactinemia y el prolactinoma incluyendo la hiperprolactinemia inducida por fármacos, diversas modalidades del tratamiento de los prolactinomas (fármacos, cirugía y radioterapia), prolactinoma y gestación, efectos adversos de los fármacos dopaminérgicos, y prolactinomas resistentes a fármacos y malignos.
To provide practical and up to date recommendations for evaluation, differential diagnosis, and treatment of prolactinoma and hyperprolactinemia in various clinical settings.
ParticipantsMembers of the Neuroendocrinology Working Group of the Spanish Society of Endocrinology.
MethodsRecommendations were formulated according to the Grading of Recommendations, Assessment, Development, and Evaluation system (GRADE) to describe both the strength of recommendations and the quality of evidence. A systematic search was made in Medline (Pubmed) for each subject, and authors’ considerations were added in areas where the literature provided scarce evidence. Finally, recommendations were jointly discussed by the Working Group.
ConclusionsThe document provides evidence-based practical and updated recommendations for diagnosis and management of hyperprolactinemia and prolactinoma, including drug-induced hyperprolactinemia, treatment options for prolactinoma (drugs, surgery, and radiotherapy), prolactinoma in pregnancy, adverse effects of dopaminergic agents, and drug-resistant and malignant prolactinomas.
Nos hemos basado en la revisión bibliográfica de trabajos originales, metaanálisis y guías clínicas elaboradas por grupos de expertos de reconocida solvencia, con el añadido de nuestra visión y experiencia personal sobre el tema. Siempre que ha sido posible, hemos categorizado la evidencia existente en cada tema de acuerdo con los grados de recomendación (GRADE system) empleados por la Endocrine Society en la elaboración de sus guías clínicas. Este sistema establece recomendaciones de 2 grados (1: fuertes, o 2: débiles), y clasifica la calidad de la evidencia en una de 4 categorías (⊕⊕⊕⊕: alta, ⊕⊕⊕O: moderada, ⊕⊕OO: baja o ⊕OOO: muy baja). Al igual que en otros temas relacionados con la neuroendocrinología, debe tenerse en cuenta que en muchos aspectos se cuenta con escasas evidencias de alta calidad.
Introducción: prolactinomas e hiperprolactinemiaLos prolactinomas son adenomas hipofisarios que secretan prolactina (PRL); representan el 40% de todos los adenomas hipofisarios y aparecen más frecuentemente en mujeres. Según su tamaño, se clasifican en microprolactinomas (<10mm) y macroprolactinomas (≥10mm). El 90% son microadenomas intraselares que no crecerán durante el seguimiento1. Aunque raramente son hereditarios pueden formar parte de la neoplasia endocrina múltiple (MEN1) y de la entidad familial isolated pituitary adenomas2. Los prolactinomas malignos son poco frecuentes.
La PRL se halla sujeta al efecto inhibitorio de la dopamina. Por tanto, la hiperprolactinemia puede deberse no solo a la hipersecreción tumoral, sino a diversas situaciones fisiológicas y patológicas, así como a múltiples fármacos que alteran la producción, el transporte o la acción de la dopamina.
En conjunto, los prolactinomas y la hiperprolactinemia son una causa frecuente de consulta al endocrinólogo.
ClínicaIndependientemente de su causa, la hiperprolactinemia interfiere con la secreción pulsátil de GnRH e inhibe la secreción de LH y FSH; en consecuencia produce hipogonadismo en ambos sexos e infertilidad. Por otra parte, la masa tumoral de un prolactinoma puede producir efectos compresivos de las estructuras paraselares e hipopituitarismo.
En mujeres, la mayoría de los prolactinomas son microadenomas y se presentan con alteraciones menstruales (oligoamenorrea), galactorrea e infertilidad. En mujeres posmenopáusicas, la clínica se deriva fundamentalmente del efecto masa del adenoma. En varones, el 80% de los prolactinomas son macroadenomas por lo que suele haber clínica por efecto masa (cefalea, pérdida visual) y/o por afectación de otros ejes hipofisarios. La hiperprolactinemia produce disminución de la libido, disfunción eréctil, oligospermia e infertilidad y, con menos frecuencia, ginecomastia y galactorrea. El hipogonadismo inducido por la hiperprolactinemia se asocia con disminución de la densidad mineral ósea en ambos sexos1.
Los prolactinomas son raros en niños y adolescentes, y cursan con retraso puberal y/o clínica por efecto masa.
Diagnóstico de hiperprolactinemiaPara la mayoría de los laboratorios, las concentraciones séricas normales de PRL son inferiores a 25ng/ml en mujeres y a 20ng/ml en varones (1ng/ml equivale a 21,2mUI/l).
Tal y como recomiendan las guías clínicas más recientes, la determinación de PRL en una extracción única es suficiente para el diagnóstico si la venopunción no ha sido traumática (1⊕⊕⊕⊕). En casos dudosos (elevaciones leves de PRL) o discordantes con la clínica puede repetirse la determinación en muestras obtenidas a intervalos de 15-20min para minimizar el efecto de la pulsatilidad3,4.
Los tests dinámicos (TRH, L-dopa, domperidona, etc.) no aportan ninguna ventaja frente a la determinación basal de PRL y por tanto no se recomiendan3–5 (1⊕⊕⊕⊕).
Generalmente las concentraciones de PRL se correlacionan con el tamaño tumoral del prolactinoma. Ante adenomas de gran tamaño con valores de PRL solo ligeramente elevados debe descartarse el efecto Hook o «gancho»6, si bien este fenómeno es improbable o prácticamente inexistente con algunos de los nuevos inmunoensayos3. Para detectarlo se recomienda realizar la determinación de PRL tras una dilución 1:100 del suero3,4 (1⊕⊕⊕⊕). También debe considerarse la posibilidad de que el tumor no sea secretor de PRL (ver el apartado «Causas de hiperprolactinemia»).
Causas de hiperprolactinemiaExisten múltiples situaciones que pueden dar lugar a hiperprolactinemia (tabla 1). Entre las causas fisiológicas se encuentran la gestación, la lactancia, el coito, el sueño, el ejercicio y el estrés.
Causas de hiperprolactinemia
| Fisiológicas: gestación, lactancia, estimulación del pezón, coito, sueño, ejercicio, estrés |
| Farmacológicas |
| Neurolépticos/antipsicóticos: fenotiacinas, haloperidol, butirofenonas |
| Antidepresivos: tricíclicos, inhibidores de la monoaminooxidasa, inhibidores de la recaptación de la serotonina |
| Antihistamínicos H2 |
| Estrógenos: anticonceptivos orales |
| Antihipertensivos: verapamilo, metildopa |
| Anestésicos |
| Anticonvulsivantes |
| Opiáceos: cocaína, morfina, heroína |
| Benzodiazepinas |
| Bloqueadores dopaminérgicos: metoclopramida, sulpiride, domperidona, cisaprida |
| Serotonina, noradrenalina |
| Procesos hipotálamo-hipofisarios |
| Patología hipofisaria: prolactinomas, acromegalia, adenomas plurihormonales, cirugía, radioterapia, traumatismo, hipofisitis |
| Patología hipotalámica/compresión del tallo hipofisario: tumores (craniofaringioma, germinoma, meningioma, metástasis, quiste de Rathke, etc), granulomas, enfermedades infiltrativas, traumatismos con sección del tallo |
| Otros procesos |
| Insuficiencia renal crónica e insuficiencia hepática |
| Hipotiroidismo primario |
| Síndrome de ovario poliquístico |
| Neurogénicas: trauma torácico, herpes zoster |
| Hiperprolactinemia idiopática |
| Macroprolactina |
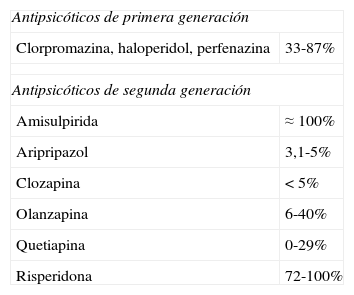
La causa más frecuente de hiperprolactinemia no tumoral es la acción de fármacos3, fundamentalmente antipsicóticos y neurolépticos (tabla 2), pero también antihipertensivos bloqueantes de los canales de calcio (verapamilo), antidepresivos, antieméticos (metoclopramida), etc.
Prevalencia de hiperprolactinemia con los distintos antipsicóticos
| Antipsicóticos de primera generación | |
| Clorpromazina, haloperidol, perfenazina | 33-87% |
| Antipsicóticos de segunda generación | |
| Amisulpirida | ≈ 100% |
| Aripripazol | 3,1-5% |
| Clozapina | <5% |
| Olanzapina | 6-40% |
| Quetiapina | 0-29% |
| Risperidona | 72-100% |
La paliperidona es un metabolito activo de la risperidona con una elevada prevalencia de hiperprolactinemia.
Fuente: Molitch9.
Diversos procesos hipotálamo-hipofisarios, además del prolactinoma, pueden producir hiperprolactinemia por daño de las neuronas dopaminérgicas, compresión del tallo hipofisario o cosecreción hormonal (adenoma secretor de GH y PRL).
En la insuficiencia renal y hepática la concentración de PRL puede estar aumentada por una disminución del aclaramiento.
Enfermedades endocrinas muy prevalentes son causa de hiperprolactinemia. El hipotiroidismo primario puede asociar hiperprolactinemia leve que revierte al normalizar la función tiroidea con levotiroxina. Por otra parte, hasta el 30% de las mujeres con síndrome de ovario poliquístico presentan elevaciones leves de PRL5.
Otra causa de hiperprolactinemia es la macroprolactina (moléculas de PRL de mayor tamaño, en general por unión de la PRL a un anticuerpo IgG, o bien por dimerización o glucosilación de la PRL monomérica), que se acumula por disminución de su aclaramiento. La macroprolactinemia se detecta con la precipitación de la muestra con polietilenglicol.
Diagnóstico diferencial de la hiperprolactinemiaEl primer paso para establecer el diagnóstico diferencial en un paciente con hiperprolactinemia es realizar una historia clínica minuciosa orientada especialmente a detectar posibles causas secundarias de hiperprolactinemia –incluyendo el empleo de fármacos–, y una exploración física detallada. Este paso inicial puede orientar ya hacia un tumor secretor con compromiso neurológico, o hacia una alteración funcional con escasa repercusión.
Se recomienda realizar pruebas de función hepática, renal y función tiroidea en todos los pacientes con hiperprolactinemia, y descartar el embarazo en mujeres en edad fértil3–5 (1⊕⊕⊕⊕).
La macroprolactinemia es una alteración benigna que está presente hasta en el 20% de los pacientes estudiados por hiperprolactinemia7. Las moléculas de macroprolactina son menos bioactivas por lo que los síntomas típicos de la hiperprolactinemia suelen estar ausentes. La guía de la Endocrine Society sugiere su determinación en pacientes con hiperprolactinemia asintomática3. La determinación sistemática de macroprolactina en pacientes con síntomas clásicos es controvertida8. Por una parte, el procedimiento es sencillo y poco costoso, y su diagnóstico evitaría la realización de procedimientos y tratamientos innecesarios; por otra, se ha documentado la presencia de macroprolactina en casos de tumores. Por tanto, también sugerimos determinar macroprolactina en aquellos pacientes con hiperprolactinemia asintomática (2⊕⊕OO).
Ante cualquier hiperprolactinemia de causa no aclarada debe realizarse una resonancia magnética (RM) hipofisaria con gadolinio3,4 (1⊕⊕⊕⊕).
Se habla de hiperprolactinemia idiopática cuando se han excluido las causas secundarias de hiperprolactinemia y la RM hipofisaria es normal. En alrededor del 10% de estos pacientes se diagnostica de forma posterior un microadenoma, mientras que en el 30% se produce una normalización espontánea de las cifras de PRL4.
La mayoría de las causas secundarias y la macroprolactinemia producen valores de PRL entre 25 y 100ng/ml. La hiperprolactinemia por daño hipotalámico o por compresión del tallo hipofisario suele ser inferior a 100-150ng/ml. Los hallazgos en todas estas entidades son superponibles a los del microprolactinoma. Valores de PRL superiores a 250ng/ml generalmente indican la presencia de un prolactinoma (habitualmente un macroprolactinoma), pero hay que tener en cuenta que algunos fármacos como la metoclopramida, risperidona y fenotiazinas pueden llegar a producir valores de PRL superiores a 200ng/ml1. En resumen, los valores de PRL ayudan a orientar el diagnóstico, pero existe superposición entre las distintas etiologías.
Hiperprolactinemia secundaria a fármacosEn los pacientes tratados con fármacos que puedan causar hiperprolactinemia sugerimos realizar, si es posible, una nueva determinación de PRL tras al menos 72h de la suspensión de dicho fármaco3,4 (2⊕⊕OO). En algunos fármacos se desconoce el tiempo necesario para que la concentración de PRL se normalice tras su retirada. Debe tenerse en cuenta que este puede ser más prolongado cuando se emplean medicamentos con formulaciones depot.
En el caso de medicación psicotropa, la retirada del fármaco debe ser realizada por el psiquiatra, valorándose la posibilidad de administrar un tratamiento alternativo con menos efecto en las concentraciones de PRL. Otra opción es el empleo de aripiprazol, antipsicótico atípico con actividad agonista y antagonista dopaminérgico que puede disminuir las concentraciones de PRL3.
Si no es posible retirar el fármaco, se recomienda realizar una RM para excluir la presencia de tumores hipofisarios o hipotalámicos3,4 (1⊕OOO).
El tratamiento de la hiperprolactinemia farmacológica debe limitarse a aquellos pacientes sintomáticos en los que no pueda retirarse o sustituirse el fármaco en cuestión. Sugerimos tratamiento sustitutivo con estrógenos en mujeres y testosterona en varones con hipogonadismo sintomático y/o disminución de la densidad ósea3,4,9 (2⊕OOO).
El tratamiento con agonistas dopaminérgicos en pacientes con hiperprolactinemia inducida por antipsicóticos está muy cuestionado por el riesgo de exacerbación de la clínica psicótica9. En nuestra opinión, esta opción solo se debe considerar, bajo control estricto, en casos de hiperprolactinemia sintomática en los que no pueda sustituirse el fármaco antipsicótico y exista una contraindicación absoluta de tratamiento sustitutivo con estrógenos/testosterona, o en la especial circunstancia de mujeres que, dentro de este contexto, deseen gestación.
Estudio de imagenLa prueba de imagen indicada para el estudio de lesiones hipofisarias es la RM. La exploración puede realizarse tras detectar una hiperprolactinemia en la que se han excluido las causas secundarias, o indicarse por otros motivos (estudio de cefalea, alteraciones campimétricas, etc.), con hallazgo de la lesión hipofisaria, y posterior estudio funcional diagnóstico de hiperprolactinemia. Se recomienda estudio de imágenes potenciadas en T1 y T2, y tras la inyección de contraste paramagnético (gadolinio), con cortes finos (2-3mm)10. Si no es posible esta exploración, deberá practicarse una tomografía computarizada de alta definición (1⊕⊕⊕O).
Si se tiene en cuenta que la conducta inicial frente a un microprolactinoma y una hiperprolactinemia idiopática persistente será similar, no se plantea una búsqueda más intensiva de microadenomas cuando no son evidentes con esta exploración. No se han valorado, por lo tanto, RM de 3 teslas, tal como se ha estudiado en otros microadenomas (p. ej., secretores de ACTH, cuya identificación es crucial para su tratamiento11) en los que de todos modos no mejoró la sensibilidad de localización. Tampoco se ha valorado de forma sistemática la tomografía de emisión de positrones con diversos trazadores como FDG, C11- metionina o F18- dopa12 (este último estudiado en otras enfermedades que afectan vías dopaminérgicas, como la enfermedad de Parkinson).
En cuanto a la periodicidad recomendada para las exploraciones de imagen, se trata en el apartado de «Monitorización del tratamiento».
Pruebas complementariasEn los microadenomas intraselares no es necesario valorar el campo visual, ni tampoco la función hipofisaria, excepto cuando no desaparece el hipogonadismo tras la normalización de los niveles séricos de PRL. En los macroadenomas se recomienda una evaluación global adenohipofisaria (ejes tirotropo, gonadotropo, corticotropo y somatotropo). Además, si el tumor tiene contacto quiasmático o lo comprime es recomendable una valoración neuroftálmica completa inicial, incluyendo agudeza visual, campimetría computarizada, motilidad ocular extrínseca, estudio de pupilas y fondo de ojo3,4. Es conveniente realizar una tomografía de coherencia óptica siempre que sea posible, ya que no solo permite establecer el compromiso de la vía óptica, sino también su potencial reversibilidad. La evolución posterior puede, lógicamente, condicionar la estrategia de tratamiento.
Por otra parte, si en el momento del diagnóstico existe una historia prolongada de hipogonadismo puede haber pérdida de densidad mineral ósea (DMO), que se debe evaluar inicialmente mediante densitometría fotónica dual. En nuestra opinión es aconsejable controlar su evolución y valorar la indicación de tratamientos específicos si no hay recuperación al restablecerse la función gonadal.
Estudio genéticoLos tumores hipofisarios, y entre ellos los prolactinomas, son mayoritariamente esporádicos. Sin embargo, algunos están incluidos en síndromes familiares bien definidos como MEN1 (gen MEN1) o el complejo de Carney (gen PRKAR1A), además de otros síndromes de predisposición familiar al desarrollo de tumores de hipófisis (familial isolated pituitary adenomas) identificados en los últimos años, en relación con el gen supresor tumoral AIP (codifica la proteína AIP-aryl hydrocarbon receptor-interacting proteín)2,13. En relación con el llamado MEN4 (por mutaciones del gen CDKN1B (p27kip1), se han descrito tumores hipofisarios en humanos, aunque no prolactinomas. Se debe plantear el estudio genético en pacientes con prolactinomas con historia de agregación familiar, asociación con otras neoplasias endocrinas, o formas agresivas y/o de inicio a edades tempranas. El fenotipo del paciente y la historia familiar definirán la secuencia de estudio de los diferentes genes. No existen aun evidencias del potencial impacto de esta información sobre el manejo y pronóstico de la enfermedad.
Estos sofisticados estudios solo están disponibles en algunos centros. Puede consultarse los laboratorios que los realizan en España y las personas de contacto en la página de la SEEN (www.seen.es), en la sección Endocrinología/Catálogo de Pruebas/Genética.
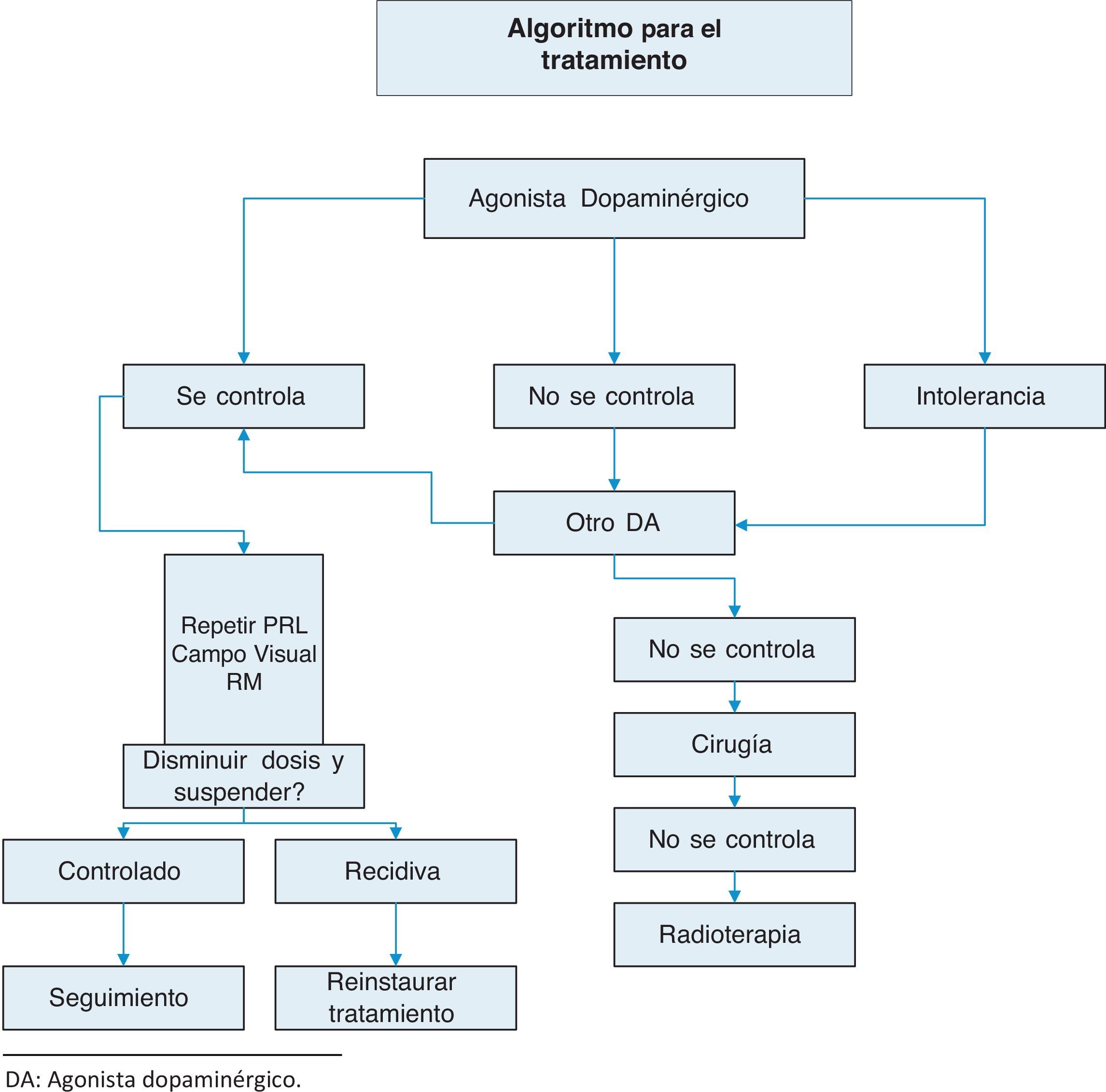
TratamientoSe resume en anexo 1:Algoritmo de tratamiento.
- A.
Objetivos: recomendamos el tratamiento de los prolactinomas para3,4,14:
- 1.
Disminuir las concentraciones de PRL y revertir la clínica.
- 2.
Disminuir el tamaño tumoral.
- 3.
Restaurar la función gonadal y otros déficits hormonales hipofisarios.
- 4.
Prevenir la recurrencia y progresión tumoral.
- 1.
- B.
Indicaciones: evitar los efectos del tamaño tumoral y de la hiperprolactinemia. Recomendamos tratar a los pacientes con microprolactinomas sintomáticos y a los pacientes con macroprolatinomas (1⊕⊕⊕⊕). Los síntomas derivados de la hiperprolactinemia que constituyen indicaciones del tratamiento son: hipogonadismo, galactorrea molesta, infertilidad y disminución de la DMO4.
Dado que los microprolactinomas raramente crecen15, los pacientes asintomáticos con microprolactinomas no precisan forzosamente tratamiento. Por tanto, sugerimos no tratarlos(2⊕OOO). Puede ser la situación de pacientes posmenopáusicas (tratadas o no previamente) en las que la hiperprolactinemia ya no condiciona hipogonadismo.
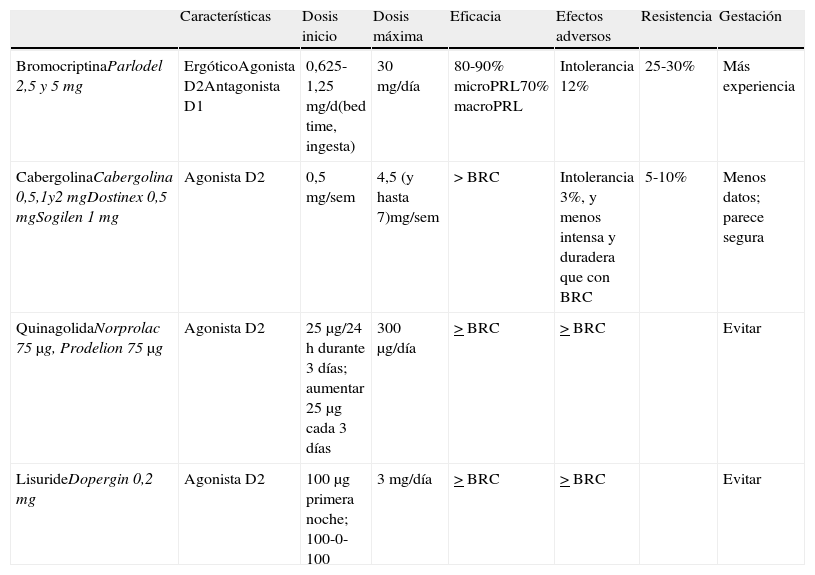
Es la primera elección en todos los casos en que esté indicado el tratamiento, incluso en los casos con déficit campimétrico4. Sus características se resumen en la tabla 3.
Características de los agonistas dopaminérgicos y presentaciones disponibles
| Características | Dosis inicio | Dosis máxima | Eficacia | Efectos adversos | Resistencia | Gestación | |
| BromocriptinaParlodel 2,5 y 5mg | ErgóticoAgonista D2Antagonista D1 | 0,625-1,25mg/d(bed time, ingesta) | 30mg/día | 80-90% microPRL70% macroPRL | Intolerancia 12% | 25-30% | Más experiencia |
| CabergolinaCabergolina 0,5,1y2mgDostinex 0,5mgSogilen 1mg | Agonista D2 | 0,5mg/sem | 4,5 (y hasta 7)mg/sem | >BRC | Intolerancia 3%, y menos intensa y duradera que con BRC | 5-10% | Menos datos; parece segura |
| QuinagolidaNorprolac 75μg, Prodelion 75μg | Agonista D2 | 25μg/24h durante 3 días; aumentar 25μg cada 3 días | 300μg/día | >BRC | >BRC | Evitar | |
| LisurideDopergin 0,2mg | Agonista D2 | 100μg primera noche; 100-0-100 | 3mg/día | >BRC | >BRC | Evitar |
BRC: bromocriptina; MacroPRL: macroprolactinoma; MicroPRL: microprolactinoma.
Hasta la actualidad se han empleado varios, que describimos a continuación
- A.
Cabergolina: agonista dopaminérgico ergótico, su larga vida media permite que se administre una o 2 veces por semana, vía oral. La dosis de inicio es de 0,25 a 0,5mg/semana y se incrementa semanalmente hasta conseguir concentraciones normales de PRL. La dosis media es de 0,5 a 1mg/semana. Lo recomendamos como primera opción por su mayor eficacia (tanto respecto a la normalizacion de las concentraciones de PRL como a la disminución del tamaño tumoral (1⊕⊕⊕⊕) y mejor tolerancia3,16. Las únicas excepciones podrían ser el crecimiento tumoral durante la gestación o los motivos económicos. En estos casos la primera elección sería la bromocriptina.
- B.
Bromocriptina: fue el primer fármaco introducido en el tratamiento de la hiperprolactinemia hace más de 30 años. Es un agonista dopaminérgico selectivo D2 y antagonista D1. Habitualmente se administra 2-3 veces al día por su vida media corta, aunque en algunos pacientes es suficiente con una dosis. Debe iniciarse a dosis de 0,62-1,25mg/día, e incrementar 1,25mg cada semana. El margen terapéutico suele oscilar entre 2,5 y 7,5mg/día. Sin embargo, algunos pacientes llegan a necesitar dosis diarias de 20-30mg. Los efectos secundarios como náuseas, vómitos, hipotensión arterial postural y cefalea son muy frecuentes, aumentan si las dosis son elevadas, y a menudo limitan la adherencia al tratamiento. Es el fármaco de elección en el embarazo por más experiencia acumulada, pero es peor tolerado que la cabergolina.
- C.
Quinagolida: agonista dopaminérgico no ergótico. Se administra en dosis única diaria; se comienza con 25μg/día durante 3 días, con incremento a 50μg/día otros 3 días, y a partir del séptimo día se continúa con 75μg/día. El 50% de los pacientes resistentes a bromocriptina responden a quinagolida
- D.
Lisurida: tiene características similares a quinagolida. Se administra en 2 tomas diarias; se inicia el tratamiento con 0,1mg por la noche, y se aumenta progresivamente. La dosis media es de 0,3mg/día.
- E.
Pergolida: retirada en EE.UU. por mayor frecuencia de enfermedad valvular que los restantes fármacos dopaminérgicos. No recomendamos su uso.
Se producen sobre todo al inicio del tratamiento; por ello, las dosis iniciales deben ser muy bajas e incrementarse progresivamente:
- •
Gastrointestinales (los más frecuentes): náuseas, vómitos, estreñimiento, reflujo, dispepsia.
- •
Neurológicos: cefalea, mareo, disquinesias y confusión.
- •
Cardiovasculares: hipotensión postural, síncope y vasoespasmo digital.
- •
Fístula de líquido cefalorraquídeo: posible complicación del tratamiento de los adenomas de gran tamaño17.
- •
Otros: sequedad de boca, calambres musculares, psicosis y manía.
Se considera respuesta al tratamiento la normalización de las concentraciones de PRL (respuesta bioquímica) y la reducción del tamaño tumoral3.
Monitorización del tratamientoLas recomendaciones generales deben adaptarse a la agresividad de la enfermedad, de modo que los macroprolactinomas invasivos requieren un seguimiento estrecho, incluso semanal, y los microprolactinomas pueden ser seguidos con una periodicidad aun mayor que la comentada.
- •
PRL sérica: al mes de iniciar el tratamiento y después periódicamente (en función de la respuesta) para ajuste de dosis3.
- •
RM: a los 3 meses en el caso del macroadenoma. No está establecido que sea necesario en el caso del microprolactinoma a menos que aumente la PRL o aparezcan nuevos síntomas3. Después, anual en el caso de los macroadenomas.
- •
Campimetría: valoración inicial en macroadenomas con riesgo de compresión del quiasma óptico y después según evolución.
- •
DMO: al inicio si existe historia prolongada de hipogonadismo, y después valorar su repetición si estaba afectada.
- •
Resto de función hipofisaria: en macroadenomas al diagnóstico y después según evolución. También se valorará en microadenomas en los que la función gonadal no se recupere al normalizar la PRL.
La resistencia a agonistas dopaminérgicos se define como el fallo en lograr un nivel de PRL normal con la dosis máxima tolerada de agonistas dopaminérgicos y la ausencia de reducción del 50% en el tamaño tumoral3. Ante esta situación recomendamos:
- •
Alcanzar la dosis máxima tolerada3 (1⊕⊕⊕⊕).
- •
En pacientes con resistencia a la bromocriptina, pasar a cabergolina3 (1⊕⊕⊕⊕) o como segunda opción utilizar alguno de los otros agonistas dopaminérgicos. En algunos pacientes resistentes a la cabergolina se han obtenido respuestas con bromocriptina18.
- •
Cirugía transesfenoidal en pacientes que no responden a ninguna de las pautas anteriores3.
- •
Si falla el tratamiento quirúrgico, radioterapia.
La causa de la resistencia no es totalmente conocida pero se ha descrito, entre otros mecanismos, la disminución del número de receptores D2. Con cabergolina se produce un 10% de resistencia en los microprolactinomas y un 18% en los macroprolactinomas19.
Los prolactinomas en varones son más frecuentemente resistentes a los agonistas dopaminérgicos que en mujeres20.
EcocardiografíaEl riesgo de enfermedad valvular cardíaca, observado en la enfermedad de Parkinson tratada con dosis muy altas de agonistas dopaminérgicos, fue estudiado recientemente en pacientes con hiperprolactinemia. La pergolida se retiró del mercado por esta causa y se realizaron estudios en relación con la cabergolina, sin hallar evidencias claras de asociación para la dosis habitual y con una posible repercusión de la dosis total acumulada, que puede ser importante en tratamientos de décadas de duración21–24.
Aunque no está aun establecida la dosis acumulada de riesgo, sugerimos que no es indispensable realizar de rutina control ecocardiográfico en los primeros años de tratamiento en los pacientes que reciban 1-2mg de cabergolina a la semana3, a menos que coexistan factores clínicos que lo aconsejen. Por otra parte, sugerimos realizarlo en los pacientes que requieran dosis iniciales elevadas de cabergolina (>2mg/semana), o al cabo de >5 años de tratamiento. En todo caso, teniendo en cuenta la duración de estas terapias (en ocasiones, de por vida) se aconseja llevar registro de la dosis acumulada de dopaminérgicos.
Otras alternativasLas mujeres con microprolactinomas que no desean gestación pueden no requerir tratamiento con agonistas dopaminérgicos. Las que están en amenorrea pueden ser tratadas con estrógenos y debe determinarse anualmente la concentración de PRL. La RM se repetirá en caso de signos de expansión del tumor o si aumentan las concentraciones de PRL4.
Interrupción de los agonistas dopaminérgicosSigue discutiéndose cuál es la duración óptima del tratamiento, y si este puede suspenderse definitivamente25. La interrupción de los agonistas dopaminérgicos debe plantearse en casos cuidadosamente seleccionados, porque la recidiva de la enfermedad puede implicar reaparición de la hiperprolactinemia y reexpansión tumoral.
La recurrencia de la hiperprolactinemia al suspender el tratamiento dopaminérgico, en micro y macroprolactinomas, es un fenómeno frecuente, tanto más cuanto más largo es el seguimiento (llega hasta alrededor del 80% a los 8 años). La recurrencia se correlaciona con la duración del tratamiento con agonistas dopaminérgicos, los concentraciones de PRL en el momento del diagnóstico y el tamaño tumoral inicial. Las guías clínicas más recientes sugieren la interrupción del tratamiento farmacológico en aquellos pacientes que presenten durante al menos 2 años concentraciones persistentes de normoprolactinemia y ausencia de tumor remanente visible en RM o disminución notable de su tamaño inicial (tabla 4) (2⊕OOO). Barber et al. proponen que la duración del tratamiento dopaminérgico hasta su suspensión sea superior a 2 años, fundamentalmente en macroprolactinomas26. Cuando se decida la interrupción del tratamiento sugerimos reducir la dosis de agonistas dopaminérgicos gradualmente, tanto como nos permita mantener la PRL dentro de la normalidad (2⊕⊕OO), hasta retirarla finalmente.
Criterios para la interrupción del tratamiento con agonistas dopaminérgicos
| Favorables | Excluyentes |
| Duración del tratamiento >2 añosConcentraciones normales de prolactinaAusencia de imagen radiológica de adenomaDisminución de tamaño tumoral:- >50% sobre el inicial- Descenso de los macroadenomas a <10 mmEmbarazoPosmenopausiaPosibilidad de realizar seguimiento médico adecuado | Duración del tratamiento <2 añosConcentraciones elevadas de prolactinaAumento de tamaño tumoralPersistencia de tamaño tumoral >10 mmBorde tumoral muy próximo a quiasma ópticoInvasión de senos cavernososImposibilidad de realizar seguimiento médico adecuado |
Como los valores de PRL pueden seguir suprimidos hasta 120 días tras su retirada27, sugerimos que la primera valoración de los niveles de PRL tras suspender esta medicación se retrase 3 meses. Posteriormente los controles de PRL deberían hacerse cada 3 meses durante el primer año y luego anualmente, al menos 5 años, sobre todo en casos de macroadenomas. Si hay aumento importante de las concentraciones de PRL, superando los 100ng/ml, o aparecen síntomas neurológicos o pérdida de visión, se debe solicitar RM, más si el paciente presentaba inicialmente un macroadenoma.
Recomendamos no interrumpir el tratamiento con agonistas dopaminérgicos en aquellos pacientes en los que el límite superior del adenoma se encuentre a menos de 5mm del quiasma óptico, exista invasión de senos cavernosos5, o mantengan concentraciones elevados de PRL y/o aumento o no reducción del tamaño tumoral (tabla 4). Una excepción podrían ser los microadenomas sin disminución del tamaño tumoral pero con cambios radiológicos sugestivos de necrosis, siempre que mantengan niveles de PRL controlados con dosis bajas de agonistas dopaminérgicos.
CirugíaSolo una minoría de pacientes requiere cirugía. En general, sugerimos la cirugía transesfenoidal cuando el tratamiento con agonistas dopaminérgicos no disminuya las concentraciones de PRL o el tamaño de los macroadenomas. En caso de microadenomas, la cirugía suele limitarse a casos sin respuesta al tratamiento farmacológico y con manifestaciones clínicas persistentes (2⊕OOO) (tabla 5).
Indicaciones del tratamiento quirúrgico en prolactinomas
| Aumento del tamaño tumoral a pesar de tratamiento médico óptimoApoplejía hipofisariaIntolerancia a tratamiento oralMacroadenoma resistente a tratamiento con agonistas-dopaminérgicosMicroadenoma resistente a tratamiento con agonistas dopaminérgicos en mujer que desea fertilidadCompresión quiasmática persistente tras tratamiento médicoProlactinoma quístico sin respuesta al tratamiento médicoFístula de líquido cefalorraquídeo tras la administración de agonistas dopaminérgicosMacroadenoma en pacientes psiquiátricos con contraindicación de agonistas dopaminérgicos |
Los porcentajes de curación quirúrgica oscilan entre el 75 y el 90% para los microadenomas y entre el 18 y el 80% para los macroadenomas. Los resultados quirúrgicos dependen de la experiencia y calidad del neurocirujano, del tamaño tumoral y de las concentraciones de PRL28. Cuando las concentraciones de PRL prequirúrgicas sean superiores a 200μg/l disminuye el porcentaje de curación, tanto en micro como en macroadenomas29. Algunos trabajos apuntan a que el tratamiento previo con agonistas dopaminérgicos puede empeorar los resultados quirúrgicos por inducir fibrosis30.
Si los cirujanos son experimentados, la mortalidad quirúrgica es muy baja (0,2%) y hay pocas complicaciones en el postoperatorio inmediato28. Considerando esto, sugerimos que la cirugía hipofisaria se centralice en hospitales donde se realicen al menos 25 intervenciones hipofisarias al año(2⊕OOO).
Las concentraciones de PRL <20μg/l a la mañana siguiente del tratamiento quirúrgico son sugestivas de remisión en pacientes que no hayan recibido agonistas dopaminérgicos durante las 4 semanas previas a la cirugía31,32. En una serie de 409 mujeres, el mejor predictor de curación fue la concentración de PRL <5μg/l en el primer día del postoperatorio. Cuando la cabergolina se mantiene hasta el tratamiento quirúrgico debe posponerse 3 meses tras la cirugía la evaluación de los niveles de PRL para obviar el efecto del fármaco27.
Las recurrencias tumorales son infrecuentes en los microadenomas, pero se presentan en más del 80% de los pacientes con macroprolactinomas33. El tiempo de recurrencia de la hiperprolactinemia tras la cirugía puede ser largo, aunque en la mayoría de los estudios se produce durante los primeros 3 años34. Sugerimos que el seguimiento se haga cada 3 meses en el primer año tras la cirugía y luego anualmente, al menos durante 5 años, sobre todo en casos de macroprolactinomas.
No hay evidencia aun de la superioridad de las nuevas técnicas endoscópicas frente a las anteriores en la cirugía transesfenoidal.
RadioterapiaSiempre debe considerarse la eficacia de la radioterapia frente a las complicaciones derivadas del propio tratamiento. La radioterapia convencional logra normalizar las concentraciones de PRL en solo el 34,1% de casos y, la mayoría de veces, tras un largo periodo de latencia y con efectos colaterales importantes (riesgo de hipopituitarismo, aparición de neoplasias intracraneales secundarias, lesión cerebral, daño de nervios ópticos). Sugerimos que la radioterapia se emplee solo en pacientes con grandes tumores que no sean candidatos a tratamiento quirúrgico y que no respondan a agonistas dopaminérgicos o no puedan ser tratados con ellos, y en casos de prolactinomas agresivos o carcinomas (2⊕OOO).
No hay evidencia científica que apoye la recomendación de algunos autores de suspender los agonistas dopaminérgicos antes de administrar la radioterapia para mejorar sus resultados35.
No se conoce si la radioterapia esteroatáxica es superior a la convencional para reducir los efectos secundarios y/o para disminuir más rápidamente los niveles hormonales y el tamaño tumoral. Los tumores con extensión supraselar, o aquellos en los que hay menos de 5mm de separación entre los límites tumorales y el quiasma óptico, no deben tratarse con dosis única de radioterapia36. Los prolactinomas con invasión de seno cavernoso pueden recibir dosis única de radioterapia, ya que los nervios craneales a este nivel son relativamente radiorresistentes.
Edad reproductivaEn mujeres en edad fértil se debe aconsejar el empleo de anticonceptivos de barrera cuando se inicia el tratamiento farmacológico porque, una vez normalizada la hiperprolactinemia, puede recuperarse con rapidez la ovulación y la fertilidad.
Las mujeres premenopáusicas que no desean gestación y que presentan microprolactinomas e hipogonadismo, y no toleran o no responden a los agonistas dopaminérigos, pueden ser tratadas con contraceptivos orales para prevenir la pérdida de masa ósea. No existe evidencia de que el tratamiento estrogénico aumente el tamaño tumoral en estas pacientes, pero serían necesarios estudios prospectivos para aclarar este punto.
En hombres, el tratamiento con agonistas dopaminérgicos causa habitualmente una mejora en la calidad del semen junto con la restauración de la función gonadal y la disminución del tamaño tumoral37.
Planificación de gestaciónSe recomienda que antes de la concepción se logre la normalización de las concentraciones de PRL y que el tamaño tumoral sea <10mm (1⊕OOO). La cirugía transesfenoidal puede ser una opción en mujeres con micro o macroadenomas con intolerancia o resistencia a agonistas dopaminérgicos4 y en mujeres con macroadenomas que no disminuyan de tamaño con tratamiento farmacológico38 (2⊕OOO). Sin embargo, la cirugía transesfenoidal también puede causar hipopituitarismo, obligando posteriormente al empleo de técnicas de reproducción asistida.
Cuando no se consigue restaurar la ovulación en mujeres con microprolactinomas que desean fertilidad sugerimos emplear citrato de clomifeno o terapia con gonadotropinas.
En la programación previa al embarazo se debe suspender la cabergolina e introducir bromocriptina aunque esta también atraviesa la barrera placentaria39 y el empleo de agonistas dopaminérgicos no está aprobado en el embarazo.
GestaciónCuando falte el primer periodo menstrual y la prueba de embarazo sea positiva, recomendamos interrumpir el tratamiento con bromocriptina para evitar la exposición fetal (2⊕⊕OO).
Durante el embarazo normal las concentraciones de PRL aumentan más de 10 veces40 y por eso las decisiones terapéuticas en mujeres con prolactinomas deben tomarse según los síntomas y signos que presenten y no por las concentraciones plasmáticas de PRL. Además, estos no se deben determinar de forma rutinaria durante la gestación (1⊕⊕⊕⊕).
En el embarazo normal, la hipófisis puede duplicar su tamaño por hiperplasia de las células lactotropas, secundaria a las concentraciones altas de estrógenos41. El riesgo de crecimiento tumoral sintomático durante el embarazo es del 2,2-5% para mujeres con microprolactinomas, pero se puede elevar hasta el 31% en macroprolactinomas. Por eso, sería prudente mantener el tratamiento con agonistas dopaminérgicos en mujeres con macroprolactinomas que han conseguido gestación mientras seguían este tratamiento, sobre todo si los tumores son invasivos o están cerca del quiasma óptico. Si las pacientes con macroadenomas han sido tratadas previamente con cirugía o radioterapia, el riesgo de crecimiento sintomático es solo del 2,8-4,3%, similar al de los microadenomas.
En mujeres con microprolactinomas sugerimos exclusivamente evaluación clínica en cada trimestre de gestación. En mujeres con macroprolactinomas se debe realizar además estudio trimestral de campimetría, o incluso con más frecuencia si antes del embarazo ya había evidencia de crecimiento supraselar.
Si aparecen síntomas neurológicos o alteraciones visuales se recomienda realizar estudio oftalmológico y morfológico con RM sin usar gadolinio, en gestantes tanto con micro como con macroprolactinomas (1⊕⊕OO).
Si se produce aumento sintomático del tamaño tumoral recomendamos reiniciar el tratamiento con bromocriptina, si previamente se había suspendido (1⊕⊕OO). Hay ya constancia de que el empleo de bromocriptina no ha causado aumento del riesgo de malformaciones fetales en más de 2.500 embarazos42. La experiencia con cabergolina es menor, pero los datos parecen ser similares42,43. Sin embargo, algunos hallazgos recientes43 señalan la necesidad de series más amplias con estudio y seguimiento del desarrollo neurológico posterior de los niños expuestos intraútero a cabergolina.
El tratamiento quirúrgico también puede considerarse en casos de crecimiento tumoral. Los beneficios y riesgos del mismo frente al tratamiento médico deben ser explicados a cada paciente, porque no hay estudios controlados hasta la actualidad que indiquen cuál es la mejor opción terapéutica. Probablemente la reintroducción del agonista dopaminérgico es menos lesiva para la madre y el feto que la cirugía. Si se opta por el tratamiento farmacológico, debe ser monitorizado de forma continua, recomendándose cirugía transesfenoidal o inducción al parto, si el feto está casi a término, cuando no haya respuesta a los agonistas dopaminérgicos con empeoramiento progresivo de la visión38 (1⊕⊕OO).
Posparto y lactanciaTras el parto no se introduce de nuevo el tratamiento con agonista dopaminérgico en las pacientes con microadenomas que deseen lactancia materna. Aunque no hay indicios de que la lactancia materna induzca aumento de tamaño tumoral14, en general, se desaconseja la lactancia materna en macroadenomas (1⊕OOO); sin embargo, podría considerarse esta si existiese deseo de la madre y no se ha comprobado aumento de tamaño tumoral durante la gestación.
Aproximadamente a las 6 semanas del parto se restablece la normoprolactinemia en las gestaciones normales y, a partir de ese momento, se pueden empezar a reevaluar los concentraciones de PRL.
Solo se ha descrito remisión espontánea de la hiperprolactinemia en mujeres con microprolactinomas44. En estos casos se puede considerar discontinuar de forma prolongada el tratamiento con agonistas dopaminérgicos tras el parto con seguimiento regular durante al menos 5 años.
Prolactinomas en niños y adolescentesLos prolactinomas son los adenomas hipofisarios más frecuentes en niños y adolescentes. Prácticamente todos los prolactinomas diagnosticados en niños son sintomáticos por lo que es obligado su tratamiento45. El empleo de agonistas dopaminérgicos es la primera opción terapéutica en ausencia de complicaciones que requieran tratamiento quirúrgico inmediato. La radioterapia debe limitarse a los casos más agresivos, sin respuesta a agonistas dopaminérgicos.
Prolactinomas en menopausiaHay escasos estudios sobre el tratamiento de los prolactinomas en pacientes posmenopáusicas. El manejo de los macroprolactinomas no difiere del que se sigue en otros grupos de edad, pero probablemente no sea necesario el tratamiento de los microadenomas (1⊕OOO). Además se han descrito casos en los que la menopausia puede estar relacionada con la resolución de la hiperprolactinemia46. Si se decide la suspensión del tratamiento farmacológico se debe mantener un seguimiento regular de las pacientes durante al menos 5 años.
Tratamiento de prolactinomas malignosLa incidencia de prolactinomas malignos es muy baja. Se debe sospechar su existencia en casos con falta de respuesta al tratamiento farmacológico o después de recurrencias tras la cirugía. El diagnóstico de malignidad solo se establece por la extensión del tumor a áreas no continuas del sistema nervioso central o por la presencia de metástasis. El estudio anatomopatológico no es concluyente aunque hay parámetros atípicos que sugieren malignidad como la presencia de numerosas mitosis, atipias y pleomorfismo nuclear, inmunorreactividad positiva p53, índice proliferativo Ki-67 superior al 3%, e invasión47.
Solo el 60% de los pacientes con carcinomas productores de PRL sobreviven más de un año tras el desarrollo de metástasis. En la mayoría de los casos el tratamiento con cirugía, radioterapia, quimioterapia o agonistas dopaminérgicos, empleados solos o en combinación, producen falta de resultados o solo respuesta parcial48.
La temozolamida se ha utilizado con resultados esperanzadores en varios casos de carcinomas hipofisarios productores de PRL49, cuando no existe respuesta al tratamiento con agonistas dopaminérgicos y en prolactinomas benignos aunque invasivos50. Por eso, sugerimos emplear este fármaco en pacientes con prolactinomas malignos o invasivos que no se controlan con cirugía y radioterapia (1⊕OOO).
Estudio histológico. Nuevas tecnologíasLos prolactinomas representan más del 50% de los tumores hipofisarios, pero tienen una representación muy inferior en las series quirúrgicas debido a su buen manejo con tratamiento farmacológico. Sin embargo, algunos son clínicamente más agresivos, ya sea porque resultan resistentes a fármacos agonistas dopaminérgicos, ya porque tienen gran tamaño al diagnóstico y elevada tasa de recurrencia tras el tratamiento quirúrgico. Por lo tanto, la información histopatológica clásica ya comentada se debe complementar con datos que puedan predecir mayor agresividad, invasividad, e incluso malignidad (definida, en los tumores hipofisarios, por la presencia de metástasis a distancia)47. Los datos tradicionales de agresividad o malignidad (polimorfismo nuclear, atipia, áreas de necrosis) tienen utilidad limitada en estos tumores. El hallazgo de un índice de proliferación Ki.67 >3%, o inmunorreactividad para p53 >3% se consideran predictivos de mayor invasividad y recurrencia. Se están investigando otros marcadores de ciclo celular y adhesividad (ciclinas D1 y E, PCNA - proliferating cell nuclear antigen-, PNCAM - polysialylated neural cell adhesion molecule-, expresión reducida de E-cadherin/catenin), y la expresión alterada de genes reguladores de la angiogénesis (FGF, VEGF y otros), que en el futuro podrían tener utilidad clínica51. Recientemente se ha descrito que la inmunoexpresión de 06-metilguanina-DNA metiltransferasa (MGMT), asociada a un comportamiento agresivo en tumores hipofisarios (y especialmente en prolactinomas) puede predecir una respuesta positiva a temazolamida50,52. Por último, los estudios moleculares de expresión y funcionalidad de receptores dopaminérgicos y estrogénicos también pueden dar información clínicamente relevante. Todas estas técnicas, solo disponibles en algunos laboratorios, encuentran su marco óptimo de desarrollo en estudios multicéntricos, del tipo del Registro Molecular de Adenomas Hipofisarios, promovido en los últimos tiempos en España desde la SEEN. (Contacto e información en: http://www.remahnacional.com).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.