La insuficiencia suprarrenal (IS) es una enfermedad poco frecuente pero con riesgo vital si no se trata. Puede ser por fallo primario de las glándulas suprarrenales (IS primaria) o por mal funcionamiento del eje hipotalámico-hipófiso-adrenal (HPA) (IS secundaria). La carencia de datos sobre la incidencia/prevalencia de la IS en España dificulta apreciar la magnitud del problema en nuestro país. Los síntomas iniciales son inespecíficos, por lo que con frecuencia se retrasa el diagnóstico.
Con las pautas actuales sustitutivas de glucocorticoides en los pacientes con IS tratados la calidad de vida está disminuida y existe una mayor morbimortalidad, probablemente en relación tanto con la sobredosificación como con la falta de glucocorticoides con picos y nadires no fisiológicos a lo largo de las 24h. La disponibilidad de un nuevo fármaco con liberación modificada dual (inmediata y retardada) que requiere una sola dosis diaria mejora y simplifica el tratamiento, incrementa la adherencia, mejora la calidad de vida, la morbilidad y posiblemente la mortalidad. Esta revisión repasa la realidad y conocimientos sobre el tema tanto globalmente como en España ante la situación previsible de disponer en el futuro de este nuevo fármaco.
Adrenal insufficiency (AI) is a rare endocrine disease, associated to increased mortality if left untreated. It can be due to a primary failure of the adrenal glands (primary AI) or malfunctioning of the hypothalamic-pituitary-adrenal axis (HPA) (secondary AI). The lack of data on incidence/prevalence of adrenal insufficiency in Spain complicates any evaluation of the magnitude of the problem in our country. Initial symptoms are non-specific, so often there is a delay in diagnosis.
Current therapy with available glucocorticoids is associated with decreased quality of life in patients with treated AI, as well as with increased mortality and morbidity, probably related to both over-treatment and lack of hydrocortisone, associated with non-physiological peaks and troughs of the drug over the 24hours. The availability of a new drug with a modified dual release (immediate and retarded), that requires one only daily dose, improves and simplifies the treatment, increases compliance as well as quality of life, morbidity and possibly mortality. This revision deals with the knowledge on the situation both globally and in Spain, prior to the availability of this new drug.
La insuficiencia suprarrenal (IS), manifestación clínica de una producción o acción deficiente de glucocorticoides, es una enfermedad poco frecuente pero con riesgo vital si no se trata. Las causas más habituales de IS son el fallo primario de las glándulas suprarrenales (mayoritariamente debido a la adrenalitis autoinmunitaria o enfermedad de Addison) o bien por un mal funcionamiento del eje hipotalámico-hipofisario-adrenal (HPA). En ambas situaciones la secreción de cortisol es deficiente.
La prevalencia global de la IS en España es desconocida dada la falta de registros específicos. La prevalencia de la adrenalitis autoimmunitaria, según series de otros países europeos, se estima entre 93-140 por millón de habitantes1,2 y la incidencia de 5-6 casos nuevos por año por millón de habitantes en poblaciones caucásicas3. La etiología más frecuente del déficit secundario es la lesión hipofisaria o la administración crónica exógena de glucocorticoides que inducen atrofia de las células corticotropas. Esta última solo es relevante cuando se retira el tratamiento corticoideo exógeno. Tampoco existen muchos datos españoles sobre el número de pacientes con déficit de corticotropina (ACTH), la mayoría acompañados de varios otros déficits hipofisarios (hipopituitarismo). Se estima una prevalencia global de entre 150-280 por millón3. Un único estudio sobre la prevalencia de hipopituitarismo en la región de Galicia reportó 45 casos/100.000 habitantes y una incidencia anual de 4,2/100.000 habitantes en 2001, donde aproximadamente el 62% tenían un déficit de ACTH asociado4.
Los síntomas cardinales de la IS fueron descritos por Thomas Addison en 1855. Incluyen debilidad, fatiga, anorexia, dolores articulares, hipotensión arterial ortostática e hiperpigmentación cutánea (específica de la IS primaria pero ausente en el déficit de ACTH). No es raro que pasen desapercibidos por su escasa especificidad, por lo que a menudo se retrasa el diagnóstico. En una situación aguda constituye una emergencia médica y conlleva una hipotensión arterial grave, una disminución de la consciencia e incluso la muerte si no se trata.
La identificación de personas con riesgo o predisposición a tener una IS clínica o subclínica permitiría alcanzar un diagnóstico correcto más precozmente. Además, conocer la etiología del fallo adrenal es de interés para su seguimiento y tratamiento. Los antecedentes personales y patológicos y la buena historia clínica pueden sugerir un diagnóstico de sospecha. Ante la sospecha de un fallo adrenal se debe proceder a confirmar el diagnóstico hormonal, buscar la etiología y sobre todo empezar el tratamiento sustitutivo con hidrocortisona. Las distintas causas de la IS se resumen en la tabla 1.
Etiología de la insuficiencia suprarrenal
| PRIMARIA |
| Autoinmunitaria: esporádica, síndrome poliglandular autoinmunitario tipo 1 y tipo 2 |
| Infecciosa: tuberculosis, infecciones fúngicas, citomegalovirus, virus de la inmunodeficiencia humana |
| Metástasis |
| Infiltración adrenal: amiloidosis, hemocromatosis |
| Hemorragia intraadrenal bilateral: sepsis meningocócica, traumatismo, coagulopatía |
| Adrenoleucodistrofia, adrenomieloneuropatia |
| Hiperplasia o hipoplasia adrenal congénita |
| Síndromes de resistencia a ACTH |
| Adrenalectomía bilateral |
| Farmacológica: ketoconazol, etomidato, aminoglutetimida, mitotane, metopirona, abiraterona |
| SECUNDARIA |
| Tratamiento con glucocorticoides exógenos |
| Hipopituitarismo |
| Resección selectiva del tumor hipofisario productor de ACTH |
| Apoplejía hipofisaria, síndrome de Sheehan |
| Enfermedad granulomatosa: sarcoidosis, tuberculosis |
| Irradiación hipofisaria |
| Déficit aislado de ACTH: idiopático, genético, hipofisitis linfocitaria |
La confirmación diagnóstica se tendrá al objetivar una cortisolemia basal por debajo de los límites de referencia (<165nmol/L o 5mcg/dL) o un pico de cortisol inferior a 500nmol/L (18mcg/dL) tras la estimulación con 250mcg de ACTH i.v. Si la sospecha es de IS secundaria se aconseja realizar un test de estimulación hipofisaria, como la hipoglucemia insulínica, que confirmará el déficit de ACTH si el pico de cortisol obtenido tras la hipoglucemia (glucosa<2,2 nmol/l) es inferior a 550nmol/L (22mcg/dL).
Una vez confirmado el diagnóstico bioquímico es importante buscar la etiología por si procediese ofrecer un tratamiento dirigido a la causa, aparte del tratamiento hormonal sustitutivo. Para el tratamiento a largo plazo de estos pacientes es indispensable la colaboración de un especialista con experiencia, aunque la sospecha diagnóstica y el tratamiento agudo es responsabilidad de todos los médicos dado que en muchos casos se trata de una emergencia médica con riesgo vital.
A pesar de optimizar el tratamiento sustitutivo con los fármacos actualmente disponibles, las comorbilidades asociadas, la mortalidad y la calidad de vida relacionada con la salud no se normalizan totalmente en estos pacientes.
Ritmo circadiano fisiológico de cortisolLa producción fisiológica de cortisol sigue un patrón circadiano. Se observa un aumento progresivo de cortisol durante la madrugada, con unas concentraciones máximas justo antes del despertar por la mañana, que van disminuyendo a lo largo del día hasta unas concentraciones mínimas (incluso<50nmol/l=1,8mcg/dl) hacia la medianoche5. Es precisamente el ascenso de cortisol durante el alba lo que más diferencia el ritmo circadiano de cortisol normal del observado en los pacientes con IS6 ya que estos se despiertan con unas concentraciones de cortisol muy bajas que solo aumentan tras ingerir el glucocorticoide exógeno. Por ello, es importante intentar conseguir concentraciones séricas de cortisol lo más similares posibles al ritmo circadiano normal, recordando que la tasa de producción de cortisol en sujetos sanos es menor de lo que anteriormente se había creído7.
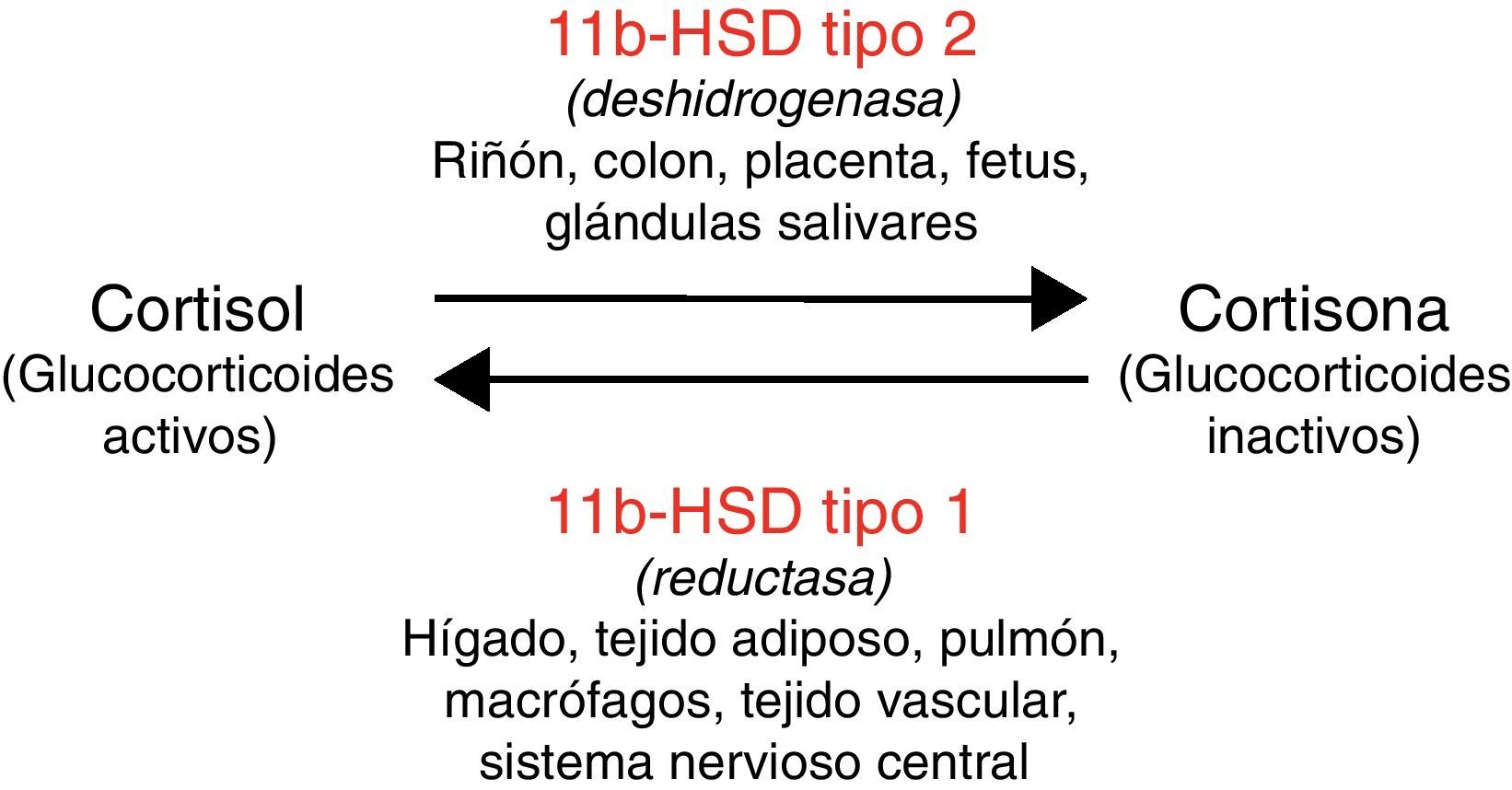
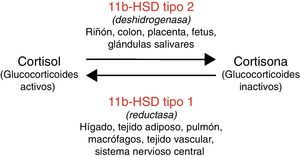
La enzima 11 beta hidroxiesteroide deshidrogenasa regula el metabolismo del cortisol, amplificando la señal esteroidea si actúa la isoforma tipo 1 de la enzima (11bHSD1) o bien convirtiendo el cortisol en cortisona (esteroide inactivo) en caso de actuar la isoforma tipo 2 (11bHSD2)8. La actividad de estas enzimas es específica de cada tejido (fig. 1). Además, la 11bHSD2 no inactiva con la misma eficacia los distintos tipos de glucocorticoides sintéticos (por ejemplo, tiene poca capacidad para inactivar la dexametasona). Esto justifica que las consecuencias metabólicas difieran con distintas formulaciones de glucocorticoides.
Morbimortalidad en pacientes en tratamiento sustitutivo con glucocorticoides por insuficiencia suprarrenalAntes de disponer del tratamiento sustitutivo con glucocorticoides (1950) la tasa de supervivencia de estos pacientes era inferior al 20% al año del diagnóstico. Con el advenimiento del tratamiento sustitutivo con hidrocortisona su supervivencia mejoró claramente.
Sin embargo, en los escasos estudios de supervivencia existentes en esta enfermedad se observa que, a pesar del correcto tratamiento sustitutivo con glucocorticoides y mineralocorticoides, las comorbilidades asociadas, la mortalidad y la calidad de vida relacionada con la salud son peores que en la población general9–16.
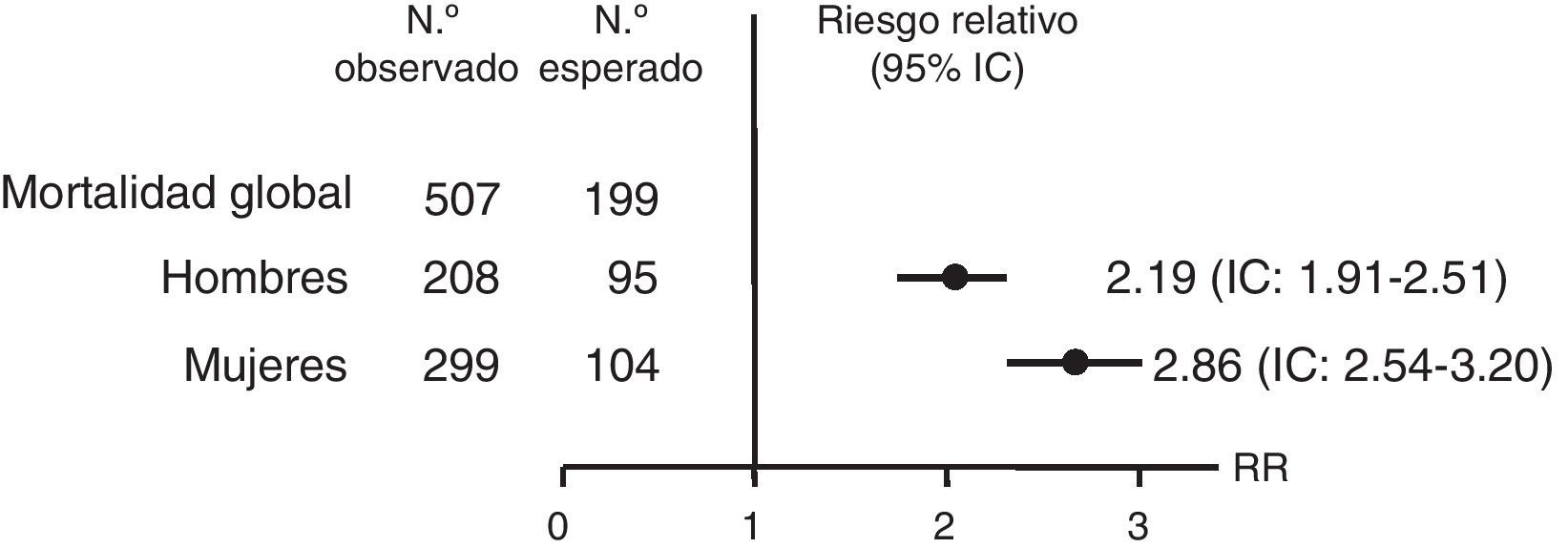
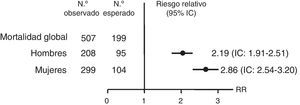
Varios trabajos reportan una mortalidad prematura en pacientes con IS tratados. Un estudio observacional retrospectivo, utilizando datos del National Swedish Hospital y Cause of Death Registers, observó en la enfermedad de Addison un riesgo de mortalidad que duplicaba el de la población general (riesgo relativo [RR]): 2,19 en hombres (intervalo de confianza [IC]: 1,91-2,51) y 2,86 en mujeres (IC: 2,54-3,20) (fig. 2). Este aumento de mortalidad se atribuyó principalmente a causas cardiovasculares, neoplasias e infecciones. El 7,1% de estas muertes fueron por un episodio de crisis suprarrenal aguda8.
Riesgo relativo e intervalo de confianza (IC) de la mortalidad global de pacientes con la enfermedad de Addison en Suecia desde 1987 hasta 2001. Fuente: Bergthorsdottir et al.8
Otro estudio sueco más reciente y mayor también objetivó un riesgo de mortalidad global doble en la enfermedad de Addison en comparación con la población general, incluso mayor en los pacientes más jóvenes9. En cambio, un estudio retrospectivo observacional noruego con 811 pacientes únicamente observó un aumento de la mortalidad comparado con la población de referencia si la IS fue diagnosticada antes de los 40 años con un standard mortality rate (SMR) de 1,5 (IC: 1,09-2,01). Las causas más frecuentes de muerte fueron la IS aguda y las infecciones10.
La mortalidad también está aumentada en el hipopituitarismo con un riesgo entre 1,2 y 2.1711–14, aunque se desconoce en qué proporción es achacable al déficit de ACTH u otros déficits hipofisarios asociados.
Rosén et al. en los años 90 analizaron retrospectivamente 333 pacientes con hipopituitarismo y objetivaron una mortalidad global aumentada en estos pacientes respecto a la población general, independientemente de la causa del hipopituitarismo. La causa más frecuente de muerte fue la cardiovascular11. Este aumento de la mortalidad persistía incluso tras excluir a aquellos que murieron por problemas quirúrgicos y con antecedentes de enfermedad de Cushing o acromegalia, donde se sabe que la mortalidad por causas cardiovasculares está aumentada. Los únicos factores independientes predictores de supervivencia que encontraron fueron la edad al diagnóstico y el hipogonadismo12. Otra serie de 344 pacientes con hipopituitarismo objetivó una mortalidad global 2 veces superior a la de la población general (SMR: 2,17; IC: 1,88-2,51) con mayor riesgo en mujeres13. La causa más frecuente de muerte fue la cerebrovascular y fue mayor en pacientes cuyos déficits hipofisarios empezaron en edades más jóvenes, sugiriendo una inadecuada sustitución hormonal.
En una serie de 1.014 pacientes británicos con hipopituitarismo también se observó una SMR global de 1,87 (IC: 1,62-2,16) atribuida principalmente a causas cardiovasculares e infecciosas. Como en las series anteriores, la edad al diagnóstico, el sexo femenino y el hipogonadismo no tratado fueron predictores independientes asociados a la mortalidad14.
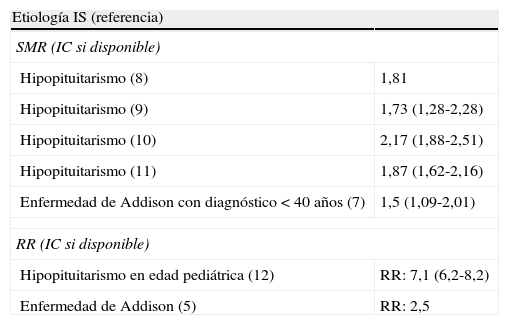
En una serie pediátrica de 5.000 pacientes con hipopituitarismo se observó en el hipoadrenalismo secundario un riesgo de mortalidad de hasta 7 veces superior al de la población de referencia15. Esto refleja la importancia de que los familiares y cuidadores de estos niños sean educados e instruidos para identificar signos de riesgo de IS aguda y actuar en consecuencia. Las tasas de mortalidad prematura se encuentran resumidas en la tabla 2.
Mortalidad prematura en el hipopituitarismo y la enfermedad de Addison
| Etiología IS (referencia) | |
| SMR (IC si disponible) | |
| Hipopituitarismo (8) | 1,81 |
| Hipopituitarismo (9) | 1,73 (1,28-2,28) |
| Hipopituitarismo (10) | 2,17 (1,88-2,51) |
| Hipopituitarismo (11) | 1,87 (1,62-2,16) |
| Enfermedad de Addison con diagnóstico <40 años (7) | 1,5 (1,09-2,01) |
| RR (IC si disponible) | |
| Hipopituitarismo en edad pediátrica (12) | RR: 7,1 (6,2-8,2) |
| Enfermedad de Addison (5) | RR: 2,5 |
IC: intervalo de confianza; IS: insuficiencia suprarenal; SMR: standard mortality rate; RR: riesgo relativo.
Este aumento global de la mortalidad podría en parte ser debido a un tratamiento sustitutivo inadecuado con glucocorticoides, bien por exceso o por defecto, especialmente en respuesta al estrés o a una enfermedad intercurrente. De hecho, se ha evidenciado cómo los pacientes con IS tratada no consiguen una buena calidad de vida ni una percepción subjetiva del bienestar8,17. Hahner et al.18 analizaron la calidad de vida y la depresión en pacientes con IS de cualquier causa a través de cuestionarios. Observaron una mala percepción del estado de salud y una peor calidad de vida, sobre todo en la IS secundaria en la que habitualmente coexisten otros déficits hormonales que pueden incidir en el bienestar percibido. Es importante resaltar que el 18% de estos pacientes no trabajaban o bien cobraban una pensión de invalidez frente a un 4% de los controles18.
Otro estudio reciente entrevistó a 1.245 pacientes con IS procedentes de varios países. Se observó que 2 terceras partes de los pacientes reportaron una alteración en su calidad de vida, siendo peor en los casos de IS secundaria19.
Aunque se desconoce qué factores determinan esta peor calidad de vida en los pacientes con IS, es probable que tengan un papel en la imposibilidad de conseguir, con la medicación actualmente disponible, un ritmo circadiano fisiológico de cortisol circulante a lo largo del día y de la noche.
Por otro lado, se han observado alteraciones en el perfil metabólico de pacientes con IS tratados con glucocorticoides. En la base de datos KIMS (un estudio internacional de farmacovigilancia que incluye 2.424 pacientes con hipopituitarismo tratados con la hormona de crecimiento recombinante humana) se compararon los pacientes con y sin déficit de ACTH. Se observó que los pacientes ACTH-deficientes, tratados con una dosis de hidrocortisona (o equivalente) superior a 20mg/d, tenían un perfil metabólico desfavorable (mayor índice de masa corporal, concentraciones más elevadas de triglicéridos, colesterol total y LDL). No se encontraron diferencias en el perfil metabólico en aquellos pacientes que tomaban dosis inferiores a 20mg/d20. Globalmente se observó que en pacientes tratados con glucocorticoides se producían más eventos cardiovasculares y diabetes mellitus, si bien los pacientes ACTH-suficientes eran de media 6 años más jóvenes.
También se ha descrito como una variación diurna atenuada del perfil de cortisol, es decir, menos cortisol sérico durante la mañana y más por la noche se asocia a la obesidad abdominal y al síndrome metabólico21.
El tratamiento con glucocorticoides inhibe la actividad osteoblástica, estimula la actividad osteoclástica e inhibe la absorción intestinal de calcio dependiente de la vitamina D, además de inducir el hipogonadismo. Todo ello favorece una reducción acelerada de la masa ósea. En efecto, un estudio reciente de pacientes con la enfermedad de Addison (n=292) observó una disminución de la densidad mineral ósea (DMO) en el cuello femoral y en la columna lumbar. Se observó una relación inversa entre la dosis de hidrocortisona administrada y la DMO, aunque no un aumento del número de fracturas22. Varios estudios van en la misma línea, objetivando una disminución de la DMO, aunque en la mayoría de casos los pacientes recibían dosis de glucocorticoides de 30 o más mg/d23,24. Otro estudio publicado recientemente no objetivó diferencias en la DMO de pacientes tratados con bajas dosis de hidrocortisona (<20mg/d) respecto a los límites de referencia (tanto en pacientes con la enfermedad de Addison como en pacientes con hiperplasia suprarrenal congénita tratada con corticoides). En cambio, en aquellos tratados con prednisolona (glucocorticoide de acción más prolongada) observaron niveles más bajos de osteocalcina (un marcador sérico de formación ósea) y del Z-score de la DMO respecto a los tratados con hidrocortisona25 al igual que lo observado en otra serie26.
Otro trabajo describe un aumento del riesgo de fractura de cadera en estos pacientes comparado con controles categorizados por edad y sexo (OR: 1,8; IC: 1,6-2,1), siendo el riesgo mayor en mujeres diagnosticadas de enfermedad de Addison antes de los 50 años27. Esto tiene un gran impacto económico para el sistema sanitario y sobre la calidad de vida de los pacientes.
Pautas actuales de tratamiento sustitutivo con glucocorticoides y sus problemasEl tratamiento glucocorticoideo, mayoritariamente utilizado en la IS, es la hidrocortisona en 2 o 3 tomas al día (en el 75% de los casos), seguida de la prednisona (11%), el acetato de cortisona (6%) y la dexametasona (4%), según una encuesta reciente realizada en 1.245 pacientes de múltiples países europeos en tratamiento sustitutivo con glucocorticoides19.
Debido a la vida media corta de la hidrocortisona se requieren múltiples dosis durante el día. Cada dosis oral administrada provoca un aumento rápido y un pico elevado de cortisol seguido de un rápido descenso. Cuando se preguntó a estos pacientes qué factor consideraban el más importante para valorar que un tratamiento sustitutivo fuera óptimo la mayoría respondieron que el fármaco durara 24h y después que tuviera pocos efectos adversos19.
La mayoría de los pacientes aquejaban alteraciones en la percepción subjetiva de la salud con repercusión sobre su vida social, actividad física, trabajo o vida familiar debido a su enfermedad y su tratamiento19. Consideraron que el tratamiento con múltiples dosis diarias dificultaba el cumplimiento, lo que a su vez repercutía negativamente en su bienestar.
Estos datos demuestran, desde la perspectiva del paciente, una clara necesidad de mejorar el régimen terapéutico sustitutivo con glucocorticoides en la IS a pesar de la existencia de múltiples pautas5. Por otro lado, faltan guías terapéuticas basadas en la evidencia.
Monitorizar la efectividad del tratamiento con glucocorticoides es difícil por falta de marcadores adecuados, por lo que se basa exclusivamente en los signos clínicos y resulta complicado identificar pacientes sobre o infratratados. Además, la mayoría refieren encontrarse mejor con dosis elevadas de hidrocortisona tomando un exceso de dosis, lo que comporta mayor riesgo de efectos adversos. Actualmente, no hay ningún método útil para valorar la adherencia del paciente al tratamiento y la adecuación de este a la secreción fisiológica del cortisol.
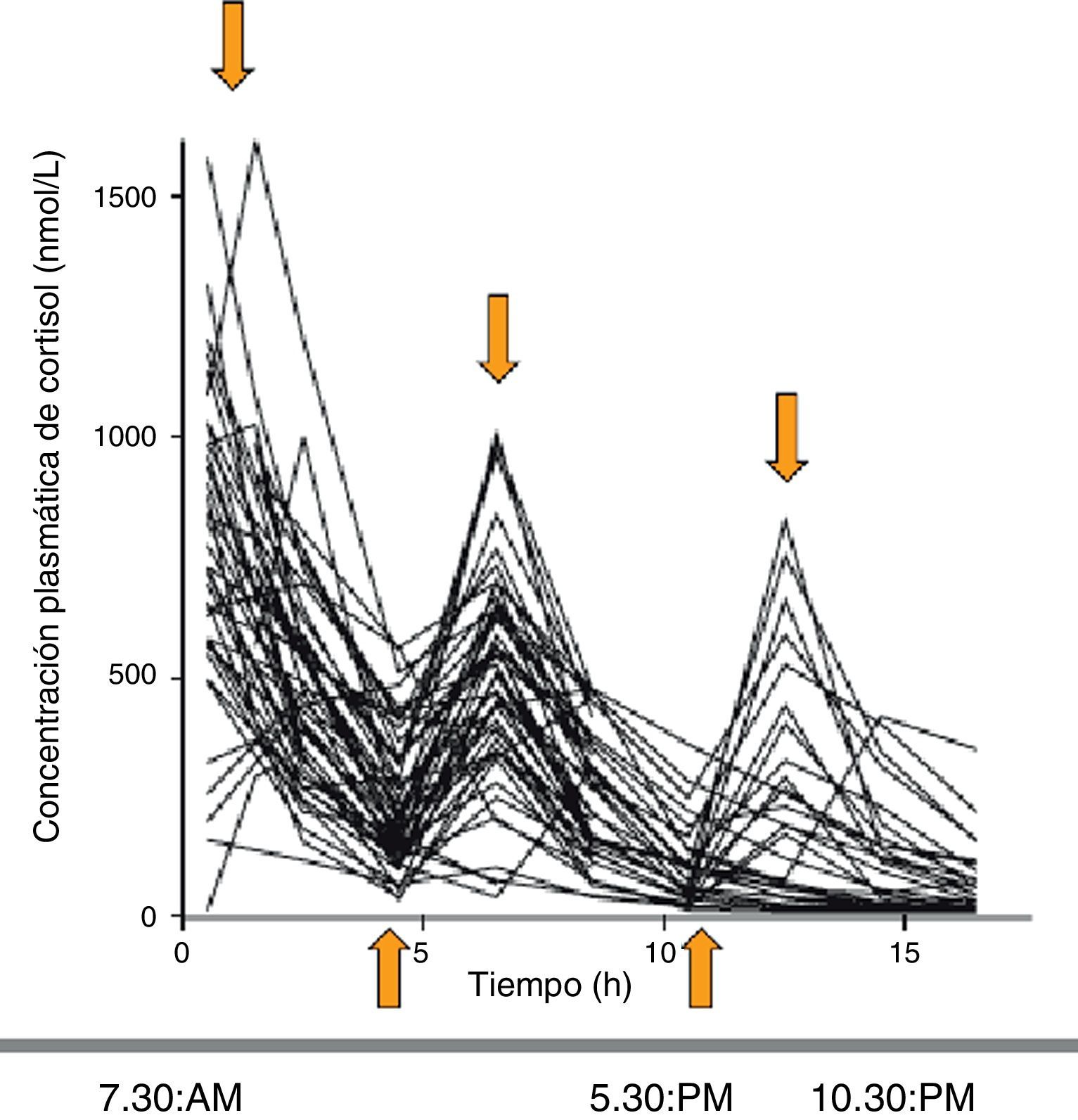
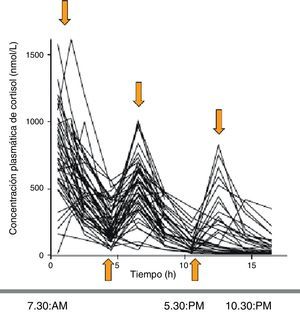
Al evaluar la farmacocinética del cortisol circulante con las distintas pautas de tratamiento se observa que, comparadas con los límites fisiológicos de cortisol (obtenidos de controles sanos), las concentraciones de cortisol muestran en el 79, 55 y el 45% de los pacientes un sobre o infratratamiento a las 8, 16 y 24h, respectivamente. Se demostró que el régimen de administración de hidrocortisona que mejor simulaba el patrón fisiológico era el de 10mg (a las 7h30min), 5mg (a las 12h) y 5mg (a las 16h30min). Aun así, el 54, 44 y 32% de los pacientes seguían estando supra o infratratados a las 8, 16 y 24h, respectivamente (fig. 3)5.
Perfiles séricos de cortisol a lo largo del día en los pacientes con IS tratados con hidrocortisona (de vida media corta) en 2-3 dosis al día. Se obtienen picos suprafisiológicos y nadires infrafisiológicos. Fuente: Simon et al.5
Los perfiles más fisiológicos, con menos sobredosificación y mejoría de la sintomatología (sobre todo fatiga), se han obtenido con 3 dosis de hidrocortisona (10-5-5mg)28,29, considerándose el mejor tratamiento actualmente disponible.
Los pacientes tratados con hidrocortisona 3 veces al día presentan concentraciones de cortisol más elevadas que las fisiológicas al atardecer, lo que se asocia a una peor tolerancia a la glucosa y una menor sensibilidad a la insulina20,30. Estas concentraciones vespertinas de cortisol elevadas también se han asociado a la obesidad abdominal, a la aterosclerosis coronaria31, al insomnio, a la disminución de la calidad del sueño32, al síndrome metabólico y a una mayor mortalidad33. De hecho, en sujetos sanos, el insomnio se ha relacionado con un aumento de la secreción de ACTH y cortisol, sobre todo al atardecer y durante la primera mitad de la noche, con un mayor número de picos de cortisol durante el día31,34 similar a lo observado con los tratamientos sustitutivos convencionales con 3 dosis de hidrocortisona diarias.
La fatiga que refieren muchos pacientes con la enfermedad de Addison se podría relacionar con una mala calidad del sueño. Los pacientes infratratados, con valores de cortisol indetectables durante la segunda parte de la noche, tienen menos episodios Rapid Eye Movement (REM) y una mayor latencia entre las fases REM, lo que supone un sueño no reparador y fragmentado. Esto sugiere que para el inicio y el mantenimiento de los episodios REM (más importantes en la segunda parte de la noche) son necesarias unas mínimas dosis de cortisol35. En cambio, los pacientes con un tratamiento excesivo y concentraciones de cortisol elevadas por la noche pueden tener insomnio o depresión, sueño fragmentado y disminución de la fase REM31,34. En resumen, ambos extremos de la actividad del eje HPA conducen a la fragmentación del sueño y, consecuentemente, a más fatiga, siendo aconsejable alcanzar concentraciones de cortisol lo más fisiológicas posibles a lo largo de las 24h35.
Aunque en pacientes seleccionados (n=7) se ha conseguido mediante infusión intravenosa o subcutánea de hidrocortisona un perfil circadiano de cortisol cercano al fisiológico con mejoría significativa de la vitalidad y la capacidad funcional y una mejor percepción global subjetiva de la salud36, esta vía parenteral no puede ser de uso general. Por ello, disponer de un preparado oral de hidrocortisona con una liberación dual (inmediata y extendida) que simulara mejor el ritmo circadiano sería de gran utilidad para mejorar la calidad de vida y el pronóstico de estos pacientes37.
Nueva formulación de un glucocorticoide oral de liberación modificada y acción prolongadaDebido a la baja prevalencia de la IS, el bajo coste del tratamiento sustitutivo con glucocorticoides y la creencia inicial de que la evolución y las consecuencias del tratamiento eran buenas no ha existido interés para el desarrollo de nuevos productos farmacéuticos para esta enfermedad. La evidencia reciente de mayor morbimortalidad en la IS probablemente relacionada con dosis suprafisiológicas de hidrocortisona de un perfil de exposición diurno a glucocorticoides insuficientes o del tratamiento inadecuado de rescate en presencia de enfermedades intercurrentes ha propiciado el desarrollo de nuevos fármacos38.
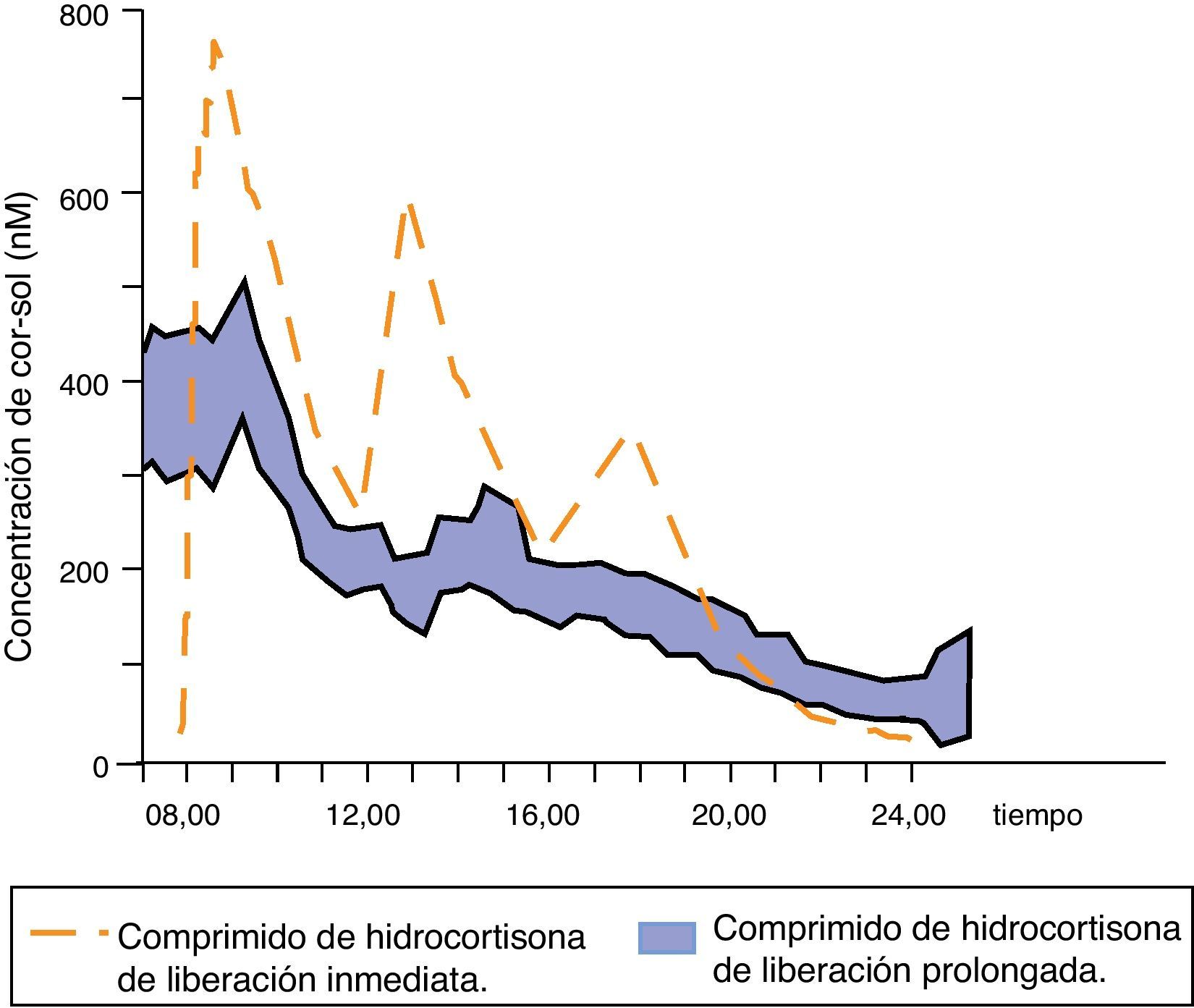
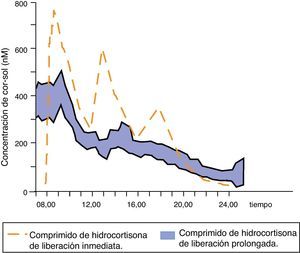
Johannsson et al. han desarrollado una nueva fórmula de hidrocortisona con una liberación modificada dual (inmediata y retardada) que permite reproducir mucho mejor el perfil fisiológico de cortisol mediante una única toma diaria del fármaco. Inicialmente se probó esta nueva formulación en sujetos sanos39, objetivándose una elevada biodisponibilidad, un perfil de cortisol sérico muy parecido al fisiológico (exceptuando el ascenso matutino) y una absorción intestinal correcta incluso con la comida, lo que condujo a ensayos clínicos. Se comparó la farmacocinética y las consecuencias metabólicas de esta nueva terapia con la de la hidrocortisona en 3 dosis al día en 64 pacientes con la enfermedad de Addison37. El perfil farmacocinético de cortisol sérico con la nueva formulación modificada fue similar al fisiológico, aunque el área bajo la curva de cortisol durante 24h se redujo; además, la concentración global de cortisol sérico a lo largo de las 24h fue un 20% inferior. Las concentraciones de cortisol se mantuvieron elevadas y estables durante las 4 primeras horas tras el fármaco y se produjo una reducción de la cortisolemia por la tarde/noche de hasta un 58% (fig. 4). Estas diferencias farmacocinéticas podrían explicar la reducción de peso corporal, tensión arterial y de hemoglobina glucosilada (incluso en pacientes diabéticos) observada en los pacientes tratados con esta formulación de liberación modificada dual.
Concentraciones séricas medias de cortisol después de la administración de una dosis de hidrocortisona de liberación prolongada en 64 pacientes con la enfermedad de Addison. Adaptado de: Johannsson et al.37.
También se observaron mejores resultados en los test de función psicológica y de bienestar y el 92% escogieron continuar con este nuevo régimen de tratamiento tras finalizar el estudio37. Estas mejorías metabólicas persistieron durante la extensión a lo largo de los 27 meses del estudio40.
Recomendación para facultativos y pacientes ante la nueva formulación disponible de hidrocortisona de liberación modificada dualUna buena educación terapéutica del paciente y la adherencia al tratamiento son puntos importantes para evitar problemas en situaciones críticas. A pesar de ello, la tasa de mortalidad por crisis adrenal incluso tras infecciones banales es preocupante. Por este motivo, la terapia sustitutiva con glucocorticoides debe proporcionar la dosis óptima y una distribución fisiológica circadiana; además, debe contemplar la mayor demanda de dosis durante procesos intercurrentes para minimizar el riesgo de crisis adrenal aguda.
Aunque durante una situación de estrés grave (cirugía mayor, infección, etc.) aumenta la secreción y la concentración de cortisol, no hay estudios que detallen las concentraciones de cortisol durante estos procesos intercurrentes. El procedimiento habitual en estos casos es doblar la dosis de hidrocortisona de cada toma. Esta práctica puede no ser suficiente debido a que la biodisponibilidad de la hidrocortisona no sigue una relación lineal con la dosis administrada, independientemente del tipo de hidrocortisona utilizada.
Un estudio prospectivo reciente en el que se documentaron alrededor de 300 episodios de enfermedad intercurrente objetivó que aumentando el número de dosis diarias de hidrocortisona de liberación modificada dual (cada 8±2h) se obtenía una relación más lineal entre la dosis administrada y la exposición al cortisol. Asimismo, observaron menos fluctuaciones y una mejor cobertura de los concentraciones de cortisol durante las 24h en comparación con doblar la dosis en una única toma diaria, minimizando así el riesgo de crisis adrenal41.
Por lo tanto, en pacientes en situaciones no graves, cuando la administración de hidrocortisona parenteral no está indicada la hidrocortisona de liberación modificada dual en 2 o 3 tomas diarias podría ser un tratamiento mejor que doblar la dosis habitual.
La educación terapéutica del paciente mediante pautas de automodificación de tratamiento, simples y seguras, debe ayudar a prevenir en la mayoría de los casos crisis adrenales agudas en pacientes con IS.
ConclusionesEl bienestar general y la calidad de vida están disminuidos en los pacientes con IS tratados con las pautas actuales de corticoides con una mayor morbimortalidad.
La mayor morbimortalidad probablemente se relaciona tanto con la sobredosificación como con la falta de hidrocortisona asociadas a picos y nadires no fisiológicos.
La disponibilidad de un nuevo fármaco con liberación modificada dual (inmediata y retardada) que requiere una sola dosis diaria mejora y simplifica el tratamiento, incrementando la adherencia y mejorando la calidad de vida, la morbilidad y posiblemente la mortalidad.
Este nuevo fármaco también es útil durante los procesos intercurrentes aunque, en vez de doblar la dosis, debe administrarse una segunda dosis pasadas unas 8±2h, con lo que se cubren las 24h minimizando el riesgo de crisis adrenal aguda.
La inexistencia de datos sobre la incidencia/prevalencia de la IS en España dificulta apreciar la magnitud del problema en nuestro país.
Conflicto de interesesLos autores son miembros del Advisory Board español de Viropharma.