El melanoma maligno colorrectal es una enfermedad infrecuente. El melanoma primario anorrectal se observa en el 0,1-4,6% de todos los tumores malignos anales. Por otro lado el melanoma metastásico en esta localización solo produce síntomas en el 4,4% de los pacientes con melanoma a otros niveles, siendo diagnosticado la mayoría de las veces post mórtem. Presentamos los casos de 2 pacientes con melanoma colorrectal. El primero de ellos muestra un paciente atendido por rectorragia en el que se diagnosticó una masa endoanal correspondiente a un melanoma y en el cual se practicó una resección abdominoperineal tras observar la positividad del ganglio centinela, discutiéndose su utilidad en este tipo de tumores. En el paciente del segundo caso se encontró una lesión polipoide en colon transverso correspondiente a una metástasis de un melanoma previamente diagnosticado. En ambas piezas histológicas la anatomía patológica fue característica con positividad para S-100, Melan-A y HMB-45.
Malignant melanoma of the colon and rectum is an infrequent disease. Primary anorectal melanoma accounts for 0.1-4.6% of all malignant neoplasms of the anal canal. Melanoma metastatic to the colon is symptomatic only in 4.4% of patients with a primary melanoma at another site and most of these tumors are diagnosed postmortem. We report two cases of colorrectal malignant melanoma. The first case concerned a patient with rectal bleeding who was diagnosed with a rectal lesion compatible with melanoma. Abdominoperineal resection was performed due to positivity of the sentinel lymph node. We discuss the utility of sentinel lymph node detection in this kind of tumor. In the second case, we discovered a polyp compatible with metastatic melanoma in the transverse colon in a patient with a previous diagnosis of melanoma. In both surgical specimens, the diagnosis of melanoma was confirmed by positivity for protein S-100, Melan-A and HMB-45.
El melanoma maligno anorrectal es una enfermedad infrecuente, observándose en menos del 1% de todos los tumores colorrectales y correspondiendo al 0,1-4,6% de los tumores malignos anales1. A pesar de ello es la tercera localización más frecuente en aparición, tras la cutánea y la ocular2.
Por otro lado, el tracto digestivo es uno de los lugares donde se producen metástasis de melanoma con mayor frecuencia. Se ha calculado que aproximadamente el 60% de los pacientes que fallecen por esta neoplasia presentan lesiones metastásicas en el tracto digestivo post mórtem3,4, si bien solo el 4,4% de estos pacientes serán diagnosticados antes de su muerte debido a la presencia de síntomas5. La metástasis de melanoma en el colon ocurre en el 22-28% del total de las metástasis digestivas en una serie de autopsias6, siendo el lugar más frecuente de asiento el intestino delgado.
Presentamos los casos de 2 pacientes con diagnóstico de melanoma maligno colorrectal, uno de ellos con origen primario anorrectal y otro en forma de una lesión polipoide en colon transverso que fue compatible con melanoma metastásico de un tumor primario desconocido.
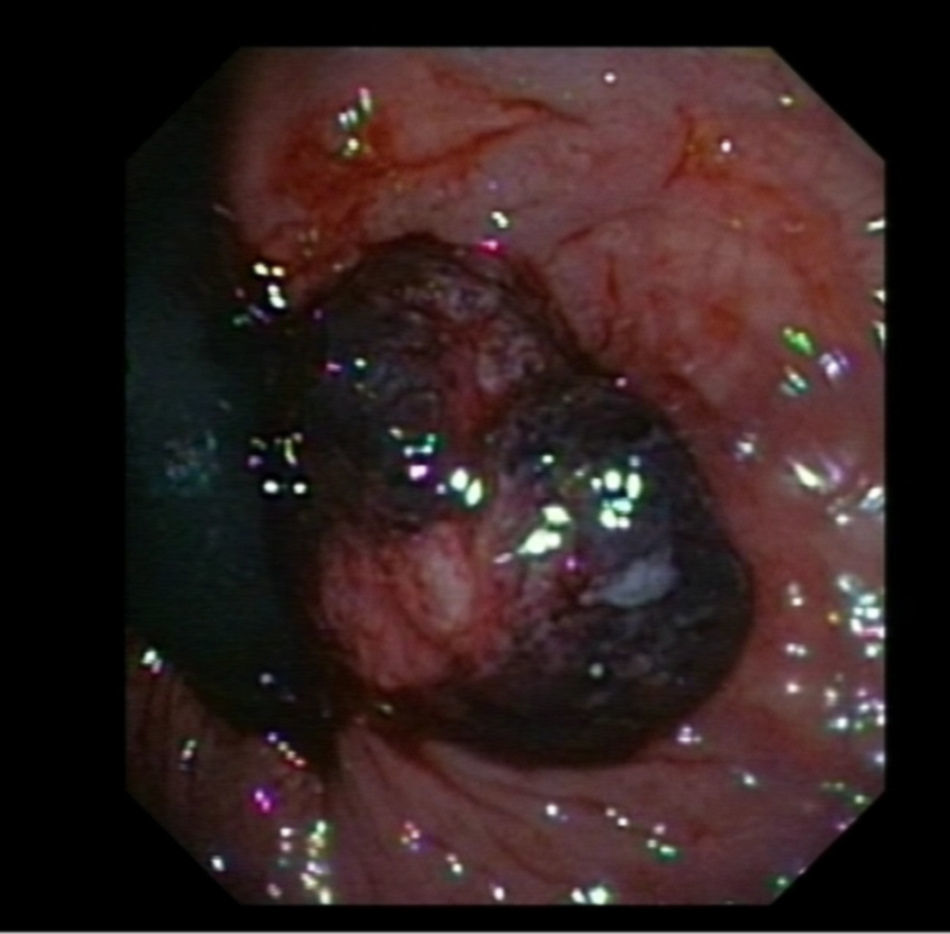
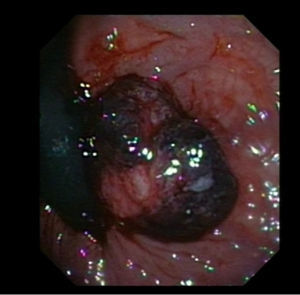
Casos clínicosCaso clínico 1Varón de 57 años que acude en septiembre de 2008 a urgencias por un cuadro de rectorragia de unas horas de evolución con estabilidad hemodinámica y analítica. En el tacto rectal se observaba una masa indurada, congestiva y violácea que protruía a través del canal anal y que era reductible manualmente. La colonoscopia reveló una masa polipoide situada en el margen interno del canal anal, muy congestiva, de unos 2cm, con estigmas de hemostasia reciente (fig. 1). El resto de la exploración hasta ciego detectó 5 pólipos hiperplásicos de pequeño tamaño. El paciente fue derivado a consultas de cirugía general donde se le realizó una resección intraanal de la lesión. La anatomía patológica de la pieza fue informada como una formación polipoide semipediculada revestida de una mucosa de coloración pardo-grisácea con zonas de erosión, constituida por una proliferación neoplásica melanocítica que crecía en grandes nidos con tendencia a fusionarse con extensa ulceración de la superficie mucosa y con infiltración en profundidad alcanzando la submucosa con un grosor de 12mm, sin invasión vascular ni perineural, estando el borde de resección libre de neoplasia pero cercana al mismo. Tras estos hallazgos se realizó un examen exhaustivo dermatológico sin encontrarse lesiones cutáneas sugerentes de melanoma primario, siendo el examen de fondo de ojo normal. La tomografía computarizada (TAC) toracoabdominal no encontró diseminación a distancia aunque la determinación del ganglio centinela fue positiva en las imágenes tardías con localización del trazador en las regiones superoexterna izquierda y derecha de la raíz del pene, realizándose marcaje de las mismas. La ecografía intrarrectal mostró una lesión con rotura de la submucosa y engrosamiento de la capa muscular y posibilidad de ganglio anterior contralateral de 6mm. Debido a estos hallazgos se procedió a la realización de una amputación abdominoperineal mesorrectal total con colostomía proximal. El estudio histológico de la pieza no encontró tumor residual en la pared rectoanal pero sí 2 adenopatías metastásicas de las 7 analizadas. Se inició posteriormente tratamiento con interferón intravenoso a dosis altas durante un año y subcutáneo a continuación a dosis de 15 millones de unidades (MU) tres veces por semana. En el momento actual y tras un seguimiento de 2 años, el paciente se encuentra vivo realizando controles periódicos.
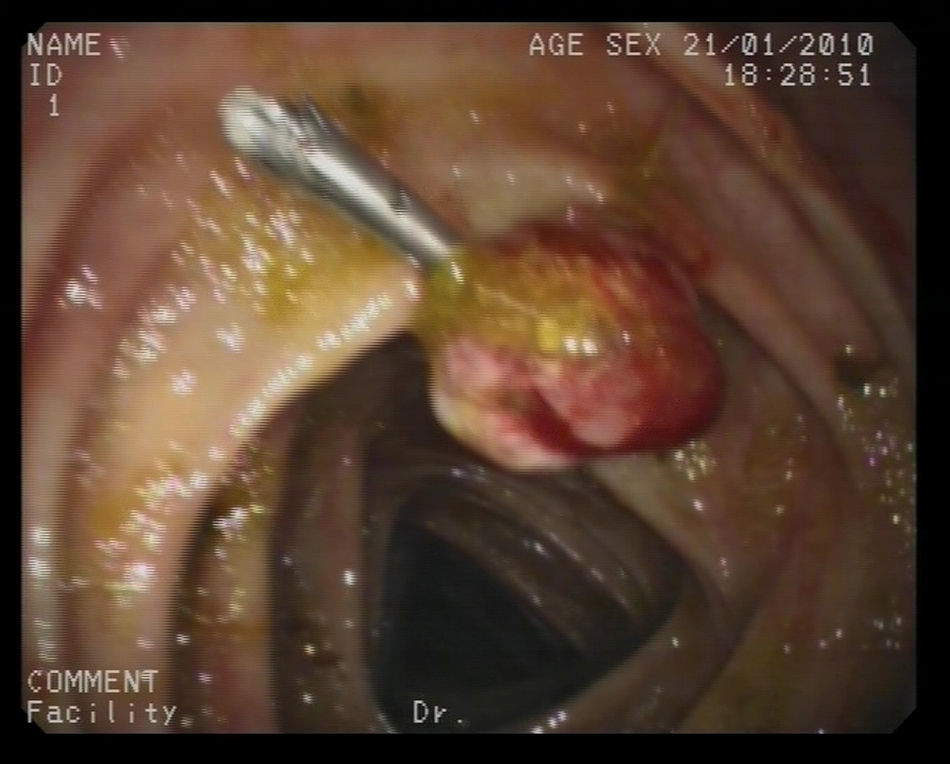
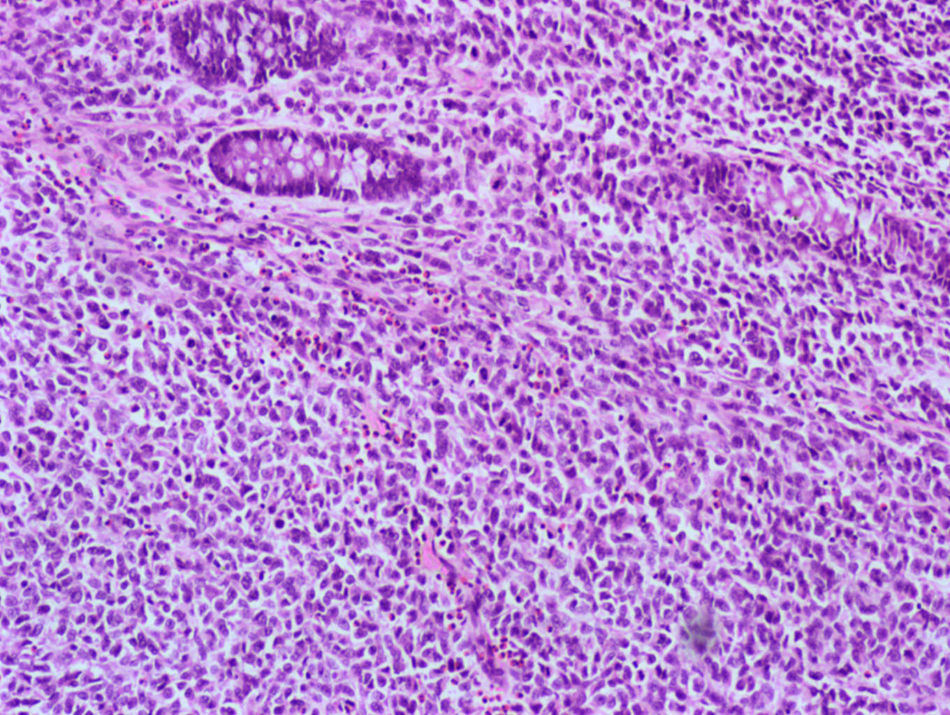
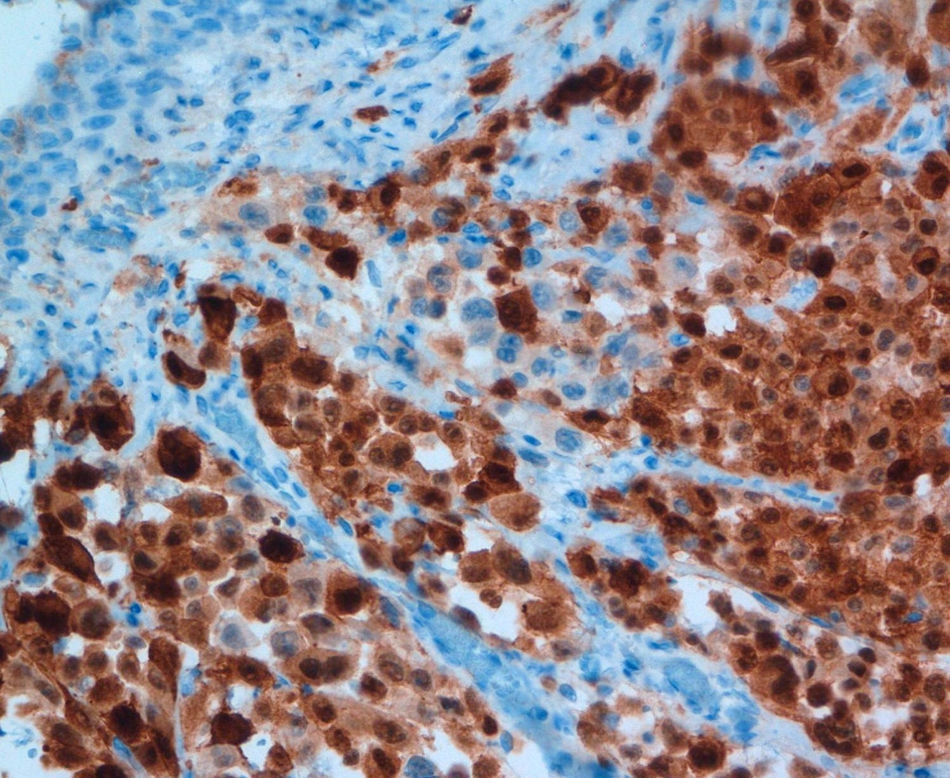
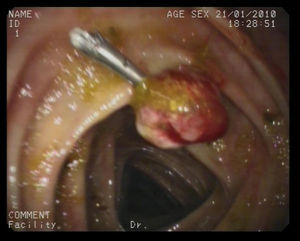
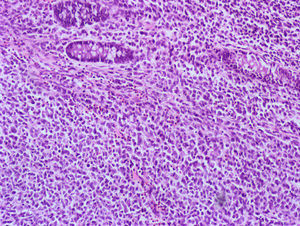
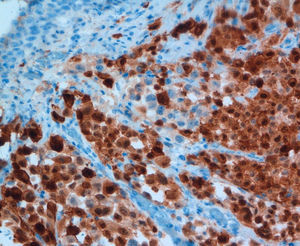
Caso clínico 2Varón de 73 años con historia de resección de tumoración sólida inguinal izquierda en 2008 compatible con metástasis de melanoma. A pesar de una exhaustiva exploración de piel y mucosas en ese momento, incluido fondo de ojo, no pudo determinarse la localización del tumor primario. El estudio de extensión fue negativo. El paciente recibió como tratamiento adyuvante a la resección quirúrgica, radioterapia e interferón alfa 2b según pauta de Kirkwood et al7, es decir, 20 MU/m2/día intravenoso durante un mes seguido de 10 MU/m2 subcutáneo tres veces por semana durante un año, finalizándose en mayo de 2009. En enero del 2010 se observó en una TAC la presencia de múltiples lesiones pulmonares compatibles con metástasis junto con un engrosamiento en sigma en contigüidad con una tumoración de la pared vesical indicativa de fístula colovesical. La cistoscopia no mostró alteraciones. Se realizó por ello una colonoscopia en la que no se encontraron orificios fistulosos, pero sí un pólipo pediculado de 1,5cm, congestivo, amelanótico, en colon transverso cerca del ángulo hepático. Se realizó polipectomía con asa de diatermia previa colocación de 2 hemoclips en la base, sin incidencias (fig. 2). El resultado histológico del pólipo fue reseñado como una neoplasia de células de núcleos grandes con moderada cantidad de citoplasma, aisladas inclusiones nucleares y sin observarse pigmento, con alto índice mitótico. En áreas focales se observaba epitelio glandular conservado con infiltración neoplásica en la lámina propia (fig. 3). El perfil inmunohistoquímico fue positivo para la proteína S-100, Melan-A y HMB-45, siendo todo ello compatible con una infiltración por melanoma (fig. 4). El paciente inició entonces una primera línea de tratamiento quimioterápico paliativo con fotemustina, desarrollando posteriormente una enfermedad metastásica diseminada al hígado, produciéndose el fallecimiento 5 meses después.
El melanoma maligno anorrectal fue descrito por primera vez en 1857 por Moore8. La incidencia exacta de este tumor es difícil de saber debido a lo poco frecuente de su presentación y la ausencia de estudios con gran número de pacientes. En este sentido, en una serie de Estados Unidos se comprobó una incidencia de 1,7 casos por millón de habitantes y año9. En el caso del melanoma anorrectal, se presupone que el tumor crece procedente de los melanocitos presentes en la zona transicional del canal anal10. Si bien el estímulo que provoca los cambios necesarios para la transformación maligna en el caso de los melanomas cutáneos es la radiación solar, sobre todo los rayos ultravioletas tipo B11, en el caso del melanoma anal las causas son desconocidas, dado que no existe virtualmente exposición solar en la región anal de forma continua. Otros factores de riesgo descritos en el caso de la variedad cutánea son el síndrome del nevo displásico o el xeroderma pigmentoso, si bien no se ha demostrado su asociación con la localización anal. En ambos casos que presentamos no existían antecedentes etiológicos que pudieran predisponer a la aparición del melanoma. Como en nuestro caso, las causas más frecuentes de presentación de esta neoplasia son la rectorragia, el dolor anal, el prurito o tenesmo, la presencia de una masa endoanal o la alteración del ritmo intestinal1. El diagnóstico se debe sospechar al observar una lesión pigmentada en el canal anal, si bien el 10-29% de estas neoplasias son amelanóticas. Histológicamente es característico el pigmento de melanina aunque es mucho más específica la inmunohistoquímica con positividad para HMB-45 y proteína S-100. En nuestros casos el resultado de la histología fue concluyente, dada la baja sospecha del diagnóstico en el estudio endoscópico.
El tratamiento no quirúrgico del melanoma anal incluye la administración de interferón, la quimioterapia y la radioterapia.
El tratamiento con interferón produciría un efecto antitumoral debido a la combinación de una actividad antitumoral directa junto con un efecto inmunoestimulador. Aunque en el melanoma anal no está bien establecido su uso debido a la ausencia de estudios, en el caso del melanoma cutáneo tiene un papel fundamental siendo uno de los tratamientos más utilizados. En 1996 Kirkwood et al7 demostraron en un ensayo clínico aleatorizado cómo la utilización de interferón a dosis altas durante un tiempo prolongado producía un incremento del intervalo libre de recurrencia y de la supervivencia global de los pacientes con resección previa del melanoma cutáneo y alto riesgo de recidiva (T4 o N1). Una revisión sistemática del uso de interferón en el melanoma cutáneo indicó un posible beneficio del mismo aunque con una tasa de efectos adversos importante12.
En cuanto a la quimioterapia, su papel en el tratamiento del melanoma anal es incierto, existiendo escasos estudios en este tipo de tumor. En el caso del melanoma cutáneo no se ha demostrado un beneficio significativo con diferentes agentes empleados13. La llamada bioquimioterapia, es decir, la combinación de un agente biológico con un agente quimioterápico convencional, ha demostrado ser beneficiosa en el melanoma cutáneo metastásico14. Basándose en estos resultados, Kim et al15 estudiaron la respuesta del melanoma anal metastásico con la bioquiomioterapia, recibiendo los pacientes tratamiento combinado con cisplatino, vinblastina, dacarbacina o temozolomida, junto a un agente biológico (interferón alfa 2b o interleucina 2). El 44% de los pacientes tuvieron una respuesta muy favorable incluyendo un 11% con respuesta completa, siendo la mediana de supervivencia de 12 meses, cuando series previas no sobrepasaban los 9 meses.
El papel de la radioterapia también ha sido estudiado en el melanoma anal con unos efectos beneficiosos. Así Moozar et al16 evaluaron la utilidad de la radioterapia con fines paliativos en una serie de pacientes con melanoma anorrectal, observando cómo los pacientes radiados tenían una supervivencia mediana de 16 meses comparada con los 5 meses de los pacientes que solo recibieron cirugía.
Respecto al tratamiento quirúrgico todavía existen controversias sobre cuál es la mejor opción en el melanoma maligno anorrectal localizado. La realización de una resección quirúrgica, bien una amputación abdominoperineal, bien una resección local amplia, han demostrado un incremento de la supervivencia, sin diferencias entre ambas técnicas aunque la resección local amplia presentó un mayor número de recidivas en una revisión sistemática reciente17. La presencia de metástasis locorregionales, que suelen estar presentes en el momento del diagnóstico, pueden ocurrir en los ganglios linfáticos inguinales o pélvicos, si bien la información de la que se dispone sobre la influencia de la afectación linfática en el melanoma anorrectal es escasa. En una de las mayores series de casos, Brady et al describieron 10 pacientes con supervivencia prolongada, 9 de ellos tras la realización de una amputación abdominoperineal y de estos solo un paciente presentaba invasión linfática en el momento de la cirugía1.
El concepto de ganglio centinela fue ya referido por Virchow en el siglo XIX aunque el concepto fisiológico del término fue propuesto y descrito por Cabanas en 1977 para el tratamiento del cáncer de pene18. Fue en 1992 cuando el término fue redefinido por Morton mejorando la técnica sobre la biopsia del ganglio centinela y el mapeo linfático en el caso del melanoma cutáneo19. Ello dio pie a intentar ampliar este conocimiento a otras neoplasias gastrointestinales, como las anales20. El concepto de ganglio centinela se define como «cualquier ganglio linfático que recibe drenaje linfático directo desde el tumor primario»21. Aunque puede haber un ganglio centinela único, frecuentemente se encuentran entre uno y 3 o más.
Aunque el concepto de ganglio centinela ha sido validado en el melanoma maligno cutáneo y el cáncer de mama, la aplicación de este concepto a otros tumores sólidos, incluidos los gastrointestinales, es todavía controvertida. Así se han realizado estudios en el caso de cáncer esofagogástrico22,23 y pancreático24. En el caso del cáncer colorrectal la detección de metástasis linfáticas va a condicionar la aplicación de tratamiento adyuvante a la cirugía. Algunos autores consideran que existe un porcentaje de infraestadificación de la invasión linfática de un 10-20% en pacientes en los que se realiza una cirugía convencional sin determinación del ganglio centinela y con métodos histológicos convencionales25.
En la actualidad hay 2 procedimientos para la detección del ganglio centinela: el método basado en radioisótopo y el método basado en tinción. En el primero de ellos se inyecta un trazador radioactivo, bien el 99mTc coloidal o el 99mTc phytate, que migra a los ganglios afectados en las primeras 2h permaneciendo allí durante más de 20h a través de la fagocitosis por parte de los macrófagos. Se administra el día anterior a la cirugía por inyección submucosa en los 4 cuadrantes de la lesión primaria. En el caso del método basado en tinción, esta se realiza directamente en la cirugía mediante inoculación directa en la subserosa del tumor y circunferencialmente alrededor del mismo con diferentes marcadores, normalmente azul de isosulfán al 1% a dosis de 1-2ml. A los 5-10min de la inoculación comienzan a teñirse de azul los primeros ganglios marcándose con un punto los 4 primeros para que los identifique el patólogo. En el caso del cáncer colorrectal, con este método se consigue la detección en el 100% de los casos26.
La evidencia sobre la detección del ganglio centinela en el caso del melanoma anorrectal es mucho menor que en el caso de otros tumores habiéndose descrito en algunas publicaciones27,28. El interés de la detección del ganglio centinela viene definido por la posibilidad de realizar una linfadenectomía completa en caso de que se detecte invasión metastásica en él. Esta determinación puede ayudar a la detección de metástasis ganglionares clínicamente inaparentes cuya extirpación puede conllevar un incremento de la supervivencia, si bien esto no ha sido evaluado por el momento en ningún estudio en el caso del melanoma anorrectal. A pesar de la escasa evidencia disponible, en nuestro caso la positividad del ganglio centinela nos hizo decantarnos por una amputación abdominoperineal con linfadenectomía completa, con un buen resultado hasta la actualidad.
Por otro lado, el melanoma es uno de los tumores que con mayor frecuencia provoca metástasis en el tracto digestivo29,30. Respecto a la localización colónica, la mayoría de estas lesiones son asintomáticas observando la presencia de síntomas tan solo en el 0,8% de los pacientes en una serie reciente, siendo fundamentalmente la hemorragia, el dolor abdominal y la obstrucción intestinal31. En nuestro caso el paciente se encontraba totalmente asintomático desde el punto de vista digestivo siendo el hallazgo del pólipo metastásico algo incidental. En un 21% de estos pacientes no se había logrado encontrar el tumor primario al igual que en el caso que presentamos. Respecto a los hallazgos endoscópicos la forma de presentación puede ser en forma de lesión polipoide normalmente amelanótica, como ocurrió en nuestro paciente, o bien como presencia de múltiples pólipos o masa simulando un cáncer colorrectal. En la serie de Tessier et al31 la localización más frecuente de las metástasis fue el colon ascendente y descendente, en posición intermedia el colon transverso y sigma y por último el ciego. En cuanto al tratamiento de estas lesiones la resección quirúrgica de las metástasis de colon aisladas conlleva una supervivencia de 58,7 meses en la mejor de las series, con mejoría de la sintomatología32, si bien otros autores consideran la extensión metastásica una contraindicación para la cirugía33. Por último, debido a la escasa evidencia en esta enfermedad y su escasa frecuencia, no es posible hacer recomendaciones sobre la implantación de la colonoscopia de cribado de lesiones metastásicas en pacientes con diagnóstico de melanoma cutáneo u ocular.
En resumen, en esta notificación intentamos mostrar 2 comportamientos diferentes de una neoplasia gastrointestinal infrecuente. Si bien las metástasis digestivas son escasamente sintomáticas, no lo son así los melanomas primarios anorrectales. El tratamiento quirúrgico ha demostrado buenos resultados en ambas manifestaciones siendo la detección y disección del ganglio centinela un prometedor avance para la individualización del tratamiento y el incremento de la supervivencia, si bien se deberá esperar a la evidencia proporcionada por estudios prospectivos adecuados de los que en este momento carecemos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.