La cápsula endoscópica (CE) es la última novedad en endoscopia gastrointestinal y la primera técnica capaz de explorar todo el intestino delgado. Recientemente se han introducido nuevos avances en este campo que incluyen la cápsula de esófago (Pillcam ESO) y la cápsula de colon (Pillcam COLON), con variaciones de la cápsula inicial y que nos permiten identificar lesiones también en estos tramos del tubo digestivo1.
En la década de los años 1980 se iniciaron los primeros estudios con CE (Gabriel Iddan, Israel 1981). Las primeras imágenes de estudios en animales fueron presentadas por el Dr. Swain en San Diego (Digestive Disease Week 2000)2. A partir de entonces, la cápsula se ha convertido en una de las principales herramientas de imagen en el estudio del intestino delgado.
El coste de esta exploración y el estado actual de nuestro sistema sanitario hacen que tengamos que definir con exactitud cuál es la utilidad real de la técnica, en que enfermedades está indicada y en qué momento de su historia natural. Esto es lo que intentaremos hacer a continuación con la máxima claridad posible.
Características técnicas de la cápsula endoscópicaGiven Imaging Ltd (Yoqneam, Israel) fue la primera entidad encargada de la fabricación de este nuevo dispositivo (videocápsula Given M2A), aprobado inicialmente per la Food and Drug Administration de EE.UU. para la evaluación de trastornos del intestino delgado en 2001. Actualmente es la cápsula más utilizada, aunque existen otros equipos disponibles de otras casas comerciales como la endocápsula de Olympus y la MiroCam (Intromedic).
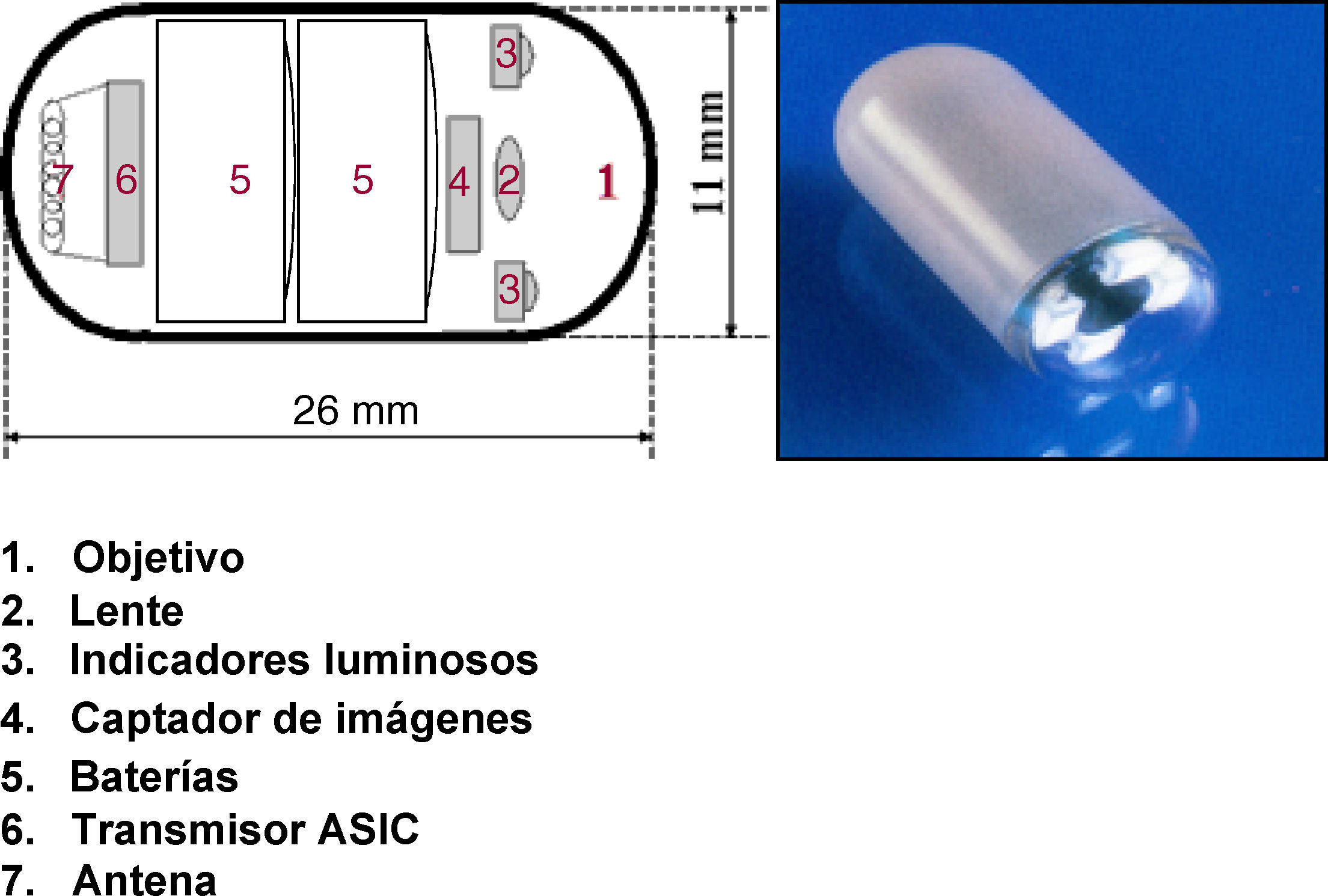
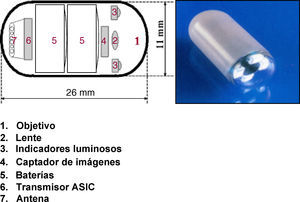
El sistema de la CE consta de una cápsula ingerible, una grabadora y una estación de trabajo donde se realiza la descarga y el análisis de las imágenes. La cápsula actual (SB2) mide 11 x 26mm, pesa alrededor de 3-4g y lleva incorporada una cámara de vídeo miniatura en color, una fuente de luz, pilas de óxido de plata y un transmisor de radiotelemetría de banda de alta frecuencia (fig. 1). A través de radiofrecuencias la cápsula transmite las imágenes a unos sensores situados en la pared abdominal del paciente, y desde aquí a una registradora o grabadora tipo Holter. La cápsula, que circula por el intestino propulsada por los movimientos peristálticos normales, realiza fotografías a una velocidad de 2 fotogramas/s y durante un tiempo aproximado de 8-9h3–5.
Desde hace unos meses existe una nueva cápsula (SB4) que realiza 4 fotografías por segundo y con una batería de mayor autonomía. Los estudios preliminares hablan de un discreto aumento de la sensibilidad de esta cápsula comparada con la SB2 en la detección de lesiones en el tubo digestivo. Captura más imágenes de cada lesión disminuyendo así el porcentaje de falsos positivos y negativos6.
Las imágenes almacenadas en la grabadora se descargan en una estación de trabajo con ayuda de un software especial (RAPID 6) y a continuación pueden visualizarse como una película, de manera continua. Este software incluye herramientas útiles en la identificación y tipificación de lesiones, como son un detector de hemorragia (marcador de píxeles rojos), la posibilidad de realizar cromoendoscopia tipo FICE y un sistema multivisión7,8.
Cápsula esofágica y cápsula de colonEn contraste con el intestino delgado, en el que la CE complementa a la exploración endoscópica, la gastroscopia y la colonoscopia siguen constituyendo las pruebas de referencia en el estudio de enfermedades esofágica y colónica.
Los dispositivos de la CE para el esófago y el colon se presentaron en el año 2004 y 2006, respectivamente. La primera podría ser una alternativa segura y sin dolor de la esofagoscopia para la vigilancia de los pacientes con esófago de Barrett (sensibilidad 60-100%)9 y adenocarcinoma de la unión gastroesofágica. No obstante, los costes y la incapacidad de tomar biopsias pueden, entre otros motivos, limitar su uso.
La cápsula de colon es útil en el diagnóstico del cáncer de colon en casos de colonoscopia contraindicada o incompleta (sensibilidad 87,5%, especificidad 75,8%, VPP 78,9% y VPN 85,4%). El alto VPN y la excelente tolerancia sugieren que podría ser evaluada en programas de cribado y en estudios de coste-eficacia10.
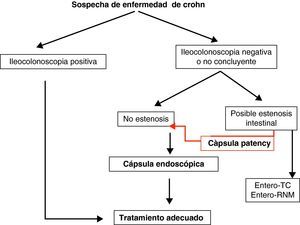
Cápsula Agile PatencyUna de las limitaciones de la CE es el riesgo de retención intestinal. Se ha estimado un riesgo de retención de la cápsula que va desde el 1,5% en general, hasta un 13% en pacientes con sospecha o enfermedad de Crohn establecida. Inicialmente, la presencia de sintomatología indicativa de oclusión intestinal contraindicaba la utilización de la CE y obligaba a la realización de alguna otra técnica de imagen para descartar la presencia de estenosis11.
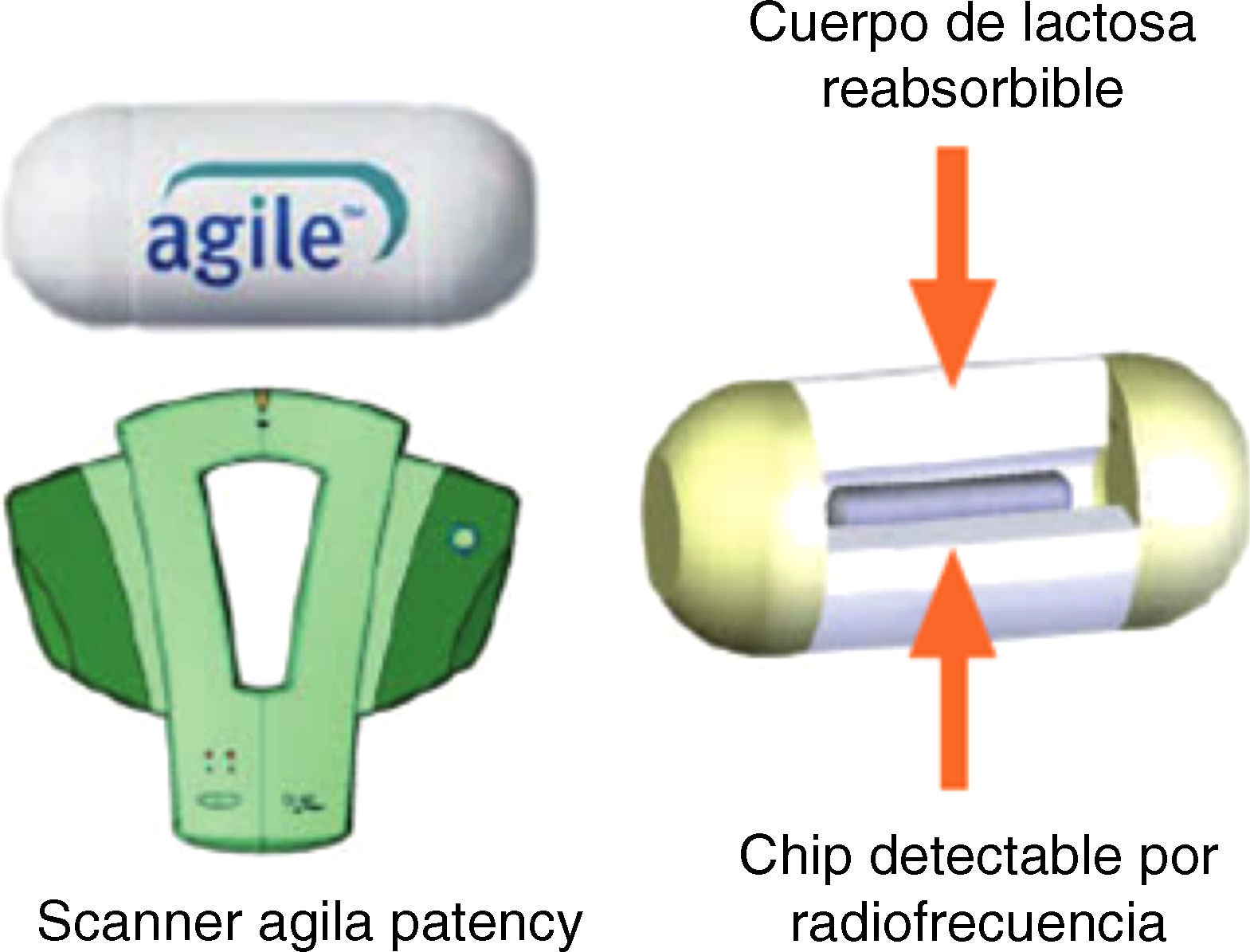
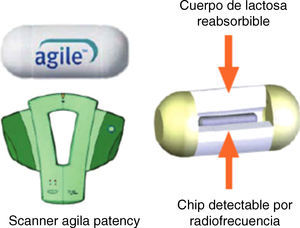
La cápsula Agile Patency es una cápsula reabsorbible que no realiza fotografías y permite constatar la permeabilidad intestinal. Tiene las mismas dimensiones que la cápsula Pillcam convencional y 2 ventanas en sus extremos por donde se inicia la desintegración (a las 30h de la ingesta) en caso de quedar retenida en una estenosis. En su interior lleva incorporado un microchip que emite señales de radiofrecuencia reconocidas per un escáner externo que nos permitirá saber si la cápsula permanece o no en el tubo digestivo en caso de no ser expulsada. En la práctica clínica la utilidad del escáner es limitada. Lo habitual es solicitar al paciente que, en los días posteriores a la ingesta de la cápsula Agile Patency la recupere de las heces y la traiga al hospital para comprobar su integridad. Si no recupera la cápsula después de 5-7 días, se realiza al paciente una radiografía de abdomen con el objetivo de comprobar su eliminación del tracto digestivo. De esta manera es posible determinar con seguridad y de manera sencilla la presencia de estenosis intestinales significativas, descartando pacientes no candidatos a una CE convencional12 (fig. 2).
Metodología de utilizaciónPreviamente a la ingesta de la cápsula, tenemos que descartar la existencia de problemas de deglución o situaciones con riesgo de retención intestinal. En caso de sospechar una estenosis intestinal se administrará la cápsula Agile Patency® antes de la CE convencional.
La presencia de gas intraluminal, residuos alimentarios y fluidos oscuros o biliosos, así como la imposibilidad de completar la visualización de todo el intestino delgado (batería insuficiente) constituyen limitaciones importantes en el estudio con cápsula.
Al inicio de la utilización de la cápsula la única preparación intestinal consistía en ayuno de 12h o bien dieta líquida las 24h previas13,14. Actualmente los estudios apoyan la realización de una preparación intestinal con solución evacuante, aunque todavía no está claro qué tipo de preparación es la mejor opción15–17. El metanálisis de Rokkas et al, publicado recientemente, concluye que los pacientes preparados con solución evacuante presentan imágenes de intestino delgado de más calidad, lo que supone una mejora en la capacidad diagnóstica de la cápsula. Hasta el momento no se ha demostrado que la preparación afecte al número de exploraciones completas, ni a los tiempos de transito gástrico e intestinal (grado de evidencia 2a y de recomendación B). Tampoco hay consenso acerca de cuál es la cantidad de solución evacuante óptima para el estudio con cápsula (1-2 l)17.
La administración de simeticona puede reducir la presencia de gas intraluminal, como constatan algunos estudios18,19 y los procinéticos parecen aumentar la probabilidad de conseguir un examen completo del intestino delgado al reducir el tiempo de tránsito gástrico20,21. La administración combinada de simeticona y metoclopramida mejora la visualización del ID y tiende a reducir el tiempo de tránsito gástrico e intestinal, aunque no de forma significativa22.
Actualmente, en la práctica habitual, la preparación consiste en la ingesta de 2 l de PEG (polietilenglicol), mejorando así la visualización de tramos distales de íleon. La administración de simeticona y metoclopramida la reservamos para casos seleccionados (pacientes encamados, con movilidad reducida, evidencia o sospecha de gastroparesia o aquellos con estudios previos no concluyentes).
Procedimiento de la cápsula endoscópicaLa exploración con CE se realiza de forma ambulatoria. Cuando el paciente llega a la consulta, se introducen sus datos en la estación de trabajo y se prepara la grabadora para el estudio. Posteriormente, se le colocan los sensores adheridos al abdomen e ingiere la cápsula. Tras 2h de la ingesta el paciente podrá tomar su medicación habitual, y a las 4h puede ingerir una comida ligera. Es conveniente que durante el día realice una actividad física moderada para facilitar el desplazamiento de la cápsula por el intestino delgado. Tras 8-9h, el paciente ha de volver al hospital, donde se le retirará la grabadora y el cinturón, y se procederá a descargar el estudio para su posterior revisión.
En las 2 semanas siguientes, se recomienda al paciente que vigile la expulsión de la cápsula y que, en caso de no identificarla, se ponga en contacto con su médico, para descartar una retención asintomática. En este caso, si no hemos constatado el paso de la cápsula al colon durante la grabación, realizaremos una radiografía de abdomen para comprobar su expulsión.
Curva de aprendizajeSi la interpretación de los estudios de CE puede parecer sencilla inicialmente en realidad se trata de un trabajo meticuloso. El ambiente de trabajo ha de ser tranquilo, evitando distracciones externas.
Al principio se recomienda una velocidad de visualización de los estudios baja (10 fotogramas/s), a pesar de que consume más tiempo, ya que un visionado a velocidad alta puede hacer pasar desapercibidas lesiones pequeñas que aparecen sólo en uno o dos fotogramas. La velocidad aumentará con la experiencia del explorador.
La duración de la revisión de los estudios varía entre diferentes exploraciones y diferentes profesionales. Inicialmente se hablaba de un tiempo medio de revisión 60min (con un rango de 28 a 93min)23, pero con las últimas actualizaciones del software se ha podido disminuir este tiempo. Un experto en cápsula tardará aproximadamente 30min en analizar un estudio de duración normal.
La tutoría de un endoscopista experto en CE, con supervisión de la lectura de las exploraciones, es la opción más aconsejable para el aprendizaje de la técnica, que puede ser complementada con la participación en cursos de CE. La curva de aprendizaje es corta siempre que el médico tenga un cierto grado de experiencia en endoscopia23,24.
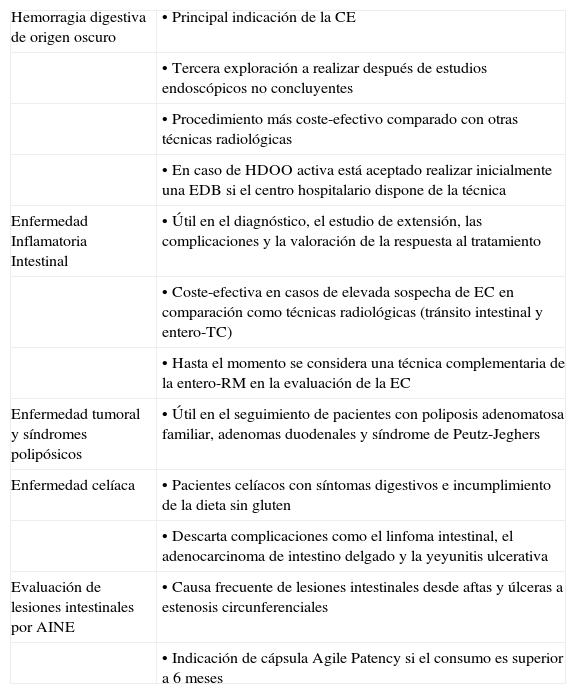
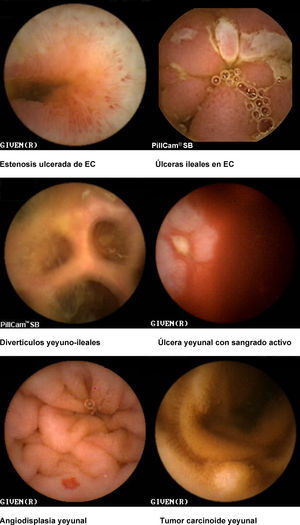
Indicaciones y contraindicaciones de la cápsula endoscópica (fig. 3)Las principales indicaciones de la utilización de la CE son las siguientes (tabla 1):
- –
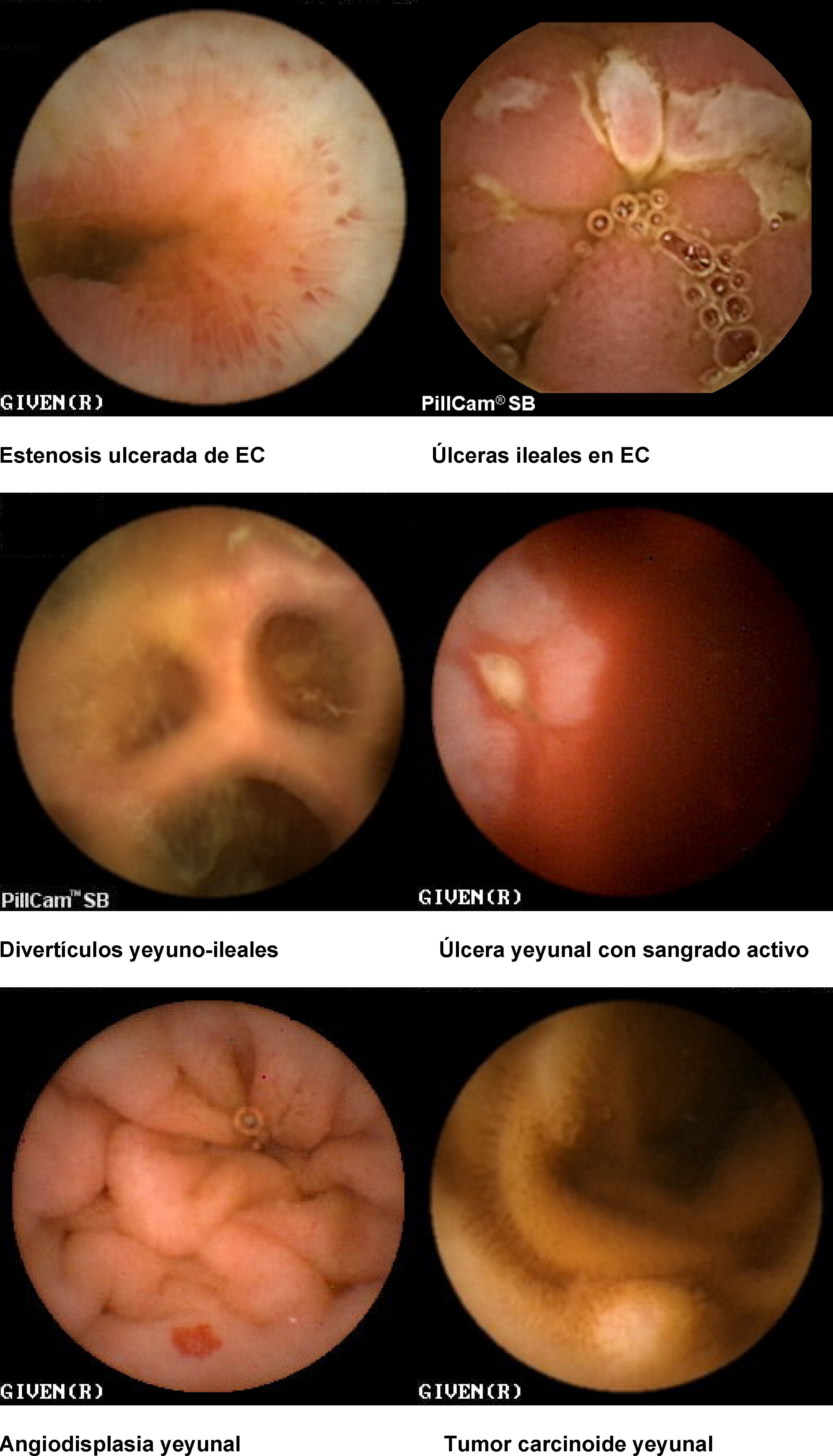
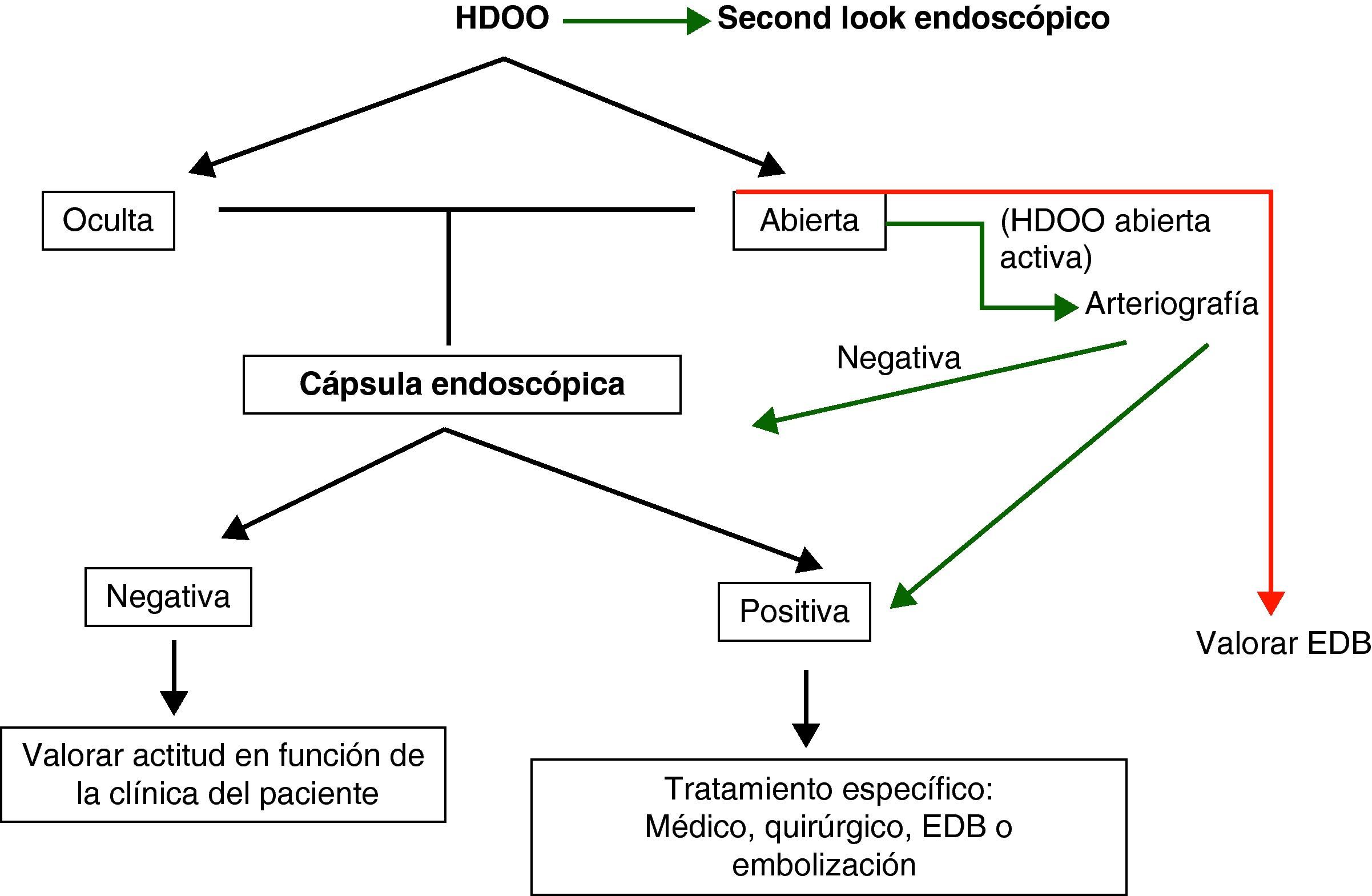
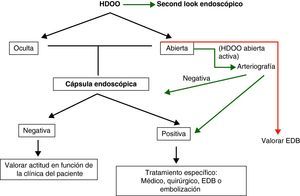
Hemorragia digestiva de origen oscuro (HDOO) (tabla 2). La HDOO es la principal indicación de la CE32 después de la realización de una o dos endoscopias alta y baja no concluyentes (importancia del second look endoscópico) (grado de evidencia 2b y de recomendación B)25.
Tabla 2.Principales estudios en enfermedad de Crohn
CE vs TI Triester SL, 2006 {71% CE vs 36% TI Sospecha dx Dionisio PM, 2010 64% CE vs 24% TI EC CE vs entero-TC Solem, 2008Eliakim R, 2004Hara AK, 2006Voderholzer WA, 2005 70% CE vs 31% entero-TC (global 4 estudios) CE vs entero-RM Albert JG, 2005Crook DM, 2009Tillack C, 2008Golder SK, 2006 {50% CE vs 43% RMN global 70% CE vs 79% RMN EC (global 4 estudios) CE vs EP Toth E, 2005Chong AK, 2005 50% CE vs 8% EP (global 2 estudios)
Principales indicaciones de la cápsula endoscópica
| Hemorragia digestiva de origen oscuro | • Principal indicación de la CE |
| • Tercera exploración a realizar después de estudios endoscópicos no concluyentes | |
| • Procedimiento más coste-efectivo comparado con otras técnicas radiológicas | |
| • En caso de HDOO activa está aceptado realizar inicialmente una EDB si el centro hospitalario dispone de la técnica | |
| Enfermedad Inflamatoria Intestinal | • Útil en el diagnóstico, el estudio de extensión, las complicaciones y la valoración de la respuesta al tratamiento |
| • Coste-efectiva en casos de elevada sospecha de EC en comparación como técnicas radiológicas (tránsito intestinal y entero-TC) | |
| • Hasta el momento se considera una técnica complementaria de la entero-RM en la evaluación de la EC | |
| Enfermedad tumoral y síndromes polipósicos | • Útil en el seguimiento de pacientes con poliposis adenomatosa familiar, adenomas duodenales y síndrome de Peutz-Jeghers |
| Enfermedad celíaca | • Pacientes celíacos con síntomas digestivos e incumplimiento de la dieta sin gluten |
| • Descarta complicaciones como el linfoma intestinal, el adenocarcinoma de intestino delgado y la yeyunitis ulcerativa | |
| Evaluación de lesiones intestinales por AINE | • Causa frecuente de lesiones intestinales desde aftas y úlceras a estenosis circunferenciales |
| • Indicación de cápsula Agile Patency si el consumo es superior a 6 meses |
La cápsula se considera la primera exploración a realizar en el estudio del intestino delgado en pacientes con HDOO26–28 seguida de una enteroscopia de pulsión, doble balón o intraoperatoria como procedimientos terapéuticos complementarios.
En la HDOO activa, la CE debería ser administrada dentro de las primeras 48h del episodio ya que su rendimiento aumentará de forma significativa29–32.
Una cápsula negativa está asociada con una baja tasa de recidiva hemorrágica a largo plazo33. Si la hemorragia recidiva tendríamos que repetir la cápsula, las exploraciones endoscópicas o valorar realizar otras exploraciones más agresivas para el paciente como una EDB o una enteroscopia intraoperatoria.
- –
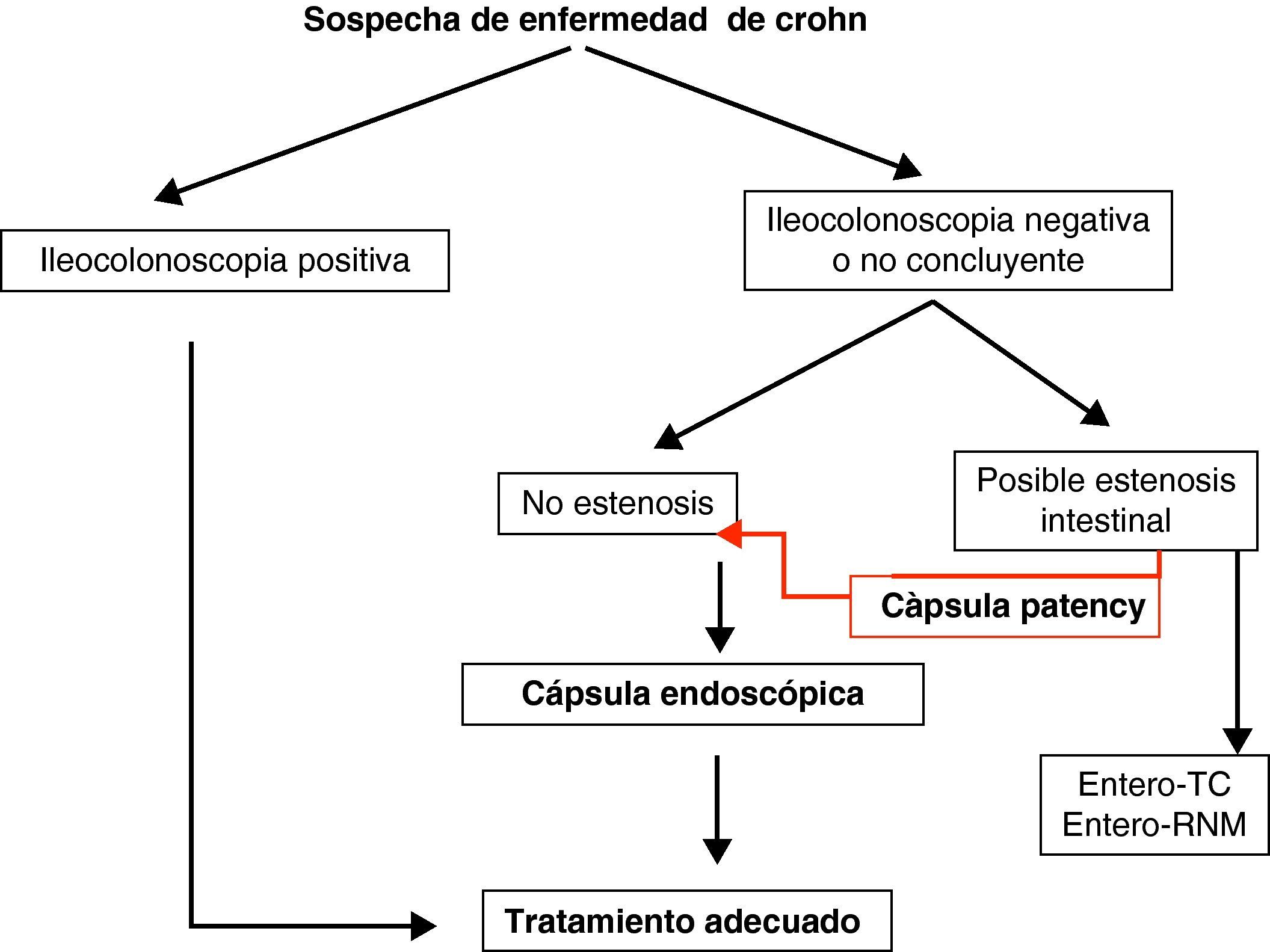
Enfermedad inflamatoria intestinal: enfermedad de Crohn (EC) y colitis indeterminada (CI). Las principales indicaciones de la CE en la enfermedad inflamatoria intestinal se centran en el diagnóstico, el estudio de extensión, las complicaciones y la valoración de la respuesta al tratamiento34–36.
La CE ha demostrado ser una técnica muy sensible en la detección de lesiones mucosas en intestino delgado37 (Grado de evidencia 3a y recomendación B)7 y su sensibilidad aumenta cuando la sospecha de EC está basada no sólo en síntomas digestivos inespecíficos, sino también combinados con parámetros analíticos y manifestaciones extraintestinales.
En la EC ya diagnosticada la CE nos ayudará a valorar la actividad de la enfermedad. En el estudio de Rutgeerts et al únicamente el 67% de los pacientes en tratamiento con infliximab y remisión sintomática presentaban curación mucosa38,39. Por tanto, cada vez es más importante la detección de lesiones en intestino delgado, ya que el objetivo principal del tratamiento es la curación mucosa, y la técnica más sensible es, sin duda, la CE.
En lo que se refiere a la colitis indeterminada, hasta un 10% de pacientes con enfermedad inflamatoria intestinal están diagnosticados de CI40. En estos casos, la CE es una herramienta útil que permite detectar lesiones en intestino delgado hasta en el 40% de estos pacientes41.
- –
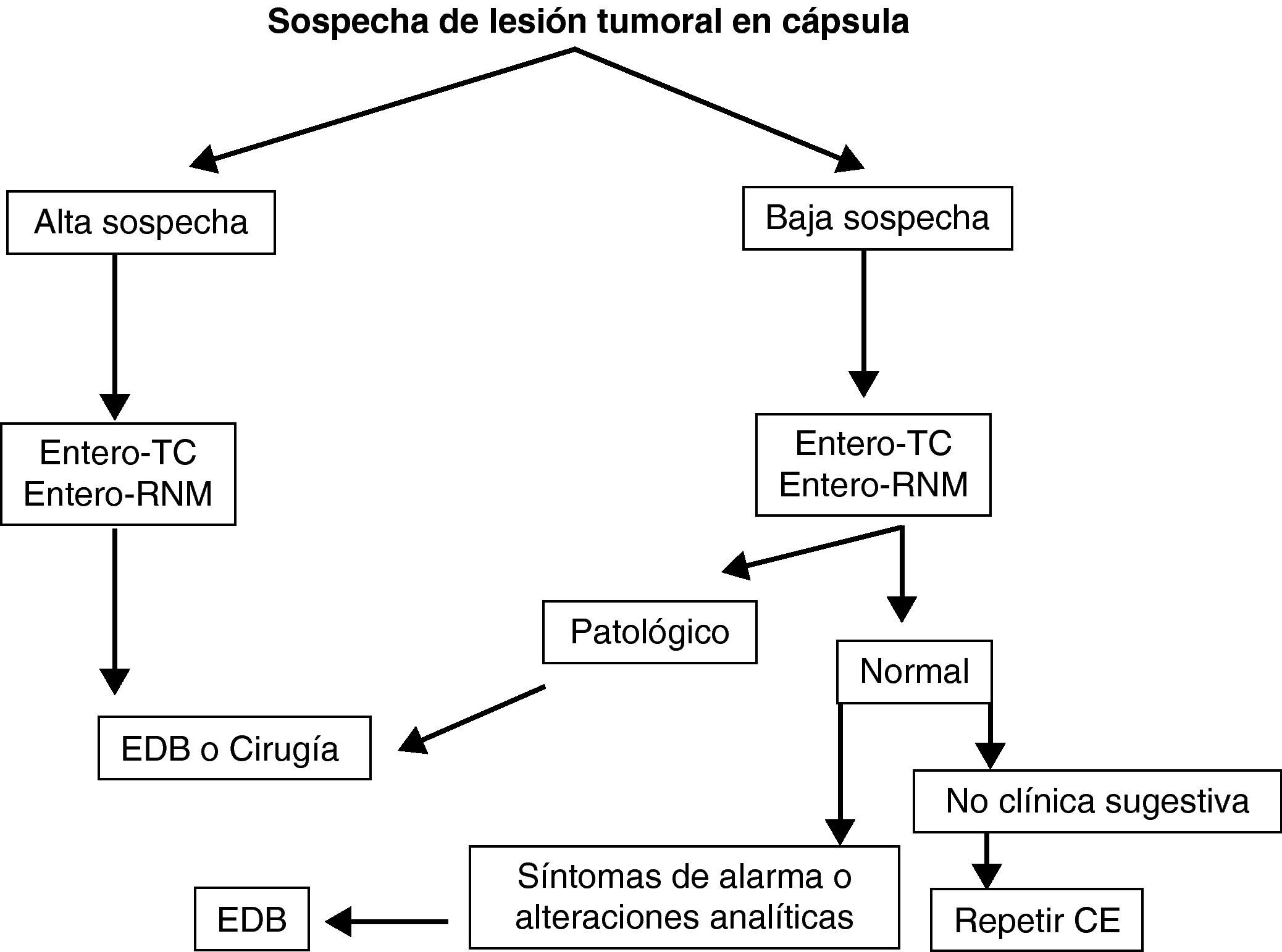
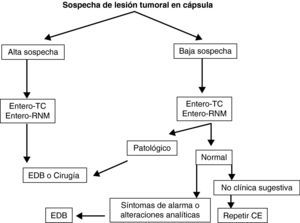
Seguimiento de síndromes polipósicos y enfermedad tumoral de intestino delgado. La CE es útil en el seguimiento de pacientes con poliposis adenomatosa familiar, adenomas duodenales avanzados o síndrome de Peutz-Jeghers42–44 (grado de evidencia 2b y de recomendación B)7.
- –
Seguimiento de enfermedad celíaca. La base del diagnóstico de celiaquía siguen siendo el estudio serológico y la biopsia duodenal, pero en el seguimiento de pacientes con enfermedad celíaca complicada la CE es la exploración no invasiva más sensible45 (grado de evidencia 2b y de recomendación B)7. Las posibles complicaciones a descartar incluyen el linfoma intestinal, el adenocarcinoma o la yeyunitis ulcerativa.
- –
Evaluación de lesiones intestinales por AINE. El tratamiento crónico con AINE (COX1 y COX 2) puede provocar lesiones en la mucosa de intestino delgado que van desde simple eritema hasta úlceras circunferenciales y estenosantes, constituyendo una causa frecuente de anemia y hemorragia intestinal. En estos pacientes no es infrecuente la retención intestinal de la cápsula, por lo que está indicada la realización de la cápsula Agile Patency de forma inicial si el tiempo de consumo de antiinflamatorios es superior a 6 meses13,46.
- –
Otras indicaciones menos frecuentes. Síndromes de malabsorción. Trasplante de intestino delgado. Enfermedad injerto contra huésped. Estudios de motilidad intestinal47.
La retención de la CE es la complicación más frecuente. Se define como la presencia de la CE en intestino delgado durante más de 2 semanas y ocurre aproximadamente en una de cada 100-150 exploraciones (0,75-1%) en general y hasta un 13% en pacientes con EC48. En estos casos la conducta a seguir pasa por una actitud expectante hasta su expulsión espontánea en pacientes asintomáticos, o la extracción diferida o urgente mediante una EDB o quirúrgica.
Son contraindicaciones absolutas para la administración de la CE49:
- –
Estenosis conocida del tracto gastrointestinal.
- –
Retención de la cápsula Agile Patency o su expulsión deformada: la cápsula reabsorbible se administra unos días antes de la CE convencional en casos de sospecha o riesgo de estenosis (EC, consumo crónico de AINE, dolor abdominal, estenosis radiológica conocida) (tabla 3)50.
- –
Embarazo.
Son contraindicaciones relativas:
- –
Dispositivos cardíacos implantables (marcapasos, desfibriladores)51. La CE es segura en pacientes con marcapasos, pero los pacientes portadores de desfibriladores deberían ser controlados con monitorización intrahospitalaria.
- –
Problemas de deglución como una disfagia orofaríngea o un divertículo de Zenker. En estos casos se pude introducir la CEmente, con un dispositivo acoplado al endoscopio que sujeta la cápsula y la libera en el punto deseado52.
En los últimos 100 años, las técnicas radiológicas eran el principal método de estudio del intestino delgado, hecho que cambió radicalmente con la aparición de la CE en el año 2001.
A continuación se muestran los principales estudios en relación a las 2 indicaciones principales de la cápsula, que son la hemorragia digestiva de origen oscuro (HDOO) y la enfermedad de Crohn (EC) (tablas 2 y 4).
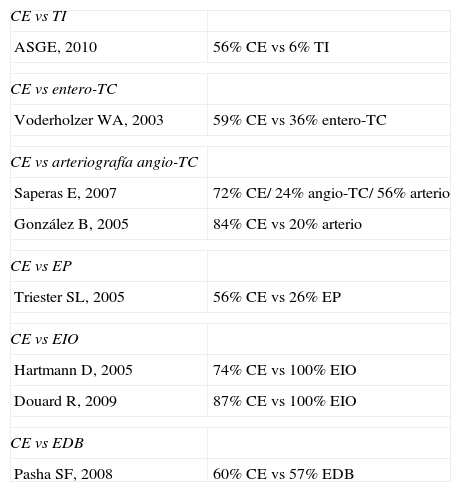
Principales estudios en la hemorragia digestiva de origen oscuro
| CE vs TI | |
| ASGE, 2010 | 56% CE vs 6% TI |
| CE vs entero-TC | |
| Voderholzer WA, 2003 | 59% CE vs 36% entero-TC |
| CE vs arteriografía angio-TC | |
| Saperas E, 2007 | 72% CE/ 24% angio-TC/ 56% arterio |
| González B, 2005 | 84% CE vs 20% arterio |
| CE vs EP | |
| Triester SL, 2005 | 56% CE vs 26% EP |
| CE vs EIO | |
| Hartmann D, 2005 | 74% CE vs 100% EIO |
| Douard R, 2009 | 87% CE vs 100% EIO |
| CE vs EDB | |
| Pasha SF, 2008 | 60% CE vs 57% EDB |
Referente a la EC, disponemos de 2 metanálisis recientes que confirman un rendimiento diagnóstico global muy superior de la CE en relación al TI, en pacientes con sospecha de EC y EC establecida (71 vs 36% del tránsito intestinal y 64 vs 24%, respectivamente (p<0,0001)53,54.
En el estudio de la HDOO, el tránsito intestinal tiene un rendimiento diagnóstico muy bajo comparado con la CE (6 vs 56%) 28.
Por tanto, actualmente no está indicada la realización de un tránsito intestinal ni en la EC ni en el estudio de la HDOO, dada la presencia de otras técnicas más coste-efectivas.
Cápsula endoscópica y enterotomografía computarizadaCuatro estudios comparan la CE con esta técnica, obteniendo una capacidad diagnóstica del 70% a favor de la CE respecto un 31% del entero-TC54. La ventaja del entero-TC es que permite la identificación de complicaciones extraluminales de la EC, como la presencia de fístulas o abscesos.
En cuanto a la HDOO, la evidencia científica es escasa. Únicamente el estudio de Voderholzer et al55 pone de manifiesto un rendimiento diagnóstico de la CE del 59% respecte un 36% del entero-TC (p=0,12).
Cápsula endoscópica y enterorresonancia magnéticaLa entero-RM es, junto con la entero-TC, una nueva técnica radiológica útil en el estudio del intestino delgado.
En el metanálisis de Dionisio et al54 se observa un rendimiento diagnóstico global similar entre las 2 técnicas (50% CE y 43% RM). Analizando el subgrupo de pacientes con EC ya conocida, el rendimiento es superior con la RM (70% CE y 79% RM; p=0,65).
La principal diferencia entre estas técnicas es que la cápsula detecta lesiones mucosas muy sutiles, difíciles de ver para la RM, pero ésta aporta información adicional tanto mural como extramural. Por tanto, parece que ambas técnicas son complementarias, y utilizadas conjuntamente podrían caracterizar mejor la patología de intestino delgado.
Cápsula endoscópica y arteriografía/angio-TCLos estudios actuales demuestran una clara superioridad diagnóstica de la cápsula comparado con el angio-TC y la arteriografía en el estudio de la hemorragia digestiva de origen oscuro56,57. La utilidad de esta última se centra fundamentalmente en la HDOO abierta activa de débito alto con el objetivo de realizar una embolización terapéutica.
Cápsula endoscópica y enteroscopia de pulsiónEn el campo de la hemorragia, el metanálisis de Triester et al demuestra una superioridad diagnóstica de la CE en la identificación de lesiones clínicamente significativas (56%) respecte a la EP (26%)58.
En la enfermedad inflamatoria, disponemos de 2 estudios comparativos donde se pone de manifiesto que la CE fue diagnóstica en un 50% de los casos (pacientes con sospecha de EC y EC ya diagnosticada) comparado con un 8% en la EP54.
Cápsula endoscópica y enteroscopia intraoperatoriaLa enteroscopia intraoperatoria (EIO) era considerada como la técnica de referencia en el estudio del intestino delgado, con una elevada capacidad diagnóstica (70-100%), pero con el gran inconveniente de su gran invasividad.
Actualmente la EIO se reserva para casos de HDOO masiva o pacientes con lesiones diagnosticadas por cápsula no accesibles a las técnicas actuales de enteroscopia.
Cápsula endoscópica y enteroscopia de balónExisten 2 sistemas de enteroscopia de balón: la enteroscopia de doble balón (EDB) y la enteroscopia de simple balón (ESB), introducida más recientemente. Hasta el momento no se han encontrado diferencias significativas en la capacidad diagnóstica de las 2 técnicas en el estudio de la enfermedad de intestino delgado59.
En el metanálisis publicado recientemente de Pasha et al que incluye 11 estudios que comparan el rendimiento diagnóstico de la CE y la EDB en 375 pacientes con enfermedad de intestino delgado (mayoritariamente HDOO), se observaron resultados comparables para las 2 técnicas (60 vs 57%, respectivamente), similar en la detección de lesiones vasculares, inflamatorias y neoplásicas60.
Un hecho destacable es la utilidad de realizar la CE previa a la EDB en pacientes con HDOO, dado que aumenta tanto el rendimiento diagnóstico (73-93%) como el terapéutico (57-73%), y nos ayudará a definir la vía de abordaje del intestino delgado en caso de EDB y en función de la localización de las lesiones. Por otro lado, permitirá evitar la EDB en pacientes con baja probabilidad de tener lesiones en intestino delgado28.
Número de exploraciones necesarias por la obtención de la máxima rentabilidadHasta el momento no existen estudios definitivos que sugieran cuál es el número de exploraciones de CE necesarias para que el explorador obtenga el máximo rendimiento.
En las reuniones de expertos realizadas en los últimos años, se ha consensuado de forma subjetiva y, basándose en su experiencia personal, que el mínimo de exploraciones necesarias para considerar un explorador apto para analizar correctamente las imágenes de la CE es de 50. Hasta completar esta cifra, se recomienda que el explorador esté supervisado por un experto con el objetivo de obtener el máximo rendimiento diagnóstico de la exploración.
Análisis de costesHemorragia digestiva de origen oscuro (HDOO)Aunque la CE permite la visualización de todo el intestino delgado, es un procedimiento diagnóstico que no permite actitudes terapéuticas, y por eso se han realizado múltiples estudios en los últimos años para estimar la coste-efectividad de la CE comparada con otras técnicas diagnósticas y terapéuticas, principalmente en el estudio de la HDOO.
Desde el punto de vista de la eficacia diagnóstica en pacientes con hemorragia digestiva oscura, se ha demostrado que la CE es un procedimiento coste- efectivo comparado con otras técnicas utilizadas7,61.
Desde la aparición de la EDB se intenta dilucidar cuál de las 2 estrategias es más coste-efectiva y cuál se ha de realizar inicialmente en pacientes con HDOO. Hay estudios que defienden la realización inicial de una EDB, como estrategia coste-efectiva a corto plazo, debido a la realización de menos exploraciones endoscópicas. De todas maneras, a largo plazo, la realización inicial de la CE y después la EDB dirigida según los hallazgos de la primera podría estar asociado a mejores resultados62,63.
Recientemente, Albert et al64 compararon la coste-eficacia de 2 estrategias basadas en la realización inicial de la CE o la EDB. El coste de personal, el número de procedimientos realizados (CE y EDB) y la probabilidad de necesitar una enteroscopia terapéutica influyen sustancialmente en el coste final del procedimiento. El coste aumenta cuando se sospecha que el tiempo de la exploración se puede alargar, por ejemplo, cuando se requiere una EDB bidireccional (vía oral y anal). Si existe una gran probabilidad (> 25%) de requerir una enteroscopia terapéutica (por ejemplo, hemorragia digestiva activa), la realización inicial de la EDB parece ser la estrategia más coste-efectiva; en los otros casos, la realización inicial de la CE minimizaría los costes.
En resumen, podemos decir que en el estudio de los pacientes con hemorragia digestiva de origen oscuro, la estrategia inicial con CE es coste-efectiva, excepto en aquellos casos de pacientes con HDOO activa que puedan ser tratados de forma urgente y en centros que dispongan de EDB. En estos casos, la realización de una EDB como primera opción sería la mejor estrategia a seguir.
Enfermedad de CrohnEn el estudio de la enfermedad de Crohn también se han realizado análisis de costes en los últimos años, con diferentes conclusiones.
Leighton et al65 analizaron el impacto económico de la CE en el diagnóstico y tratamiento de la enfermedad de Crohn, comparando la realización de la CE y el tránsito intestinal después de la ileocolonoscopia. Concluyen que la CE es una herramienta valiosa y coste-efectiva en el diagnóstico y manejo de pacientes con sospecha de enfermedad de Crohn, ya que sus hallazgos permiten realizar un diagnóstico y tratamiento más precoces, con el consiguiente impacto clínico.
Por otro lado, Levesque et al66 analizaron la coste-efectividad de la CE en el diagnóstico de la enfermedad de Crohn de intestino delgado, como tercera exploración a realizar, después de la ileocolonoscopia y la enterografía por TC o el tránsito intestinal. Según los cálculos realizados en este análisis, la posibilidad de que un paciente con hallazgos positivos positivos en la CE tenga realmente una enfermedad de Crohn varía entre el 6 y el 44%, dependiendo de si la sospecha es alta o baja. Por eso, concluyen que la CE no es un procedimiento coste-efectivo.
Los datos disponibles hasta el momento son muy contradictorios en los estudios coste-efectividad de la CE, aunque probablemente se trate de una exploración coste-efectiva fundamentalmente en aquel subgrupo de pacientes con alta sospecha diagnóstica de la enfermedad.
En la práctica clínica habitual realizamos una CE a aquellos pacientes con alta sospecha de EC e ileocolonoscopia negativa, siempre que no existan contraindicaciones.
ConclusiónLa exploración con CE ha cambiado el algoritmo diagnóstico en los pacientes con sospecha de enfermedad de intestino delgado, disminuyendo de manera importante el coste sanitario y permitiendo realizar diagnósticos más precoces. Así, las técnicas radiológicas convencionales como el tránsito intestinal y la enteroclisis se consideran actualmente obsoletas. En cambio, el entero-TC y la entero-RM tienen la ventaja de identificar no únicamente lesiones mucosas sino también enfermedad extraintestinal, imponiéndose como técnicas de primera línea en la investigación de complicaciones de la enfermedad inflamatoria intestinal y de segunda línea en la sospecha de la enfermedad de Crohn o hemorragia de origen oscuro.
Teniendo en cuenta lo mencionado previamente en este documento, y de manera práctica, podemos establecer unos algoritmos diagnósticos a seguir en las enfermedades más frecuentes de intestino delgado y definir cuál es el posicionamiento de la CE en cada caso (figs. 4–6).
En un futuro próximo, con el avance de la endoscopia capsular se conseguirá aumentar la eficacia y la capacidad diagnóstica de estos sistemas, así como intentar realizar maniobras terapéuticas. Las baterías recargables desde el exterior evitarán los problemas de duración de éstas, y la miniaturización de los componentes de la cápsula liberará espacios para diferentes necesidades clínicas y para la realización de biopsias o la liberación de fármacos.