La terapia triple, que continúa siendo el estándar en España para el tratamiento de la infección por Helicobacter pylori (H. pylori), no se debería emplear cuando su eficacia es inferior al 80% o las tasas de resistencia a claritromicina son superiores al 15-20%.
ObjetivoEvaluar la evidencia disponible en adultos acerca de la eficacia de la terapia triple y las tasas de resistencia a claritromicina en nuestro medio durante los últimos 6 años.
MétodosBúsqueda bibliográfica (2007-2012) utilizando los términos «Helicobacter pylori», «España» y «claritromicina» en Medline y en los resúmenes de diversos congresos nacionales de gastroenterología y microbiología. Fueron incluidos todos los estudios en los que se utilizó un tratamiento de primera línea compuesto por un inhibidor de la bomba de protones, amoxicilina y claritromicina, así como aquellos en los que se estudió la susceptibilidad in vitro de H. pylori a claritromicina en pacientes no tratados previamente.
ResultadosRespecto a la terapia triple, se identificaron 5 artículos y 9 resúmenes (3.147 pacientes), con una tasa media de erradicación del 70,8% (IC 95% = 66-76%). Estratificados por duración del tratamiento, la eficacia media fue 68,8% (60-76%) para 7 días de tratamiento y 71,8% (68-78%) para 10 días. En relación con la tasa de resistencia a claritromicina, se identificaron 4 artículos y 5 resúmenes (1.709 pacientes) con una tasa media de resistencia del 18,3% (13-22%).
ConclusionesLa eficacia de la terapia triple parece subóptima en los estudios españoles más recientes, debido probablemente a tasas de resistencia a claritromicina superiores a las previamente descritas.
Triple therapy, which remains the standard treatment for Helicobacter pylori infection, should be discouraged when its efficacy is lower than 80% or when clarithromycin resistance rates are above 15-20%.
AimTo update the available evidence on the effectiveness of triple therapy and clarithromycin resistance rates in adults in Spain over the last 6 years.
MethodsA literature search (2007-2012) was conducted in Medline and the abstracts books of the annual meetings of several Spanish gastroenterological and microbiological congresses. The search terms were «Helicobacter pylori», «Spain» and «clarithromycin». Studies were selected if they included triple therapy consisting of a proton pump inhibitor with clarithromycin and amoxicillin or if they analyzed H. pylori clarithromycin susceptibility in treatment-naïve patients.
ResultsThere were five articles and nine abstracts (3147 patients) on triple therapy, which showed a mean cure rate of 70.8% (95% CI = 66-76%). When stratified by the duration of therapy, the mean cure rates were 68.8% (60-76%) for 7-day regimens and 71.76% (68-78%) for 10-day regimens. For clarithromycin resistance rates, four articles and five abstracts (1709 patients) revealed a mean resistance rate of 18.3% (13-22%).
ConclusionsThe efficacy of triple therapy seems to be unacceptable in recent studies conducted in Spain, possibly associated with clarithromcyin resistance rates higher than previously reported.
La terapia triple, constituida por un inhibidor de la bomba de protones (IBP) junto a 2 antibióticos, habitualmente amoxicilina y claritromicina, es el tratamiento de primera línea más utilizado para la infección por Helicobacter pylori (H. pylori) en la actualidad. La pauta terapéutica inicial recomendada en las primeras reuniones de consenso a nivel europeo1 (1997) y español2,3 (1999-2004) era de 7 días, estableciéndose por consenso que la eficacia mínima por intención de tratar (IT) de cualquier tratamiento erradicador de primera línea debería ser al menos del 80%1.
En 2007, se publican simultáneamente las recomendaciones de consenso en Europa4 y Estados Unidos5; en ambas se alertaba acerca de un descenso progresivo de las tasas de eficacia de la terapia triple, hasta cifras inaceptables (70-85%), en relación con un aumento en las tasas de resistencia de H. pylori a claritromicina. En Europa, se mantenía la terapia triple como el tratamiento de elección, con una duración recomendada de 10-14 días, pudiendo utilizarse durante 7 días en aquellas zonas donde se mantiene su eficacia. Igualmente, se establecía un punto de corte en las tasas de resistencia a claritromicina (15-20%), a partir del cual se desaconsejaba el uso de cualquier terapia triple, recomendándose en estos casos una combinación cuádruple con bismuto (IBP, bismuto, tetraciclina y metronidazol) durante 10 a 14 días4. En las guías americanas, se sugería una duración de la terapia triple de 10-14 días y se recomendaban como alternativas de primera línea la terapia cuádruple clásica con bismuto durante 10 a 14 días o bien la terapia cuádruple sin bismuto, durante 10 días, administrada de manera secuencial5.
En el año 2012, se publican las conclusiones de la tercera reunión de consenso del grupo Europeo para el estudio de H. pylori6. En ellas, se recomienda abandonar el uso de la terapia triple clásica en áreas geográficas con una tasa de resistencia a claritromicina igual o superior al 15-20% y se propone la terapia cuádruple con bismuto como alternativa en zonas con tasas bajas de resistencia a claritromicina y como terapia de elección en las zonas con resistencias > 15-20%. Un estudio multicéntrico europeo recientemente publicado7, que incluyó a 2.204 pacientes adultos, ha evidenciado una tasa media de resistencia a claritromicina en Europa del 17,5%, siendo significativamente superior en los países de Europa del Sur, Central y Occidental (> 20%) comparado con los países del norte de Europa (< 10%).
La situación en España a este respecto entre los años 1997 y 2008ha sido recientemente revisada8. En cuanto a la eficacia de la terapia triple, se confirmó una tasa media de curación por IT del 80%, mantenida a lo largo del tiempo, en 32 estudios que incluyeron a 4.727 pacientes. Respecto a la resistencia a claritromicina, la información disponible hasta 2008 señalaba que las tasas permanecían estables, en torno al 8%. Sin embargo, la tasa de resistencia comunicada por los centros españoles participantes en el reciente estudio multicéntrico europeo mencionado previamente7 fue del 14%. Por tanto, existe una tendencia evidente en nuestro país a una relativamente baja eficacia de la terapia triple, y datos emergentes que apuntan a un incremento manifiesto en las tasas locales de resistencia a claritromicina. Por ello, sería interesante actualizar estos datos para determinar si está justificado el cambio de los esquemas terapéuticos de primera línea en España y si este cambio debe ser generalizado o se debe realizar de manera individualizada. Así, el objetivo del presente estudio es evaluar de manera actualizada (durante los últimos 6 años) la eficacia de la terapia triple y la prevalencia de resistencia a claritromicina en España.
MétodosEficacia de la terapia tripleSe realizó una búsqueda sistemática (2007-2012) de artículos publicados en revistas internacionales y nacionales a través de MEDLINE, utilizando los términos de búsqueda «Helicobacter pylori/H. pylori» y «Spain». Igualmente, se llevó a cabo una búsqueda minuciosa en los libros de resúmenes de la reunión anual del la Asociación Española de Gastroenterología (AEG), la Sociedad Española de Patología Digestiva (SEPD) y la Sociedad de Enfermedades Infecciosas y Microbiología (SEIMC), utilizando el término de búsqueda «Helicobacter pylori/H. pylori». Fueron incluidos todos los estudios en los que se utilizaba una terapia triple de primera línea con una duración máxima de 14 días con cualquier IBP (omeprazol, lansoprazol, pantoprazol, rabeprazol o esomeprazol), amoxicilina 1g/12h y claritromicina 500mg/12h. Los resúmenes que duplicaban información presentada previamente en otros congresos (AEG, SEPD) o publicada posteriormente en formato de artículo fueron excluidos. Los estudios en población pediátrica o aquellos que utilizaban antibióticos como levofloxacino o metronidazol en la terapia triple fueron igualmente excluidos. Las variables analizadas en cada estudio fueron: autor, año de publicación, ciudad, número de pacientes incluidos, tipo de IBP utilizado y dosis.
La variable principal de análisis fue la erradicación de H. pylori, documentada mediante histología o test de aliento, tanto por protocolo (PP) (teniendo en cuenta solo a los pacientes que realizaron de manera completa el tratamiento) como por IT (incluyendo a todos los pacientes, independientemente de que completaran o no el tratamiento y asumiendo que los pacientes sin seguimiento suponían un fracaso del tratamiento). La eficacia del tratamiento erradicador no aparece desglosada por PP/IT en la gran mayoría de los resúmenes de congresos; cuando esta información sí estaba disponible por separado, se tuvo en cuenta la eficacia por IT.
Prevalencia de la resistencia a claritromicinaSe realizó una búsqueda sistemática (2007-2012) de artículos publicados en revistas internacionales y nacionales a través de MEDLINE, utilizando los términos de búsqueda «Helicobacter pylori/H. pylori», «clarithromycin» y «Spain». Igualmente, se llevó a cabo una búsqueda minuciosa en los libros de resúmenes de los congresos previamente mencionados, utilizando el término de búsqueda «Helicobacter pylori/H. pylori». Fueron excluidos los estudios con resultados duplicados, en población pediátrica y aquellos en los que se evaluaba la resistencia en pacientes que habían recibido previamente tratamiento erradicador. Las variables analizadas en cada estudio fueron: autor principal, año de publicación, ciudad, número de pacientes incluidos, prevalencia de resistencia a claritromicina, metronidazol y resistencia combinada a ambos antibióticos. En las provincias donde existía más de una tasa de resistencia comunicada, se calculó la media de las mismas.
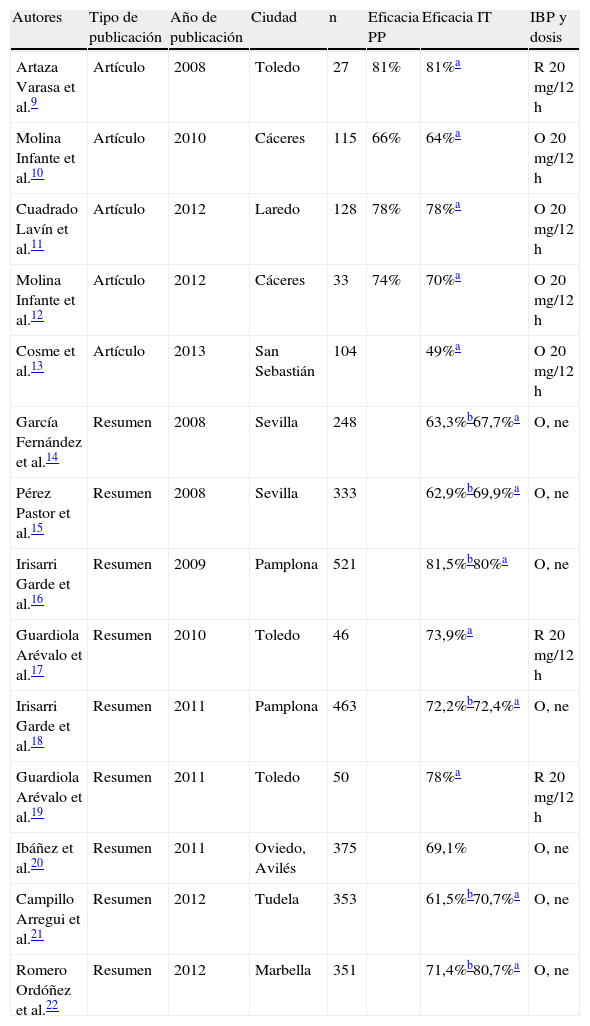
ResultadosEficacia de la terapia tripleSe identificaron 5 artículos y 9 resúmenes9–22, que incluyeron a 3.147 pacientes (tabla 1), con una tasa media de erradicación del 70,8% (IC 95% = 66-76%). Estratificados por duración del tratamiento, la eficacia media fue del 68,8% (60-76%) para esquemas terapéuticos de 7 días y del 71,7% (68-78%) para tratamientos de 10 días. No se identificó ningún estudio que incluyera tratamientos triples de 14 días de duración. En el total de los 14 estudios que evaluaron la eficacia de la terapia triple, todos mostraron una eficacia < 80%, con la excepción de 3 estudios con tasas de curación del 80,722, 819 y 81,5%16.
Estudios que han evaluado la eficacia de la terapia triple con un inhibidor de la bomba de protones (IBP), amoxicilina y claritromicina en España desde 2007 a 2012
| Autores | Tipo de publicación | Año de publicación | Ciudad | n | Eficacia PP | Eficacia IT | IBP y dosis |
| Artaza Varasa et al.9 | Artículo | 2008 | Toledo | 27 | 81% | 81%a | R 20 mg/12 h |
| Molina Infante et al.10 | Artículo | 2010 | Cáceres | 115 | 66% | 64%a | O 20 mg/12 h |
| Cuadrado Lavín et al.11 | Artículo | 2012 | Laredo | 128 | 78% | 78%a | O 20 mg/12 h |
| Molina Infante et al.12 | Artículo | 2012 | Cáceres | 33 | 74% | 70%a | O 20 mg/12 h |
| Cosme et al.13 | Artículo | 2013 | San Sebastián | 104 | 49%a | O 20 mg/12 h | |
| García Fernández et al.14 | Resumen | 2008 | Sevilla | 248 | 63,3%b67,7%a | O, ne | |
| Pérez Pastor et al.15 | Resumen | 2008 | Sevilla | 333 | 62,9%b69,9%a | O, ne | |
| Irisarri Garde et al.16 | Resumen | 2009 | Pamplona | 521 | 81,5%b80%a | O, ne | |
| Guardiola Arévalo et al.17 | Resumen | 2010 | Toledo | 46 | 73,9%a | R 20 mg/12 h | |
| Irisarri Garde et al.18 | Resumen | 2011 | Pamplona | 463 | 72,2%b72,4%a | O, ne | |
| Guardiola Arévalo et al.19 | Resumen | 2011 | Toledo | 50 | 78%a | R 20 mg/12 h | |
| Ibáñez et al.20 | Resumen | 2011 | Oviedo, Avilés | 375 | 69,1% | O, ne | |
| Campillo Arregui et al.21 | Resumen | 2012 | Tudela | 353 | 61,5%b70,7%a | O, ne | |
| Romero Ordóñez et al.22 | Resumen | 2012 | Marbella | 351 | 71,4%b80,7%a | O, ne |
ne: no especificado; O: omeprazol; R: rabeprazol.
Respecto a artículos publicados en revistas (n = 5), se incluyeron 407 pacientes y todos los tratamientos triples pautados tuvieron una duración de 10 días9–13. La tasa de erradicación media fue del 74,7% (64-85%) en el análisis PP y del 72,5% (60-84%) por IT.
De igual manera, se identificaron 18 resúmenes, de los que 9 fueron excluidos por duplicidad de resultados previamente comunicados en otros congresos o posteriormente publicados en formato de artículo. Por tanto, finalmente se incluyeron en el análisis 9 resúmenes14–22, que incluyeron a 2.740 pacientes. Los tratamientos triples pautados tuvieron una duración variable de 7 o 10 días. La tasa de erradicación media fue del 68,8% (60-76%) para los tratamientos de 7 días y del 73,7% (68-78%) para los de 10 días de duración.
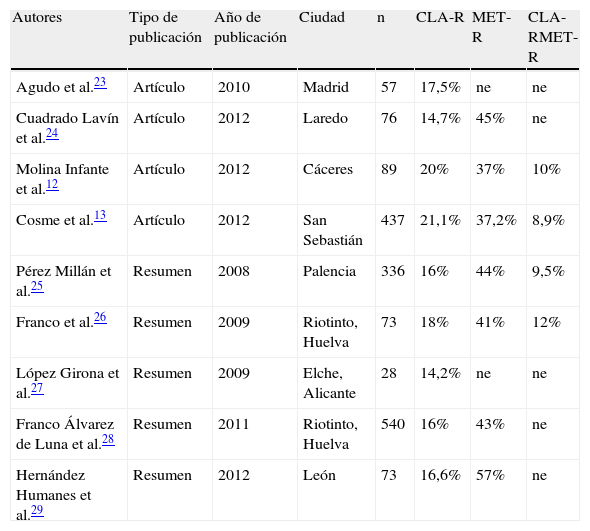
Prevalencia de resistencia a claritromicinaSe identificaron 4 artículos y 5 resúmenes12,13,23–29, que incluyeron a 1.709 pacientes (tabla 2), con una tasa media de resistencia a claritromicina del 18,3% (13-22%), a metronidazol del 40,8% (30-47%) y frente a ambos del 10,1% (8-12%).
Estudios que han evaluado la tasa de resistencia de Helicobacter pylori a claritromicina en España desde 2007 a 2012
| Autores | Tipo de publicación | Año de publicación | Ciudad | n | CLA-R | MET-R | CLA-RMET-R |
| Agudo et al.23 | Artículo | 2010 | Madrid | 57 | 17,5% | ne | ne |
| Cuadrado Lavín et al.24 | Artículo | 2012 | Laredo | 76 | 14,7% | 45% | ne |
| Molina Infante et al.12 | Artículo | 2012 | Cáceres | 89 | 20% | 37% | 10% |
| Cosme et al.13 | Artículo | 2012 | San Sebastián | 437 | 21,1% | 37,2% | 8,9% |
| Pérez Millán et al.25 | Resumen | 2008 | Palencia | 336 | 16% | 44% | 9,5% |
| Franco et al.26 | Resumen | 2009 | Riotinto, Huelva | 73 | 18% | 41% | 12% |
| López Girona et al.27 | Resumen | 2009 | Elche, Alicante | 28 | 14,2% | ne | ne |
| Franco Álvarez de Luna et al.28 | Resumen | 2011 | Riotinto, Huelva | 540 | 16% | 43% | ne |
| Hernández Humanes et al.29 | Resumen | 2012 | León | 73 | 16,6% | 57% | ne |
CLA-R: cepas de H. pylori resistentes a claritromicina; CLA-R MET-R: cepas de H. pylori resistentes a claritromicina y metronidazol; MET-R: cepas de H. pylori resistentes a metronidazol; ne: no especificado.
Respecto a artículos publicados en revistas (n = 4), se incluyeron 659 pacientes12,13,24,25. La tasa media de resistencia a claritromicina fue del 18,3% (13-22%), a metronidazol del 41% (20-63%) y combinada a claritromicina y metronidazol del 9,4% (2-16%).
Se identificaron 10 resúmenes, de los que 5 fueron excluidos por duplicidad de resultados previamente comunicados en otros congresos o posteriormente publicados en formato de artículo. Por tanto, se incluyeron finalmente 5 resúmenes con 1.050 pacientes25–29. La tasa media de resistencia a claritromicina fue del 16% (13-18%), a metronidazol del 42% (23-61%) y combinada a claritromicina y metronidazol del 10,7% (4-18%).
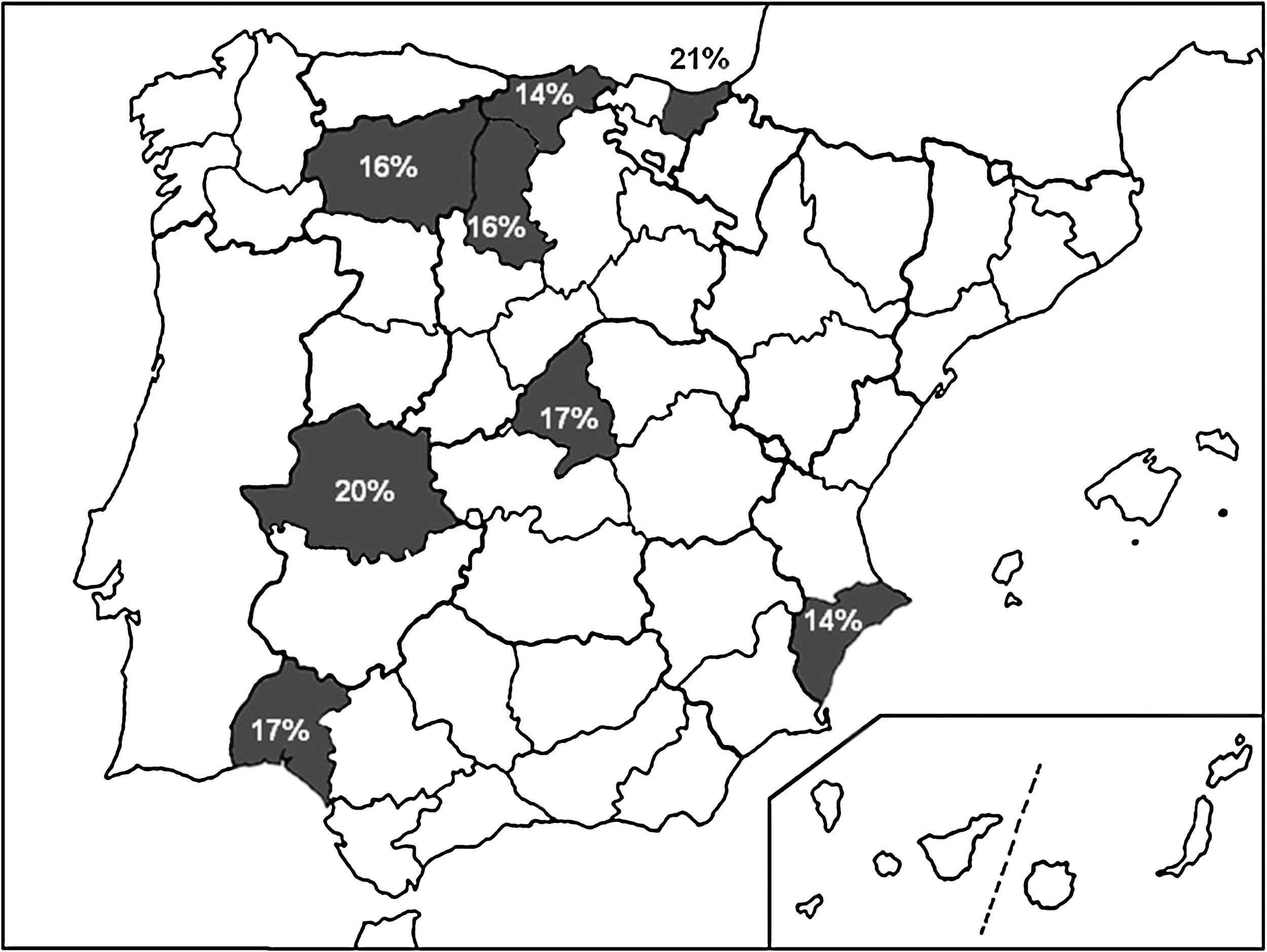
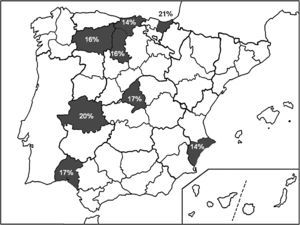
En la figura 1 se exponen las localizaciones geográficas de España donde se han evaluado recientemente las tasas de resistencia a claritromicina, así como su valor numérico.
DiscusiónEl manifiesto declive de la eficacia de la terapia triple para el tratamiento de la infección por H. pylori es un fenómeno generalizado en todo el mundo, pero que ha sido especialmente acusado en los países de la cuenca mediterránea (España, Italia, Francia, Turquía), donde en general la terapia triple no alcanza tasas de curación superiores al 80%30. Los resultados del presente estudio confirman que las tasas de curación actualizadas en nuestro país son, de manera homogénea, inaceptables. Del mismo modo, queda claro que las tasas actualizadas de resistencia a claritromicina, e igualmente de manera homogénea a lo largo del país, son notablemente superiores a las comunicadas previamente y justifican este descenso sostenido en la eficacia de la terapia triple durante los últimos años8.
El interés científico reciente en España por conocer la eficacia del tratamiento empírico triple (5 artículos publicados en 6 años) y las tasas de resistencia antibióticas (4 artículos publicados en 6 años) es ínfimo si se tiene en cuenta que H. pylori infecta aproximadamente al 50% de la población española y que suele realizarse tratamiento erradicador empírico en la inmensa mayoría de los pacientes dispépticos, cuya prevalencia estimada varía entre el 15 y el 45% de la población general31. Como consecuencia lógica, no se ha evaluado de una manera crítica la necesidad de cambiar los esquemas terapéuticos de primera línea en nuestro medio. Es probable que, para ello, debamos empezar a considerar el manejo de la infección por H. pylori desde el prisma de las enfermedades infecciosas y no meramente como una enfermedad del tracto digestivo32. A la hora de pautar un tratamiento antibiótico para eliminar un microorganismo se deben tener en cuenta las tasas locales de resistencia antimicrobiana y de eficacia de los tratamientos empíricos, siempre con un objetivo de éxito terapéutico mínimo del 90%, como el que esperaríamos para el tratamiento antibiótico de una infección del tracto respiratorio o de las vías urinarias. En el campo de la microbiología, el desarrollo de resistencia a antibióticos se detecta habitualmente con rapidez y esto se traduce en cambios en las estrategias clínicas para mantener los mejores resultados terapéuticos posibles.
Es evidente que esta perspectiva «microbiológica» no se ha aplicado a la infección por H. pylori en nuestro país, ya que, a pesar de que no se ha comunicado una eficacia superior al 81% en ningún estudio con terapia triple en los últimos 6 años y a que la tasa de resistencia a claritromicina detectada en la presente revisión (18%) es notablemente superior a la publicada hasta 20088, no se ha evidenciado en los últimos años un cambio en la práctica clínica habitual.
Queda claro, por tanto, que existen regiones en España donde es necesario abordar la infección por H. pylori mediante nuevas estrategias terapéuticas. En este sentido, las recomendaciones de consenso europeas actualizadas6 han propuesto una actitud dicotómica: en regiones donde las tasas de resistencia sean menores al 15-20%, o con elevada eficacia mantenida de la terapia triple, se puede seguir utilizando esta terapia, aunque se recomienda una duración de 10-14 días y dosis altas de IBP; mientras que en regiones con tasas de resistencia a claritromicina > 15-20% la terapia clásica con bismuto se considera el tratamiento de primera línea y, en caso de ausencia de disponibilidad de este régimen, se recomienda utilizar una terapia cuádruple sin bismuto, ya sea administrada de manera secuencial o concomitante.
La terapia triple durante 14 días con dosis altas de IBP no ha sido valorada en nuestro país y puede ser una opción que merezca ser evaluada en el futuro. Dos estudios recientes llevados a cabo en América Latina con terapia triple de 14 días obtuvieron tasas de erradicación bajas, del 82 y 83%, respectivamente33,34. Una desventaja de la terapia cuádruple clásica es que, actualmente, es difícil obtener alguno de sus componentes en España, específicamente la tetraciclina clorhidrato/hidrocloruro. Por su parte, Pylera® (Aptalis Pharma), una formulación galénica novedosa que contiene sales de bismuto, tetraciclina y metronidazol en una sola cápsula y que ha obtenido unos resultados iniciales prometedores35, aún no se encuentra comercializada en España.
Las terapias cuádruples sin bismuto parecen una alternativa terapéutica prometedora para curación de la infección por H. pylori (tabla 3). En nuestro medio, la terapia secuencial ha mostrado una eficacia limitada (84%)36 e incluso inaceptable (76%)10. El tratamiento concomitante (IBP, amoxicilina, claritromicina y metronidazo) durante 10 días ha demostrado una eficacia inicial del 86%, en un medio donde la terapia triple y secuencial obtuvieron tasas de curación menores del 80%12. Un reciente estudio multicéntrico español ha comparado la eficacia y seguridad de las 2 modalidades fundamentales de terapia cuádruple sin bismuto (secuencial y concomitante) durante 10 días37. Los resultados finales demuestran que la erradicación por IT fue del 89,6% con el tratamiento concomitante y del 86,2% con el tratamiento secuencial, sin que estas diferencias alcanzaran significación estadística. Por último, un estudio reciente realizado en España e Italia y presentado en el último congreso europeo de gastroenterología38 ha comparado la eficacia de las terapias cuádruples de tipo híbrido y concomitante «optimizadas» (esto es, con una duración de 14 días y con dosis altas de IBP). Las tasas de curación por IT fueron del 92% para el tratamiento concomitante y del 90% para el tratamiento híbrido, sin diferencias estadísticamente significativas entre ambos.
Esquemas terapéuticos cuádruples sin bismuto evaluados hasta la actualidad en nuestro medio
| Tratamiento | Descripción |
| Secuencial 10 días | IBP/12 h durante 10 díasAmoxicilina 1 g/12 h durante los 5 primeros díasClaritromicina 500 mg/12 h durante los últimos 5 díasMetronidazol 500 mg/12 h durante los últimos 5 días |
| Concomitante 10-14 días | IBP/12 hAmoxicilina 1 g/12 hClaritromicina 500 mg/12 hMetronidazol 500 mg/12 h |
| Híbrido secuencial-concomitante 14 días | IBP/12 h durante 14 díasAmoxicilina 1 g/12 h durante 14 díasClaritromicina 500 mg/12 h durante los últimos 7 díasMetronidazol 500 mg/12 h durante los últimos 7 días |
IBP: inhibidor de la bomba de protones.
El presente estudio posee una serie de limitaciones que deben ser tenidas en cuenta. Cabe la posibilidad de que exista un sesgo de publicación en los estudios analizados, dado que los autores con tasas de curación adecuadas sean menos propensos a publicar sus resultados, al ser de menor interés. De igual manera, la heterogeneidad de los resultados de eficacia de la terapia triple en nuestro país impide hacer una recomendación generalizada de cambio a otros tratamientos para la infección por H. pylori. Serían deseables, por tanto, grandes estudios abarcando un espectro más amplio de la geografía española para evaluar la realidad actual de la terapia triple y revisar de manera crítica la necesidad de cambio de tratamiento de primera línea y si este debe ser generalizado. En este sentido, ha sido publicado recientemente un estudio multicéntrico de gran tamaño muestral comparando la terapia triple y secuencial en Taiwán, con una tasas de resistencia a claritromicina bajas (9%)39. Ambos tratamientos fueron utilizados durante 14 días y con dosis altas de IBP (lansoprazol 30mg/12h). La eficacia de la terapia secuencial fue significativamente superior (90,7%) a la obtenida con la terapia triple (82,3%). La eficacia subóptima obtenida con la terapia triple de 14 días en una región con baja resistencia a claritromicina documentada nos puede estar indicando la necesidad de replantearnos un cambio en la actitud terapéutica, máxime en áreas con resistencias antimicrobianas crecientes, como es el caso de España. En último lugar, pese a que los datos iniciales de las terapias cuádruples en nuestro medio son prometedores, necesitamos una experiencia más sólida respecto a su eficacia y aplicabilidad, ya que son más complejas y con un mayor potencial de efectos secundarios y mal cumplimiento terapéutico.
En conclusión, en general, la eficacia de la terapia triple parece subóptima en la evidencia más reciente comunicada en España, debido muy probablemente a un incremento de la resistencia de H. pylori a claritromicina. Son necesarios, por tanto, nuevos tratamientos para obviar las resistencias antibióticas, si bien desconocemos en la actualidad si la terapia triple debe ser abandonada de manera generalizada. Actualmente, una alternativa a la triple terapia la constituyen las terapias cuádruples sin bismuto, destacando entre ellas la denominada terapia «concomitante», con la que se han alcanzado en nuestro medio cifras de erradicación ≥ 90%, por lo que ha sido recientemente recomendada en regiones con tasas de erradicación menores del 80% o con una resistencia a claritromicina > 15-20% por la Guía de práctica clínica sobre el manejo del paciente con dispepsia, elaborada por la Asociación Española de Gastroenterología y la Sociedad Española de Medicina de Familia y Comunitaria31.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.