Las integrinas desempeñan un papel clave en el desarrollo y mantenimiento del proceso inflamatorio en pacientes con enfermedad inflamatoria intestinal. Vedolizumab es un anticuerpo monoclonal humanizado con efecto predominante a nivel intestinal. Su mecanismo de acción consiste en una inhibición específica de la integrina α4ß7 de los leucocitos, lo que impide su interacción con la molécula de adhesión celular adresina de la mucosa 1 (MAdCAM-1) que participa en la migración de los linfocitos desde el torrente sanguíneo al tejido intestinal. Vedolizumab está indicado para el tratamiento de la enfermedad de Crohn y la colitis ulcerosa activas, de moderadas a graves, en pacientes adultos que hayan tenido una respuesta inadecuada, presenten pérdida de respuesta o sean intolerantes al tratamiento convencional o a un antagonista del factor de necrosis tumoral α (TNF-α). En esta revisión se presentan los resultados clínicos más importantes de vedolizumab en el tratamiento de pacientes con colitis ulcerosa.
Integrins play a crucial role in the development and maintenance of the inflammatory process in patients with inflammatory bowel disease. Vedolizumab is a humanized monoclonal antibody with a predominantly gastrointestinal effect. It specifically inhibits leukocyte integrin α4β7, thus preventing its interaction with mucosal vascular addressin cell adhesion molecule 1(MAdCAM-1), which is involved in the migration of lymphocytes from the blood stream to the intestinal tissue. Vedolizumab is indicated in the treatment of moderate to severe active Crohn's disease and ulcerative colitis in adult patients with poor response, loss of response, or intolerance to conventional treatment or to tumour necrosis factor alpha (TNF-α) antagonists. This review presents the most relevant clinical outcomes of vedolizumab in the treatment of patients with ulcerative colitis.
La colitis ulcerosa (CU) es una enfermedad inflamatoria crónica e idiopática de la mucosa del colon. Afecta de forma prácticamente constante la mucosa rectal y se extiende en sentido proximal y de forma continua, y puede afectar la totalidad de la mucosa cólica. La CU se clasifica fenotípicamente, por la extensión de la afectación del colon, desde una proctitis hasta una colitis extensa1.
Tanto la CU como la enfermedad de Crohn se desarrollan a partir de una respuesta inmunológica inapropiada, en sujetos genéticamente susceptibles, como resultado de interacciones complejas entre factores ambientales, microbianos y del sistema inmunológico intestinal2. Entre los mecanismos fisiopatológicos propuestos en la CU se incluyen la alteración de la barrera epitelial, la rotura del equilibrio homeostático entre la inmunidad de la mucosa del huésped y la microbiota, la activación de los receptores toll-like de las células dendríticas, la desregulación de las respuestas inmunológicas a nivel de la mucosa y la lámina propia del colon inflamado (con participación, entre otros, de las células T colaboradoras y de NK, interleucinas 5, 10 y 13, citocinas relacionadas con las células Th2 y factor de necrosis tumoral α [TNF-α]), el reclutamiento y el tráfico leucocitario y, finalmente, diversos factores genéticos. El mejor conocimiento de los mecanismos inductores y perpetuadores de la inflamación de la mucosa colónica ha hecho posible la identificación de nuevas dianas terapéuticas y el desarrollo de nuevos fármacos con distintos mecanismos de acción3.
Tráfico linfocitario y antagonistas de las integrinasLos linfocitos juegan un papel clave en la patogenia de la CU. Los inhibidores de las integrinas constituyen un grupo de fármacos que tienen como diana terapéutica la interrupción de los sistemas de adhesión y tráfico leucocitario, con la consiguiente reducción de la inflamación4. La capacidad de alterar los mecanismos intrínsecos de adhesión y transmigración de los linfocitos T a través de las células endoteliales del intestino inflamado puede contribuir a la resolución de la inflamación existente, así como al potencial control de la CU a largo plazo5,6.
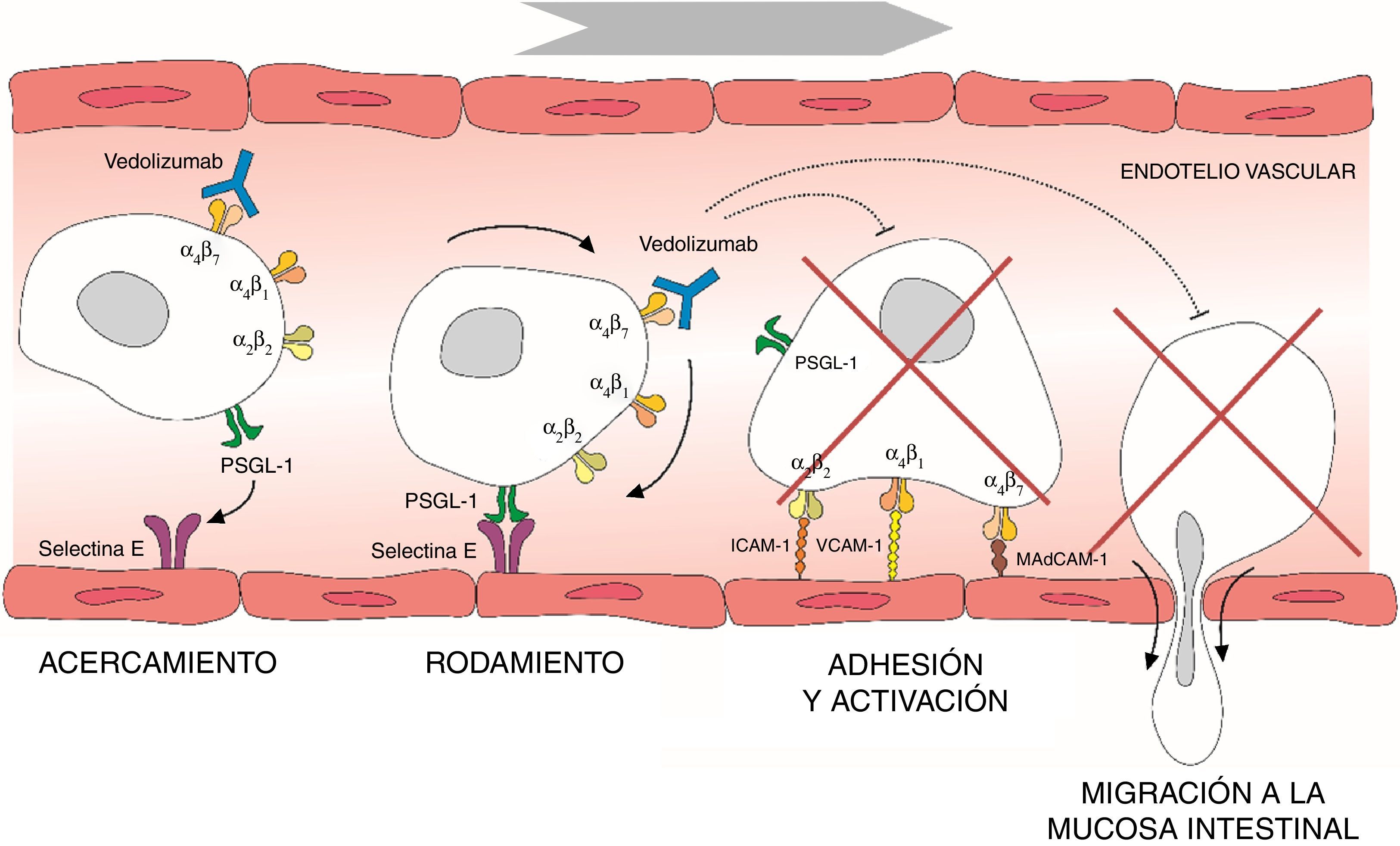
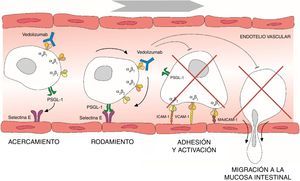
La migración de los leucocitos de la circulación sanguínea a través del endotelio intestinal acontece a través de una serie de mecanismos basados en sistemas de adhesión, en los que participan las integrinas α4β1 y α4β7, así como las molécula de adhesión vascular (VCAM-1) y la molécula de adhesión celular adresina de la mucosa 1 (MAdCAM-1)6–8. La integrina α4β7 se expresa en un subtipo concreto de linfocitos T colaboradores de memoria que migran preferentemente al tracto gastrointestinal y causan la inflamación característica de la CU9. Una vez que la migración transendotelial de leucocitos ha tenido lugar, el proceso inflamatorio se propaga gracias a la proliferación y activación local de linfocitos, y a la reducción en la salida de linfocitos de la mucosa. Las moléculas de adhesión también participan en la interacción entre las células T y las células dendríticas o mesenquimales de la mucosa y submucosa intestinal, facilitando la activación de los linfocitos T10. Por otra parte, las integrinas α4 también juegan un importante papel en el proceso inflamatorio a través de interacciones con diversos ligandos tisulares que, a su vez, inducen señales coestimuladoras que determinan la proliferación y adhesión de los linfocitos T, la producción de citocinas y el aumento de la expresión de las células T de las metaloproteinasas de matriz que degradan la matriz extracelular y facilitan la migración celular11. Así pues, la interrupción de las interacciones de las moléculas de adhesión puede ser efectiva para disminuir el reclutamiento de las células T, la inhibición de las señales de coestimulación locales, o una combinación de ambas (fig. 1).
Proceso de migración de los linfocitos desde los vasos sanguíneos hacia la mucosa intestinal y mecanismo de acción de vedolizumab.
ICAM-1: intercellular adhesion molecule 1; MAdCAM-1: mucosal vascular addressin cell adhesion molecule 1; PSGL-1: P-selectin glycoprotein ligand 1; VCAM-1: vascular cell adhesion molecule 1.
El tratamiento de la CU depende, fundamentalmente, de la gravedad de los brotes de actividad y de la respuesta a los corticoesteroides. De hecho, la mitad de los pacientes con CU nunca requerirá tratamiento con corticoides y, por tanto, no precisará de otros fármacos aparte de los aminosalicilatos12. Entre los pacientes que precisen corticoides orales o intravenosos, la mitad requerirá tratamientos inmunosupresores, ya sea para el tratamiento de la corticorrefractariedad ya sea de la corticodependencia13. Vedolizumab tiene aprobada su indicación para el tratamiento de pacientes con CU activa con fracaso del tratamiento convencional (entendido como tratamiento con corticoesteroides o inmunosupresores tiopurínicos), lo que coincide con las indicaciones de infliximab, adalimumab y golimumab, los 3 fármacos anti-TNF-α aprobados en España para el tratamiento de la CU. Al margen de dicha indicación, vedolizumab puede representar una alternativa terapéutica de gran interés en el fallo primario o en la pérdida secundaria de respuesta al tratamiento con anti-TNF-α.
Vedolizumab es un anticuerpo monoclonal humanizado recombinante del tipo IgG1 que actúa como inhibidor selectivo del heterodímero α4β7, inhibiendo, por tanto, la adhesión y migración de los leucocitos hacia el tracto gastrointestinal14. El fármaco es un antagonista de la integrina α4β7, sin actividad inmunosupresora sistémica identificada. Mediante la unión a α4β7 de linfocito T, vedolizumab inhibe la adhesión de estas células a MAdCAM-1, pero no la VCAM-115. La molécula de adhesión MAdCAM-1 se expresa en el intestino y en tejidos asociados al tracto digestivo (como el páncreas) y tejido linfoide (como las placas de Peyer, o lamina propria intestinal)16. Generalmente no se detecta en la mayoría de los tejidos extraintestinales (normales o inflamados), incluyendo aquellos con superficies mucosas, o en el endotelio de las venas del pulmón, hígado, riñón, corazón, glándulas salivales, útero, ovario, músculo esquelético, piel o parénquima cerebral16. Sin embargo, se ha detectado MAdCAM-1 en el tejido hepático tras inflamación prolongada asociada a enfermedad inflamatoria intestinal17. La molécula de adhesión MAdCAM-1 expresada en las células endoteliales del intestino juega un papel crítico en la migración de los linfocitos T a los tejidos del tracto intestinal. Vedolizumab, a diferencia de natalizumab, no se une a las integrinas α4β1 y αEβ7 ni inhibe su función. Asimismo, tampoco induce alteraciones en la inmunosupresión sistémica, hecho que no afecta a los mecanismos de vigilancia inmunológica del sistema nervioso central. Por ello, aunque el tratamiento con natalizumab está asociado con un aumento en el riesgo de leucoencefalopatía multifocal progresiva (LMP), una enfermedad desmielinizante progresiva del sistema nervioso central causada por un tipo oportunista de poliomavirus humano (el virus John Cunninghamo virus JC), durante el desarrollo clínico de vedolizumab, que incluyó aproximadamente a 3.000 pacientes (media de exposición de 19 meses), no se ha comunicado ningún caso de LMP en pacientes tratados con este último fármaco a pesar de que más del 80% de los pacientes habían recibido tratamiento inmunosupresor previamente a su inclusión en el estudio18–20.
En mayo de 2014, la Food and Drug Administration americana y la Agencia Europea de Medicamentos dieron la aprobación para la comercialización de vedolizumab (Entyvio®, Takeda Pharmaceuticals International GmbH) para el tratamiento de la enfermedad de Crohn y CU activas, de moderada a grave, en pacientes adultos que hayan tenido una respuesta inadecuada, presenten pérdida de respuesta o sean intolerantes al tratamiento convencional o a un antagonista del TNF-α21.
Eficacia de vedolizumab en pacientes con colitis ulcerosaLas versiones previas de vedolizumab se denominaban LDP-02, MLN02 y MLN0002. Para facilitar su lectura, en esta revisión, nos referiremos a todas las versiones como «vedolizumab». Los estudios de fase 1 en voluntarios sanos han confirmado el mecanismo de acción selectivo intestinal de vedolizumab22, la ausencia de efecto sobre los linfocitos del líquido cefalorraquídeo (tasa CD4+:CD8+)23 y la similitud en los parámetros farmacocinéticos en pacientes con CU y enfermedad de Crohn sin necesidad de variación de dosis en presencia de covariables como edad, sexo, peso, presencia de anticuerpos antivedolizumab y albúmina24.
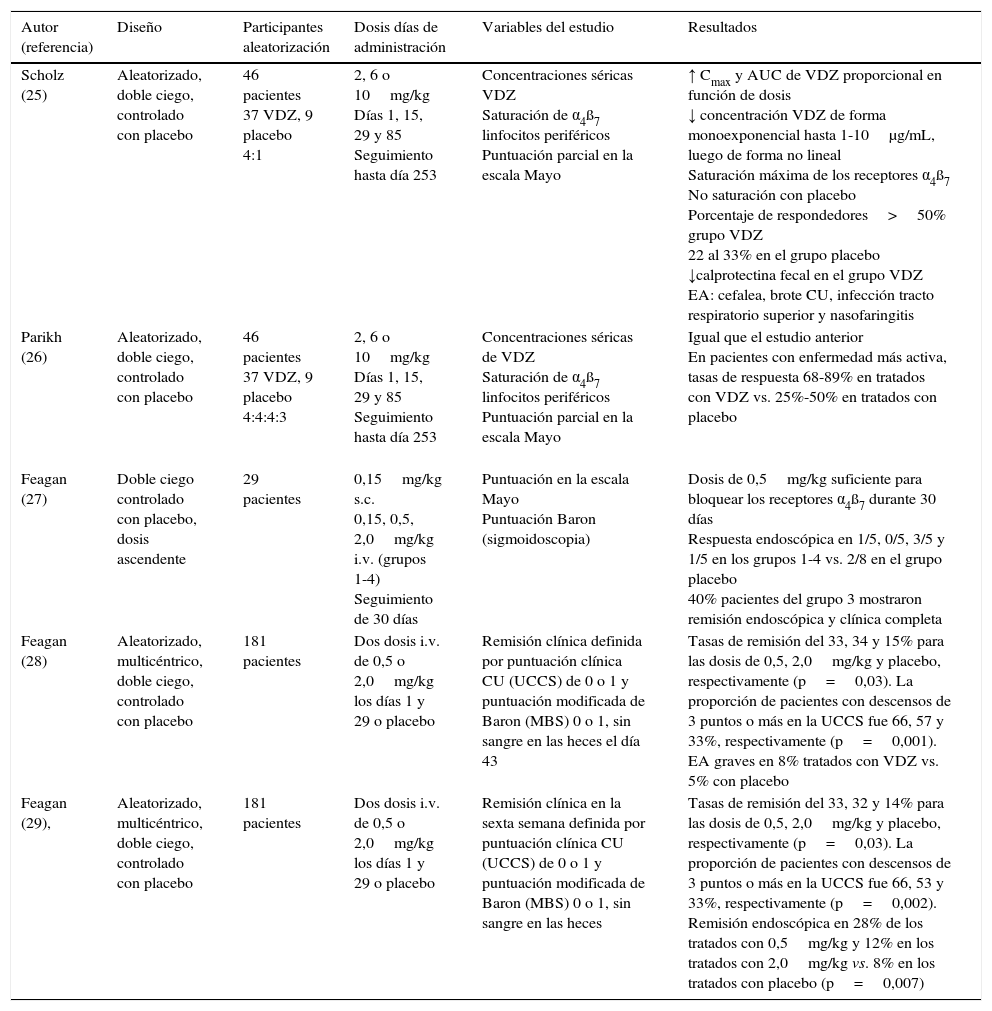
Asimismo, diferentes estudios de fase 2 en pacientes con CU activa han proporcionado datos de eficacia, seguridad, tolerabilidad y farmacocinética (tabla 1). En 46 pacientes incluidos en un estudio aleatorizado y doble ciego controlado con placebo, tratados con vedolizumab (2, 6 o 10mg/kg) los días 1, 15, 29 y 85 o placebo, y monitorizados durante 8 meses, vedolizumab mostró una farmacocinética proporcional a la dosis, con saturación de los receptores α4β7 de los linfocitos de la sangre periférica25,26. En otro estudio de 29 pacientes con CU moderada-grave, se compararon varias dosis de vedolizumab (0,15mg/kg por vía subcutánea o 0,15; 0,5 o 2mg/kg i.v.) con placebo. La dosis de 0,5mg/kg fue suficiente para lograr la saturación de los receptores α4β7 de los linfocitos circulantes durante 30 días27. En un estudio multicéntrico, doble ciego y controlado con placebo que incluyó a 181 pacientes con CU activa y aleatorizados a tratamiento con 0,5 o 2mg/kg (o placebo) los días 1 y 29, las tasas de remisión fueron significativamente superiores en el grupo de tratamiento activo28 y a la sexta semana fueron del 33, 32 y 14% para los grupos tratados con 0,5, 2mg/kg y placebo, respectivamente (p=0,002), con unas tasas de remisión endoscópica del 28, 12 y 8%, respectivamente29.
Ensayos clínicos de fase 2 de vedolizumab frente a placebo en pacientes con colitis ulcerosa activa
| Autor (referencia) | Diseño | Participantes aleatorización | Dosis días de administración | Variables del estudio | Resultados |
|---|---|---|---|---|---|
| Scholz (25) | Aleatorizado, doble ciego, controlado con placebo | 46 pacientes 37 VDZ, 9 placebo 4:1 | 2, 6 o 10mg/kg Días 1, 15, 29 y 85 Seguimiento hasta día 253 | Concentraciones séricas VDZ Saturación de α4ß7 linfocitos periféricos Puntuación parcial en la escala Mayo | ↑ Cmax y AUC de VDZ proporcional en función de dosis ↓ concentración VDZ de forma monoexponencial hasta 1-10μg/mL, luego de forma no lineal Saturación máxima de los receptores α4ß7 No saturación con placebo Porcentaje de respondedores>50% grupo VDZ 22 al 33% en el grupo placebo ↓calprotectina fecal en el grupo VDZ EA: cefalea, brote CU, infección tracto respiratorio superior y nasofaringitis |
| Parikh (26) | Aleatorizado, doble ciego, controlado con placebo | 46 pacientes 37 VDZ, 9 placebo 4:4:4:3 | 2, 6 o 10mg/kg Días 1, 15, 29 y 85 Seguimiento hasta día 253 | Concentraciones séricas de VDZ Saturación de α4ß7 linfocitos periféricos Puntuación parcial en la escala Mayo | Igual que el estudio anterior En pacientes con enfermedad más activa, tasas de respuesta 68-89% en tratados con VDZ vs. 25%-50% en tratados con placebo |
| Feagan (27) | Doble ciego controlado con placebo, dosis ascendente | 29 pacientes | 0,15mg/kg s.c. 0,15, 0,5, 2,0mg/kg i.v. (grupos 1-4) Seguimiento de 30 días | Puntuación en la escala Mayo Puntuación Baron (sigmoidoscopia) | Dosis de 0,5mg/kg suficiente para bloquear los receptores α4ß7 durante 30 días Respuesta endoscópica en 1/5, 0/5, 3/5 y 1/5 en los grupos 1-4 vs. 2/8 en el grupo placebo 40% pacientes del grupo 3 mostraron remisión endoscópica y clínica completa |
| Feagan (28) | Aleatorizado, multicéntrico, doble ciego, controlado con placebo | 181 pacientes | Dos dosis i.v. de 0,5 o 2,0mg/kg los días 1 y 29 o placebo | Remisión clínica definida por puntuación clínica CU (UCCS) de 0 o 1 y puntuación modificada de Baron (MBS) 0 o 1, sin sangre en las heces el día 43 | Tasas de remisión del 33, 34 y 15% para las dosis de 0,5, 2,0mg/kg y placebo, respectivamente (p=0,03). La proporción de pacientes con descensos de 3 puntos o más en la UCCS fue 66, 57 y 33%, respectivamente (p=0,001). EA graves en 8% tratados con VDZ vs. 5% con placebo |
| Feagan (29), | Aleatorizado, multicéntrico, doble ciego, controlado con placebo | 181 pacientes | Dos dosis i.v. de 0,5 o 2,0mg/kg los días 1 y 29 o placebo | Remisión clínica en la sexta semana definida por puntuación clínica CU (UCCS) de 0 o 1 y puntuación modificada de Baron (MBS) 0 o 1, sin sangre en las heces | Tasas de remisión del 33, 32 y 14% para las dosis de 0,5, 2,0mg/kg y placebo, respectivamente (p=0,03). La proporción de pacientes con descensos de 3 puntos o más en la UCCS fue 66, 53 y 33%, respectivamente (p=0,002). Remisión endoscópica en 28% de los tratados con 0,5mg/kg y 12% en los tratados con 2,0mg/kg vs. 8% en los tratados con placebo (p=0,007) |
CU: colitis ulcerosa; EA: efectos adversos; VDZ: vedolizumab.
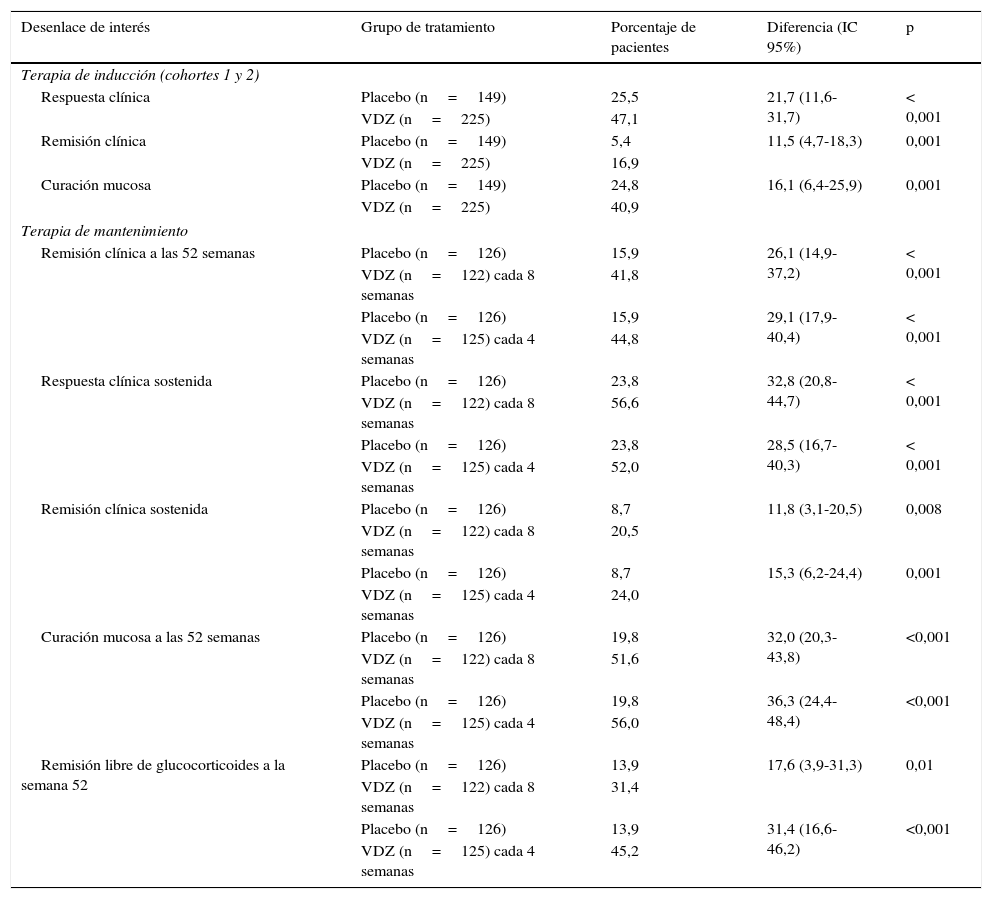
La eficacia y seguridad de vedolizumab se ha estudiado en un ensayo clínico fase 3 en pacientes con CU (GEMINI 1)20,30. Este ensayo integraba los resultados de 2 estudios aleatorizados, doble ciego y controlados con placebo. En el estudio se incluyó a pacientes con CU activa definida como una puntuación en el índice de Mayo de 6 a 12, con una subpuntuación mínima de 2 en la sigmoidoscopia, y con fracaso de tratamientos previos (falta de respuesta o efectos adversos), incluyendo glucocorticoides, medicaciones inmunosupresoras o anti-TNF-α. En el estudio de terapia de inducción se incluyeron 2 cohortes: la cohorte 1 estaba formada por 374 pacientes que fueron tratados con 300mg de vedolizumab i.v. o placebo en las semanas 0 y 2, y la cohorte 2 (estudio abierto), formada por 521 pacientes tratados con vedolizumab en estas mismas semanas. Se evaluó la respuesta clínica en ambas cohortes a la sexta semana. En el estudio de terapia de mantenimiento, los pacientes de ambas cohortes que mostraron respuesta a vedolizumab en la sexta semana fueron aleatorizados a continuar siendo tratados con vedolizumab, cada 4 u 8 semanas, o placebo hasta las 52 semanas. La variable principal en la fase de inducción fue la respuesta clínica a la sexta semana, definida como una disminución de la puntuación del índice de Mayo como mínimo de 3 puntos y una reducción como mínimo del 30% respecto a la puntuación basal, con una disminución como mínimo de un punto en la puntuación de rectorragia o una puntuación absoluta de sangrado rectal de 0 a 1. Las variables secundarias incluían la remisión clínica (puntuación del índice de Mayo de 2 o inferior sin subpuntuación de rectorragia superior a uno y curación mucosa definida como subpuntuación endoscópica de 0 a 1). La variable principal para la fase de mantenimiento era la remisión clínica a la semana 52 y las variables secundarias fueron la respuesta clínica y la remisión clínica sostenidas (a las 6 y 52 semanas), la curación mucosa a las 52 semanas y la ausencia de tratamiento con corticoides en los pacientes que recibían esta medicación en situación basal. La calidad de vida se midió con el cuestionario específico para pacientes con enfermedad inflamatoria intestinal (IBDQ).
Tanto en el ensayo de tratamiento de inducción como en el de mantenimiento, las diferencias entre los grupos de tratamiento con vedolizumab y placebo fueron estadísticamente significativas en todas las variables de interés primarias y secundarias (tabla 2). Asimismo, los pacientes tratados con vedolizumab experimentaron mejorías más significativas en la puntuación parcial del índice de Mayo, en el IBDQ, en la concentración de calprotectina fecal y en el uso de glucocorticoides, que los pacientes tratados con placebo. En un análisis posthoc, no se observaron diferencias aparentes en eficacia de vedolizumab administrado cada 4 o cada 8 semanas. Respecto a los efectos adversos más frecuentes (cefalea, nasofaringitis, infección de las vías respiratorias superiores, artralgia, náuseas, dolor abdominal, fatiga, anemia y tos) no se observaron diferencias entre los grupos de vedolizumab y placebo, si bien las infecciones graves fueron más frecuentes en el grupo de tratamiento activo (2,9 vs. 1,9%). No se observó ningún caso de LMP.
Resultados principales del ensayo de fase 3 GEMINI 1 20,30: vedolizumab (VDZ) frente a placebo
| Desenlace de interés | Grupo de tratamiento | Porcentaje de pacientes | Diferencia (IC 95%) | p |
|---|---|---|---|---|
| Terapia de inducción (cohortes 1 y 2) | ||||
| Respuesta clínica | Placebo (n=149) | 25,5 | 21,7 (11,6-31,7) | < 0,001 |
| VDZ (n=225) | 47,1 | |||
| Remisión clínica | Placebo (n=149) | 5,4 | 11,5 (4,7-18,3) | 0,001 |
| VDZ (n=225) | 16,9 | |||
| Curación mucosa | Placebo (n=149) | 24,8 | 16,1 (6,4-25,9) | 0,001 |
| VDZ (n=225) | 40,9 | |||
| Terapia de mantenimiento | ||||
| Remisión clínica a las 52 semanas | Placebo (n=126) | 15,9 | 26,1 (14,9-37,2) | < 0,001 |
| VDZ (n=122) cada 8 semanas | 41,8 | |||
| Placebo (n=126) | 15,9 | 29,1 (17,9-40,4) | < 0,001 | |
| VDZ (n=125) cada 4 semanas | 44,8 | |||
| Respuesta clínica sostenida | Placebo (n=126) | 23,8 | 32,8 (20,8-44,7) | < 0,001 |
| VDZ (n=122) cada 8 semanas | 56,6 | |||
| Placebo (n=126) | 23,8 | 28,5 (16,7-40,3) | < 0,001 | |
| VDZ (n=125) cada 4 semanas | 52,0 | |||
| Remisión clínica sostenida | Placebo (n=126) | 8,7 | 11,8 (3,1-20,5) | 0,008 |
| VDZ (n=122) cada 8 semanas | 20,5 | |||
| Placebo (n=126) | 8,7 | 15,3 (6,2-24,4) | 0,001 | |
| VDZ (n=125) cada 4 semanas | 24,0 | |||
| Curación mucosa a las 52 semanas | Placebo (n=126) | 19,8 | 32,0 (20,3-43,8) | <0,001 |
| VDZ (n=122) cada 8 semanas | 51,6 | |||
| Placebo (n=126) | 19,8 | 36,3 (24,4-48,4) | <0,001 | |
| VDZ (n=125) cada 4 semanas | 56,0 | |||
| Remisión libre de glucocorticoides a la semana 52 | Placebo (n=126) | 13,9 | 17,6 (3,9-31,3) | 0,01 |
| VDZ (n=122) cada 8 semanas | 31,4 | |||
| Placebo (n=126) | 13,9 | 31,4 (16,6-46,2) | <0,001 | |
| VDZ (n=125) cada 4 semanas | 45,2 | |||
IC 95%: intervalo de confianza del 95%; VDZ: vedolizumab.
Los resultados del ensayo GEMINI 1 demostraron que vedolizumab era más eficaz que el placebo como tratamiento de inducción y mantenimiento en pacientes con CU activa. Asimismo, los análisis adicionales en otros subgrupos de pacientes de este ensayo, incluyendo el fracaso previo del tratamiento con anti-TNF-α o del tratamiento con inmunomoduladores31 o de los pacientes de las cohortes 1 y 2 no respondedores a la sexta semana32, también mostraron la superioridad de vedolizumab frente a placebo a las 6 y 52 semanas. La medición de la calidad de vida utilizando instrumentos genéricos, tales como la versión abreviada del cuestionario de salud SF-36 y la escala analógica visual del cuestionario EQ-5D, además del cuestionario específico IBDQ, también han demostrado que el tratamiento con vedolizumab ejerce efectos beneficiosos en la calidad de vida de los pacientes33.
Por otra parte, se dispone ya de datos de eficacia de vedolizumab a más largo plazo derivados del estudio abierto de extensión del ensayo GEMINI 1 (GEMINI LTS), que incluyen resultados de remisión clínica hasta la semana 10434. Así, en un total de 275 pacientes que completaron el ensayo GEMINI 1 y recibieron cualquier dosis de vedolizumab durante el GEMINI LTS, se obtuvo una remisión clínica en el 73% de los casos. Asimismo, en el subgrupo de pacientes con fracaso previo al tratamiento con anti-TNF-α, un 65% mantenían la remisión clínica a la semana 10435. Más allá de la actividad clínica, también disponemos de resultados preliminares con relación a la cicatrización mucosa a las 52 semanas, que fue del 28% en el grupo vedolizumab frente al 8,7% en el grupo placebo (p<0,001), con tasas de mejoría endoscópica y remisión clínica del 31 y del 13%, respectivamente (p=0,001)36. Estos estudios también han permitido constatar que la eficacia de vedolizumab no difiere según la edad37, los valores basales de calprotectina fecal38 ni el uso concomitante de corticoesteroides o inmunomoduladores39. Por último, un estudio de extensión del ensayo GEMINI 1 demostró la seguridad de la readministración de vedolizumab cada 4 semanas tras un año sin tratamiento40.
Dos revisiones sistemáticas han analizado la eficacia de vedolizumab en el tratamiento de la CU41,42. En una de ellas41, que incluyó 8 ensayos aleatorizados y controlados de tratamiento con fármacos biológicos (vedolizumab, abatacept, visilizumab, golimumab), vedolizumab fue significativamente más efectivo que el placebo para lograr la respuesta clínica, la remisión clínica y la cicatrización mucosa en la fase de inducción, con beneficios relativos del 82, 166 y 75%, respectivamente (p<0,001 para todas las comparaciones); en la fase de mantenimiento, vedolizumab alcanzó un porcentaje de remisión clínica y cicatrización mucosa significativamente mayor respecto al placebo (p<0,01). En otra revisión sistemática en la que se incluyeron 4 ensayos clínicos aleatorizados y controlados que comparaban vedolizumab con placebo, en un total de 606 pacientes, los análisis agregados demostraban la superioridad estadísticamente significativa de vedolizumab frente a placebo para inducir la remisión, la respuesta clínica, la remisión endoscópica y el mantenimiento de la remisión42.
Seguridad del tratamiento con vedolizumabLos efectos adversos más frecuentemente observados en pacientes tratados con vedolizumab incluyen nasofaringitis, cefalea, náuseas, artralgias, pirexia, fatiga, infecciones de las vías respiratorias superiores, tos y dolor abdominal43. Los datos de seguridad descritos en una reciente revisión sistemática41 señalan que vedolizumab fue igual de seguro que el placebo en términos de riesgo de efectos adversos, efectos adversos graves o muertes en la fase de inducción. En la fase de mantenimiento, el riesgo de efectos adversos fue también similar entre pacientes tratados con vedolizumab o placebo, pero las diferencias entre grupos en el riesgo de efectos adversos graves fue marginalmente significativo (p=0,05). En una revisión sistemática de 4 ensayos clínicos con un total de 606 pacientes42, tampoco se encontró una diferencia estadísticamente significativa entre vedolizumab y placebo en términos de riesgo para cualquier efecto adverso (riesgo relativo [RR] 0,99, intervalo de confianza del 95% [IC95%]: 0,93-1,07) o efectos adversos graves (RR 1,01; IC95%: 0,72-1,42). Sin embargo, se observó una diferencia estadísticamente significativa en los pacientes que abandonaron a causa de un efecto adverso: 6% para vedolizumab vs. 11% en el caso del placebo (RR 0,55; IC95%: 0,35-0,87; 2 estudios, 941 pacientes). Por otra parte, no se han descrito infecciones graves que incluyan LMP en pacientes con CU en el ensayo GEMINI 120.
Por último, se ha descrito una tasa de inmunogenicidad del 4% en los estudios controlados GEMINI 1 y 2 (56 de 1.434 pacientes)30,44,45. La frecuencia de anticuerpos antivedolizumab detectados en los pacientes 16 semanas después de la última dosis de vedolizumab fue de aproximadamente el 10%30,44. En dichos ensayos, el 5% de los pacientes que presentaron un efecto adverso considerado como relacionado con la perfusión por el investigador presentaron también positividad para anticuerpos antivedolizumab. Sin embargo, en general, no hubo correlación entre el desarrollo de anticuerpos antivedolizumab y la respuesta clínica o los efectos adversos.
ConclusionesVedolizumab ha demostrado ser más eficaz que el placebo para inducir y mantener la remisión clínica en la CU, de una forma similar a los agentes anti-TNF-α aprobados para el tratamiento de la CU (infliximab, golimumab y adalimumab). Vedolizumab ha sido aprobado para el tratamiento de los pacientes con CU con fracaso previo al tratamiento convencional, por lo que en esa indicación coincidiría con la de los 3 fármacos anti-TNF-α actualmente aprobados en España para el tratamiento de la CU: infliximab, adalimumab y golimumab. Más allá de esta indicación aprobada, uno de los escenarios más atractivos es el de aquellos pacientes con exposición previa a anti-TNF. La pérdida secundaria de respuesta a los anti-TNF-α suele manejarse mediante la intensificación del mismo fármaco o el cambio a otro anti-TNF, estrategias que suelen incrementar los costes y que han demostrado una eficacia aceptable a corto, pero no a largo plazo. Por otra parte, alrededor del 25% de los pacientes no presentan respuesta primaria a un primer anti-TNF;46,47 en esta situación la eficacia de un segundo anti-TNF es todavía menor48,49. Por todo ello, parece razonable que vedolizumab sea el fármaco de elección en ambas situaciones (fallo primario o secundario a anti-TNF-α), además de que se pueda utilizar como fármaco de primera línea en caso de fracaso o intolerancia a los inmunosupresores convencionales (tiopurínicos o metotrexato).
Por otra parte, vedolizumab ha demostrado ser un fármaco con un buen perfil de seguridad, sin haberse demostrado por el momento las complicaciones neurológicas (LMP) que se habían descrito previamente con otros fármacos que comparten un mecanismo de acción similar (inhibición de las integrinas), lo que probablemente se explica por la selectividad de vedolizumab sobre el tracto digestivo. Precisamente, esta selectividad podría suponer una ventaja sobre otros fármacos de efecto más inespecífico o sistémico, como los tiopurínicos, calcineurínicos o anti-TNF-α. Finalmente, la inmunogenicidad (esto es, la formación de anticuerpos frente a vedolizumab) parece ser infrecuente, posiblemente menor a la descrita con los fármacos anti-TNF-α.
En resumen, vedolizumab puede considerarse una opción prometedora para el tratamiento (inducción y, sobre todo, mantenimiento) de la CU moderada o grave. Su posición en el arsenal terapéutico con relación a los demás fármacos —en especial a los anti-TNF-α— no está aún establecida. Ello dependerá de la experiencia que se vaya acumulando con vedolizumab en cuanto a eficacia (incluyendo un mayor número de pacientes y un seguimiento más prolongado) y seguridad (si se confirma el favorable perfil de seguridad descrito hasta el momento). Por último, algunos aspectos relevantes deberán clarificarse en el futuro, como son la eficacia de vedolizumab en los pacientes con CU grave y corticorrefractaria, o el posible sinergia entre este fármaco y los inmunosupresores tradicionales.
Conflicto de interesesLos autores no han recibido ninguna remuneración por la redacción de este artículo y han actuado con total independencia en su elaboración, sin que ningún empleado de Takeda Farmacéutica España haya participado en la redacción del mismo. Takeda Pharmaceuticals international tuvo la oportunidad de revisar el manuscrito.
E. Domènech: asesoramiento científico, conferencias, soporte para investigación o actividades formativas: MSD, AbbVie, Takeda, Hospira, Kern Pharma, Ferring, Faes Farma, Shire Pharmaceuticals, Chiesi, Otsuka Pharmaceuticals, y Gebro Pharma.
J.P. Gisbert: asesoramiento científico, conferencias, soporte para investigación o actividades formativas: MSD, AbbVie, Takeda, Hospira, Kern Pharma, Pfizer, Janssen, Ferring, Faes Farma, Shire Pharmaceuticals, Chiesi, Laboratorios Casen Fleet, Otsuka Pharmaceutical, Uriach y Dr. Falk Pharma y Gebro Pharma.
Los autores agradecen a la Dra. Marta Pulido y a Nature Publishing Group Iberoamérica su ayuda para la redacción de este artículo, cuyo soporte editorial ha sido financiado por Takeda Farmacéutica España.