Los cambios cualitativos y cuantitativos en la microbiota intestinal juegan un papel muy importante en la cirrosis. El ser humano alberga cerca de 100 trillones de bacterias intestinales, representando así alrededor de 10 veces más células microbianas que eucariotas. El tracto gastrointestinal es el área de superficie más grande del cuerpo y se encuentra en constante exposición a estos microorganismos vivos. La simbiosis existente, demostrada por la falta de respuesta proinflamatoria contra bacterias comensales, implica la presencia de líneas de comunicación claramente definidas que contribuyen al mantenimiento de la homeostasis del hospedador. Así, las alteraciones en la flora intestinal parecen tener un papel en la patogénesis y la progresión de varias enfermedades hepáticas y gastrointestinales. Esto ha convertido su modificación selectiva en un área de interés terapéutico.
La traslocación bacteriana se define como el paso de bacterias y/o sus productos desde el intestino a los ganglios linfáticos mesentéricos. Por tanto, las alteraciones en la microbiota intestinal han mostrado su importancia, al menos parcialmente, en la patogénesis de varias complicaciones que surgen en la enfermedad hepática en fase terminal, tales como la encefalopatía hepática, la hipertensión portal y la peritonitis bacteriana espontánea.
En esta revisión se resume, por un lado, cómo la enfermedad hepática puede alterar la composición habitual de la microbiota intestinal, y por otro, cómo esta alteración contribuye al desarrollo de complicaciones en la cirrosis.
Qualitative and quantitative changes in gut microbiota play a very important role in cirrhosis. Humans harbour around 100 quintillion gut bacteria, thus representing around 10 times more microbial cells than eukaryotic ones. The gastrointestinal tract is the largest surface area in the body and it is subject to constant exposure to these living microorganisms. The existing symbiosis, proven by the lack of proinflammatory response against commensal bacteria, implies the presence of clearly defined communication lines that contribute to the maintenance of homeostasis of the host. Therefore, alterations of gut flora seem to play a role in the pathogenesis and progress of multiple liver and gastrointestinal diseases. This has made its selective modification into an area of high therapeutic interest.
Bacterial translocation is defined as the migration of bacteria or bacterial products from the intestines to the mesenteric lymph nodes. It follows that alteration in gut microbiota have shown importance, at least to some extent, in the pathogenesis of several complications arising from terminal liver disease, such as hepatic encephalopathy, portal hypertension and spontaneous bacterial peritonitis.
This review sums up, firstly, how liver disease can alter the common composition of gut microbiota, and secondly, how this alteration contributes to the development of complications in cirrhosis.
El intestino grueso es el entorno natural conocido más densamente poblado. Contiene aproximadamente 1014 células bacterianas1, lo que representa alrededor de 10 veces más células microbianas que células eucariotas. La microbiota intestinal es una población diversa de microorganismos vivos, de la que el 99,1% está constituida por aproximadamente unas 1.000 especies bacterianas diferentes2, altamente susceptibles a las alteraciones ambientales y fisiopatológicas3, mientras el resto lo constituyen mayoritariamente arqueas, con únicamente un 0,1% de origen eucariota y viral4. El genoma total de los microorganismos que forman parte de la microbiota, llamado microbioma (unos 60.000 genes), excede en unas 100 veces al genoma humano codificado5 y proporciona funciones que no han evolucionado en los seres humanos6. Por tanto, podemos considerar que nuestro genoma es la suma de nuestros genes y los que pertenecen a los billones de microorganismos que forman parte de nuestra microbiota7. La distribución de los microorganismos varía desde 10 hasta 102 bacterias/ml entre estómago y duodeno, de 102 a 108 bacterias/ml entre yeyuno e íleon, y de 1012-1013 bacterias/ml en el colon8.
La microbiota intestinal desempeña varias funciones importantes en la salud del hospedador, complementando sus necesidades nutricionales a través de la descomposición y absorción de hidratos de carbono complejos de la dieta que las enzimas humanas no pueden digerir, y sintetizando algunas sustancias esenciales, por ejemplo, la vitamina K9,10. Además, ayudan a mantener la integridad de la barrera del epitelio intestinal a través de la producción de ácidos grasos de cadena corta, como el butirato o el propionato. Los ácidos grasos de cadena corta constituyen la principal fuente de energía para las células epiteliales del colon, ayudan a la restitución epitelial11 y contribuyen a la maduración del sistema inmune del hospedador12. Además, estos organismos protegen al hospedador contra los microorganismos patógenos, compitiendo por los sitios de adhesión y nutrientes, y mediante la producción de agentes antimicrobianos.
La cirrosis se caracteriza por una distorsión histológica del hígado con presencia de nódulos regenerativos que provocan hipertensión portal. Este hecho, a su vez, altera la motilidad intestinal induciendo sobrecrecimiento bacteriano intestinal (SBI)13. En concreto, en pacientes con cirrosis existe un sobrecrecimiento de bacterias potencialmente patógenas (por ejemplo, especies gramnegativas) y un descenso en familias bacterianas autóctonas. La estrecha relación entre las complicaciones más frecuentes que surgen en los pacientes con cirrosis y la microbiota intestinal se ha estudiado intensamente en los últimos años y ha resaltado la importancia de la constante comunicación entre el intestino y el hígado en el manejo de pacientes con cirrosis14. Las complicaciones como la encefalopatía hepática (EH), la peritonitis bacteriana espontánea (PBE) y la hemorragia por varices en los pacientes cirróticos están directamente causadas o agravadas por la traslocación de flora entérica o sus productos a territorios extraintestinales.
Traslocación bacteriana en la cirrosisLas infecciones bacterianas son una complicación frecuente en los pacientes con cirrosis descompensada, con una incidencia en el momento del ingreso o durante la hospitalización de aproximadamente el 32% en el último estudio prospectivo15. De ellas, la PBE es la más frecuente, inducida en hasta un 70-80% de los casos por bacterias aerobias gramnegativas de origen entérico, principalmente Escherichia coli (E. coli) y Klebsiella pneumoniae16–18.
El mecanismo patogénico más común para explicar el paso de bacterias o de sus productos desde la luz intestinal hacia los ganglios linfáticos mesentéricos (GLM)19 y otras localizaciones extraintestinales se define como traslocación bacteriana (TB)19,20. Nuestro conocimiento de la patogenia de la TB se basa principalmente en estudios realizados en modelos experimentales, dada la dificultad obvia de obtener GLM de pacientes cirróticos. La TB se define como la presencia de un cultivo positivo en los GLM, y de acuerdo con este criterio está presente en aproximadamente el 50-60% de las ratas con cirrosis inducida por CCl4 y presencia de ascitis, mientras que este porcentaje se reduce al 0-10% en los animales control21. En los últimos años, el concepto de TB se ha ampliado para incluir no solo el paso de bacterias, sino también de sus productos20,22–25 a través de la barrera intestinal, siendo también capaces de generar una respuesta inmunitaria23,26–28. Uno de los experimentos que más claramente demuestran la traslocación de bacterias a GLM fue descrito por Teltschik et al. utilizando E. coli marcada con proteína verde fluorescente y administrada por vía oral a ratas con cirrosis. Las bacterias podían observarse no solo en la luz intestinal, sino también en los GLM y en líquido ascítico (LA)29.
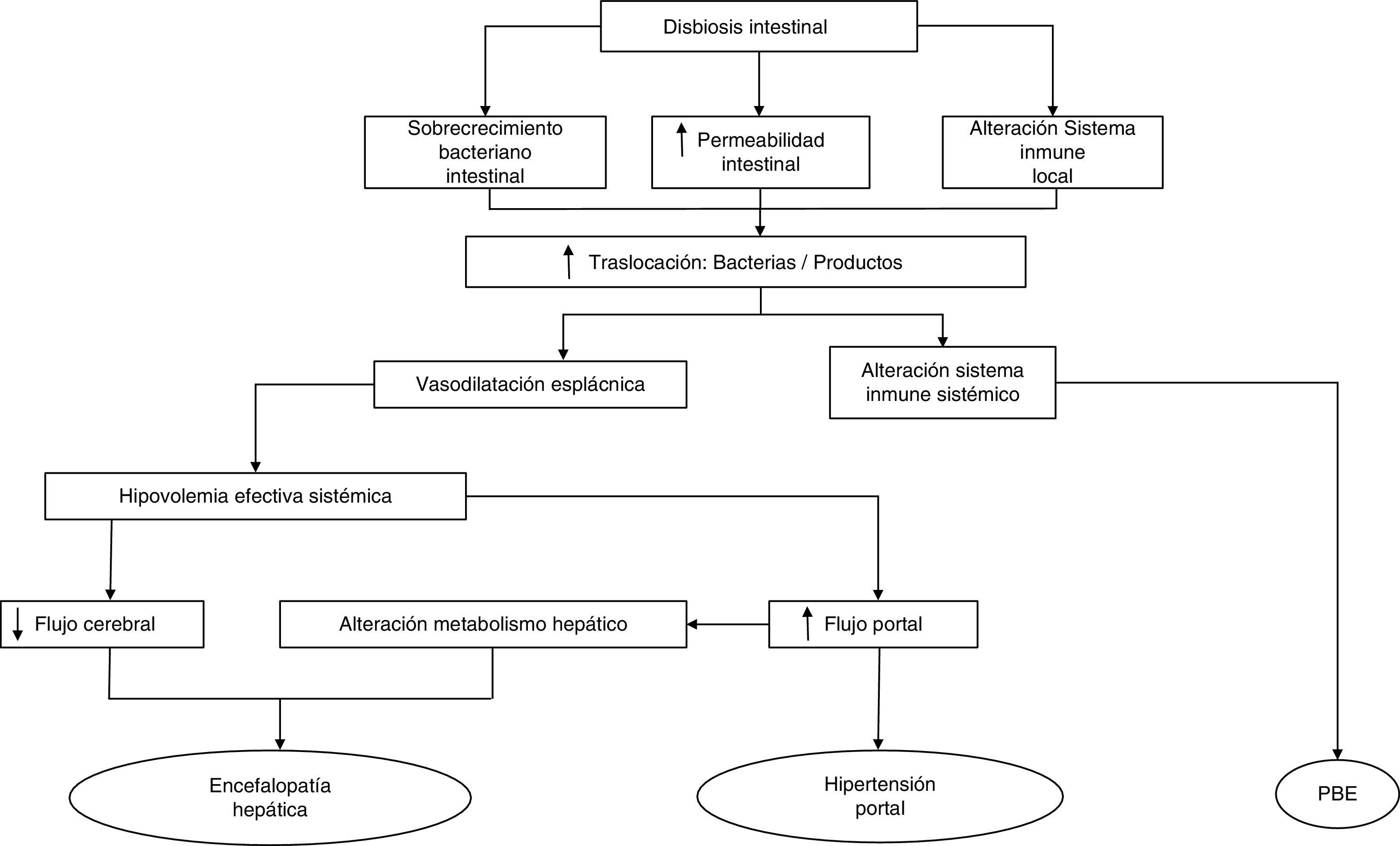
Los mecanismos que influyen en la patogenia de la TB son fundamentalmente el SBI, las alteraciones inmunológicas locales y sistémicas y un aumento de la permeabilidad intestinal30,31. Cualquiera de estas alteraciones trastorna el aclaramiento de bacterias endógenas de la circulación portal y sistémica, convirtiendo el intestino en la principal fuente de complicaciones bacterianas en la cirrosis (fig. 1). Por lo tanto, la comprensión de la fisiología de las interacciones de las bacterias intestinales y la patogénesis de la TB puede conducir a nuevas estrategias terapéuticas enfocadas a la modulación de la microbiota intestinal y dirigidas a mejorar o prevenir los episodios de BT y la inflamación en la cirrosis.
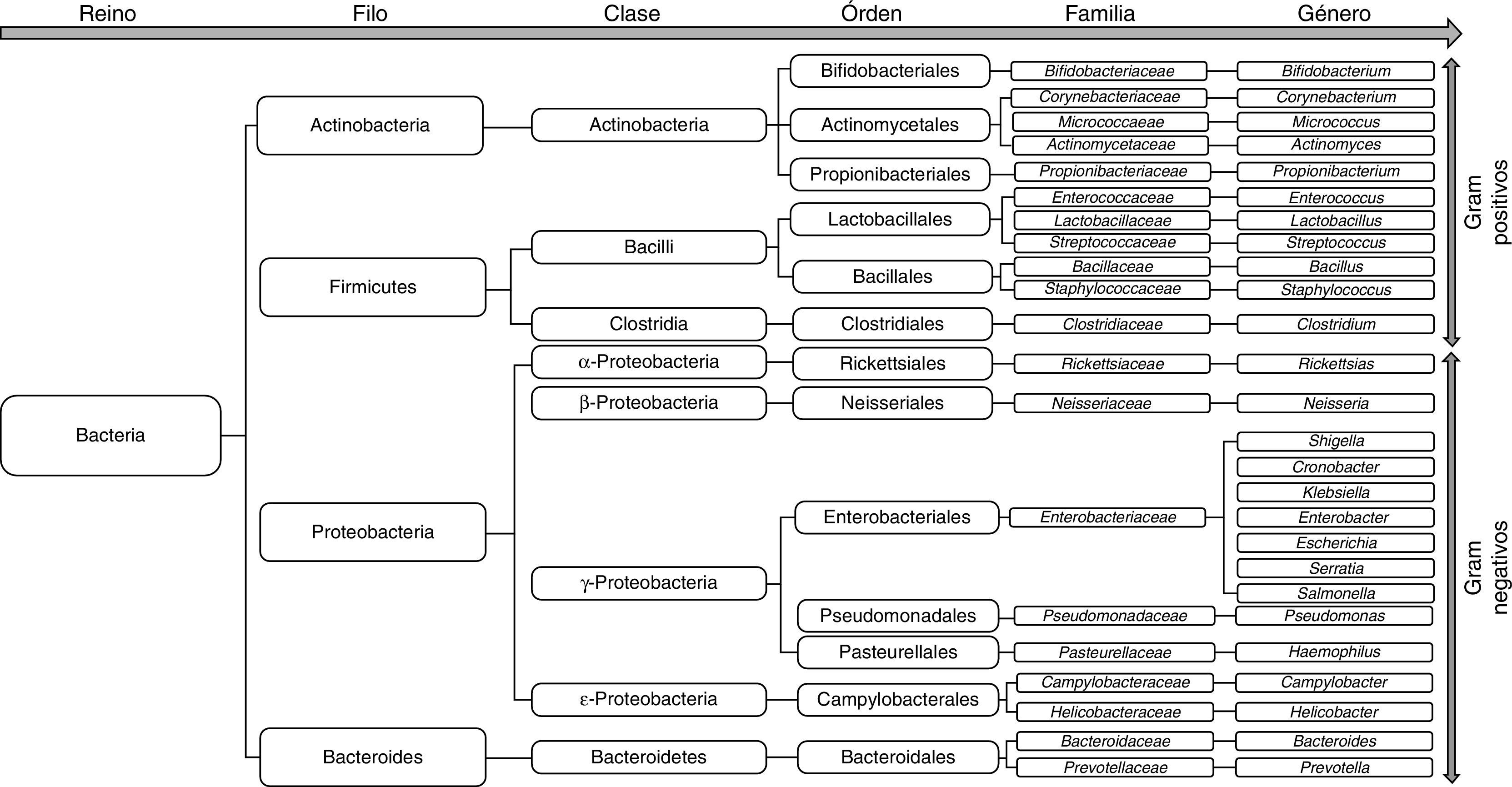
Cambios de la microbiota intestinal en la cirrosisLas especies bacterianas que constituyen la microbiota pertenecen en su mayoría a los phylum Firmicutes, Bacteroidetes, Proteobacterias y Actinobacterias32, siendo los 2 primeros los phylum predominantes en todos los vertebrados33 (fig. 2). Las bacterias gramnegativas aerobias traslocan con más frecuencia los GLM, incluso a través de un epitelio intestinal histológicamente intacto34,35, especialmente E. coli, Klebsiella pneumoniae, Pseudomonas aeruginosa y otras enterobacterias y enterococos35. Especies como E. coli son las que causan infecciones bacterianas en pacientes cirróticos con mayor frecuencia36–39. No obstante, los anaerobios superan en número a los aerobios en una proporción 100:1, limitando así la colonización y el crecimiento excesivo de otros microorganismos potencialmente invasores o patógenos. De hecho, la eliminación selectiva de las bacterias anaerobias facilita el SBI y la traslocación de bacterias facultativas40.
El SBI se describe como un incremento cuantitativo de la microbiota intestinal, y puede referirse tanto a la población global como a una especie bacteriana en concreto. Dicho SBI ha sido definido de forma arbitraria como>105UFC/ml y/o la presencia de bacterias colónicas en aspirado yeyunal superior41. Utilizando esta medida, la prevalencia de SBI en los pacientes con cirrosis varía de un 48 a un 73%42–46. En la cirrosis, el SBI es uno de los principales factores que promueven la TB, y la presencia de TB en GLM en modelos experimentales se asocia de forma rutinaria a un SBI30,47. Estudios experimentales han demostrado que en las ratas cirróticas con ascitis y TB el SBI es más frecuente que en animales sin TB47. Por el contrario, en ratas con ausencia de SBI, la TB ocurre raramente (0-11%) y es comparable a la observada en ratas control. Otro estudio, en esa ocasión en ratones, demostró que existía una relación directa entre la densidad y la composición de las bacterias presentes en un segmento del intestino y el número de bacterias viables de esta cepa presente en GLM48.
El SBI es más frecuente en los pacientes con daño hepático severo49 que en los sanos, especialmente en aquellos con una mayor insuficiencia hepática50 y con antecedentes de PBE51. Sin embargo, en estos estudios el SBI se estimó mediante el test del aliento, que no es un método completamente fiable para su diagnóstico30,44,46. Además, el hecho de que la TB esté presente en un 50% de las ratas sin SBI demuestra que otros factores además del SBI intervienen en su patogenia. Por ejemplo, en la lesión hepática inducida por etanol experimental, el aumento de TB se produce antes de los cambios en la flora intestinal52.
El SBI en la cirrosis se ha atribuido tradicionalmente a una disminución de la motilidad del intestino delgado y a un aumento del tiempo de tránsito intestinal43,51,53–55 debido, en parte, a un incremento de la actividad de la síntesis de óxido nítrico (NO)51 y del estrés oxidativo de la pared intestinal. Con independencia de las causas que lo originan, el defecto de tránsito parece relevante en estos pacientes ya que la administración de procinéticos, como cisaprida, reduce considerablemente la incidencia de SBI en pacientes y animales de experimentación46. Otros factores como la acidez gástrica, los defectos en la actividad inmune local de la mucosa intestinal y una disminución de las secreciones pancreatobiliares en el colon de pacientes con cirrosis parecen desencadenar un fallo en el control del crecimiento bacteriano intestinal56–58. Las implicaciones clínicas de este fallo están representadas por la existencia de TB patológica, un elevado riesgo de infecciones bacterianas y de la descompensación del daño hepático24. La asociación propuesta recientemente entre los inhibidores de la bomba de protones y el desarrollo de SBI44,59 y PBE60,61 se ha cuestionado en una gran cohorte de pacientes cirróticos62. Sin embargo, la hipoglucemia y la aclorhidria sí se han observado en pacientes con cirrosis, incluso sin tratamiento con inhibidores de la bomba de protones, resultando en un mayor pH en el intestino delgado que, bajo estas circunstancias, se ha asociado con SBI63.
Los pacientes con cirrosis están expuestos a un elevado riesgo de disbiosis debido a las interacciones patológicas entre el hígado y el tracto gastrointestinal. Cuando se altera la barrera ácido-gástrica, las bacterias orofaríngeas, incluyendo principalmente bacterias grampositivas (Streptococcus spp., Staphylococcus spp., Micrococcus spp., Lactobacillus spp., Neisseria spp., Veillonella spp., Corynebacterium spp., Actinomyces spp., Fusobacterium spp.), incrementan su número en el estómago, el duodeno y el yeyuno proximal. Al mismo tiempo, cuando el aclaramiento intestinal está dañado, debido a una reducción en la motilidad intestinal, la concentración de la microbiota colónica (incluyendo Enterobacteriaceae, Enterococcus spp., Pseudomonas spp., y Bacteroides spp.) aumenta en el intestino delgado43. Además, la disminución de ácidos biliares en el intestino favorece el sobrecrecimiento de miembros patogénicos del microbioma intestinal, incluyendo Porphyromonadaceae y Enterobacteriaceae64. De hecho, una publicación reciente de Kakiyama et al. proporciona evidencias sobre la baja entrada de ácidos biliares en el intestino como posible causa de la disbiosis en los pacientes con cirrosis65.
Utilizando técnicas de cultivo y pirosecuenciación del contenido fecal se ha podido identificar también un cambio cualitativo de la microbiota intestinal tanto en modelos animales de cirrosis como en la cirrosis humana66,67. El microbioma de la cirrosis se ha asociado con una disminución del phylum Lachnospiraceae (particularmente Clostridiae)67,68 y Bacteroidetes (principalmente la familia de Bacteroidaceae)67 y un aumento en el phylum Proteobacteria (principalmente la clase de Gammaproteobacteria y particularmente entre los Enterobacteriaceae)67,68. Curiosamente, la disminución de Clostridiae dio lugar a un aumento en la respuesta proinflamatoria68 y se correlacionó negativamente con la puntuación Child-Pugh67.
En un reciente estudio, Fouts et al.66 investigaron la dinámica de la enfermedad hepática, la TB y los cambios en el microbioma intestinal en un modelo de colestasis por ligadura del conducto biliar común y de daño hepático crónico por CCl4 en ratón. En dicho estudio se observó un aumento de la permeabilidad intestinal y la TB muy temprano tras la lesión hepática, así como un SBI de bacterias aerobias y anaerobias, evidente de forma temprana tras la ligadura del conducto biliar común. El microbioma tras la colestasis fue cualitativamente similar al de los ratones control, mientras que en el modelo de cirrosis por CCl4 se observó un aumento de Firmicutes y Actinobacteria. En este estudio se evidenciaba también que la TB precede a los cambios cualitativos y cuantitativos en la microflora intestinal en un modelo de daño hepático tóxico inducido por CCl4, como sucede en el modelo de esteatohepatitis alcohólica52.
También recientemente, un estudio realizado por Qin et al.69 elaboró un catálogo de genes de la microbiota intestinal de muestras de pacientes con cirrosis y controles sanos. Bacteroidetes y Firmicutes fueron los phylum de microorganismos más comunes en ambos grupos de estudio. Sin embargo, en los pacientes con cirrosis había menos Bacteroides, y estaban aumentadas las proporciones de Veillonella, Streptococcus, Clostridium y Prevotella en comparación con los controles, planteando la posibilidad de que la alteración de la microbiota podría tener un papel como causa de la cirrosis. Además, en este estudio los autores seleccionaron 15 genes microbianos como biomarcadores para crear un índice de discriminación entre pacientes con cirrosis y controles.
Consecuencias clínicas de los cambios en el microbioma de los pacientes cirróticosEl curso clínico de la cirrosis se complica frecuentemente con el desarrollo de hemorragias gastrointestinales, EH, insuficiencia renal, o PBE, dando lugar a un empeoramiento de la función hepática y a un peor pronóstico de los pacientes. Las alteraciones en el microbioma intestinal también pueden influir en el desarrollo y la evolución de dichas complicaciones70. Un estudio reciente documentó un cambio en el cociente entre la flora autóctona y no autóctona en pacientes con cirrosis. Dicha ratio fue más alta en los pacientes control (2,05), seguida de la relativa a los pacientes con cirrosis compensada (0,89) y descompensada (0,66) (p<0,0001), y este cociente se correlacionó negativamente con los valores de endotoxina71. Por lo tanto, es importante comprender el perfil de estos microorganismos con el fin de desarrollar estrategias para modificar la evolución de la enfermedad.
Encefalopatía hepáticaLa EH es una enfermedad neuropsiquiátrica grave y progresiva que se presenta en pacientes con cirrosis avanzada. Está presente en un 25% de los pacientes con fallo hepático agudo72, y está asociada a una menor supervivencia73,74.
Varios estudios muestran que la microbiota intestinal se encuentra alterada en pacientes cirróticos con EH. Más específicamente, se ha descrito un cambio cuantitativo en la relación de Bacteroides/Firmicutes con la prevalencia de bacterias potencialmente patógenas (Enterobacteriaceae y Streptococcaceae)67,75, y la reducción de poblaciones beneficiosas (Lachnospiraceae)75. Liu et al.76 demostraron un sobrecrecimiento significativo de E. coli y Staphylococcal spp. potencialmente patógenos en la microbiota intestinal de los pacientes cirróticos con EH mínima. Otros estudios han demostrado que los pacientes con cirrosis y EH poseen una mayor concentración de Enterobacteriaceae y Alcaligenaceae en comparación con los sujetos control y pacientes cirróticos sin EH75. Este estudio muestra, además, que familias bacterianas específicas (Alcaligenaceae, Porphyromonadaceae, Enterobacteriaceae) están fuertemente asociadas con la función cognitiva y la inflamación en la EH75. Bajaj et al. estudiaron también la relación entre la microbiota intestinal, la inflamación y la función cognitiva en pacientes75,77,78. El aumento en la cantidad de bacterias de la familia Alcaligenaceae se asoció significativamente con un mal rendimiento cognitivo, mientras que el aumento en el número de bacterias de la familia Enterobacteriaceae se asoció con el empeoramiento en la inflamación en el grupo de pacientes con cirrosis. El grupo Alcaligenaceae lo constituyen proteobacterias que degradan la urea para producir amonio, lo que puede explicar su asociación con una peor función cognitiva79. Por último, en los pacientes con EH existen marcadores de la respuesta inmune altamente correlacionados con componentes del microbioma intestinal, indicando una posible sinergia entre la inflamación, la función cognitiva y cambios en el microbioma80,81.
Se ha demostrado que algunos probióticos y la lactulosa son efectivos en la profilaxis secundaria de la EH, con una menor incidencia de diarrea y distensión abdominal en el caso del uso de probióticos82. De hecho, la lactulosa tiene un efecto prebiótico sobre la flora intestinal83, ya que incrementa la población de Bifidobacterium. En un estudio reciente84, pacientes con cirrosis que se habían recuperado de un episodio de EH el mes anterior fueron distribuidos al azar para tomar VSL#3 o placebo durante 6 meses. Este estudio mostró una mejora en la función hepática y una reducción en los niveles de marcadores proinflamatorios en pacientes que recibieron probióticos, quizás a causa de una reducción en la tasa de TB debida a la disbiosis causada, aunque los autores no midieron en este trabajo ningún indicador de TB.
Hipertensión portalLa vasodilatación arterial esplácnica es el factor principal en la patogénesis del síndrome circulatorio hiperdinámico que ocurre en pacientes con cirrosis e hipertensión portal85–87. Su causa principal es el aumento en la síntesis y la liberación de NO, un potente vasodilatador, por parte de las formas endotelial e inducible de la NO sintasa en la circulación esplácnica. Si bien la activación de la forma endotelial de la NO sintasa se debe principalmente al esfuerzo constante, la activación de la forma inducible se ha asociado con la exposición a bacterias y sus productos y con un aumento de la liberación de NO23, que a su vez agrava aún más la alteración circulatoria presente en la cirrosis88,89. El TNF-a también parece estar involucrado en la patogénesis de este síndrome90,91. En respuesta a la hipertensión portal se desarrollan varices esofágicas, clínicamente relevantes debido a su riesgo de rotura y sangrado, con una mortalidad del 30% por episodio, y alcanzando una probabilidad de resangrado de un 30-40% en las primeras 6 semanas si no existe un tratamiento adecuado.
Las alteraciones hemodinámicas en la cirrosis parecen ser consecuencia de la disbiosis intestinal y la migración de bacterias comensales a la cavidad intestinal y la circulación sistémica92. Las citocinas proinflamatorias contribuyen a una circulación hiperdinámica, hipertensión portal93, daño en la función hepática y alteraciones en la coagulación57. Existe una relación causal entre la inflamación provocada por la TB y la hipertensión portal, demostrada en estudios con modelos animales en los que la administración de ADN bacteriano o LPS desencadena un aumento de la presión portal94. En un trabajo realizado en pacientes con cirrosis, estos recibieron al azar una descontaminación intestinal selectiva con norfloxacino (400mg/2 veces al día) o placebo95. En este trabajo, solo los pacientes tratados con antibiótico mostraron una mejora en la circulación hiperdinámica. La capacidad de norfloxacino para alterar de forma selectiva la microbiota intestinal parece ser responsable de los cambios hemodinámicos vistos en los pacientes. Estos resultados demuestran indirectamente la relación entre la disbiosis intestinal, el estado proinflamatorio provocado por la TB y el empeoramiento de la hipertensión portal. En otro estudio reciente, la investigación se realizó con rifaximina, un antibiótico oral no absorbible, y los autores encontraron resultados similares, reduciendo la presión portal y la fibrosis in vivo en comparación con el grupo no tratado96. En este trabajo los autores utilizaron un modelo de ratón knock-out para TLR4, incapaz, por tanto, de activar la vía TLR4 en respuesta a LPS. En estos animales, la exposición a LPS no se reflejó en cambios en la presión portal, angiogénesis, fibrosis o estado inflamatorio de los animales, evidenciando que el efecto de rifaximina en la inflamación hepática y la hipertensión portal está mediado por una disminución en la regulación de la vía TLR4 como resultado de una disminución de la traslocación de bacterias gramnegativas.
Peritonitis bacteriana espontáneaLa PBE es la infección del LA en ausencia de cualquier otra fuente de infección intraabdominal primaria, y se considera que está presente si el recuento de neutrófilos en LA es superior a 250 por microlitro97, ya sea con cultivo microbiológico positivo o negativo18,98. Los pacientes con daño hepático crónico tienen un SBI y una elevada tasa de TB, evidenciado por un aumento en la presencia de ADN bacteriano22 y de anticuerpos antimicrobianos99 en su circulación. La bacteriemia y el aumento en la traslocación de productos bacterianos a la circulación hepatoesplácnica y sistémica provocan un aumento en la respuesta proinflamatoria que, sumado al fallo en el control de la TB por parte del hospedador y al aumento en la susceptibilidad de este, determinan el daño de órganos lejanos al intestino. La permeabilidad intestinal también está alterada en pacientes cirróticos con ascitis, historia de PBE y elevado Child-Pugh100.
Inmediatamente después de diagnosticar la PBE en pacientes en los que existe sospecha clínica se debe comenzar una terapia intravenosa de amplio espectro. La PBE se trata generalmente con cefalosporinas de tercera generación, como cefotaxima, durante 5 días101–104. En un ensayo aleatorizado y controlado se ha demostrado que ofloxacino oral es tan efectivo como cefotaxima intravenosa en un subgrupo de pacientes con PBE y ausencia de otros factores de riesgo39. Los pacientes que sobreviven a un episodio de PBE tienen una recurrencia en un año de alrededor de un 70%. En este sentido, la descontaminación intestinal selectiva de la microbiota gramnegativa con norfloxacino reduce el riesgo de la recurrencia de PBE a un 20% en 2 años105. Igualmente, nuestro grupo ha demostrado tanto en pacientes con cirrosis como en modelos experimentales la reducción de la tasa de traslocación de productos bacterianos por parte de norfloxacino26,106, así como su efecto modulador directo sobre la respuesta inflamatoria asociada a la TB68,107. Sin embargo, se ha descrito un aumento en la frecuencia de infecciones debidas a bacterias resistentes a las quinolonas (tanto gramnegativas como grampositivas) y bacterias multirresistentes en pacientes que han sido tratados con norfloxacino, y este hecho se ha asociado con un fallo en el control de la infección por parte de la terapia antibiótica y un aumento en la mortalidad108.
Existen estudios que evalúan terapias alternativas al uso de norfloxacino en pacientes con cirrosis con riesgo de sufrir un episodio de PBE. Por ejemplo, en un modelo experimental de ratas con cirrosis inducida por administración oral de CCl4, la administración de trimetoprim-sulfametoxazol retrasó el desarrollo de ascitis y la incidencia en la traslocación de bacterias gramnegativas109, suponiendo una buena alternativa a norfloxacino. Las citocinas proinflamatorias están involucradas en el proceso de TB. La administración de anti-TNF disminuye significativamente la TB en un modelo de rata con cirrosis110. Sin embargo, este enfoque para disminuir la respuesta proinflamatoria no se ha continuado para estudiar el riesgo de infecciones. La pentoxifilina es también un fármaco anti-TNF con una eficacia similar a norfloxacino en la prevención de TB y PBE en ratas con cirrosis y ascitis111 inducida por CCl4. Este hecho está en consonancia con un estudio experimental en cirrosis experimental inducida por CCl4 en ratas, que demuestra que un estrés oxidativo prolongado en el intestino, acompañado de cambios en la composición de la microbiota intestinal, puede facilitar la traslocación a través de la mucosa, resultando en complicaciones como la PBE112. De hecho, la administración de pentoxifilina, pero no de norfloxacino, disminuye el estrés oxidativo en la mucosa cecal.
Existen numerosos estudios enfocados hacia la prevención o la disminución de la tasa de TB mediante la modificación de la microbiota intestinal con probióticos, tanto en modelos experimentales como en pacientes con PBE. Sin embargo, los resultados aún son contradictorios. En un modelo experimental de rata con cirrosis y ascitis113, Lactobacillus strain GG fue incapaz de prevenir tanto la TB como la infección del LA. En otro estudio que utilizaba Lactobacillus johnsonii La1 con antioxidantes114 en ratas con cirrosis inducida con CCl4, disminuyó el porcentaje de TB y el número de enterobacterias intestinales comparado con las ratas control no tratadas, si bien posteriormente el mismo grupo describió que la eliminación del antioxidante hacía desaparecer este efecto115. Además, se realizó un estudio doble ciego en pacientes con cirrosis que se habían recuperado de un episodio previo de PBE o que tenían un alto riesgo de presentarla116, a quienes se les administró norfloxacino (400mg/día) con cápsulas de probióticos (Enterococcus faecalis, Clostridium butyricum, Bacillus mesentericus JPC, Bacillus coagulans) o norfloxacino con placebo, y se determinó la existencia de episodios de PBE en un período de 6 meses. Los resultados fueron similares en ambos grupos, cuestionando la eficacia de la adición de los probióticos. Por otro lado, el uso de Bifidobacterium pseudocatenulatum CECT7765 ha mostrado un efecto beneficioso en la reducción de la permeabilidad de la barrera intestinal y de la TB en un modelo experimental de cirrosis117. En un reciente estudio con un modelo experimental de ratas con cirrosis inducida por CCl4, la administración de VSL#3118 disminuyó la tasa de TB y el estado proinflamatorio, aumentando la expresión de ocludina en íleon, evidenciando que la administración del probiótico mejora la integridad de la barrera intestinal.
ConclusionesLa importancia de la interacción entre el intestino y el hígado en el desarrollo de complicaciones de tipo bacteriano en la cirrosis ha sido claramente demostrada. Los cambios en la composición de la microbiota alteran la homeostasis intestinal, favoreciendo la traslocación de antígenos bacterianos que inducen una respuesta proinflamatoria, dañando los mecanismos de defensa del hospedador y facilitando la producción de mediadores solubles que complican la enfermedad hepática.
El uso de antibióticos sigue siendo una estrategia eficaz para la gestión de estas complicaciones. Sin embargo, están surgiendo otras alternativas en el intento de evitar el impacto adverso de la terapia antibiótica sobre la composición y la función de la microbiota, dada su importancia en mantener la homeostasis intestinal. Estas estrategias incluyen el uso de formulaciones previas, probióticos o simbióticos, y el trasplante fecal experimental destinado a restablecer dicha homeostasis en pacientes con cirrosis descompensada. Sin embargo, en contraste con la abundante evidencia clínica de la eficacia y seguridad del uso de antibióticos en estos pacientes, los datos disponibles sobre la eficacia de estas otras estrategias provienen principalmente de estudios experimentales individuales119.
Una comprensión más profunda de las alteraciones en la microbiota intestinal y de su influencia en la inmunobiología del hospedador permitirá, en los próximos años, mejorar distintas estrategias que permitan la implementación de tratamientos más personalizados para el manejo de la enfermedad hepática crónica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.