Las enfermedades vasculares hepáticas, a pesar de su relativamente baja prevalencia, representan un problema de salud importante en el campo de las enfermedades hepáticas. Una característica común a muchas de estas enfermedades es que pueden causar hipertensión portal, con la elevada morbimortalidad que ello conlleva. Con frecuencia estas enfermedades se diagnostican en pacientes jóvenes y el retraso en su diagnóstico y/o un tratamiento inadecuado pueden reducir de forma importante la esperanza de vida.
El presente artículo revisa la evidencia actual en el síndrome de Budd-Chiari, la trombosis venosa portal en pacientes no cirróticos, la hipertensión portal idiopática, el síndrome de obstrucción sinusoidal, las malformaciones vasculares hepáticas en la telangiectasia hemorrágica hereditaria, la trombosis portal en la cirrosis, otras patologías vasculares menos frecuentes como las fístulas arterioportales, así como un apartado sobre el diagnóstico por imagen de las enfermedades vasculares hepáticas y su tratamiento desde el punto de vista hematológico (estudio de la diátesis trombótica y tratamiento anticoagulante). Las recomendaciones se han realizado de acuerdo a los estudios publicados extraídos de Pubmed. La calidad de la evidencia y la intensidad de las recomendaciones fueron graduadas de acuerdo al sistema Grading of Recommendations Assessment Development and Evaluation (GRADE). Cuando no existían evidencias suficientes, las recomendaciones se basaron en la opinión del comité que redactó la guía.
Despite their relatively low prevalence, vascular diseases of the liver represent a significant health problem in the field of liver disease. A common characteristic shared by many such diseases is their propensity to cause portal hypertension together with increased morbidity and mortality. These diseases are often diagnosed in young patients and their delayed diagnosis and/or inappropriate treatment can greatly reduce life expectancy.
This article reviews the current body of evidence concerning Budd-Chiari syndrome, non-cirrhotic portal vein thrombosis, idiopathic portal hypertension, sinusoidal obstruction syndrome, hepatic vascular malformations in hereditary haemorrhagic telangiectasia, cirrhotic portal vein thrombosis and other rarer vascular diseases including arterioportal fistulas. It also includes a section on the diagnostic imaging of vascular diseases of the liver and their treatment from a haematological standpoint (study of thrombotic diathesis and anticoagulation therapy). All recommendations are based on published studies extracted from PubMed. The quality of evidence and strength of recommendations were rated in accordance with the GRADE system (Grading of Recommendations, Assessment Development and Evaluation). In the absence of sufficient evidence, recommendations were based on the opinion of the committee that produced the guide.
Las enfermedades vasculares hepáticas, a pesar de su relativamente baja prevalencia (menos de 5/10.000 pacientes), representan un problema de salud importante en el campo de las enfermedades hepáticas. Una característica común a muchas de estas enfermedades es que pueden causar hipertensión portal (HTP), con la elevada morbimortalidad que ello conlleva. Con frecuencia estas enfermedades se diagnostican en pacientes jóvenes, y el retraso en su diagnóstico y/o un tratamiento inadecuado pueden reducir de forma importante la esperanza de vida.
El avance en el conocimiento de estas enfermedades viene dificultado por el número reducido de estudios dirigidos a evaluar su historia natural, fisiopatología o tratamiento. Sin embargo, recientemente ha aumentado el interés por estas enfermedades, como demuestra el aumento en el número de publicaciones sobre el tema observado en los últimos años.
El presente artículo revisa la evidencia actual en el síndrome de Budd-Chiari, la trombosis venosa portal en pacientes no cirróticos, la HTP idiopática, el síndrome de obstrucción sinusoidal, las malformaciones vasculares hepáticas en la telangiectasia hemorrágica hereditaria, la trombosis portal en la cirrosis, otras patologías vasculares menos frecuentes, como las fístulas arterioportales, así como un apartado sobre el diagnóstico por imagen de las enfermedades vasculares hepáticas y su tratamiento desde el punto de vista hematológico (estudio de la diátesis trombótica y tratamiento anticoagulante). Las recomendaciones se han realizado de acuerdo a los estudios publicados extraídos de Pubmed. La calidad de la evidencia y la intensidad de las recomendaciones fueron graduadas de acuerdo al sistema Grading of Recommendations Assessment Development and Evaluation (GRADE). El grado de evidencia se clasificó en tres niveles de calidad: alto (A), moderado (B) o bajo (C). La intensidad de la recomendación se clasificó en dos niveles: fuerte (1) o débil (2) (tabla 1). Cuando no existían evidencias suficientes, las recomendaciones se basaron en la opinión del comité que redactó la guía.
Grados de evidencia y recomendación (adaptado del sistema GRADE)
| Descripción | Símbolo | |
|---|---|---|
| Grados de evidencia | ||
| Alta | Es muy improbable que investigaciones adicionales cambien nuestra confianza en la estimación del efecto | A |
| Moderada | Es probable que investigaciones adicionales tengan un impacto importante en nuestra confianza en la estimación del efecto y puedan cambiar la estimación | B |
| Baja o muy baja | Es muy probable que investigaciones adicionales tengan un impacto importante en nuestra confianza en la estimación del efecto por lo que es probable que esta cambie. Cualquier estimación del efecto es incierta | C |
| Grado de recomendación | ||
| Fuerte | La evidencia existente indica que los beneficios superan a los riesgos y costos o viceversa, por lo que la recomendación es aplicable a la mayoría de los pacientes | 1 |
| Débil | La recomendación se hace con menos certeza: existe un mayor costo o consumo de recursos y el equilibrio entre estos y los beneficios es más frágil o incierto. Cualquier alternativa puede ser igualmente razonable | 2 |
El síndrome de Budd-Chiari (SBC) se define como la obstrucción a la salida del flujo venoso hepático. Esta obstrucción puede localizarse desde las pequeñas vénulas hepáticas hasta la entrada de la vena cava inferior a la aurícula derecha. No se incluye en esta definición la obstrucción producida por una enfermedad cardiaca, por una enfermedad del pericardio o por un síndrome de obstrucción sinusoidal (anteriormente denominada enfermedad veno-oclusiva), ya que estas entidades tienen un comportamiento y pronóstico específico1. El SBC se clasifica como primario cuando la obstrucción es debida a un proceso primario (trombosis venosa) y como secundario cuando hay una compresión o una invasión de las venas suprahepáticas y/o de la vena cava inferior por una lesión que se origina fuera de las venas (p.ej., una neoplasia). El objeto de las presentes recomendaciones es el SBC primario.
EpidemiologíaExiste una gran variabilidad geográfica en la incidencia del SBC. Así, se ha estimado una incidencia anual de 0,36 casos por millón de habitantes en Francia, 0,8 en Suecia y 0,13 en Japón2-4. Los estudios sugieren que en los países occidentales el SBC es más frecuente en mujeres entre la tercera y cuarta décadas de la vida5,6. Sin embargo, en Asia hay un discreto predominio en hombres, con una edad media de 45años en el momento del diagnóstico. En Occidente es más común la obstrucción aislada de venas suprahepáticas, mientras que en Asia predomina la obstrucción combinada de la vena cava inferior y las venas suprahepáticas6,7.
Una de las series más extensas publicadas en Occidente incluyó 237 pacientes con SBC diagnosticados entre 1984 y 20017. Dos tercios de los pacientes eran mujeres, y la mediana de edad fue de 35años (oscilando entre 13 y 76años). La localización más frecuente de la obstrucción fue en las venas suprahepáticas (62%), seguida de la vena cava inferior (7%), o en ambas (31%); 34 pacientes (14%) presentaron además trombosis de la vena porta.
Manifestaciones clínicasLa presentación clínica del SBC es diversa y puede variar desde un cuadro de fallo hepático agudo con ictericia y encefalopatía hepática hasta cuadros asintomáticos6. La presentación depende de la extensión y de la velocidad de instauración de la trombosis. La alteración en las transaminasas y en el resto de parámetros de función hepática también es variable en intensidad y patrón. En un amplio estudio prospectivo multicéntrico en el momento del diagnóstico, un 83% de pacientes presentaban ascitis, un 67% hepatomegalia, un 61% tenían dolor abdominal, un 58% varices esofagogástricas y un 5% sangrado gastrointestinal8.
En aproximadamente el 5% de los pacientes el SBC puede presentarse con carácter fulminante1,8-11. En formas agudas no fulminantes, el SBC suele manifestarse con dolor abdominal y ascitis importante, las aminotransferasas pueden oscilar desde 100-200UI/ml hasta más de 600UI/ml y la fosfatasa alcalina oscila entre 2-3 veces el valor normal. La bilirrubina no suele aumentar a cifras que ocasionen ictericia. En formas subagudas el inicio es insidioso y se manifiesta con ascitis y escasa necrosis hepática. En el SBC crónico los pacientes se diagnostican por la presencia de estigmas de hepatopatía crónica y complicaciones de la HTP. Estos pacientes pueden presentar niveles normales o levemente elevados de aminotransferasas, fosfatasa alcalina y bilirrubina sérica12. También pueden presentar hipoalbuminemia. El síndrome hepatopulmonar se ha descrito en más del 28% de estos pacientes si se busca intencionadamente13.
La concentración de proteínas en líquido ascítico es variable, y aunque suele ser más elevada que en la cirrosis (entre 1,5 y 4,9g/dl)13, el gradiente de proteínas plasma-ascitis es elevado (>1,1).
Durante su evolución, los pacientes con SBC crónico pueden desarrollar hepatocarcinoma con una incidencia acumulada del 4% tras una mediana de seguimiento de 5 años14.
DiagnósticoDada la gran heterogeneidad en su forma de presentación, debe considerarse el diagnóstico de SBC en cualquier paciente con fallo hepático agudo, hepatitis aguda o enfermedad hepática crónica.
Habitualmente, el diagnóstico de SBC se puede establecer de forma no invasiva con ultrasonografía Doppler, la cual tiene una sensibilidad diagnóstica mayor del 75%15. También se debe valorar la permeabilidad del eje esplenoportal, ya que puede coexistir trombosis portal o esplénica en más del 10% de los casos. Si no se dispone de un ecografista experimentado, se puede utilizar la tomografía computarizada o la resonancia magnética para confirmar el diagnóstico y planificar el tratamiento. Estas dos exploraciones se pueden realizar también cuando la ecografía es aparentemente normal pero la sospecha de SBC es elevada15. Los posibles hallazgos en estas diferentes técnicas son descritos en el capítulo correspondiente.
Si las exploraciones no invasivas son negativas o no diagnósticas pero existe una fuerte sospecha clínica de SBC, la venografía hepática puede ayudar en el diagnóstico al confirmar la imagen de obstrucción de la vena con o sin el típico patrón de colaterales intrahepáticas «imagen en tela de araña».
La biopsia hepática no es necesaria para el diagnóstico de SBC. Sin embargo, puede ser el único método para establecer el diagnóstico en aquellos casos en los que exclusivamente están trombosadas las pequeñas venas hepáticas. La biopsia hepática puede además ayudar para decidir el tratamiento más adecuado cuando hay fallo hepático, dado que si este se debe a congestión hepática, el paciente se puede beneficiar de una técnica derivativa, mientras que si el fallo hepático se debe a cirrosis, el paciente se beneficiará de un trasplante hepático16,17. Hay que tener en cuenta el riesgo de sangrado en estos pacientes, particularmente si están en tratamiento anticoagulante. Este riesgo es menor si la biopsia se realiza por vía transyugular.
Estudio etiológico en el síndrome de Budd-ChiariEn más del 80% de los pacientes con SBC se identifica una enfermedad subyacente8,13,18-23, y una cuarta parte de los mismos presentan más de un factor de riesgo trombótico.
Hasta en un 50% de pacientes se diagnostica una neoplasia mieloproliferativa (policitemia vera, trombocitemia esencial o mielofibrosis primaria)7. El diagnóstico de los mismos en muchas ocasiones no es evidente a partir del análisis de sangre periférica por la presencia de HTP, esplenomegalia e hiperesplenismo que enmascaran los aumentos esperados en los parámetros del hemograma. Sin embargo, la posibilidad de determinar la presencia de la mutación JAK2V617F (presente en un 95% de los pacientes con policitemia vera y en aproximadamente el 50% de los pacientes con trombocitemia esencial o mielofibrosis primaria) ha facilitado su diagnóstico24,25. Recientemente se ha publicado la presencia de mutaciones de la calreticulina (CALR)26-29 en pacientes con trombosis venosa esplácnica, siendo positiva entre un 0,7 un 1,9% de los pacientes. La mutación JAK2 y la CALR son mutuamente exclusivas.
Aproximadamente el 20% de los casos de SBC ocurren en mujeres que están tomando anticonceptivos orales, están embarazadas o han dado a luz en los 2meses previos30-34. En muchas de estas pacientes, el estudio exhaustivo de una potencial causa trombofílica pone de manifiesto un estado de hipercoagulabilidad específica de forma que el embarazo o el uso de anticonceptivos actuarían como causa desencadenante. En la tabla 2 se resumen las condiciones protrombóticas que se han descrito como causa de SBC y su prevalencia.
Factores etiológicos en el síndrome de Budd-Chiari y en la trombosis portal
| Factor de riesgo | SBC, frecuencia (%) | TP, frecuencia (%) |
|---|---|---|
| Trombofilia hereditaria | 21 | 35 |
| Trombofilia adquirida | 44 | 19 |
| Neoplasias mieloproliferativas (JAK2+) | 49 (29) | 21 (16) |
| Factores hormonales | 38 | 44 |
| Anticonceptivos orales | 3 | 44 |
| Embarazo | 6 | 0 |
| Hemoglobinuria paroxística nocturna | 19 | 0 |
| Otros factores sistémicos | 23 | SD |
| Factores locales | 0 | 21 |
SBC: síndrome de Budd-Chiari; TP: trombosis portal; SD: sin datos.
El SBC sintomático sin tratamiento tiene una mortalidad cercana al 90% a los 3años de seguimiento35. La causa de muerte más frecuente es la ascitis refractaria con desnutrición, sangrado digestivo y fallo hepático. En la actualidad y con la introducción de las nuevas estrategias de tratamiento, el pronóstico ha mejorado de forma muy significativa. En una serie reciente que incluyó 163 pacientes con SBC tratados utilizando una estrategia escalonada de tratamiento de menor a mayor agresividad, la supervivencia a 1, 2 y 5años fue del 87, del 82 y del 74%, respectivamente8.
Se han descrito diferentes parámetros o combinaciones de parámetros capaces de predecir el pronóstico en los pacientes con SBC7,35-37. A pesar de que todos estos índices son válidos para la evaluación de la supervivencia libre de trasplante y la supervivencia libre de terapia invasiva, su exactitud predictiva para un paciente concreto no es lo suficientemente elevada como para ser útil en la personalización del tratamiento38. Por otra parte, el desarrollo de hepatocarcinoma o la progresión de la enfermedad hematológica pueden modificar el pronóstico del SBC.
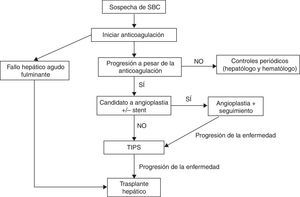
TratamientoNo existen estudios aleatorizados que comparen diferentes estrategias terapéuticas en pacientes con SBC, por lo que las recomendaciones se basan en estudios retrospectivos y en la experiencia clínica. La estrategia terapéutica ha cambiado con los años; mientras que antes de 1990 el tratamiento era o bien médico o bien quirúrgico, en la actualidad los tratamientos mediante técnicas de radiología intervencionista tienen una eficacia muy elevada, por lo que son los más frecuentemente utilizados. Actualmente se recomienda un tratamiento escalonado, empezando por el tratamiento médico, progresando a estrategias más invasivas ante la falta de respuesta al tratamiento previo39-41.
Es importante señalar que los objetivos del tratamiento del SBC son varios: 1)reconocer y tratar el estado protrombótico subyacente; 2)aliviar la congestión hepática para minimizar el impacto sobre la función hepática y la aparición de HTP, y 3)tratar las complicaciones derivadas del desarrollo de HTP.
AnticoagulaciónEl tratamiento anticoagulante ha de iniciarse tan pronto como sea posible y de modo indefinido para prevenir la aparición de nuevos fenómenos de re-trombosis. Habitualmente se utiliza acenocumarol o warfarina debido a la comodidad de su administración oral, y se recomienda alcanzar una razón internacional normalizada (INR) entre 2-3 de un modo sostenido. La anticoagulación se debe realizar incluso en los pacientes asintomáticos e independientemente de otros tratamientos específicos de la enfermedad protrombótica subyacente41.
Corrección de la obstrucción al flujoTrombólisis químicaPretende recanalizar la vena trombosada. La experiencia con esta técnica es muy limitada y solo se ha propuesto para aquellos pacientes diagnosticados en las primeras 72h de evolución. El activador tisular del plasminógeno o la estreptoquinasa son los agentes más utilizados. Puede realizarse de forma local o sistémica. La forma local permite una mayor concentración de sustancia trombolítica en la zona del trombo, pero los efectos secundarios son similares a si se utiliza la vía sistémica. La técnica debe evitarse si se ha llevado a cabo cualquier procedimiento invasivo, incluida la paracentesis, en las 24h previas42,43.
Angioplastia con o sin colocación de prótesisEn pacientes con estenosis segmentarias, parciales y cortas de las venas suprahepáticas está indicada la angioplastia por vía transvenosa o percutánea en un intento de restablecer el drenaje fisiológico de las venas44,45. El principal inconveniente es que con frecuencia aparecen reestenosis que obligan a nuevas dilataciones, hecho que puede ser evitado con la colocación de prótesis expandibles.
Tratamiento derivativo- a)
Cirugía. La intención de la cirugía es convertir la vena porta en un conducto de drenaje del hígado congestivo. Las dos técnicas posibles son la anastomosis porto-cava latero-lateral y la anastomosis meso-cava (no la porto-cava termino-lateral, ya que esta no sirve de drenaje del hígado). Se suele preferir la anastomosis meso-cava, ya que es técnicamente más sencilla cuando existe hipertrofia del lóbulo caudado. Cuando esta compresión es relevante (se ha sugerido cuando crea un gradiente de presión superior a 20mmHg) la anastomosis no es efectiva. En estos casos, en la era anterior a la implantación de derivación portosistémica percutánea (TIPS) se había propuesto la colocación de una prótesis expandible en la vena cava a nivel de la compresión y/o la realización de anastomosis directas entre la vena mesentérica y la aurícula (meso-atriales). Existen pocos datos sobre la eficacia de la cirugía en el SBC, pero parece que no consigue aumentar la supervivencia, debido a la elevada mortalidad perioperatoria (próxima al 25%) y el alto riesgo de trombosis de la derivación. No obstante, en los pacientes que superan el momento agudo el pronóstico con cirugía suele ser excelente46-48. La cirugía en la actualidad ha quedado relegada a los escasos casos en los que los tratamientos endovasculares no son posibles.
- b)
Derivación portosistémica percutánea (TIPS). El TIPS (de su acrónimo en inglés transjugular intrahepatic portosystemic shunt) es en la actualidad el tratamiento derivativo de elección en el SBC36,49,50. Hasta una tercera parte de los pacientes con SBC acaban precisando un TIPS8. Ofrece claras ventajas sobre la cirugía por su menor morbimortalidad y por la menor complejidad técnica, ya que, en manos expertas, es posible su realización hasta en el 90% de los casos. En el 45% de los casos no se consigue canular ninguna vena suprahepática y se debe acceder a una rama portal directamente desde la vena cava intrahepática. El TIPS, además, permite superar uno de los escollos de la cirugía como es la hipertrofia del lóbulo caudado. Se deben utilizar prótesis recubiertas, ya que disminuyen el riesgo de re-trombosis y disfunción.
En pacientes donde la derivación no es posible, está contraindicada o presentan cirrosis con o sin insuficiencia hepática grave, se debe valorar la posibilidad de un trasplante hepático51. Aunque hasta en un 11% puede haber una recurrencia de la enfermedad, esta es excepcional si se reinicia precozmente la anticoagulación tras el trasplante. Por otro lado, existen trastornos de la hemostasia protrombóticos que, al ser factores de síntesis hepática, desaparecen tras el trasplante.
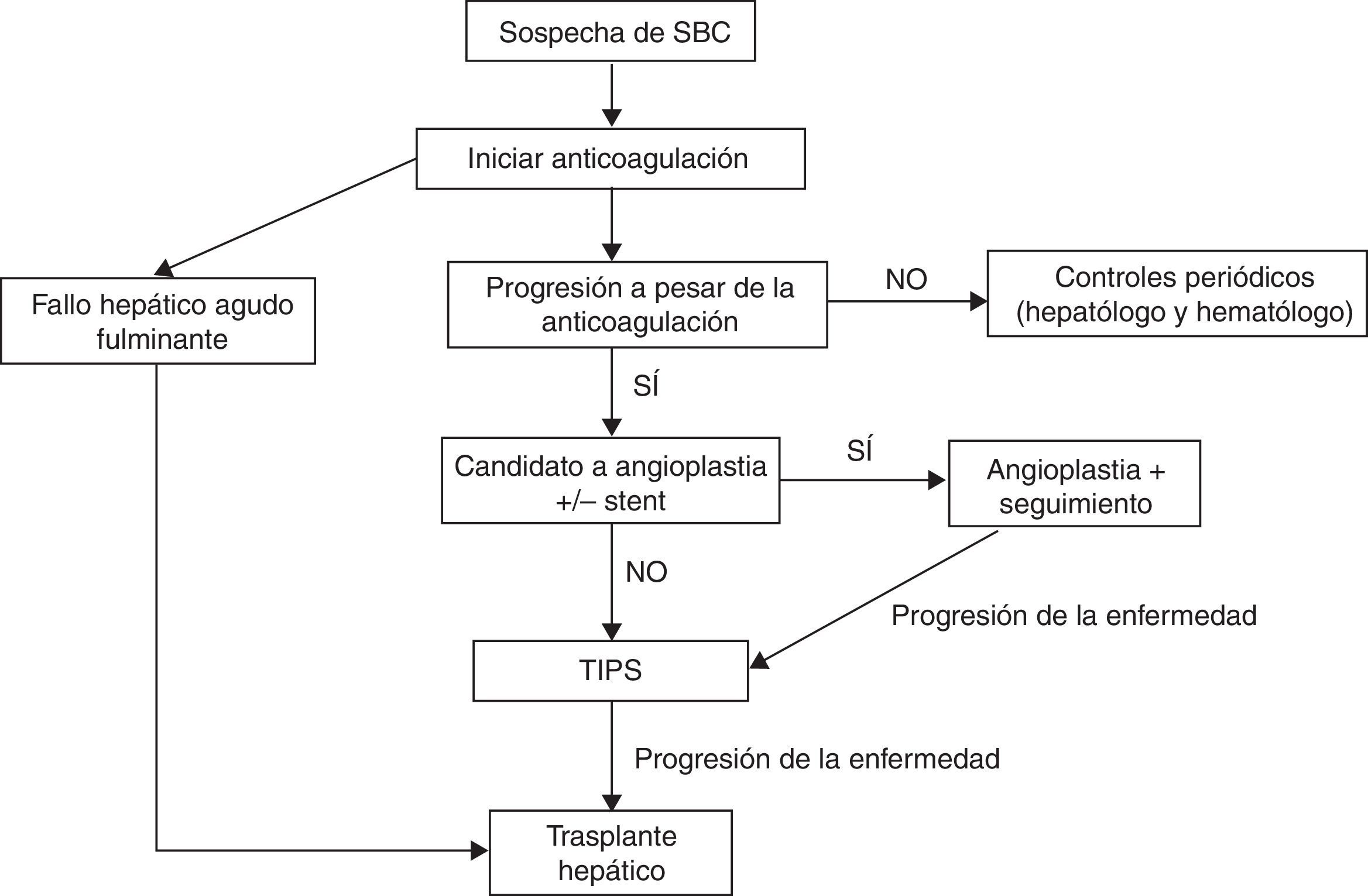
A pesar de que en varios estudios se ha demostrado la validez de un tratamiento escalonado del SBC (fig. 1)38,51, se ha sugerido que en los pacientes sintomáticos se pueda realizar un tratamiento más agresivo desde el comienzo, con la finalidad de evitar la progresión de la enfermedad hepática por congestión venosa. No obstante, actualmente no existen datos sólidos que sustenten dicha sugerencia.
SeguimientoLos pacientes con SBC deben ser monitorizados para descartar la aparición de complicaciones derivadas de la progresión de la enfermedad, incluyendo varices esofagogástricas o un hepatocarcinoma, con una periodicidad igual que en los pacientes con cirrosis12. Asimismo, se debe monitorizar la posibilidad de transformación de la neoplasia mieloproliferativa subyacente.
Recomendaciones- •
Se debe considerar el diagnóstico de SBC ante cualquier paciente con enfermedad hepática aguda o crónica, ya esté sintomático o asintomático (A1).
- •
La ecografía Doppler es el método diagnóstico de elección. La angio-RM y la angio-TC se pueden utilizar para confirmar el diagnóstico, especialmente si la ecografía no es diagnóstica y el grado de sospecha de la enfermedad es elevado (A1).
- •
Se recomienda derivar a los pacientes con SBC a centros de referencia para su diagnóstico y tratamiento (A1).
- •
En todos los pacientes con SBC se debe investigar la presencia de factores protrombóticos. La identificación de un factor aislado no descarta la posibilidad de que existan otros (A1). Para descartar la existencia de una neoplasia mieloproliferativa crónica (NMC) se recomienda determinar la mutación JAK2V617F (A1). Si esta es negativa, se recomienda determinar la mutación del gen de la calreticulina. Si el paciente tiene o se sospecha una NMC se debe remitir al paciente a un hematólogo (B2).
- •
Se debe tratar específicamente el factor protrombótico predisponente (B1).
- •
En los pacientes con SBC en fase de cirrosis se deben tratar las complicaciones derivadas de la HTP (C2).
- •
Se recomienda el tratamiento con anticoagulantes en todos los pacientes con SBC (A1). Las complicaciones derivadas de la HTP, si están correctamente tratadas, no contraindican la anticoagulación (B1).
- •
Se debe considerar la interrupción transitoria de la anticoagulación ante cualquier procedimiento invasivo, incluyendo la paracentesis (B1).
- •
Se recomienda considerar la angioplastia con o sin colocación de prótesis como procedimiento descompresivo de primera línea en los pacientes con una estenosis corta de las venas suprahepáticas o de la vena cava inferior (A1).
- •
Los pacientes que no respondan al tratamiento médico inicial o a la angioplastia con o sin prótesis se deben tratar con técnicas derivativas (A1). Para detectar precozmente el fallo de estos tratamientos se debe realizar un seguimiento estrecho. El tratamiento derivativo de elección es el TIPS con prótesis recubierta (A1). Si el TIPS fracasa o no se puede llevar a cabo, se sugiere considerar la realización de una derivación quirúrgica (B1).
- •
El trasplante hepático es el tratamiento de rescate para los pacientes en quienes han fracasado los tratamientos derivativos (A1), tanto en situación de fallo hepático agudo como crónico. Muchos pacientes deben continuar con el tratamiento anticoagulante después del trasplante hepático.
- •
En los pacientes con SBC se debe hacer seguimiento para descartar la aparición de hepatocarcinoma. Puesto que la diferenciación entre nódulos benignos y malignos no suele ser fácil y puede requerir de biopsia, se recomienda que sea realizado en centros de referencia (A1).
El diagnóstico de hipertensión portal idiopática (HTPI) debe considerarse cuando existe HTP en ausencia de cirrosis y se han descartado otras causas de HTP no cirrótica52.
La nomenclatura de esta entidad ha sido muy ambigua y ha dificultado el avance en el conocimiento de su etiopatogenia. Durante años ha recibido distintas denominaciones, como esclerosis hepatoportal, fibrosis portal no cirrótica, HTPI, cirrosis septal incompleta e hiperplasia nodular regenerativa. Se ha sugerido que el cuadro de HTPI sería la punta sintomática de un iceberg en la que un número mucho más importante de pacientes asintomáticos tendrían lesiones histológicas compatibles con la esclerosis hepatoportal en la que un número importante de estos pacientes nunca desarrollarían el cuadro clínico sintomático.
La epidemiología de esta entidad es desconocida; no obstante, existe un predominio de sexo masculino, con una edad media de presentación a los 40años, aunque también se ha descrito de forma excepcional en niños53-55.
Los principales factores etiológicos identificados asociados al desarrollo de HTPI son trastornos inmunológicos, infecciones, virus de la inmunodeficiencia humana y/o sus tratamientos, fármacos (azatioprina) y toxinas, predisposición genética y trombofilia. En los países occidentales se ha descrito una prevalencia de trastorno trombofílico subyacente hasta en el 40% en los pacientes con HTPI52,53. Se ha postulado una base genética para la enfermedad. La presencia de las mutaciones en el gen DGUOK56 y en el KCNN357 se ha descrito recientemente en pacientes con HTPI; sin embargo, se necesita más información para poder establecer dicha asociación causal.
Manifestaciones clínicasEn el momento del diagnóstico de HTPI la mayoría de los pacientes presentan signos o complicaciones de la HTP52. La hemorragia secundaria a HTP, principalmente por varices esofágicas, es la manifestación inicial más frecuente58. La esplenomegalia es un dato comúnmente observado en pacientes con HTPI, en mayor frecuencia que en otras causas de HTP como cirrosis y trombosis portal53. Habitualmente, los pacientes presentan una función hepática conservada en el momento del diagnóstico; solo en una minoría se objetiva un deterioro de la misma, y este suele acontecer en el contexto de procesos intercurrentes. La aparición de ascitis, aunque rara, es un factor de mal pronóstico52. La aparición de encefalopatía hepática es muy infrecuente y suele deberse a presencia de grandes colaterales porto-sistémicas59. En un estudio español reciente en el que se evaluaron 69 pacientes con HTPI, el 58% de ellos estaban asintomáticos en el momento del diagnóstico, siendo la detección de trombocitopenia y esplenomegalia los principales motivos del diagnóstico de HTPI60.
DiagnósticoNo existe en la actualidad una prueba diagnóstica que pueda considerarse como patrón de oro para el diagnóstico de HTPI, que pasa por la exclusión de otras causas de HTP (tabla 3). Frecuentemente, a los pacientes con HTPI se les considera erróneamente que tienen cirrosis hepática, debido a la presencia de un hígado nodular en las pruebas de imagen conjuntamente con signos de HTP53,61. La realización de una elastografía hepática puede ser de utilidad para la sospecha del diagnóstico de HTPI. Un valor bajo de elastografía hepática (<12kPa) en un paciente con signos claros de HTP debe hacernos sospechar el diagnóstico de HTPI52,62. Un estudio español reciente ha identificado el análisis metabolómico de muestras séricas como una potencial herramienta para ayudar en el diagnóstico de HTPI63.
Criterios diagnósticos de la hipertensión portal idiopática
| 1. Presencia de signos clínicos de hipertensión portal |
| Esplenomegalia/hiperesplenismoa |
| Varices esofágicas |
| Ascitis |
| Gradiente de presión venosa mínimamente elevada |
| Presencia de colaterales portales |
| 2. Exclusión de cirrosis mediante biopsia hepáticab |
| 3. Exclusión de enfermedades hepáticas crónicas que ocasionen cirrosis o hipertensión portal no cirrótica |
| Hepatitis crónica por VHB o VHC |
| Esteatohepatitis no alcohólica/Esteatohepatitis alcohólica |
| Hepatitis autoinmune |
| Hemocromatosis hereditaria |
| Enfermedad de Wilson |
| Colangitis biliar primaria/Colangitis esclerosante primaria |
| 4. Exclusión de enfermedades causantes de hipertensión portal no cirrótica |
| Fibrosis hepática congénita |
| Sarcoidosis |
| Esquistosomiasis |
| 5. Vena porta y hepática permeable (por ecografía-Doppler o TC abdominal) |
Para realizar el diagnóstico de HTPI se deben cumplir todos los criterios. Cuando se cumplan todos los criterios excepto el número 5, pero existan datos en la biopsia característicamente asociados a HTPI, se considerará como HTPI probable.
Hoy en día, la biopsia hepática continúa siendo esencial para establecer el diagnóstico de HTPI. El dato fundamental es que excluya la presencia de cirrosis. Además, revisadas por patólogos expertos, existen algunas alteraciones que, si bien no son patognomónicas, apoyan el diagnóstico. Entre estas, fleboesclerosis, regeneración nodular, dilatación sinusoidal, anastomosis venosas para-portales y fibrosis perisinusoidal53,61. Se ha sugerido que la fleboesclerosis es la lesión inicial que origina los cambios hemodinámicos intrahepáticos. De esta manera, la posible obliteración de las vénulas portales condicionaría una alteración de la circulación intrahepática y, en consecuencia, una remodelación del parénquima (regeneración nodular), con atrofia hepatocitaria de las zonas con flujo venoso disminuido e hiperplasia compensadora en las zonas mejor perfundidas.
Para poder llegar al diagnóstico correcto es importante obtener una biopsia hepática de alta calidad y gran tamaño para poder detectar estos cambios, a veces mínimos.
Historia naturalLa mortalidad por complicaciones de la HTP, principalmente hemorragia variceal, en los pacientes con HTPI es significativamente menor que la descrita en los pacientes cirróticos52,53, probablemente debido a que la mayoría de pacientes con HTPI mantienen una función hepática conservada. Sin embargo, en los casos en que se evidencia deterioro progresivo de la función hepática el trasplante hepático puede llegar a ser necesario59,61. Se postula que en la evolución desfavorable de la enfermedad se podría implicar un factor precipitante o una causa adicional de daño hepático53. El deterioro de la función hepática y la aparición de ascitis podrían explicarse por una reducción en el flujo portal y, consecuentemente, una atrofia del parénquima hepático periférico52.
Se ha descrito una elevada incidencia de trombosis venosa portal en los pacientes con HTPI53. En estos casos, el inicio precoz de anticoagulación es capaz de conseguir la recanalización hasta en el 54% de los pacientes60.
Los pacientes con HTPI desarrollan con frecuencia nódulos hepáticos, la mayoría de ellos benignos; sin embargo, hay que tener en cuenta que también se ha descrito de forma anecdótica la aparición de hepatocarcinoma. Actualmente, y según los datos disponibles, el cribado del carcinoma hepatocelular no puede recomendarse de forma rutinaria en los pacientes con HTPI52. Aunque en estos pacientes un nódulo pueda presentar las características radiológicas de hepatocarcinoma, este diagnóstico no puede establecerse, ya que estos criterios solo están validados en el hígado cirrótico.
En general la mortalidad por causa hepática es baja y el impacto en la reducción de la supervivencia de los pacientes con HTPI suele ser debido a la alta mortalidad de los trastornos subyacentes asociados61.
TratamientoProfilaxis de la hemorragia gastrointestinalLa recomendación actual es el manejo de estos pacientes siguiendo las mismas recomendaciones que para los pacientes con cirrosis, aunque los datos específicos en pacientes con HTPI son escasos.
Tratamiento endoscópicoEl tratamiento endoscópico es eficaz en el control de la hemorragia aguda en el 95% de los casos64 y como profilaxis secundaria en pacientes con HTPI65. No existen datos sobre la eficacia de la ligadura de varices en estos pacientes, sin embargo, la superioridad de este tratamiento frente a la esclerosis de varices en los pacientes cirróticos apoya la utilización de la ligadura en los pacientes con HTPI con varices.
Betabloqueantes no selectivosA pesar de la ausencia de datos específicos sobre la eficacia de los betabloqueantes no selectivos en pacientes con HTPI, la gran evidencia sobre su beneficio en pacientes con cirrosis justifica su uso en HTPI.
Derivación portosistémicaEl TIPS ha demostrado recientemente ser una excelente opción para el tratamiento de la hemorragia refractaria en los pacientes con HTPI66. Aunque poco frecuente debido a la función hepática conservada en la mayoría de los casos, el tratamiento derivativo incrementa el riesgo de aparición de encefalopatía hepática, sobre todo en el subgrupo de pacientes con trombosis portal66. La anastomosis portosistémica quirúrgica es una estrategia segura en pacientes con HTPI67, pero el TIPS, debido a su menor invasividad, ha de considerarse como la opción de primera elección.
AnticoagulaciónNo hay datos suficientes que apoyen la utilización del tratamiento anticoagulante para la prevención de la trombosis en pacientes con HTPI. La recomendación actual queda relegada a pacientes que desarrollen trombosis portal y/o tengan una clara alteración protrombótica subyacente.
Trasplante hepáticoEn los pacientes con deterioro progresivo de la función hepática y complicaciones intratables de la HTP debe considerarse el trasplante hepático53,59,61.
Recomendaciones- •
Se debe considerar el diagnóstico de HTPI en los pacientes con signos de HTP una vez excluidas la cirrosis y otras causas específicas de HTP (B1).
- •
La biopsia hepática es necesaria para el diagnóstico de HTPI (A1).
- •
El manejo de las complicaciones de la HTP debe seguir las recomendaciones establecidas para la cirrosis (B1).
- •
Se recomienda evaluar el posible desarrollo de trombosis portal cada 6meses (B1).
- •
Los pacientes con HTPI pueden desarrollar nódulos hepáticos que mayoritariamente, pero no siempre, son benignos (C).
- •
Se puede considerar el trasplante hepático en los pacientes con HTPI que desarrollen insuficiencia hepática o complicaciones intratables de la HTP (B1).
La trombosis portal (TP) se define como la presencia de trombosis en el tronco venoso portal o en las ramas intrahepáticas, que se puede extender a la vena esplénica, a la mesentérica o a ambas. Cuando ya se ha formado un cavernoma se denomina TP crónica, tratándose de una fase evolutiva de la misma entidad. La incidencia de TP de cualquier etiología es de 0,7 por 100.000 habitantes/año, y la prevalencia, de 3,5 por 100.000 habitantes68, constituyendo la principal causa de HTP prehepática69.
Manifestaciones clínicas e historia naturalLos síntomas de la TP varían según se diagnostique en fase aguda o crónica y dependen de la velocidad de formación de la trombosis, la extensión de esta y el desarrollo de complicaciones secundarias.
Trombosis portal agudaEl síntoma principal es el dolor abdominal (90-95%), cuya presentación es muy variable, abarcando desde un cuadro inespecífico de dispepsia hasta la aparición de abdomen agudo, incluso con isquemia intestinal, cuando las venas mesentéricas están afectadas. Esta es la principal causa de mortalidad, por lo que ante un cuadro de dolor abdominal intenso, con ausencia de irritación peritoneal, en ocasiones con diarrea y rectorragia, con datos analíticos sugestivos (acidosis metabólica, aumento de LDH y/o lactato) e insuficiencia renal o respiratoria, se debe completar el estudio con técnicas de imagen (angio-TC) y solicitar una valoración quirúrgica de forma precoz70-73. Otros posibles síntomas son la fiebre (aproximadamente 50%), ocasionalmente con síndrome de respuesta inflamatoria sistémica en ausencia de sepsis, y la ascitis (35%), que suele ser escasa, habitualmente detectada en pruebas de imagen. Por último, existe una proporción no despreciable de pacientes en quienes la TP cursa de forma asintomática o con clínica inespecífica en los que el episodio agudo pasa desapercibido y se diagnostican en fase de cavernomatosis portal1,74,75.
La TP aguda séptica (pileflebitis) se presenta habitualmente como un síndrome febril, con malestar, náuseas, dolor abdominal y en ocasiones shock con o sin abscesos hepáticos, que aparece asociado al cuadro infeccioso abdominal causal: apendicitis, diverticulitis, colitis, colangitis, colecistitis o colecistopancreatitis. Es esencial obtener hemocultivos, que son positivos en el 45-77%. La presencia de gas portal es un dato radiológico específico, aunque poco frecuente76-78.
Trombosis portal crónicaEn esta etapa el paciente suele permanecer asintomático. Cuando se presentan síntomas, estos vienen derivados del desarrollo de HTP o de la existencia de colangiopatía portal. El síntoma más frecuente asociado a HTP es la hemorragia por varices esofagogástricas, que suele ser mejor tolerada que en otras formas de HTP, probablemente por la buena función hepática. Los factores predictivos de sangrado son el tamaño de las varices y el antecedente de hemorragia previa1,74. Puede aparecer anemia ferropénica o sangrado por gastropatía de la HTP o por varices ectópicas (duodenales, anorrectales, perivesiculares, árbol biliar) que son más frecuentes que en otras causas de HTP, pero cuyo sangrado es infrecuente74,79. La ascitis, cuando aparece, suele ser de fácil tratamiento75,78,80 y suele asociarse a factores desencadenantes, como la hemorragia digestiva alta o la infección. De forma muy infrecuente se ha descrito encefalopatía hepática74, siendo posible la presencia de encefalopatía hepática mínima81.
DiagnósticoLa ecografía Doppler es la primera prueba a realizar ante la sospecha de TP, la cual debe efectuarse por personal experto, ya que es una técnica dependiente del explorador. Su sensibilidad es del 89-94% y su especificidad del 92-96%82-84. Los hallazgos de esta exploración se señalan en el apartado de radiología. Es esencial realizar angio-TC y/o angio-RM en el momento del diagnóstico para valorar la extensión de la trombosis y estudiar su posible etiología. Igualmente, se deben utilizar estas técnicas para llegar al diagnóstico de TP en pacientes con alta sospecha clínica y ausencia de datos ecográficos compatibles1,41,72,74,85-87. Se debe tener en cuenta que pueden aparecer fenómenos de re-trombosis aguda en pacientes con una cavernomatosis portal conocida, los cuales suelen ser de más difícil diagnóstico.
Puede aparecer ascitis en la fase aguda, aunque en este caso forma parte del proceso inflamatorio de la TP aguda, y por lo tanto suele ser escasa y transitoria80. La esplenomegalia puede ser secundaria a la HTP establecida o a una neoplasia mieloproliferativa crónica como patología protrombótica causal73,75,78,80.
Las pruebas de función hepática suelen ser normales o levemente alteradas de forma transitoria1,74,79,88.
Diagnóstico etiológico de la trombosis portalEl diagnóstico etiológico de la TP es esencial, ya que puede modificar la actitud terapéutica. Las causas incluyen factores trombofílicos adquiridos o hereditarios, factores locales y otros posibles desencadenantes menos frecuentes en nuestro medio1,41,75,79,88-92. En el 75-81% de los casos es posible encontrar al menos un factor protrombótico, y en el 18-36% se ha descrito la presencia de dos factores; así pues, solamente se consideran como idiopáticos un 18-25% de los casos75,91,92. Recientemente se ha incluido la obesidad central como un factor asociado a la TP idiopática93.
Por lo tanto, es preciso realizar un estudio etiológico exhaustivo con la colaboración de un especialista en hematología, incluyendo la valoración detallada de antecedentes personales y familiares de fenómenos de tromboembolismo venoso, descrita en el 14 y en el 24% de los casos, respectivamente75.
Los trastornos mieloproliferativos son la causa más frecuentemente descrita. La evaluación en sangre periférica puede estar condicionada por la hemodilución e hiperesplenismo asociados a la presencia de HTP, por lo que sistemáticamente debe solicitarse la mutación del gen JAK2V617F; si este es negativo, estudiar la mutación somática del gen de la calreticulina (CALR), y si ambos son negativos se debe valorar la punción de médula ósea, además de considerar repetir la determinación de manera evolutiva (tabla 2)1,41,75,79,88-93. En niños se ha valorado el origen congénito de la cavernomatosis portal como una posible etiología74.
Diagnóstico de las complicaciones de la trombosis portalVarices esofagogástricas y gastropatía de la hipertensión portalUn estudio publicado recientemente ha evaluado la historia natural de las varices esofagogástricas en pacientes con TP no cirrótica. Este trabajo objetiva que en el momento del diagnóstico de la TP el 66% de los pacientes tienen varices esofagogástricas (19% varices esofágicas pequeñas, 40% varices esofágicas grandes y 7% varices gástricas aisladas). En el 34% de pacientes sin varices esofágicas la probabilidad de desarrollar varices es del 2, del 22 y del 22% a los 1, 3 y 5años. La presencia de ascitis y la esplenomegalia se identificaron como factores independientes del riesgo de desarrollar varices. La probabilidad de crecimiento de las varices esofágicas pequeñas en el momento del diagnóstico fue del 13, del 40 y del 54% a los 1, 3 y 5años, mientras que la probabilidad de hemorragia por varices esofagogástricas en pacientes en profilaxis primaria fue del 9, del 20 y del 32% a los 1, 3 y 5años. Finalmente, la mortalidad secundaria a hemorragia por varices esofagogástricas fue del 0,7%. El estudio concluye que el curso evolutivo de las varices en la TP no cirrótica es similar al de los pacientes con cirrosis hepática, lo que apoya realizar el mismo seguimiento en ambas entidades94. Pueden formarse varices esofagogástricas desde el primer mes desde el diagnóstico de TP aguda sintomática)80; por lo tanto, debe realizarse una endoscopia digestiva alta de forma precoz (a los 2-3meses del episodio de TP), y debe repetirse a los 6-9meses si no hay varices o estas son pequeñas, especialmente en ausencia de recanalización. Posteriormente se seguirá el esquema habitualmente empleado en la cirrosis, con endoscopia cada 2-3años en pacientes sin varices y cada 1-2años en pacientes con varices pequeñas1,72,87,94.
Colangiopatía portalLa patogenia de la colangiopatía portal (CP) no está completamente aclarada. Algunos autores señalan que la TP crónica y la transformación cavernomatosa ocasionan isquemia en los conductos biliares, si bien la teoría más aceptada defiende que las colaterales periportales que componen el cavernoma pueden ejercer suficiente presión sobre la vía biliar como para provocar cuadros de colestasis y, en ocasiones, verdaderas estenosis de la vía biliar. La mayoría de los casos de CP se asocian a TP crónica extrahepática (81-100%), si bien esta entidad también puede aparecer en pacientes con marcada HTP sin trombosis, ya sea de origen cirrótico (0-33%) o idiopático (9-40%)95. Respecto a la presentación clínica, la mayoría de los pacientes están asintomáticos. En la serie de casos de CP más numerosa publicada hasta la fecha, que incluye 67 pacientes, solo el 21% presentaron síntomas, siendo los más frecuentes el dolor abdominal, la ictericia y la colangitis aguda. Los autores de este trabajo proponen una clasificación de la CP en función de los hallazgos radiológicos (gradoi: angulaciones en el tracto biliar; gradoii: estenosis sin dilatación; gradoiii, estenosis con dilatación) y observan que solo los casos con estenosis y dilatación biliar (gradoiii) presentan sintomatología. El intervalo de tiempo medio transcurrido entre el episodio de TP y la aparición de síntomas relacionados con la CP fue de 42 y 118meses en los casos de TP aguda y crónica, respectivamente. Existen casos descritos en la literatura médica con periodos de latencia superiores a 10años96.
La colangio-RM es la técnica de elección para el diagnóstico y la clasificación de esta entidad87,96,97. Existen dos clasificaciones de la CP: una anatómica, centrada en el tipo de lesión biliar98, y otra que muestra una correlación clínico-radiológica que permite aunar características morfológicas con sintomatología, ya que solo los pacientes con lesiones gradoiii presentan complicaciones biliares96. En nuestro medio, dados los resultados de esta serie española, se recomienda que si en la colangio-RM inicial no existe CP gradoiii, no se produce repermeabilización portal y no existen fenómenos de re-trombosis, debe repetirse la exploración a los 12meses del estudio inicial, sin precisar más exploraciones posteriores debido a la precocidad con la que se produce esta entidad tras la formación de la TP y la baja probabilidad de progresión tras este periodo87,89,96.
TratamientoEl tratamiento de la TP tiene como objetivo revertir o prevenir el avance de la trombosis en el sistema venoso portal y tratar las complicaciones. Asimismo, es imprescindible el tratamiento de la enfermedad de base asociada, si la hubiese. La mayoría de las decisiones deben ser individualizadas, dependiendo de la experiencia local, dado que no hay ensayos clínicos controlados.
Trombosis portal agudaAnticoagulaciónLos estudios que han evaluado la eficacia de la anticoagulación en la TP aguda indican que la recanalización completa y parcial se obtiene alrededor del 40 y del 22%, respectivamente75,80. La posibilidad de recanalización asciende hasta el 69% si la anticoagulación se inicia en la primera semana desde el inicio de los síntomas, en comparación con solo el 25% si se inicia tardíamente80, siendo la repermeabilización espontánea infrecuente75,78,99. Por este motivo, la anticoagulación debe iniciarse de forma precoz en todos los pacientes, salvo que exista contraindicación75,78,80. Es importante señalar que la recanalización de la vena porta no solo previene el desarrollo de HTP80,100, con el consiguiente impacto en el pronóstico, sino que además minimiza el riesgo de aparición de complicaciones graves, como la peritonitis debida a necrosis intestinal por isquemia80. Los factores predictivos de fallo de la recanalización a pesar de la anticoagulación son la presencia de ascitis (incluso grado1), la extensión de la trombosis a la vena esplénica, la presencia de varios factores protrombóticos y el retraso en el inicio de la anticoagulación75,80. La duración de la anticoagulación no está bien definida. Sin embargo, en un estudio multicéntrico reciente se objetiva recanalización de la vena porta al menos hasta 6meses después de iniciado el tratamiento75. En ese mismo estudio se observó que cuando la trombosis afecta a la vena esplénica y/o a la vena mesentérica superior se puede obtener recanalización hasta 12meses después del inicio de la anticoagulación75. Por ese motivo, se recomienda mantener la anticoagulación al menos 6meses cuando está afectado el tronco venoso portal y/o sus ramas, mientras que en pacientes con afectación de la mesentérica y de la esplénica puede considerarse mantener la anticoagulación hasta 12meses. La incidencia de complicaciones hemorrágicas en pacientes anticoagulados es baja y la mortalidad debida a la anticoagulación es prácticamente nula75,78.
Se recomienda el inicio precoz con heparina de bajo peso molecular (HBPM) como fármaco anticoagulante. Para la anticoagulación permanente se recomienda la utilización de anticoagulación oral con antagonistas de la vitaminaK, con un rango terapéutico definido por un valor de INR entre 2 y 372.
TrombólisisLa terapia trombolítica mediante un catéter introducido en la vena porta por vía transhepática se ha evaluado en no más de 100 pacientes, y muchos de ellos publicados tan solo como casos clínicos. La probabilidad de recanalización es similar a la obtenida con la anticoagulación; sin embargo, la morbimortalidad descrita es elevada y la hemorragia en el lugar de punción alcanza el 60%101-103. El acceso transyugular parece tener menos complicaciones, si bien los datos están limitados a menos de 30 pacientes104,105. La experiencia con la trombectomía quirúrgica o mecánica y la derivación percutánea portosistémica intrahepática (TIPS) es muy limitada. La trombectomía quirúrgica no se recomienda dada la frecuente recurrencia trombótica y la elevada morbimortalidad106. La experiencia de la trombectomía mecánica percutánea o asociada al TIPS es también muy limitada; por otra parte, estas técnicas pueden ocasionar trauma vascular o de la capa íntima de la vena porta y, por lo tanto, asociarse a trombosis recurrente107. Por último, no hay estudios que hayan evaluado el riesgo-beneficio de estos tratamientos en comparación con la anticoagulación precoz. Teniendo en cuenta además que el pronóstico a largo plazo de los pacientes con TP crónica es generalmente bueno y que estas técnicas conllevan alta morbimortalidad, su indicación es muy dudosa.
Trombosis portal crónicaAnticoagulaciónLa anticoagulación en la TP crónica tiene un papel controvertido. Sus objetivos teóricos son evitar fenómenos de re-trombosis del eje esplenoportal que podrían agravar la HTP y evitar fenómenos trombóticos en otros territorios vasculares (tanto arteriales como venosos)108,109.
No existen estudios prospectivos controlados que evalúen el riesgo-beneficio de la anticoagulación en la prevención de la re-trombosis en pacientes con cavernomatosis portal, y toda la información se basa en cohortes retrospectivas en las que no se distingue entre pacientes con y sin factores de riesgo protrombóticos. En uno de estos estudios la anticoagulación reduce de forma significativa el riesgo de nuevos episodios trombóticos109, mientras otro solo muestra una tendencia a disminuir este riesgo, pero no de forma significativa108. En cuanto al riesgo de hemorragia, existen datos discrepantes; en el primero de los estudios publicados la anticoagulación no conllevó un aumento en el riesgo de hemorragia, ni un incremento en la gravedad de esta109; sin embargo, en el segundo estudio la anticoagulación se relacionó de forma estadísticamente significativa con la aparición de fenómenos hemorrágicos que, sin embargo, no influyeron en la supervivencia. Llamativamente, la supervivencia se vio influida por la aparición de nuevos episodios trombóticos; así pues, este estudio sugiere un posible efecto beneficioso de la anticoagulación sobre la supervivencia, a pesar del incremento observado en el riesgo de hemorragia108.
A pesar de la relativa falta de datos actualmente disponible, se considera que la anticoagulación permanente está indicada en los pacientes que tienen un trastorno protrombótico subyacente que así lo requiera, y se debe considerar en pacientes con episodios recurrentes de trombosis, historia familiar de trombosis venosa profunda y antecedentes de isquemia intestinal en el momento agudo41,72,74,108,109. Es importante resaltar que el inicio de la anticoagulación debe ir precedido de una adecuada profilaxis primaria o secundaria de hemorragia digestiva alta por varices esofagogástricas41,72,74,109.
Tratamiento de la hipertensión portalEn los pacientes con TP crónica no cirrótica las recomendaciones para la profilaxis y el tratamiento de la hemorragia por varices esofagogástricas se basa en los estudios realizados en pacientes con cirrosis e HTP72. Esto se debe a que no existen estudios controlados que hayan evaluado el tratamiento de la hemorragia variceal en este contexto. Así pues, está recomendado el inicio de profilaxis primaria con betabloqueantes no selectivos o tratamiento endoscópico con ligadura en pacientes con varices esofágicas grandes (>5mm)72.
Con respecto a la profilaxis secundaria, se ha demostrado asimismo que la erradicación endoscópica de las varices esofágicas en pacientes con TP no cirrótica disminuye significativamente el riesgo de resangrado y se acepta la utilización combinada de betabloqueantes y tratamiento endoscópico con ligadura72.
Tampoco hay estudios que evalúen cuál es el mejor tratamiento para controlar el episodio agudo. El último consenso de BavenoVI recomienda la utilización de fármacos vasoconstrictores y/o tratamientos endoscópicos72. En caso de fracaso del tratamiento médico o endoscópico, puede plantearse la realización de un TIPS. Las tasas de éxito en la colocación oscilan entre el 75 y el 100% según un estudio, con una incidencia de encefalopatía hepática similar a la de los pacientes con cirrosis110. Sin embargo, un estudio reciente muestra una menor probabilidad de éxito en su colocación (menor del 35%), pero con una gran eficacia en el control de la hemorragia en el grupo en el que se logró un TIPS funcionante (69% vs. 14%; p=0,057)111. Por tanto, se necesitan más estudios, con series amplias de pacientes, que evalúen el papel real del TIPS en esta indicación. Asimismo, existe la posibilidad de intentar, mediante técnicas de angio-radiología intervencionista con la eventual colocación de prótesis, la repermeabilización portal112. En caso de no poder realizarse el TIPS, y si se plantea la realización de una anastomosis quirúrgica derivativa de rescate, se debe analizar cuidadosamente si existen vasos permeables aptos para una posible derivación. De hecho, hasta en un 50% de los pacientes con TP también se observa trombosis esplénica y de la vena mesentérica superior75,90, hechos que imposibilitan la cirugía derivativa. Por otra parte, en el caso de existir algún vaso adecuado habría que valorar, de forma individual en cada paciente, si la derivación prevista a priori es capaz de resolver el cuadro de HTP.
En caso de que aparezca una hemorragia incoercible o incontrolable y no se pueda realizar alguna de las técnicas previamente expuestas, se pueden intentar otras medidas, como la devascularización quirúrgica selectiva (transección esofágica)113, la esplenectomía o la ligadura quirúrgica de las varices. En niños con la vena mesentérica superior permeable y la rama portal izquierda permeable se puede realizar una derivación entre estas dos venas, lo que se conoce como derivación mesentérica de Rex114,115. Esta técnica permitiría descomprimir el sistema venoso portal y al mismo tiempo revascularizar con sangre portal el hígado. No existe experiencia con este tipo de derivación en adultos.
Tratamiento de la colangiopatía portalEl tratamiento de la colangiopatía portal (CP) no se ha evaluado en estudios prospectivos y controlados, por lo que las recomendaciones de tratamientos se basan en consensos de expertos. En pacientes asintomáticos con CP radiológica, o únicamente con aumento discreto de las enzimas de colestasis, no se recomienda realizar ningún tipo de tratamiento41. Las alteraciones enzimáticas suelen revertir con el uso de ácido ursodesoxicólico, aunque se necesitarían estudios controlados prospectivos que evaluasen esta alternativa. Un consenso de expertos publicado recientemente recomienda el tratamiento endoscópico con esfinterotomía y drenaje biliar del paciente sintomático con obstrucción biliar con o sin cálculos95. El drenaje de la vía biliar se debe realizar mediante la colocación de prótesis insertadas en colédoco que requieren recambios periódicos debido a su frecuente obstrucción. El ácido ursodesoxicólico puede tener un beneficio en este contexto, pero de nuevo esta estrategia debe ser evaluada. La descompresión portal mediante cirugía derivativa del eje esplenoportal o el TIPS quedarían reservados a casos de recurrencia de la sintomatología a pesar del tratamiento endoscópico95,116. Las derivaciones bilioentéricas están asociadas con una elevada morbimortalidad, y por ello no se recomiendan95.
PronósticoEl mejor conocimiento de la enfermedad y la mejoría de las técnicas de imagen han permitido un diagnóstico precoz de la TP aguda, lo que permite la instauración precoz de la anticoagulación, siendo la supervivencia comunicada a los 5años del 85%. Sin embargo, si existe infarto intestinal y fallo multiorgánico la mortalidad puede ser del 20-50%79. En pacientes con TP crónica la mortalidad global es inferior al 10%117, si bien no existe una comparación específica con la mortalidad observada en la población general. Es importante señalar que en más del 50% de casos la causa de la muerte no guarda relación directa con la TP. Cuando esta es la responsable de la muerte del paciente, es debido a una hemorragia digestiva en la mitad de los casos, estando el resto de casos asociados a extensión o recurrencia de la trombosis109. Los factores predictivos de supervivencia no han sido convenientemente estudiados, aunque los principales determinantes parecen ser la edad avanzada y la presencia de trombosis mesentérica79.
Recomendaciones- •
Se recomienda descartar una TP aguda ante cualquier paciente con dolor abdominal agudo persistente.
- •
Se recomienda descartar una TP crónica en pacientes con HTP sin enfermedad hepática conocida.
- •
La ecografía Doppler es la técnica inicial para el diagnóstico de TP. La angio-TC y/o la angio-RM son necesarias para evaluar su extensión.
- •
Ante el hallazgo de una TP se debe descartar la presencia de enfermedad hepática crónica subyacente.
- •
En la TP aguda debe realizarse una endoscopia digestiva alta a los 2-3meses del diagnóstico, que se repetirá a los 6-9meses si no hay varices o estas son pequeñas. En la TP crónica la endoscopia debe realizarse en el momento del diagnóstico. Posteriormente se seguirán las recomendaciones de la cirrosis.
- •
En la TP crónica se sugiere la realización de una colangiografía por RM al diagnóstico para evaluar la presencia de CP.
- •
En la TP aguda se recomienda iniciar la anticoagulación de forma precoz, y esta se mantendrá un mínimo de 6-12meses. Existe poca experiencia para recomendar otros tratamientos como la trombólisis, la trombectomía quirúrgica o la colocación de un TIPS.
- •
Si existe algún factor de riesgo protrombótico, isquemia intestinal durante el episodio o historia familiar o personal de tromboembolismo venoso, se recomienda mantener la anticoagulación de forma indefinida para evitar la re-trombosis.
- •
La profilaxis y el tratamiento de las complicaciones de la HTP se realizará siguiendo las recomendaciones establecidas para la cirrosis.
La consideración de la cirrosis como una enfermedad con fenotipo prohemorrágico ha cambiado claramente en los últimos años. Así, se ha demostrado que en los pacientes con cirrosis existe una tendencia protrombótica fundamentalmente debida a una alteración en el complejo equilibrio fisiológico entre factores pro y anticoagulantes118. Este desequilibrio se asocia clínicamente a un incremento del riesgo de trombosis en diferentes territorios, incluyendo las extremidades inferiores y el tromboembolismo pulmonar y, de forma destacada, la trombosis del eje esplenoportal (TP)119,120.
Por otra parte, esta realidad fisiopatológica y clínica sugiere la posibilidad de incluir el tratamiento anticoagulante (heparina o antagonistas de la vitaminaK) entre las posibles opciones terapéuticas de la trombosis venosa en pacientes con cirrosis, lo cual se ha considerado clásicamente como una contraindicación.
Incidencia y prevalenciaLa TP es el tipo de trombosis más frecuentemente observado en los pacientes con cirrosis, y su prevalencia depende en gran medida de la población estudiada y del procedimiento diagnóstico. Así, se han comunicado prevalencias que van del 2,1 al 23,3% en las diferentes series recogidas en pacientes candidatos a trasplante sin hepatocarcinoma121. Llamativamente, cerca de la mitad de los pacientes en los que se detecta TP en el momento del trasplante no tenían un diagnóstico previo al acto quirúrgico, lo que indica probablemente una insuficiente capacidad de detección del problema. Por otra parte, se ha comunicado en varios estudios de cohortes una incidencia anual estimada del 4,6 al 17%122-125. Finalmente, la presencia de cirrosis se asocia a un incremento del riesgo relativo de 7,3 para el desarrollo de TP con respecto a la población general126.
En definitiva, todos estos datos ponen de manifiesto la presencia de un problema cuantitativamente relevante y con potencial repercusión clínica.
Manifestaciones clínicasEn la mayoría de los casos, la TP en pacientes cirróticos es asintomática y se detecta de forma casual en las ecografías de seguimiento semestral, aunque ocasionalmente se puede diagnosticar coincidiendo con una descompensación hepática. No obstante, se ha sugerido que la presencia de TP puede tener consecuencias clínicas relevantes dado que se ha asociado, de forma independiente, a un mayor riesgo de hemorragia variceal, al fallo de tratamiento endoscópico en el control de la hemorragia aguda, al riesgo de recidiva y a un incremento de la mortalidad a las 6semanas (36% en pacientes con TP vs. 16% en pacientes sin TP)127-129. Por otra parte, el riesgo de infarto intestinal, así como la mortalidad asociada, son superiores en los pacientes con extensión del trombo a la vena mesentérica superior130. Se ha sugerido que el impacto de la TP podría ser mayor en el contexto del trasplante hepático131. Así, la presencia de TP se ha asociado a un incremento significativo de la mortalidad a los 30días y a 1año tras el trasplante con respecto a los pacientes sin TP121. No obstante, es importante señalar que este exceso de riesgo de mortalidad se ha descrito únicamente en presencia de TP completa131.
Factores de riesgoEl desarrollo de una TP está determinado por la alteración en el equilibrio fisiológico que regula la hemostasia como uno de los componentes de la tríada de Virchow. La etiopatogenia de la TP en la cirrosis es probablemente de origen multifactorial. Así, una velocidad reducida del flujo portal se asocia a un mayor riesgo de desarrollar TP123. Por otra parte, es difícil estudiar la presencia de trombofilia en la cirrosis debido al descenso inespecífico de los factores anticoagulantes132. No obstante, varias cohortes han investigado el posible papel de las mutaciones genéticas asociadas a trombofilia; la mutación del gen de la protrombina G20210A es la alteración que más frecuentemente se ha asociado a TP130,133,134. Por otra parte, la enfermedad hepática más avanzada (Child-PughC), la presencia de complicaciones de la HTP, el tratamiento endoscópico previo de las varices esofágicas con esclerosis y la edad son otros factores que se han sugerido como factores de riesgo para el desarrollo de TP121,124,125,135.
DiagnósticoLa ecografía Doppler es el método de elección de primera línea para su diagnóstico, con una sensibilidad de aproximadamente el 90% si la TP es completa y del 50% si es parcial121. La TC o la RM tienen una mayor capacidad para valorar la extensión de la TP a otros vasos esplácnicos. En pacientes cirróticos frecuentemente se puede encontrar TP asociada a invasión portal por un hepatocarcinoma. En estos casos la elevación de los niveles séricos de alfafetoproteína, el aumento del diámetro de la vena porta, el realce del trombo en fase arterial con la administración de contraste136, la detección de un flujo arterializado por ecografía Doppler137 o la realización de una biopsia del trombo permiten un correcto diagnóstico.
TratamientoExiste información limitada respecto el beneficio del tratamiento anticoagulante en pacientes con cirrosis y TP. Se ha descrito la recanalización espontánea de la TP principalmente cuando esta es parcial en pacientes no anticoagulados124,138,139, pero la probabilidad de progresión es más elevada (del 48% hasta el 70% de pacientes) en un seguimiento de 2años138,140.
Un estudio controlado y aleatorizado demostró que la administración de enoxaparina 4.000UI/día durante un año previene el desarrollo de TP sin aumentar el riesgo de complicaciones hemorrágicas141. Cinco cohortes publicadas122,140,142-144 evaluaron la eficacia del tratamiento anticoagulante en un total de 163 pacientes anticoagulados, la mayoría con TP parcial y con diferentes regímenes de anticoagulación (heparinas de bajo peso molecular [HBPM] o antagonistas de la vitaminaK). La tasa de repermeabilización fue del 55 al 75% en un tiempo medio de 6meses. El inicio precoz de la anticoagulación parece ser el factor predictor más importante de recanalización140,143,145, siendo el tiempo medio entre el diagnóstico de TP y el inicio de anticoagulación inferior a 6meses el que mejor predice la posibilidad de respuesta140. También se ha asociado a la presencia de ascitis con una menor respuesta a la anticoagulación145. No existen recomendaciones específicas en cuanto a la duración de la anticoagulación, aunque se ha descrito una recurrencia de TP de hasta el 38% al suspender la anticoagulación143, por lo que se sugiere que la prolongación del tratamiento anticoagulante después de la repermeabilización podría prevenir la re-trombosis. Además, se puede considerar mantener el tratamiento anticoagulante de forma indefinida en aquellos pacientes que presenten progresión de la TP, extensión de la trombosis a la vena mesentérica superior, historia de isquemia intestinal o la presencia de algún factor procoagulante conocido41,72.
Un estudio multicéntrico mostró un mayor riesgo de hemorragia en los pacientes con un recuento de plaquetas inferior a 50×109/l143. Otro estudio multicéntrico reciente evaluó el impacto de la anticoagulación en pacientes con cirrosis hepática y hemorragia digestiva alta, siendo la comorbilidad y el grado de fallo multiorgánico asociado, y no el propio tratamiento anticoagulante, los factores con impacto en la morbimortalidad de estos pacientes146.
Existen datos muy preliminares sobre los nuevos anticoagulantes directos que sugieren que podrían ser una opción en los pacientes con cirrosis, con una eficacia similar a los anticoagulantes tradicionales sin incrementar el riesgo de hemorragia ni de hepatotoxicidad147-149. No obstante, no hay datos suficientes para poder recomendar su uso.
En cualquier caso, se recomienda implementar una adecuada profilaxis de la hemorragia variceal, con betabloqueantes o con ligadura endoscópica de las varices, antes de iniciar cualquier tipo de anticoagulación en estos pacientes1,41,72.
Aunque la aplicabilidad y la eficacia del TIPS para tratar la TP no están bien establecidas, es una opción posible en pacientes con TP, siendo factible técnicamente incluso en algunos casos seleccionados con cavernomatosis portal140,150-152. No obstante, en la mayoría de casos la indicación de TIPS no es la propia TP sino otras complicaciones de la HTP. En presencia de trombosis de las ramas portales intrahepáticas puede ser necesario un abordaje percutáneo que, sin embargo, se asocia con un incremento del riesgo de complicaciones durante el procedimiento153,154.
En definitiva, son necesarios estudios controlados y aleatorizados para poder realizar recomendaciones sobre la mejor estrategia terapéutica en este entorno tan complejo. No obstante, a la espera de datos robustos, cada institución debería definir su propio algoritmo de acuerdo a la tipología de los pacientes y a su propia experiencia, teniendo en cuenta factores importantes como la posible indicación de trasplante, el grado y la extensión de la TP, la existencia de factores protrombóticos subyacentes, la historia de trombosis previa o la presencia de complicaciones de la HTP, entre otros1,41,72.
Recomendaciones- •
Se debe evaluar la permeabilidad de la vena porta en todos los pacientes con cirrosis hepática en lista de espera de trasplante o potenciales candidatos al mismo (B2).
- •
Ante el diagnóstico inicial de TP se debe evaluar siempre su extensión mediante angio-TC o angio-RM (A1).
- •
En pacientes con hepatocarcinoma y TP, se debe descartar su posible carácter tumoral mediante una prueba de imagen con contraste o la biopsia del trombo (A1).
- •
En pacientes con cirrosis y TP puede considerarse la realización de un estudio de factores protrombóticos (B2).
- •
En pacientes con TP y varices esofágicas se debe realizar una adecuada profilaxis de la hemorragia por HTP antes del inicio de la anticoagulación (A1).
- •
Se recomienda iniciar tratamiento anticoagulante en los pacientes con TP en lista de espera de trasplante hepático o los potenciales candidatos al mismo, especialmente cuando exista extensión a la vena mesentérica superior o la trombosis progrese en el seguimiento.
- •
El tratamiento anticoagulante a dosis terapéuticas se debe mantener como mínimo durante 6meses (B1). En los pacientes con historia de isquemia intestinal, con factor protrombótico conocido, trombosis que progresa en el seguimiento o en candidatos a trasplante hepático se puede considerar el mantenimiento de la anticoagulación de forma indefinida o hasta el trasplante (C2).
- •
En los pacientes candidatos a trasplante hepático que presenten una TP que progresa en el seguimiento sin respuesta a la anticoagulación se puede considerar la colocación de un TIPS (B2). En estos casos es importante adaptar la extensión del TIPS para evitar dificultades técnicas en el momento del trasplante.
La fístula arterioportal (FAP) es una comunicación arteriovenosa anómala entre cualquier arteria esplácnica y la circulación portal. Normalmente la arteria más frecuentemente implicada es la arteria hepática (65%), seguida de la esplénica (11%) y de la mesentérica superior (10%). Supone una causa poco habitual de HTP presinusoidal. Aunque infrecuente, su incidencia está aumentando debido al incremento de los procedimientos invasivos a nivel hepático155.
Las FAP pueden ser adquiridas o congénitas. Las adquiridas (más frecuentes) se deben normalmente a procesos invasivos (biopsias hepáticas percutáneas o transyugulares, implantación de TIPS, drenaje biliar transparietohepático, etc.), aunque también pueden ocurrir tras traumatismos, debido a la rotura de una arteria aneurismática en el sistema portal, en relación a cirrosis, a hepatocarcinoma o a otros tumores benignos156-158. De acuerdo a sus características, se ha propuesto la siguiente clasificación por Guzman et al.159.
- •
Tipo 1. Las FAP de pequeño tamaño, normalmente intrahepáticas y periféricas, apenas tienen repercusión funcional. Este suele ser el caso de las fístulas secundarias a una biopsia hepática. El paciente normalmente permanece asintomático y la fístula se resuelve en un mes por un mecanismo de trombosis.
- •
Tipo 2. Las FAP más grandes, con flujo suficiente para causar HTP, suelen ser extrahepáticas o intrahepáticas centrales y desarrollarse tras un traumatismo o por rotura de un aneurisma arterial en el sistema portal.
Tipo 3. Las FAP congénitas son menos frecuentes (<10%). Suelen ser intrahepáticas, difusas o múltiples y son causa de HTP grave en la infancia160. Las causas de fístulas congénitas incluyen el síndrome de Rendu-Osler-Weber, el síndrome de Ehlers-Danlos, las malformaciones arteriovenosas y los aneurismas161,162.
El hallazgo de una fístula aislada en la edad adulta es típicamente adquirido.
FisiopatologíaLas FAP son causa de HTP presinusoidal, fundamentalmente por incremento en el flujo portal que aumenta a expensas del flujo arterial que alimenta la fístula. En casos de larga evolución, debido a la arterialización de la vena porta, se observa además hiperplasia de la íntima. La gravedad de los síntomas se relaciona con el volumen de sangre que circula a través de la fístula, mientras que la función hepática permanece relativamente conservada, en ausencia de hepatopatía previa156.
Manifestaciones clínicasLa mayoría de casos son asintomáticos. Las FAP centrales, más grandes, de alto flujo se manifiestan como complicaciones relacionadas con la HTP. La forma de presentación más frecuente es la hemorragia gastrointestinal alta o baja (33%), normalmente por rotura de varices esofágicas, seguida de ascitis (26%)155. La aparición de insuficiencia cardiaca es poco habitual (4,5%), ya que el propio hígado impide un incremento significativo del retorno venoso. Algunos pacientes presentan un cuadro diarreico (4,5%), que probablemente se deba a isquemia por fenómeno de robo o a congestión de la vasculatura mesentérica163. La exploración física puede evidenciar en un 33% de los casos un soplo, y si la fístula mide más de 4mm, puede identificarse un frémito164,165. En caso de cirrosis hepática, el desarrollo de una FAP puede pasar desapercibido, al atribuirse la descompensación en cuestión a la propia hepatopatía.
Las FAP congénitas son causa de HTP grave en la infancia. Es más probable que se asocien a insuficiencia cardiaca, ya que la resistencia sinusoidal intrahepática es mínima, y a diarrea155.
DiagnósticoLa evaluación inicial puede llevarse a cabo mediante ecografía Doppler, confirmándose posteriormente el diagnóstico mediante angio-TC o angio-RM abdominal166. Estas técnicas de imagen permiten evidenciar la arteria y la vena porta dilatadas y, mediante ecografía Doppler, un flujo portal turbulento que puede ser hepatopetal o hepatofugal167. La propia fístula puede verse en fase arterial, a los 20-30segundos de la inyección del contraste. La angiografía es útil, además de para establecer el diagnóstico, para planificar el tratamiento155.
TratamientoDepende de la localización, del tamaño y del número de FAP. Las fístulas pequeñas normalmente se resuelven solas. El manejo propuesto en estos casos es el seguimiento mediante ecografía Doppler. En los casos en que la fístula aumenta de tamaño o aparece sintomatología, se recomienda tratamiento. El tratamiento de elección es la embolización, siendo en ocasiones necesario más de un procedimiento168,169. Si esta no es posible o fracasa, hay que considerar cirugía170. En los casos de FAP congénitas, dada su complejidad, se aconseja valoración individualizada de cada caso en un centro de referencia pediátrica. El tratamiento propuesto puede ser ligadura, embolización, resección o incluso trasplante hepático159.
Recomendaciones- •
Se debe considerar el diagnóstico de FAP en los pacientes con HTP sin etiología evidente, especialmente si existe el antecedente de un procedimiento hepático invasivo, un traumatismo o una herida abdominal (B1).
- •
El diagnóstico de una FAP debe confirmarse mediante angio-TC o angio-RM abdominal (B1).
- •
Las FAP que requieren tratamiento mediante embolización son las de gran tamaño o asociadas a HTP. Se recomienda seguimiento por pruebas de imagen del resto de FAP (B2).
Son malformaciones debidas a alteraciones en el desarrollo embrionario. Hay pocos casos descritos, aunque su diagnóstico está aumentando debido al mayor empleo de técnicas de imagen. La mayoría de pacientes se diagnostican en la infancia, aunque algunos casos se identifican en la edad adulta. Su hallazgo debe tenerse siempre en consideración, dado que puede implicar el desarrollo de complicaciones. Se clasifican en comunicaciones intrahepáticas o extrahepáticas171.
Comunicaciones porto-sistémicas intrahepáticasSe define como una comunicación entre el sistema portal y la circulación venosa sistémica, con un diámetro mayor de 1mm, de localización al menos parcialmente intrahepática172. En función de su morfología, se han descrito cuatro tipos distintos (tabla 4)173.
Clasificación de las colaterales portosistémicas intrahepáticas propuesta por Park et al.173
| Tipo 1 | Comunicación única de gran tamaño entre la vena portal derecha y la vena cava inferior |
| Tipo 2 | Presencia de una o múltiples colaterales entre el sistema portal y las venas hepáticas, de localización periférica limitadas a un segmento hepático |
| Tipo 3 | Conexión aneurismática entre la vena porta y la vena hepática |
| Tipo 4 | Múltiples conexiones entre el sistema portal periférico y las venas hepáticas, con distribución difusa en ambos lóbulos |
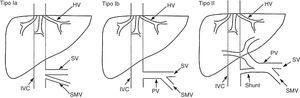
También conocida como malformación de Abernethy, son un grupo de malformaciones poco frecuentes en las que se produce un drenaje directo desde la circulación venosa esplácnica al retorno venoso sistémico, evitando el paso hepático. En estos pacientes el hígado se encuentra perfundido por la arteria hepática, en ausencia de vena porta. El drenaje venoso de la comunicación puede tener lugar en la vena cava inferior, en la vena renal izquierda, en la aurícula derecha, en las venas ilíacas, en la vena hepática izquierda o en la vena ácigos174.
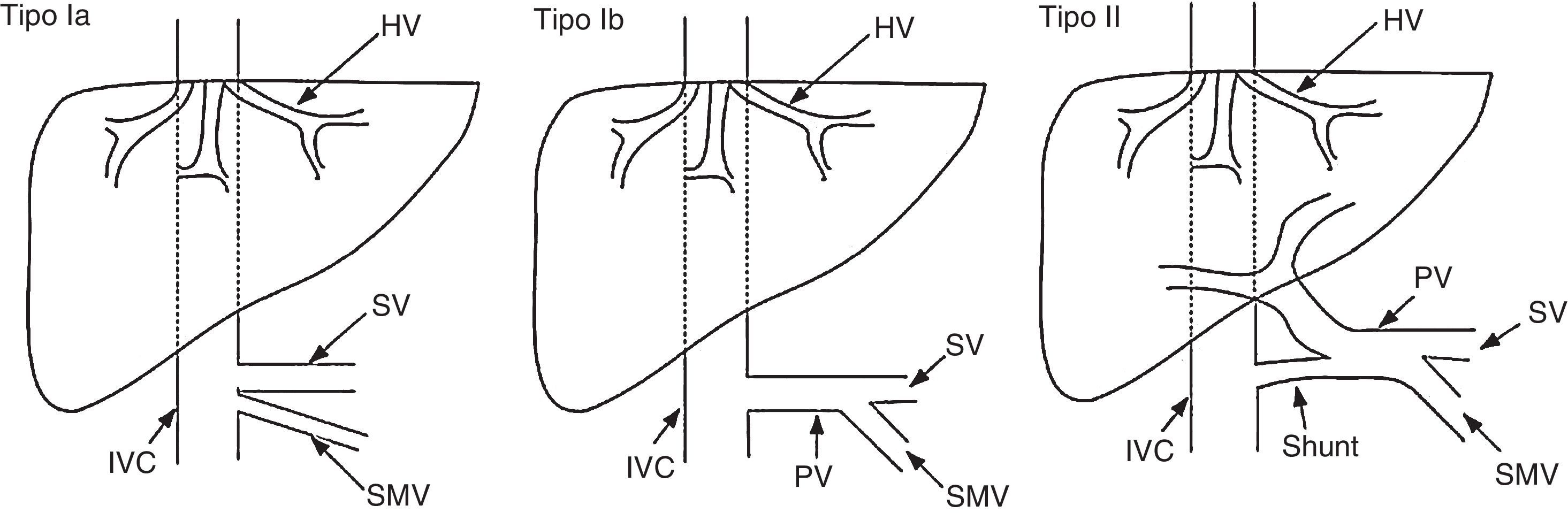
Estas malformaciones se clasifican como tipoi o tipoii en función de la ausencia completa de vena porta o de la presencia de un remanente de la misma (fig. 2). A su vez, el tipoi se clasifica en los subtipos ia y ib (tabla 5)175.
Clasificación de las comunicaciones congénitas extrahepáticas propuestas por Morgan y Superina en 1994.
Modificado por Hu174.
Clasificación de las comunicaciones congénitas extrahepáticas (malformación de Abernethy) propuesta por Morgan y Superina175
| Tipo I | Ausencia de vena porta intrahepática |
| Tipo Ia | La vena mesentérica superior y la vena esplénica drenan por separado |
| Tipo Ib | La vena mesentérica superior y la vena esplénica forman un tronco común |
| Tipo I | Presencia de una comunicación significativa, con persistencia de sistema portal intrahepático (a menudo, hipoplásico) |
Las manifestaciones clínicas abarcan desde el paciente asintomático hasta la encefalopatía hepática grave. La encefalopatía se debe a la presencia de la comunicación y no a disfunción hepática; se ha sugerido una asociación entre el empeoramiento de la clínica y la edad, por lo que algunos pacientes se diagnostican en la edad adulta176,177. En la mayoría de casos la función hepática se mantiene conservada y es característica la ausencia de manifestaciones de HTP (esplenomegalia, varices esofágicas o ascitis). En el transcurso de la enfermedad es frecuente la aparición de lesiones nodulares hepáticas (hiperplasia nodular focal, hiperplasia nodular regenerativa, adenoma, hepatoblastoma e incluso hepatocarcinoma)178-180.
Existen malformaciones congénitas asociadas, como atresia de vías biliares, malformaciones cardíacas, genitourinarias o del sistema musculoesquelético. A nivel cardíaco, la clínica se ve agravada por el aumento del retorno venoso a través de la comunicación. Las complicaciones más frecuentes identificadas son foramen oval permeable, defectos del tabique auricular o ventricular, conducto arterioso persistente, coartación de aorta, dextrocardia, etc.172,174. Respiratoriamente, a pesar de la ausencia de HTP, se ha descrito tanto la aparición de síndrome hepatopulmonar como hipertensión portopulmonar, debido al paso de sustancias a través de la comunicación. En ambos casos el paciente presenta disnea, añadiéndose ortodesoxia en el síndrome hepatopulmonar181,182.
DiagnósticoEl diagnóstico se establece mediante angio-TC o angio-RM abdominal183. La ecografía Doppler es de utilidad sobre todo en el cribado prenatal. Además de observarse la comunicación venosa portosistémica, puede apreciarse hipertrofia compensatoria de la arteria hepática. Es importante no confundir la ausencia de vena porta con una TP174. Por otro lado, estas técnicas de imagen pueden ayudar a completar la valoración del paciente, permitiendo el diagnóstico de otras malformaciones y el examen del parénquima hepático. La angiografía es útil tanto para establecer el diagnóstico como para planificar el tratamiento.
TratamientoExiste una experiencia limitada en el manejo de estas malformaciones172. En general, en casos asintomáticos se recomienda seguimiento. Para los casos sintomáticos, las opciones de tratamiento dependen del tipo de malformación. Algunas comunicaciones intrahepáticas de pequeño tamaño detectadas en los primeros meses de vida se han resuelto espontáneamente184,185, por lo que se recomienda control evolutivo hasta los 2años. Si la comunicación no se resuelve y el paciente presenta sintomatología, se considera embolización o resección quirúrgica186,187.
En la malformación de Abernethy tipoi no existe una técnica quirúrgica que permita reconstruir la vena porta, por lo que las opciones disponibles son el trasplante hepático o bien, en el caso de lesiones tumorales localizadas, considerar la resección de las mismas174. En la malformación de Abernethy tipoii, cuando el manejo médico no es suficiente, la alternativa más recomendada es la embolización de la comunicación. Antes del procedimiento es importante asegurar que el sistema portal existe y recibe un flujo sanguíneo adecuado, o las complicaciones derivadas pueden ser graves e implicar el consiguiente desarrollo de HTP188.
Recomendaciones- •
La presencia de una comunicación portosistémica congénita debe sospecharse en los casos de encefalopatía hepática no explicada por otra causa (A1).
- •
El diagnóstico de las comunicaciones portosistémicas congénitas se debe confirmar mediante angio-TC o angio-RM abdominal (B1).
- •
En los pacientes con comunicaciones congénitas intrahepáticas (diagnosticadas al nacimiento) que no se resuelven a los 2años de vida y son sintomáticas se debe considerar tratamiento mediante embolización o cirugía, asegurando que el hígado reciba un flujo sanguíneo portal adecuado (B2).
- •
El tratamiento recomendado en los casos sintomáticos de malformación de Abernethy tipoi es el trasplante hepático (B2).
- •
Se recomienda la embolización o ligadura de la malformación de Abernethy tipoii siempre que sea sintomática, asegurando que el hígado reciba un flujo sanguíneo portal adecuado (B1).
- •
En la malformación de Abernethy se recomienda evaluar la asociación con otras malformaciones y un seguimiento específico para detectar la aparición de complicaciones pulmonares y tumores hepáticos (B2).
El hallazgo de colaterales portosistémicas es frecuente en pacientes cirróticos con encefalopatía hepática clínicamente manifiesta refractaria a tratamiento (definida como encefalopatía recurrente o persistente). Según las series, el porcentaje es variable, abarcando de un 46 a un 70%189-191.
El manejo inicial es similar al del resto de pacientes con encefalopatía hepática: como primer escalón, se recomienda identificar y corregir el posible factor precipitante, administrar disacáridos no absorbibles para conseguir 1-2 deposiciones al día y, en un segundo tiempo, introducir antibióticos no absorbibles como rifaximina. En caso de recidiva o ausencia de respuesta se ha propuesto, como tratamiento alternativo, la embolización de las colaterales de gran tamaño, procedimiento que se lleva a cabo mediante técnicas de radiología intervencionista. Los materiales empleados (coils, amplatzer, matrix) y las vías de abordaje (femoral, transyugular, transparietohepática) varían en función de cada caso y de la experiencia del centro.
En las últimas guías europea y americana de manejo de encefalopatía192,193 se recoge como opción terapéutica, en los casos refractarios, la embolización de las colaterales de gran tamaño en pacientes con buena función hepática. De acuerdo a un estudio retrospectivo multicéntrico que analiza la experiencia en la serie más larga publicada hasta la fecha (37 pacientes), el punto de corte que permite predecir una buena respuesta es una función hepática con una puntuación menor o igual a 11 puntos en la escala MELD. En cuanto a las complicaciones, además de los riesgos inherentes a la técnica, el incremento en la presión portal derivado de la embolización puede favorecer la aparición de ascitis o de hemorragia. Sin embargo, en pacientes bien seleccionados (sin varices esofágicas o con varices pequeñas y sin ascitis o con ascitis leve, bien controlada) el procedimiento se ha demostrado seguro, sin evidenciarse un incremento significativo en las complicaciones194,195.
Recomendaciones- •
En los pacientes cirróticos con encefalopatía hepática recurrente o persistente refractaria al tratamiento médico se debe investigar la presencia de colaterales portosistémicas grandes mediante angio-TC y/o angio-RM (A1). En estos casos se recomienda la embolización de la colateral dominante, especialmente en los pacientes con buena función hepática (B1).
La telangiectasia hemorrágica hereditaria (THH) o enfermedad de Rendu-Osler-Weber es una enfermedad genética con herencia autosómica dominante, caracterizada por la aparición de estructuras vasculares anómalas (telangiectasias o malformaciones arteriovenosas) que pueden asentar en cualquier órgano de la economía, siendo responsables de la morbimortalidad asociada. La penetrancia de los síntomas es variable y aumenta generalmente con la edad, siendo a los 45años del 90%196. La epistaxis es la manifestación clínica más frecuente (hasta el 96% de los pacientes pueden presentar sangrados nasales) y es generalmente la primera en aparecer197. La THH está incluida dentro de las enfermedades raras o minoritarias, ya que su prevalencia media se estima en torno a 1:5.000-1:8.000198, aunque existen poblaciones aisladas donde el índice es superior debido al efecto fundador (Jurá en Francia, Isla de Funen en Dinamarca y Antillas holandesas)199. Constituye aún una patología infradiagnosticada200 y sin tratamiento curativo definitivo.
El diagnóstico se basa bien en los criterios clínicos de Curaçao201 (tabla 6): epistaxis, telangiectasias, agregación familiar de aspecto dominante y afectación de órganos internos (siendo necesaria la presencia de al menos tres de los anteriores para su confirmación)202,203, o bien en la identificación de la mutación causal mediante la realización de un estudio molecular. Nuevas técnicas para facilitar el diagnóstico, como la espectroscopia con infrarrojos, parecen ser útiles en la identificación de pacientes.
Criterios clínicos de Curaçao para el diagnóstico de la telangiectasia hemorrágica hereditaria
| Epistaxis | Espontáneas y recurrentes |
| Telangiectasias | Múltiples y en localizaciones características: labios, cavidad oral, dedos, nariz |
| Agregación familiar | Historia familiar o pariente en primer grado con HHT (los parientes afectos deberán presentar al menos dos de los síntomas reseñados) |
| Afectación de órganos internos | Malformaciones arteriovenosas: pulmonares, hepáticas, cerebrales o espinales Telangiectasias en tracto gastrointestinal |
Diagnóstico incierto: 1 criterio. Diagnóstico probable: 2 criterios. Diagnóstico seguro: 3 o 4 criterios.
Hasta el momento se han identificado tres genes implicados en el desarrollo de la enfermedad (tabla 7). El primero en ser descrito fue el gen ENG, localizado en el cromosoma 9 (9q33-q34) que codifica la proteína endoglina; mutaciones en este gen dan lugar a la THH tipo1204-206. En la THH tipo2 la mutación se encuentra en el gen ACVRL1, que codifica la proteína activin receptor-like kinase 1 (ALK1), en concreto en la región 12q11-q14 del cromosoma 12207,208. Un 2% de pacientes presentan un síndrome combinado de THH y poliposis juvenil hereditaria. En este caso la mutación se presenta en el gen MADH4, localizado en el cromosoma 18209. Este grupo de pacientes presenta rasgos fenotípicos de THH y alto riesgo de aparición de tumores malignos en el tracto gastrointestinal en edades precoces210.
Genes implicados en la telangiectasia hemorrágica hereditaria
| Tipo | Número OMIM | Cromosoma | Gen implicado | Proteína |
|---|---|---|---|---|
| HHT 1 | #187300 | 9 | ENG | Endoglina |
| HHT 2 | #600376 | 12 | ACVRL1 | ALK1 |
| JPHT | #175050 | 18 | MADH4 | Smad 4 |
| HHT 3 | 5 | No identificado | ||
| HHT 4 | 7 | No identificado | ||
| SMCMA | 14 | BMP9 (GDF2) | BMP9 |
OMIM: Online Mendelian Inheritance in Man; HHT: hereditary hemorrhagic telangiectasia; JPHT: juvenile polyposis hereditary telangiectasia; SMCMA: síndrome de malformaciones capilares-malformaciones arteriovenosas.
Se han identificado por técnicas de mapeo al menos otros dos loci, uno localizado en el cromosoma5 y otro en el cromosoma7211,212, potencialmente implicados en la génesis de la enfermedad, aunque todavía no se han identificado los genes causantes; recientemente se ha descrito un nuevo síndrome (síndrome de malformaciones capilares-malformaciones arteriovenosas) con fenotipo similar al de la THH, causado por mutaciones en el gen que codifica la proteína bone morphogenetic protein 9 (BMP9)213.
Todas estas proteínas tienen en común el estar implicadas en la cascada de señalización extracelular-intracelular de la superfamilia TGF-β, implicada en múltiples efectos biológicos como regulación de la proliferación celular, diferenciación, migración y formación de la matriz extracelular, mantenimiento de la homeostasis del tejido y reparación en el adulto. Parece existir una variabilidad geográfica con prevalencia de THH tipo1 en Norteamérica, países anglosajones y del norte europeo, mientras que la THH tipo2 es más habitual en la zona mediterránea y sudamericana198,214,215. Considerando la relación genotipo-fenotipo, los pacientes con THH tipo1 parecen tener más riesgo de presentar malformaciones vasculares a nivel pulmonar y en el sistema nervioso central, mientras que los pacientes con THH tipo2 tienen mayores tasas de afectación hepática y de tracto gastrointestinal216,217.
Manifestaciones clínicasLa afectación hepática en THH puede presentarse en forma de telangiectasias, masas vasculares confluentes, dilatación de arteria hepática y cortocircuitos de diversos tipos (arterioportal, arteriovenoso y/o portovenoso)218,219. Según las diferentes series la participación hepática aparece en el 30 al 84% de los enfermos con THH220-222, siendo más frecuente en pacientes con THH2 y en el sexo femenino199. El aumento en el diámetro de la arteria hepática común parece ser uno de los signos más precoces de afectación hepática223 y también supone uno de los hallazgos más específicos de hepatopatía en los pacientes con THH224,225.
En casos de compromiso hepático grave (8%)226 se pueden desarrollar complicaciones secundarias al desarrollo de distintos tipos de comunicaciones arteriovenosas o venoportales que, según la clasificación realizada por García-Tsao et al.218 pueden ser:
- •
Tipo 1. Cortocircuito entre la arteria hepática y las venas suprahepáticas con insuficiencia cardiaca de alto gasto secundaria a la circulación hiperdinámica que se produce por hiperaflujo. Es la más habitual (63%) de las complicaciones secundarias a fístulas hepáticas de gran tamaño227 y cursa con disnea de esfuerzo, ortopnea, edemas periféricos, oliguria y ascitis.
- •
Tipo 2. Cortocircuito entre arteria hepática y vena porta (17% de casos), con pseudocirrosis hepática (debida al aumento de flujo en el sinusoide con depósito de tejido fibroso) e HTP228 o bien HTP secundaria a hiperplasia nodular regenerativa229. La clínica acompañante es de descompensación hidrópica, anemia, riesgo de sangrado por gastropatía congestiva o varices esofágicas, esplenomegalia y encefalopatía hepática230,231.
- •
Tipo 3. Isquemia biliar (19% de casos) secundaria al robo vascular (la vascularización biliar se origina desde la arteria hepática). En el caso de cortocircuito arteriohepático o arterioportal de gran tamaño se puede producir isquemia biliar con estenosis de conductos biliares y necrosis biliar con formación de biliomas, colestasis y ocasionalmente colangitis. La clínica corresponde a la triada clásica de dolor en hipocondrio derecho, ocasionalmente con fiebre e ictericia232.
Otro tipo de fístulas son las porto-hepáticas (entre vena porta y suprahepáticas) con potencial riesgo de desarrollo de hiperplasia nodular regenerativa. Otro síntoma menos habitual es la isquemia mesentérica por robo vascular en cortocircuitos arteriohepáticos233.
García-Tsao et al. observaron que la media de edad para el diagnóstico de insuficiencia cardiaca de alto gasto, HTP y afectación biliar en THH fue de 52, 62 y 39años respectivamente, cifras que coinciden con estudios posteriores234.
En un estudio de seguimiento a largo plazo (media de 44meses) de pacientes con THH y afectación hepática se observó una mortalidad del 5,2% relacionada con la hepatopatía (tasa de mortalidad de 1,1 y de morbilidad de 3,6% por cada 100 pacientes/año) con una respuesta eficaz a los tratamientos (médicos, quirúrgicos y de radiología intervencionista) aplicados del 63%235.
Diagnóstico y cribadoLa presencia de malformaciones vasculares hepáticas difusas debe orientar hacia el diagnóstico de THH, aunque hay otros síndromes con menor prevalencia aún, como el Klippel-Trénaunay, que también pueden presentar este tipo de alteraciones41.
Aunque existe controversia sobre la conveniencia de realizar un cribado para afectación hepática debido al relativo bajo porcentaje de sintomatología asociada (un 8% de pacientes presentan fallo cardiaco, HTP, encefalopatía o colangitis)233,236, estudios prospectivos recientes en pacientes con THH mostraron tasas de morbimortalidad sustanciales (1,1 y 3,6% por año, respectivamente), lo que aconseja tanto la realización de cribado de la posible afectación hepática como el establecimiento de un protocolo de seguimiento234. Motivos adicionales para proceder con el estudio hepático/abdominal son el apoyo que supone para el diagnóstico de la enfermedad basado en los criterios clínicos de Curaçao y el hecho de que en algunos estudios se han observado alteraciones farmacocinéticas en pacientes con afectación hepática237, así como una mayor predisposición para el desarrollo de complicaciones cardiacas en pacientes con hiperplasia nodular focal y aumento del diámetro de la arteria hepática224.
Para el diagnóstico de afectación hepática en THH se precisan estudios de imagen basados en ecografía abdominal y tomografía computarizada (TC). A nivel ecográfico es importante la observación del tamaño de la arteria hepática (habitualmente dilatada) y la determinación de la velocidad del pico sistólico en la misma220,238; además, una alteración del flujo portal y de las venas suprahepáticas en el Doppler permite diagnosticar la presencia de cortocircuitos arterioportales y arteriohepáticos239. El estudio con ultrasonidos permite estratificar la gravedad de las lesiones hepáticas en la THH mediante la clasificación propuesta por Buscarini et al.220 (tabla 8), en la cual los pacientes asintomáticos y aquellos con afectación 0, 1, 2 no precisarían tratamiento, mientras que en los grados 3 y 4 se recomendaría la realización de estudios adicionales (ecocardiograma con cálculo estimado de gasto cardiaco y de presión pulmonar y estudios endoscópicos, respectivamente, para identificar la presencia de insuficiencia cardiaca de alto gasto o HTP).
Grados de severidad de las malformaciones vasculares hepáticas en pacientes con telangiectasia hemorrágica hereditaria según la ecografía Doppler
| Grados | Parámetros |
|---|---|
| Grado 0 | Diámetro de arteria hepática >5 <6mm y/o |
| Velocidad sistólica pico de la arteria hepática >80cm/s y/o | |
| Índice de resistencia de la arteria hepática <0,55 y/o | |
| Hipervascularización hepática periférica | |
| Grado 1 | Dilatación de la arteria hepática a nivel extrahepático >6mm y |
| Velocidad sistólica pico de la arteria hepática >80cm/s y/o | |
| Índice de resistencia de la arteria hepática <0,55 | |
| Grado 2 | Dilatación de la arteria hepática extra e intrahepática (doble canal) y |
| Velocidad pico sistólica de la arteria hepática >80cm/s | |
| Alteraciones moderadas en el flujo portal y/o de venas hepáticas | |
| Grado 3 | Arterias hepáticas de aspecto tortuoso y/o |
| Dilatación moderada de la porta y/o de las venas hepáticas | |
| Grado 4 | Dilatación marcada de la porta y/o venas hepáticas |
| Anomalías marcadas en el flujo portal y esplénico en el estudio Doppler |
La angio-TC abdominal parece ser más sensible que la ecografía Doppler tanto para la detección de pequeñas lesiones vasculares como para el diagnóstico indirecto de fístulas y malformaciones arteriovenosas hepáticas de gran tamaño222,240. Por ello, y a pesar de la radiación asociada (a considerar sobre todo en edades pediátricas), sería aconsejable valorar su realización al menos en el momento del diagnóstico, lo cual ayudaría además al diagnóstico de malformaciones vasculares en otros órganos abdominales como el páncreas, donde llegan a observarse malformaciones arteriovenosas en el 33-42% de casos (más habituales en pacientes con THH2)241-243, bazo, pared del tracto gastrointestinal y riñones. Un hallazgo frecuente también en estos pacientes es la existencia de variantes anatómicas de la normalidad fundamentalmente a nivel del nacimiento de la arteria hepática y sus ramas en tronco celiaco y arteria mesentérica superior244.
La resonancia magnética parece tener la misma sensibilidad que la TC para el diagnóstico de afectación hepática en THH, con la ventaja añadida de la ausencia de radiaciones ionizantes, aunque las series de pacientes y la experiencia con esta técnica son mucho menores en la actualidad245.
La arteriografía abdominal se reserva habitualmente para casos en los que se plantea realizar un estudio hemodinámico o pre-trasplante222.
Debido a que la mayoría de pacientes con THH reciben un estudio ecocardiográfico rutinario y con contraste (suero salino agitado) para el cribado de cortocircuito derecha-izquierda para el diagnóstico de malformaciones arteriovenosas pulmonares, sería recomendable proceder simultáneamente a la estimación de gasto cardiaco y presiones pulmonares. Los estudios endoscópicos se reservarán para los pacientes con sangrado activo, anemia no justificada por el grado de epistaxis nasales y para el cribado y tratamiento si procede de varices esofágicas y gastropatía de la HTP.
Bioquímicamente, la presencia de colestasis anictérica se observa hasta en un tercio de pacientes y parece correlacionarse con la extensión de las malformaciones vasculares235. Se están desarrollando además sistemas de evaluación de la gravedad de la afectación hepática en pacientes con THH basados en modelos de regresión logística que consideran, además de los niveles de fosfatasa alcalina y de hemoglobina, la afectación radiológica en ecografía o TC y la edad y el sexo234. Las alteraciones vasculares que se observan en los pacientes con THH favorecen el desarrollo de focos de hiperplasia nodular focal, un hallazgo observado en el 16% de casos234.
La realización de biopsias hepáticas en pacientes con THH se debe evitar en lo posible por el alto riesgo de complicaciones hemorrágicas41.
TratamientoMedidas generalesActualmente no existe indicación de tratamiento en pacientes asintomáticos con o sin afectación hepática.
En los casos sintomáticos el tratamiento depende del tipo de complicación asociada. En la complicación extrahepática más frecuente, la insuficiencia cardiaca de alto flujo, está indicado el tratamiento intensivo en las clases funcionales NYHAII a IV, basado en las medidas generales de corrección de la anemia, dieta hiposódica, diuréticos, betabloqueantes, digoxina, IECA, cardioversión o ablación por radiofrecuencia cuando existen trastornos del ritmo asociados. El objetivo será aliviar los síntomas y estabilizar la situación hemodinámica203,246.
Respecto a las complicaciones de la HTP (sangrado por varices esofágicas, ascitis, encefalopatía), el tratamiento debe ser el mismo que el de los pacientes con HTP por otras etiologías219. Es fundamental, en este grupo de pacientes, un adecuado tratamiento de soporte de la anemia (ferroterapia y/o trasfusiones sanguíneas).
Tratamiento farmacológicoAproximadamente el 63% de los pacientes presentan una respuesta completa al tratamiento médico, mientras que el 21% tienen una respuesta parcial. La respuesta al tratamiento debe evaluarse tras 6-12meses del inicio del mismo. En caso de sobrecarga cardiaca, los IECA y el carvedilol pueden ser utilizados para prevenir el remodelamiento cardiaco. Este último, junto con los betabloqueantes no cardioselectivos habituales (nadolol y propranolol), pueden ser utilizados en la prevención de la hemorragia por HTP en pacientes con varices esofágicas clínicamente significativas o con telangiectasias gastrointestinales235. Además el propranolol, por su efecto apoptótico y antiangiogénico, parece ser capaz de disminuir los sangrados nasales247. El manejo invasivo que se detalla más adelante estará destinado a los pacientes no respondedores a tratamiento médico.
El bevacizumab, anticuerpo monoclonal, inhibidor de la angiogénesis, ha demostrado en un único estudio, con 24 pacientes con malformaciones vasculares hepáticas grandes y elevado gasto cardiaco, que es capaz de mejorar el gasto cardiaco y acortar la duración de los episodios de epistaxis (respuesta completa y parcial del 12 al 70%, respectivamente). Sin embargo, este dato debe ser interpretado con cautela, dado que presenta una toxicidad no desdeñable (crisis hipertensivas, proteinuria, riesgo de complicaciones tromboembólicas) y genera alteraciones en el proceso de angiogénesis que pudieran favorecer una dehiscencia de anastomosis o infección de herida quirúrgica en caso de trasplante hepático urgente248.
Tratamiento endoscópicoEn el caso de telangiectasias gastrointestinales sangrantes accesibles, el tratamiento endoscópico con gas argón es el de elección, dada su facilidad de uso, eficacia y seguridad. El tratamiento farmacológico concomitante con fármacos estimuladores de la producción de endoglina o antiangiogénica como el bevacizumab no están recomendados en la actualidad249-252.
Tratamiento endovascularEl tratamiento endovascular mediante la embolización transarterial de las malformaciones vasculares debería utilizarse solamente en el caso de pacientes con afectación cardiaca, con sintomatología invalidante, sin respuesta a tratamiento médico y que no sean candidatos a trasplante hepático, ya que la mortalidad posprocedimiento alcanza el 10%, con una tasa de complicaciones no desdeñable del 20% (embolización pulmonar iatrogénica, desarrollo de abscesos biliares, necrosis extensa del parénquima y conductos biliares, colangitis, hemobilia, sepsis biliar o fallo hepático)253. El riesgo del procedimiento y la reaparición de fístulas a otros niveles han hecho que hoy día se plantee el trasplante hepático como tratamiento de elección, especialmente cuando los pacientes desarrollan afectación cardiaca secundaria.
El uso del TIPS en el manejo de las complicaciones de la HTP no está recomendado por la alta morbilidad y el empeoramiento del estado hiperdinámico219.
Trasplante hepáticoEl trasplante hepático es la única alternativa con fines curativos de las malformaciones venosas hepáticas en el contexto de THH, aunque hay casos descritos de revascularización anómala sobre injerto254.
Las indicaciones del trasplante, además de las habituales, son la necrosis biliar isquémica y la afectación cardiaca secundaria intratable farmacológicamente. Tras el trasplante, desaparece la situación hiperdinámica secundaria255. Como aspecto a considerar, en el estudio pretrasplante siempre se debe incluir un cateterismo cardiaco derecho, con el fin de descartar hipertensión pulmonar grave.
En las series publicadas, el trasplante hepático presenta una mayor dificultad técnica por el riesgo de sangrado arterial secundario a la hiperperfusión del hígado. Por ello, la ligadura inicial de la arteria hepática es imprescindible para disminuir la circulación hiperdinámica y para una rápida mejoría de la función cardiaca. En pacientes con grandes aneurismas arteriales preexistentes será necesaria la resección completa de la arteria hepática para prevenir la aparición de trombosis pseudoaneurismáticas postoperatorias.
La mortalidad postoperatoria en el trasplante hepático es del 7-10%, con una excelente supervivencia a largo plazo (82-92% en un seguimiento medio de 10años)256-258.
Recomendaciones- •
Ante la presencia de malformaciones arteriovenosas hepáticas múltiples se recomienda considerar el diagnóstico de THH mediante criterios clínicos y/o estudio genético (A2).
- •
Se recomienda realizar una ecografía Doppler como técnica de primera elección para el diagnóstico y estadificación de las malformaciones hepáticas. La angio-TC puede considerarse una alternativa en los casos en que no se disponga de ecografista experimentado (A1).
- •
En pacientes con afectación hepática, especialmente si esta es grave, se recomienda una evaluación cardiológica y de los signos de HTP al diagnóstico y durante el seguimiento.
- •
La biopsia hepática no es necesaria para el diagnóstico. Si se plantea por otros motivos es aconsejable valorar el riesgo-beneficio debido al alto riesgo de hemorragia (A1).
- •
El manejo de los pacientes con THH debe ser realizado en centros especializados, preferiblemente con unidad de trasplante hepático (A1).
- •
El trasplante hepático es la única opción curativa para la THH con afectación cardíaca de alto flujo, enfermedad hepática avanzada o necrosis biliar isquémica (B1).
- •
La embolización transarterial es un método paliativo, temporal y de alto riesgo, que solo debe considerarse en centros especializados en pacientes no candidatos a trasplante hepático (B2).
El síndrome de obstrucción sinusoidal (SOS) es un cuadro secundario a una obstrucción del drenaje venoso del hígado que se produce por el daño causado en el endotelio sinusoidal hepático por los metabolitos intermedios de diferentes sustancias tóxicas. Inicialmente se denominó enfermedad veno-oclusiva hepática, pues se describieron como hallazgos característicos congestión sinusoidal, necrosis hemorrágica centrolobulillar y fibrosis perisinusoidal y endovenular. Actualmente, gracias al desarrollo de un modelo animal inducido por alcaloides de la pirrolizidina, se sabe que el fenómeno inicial en el SOS es la lesión de las células endoteliales hepáticas, que se desprenden de la pared, embolizan hasta la zona central del lobulillo hepático, generan una obstrucción al flujo y, por tanto, congestión sinusoidal. Asimismo, se producen otros cambios como la extravasación de eritrocitos y la acumulación de detritus celular y no celular en el espacio de Disse, que también dificultan el paso de la sangre a través de los sinusoides y hacen que el nombre de SOS sea más adecuado259.
En nuestro medio, el SOS aparece en cuatro escenarios: 1)como complicación de los regímenes mieloablativos en el trasplante de células hematopoyéticas (TCH); 2)tras el tratamiento con quimioterapia de tumores sólidos (generalmente metástasis de carcinoma colorrectal con oxaliplatino); 3)tras tratamiento inmunosupresor como azatioprina, 6-mercaptopurina o gemtuzumab, y 4)como complicación de la radioterapia, administrada de forma corporal total o local (radioembolización de tumores hepáticos). No obstante, existe una larga lista de fármacos y agentes tóxicos relacionados con el SOS (tabla 9)41.
Fármacos y agentes tóxicos relacionados con el síndrome de obstrucción sinusoidal
| Actinomicina D |
| Azatioprina |
| Busulfán |
| Carmustina |
| Arabinósido de citosina |
| Ciclofosfamida |
| Dacarbacina |
| Gentuzumab |
| Mercaptopurina |
| Mitomicina |
| Oxaliplatino |
| Alcaloides de la pirrolizidina |
| Uretano |
| Terbinafina |
| Hierbas de la medicina tradicional oriental |
| 6-Mercaptopurina |
| 6-Tioguanina |
| Radioterapia corporal y local |
| Trasfusión de plaquetas que contienen plasma ABO-incompatible |
La gran variabilidad del espectro clínico del SOS y la heterogeneidad de sus criterios diagnósticos hacen que sea difícil establecer su incidencia real. En Occidente la incidencia de SOS tras un TCH se sitúa entre el 5 y el 50%1. Esta variabilidad se debe a que el riesgo de SOS difiere en función del tipo de tratamiento mieloablativo, el número de ciclos de quimioterapia y factores propios del paciente. El SOS es más frecuente en pacientes tratados con ciclofosfamida o busulfán, en los que han recibido más de cuatro ciclos de quimioterapia y en aquellos con enfermedad hepática preexistente. La identificación de los factores de riesgo ha permitido optimizar el tratamiento y reducir la incidencia hasta cifras en torno al 5%260. La mayor incidencia de SOS en los receptores de un TCH puede deberse a que el tratamiento daña simultáneamente tanto las células sinusoidales hepáticas como los progenitores hematopoyéticos, lo que impide que estos reemplacen las células sinusoidales lesionadas261.
En los últimos años se han descrito cambios histológicos propios de SOS en tejido hepático procedente de la resección de metástasis hepáticas de carcinoma colorrectal de pacientes que habían recibido tratamiento con oxaliplatino. Estos cambios, a los que hay que añadir la hiperplasia nodular regenerativa, se observan en el 35-75% de estos pacientes262,263. La adición de bevacizumab, un fármaco antiangiogénico, parece desempeñar un efecto protector264. En la patogenia de estos hallazgos se ha invocado un mecanismo inflamatorio con activación del factor de crecimiento endotelial vascular (VEGF) secundario a la necrosis tumoral inducida por la quimioterapia.
La azatioprina y la 6-mercaptopurina se han asociado tradicionalmente con el desarrollo de SOS, pero se desconoce el mecanismo por el que inducen el daño sinusoidal. Por su parte, gemtuzumab es un anticuerpo cuya diana principal son las células mieloides que expresan CD34, un antígeno que comparten con las células sinusoidales hepáticas. Este anticuerpo monoclonal fue utilizado para el tratamiento de la leucemia mieloide aguda, junto con otros agentes citotóxicos potentes, entre los años 2000 y 2010, ocasionando SOS hasta en el 9% de los pacientes, con una mortalidad del 2,7%265.
Manifestaciones clínicasTres son las formas de presentación clínica del SOS: 1)aguda, caracterizada por ascitis rápidamente progresiva, hepatomegalia dolorosa e ictericia; 2)subaguda, con ascitis recurrente, esplenomegalia y hepatomegalia, y 3)crónica, indistinguible del cuadro de HTP asociada a la cirrosis, bien asintomática o manifiesta por complicaciones de la HTP.
En los receptores de un TCH, el SOS suele aparecer en los primeros 20días tras el tratamiento con ciclofosfamida, aunque puede demorarse más allá del mes si se han utilizado otros tratamientos menos agresivos. Se caracteriza por hiperbilirrubinemia, ascitis de difícil control y hepatomegalia dolorosa. Estos hallazgos, aunque característicos del SOS, pueden obedecer a otros factores etiológicos frecuentes en el contexto de un TCH, como la hepatitis aguda viral, las infecciones bacterianas, la hepatotoxicidad o la enfermedad de injerto contra el huésped. Este hecho hace que la aplicación de criterios diagnósticos puramente clínicos, como los de Seattle o Baltimore, sean insuficientes para el diagnóstico de SOS tras el TCH266,267.
El SOS es una complicación grave del TCH, con tasas de mortalidad que varían entre el 3% en las formas leves hasta el 100% en las graves. El grado de hiperbilirrubinemia y de hipertransaminasemia, el aumento de peso y el mayor gradiente de presión venosa hepática se asocian a un peor pronóstico.
El SOS asociado a la quimioterapia con oxaliplatino suele ser asintomático o escasamente sintomático en su forma aguda y suele manifestarse tardíamente con signos inequívocos de HTP (varices esofágicas, trombocitopenia o esplenomegalia). La correlación entre los hallazgos histológicos y clínicos es mínima, ya que la mayoría de las muestras de tejido hepático analizadas proceden del material de resección de las metástasis hepáticas, que solo se llevan a cabo en los casos con función hepática conservada. El impacto del SOS sobre el pronóstico de estos pacientes es incierto y no se ha demostrado que su presencia aumente la mortalidad. Se desconoce la capacidad de regresión del SOS tras la suspensión de la quimioterapia con oxaliplatino, y parece que debe transcurrir entre 1 y 3años para observar una mejoría en parámetros indirectos de HTP, como el diámetro esplénico.
DiagnósticoEn nuestro medio, el SOS hay que sospecharlo en dos contextos clínicos muy diferentes: inmediatamente después de un TCH y tras tratamiento prolongado con quimioterapia por un carcinoma colorrectal o con algunos inmunosupresores.
Respecto a la primera de las situaciones, la sospecha de SOS se basa principalmente en la aparición de ictericia, hepatomegalia y aumento de peso o ascitis tras un TCH. Los criterios diagnósticos publicados en la década de los ochenta se basaban únicamente en hallazgos clínicos, y cuando están presentes la enfermedad ya está muy evolucionada266,267. Por este motivo, la Sociedad Europea de Trasplante de médula y células hematopoyéticas ha establecido nuevos criterios que combinan hallazgos clínicos, histológicos y de imagen, y ha descrito la cronología de su aparición (tabla 10)268.
Criterios diagnósticos del síndrome de obstrucción sinusoidal (SOS) tras el trasplante de células hematopoyéticas (TCH)268
| SOS clásico (en los 21 días tras el TCH) | SOS de comienzo tardío (>21 días tras TCH) |
|---|---|
| Bilirrubina ≥ 2mg/dl y dos de los siguientes: | Criterios clásicos o |
| Hepatomegalia dolorosa | Confirmación histológica o |
| Aumento de peso >5% | Dos de los siguientes: |
| Ascitis | Bilirrubina ≥2mg/dl |
| Hepatomegalia dolorosa | |
| Aumento de peso >5% | |
| Ascitis | |
| y evidencia hemodinámica o ultrasonográfica de SOS |
Analíticamente, la elevación de bilirrubina es un índice sensible pero inespecífico. Aunque en el pasado se analizó la posible utilidad diagnóstica y pronóstica de varios factores hemostáticos como las proteínasC y S, la antitrombina, el factorviii o el fibrinógeno, y de algunos marcadores de daño endotelial, como la trombomodulina o el factor Von Willebrand269,270, actualmente carecen de aplicabilidad práctica.
Las pruebas de imagen son imprescindibles, ya que permiten excluir otras enfermedades, como el síndrome de Budd-Chiari o la trombosis aguda de la vena porta, y ofrecen unos hallazgos que, aunque inespecíficos, pueden apoyar el diagnóstico. Los signos ecográficos más frecuentes en el estudio Doppler son hepatomegalia, esplenomegalia, ascitis, engrosamiento de la pared vesicular, aumento del calibre portal con inversión del flujo y pérdida del patrón trifásico típico del flujo en las venas hepáticas271.
La biopsia hepática resulta fundamental, pues permite establecer el diagnóstico y excluir otras entidades con presentación similar tras un TCH. Se debe realizar por vía transyugular para minimizar el riesgo de complicaciones y medir el gradiente de presión venosa hepática. Un gradiente de presión venosa hepática superior a 10mmHg se ha relacionado con un peor pronóstico y se correlaciona estrechamente con los hallazgos de la biopsia hepática, con una especificidad del 91% y un valor predictivo positivo del 86%272. Los hallazgos histopatológicos más característicos son la obstrucción sinusoidal congestiva, que puede asociarse a fibrosis perisinusoidal, la obstrucción fibrosa de la vena central, la hiperplasia nodular regenerativa y la peliosis hepática273.
El SOS inducido por quimioterapia para el tratamiento del carcinoma colorrectal debe sospecharse en pacientes con signos inequívocos de HTP (fundamentalmente presencia de varices esofagogástricas, trombocitopenia o esplenomegalia), en ausencia de datos clínicos, radiológicos o elastográficos sugerentes de cirrosis. En estos pacientes es imprescindible realizar un estudio etiológico completo de enfermedad hepática, que incluya la biopsia hepática. Esta última mostrará hallazgos similares a los descritos en el contexto de un TCH, a los que pueden añadirse cambios crónicos como la hiperplasia nodular regenerativa. La ecografía Doppler es obligatoria para comprobar la permeabilidad de las grandes venas hepáticas y evaluar la presencia de signos de cirrosis, como la irregularidad del contorno hepático. El desarrollo de nuevas técnicas de resonancia nuclear magnética facilitará el diagnóstico radiológico del SOS274,275. El SOS atribuido a inmunosupresores, como azatioprina, habitualmente se sospecha ante una trombocitopenia progresiva y mantenida en pacientes que reciben dichos tratamientos y, al igual que en el SOS inducido por quimioterápicos, hay que confirmarlo histológicamente.
Profilaxis y tratamientoEs fundamental intentar minimizar el riesgo y la gravedad del SOS, pues no se dispone de ningún tratamiento totalmente eficaz. Las medidas profilácticas incluyen la actuación sobre los factores de riesgo modificables, como reducir la intensidad del acondicionamiento en el TCH o evitar el uso concomitante de fármacos hepatotóxicos con agentes potencialmente causantes de SOS. Por otro lado, se debe identificar a los pacientes con mayor riesgo de desarrollar la enfermedad para utilizar en ellos regímenes no ablativos y monitorizarlos de forma estricta durante el tratamiento271,276.
Existe también la posibilidad de utilizar profilaxis farmacológica. En este sentido, un metaanálisis ha analizado la utilidad de la anticoagulación, con resultado global negativo277. Un estudio prospectivo mostró que los pacientes que recibían ácido ursodesoxicólico tras un TCH presentaban un SOS de menor severidad y una supervivencia al año superior a quienes no lo recibían278. Sin embargo, una revisión reciente de los cuatro estudios publicados que comparan ácido ursodesoxicólico con placebo o no tratamiento concluye que la evidencia que sustenta el uso profiláctico de ácido ursodesoxicólico es de baja calidad279.
Por otra parte, se ha demostrado en un estudio multicéntrico controlado que el defibrotide, un oligodesoxiribonucleótido con propiedades antitrombóticas y antiinflamatorias, disminuye la incidencia de SOS tras el TCH en menores de 18años con al menos un factor de riesgo para el desarrollo del mismo. En adultos solo se han realizado estudios retrospectivos, pero no existen motivos que impidan extrapolar los resultados obtenidos en niños280.
El tratamiento del SOS es principalmente de soporte, con un adecuado manejo de la retención hídrica y vigilancia de las posibles complicaciones. Los casos más graves deben manejarse en una unidad de cuidados intensivos281. El TIPS se ha utilizado en algunos pacientes con resultados dispares282,283. La indicación de trasplante hepático está limitada por la frecuente naturaleza oncológica de la enfermedad subyacente, aunque se ha realizado con éxito en pacientes seleccionados284. El único fármaco que ha demostrado eficacia para el tratamiento del SOS grave es el defibrotide, que a dosis de 25mg/kg/día demostró un aumento de la supervivencia en pacientes con SOS y fallo multiorgánico cuando se comparó con controles históricos (38.2% vs. 25%; p=0,0109)285.
Recomendaciones- •
Considerar el diagnóstico de SOS ante signos sugerentes de enfermedad hepática o HTP en pacientes que hayan recibido un trasplante de médula ósea, tratamiento con quimioterápicos o con inmunosupresores por un trasplante de órgano sólido o para el control de una enfermedad inflamatoria intestinal (B1).
- •
Considerar el diagnóstico de SOS ante la presencia de hepatomegalia, hiperbilirrubinemia, aumento de peso y ascitis en pacientes sometidos a trasplante de médula ósea y/o en tratamiento citostático o inmunosupresor (B1).
- •
El diagnóstico de SOS se establece por los datos que aportan las técnicas de imagen y, especialmente, el estudio hemodinámico y la biopsia hepática transyugular (B1).
- •
La profilaxis del SOS se basa en controlar los factores de riesgo y el tratamiento en medidas de soporte (B1).
- •
El defibrotide es eficaz como profilaxis en pacientes con factores de riesgo y como tratamiento de los casos de SOS con fracaso multiorgánico (B1).
- •
No existe evidencia para recomendar el uso del TIPS en pacientes en los que fracase el tratamiento médico.
Las técnicas de imagen están cobrando cada vez más importancia en el diagnóstico y evaluación de las enfermedades vasculares hepáticas, no solamente como herramienta no invasiva para establecer el diagnóstico, sino también para valorar el grado de afectación, monitorizar la respuesta al tratamiento y detectar complicaciones asociadas.
La ecografía Doppler sigue siendo la herramienta fundamental y es, sin duda, la primera prueba a realizar en cualquiera de las enfermedades vasculares hepáticas1,286,287. Es una técnica inocua, no invasiva y con elevada disponibilidad. La sensibilidad de la ecografía Doppler para detectar flujo en los vasos, incluso de pequeño calibre, es muy elevada. Los hallazgos generalmente no necesitan confirmación mediante otras pruebas de imagen288. Tiene la ventaja añadida de que permite un estudio funcional, ofreciendo información sobre la dirección y la velocidad del flujo. El contraste ecográfico puede ser de ayuda en algunas ocasiones, ya que aumenta la sensibilidad de la ecografía basal para la detección de flujo289-291.
La elastografía permite obtener datos acerca de las propiedades físicas del tejido hepático y esplénico a través de la medición de la velocidad de desplazamiento de las ondas de cizallamiento que se generan tras la transmisión de impulsos mecánicos o ultrasonográficos en los tejidos292. Ya que en la cirrosis hepática existe un notable componente de fibrosis en el tejido hepático, la rigidez del hígado es elevada en esta enfermedad292; en cambio, grados altos de fibrosis hepática están generalmente ausentes en las enfermedades vasculares del hígado, y la elastografía hepática en estos últimos resulta normal o solo ligeramente elevada. Por tanto, la elastografía hepática es una herramienta adicional que puede utilizarse para un diagnóstico diferencial correcto.
La TC y la RM, ambas con contraste intravenoso, pueden ser útiles para completar el diagnóstico cuando no hay una buena visión ecográfica293,294. Además, permiten estudiar la permeabilidad del eje espleno-porto-mesentérico completo, muchas veces parcialmente oculto en la ecografía por la interposición del gas abdominal87,295, y ofrecen un mapa de la circulación colateral de todo el abdomen, que tampoco es posible obtener en su totalidad mediante ecografía296-301. Por otra parte, las imágenes obtenidas con la TC o la RM tienen la gran ventaja de ser apropiadas para poderlas evaluar en comités multidisciplinarios para planificación terapéutica1. No existen suficientes estudios comparativos que aporten datos sobre la superioridad diagnóstica de una de las dos técnicas sobre la otra en la valoración de los vasos hepáticos. Las ventajas de la TC sobre la RM son la mayor disponibilidad, el menor coste y la rapidez de la adquisición, lo que favorece que sea mejor tolerada por los pacientes y que esté sujeta a menos artefactos de movimiento. Sin embargo, la gran desventaja es el uso de radiaciones ionizantes, lo cual limita su empleo cuando se requieren exámenes repetidos302. En caso de alergia al contraste yodado de la TC, la alternativa es realizar una RM. Sin embargo, tanto el contraste yodado utilizado en la TC como el contraste con gadolinio de la RM están contraindicados si existe insuficiencia renal, el primero porque es nefrotóxico y el segundo porque se ha asociado a la fibrosis sistémica nefrogénica303. Se han propuesto estudios RM sin contraste con secuencias específicas para poder estudiar los vasos venosos abdominales304,305, si bien el estudio con contraste es siempre preferible.
Radiología en el síndrome de Budd-ChiariLa ecografía, la TC y la RM son muy sensibles a la hora de valorar la permeabilidad de las venas suprahepáticas y de la vena cava inferior, con una precisión >95%306. Por ello, la ecografía es la técnica inicial para valorar un paciente con sospecha clínica de síndrome de Budd-Chiari (SBC)1,41. Es recomendable que en pacientes con sospecha de SBC se realice la ecografía en centros con amplia experiencia.
Signos directosEl diagnóstico de SBC se confirma observando directamente la afectación de una o más venas suprahepáticas307. Esta se puede manifestar de diferentes maneras: 1)material ecogénico (trombo) en el interior de una o más venas suprahepáticas, con ausencia de flujo en la totalidad del vaso o distalmente a la trombosis (en casos agudos o subagudos); 2)total ausencia de una o más venas suprahepáticas, sustituidas por cordón hiperecogénico (fibrosis), con ausencia de flujo suprahepático confirmada por Doppler color y Doppler pulsado, y 3)sustitución de la vena hepática por un vaso tortuoso de morfología anormal.
Aunque en nuestro medio la afectación de la vena cava inferior no es frecuente (10-15%), en todos los pacientes con sospecha o diagnóstico confirmado de SBC la ecografía Doppler debería explorar la permeabilidad de la vena cava inferior307.
En la gran mayoría de casos la exploración en modoB, Doppler color y Doppler pulsado es suficiente para descartar o diagnosticar el SBC. En casos complejos en los que persistan dudas acerca de la presencia de trombosis en una o más venas hepáticas tras Doppler color/potencia/pulsado, la utilización de contraste ecográfico puede ser de gran ayuda para confirmar o descartar este diagnóstico.
A pesar de que las tres técnicas (ecografía, TC y RM) permiten detectar los trombos en el interior de las venas suprahepáticas con precisión similar, la ecografía parece superior para la detección de membranas en la vena cava inferior y de estenosis cortas en las venas suprahepáticas308.
Signos indirectosMorfología hepáticaEn casos agudos, casi invariablemente el hígado se presenta muy aumentado de tamaño y muy heterogéneo, a veces con presencia de nódulos (ver más adelante)309,310. La superficie del hígado suele ser lisa y suele estar presente la ascitis. La TC y la RM pueden demostrar el trastorno en la perfusión del parénquima hepático, hecho que no es posible constatar con la ecografía309-311. Las regiones hepáticas más periféricas están más congestivas y edematosas, por lo que el estudio con contraste se caracteriza por un aumento de la captación de las áreas más centrales del hígado y disminución de la captación del parénquima periférico. Las regiones con menor afectación del drenaje, como el lóbulo caudado, muestran un aumento relativo de la captación de contraste en fase venosa309-313. Además, el edema periférico se traduce en la RM por una hiposeñal en las secuencias potenciadas en T1 y una hiperseñal en las secuencias potenciadas en T2 en las áreas más periféricas.
En fases crónicas puede observarse un aspecto del hígado parecido al del hígado cirrótico, con atrofia de los segmentos que no tienen un suficiente retorno venoso en función de la/s vena/s interesada/s (p.ej., lóbulo derecho atrófico)309-311. En la TC/RM se pierde el patrón de captación central, apareciendo en ocasiones una captación heterogénea sin patrón definido o bien presentando una captación homogénea. Además, la disminución del edema en las formas crónicas provoca una disminución de la hiperseñal en las secuencias potenciadas en T2311,314. En el 80% de los casos subagudos o crónicos el lóbulo caudado es hipertrófico (ver más adelante). La hipertrofia del lóbulo caudado puede ser muy marcada y dar lugar a compresión de la vena cava inferior en su trayecto intrahepático307,309-311.
En pacientes con SBC no tratado la elastografía hepática demuestra un marcado aumento de la rigidez hepática debido a la congestión venosa (datos no publicados); por tanto, la rigidez hepática no debería utilizarse para detectar la presencia de cirrosis en estos pacientes.
Vena caudadaEl lóbulo caudado tiene un drenaje venoso independiente de la vena cava inferior en forma de una vena caudada única (85-90%). Esta vena no suele estar afectada por la trombosis y, en caso de trombosis de las demás venas, el drenaje venoso hepático se realiza a través de ella, con su consecuente hipertrofia y la del lóbulo caudado. En el 50% de los pacientes con SBC se encuentra una dilatación de la vena caudada, siendo un diámetro >3mm diagnóstico, en ausencia de insuficiencia cardiaca315.
Colaterales veno-venosas intrahepáticasSuelen visualizarse mejor con Doppler color/potencia como pequeños vasos de distribución anárquica alrededor de las venas hepáticas trombosadas (spider web)307. Menos frecuentemente existen vasos de tamaño mayor que conectan dos diferentes venas hepáticas o entre una vena hepática y la vena cava inferior a lo largo de una trayectoria no habitual (p.ej., subcapsulares o intracapsulares)316. La presencia de colaterales veno-venosas puede provocar inversión de flujo en una o más venas hepáticas en sus porciones permeables307.
Colaterales portosistémicas y vena portaEn pacientes con SBC agudo se observa frecuentemente un flujo hepatofugal en la vena porta307; asimismo, en pacientes con SBC subagudo y crónico es frecuente observar la repermeabilización de la vena paraumbilical (debido a HTP intrahepática), y pueden desarrollarse otros signos de HTP como esplenomegalia y circulación portosistémica, como en la HTP cirrótica.
Tanto la TC como la RM ofrecen un mapa excelente de los vasos de circulación colateral extrahepáticos, los cuales no se suelen poder explorar en su totalidad mediante ecografía317 Sin embargo, son menos precisas que la ecografía Doppler en la detección de pequeños vasos de circulación colateral intrahepáticos y subcapsulares, propios de este síndrome310,318.
La coexistencia de TP tiene que evaluarse siempre en pacientes con SBC, ya que esta es frecuente (15-20% de los casos) y se asocia a peor pronóstico.
Nódulos en el síndrome de Budd-ChiariEn el SBC crónico aparecen muy frecuentemente nódulos benignos de naturaleza regenerativa que suelen ser múltiples319-321. Histológicamente son similares a hiperplasias nodulares focales o hiperplasia nodular focal like322. En su mayoría son nódulos arterializados que muestran captación de contraste en fase arterial en las técnicas de imagen con contraste (TC, RM y ecografía con contraste) y clásicamente se ha descrito que se mantienen hiper o isocaptantes en las fases venosas14,16,323. No obstante, el aspecto es heterogéneo y puede haber diferentes patrones de captación en las pruebas de imagen. Un hallazgo característico es la presencia de una cicatriz central generalmente cuando los nódulos son mayores de 1cm16,324. El hecho de que estos nódulos sean hipervasculares obliga a establecer el diagnóstico diferencial con el hepatocarcinoma. Este se ha descrito especialmente en las formas congénitas ocasionadas por membranas en la vena cava inferior, forma poco frecuente en Europa325,326. Sin embargo, Moucari et al.14 reportan una prevalencia del hepatocarcinoma en el SBC similar a la que existe en otras hepatopatías crónicas. Se trata, no obstante, de un estudio retrospectivo, y no existen estudios prospectivos con series largas que permitan confirmar estos datos. La RM con contraste de excreción hepatobiliar puede ser de ayuda en el diagnóstico321,327; sin embargo, hacen falta más estudios. Hasta la fecha no hay una pauta establecida para el control de los nódulos asociados al SBC; es importante conocer que son lesiones que pueden crecer, generalmente de forma lenta, aunque en ocasiones pueden presentar un crecimiento rápido sin que se asocien a malignidad.
La venografía no suele ser necesaria para establecer el diagnóstico del SBC, aunque puede ser de ayuda en la determinación de la extensión de la trombosis y es útil para medir presiones y planificar el tratamiento. Además de constatar la obstrucción de las venas suprahepáticas o la vena cava inferior, ofrece un patrón de opacificación característico rellenando la red de pequeños vasos colaterales intrahepáticos (spider-web) o vasos de circulación colateral subcapsulares328.
Radiología en la hipertensión portal idiopáticaEcográficamente el hígado en la HTPI puede ser indistinguible de un hígado cirrótico329, pero más frecuentemente la superficie hepática es solo ligeramente irregular (sin claros nódulos), y el hígado puede tener una morfología atípica con marcada hipotrofia segmentaria subcapsular (visible como acercamiento de las venas hepáticas y ramas portales a la cápsula hepática)330. En los pacientes con HTPI suele destacar una gran esplenomegalia331. Por portografía se han descrito anomalías de la ramificación de la vena porta (disminución de las ramas de tamaño medio, irregularidades e interrupciones a este nivel, y áreas subcapsulares sin vascularización portal)332, y en un estudio se ha postulado que la ecografía con medio de contraste en 3 dimensiones pueda reproducir este hallazgo permitiendo diferenciar la HTPI de la cirrosis333. En poblaciones asiáticas se han descrito también cambios específicos de la HTPI tras medio de contraste ecográfico (Sonazoid), que corresponden a un retraso en el refuerzo periportal334,335. No hay datos en pacientes europeos, y estas técnicas tienen que considerarse experimentales. En la RM se ha descrito un incremento en la intensidad de señal periportal en las secuencias potenciadas en T2336-338 y un realce periportal en la fase hepatobiliar del contraste hepatoespecífico Gd-EOB-DTPA en la RM339. Otros hallazgos menos frecuentes son la hipercaptación periférica en fases agudas338,340 y una mayor incidencia de nódulos hepáticos benignos hipervasculares tipo HNF-like59,341.
Se ha demostrado que la rigidez hepática (que refleja la presencia de fibrosis hepática) por elastografía de transición (FibroScan)342 o por point Shear-Wave Elastography (pSWE)343 es significativamente inferior en los pacientes que padecen HTPI que en los pacientes cirróticos, a paridad con las manifestaciones clínicas. En los dos estudios publicados la rigidez hepática en HTPI fue de media de 8kPa342 y de 1,56m/s343; estos valores no son estrictamente normales, pero no son compatibles con los hallazgos típicos de la HTP cirrótica (rigidez hepática al menos 13kPa, y normalmente >20kPa; pSWE>2,4m/s)292.
En cambio, la rigidez del bazo (que parece reflejar la severidad de la HTP independientemente de su causa)344 es elevada de forma parecida (o es incluso mayor en la HTPI) en ambos grupos de pacientes343. Aunque faltan datos de validación en series amplias, y existe un amplio solapamiento de valores entre HTPI y cirrosis en los dos estudios publicados, la medición de la rigidez en el hígado (eventualmente en combinación con la rigidez del bazo) podría ser de utilidad para diferenciar la HTPI de la HTP cirrótica.
Radiología en la trombosis portalFrente a una sospecha clínica de TP, la primera técnica de diagnóstico por imagen a utilizarse es la ecografía, ya que tiene una sensibilidad y una especificidad >90% para la identificación de la trombosis (similar a la de la TC), y es generalmente suficiente para establecer o descartar trombosis288. Los elementos diagnósticos de la TP incluyen al menos uno de los siguientes signos: 1)presencia de un trombo endoluminal en al menos uno de los vasos del sistema portal; 2)ausencia de flujo en uno o más vasos del sistema portal, o 3)presencia de cavernomatosis87.
Por ecografía en escala de grises la trombosis se identifica como material ecogénico en el interior de la luz del vaso; puede ocupar el vaso parcialmente (trombosis mural o parcial) o completamente87. El Doppler color/potencia y el Doppler pulsado permiten completar la exploración confirmando la presencia o ausencia de flujo venoso residual; la ausencia de flujo debe confirmarse utilizando la mínima frecuencia de repetición de pulso (pulse repetition frequency [PRF]) posible para evitar confusión con flujos lentos (particularmente en cirrosis). La ecografía es igualmente sensible y específica para el diagnóstico de trombosis de la vena esplénica, mientras que no es suficientemente sensible para el diagnóstico de trombosis de la vena mesentérica superior288,345. Por tanto, en caso de sospecha de trombosis mesentérica (dolor abdominal sugestivo de infarto intestinal o signos de gravedad) se debería utilizar directamente la TC con medio de contraste.
En pacientes diagnosticados de TP la ecografía debería informar acerca de la presencia o ausencia de cirrosis, ya que esto puede modificar la actitud terapéutica. Dado que en la trombosis de larga evolución el hígado puede sufrir cambios morfológicos importantes (atrofia segmentaria e hipertrofia de otros segmentos) parecidos a los que ocurren en el hígado cirrótico, el diagnóstico diferencial por técnicas de imagen tradicionales puede ser difícil o imposible. Este aspecto ha mejorado con la introducción de las técnicas elastográficas346.
En cuanto a la datación de la trombosis, por ecografía (y por TC, pero no por RM) es posible detectar calcificaciones en el trombo o en la pared del vaso, que sugieren que la trombosis es de larga evolución87. En los pacientes que desarrollan cavernomatosis tras una TP completa la ecografía identifica pequeños vasos tortuosos con flujo hepatopetal que sustituyen el vaso afectado por la trombosis87. Debería intentarse valorar e informar al clínico acerca de la presencia y tamaño de un remanente de vena porta, y de un vaso dominante dentro del cavernoma, ya que esto puede modificar la actitud terapéutica (p.ej., TIPS).
En pacientes que desarrollan TP en el contexto de un hepatocarcinoma, o en los que se detecten a la vez lesiones focales hepáticas y TP, debería considerarse siempre el diagnóstico diferencial entre trombosis simple e invasión vascular tumoral. Acerca de este problema, debería evitar utilizarse el término «trombosis maligna» o «trombosis neoplásica», ya que estos no son correctos. Los signos que sugieren invasión vascular son: 1)interrupción de la pared de la vena porta; 2)aspecto expansivo (>2cm) del vaso, y 3)presencia de hipervascularización arterial en caso de tratarse de invasión por parte de un hepatocarcinoma o de un colangiocarcinoma137,347,348; el tejido tumoral intravascular suele tener un comportamiento con el contraste similar al del tumor primario, mostrando hipercaptación en la fase arterial y lavado precoz en la fase tardía. La ecografía con medio de contraste es útil para detectar este comportamiento (alta especificidad)137,289,347,348 y debería utilizarse una prueba con contraste (ecografía, TC o RM) en pacientes con cirrosis, presencia o historia de hepatocarcinoma y TP de nueva aparición290,349.
Además de la extensión del trombo, la TC y la RM pueden dar mayor información que la ecografía sobre otras causas de trombosis distintas de la cirrosis (pancreatitis, focos sépticos abdominales) y, en los casos en que las venas mesentéricas estén afectadas, permiten valorar signos de isquemia intestinal.
En la trombosis crónica con formación de cavernoma, la colangio-RM es la técnica de elección para valorar la presencia de CP, que llega a estar presente en más del 80% de los pacientes con cavernomatosis97.
Sería recomendable realizar al menos un estudio colangio-RM en el momento del diagnóstico a todos los pacientes con cavernomatosis. En las trombosis agudas en las que no se consigue recanalización es también recomendable realizar una colangio-RM a los 12meses del episodio agudo para constatar la presencia de CP. Si no se ha desarrollado una colangiopatía severa (grado3) en este periodo, la probabilidad de progresión es baja y no parece necesario realizar más estudios de evaluación96.
Radiología en la telangiectasia hemorrágica hereditariaLa ecografía Doppler color es la técnica de primer nivel para valorar la afectación hepática en pacientes con sospecha de telangiectasia hemorrágica hereditaria (THH) y en el seguimiento de pacientes con THH asintomática, ya que se ha comprobado una buena correlación con el curso clínico de la enfermedad235. Sin embargo, la sensibilidad de esta técnica parece inferior a la de la TC242, y el rol de otras técnicas se está rápidamente redefiniendo.
Existen múltiples signos ecográficos de afectación hepática en THH239,350-352. El vaso más importante a valorar en pacientes con THH es la arteria hepática, ya que sus cambios reflejan la presencia de afectación hepática precozmente239.
Debería utilizarse tanto el modoB para valorar el diámetro y la morfología extrahepática e intrahepática de este vaso, como el Doppler pulsado para medir la velocidad de flujo y los índices de resistencia. La afectación hepática lleva progresivamente a un aumento del diámetro de la arteria hepática, a una mayor tortuosidad de este vaso en su parte extrahepática e intrahepática y a un flujo acelerado y de baja resistencia. Además, mediante Doppler-color/potencia pueden observarse pequeñas telangiectasias parenquimatosas (color-spots), en particular con sonda de alta frecuencia a nivel subcapsular221. En fases más avanzadas de la afectación hepática puede aparecer dilatación de las venas hepáticas y vena porta (hasta la inversión del flujo portal). Existen casos de desarrollo de cirrosis hepática en pacientes con THH; en esta fase el hígado puede tener los signos ecográficos clásicos de esta enfermedad (superficie nodular; parénquima heterogéneo)239,350-352. Finalmente, pueden encontrarse lesiones focales hepáticas en pacientes con THH; la mayoría de ellas son hiperplasias nodulares focales, y su estudio debería ampliarse con RM (ver más adelante).
Para simplificar el diagnóstico ecográfico de afectación hepática en pacientes con THH se ha sugerido utilizar la combinación de los criterios de la tabla 11225. Dos criterios mayores o un criterio mayor y dos menores serían suficientes para el diagnóstico de afectación hepática en THH. Se han descrito alteraciones hepáticas en el 74-100% de las TC de pacientes con este síndrome, que en su mayor parte son clínicamente silentes222,228,353. A pesar de que la ecografía Doppler es la técnica de primera línea, la TC está cobrando cada vez más importancia en el manejo de la enfermedad para establecer el diagnóstico. El papel de la TC en el manejo de esta enfermedad no está bien establecido, y algunos autores solo la recomiendan cuando la afectación hepática por las malformaciones vasculares es severa con gran impacto hemodinámico y repercusión clínica, o cuando se asocian lesiones focales hepáticas para su caracterización. Sin embargo, la TC permite la detección de signos propios de la enfermedad que no es posible detectar con la ecografía y que podrían ser útiles en el diagnóstico e incluso en la determinación del grado de afectación240. Permite además detectar malformaciones vasculares en otros órganos abdominales, como el páncreas241,242. Son necesarios más estudios que correlacionen los hallazgos de la TC con la evolución clínica.
Criterios ecográficos simplificados para el diagnóstico de la afectación hepática en la telangiectasia hemorrágica hereditaria225
| Criterios | Hallazgos ecográficos |
|---|---|
| Mayores | Dilatación de la arteria hepática común >7mm |
| Hipervascularidad arterial intrahepática | |
| Menores | Velocidad pico sistólica en la arteria hepática común >110cm/s |
| Índice de resistencia de la arteria hepática común <0,60 | |
| Velocidad máxima del flujo en la vena porta >25cm/s | |
| Arteria hepática común tortuosa | |
| Opcionales (no se utilizan para el diagnóstico) | Dilatación de la vena porta >13mm |
| Dilatación de las venas hepáticas >11mm | |
| Hepatomegalia >15cm (línea medio-clavicular) | |
| Superficie hepática nodular |
Para poder detectar todos los signos asociados a la enfermedad es fundamental incluir una fase arterial en el estudio con TC o RM. Ambas técnicas permiten la detección de los hallazgos característicos: aneurismas de la arteria hepática, fístulas arterioportales, fístulas arteriovenosas, shunts veno-venosos y telangiectasias con gran fiabilidad222,229,242,353. Las fístulas arterioportales y arteriovenosas se ponen de manifiesto en la TC y la RM por la opacificación precoz de la porta o de las venas suprahepáticas durante la fase arterial, hallazgo que no es posible detectar con la ecografía Doppler.
A pesar de no tener suficientes estudios que comparen la TC con la ecografía, la primera parece superior en la detección de pequeñas anomalías vasculares que pueden pasar desapercibidas en la ecografía, especialmente pequeñas fístulas arteriovenosas periféricas o pequeñas telangiectasias242. Uno de los hallazgos más específicos en la TC (hasta un 100% de especificidad reportado) es la presencia de ramas arteriales intrahepáticas dilatadas y tortuosas242.
Un hallazgo relativamente frecuente en la TC es la presencia de masas vasculares confluentes, que corresponden a áreas de múltiples telangiectasias que confluyen, o grandes cortocircuitos que son directamente visibles222,354,355. Son masas que captan contraste en fase arterial y se mantienen hipercaptantes en las fases venosas.
Se ha descrito también una mayor prevalencia de hiperplasia nodular focal en la THH (en torno al 3%)220,229,356, aunque hay alguna serie reportada con prevalencias de hasta el 47%232. La RM puede ser útil en estos casos; sin embargo, su papel en el diagnóstico de la enfermedad no se ha estudiado en profundidad. La arteriografía ya no se utiliza para el diagnóstico, quedando reservada para maniobras terapéuticas.
Radiología en el síndrome de obstrucción sinusoidalNo es posible establecer el diagnóstico de síndrome de obstrucción sinusoidal (SOS) mediante técnicas de imagen, ya que no existen signos específicos; sin embargo, proporcionan datos que pueden apoyar la sospecha clínica y descartar otros posibles diagnósticos.
La ecografía en modo B es la prueba de primer nivel. En pacientes con SOS suele observarse hepatomegalia y presencia de ascitis, engrosamiento de la pared de la vesícula biliar (>6mm), y se puede descartar dilatación del árbol biliar357.
El gran aumento de la presión sinusoidal lleva a alteraciones hemodinámicas, y mediante Doppler color y Doppler pulsado puede observarse precozmente un aumento de los índices de resistencia de la arteria hepática y más tardíamente una inversión del flujo portal (segmentario inicialmente o hasta la porta principal) y una disminución del flujo en las venas hepáticas. La combinación de estos criterios ecográficos tuvo valor pronóstico en un estudio358. El papel de la elastografía hepática y de la ecografía con contraste en el SOS no está definido, pero se ha descrito un aumento de rigidez hepática por pSWE y una perfusión heterogénea por contraste ecográfico359.
En la TC y en la RM con contraste convencional los hallazgos son inespecíficos: edema periportal, ascitis, disminución del diámetro de las venas suprahepáticas (<0,45cm)360-363. Hace unos años se reportó que la RM con contrastes superparamagnéticos de óxido de hierro era capaz de demostrar un patrón reticular en el hígado afecto de este síndrome, con una sensibilidad y una especificidad del 87 y del 89%, respectivamente, permitiendo incluso la detección subclínica del síndrome275,364. Sin embargo, estos contrastes no están disponibles en la actualidad. En un estudio reciente con contrastes hepatoespecíficos de excreción biliar, ácido gadoxético (Gd-EOB-DTPA, Primovist®), Shin et al.274 reportan que también es posible detectar un patrón reticular con una elevada especificidad, próxima al 100%, si bien la sensibilidad es baja y no es útil para la detección de formas leves. Este hallazgo ha sido respaldado con casos aislados reportados365, sin que hasta la fecha haya estudios robustos que permitan establecer el papel de la RM con los nuevos contrastes hepatoespecíficos en el diagnóstico de esta enfermedad.
Recomendaciones generales- •
La ecografía (modo B +Doppler color y Doppler pulsado) es la técnica de imagen inicial en el estudio de los pacientes con HTP, con el fin de establecer la permeabilidad de la vena porta y las suprahepáticas, así como de evaluar el parénquima hepático (A).
- •
En los pacientes con HTP de causa desconocida y sin trombosis vascular se recomienda realizar una elastografía hepática, ya que una rigidez hepática inferior a la esperada en la cirrosis sugiere HTPI (C).
- •
Para la caracterización de los nódulos hepáticos en pacientes con enfermedades vasculares del hígado se recomienda la RM (A).
- •
En los pacientes con enfermedad vascular hepática que son potenciales candidatos a trasplante hepático, TIPS o derivación portosistémica quirúrgica es recomendable realizar una angio-TC y/o una angio-RM para definir la anatomía vascular (estudio de vasos permeables, mapeo de colaterales) (A).
- •
Se recomienda un seguimiento semestral con ecografía Doppler de todos los pacientes con SBC para detectar lesiones focales, descartar signos de progresión de la trombosis o confirmar la permeabilidad del TIPS (B).
- •
Se recomienda un seguimiento semestral con ecografía Doppler de los pacientes con HTPI para detectar TP asintomática (D).
- •
Se recomienda emplear la angio-TC en caso de sospecha de infarto intestinal, o que no existan operadores expertos en ecografía abdominal (A).
- •
En pacientes con diagnóstico previo o concomitante de neoplasia primitiva del hígado se debe descartar el origen tumoral de la TP (B).
- •
Es recomendable la TC o la RM con contraste para detallar la gravedad, la extensión de la trombosis y mapear la circulación colateral (B).
- •
Para evaluar la presencia y el grado de CP se recomienda utilizar la colangiografía por RM (A).
- •
En los pacientes con TP aguda que reciban tratamiento anticoagulante se recomienda la realización de una prueba de imagen 6meses después del inicio del tratamiento para evaluar el grado de recanalización.
- •
En los pacientes con TP crónica se sugiere la realización de pruebas de imagen cada 6-12meses para evaluar posibles fenómenos de re-trombosis (D).
- •
La técnica de imagen elegida para el seguimiento debería ser valorada individualmente en función de la localización de la trombosis, su posibilidad de ser visualizada por ecografía y la presencia o ausencia de síntomas (D).
- •
La presencia de afectación hepática en pacientes con THH debe evaluarse inicialmente con ecografía (modo B +Doppler color y Doppler pulsado) (A).
- •
En pacientes con afectación hepática por THH se valorará la realización de una TC y/o una RM con contraste para obtener un estudio más detallado de la afectación hepática (C).
- •
Se recomienda el seguimiento anual de los pacientes asintomáticos con técnicas de imagen mediante la ecografía Doppler (B).
Se entiende como trombofilia el incremento de susceptibilidad para padecer episodios trombóticos, especialmente venosos366. La trombofilia puede ser congénita o adquirida y se identifica en alrededor del 50% de los pacientes con tromboembolismo venoso idiopático (tabla 12)366-368. Los individuos afectos puede desarrollar un episodio de manera espontánea, pero en ocasiones concurren factores de riesgo adicionales que actúan a modo de desencadenantes, como cirugías, embarazo, tratamiento hormonal o cáncer366.
Estados protrombóticos a considerar en el estudio etiológico de la trombosis venosa esplácnica
| Estados protrombóticos hereditarios |
| Déficit de antitrombina |
| Déficit de proteína C |
| Déficit de proteína S |
| Mutación factor vLeiden |
| Mutación G20210A del gen de la protrombina |
| Estados protrombóticos adquiridos |
| Neoplasias mieloproliferativas (policitemia vena, trombocitemia esencial, mielofibrosis) |
| Hemoglobinuria paroxística nocturna |
| Síndrome antifosfolipídico |
| Cáncer |
| Embarazo |
| Uso de contracepción hormonal |
| Enfermedad inflamatoria intestinal |
| Enfermedad de Behçet |
| Otras enfermedades inflamatorias sistémicas |
La trombofilia hereditaria incluye deficiencias de inhibidores de la coagulación (antitrombina, proteínaC y proteínaS), aumento de factores de la coagulación y determinadas mutaciones genéticas como la mutación factor v Leiden y la mutación 20210 del gen de la protrombina368. Existen otras anomalías, como la disfibrinogenemia congénita, y diversas mutaciones, o aumentos de factores de la coagulación, que podrían estar también implicadas. El grupo sanguíneo ABO determina el riesgo trombótico de manera significativa, con un aumento del riesgo relativo entre 2 y 4 veces368.
En general, la prevalencia de defectos trombofílicos en la trombosis esplácnica es superior a la encontrada en otros territorios en los que las trombosis venosas son mucho más frecuentes y otros factores de riesgo son más comunes. En ocasiones los niveles de inhibidores de la coagulación no son fáciles de interpretar, dado que su síntesis hepática puede estar disminuida y, adicionalmente, la síntesis de proteínaC y S es dependiente de la vitaminaK. La deficiencia de antitrombina oscila entre el 0-5%, según series; la deficiencia de proteínaC, entre el 4-20%, y la deficiencia de proteínaS, entre el 0-30%8,75,117,369-371.
La presencia de mutación factor v Leiden es más frecuente en la población general. En estos pacientes se han comunicado prevalencias entre el 7-32%. En general son portadores heterocigotos, aunque pueden ser homocigotos372.
Otra mutación frecuente implicada en trombofilia es la mutación G20210A del gen de la protrombina (PT20210A). Se ha calculado que los portadores del factor v Leiden muestran un incremento de riesgo entre 2-11 veces y los portadores de la mutación PT20120A, entre 2-5 veces373.
Las otras anomalías genéticas no se han evaluado en estas series de pacientes, pero pueden estar asimismo implicadas. Tampoco hay información sobre el papel del grupo ABO.
Trombofilia adquiridaExisten diversas situaciones adquiridas que aumentan el riesgo de trombosis. La más prominente es el síndrome antifosfolipídico366-368, causado por anticuerpos antifosfolipídicos contra membranas celulares. Los más relacionados con trombosis son los anticuerpos anticardiolipina, anti-β2-glucoproteína-i y el anticoagulante lúpico. La trombocitopenia inducida por heparina es una potente situación protrombótica causada por anticuerpos contra el complejo PF-4/heparina en pacientes tratados con heparina. También en la anemia falciforme existe un incremento del riesgo trombótico.
En las trombosis en territorio esplácnico la prevalencia de anticuerpos antifosfolipídicos se ha estimado entre el 5-15%8,75,117, aunque la determinación no se ha realizado en ocasiones según las guías para establecer que se trate de un síndrome antifosfolipídico, con al menos dos determinaciones separadas 12 semanas374.
El aumento de factor viii se ha relacionado con trombofilia. Los motivos del aumento de factorviii no se conocen. Existen situaciones agudas que hacen que el factorviii aumente, pero también individuos en los que el aumento es persistente. Probablemente exista una base genética y factores adquiridos que concurran. Se han encontrado niveles superiores de factorviii en pacientes con TP375,376. Recientemente se están incorporando en los laboratorios de investigación pruebas globales de la hemostasia como la generación de trombina, o tiempo de lisis de coágulo, aunque su papel aún no está bien establecido en la actualidad377.
Neoplasias mieloproliferativasLas neoplasias mieloproliferativas están comúnmente implicadas en la causa de las trombosis esplácnicas, en especial la policitemia vera y la trombocitemia esencial. Son enfermedades clonales de las stem cells medulares que se caracterizan de manera general por la sobreproducción de elementos maduros funcionales de las tres series. Una de las principales y más frecuentes complicaciones es el desarrollo de trombosis arterial o venosa, causada por hiperagregabilidad plaquetaria y aumento de generación de trombina377. Las trombosis pueden ocurrir en cualquier territorio, aunque son especialmente frecuentes en el territorio esplácnico, donde se asocian con neoplasias mieloproliferativas en el 30-40% de los casos8,75,370,378,379. En ocasiones la trombosis esplácnica sucede en pacientes que todavía no han sido diagnosticados de neoplasia mieloproliferativa, ya que aún no han presentado anomalías en los recuentos periféricos.
El diagnóstico de las neoplasias mieloproliferativas se basa en criterios establecidos que incluyen cambios en los recuentos periféricos y en hallazgos medulares. En los pacientes con trombosis esplácnicas que presentan hiperesplenismo por HTP secundaria a la trombosis estos criterios pueden ser difíciles de aplicar. Especialmente en estos casos es de gran ayuda la determinación de marcadores moleculares específicos, como la mutación JAK2V617F que se puede detectar en pacientes con trombosis esplácnica. En un metaanálisis reciente, la prevalencia de neoplasias mieloproliferativas y la mutación JAK2V617F fue del 40% aproximadamente en SBC y de aproximadamente el 30% en TP (tabla 2)380. La mutación JAK2V617F en pacientes con trombosis esplácnica sin anomalías sanguíneas periféricas se encontró en el 17,1% de los pacientes con SBC y en el 15,4% de los pacientes con TP380. Esto hace que en pacientes con trombosis esplácnicas esté recomendado descartar la presencia de neoplasias mieloproliferativas y la determinación de JAK2V617F. Hay que tener en cuenta que en pacientes con mutaciones negativas en ocasiones es conveniente repetir la determinación, dado que pueden positivizarse durante la evolución por aumento de la población clonal en sangre periférica. También pueden ser negativas en pacientes neutropénicos, dado que el ADN representativo está en los granulocitos y no en los linfocitos. La mutación JAK2V617F se encuentra en prácticamente todos los pacientes con policitemia vera y en alrededor del 50% de los pacientes con trombocitemia esencial y mielofibrosis. Existen otras mutaciones implicadas en neoplasias mieloproliferativas que también pueden ser evaluadas cuando la mutación JAK2V617F es negativa26,27. Las mutaciones de la calreticulina (CALR) son más frecuentes (80%) en pacientes con trombocitemia esencial y mielofibrosis sin mutación JAK2V617F, y lo son menos en los pacientes con policitemia vera28.
El mecanismo fisiopatológico que subyace para que estos pacientes desarrollen un episodio trombótico no es del todo conocido. Además de la trombocitosis y la eritrocitosis, se han identificado anomalías en los leucocitos y plaquetas que pueden producir hipercoagulabilidad381.
Hemoglobinuria paroxística nocturnaLa hemoglobinuria paroxística nocturna en una enfermedad clonal muy poco frecuente. Los pacientes tienen un riesgo incrementado de trombosis de manera notable. Se asocia más a SBC (9-13%) que a TP (0-3%)75,382. El mecanismo subyacente no se conoce, pero cuando la población clonal aumenta por encima del 60% el riesgo de trombosis es muy elevado383. La hemoglobinuria paroxística nocturna debe descartarse en los pacientes con SBC y considerarse en los que presentan TP.
MisceláneaExisten otras entidades que pueden asociarse con trombosis esplácnicas, aunque con menor frecuencia que las comentadas previamente, como enfermedades autoinmunes, enfermedad inflamatoria intestinal, vasculitis, sarcoidosis, enfermedad de Behçet o celiaquía. El síndrome nefrótico puede producir deficiencia adquirida de antitrombina, pero la trombosis más frecuente es en las venas renales, sobre todo en la infancia.
El uso de anticonceptivos hormonales y el embarazo se han implicado como factores de riesgo de trombosis esplácnica. Especialmente existe un incremento de riesgo de unas 2 veces de SBC30.
Relevancia de los factores etiológicos en el tratamientoLa presencia de factores etiológicos es muy relevante, dado que tiene implicaciones terapéuticas y pronósticas, por lo que es preciso investigarlos sistemáticamente.
En pacientes con SBC se suele recomendar tratamiento anticoagulante indefinido debido a la gravedad del cuadro. En pacientes con TP el tratamiento habitualmente se recomienda durante 6meses, aunque en algunas situaciones el riesgo de recurrencia es tan elevado que también puede ser aconsejable mantenerlo de manera indefinida, especialmente en pacientes con bajo riesgo de sangrado.
Existen pocos estudios que evalúen el riesgo de recurrencia en la TP. En estos pacientes la presencia de trombofilia subyacente es un factor de riesgo de recurrencia108,109,384. Por otra parte, es necesario considerar el riesgo de sangrado especialmente por varices esofagogástricas. Por ello, en guías recientes se ha sugerido prolongar el tratamiento anticoagulante en pacientes con factores trombofílicos mayores, como la deficiencia de antitrombina, y los homocigotos para las mutaciones factor v Leiden y PT20210A, aunque no hay evidencia de suficiente calidad y la recomendación se basa en extrapolaciones de trombosis en otros territorios385,386.
En caso de neoplasias mieloproliferativas, el tratamiento anticoagulante debe administrarse de manera indefinida. La mayoría de los pacientes con neoplasias mieloproliferativas reciben aspirina como prevención primaria. No se sabe si en caso de precisar anticoagulación debe mantenerse el tratamiento antiagregante, aunque se ha identificado un beneficio potencial en estudios retrospectivos386,387.
Además del tratamiento antitrombótico, los pacientes con neoplasias mieloproliferativas deben recibir el tratamiento indicado de su enfermedad de base.
En los pacientes con hemoglobinuria paroxística nocturna la presencia de una complicación trombótica esplácnica puede indicar el tratamiento con eculizumab de manera indefinida388.
Recomendaciones- •
En los pacientes con trombosis venosa esplácnica se debe investigar la existencia de factores protrombóticos sistémicos (factores trombofílicos hereditarios y adquiridos, neoplasias mieloproliferativas, hemoglobinuria paroxística nocturna, enfermedades autoinmunes) y locales (neoplasias, procesos inflamatorios, cirugías recientes).
- •
La evaluación de trombofilia debe incluir la determinación de antitrombina, proteínaC, proteínaS, mutación factor v Leiden, mutación PT20210A, anticoagulante lúpico y anticuerpos antifosfolipídicos. Si estos 2 últimos son positivos, deben reevaluarse a las 12semanas.
- •
Se recomienda determinar las mutaciones JAK2V617F y calreticulina para descartar neoplasias mieloproliferativas, incluso en los pacientes con recuentos sanguíneos periféricos normales. Si las mutaciones son negativas, se recomienda considerar estudio citohistológico medular. Ante la sospecha de síndrome mieloproliferativo se aconseja valoración y seguimiento por un hematólogo.
- •
Frecuentemente coexisten varios factores, por lo que el hallazgo de un factor no excluye que existan otros.
Tras el diagnóstico de SBC, los pacientes deben recibir tratamiento anticoagulante lo antes posible con el fin de reducir la extensión de trombo y prevenir nuevas trombosis1,8,15,389. Si con el tratamiento anticoagulante no se consigue la repermeabilización o la sintomatología lo requiere, se debe plantear recanalizar el flujo en las venas suprahepáticas mediante angioplastia, colocación de prótesis endovasculares, trombólisis o TIPS.
Dada la falta de evidencia específicamente en este campo, se asumen las recomendaciones establecidas en trombosis venosa profunda o embolia pulmonar390. Deben recibir tratamiento anticoagulante con heparinas de bajo peso molecular (HBPM) a dosis terapéuticas durante al menos 5-7días seguido de antagonistas de la vitaminaK con la dosis necesaria para mantener la INR entre 2-3. Deben solaparse durante 3-5 días y suspender la HBPM cuando la INR esté en rango terapéutico 2días consecutivos. No existe experiencia comunicada sobre el uso de anticoagulantes orales de acción directa en esta entidad.
El riesgo hemorrágico en pacientes con SBC es elevado (17% en series recientes), por lo que es muy importante un manejo preciso del tratamiento anticoagulante, así como la prevención del sangrado relacionado con HTP39.
Se recomienda mantener la anticoagulación de manera precoz en aquellos pacientes con SBC que han requerido trasplante hepático con el fin de prevenir recidivas. La única excepción podría ser en los estados trombofílicos, dado que se corrigen con el trasplante hepático.
Trombosis portal agudaLos objetivos principales del tratamiento de la TP aguda son: 1)la prevención de la extensión de la trombosis hacia las venas mesentéricas y, por consiguiente, el infarto venoso mesentérico, y 2)la recanalización de la vena porta.
AnticoagulaciónEn una cohorte amplia reciente, el inicio de la anticoagulación precoz previene la extensión del trombo75. Se confirmó infarto mesentérico limitado en 2/95 pacientes, aunque el 60% de los pacientes presentaron afectación inicial en la vena mesentérica superior. La recanalización se obtuvo en la vena porta en el 39% de los casos, en la esplénica en el 80% y en la mesentérica en el 73% de los pacientes anticoagulados durante más de 6meses. Ocurrió hemorragia durante el periodo de anticoagulación en el 9% de los pacientes. Los factores relacionados con fracaso en la recanalización fueron la obstrucción de la vena esplénica, la ascitis y el retraso en el inicio de la anticoagulación.
Los fármacos más empleados de manera inicial han sido la heparina y las HBPM a dosis terapéuticas, y posteriormente antagonistas de la vitaminaK con una INR entre 2-3. Es preferible la HBPM sobre la heparina no fraccionada por la menor incidencia de trombocitopenia inducida por heparina que se ha identificado con más frecuencia de lo esperado en pacientes con TP aguda391. No hay experiencia respecto a la eficacia y la seguridad de los anticoagulantes orales de acción directa para esta indicación.
La trombólisis no consigue mejores tasas de recanalización que el tratamiento anticoagulante y comporta mayor riesgo de sangrado, por lo que no se recomienda.
Actualmente se están empleando técnicas de recanalización mediante angioplastia o prótesis endovasculares que ofrecen buenos resultados, especialmente en trombosis posquirúrgicas107.
Otras causas de obstrucción portal extrahepáticaLa obstrucción extrahepática de la vena porta se debe a tres mecanismos: invasión neoplásica, compresión tumoral o cavernomatosis portal.
En esta situación la evidencia del beneficio de la anticoagulación es pobre, sin que existan estudios prospectivos al respecto. Hay estudios retrospectivos en cohortes de pacientes con TP no cirróticas en las que el uso de anticoagulación se ha asociado a una reducción del riesgo de re-trombosis, con una reducción entre el 40 y el 80%108,109. El riesgo de hemorragia no estaba incrementado si la profilaxis del sangrado era adecuada. En un estudio, la anticoagulación se relacionó con un impacto favorable en la supervivencia con un descenso significativo en la mortalidad392, aunque no se apreció este beneficio en otro estudio más reciente109.
Manejo de la anticoagulación en pacientes con hepatopatíaLa guía de más amplia difusión sobre tratamiento antitrombótico es The American College of Chest Physicians Evidence-Based Clinical Practice Guidelines en su 9.a edición390. Existe una actualización reciente que incluye la evidencia existente con los anticoagulantes orales de acción directa, pero solo se contemplan en la trombosis venosa profunda de extremidades inferiores y la embolia de pulmón393. En trombosis esplácnicas las recomendaciones vigentes siguen siendo las de la 9.ª edición390. Estas guías, en trombosis esplácnica solo incluyen las HBPM y fondaparinux como tratamiento inicial. Son anticoagulantes que potencian el efecto anticoagulante de la antitrombina inhibiendo el factor Xa y la trombina (fondaparinux solo anti-Xa). Como tratamiento a largo plazo contemplan los antagonistas de la vitaminaK.
HeparinasLa heparina no fraccionada es eficaz en el tratamiento inicial, pero presenta mayor riesgo de trombocitopenia y osteoporosis; necesita monitorización mediante tiempo de tromboplastina parcial activado (APTT) y los rangos terapéuticos no están bien estandarizados. Debido a estas limitaciones es preferible el uso de HBPM, que pueden administrarse de manera subcutánea 1 o 2 veces al día y no precisan monitorización rutinaria, excepto en algunos casos (embarazo, insuficiencia renal y obesos)394.
El mayor problema en estos pacientes es que el efecto de estos fármacos depende de la antitrombina, que es de síntesis hepática y está disminuida en pacientes con enfermedad avanzada. Esto hace que se plantee la cuestión de si es necesaria la monitorización en estos pacientes para ajustar la dosis, aunque no hay evidencia suficiente que aconseje ajustar las dosis según niveles anti-Xa395,396.
Antagonistas de la vitamina KLos antagonistas de la vitaminaK (AVK) son fármacos cumarínicos que interfieren en la carboxilación de los factores vitaminaK-dependientes (factorvii, ix, x y protrombina) y de los anticoagulantes proteínasC y S. Su margen terapéutico es estrecho y precisan monitorización periódica para ajustar su dosis397. Además, existen importantes variaciones interindividuales debido a polimorfismos genéticos e interacciones medicamentosas o dietéticas que hacen que su manejo sea complejo. El test de elección para monitorizar su efecto es el tiempo de protrombina, expresado como INR. La INR incluye un ajuste que hace que sea independiente del instrumento de medición o del reactivo utilizado398. Este ajuste determina que los valores de tiempo de protrombina expresados como INR solo sean aplicables a pacientes que reciben AVK y no para pacientes hepatópatas o con déficit de factores por diversas causas (consumo, pérdida por hemorragia, hereditarios). El rango terapéutico en pacientes con tromboembolismo venoso (incluyendo la trombosis de venas esplácnicas) está entre un INR de 2 a 3.
La principal preocupación del uso de AVK en la hepatopatía es la posibilidad de que el tiempo de protrombina basal esté prolongado. Esto implicaría una posible infradosificación, aunque no hay estudios al respecto. Además, el tiempo de protrombina basal puede variar en la evolución de la hepatopatía e incrementar la inestabilidad de los controles. En pacientes hepatópatas el uso de AVK es complejo y puede estar comprometidas su eficacia y su seguridad.
Anticoagulantes orales directosSon anticoagulantes orales que ejercen su acción mediante la inhibición específica de factores de la coagulación. Dabigatrán inhibe la trombina y rivaroxabán, apixabán y edoxabán inhiben el factorx activado. Tienen una semivida corta y un rápido inicio de acción, su farmacocinética es previsible, no precisan monitorización rutinaria, tienen pocas interacciones farmacológicas y no se ven influidos por la ingesta, por lo que tienen ventajas sobre los AVK. Recientemente se han aprobado en el tratamiento inicial y a largo plazo del tromboembolismo venoso con un perfil de eficacia similar al del tratamiento convencional, aunque con mejor perfil de seguridad393. Aunque pueden tener ventajas teóricas en pacientes con hepatopatía, los cirróticos han sido excluidos de los ensayos clínicos principales, por lo que no deben utilizarse por el momento. En las trombosis esplácnicas existe algún caso tratado de manera excepcional, pero no deben utilizarse hasta que exista más información específica en estos pacientes.
Recomendaciones- •
En los casos en los que se encuentre indicado el tratamiento anticoagulante se recomienda iniciar el mismo con HBPM.
- •
La HBPM se utiliza con dosis fijas en profilaxis o ajustadas al peso en dosis terapéuticas.
- •
En los pacientes bajo tratamiento con HBPM se debe vigilar la aparición de trombocitopenia. No es necesario monitorizar los niveles anti-Xa, salvo en embarazadas, pacientes obesos o con insuficiencia renal.
- •
Se recomienda considerar la interrupción temporal de la anticoagulación antes de la realización de procedimientos invasivos, incluida la paracentesis.
- •
La duración del tratamiento anticoagulante debe ser al menos de 6meses.
- •
Una vez realizada la profilaxis de sangrado gastrointestinal se recomienda considerar anticoagulación permanente en los pacientes con situaciones protrombóticas relevantes, historia compatible con isquemia intestinal o trombosis recurrente.
- •
En los pacientes con neoplasias mieloproliferativas subyacentes está indicada la anticoagulación a largo plazo.
- •
Si se considera la anticoagulación permanente, se recomienda el tratamiento con AVK, que deben administrarse a las dosis necesarias para mantener unos niveles INR entre 2-3, aunque en la cirrosis pueden no ser representativos.
- •
En la actualidad no existe evidencia suficiente sobre la eficacia y la seguridad de los anticoagulantes orales directos para recomendar su uso en pacientes con cirrosis o trombosis esplácnica.
Los autores declaran no tener ningún conflicto de intereses.