La hepatitis autoinmune (HAI) con características de colangitis biliar primaria (CBP) es conocida como síndrome de superposición. Su prevalencia y pronóstico aún no han sido determinados comparativamente con aquellos con HAI.
MétodosSe realizó un estudio de cohorte retrospectiva comparando pacientes con diagnóstico de HAI y síndrome de superposición por HAI-CBP, seguidos por 7años en un hospital universitario de Colombia, hasta el 31 de diciembre de 2016.
ResultadosSe incluyeron 210 pacientes (195 mujeres, edad media 48,5años), de los cuales 32 (15,2%) tenían síndrome de superposición HAI-CBP. Al diagnóstico no se hallaron diferencias significativas por perfil demográfico, autoanticuerpos positivos (ANA, ASMA) excepto AMA (81,2% vs 3,9%; p<0,001) y grado histológico de fibrosis. La presentación clínica más frecuente en HAI-CBP fueron síntomas inespecíficos y en HAI, hepatitis aguda. Aunque con diferencias no significativas, en HAI se presentó mayor respuesta bioquímica al manejo inmunosupresor (87,3% vs 74,2%; p=0,061) y mayor número de recaídas en quienes lograron remisión parcial o completa durante tratamiento (12,4% vs 7,63%; p=0,727). Los pacientes con HAI-CBP tuvieron mayor progresión a cirrosis (22,2% vs 13,1%; p=0,038), incluso quienes lograron remisión bioquímica parcial o completa sin recaída, mayor indicación de TOH (p=0,009), pero no retrasplante (p=0,183); no hubo diferencias en la mortalidad.
ConclusiónEl síndrome de superposición HAI-CBP constituye una proporción no despreciable entre aquellos con HAI, con mayor progresión a cirrosis, indicación de trasplante hepático y posiblemente retrasplante. Este mayor riesgo de desenlaces adversos sugiere seguimiento más estricto, probablemente con seguimiento hasta remisión histopatológica confirmada.
Autoimmune hepatitis (AIH) with characteristics of primary biliary cholangitis (PBC) is known as overlap syndrome. Its prevalence and prognosis have not yet been determined comparatively with AIH.
MethodsA retrospective cohort study was conducted comparing patients diagnosed with AIH and AIH-PBC overlap syndrome, followed-up for seven years in a university hospital in Colombia, until 31 December 2016.
ResultsA total of 210 patients were included (195 women, mean age 48.5years). Of these, 32 (15.2%) had AIH-PBC overlap syndrome. At diagnosis, no significant differences were found by demographic profile, positive autoantibodies (ANA, ASMA), except AMA (81.2% vs 3.9%, P<.001), and histological grade of fibrosis. The most frequent clinical presentations were nonspecific symptoms in AIH-PBC and acute hepatitis in AIH. Although there were no significant differences, AIH showed a greater biochemical response to immunosuppressive management (87.3% vs 74.2%, P=.061) and a greater number of relapses in those who achieved partial or complete remission during treatment (12.4% vs 7.63%; P=.727). Patients with AIH-PBC had greater progression to cirrhosis (22.2% vs 13.1%, P=.038), even in those who achieved partial or complete biochemical remission without relapse, with greater indication of orthotopic liver transplantation (P=.009), but not retransplantation (P=.183); there were no differences in mortality.
ConclusionsAIH-PBC overlap syndrome accounts for a significant proportion of patients with AIH, with greater progression to cirrhosis, indication of liver transplantation and possibly retransplantation. This higher risk of adverse outcomes suggests closer monitoring, probably with follow-up until confirmed histopathological remission.
Aparte de las enfermedades hepáticas autoinmunes clásicas como son la hepatitis autoinmune (HAI), la colangitis biliar primaria (CBP) y la colangitis esclerosante primaria (CEP), con criterios diagnósticos propios1, la coexistencia simultánea de dos entidades no asimilables en categorías diagnósticas clásicas se denomina síndrome de superposición.
La presentación sincrónica o consecutiva de CBP con hepatitis autoinmune, aunque es reconocida, aún es debatida en cuanto a su patogénesis y si en realidad representa una variante de HAI o CBP2, incluso con criterios diagnósticos aún no estandarizados, como es el caso de la aplicación de los criterios simplificados de HAI3 a pacientes con síndrome de superposición. Actualmente el enfoque más aceptado para el diagnóstico ha sido la presencia de 2 de 3 de las características principales de cada entidad propuestos por Chazouillères et al.4. Estos criterios han sido incorporados en las guías de la Asociación Europea para el Estudio del Hígado (European Association for the Study of the Liver [EASL])5.
Desde la década de los setenta se reportan series pequeñas de superposición HAI-CBP6-8, por lo que se llegó a considerar un síndrome raro, incluso se sugirió que el nombre de síndrome de superposición fuese abandonado9; sin embargo, subsecuentes series descritas en diferentes partes del mundo9-11, algunas comparando características clínicas y pronósticas entre CBP y síndrome de superposición HAI-CBP, reportan peor pronóstico que en CBP por mayor grado de fibrosis al diagnóstico, peor respuesta bioquímica al ácido ursodesoxicólico (UDCA), progresión a fibrosis y mortalidad relacionada. No obstante, no hay grandes series comparativas entre pacientes con HAI y aquellos con síndrome de superposición por HAI-CBP, por lo cual no es claro si los desenlaces difieren entre estas dos entidades.
En este estudio se reevalúan pacientes caracterizados en un estudio previo HAI12, con diagnóstico confirmado de HAI y síndrome de superposición HAI-CBP, con el objetivo de determinar la prevalencia de síndrome de superposición HAI-CBP en HAI clásica, las características diferenciales tanto clínicas desde el diagnóstico, como curso y pronóstico con el tratamiento.
MetodologíaDiseño y muestraEl presente estudio es de cohorte retrospectivo analítico, con muestreo por conveniencia basado en pacientes con diagnóstico de HAI según la Clasificación Internacional de Enfermedades (CIE10) en registros de historia clínica electrónica del Hospital Pablo Tobón Uribe (HPTU) en la ciudad de Medellín (Colombia) durante el periodo de enero de 2010 a 31 de diciembre de 2016.
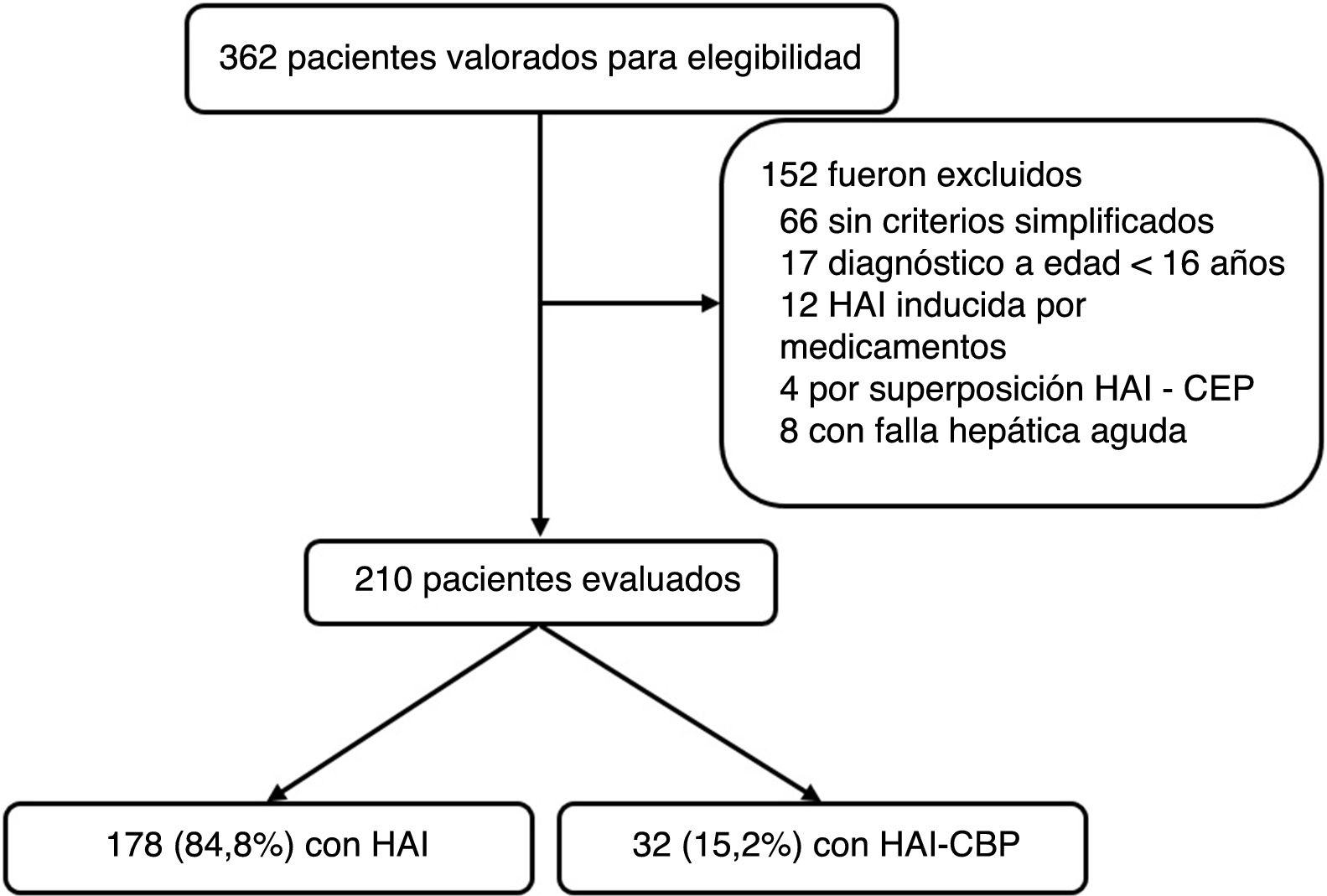
Se incluyeron pacientes con historia clínica completa y diagnóstico inicial confirmado de HAI y superposición HAI-CBP por biopsia y criterios simplificados de hepatitis autoinmune3 y de Paris4, respectivamente, desde el momento de la sospecha diagnóstica, seguimiento a disposición del hepatólogo tratante, hasta el último registro médico ambulatorio u hospitalario. Las razones para exclusión fueron: pacientes con edad menor de 16años, HAI inducida por medicamentos, fallo hepático agudo, puntaje menor a 6 según los criterios simplificados de HAI o menos de dos criterios para cada entidad (HAI y CBP) según los criterios de Paris para diagnóstico de HAI y superposición, respectivamente. Adicionalmente se excluyeron aquellos sin disponibilidad de biopsia hepática.
Todos los pacientes incluidos tuvieron estudios de exclusión de etiologías diferentes, como hepatitis viral (anti VHC, anti HBc, HBsAg y anti HBs), tóxica, metabólica (α-1antitripsina, saturación de transferrina, ferritina, ceruloplasmina) y otras enfermedades hepáticas autoinmunes (CEP).
La base de datos computarizada fue creada por el grupo de gastrohepatología, con variables acordes a definiciones estándar. Se incluyeron variables sociodemográficas (edad, género, raza) y clínicas, como la forma de presentación: alteración asintomática de la bioquímica hepática, síntomas inespecíficos (astenia, adinamia hiporexia y fiebre), hepatitis aguda (ictericia, dolor abdominal, fiebre y elevación de transaminasas al menos tres veces el límite superior de normalidad) o cirrosis hepática diagnosticada por clínica y cualquier técnica de imagen o biopsia. Además, se describen los niveles de anticuerpos antinucleares (ANA), anticuerpos antimúsculo liso (ASMA), anticuerpos antimitocondriales (AMA), niveles de IgG sérica, AST, ALT, fosfatasa alcalina, bilirrubina total, albúmina sérica, tiempo de protrombina e INR al diagnóstico y cambios en estos con el tratamiento.
Los hallazgos histológicos fueron evaluados al diagnóstico por dos patólogos con amplia experiencia en biopsia de hígado, quienes desconocían los datos clínicos y el seguimiento de los pacientes; dichos hallazgos de clasificaron como: histología típica de hepatitis autoinmune si presentaban hepatitis de interfase, infiltrado linfoplasmocitario en tractos porta con extensión al lobulillo, emperipolesis y formación de rosetas. Histología compatible: presencia de hepatitis crónica con infiltración linfocítica. Histología atípica: signos histológicos diferentes a HAI, como la esteatohepatitis u otros3. El rasgo histológico necesario para CBP en superposición fue la lesión florida de conductos biliares interlobulares y septales.
El grado de fibrosis hepática se evaluó con la escala METAVIR (F0 hasta F4): estadio0 (F0) ausencia de fibrosis, estadio1 (F1) fibrosis leve, estadio2 (F2) fibrosis moderada, estadio3 (F3) fibrosis grave, estadio4 (F4) cirrosis13.
Se incluyó puntaje de criterios diagnósticos simplificados del Grupo Internacional de Hepatitis Autoinmune (IAIHG) (<6puntos: no compatible; probable si >6 puntos, o definitiva si es ≥7puntos)3, o fue calculado si no estuvo registrado. De los criterios de Paris, al menos 2 de 3 criterios de CBP y HAI debían estar presentes para el diagnóstico de síndrome de superposición. HAI: I)elevación de ALT≥5veces el límite superior de normalidad (LSN); II)niveles séricos de IgG≥2 veces el límite superior de normalidad (LSN) y/o ASMA positivos, y III)biopsia hepática con inflamación lobular periportal o periseptal moderada o grave. CBP: I)FA≥2 LSN o GGT≥5 LSN; II)AMA≥1:40; III)biopsia con hallazgo de lesión florida del ducto biliar4.
Con el tratamiento de inducción y de mantenimiento se evaluó la remisión bioquímica, la respuesta incompleta, el fracaso en el tratamiento, la recaída, la progresión a cirrosis, la indicación de trasplante hepático, la muerte relacionada a cirrosis y de cualquier causa.
La remisión bioquímica fue definida como la normalización en cifras de transaminasas e IgG; respuesta incompleta: mejoría sin alcanzar niveles de remisión; recaída como nueva elevación de ALT>3veces la LSN según los criterios del IAIHG o aumento de los niveles de IgG, y fracaso terapéutico: empeoramiento clínico, bioquímico e histológico a pesar del tratamiento1. El componente colestásico de CBP en superposición se evaluó así: FA≥1,5 LSN o bilirrubina >1mg/dl posterior a un año para determinar fallo al tratamiento14; este se evaluó conjuntamente con el componente hepatocelular para definir o no respuesta.
Análisis estadísticoLas variables categóricas se presentan en frecuencias absolutas o porcentajes; las variables continuas, como media y desviación estándar según distribución normal o mediana y rango intercuartílico (RIC) con distribución no normal según prueba de Kolmogorov-Sminrnov. Las diferencias entre grupos se establecieron con el test de chi cuadrado para variables categóricas y prueba U de Mann-Whitney para diferencia de medianas. Las probabilidades actuariales se calcularon utilizando el método de Kaplan-Meier, los datos fueron censurados a la fecha del evento, trasplante ortotópico de hígado (TOH), fecha de última visita o al completar el periodo de seguimiento; los pacientes con TOH fueron censurados como vivos. Todos los valores de p fueron calculados a dos colas, con valor p<0,05 para considerar significancia estadística. Todos los análisis se realizaron con el software estadístico SPSS versión 20.1 (SPSS Inc.).
La preparación y la presentación final del artículo tienen en cuenta las recomendaciones STROBE para reporte de estudios observacionales15.
El estudio se mantuvo en el marco de parámetros internacionales para estudios con seres humanos, como Declaración de Helsinki y reglamentación colombiana sustentada en la resolución 8430 del año 1993, considerada como investigación sin riesgo. El protocolo fue evaluado y aprobado por el comité de ética y el comité de investigación en seres humanos del HPTU. Dado el carácter retrospectivo, no se requirió consentimiento informado.
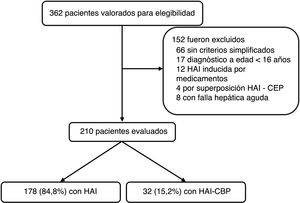
ResultadosDesde enero de 2010 a diciembre de 2016 se registraron 362 pacientes potenciales por código diagnóstico CIE10 de hepatitis autoinmune; de estos, se excluyeron 152 (fig. 1). HAI inducida por medicamentos, síndrome de superposición (HAI-CEP), fallo hepático agudo (por perfil inmunológico negativo, IgG negativa o limitantes en realización de biopsia hepática) fueron las principales razones de exclusión. En total se incluyen 210 para el análisis, de los cuales 178 (84,8%) fueron por HAI y 32 (15,2%) con superposición de HAI-CBP; la mediana de seguimiento fue de 47,8meses (RIC 14-69) y 52 meses (RIC 23,7-68,5), respectivamente, sin diferencias significativas (p=0,4).
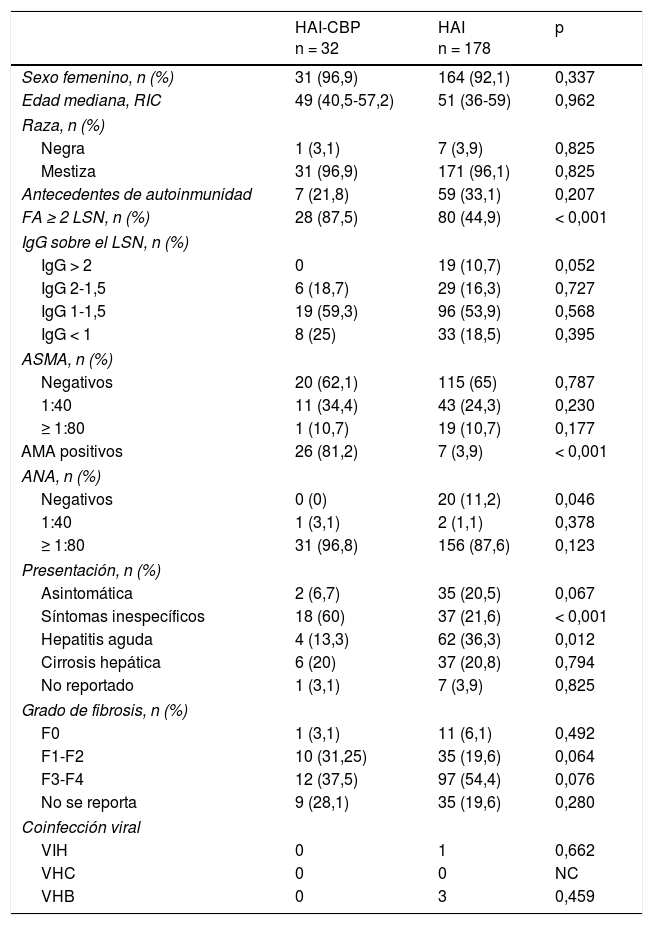
El rango de edad en los grupos fue de 16 a 82años en HAI y de 31 a 78años en HAI-CBP, siendo de género femenino del 92,1 y del 96,9%, y de raza mestiza en un 96,1 y un 96,9%, respectivamente (tabla 1).
Características de base. Comparación de las características demográficas, seropositividad, puntaje de HAI, presentación clínica e histología al diagnóstico
| HAI-CBP n = 32 | HAI n = 178 | p | |
|---|---|---|---|
| Sexo femenino, n (%) | 31 (96,9) | 164 (92,1) | 0,337 |
| Edad mediana, RIC | 49 (40,5-57,2) | 51 (36-59) | 0,962 |
| Raza, n (%) | |||
| Negra | 1 (3,1) | 7 (3,9) | 0,825 |
| Mestiza | 31 (96,9) | 171 (96,1) | 0,825 |
| Antecedentes de autoinmunidad | 7 (21,8) | 59 (33,1) | 0,207 |
| FA ≥ 2 LSN, n (%) | 28 (87,5) | 80 (44,9) | < 0,001 |
| IgG sobre el LSN, n (%) | |||
| IgG > 2 | 0 | 19 (10,7) | 0,052 |
| IgG 2-1,5 | 6 (18,7) | 29 (16,3) | 0,727 |
| IgG 1-1,5 | 19 (59,3) | 96 (53,9) | 0,568 |
| IgG < 1 | 8 (25) | 33 (18,5) | 0,395 |
| ASMA, n (%) | |||
| Negativos | 20 (62,1) | 115 (65) | 0,787 |
| 1:40 | 11 (34,4) | 43 (24,3) | 0,230 |
| ≥ 1:80 | 1 (10,7) | 19 (10,7) | 0,177 |
| AMA positivos | 26 (81,2) | 7 (3,9) | < 0,001 |
| ANA, n (%) | |||
| Negativos | 0 (0) | 20 (11,2) | 0,046 |
| 1:40 | 1 (3,1) | 2 (1,1) | 0,378 |
| ≥ 1:80 | 31 (96,8) | 156 (87,6) | 0,123 |
| Presentación, n (%) | |||
| Asintomática | 2 (6,7) | 35 (20,5) | 0,067 |
| Síntomas inespecíficos | 18 (60) | 37 (21,6) | < 0,001 |
| Hepatitis aguda | 4 (13,3) | 62 (36,3) | 0,012 |
| Cirrosis hepática | 6 (20) | 37 (20,8) | 0,794 |
| No reportado | 1 (3,1) | 7 (3,9) | 0,825 |
| Grado de fibrosis, n (%) | |||
| F0 | 1 (3,1) | 11 (6,1) | 0,492 |
| F1-F2 | 10 (31,25) | 35 (19,6) | 0,064 |
| F3-F4 | 12 (37,5) | 97 (54,4) | 0,076 |
| No se reporta | 9 (28,1) | 35 (19,6) | 0,280 |
| Coinfección viral | |||
| VIH | 0 | 1 | 0,662 |
| VHC | 0 | 0 | NC |
| VHB | 0 | 3 | 0,459 |
AMA, anticuerpos antimitocondriales; ANA, anticuerpos antinucleares; ASMA, anticuerpos antimúsculo liso; CPB, colangitis biliar primaria; FA, fosfatasa alcalina; HAI, hepatitis autoinmune; IgG, inmunoglobulina G; LSN, límite superior de normalidad; RIC, rango intercuartil; VHB, virus de la hepatitis B; VHC, virus de la hepatitis C; VIH, virus de inmunodeficiencia humana.
Diferencias de proporciones calculadas por método de chi cuadrado.
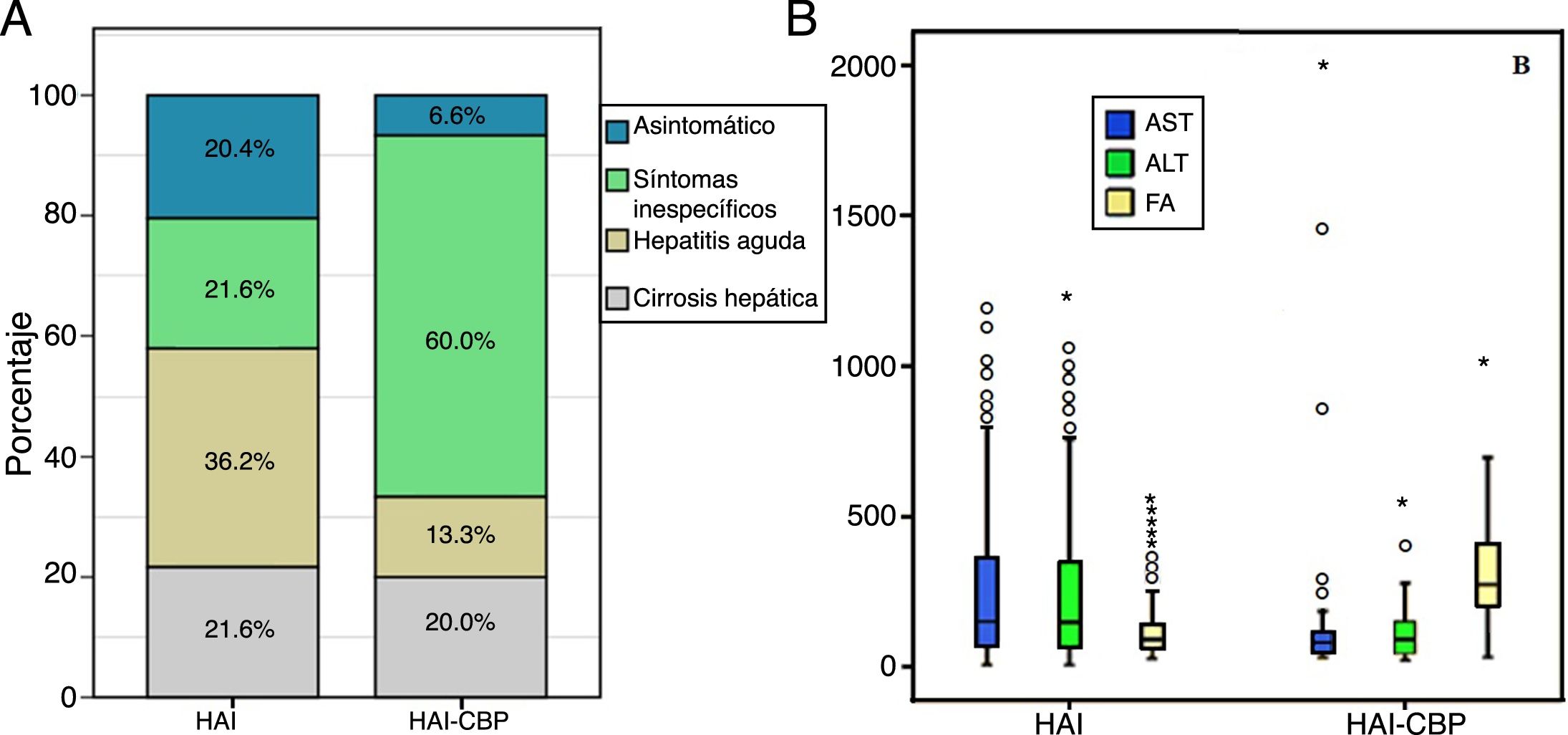
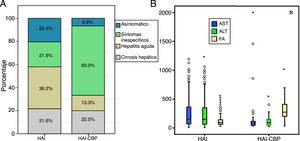
Al momento del diagnóstico no se hallaron diferencias estadísticamente significativas para antecedente de autoinmunidad, pero sí en la forma de presentación clínica, siendo la hepatitis aguda más frecuente en HAI (36,3%, n=62 vs 13,3%, n=2; p=0,012) en contraste con aquellos con síndrome de superposición, en quienes fue más frecuente la presencia de síntomas inespecíficos (21,6%, n=37 vs 60%, n=18; p<0,001) (fig. 2A). No hubo diferencias en cuanto al grado de fibrosis hepática al momento del diagnóstico; sin embargo, este rasgo no se reportó en 35 y en 9 pacientes con HAI y HAI-CBP, respectivamente.
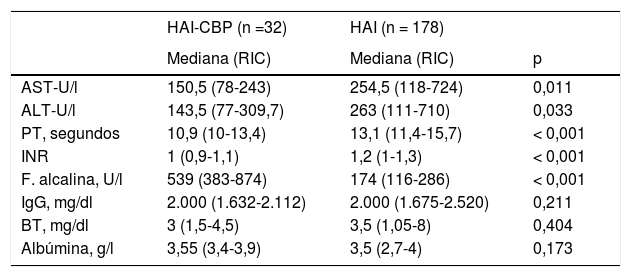
Según la analítica hepática diferencial al diagnóstico, los pacientes con HAI-CBP tuvieron significativamente mayores niveles de fosfatasa alcalina (539 vs 229U/l; p<0,001), al igual que en mayor proporción AMA positivos (81,2% vs 3,9%; p<0,001) (tablas 1 y 2). En contraste, las medianas de AST y ALT fueron mayores de forma significativa en HAI (p=0,011 y p=0,033, respectivamente) que en aquellos con superposición (fig. 2B).
Comparación de las pruebas bioquímicas y funcionales hepáticas al diagnóstico de síndrome de superposición y HAI
| HAI-CBP (n =32) | HAI (n = 178) | ||
|---|---|---|---|
| Mediana (RIC) | Mediana (RIC) | p | |
| AST-U/l | 150,5 (78-243) | 254,5 (118-724) | 0,011 |
| ALT-U/l | 143,5 (77-309,7) | 263 (111-710) | 0,033 |
| PT, segundos | 10,9 (10-13,4) | 13,1 (11,4-15,7) | < 0,001 |
| INR | 1 (0,9-1,1) | 1,2 (1-1,3) | < 0,001 |
| F. alcalina, U/l | 539 (383-874) | 174 (116-286) | < 0,001 |
| IgG, mg/dl | 2.000 (1.632-2.112) | 2.000 (1.675-2.520) | 0,211 |
| BT, mg/dl | 3 (1,5-4,5) | 3,5 (1,05-8) | 0,404 |
| Albúmina, g/l | 3,55 (3,4-3,9) | 3,5 (2,7-4) | 0,173 |
ALT, alanina aminotransferasa; AST, aspartato aminotransferasa; BT, bilirrubina total; CPB, colangitis biliar primaria; HAI, hepatitis autoinmune; IgG, inmunoglobulina G; INR, relación normalizada internacional; PT, tiempo de protrombina; RIC: rango intercuartil.
Se realizó análisis de diferencia de medianas por distribución no normal.
Entre los grupos, la diferencia de medianas en índices de función hepática como PT e INR fue significativamente superior en aquellos con superposición (p<0,001), y aunque también mayores los niveles de albúmina (3,55 vs 3,5g/l; p=0,173), con menor mediana de bilirrubina total (3 vs 3,5; p=0,082), estas últimas diferencias no fueron estadísticamente significativas respecto de aquellos con HAI (tabla 2).
El comportamiento en diferencia de medianas o intervalos discretos de IgG no fue significativo entre las dos entidades (tabla 1), como tampoco el porcentaje de pacientes con ANA positivos, contrario a la diferencia porcentual de pacientes con ANA negativos, siendo este hallazgo más frecuente en HAI que en pacientes con superposición (11,2%, n=20 vs 0%, n=0; p<0,046).
Tratamiento y curso de los pacientesEn cuanto al tratamiento de inducción o mantenimiento, no hubo diferencias significativas entre los grupos (tabla 3), excepto para UDCA, que fue indicado con mayor frecuencia en HAI-CBP que en HAI: 31 (96,8%) y 39 (21,9%), respectivamente (p<0,001); la dosis prescrita en todos los casos fue de 13 a 15mg/kg de peso corporal día, una vez realizado el diagnóstico.
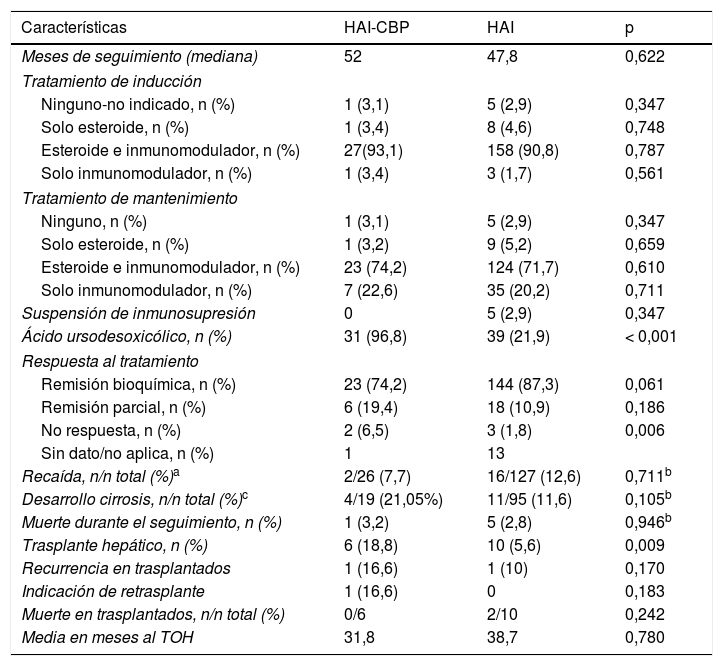
Seguimiento y resultados en pacientes con HAI y Superposición
| Características | HAI-CBP | HAI | p |
|---|---|---|---|
| Meses de seguimiento (mediana) | 52 | 47,8 | 0,622 |
| Tratamiento de inducción | |||
| Ninguno-no indicado, n (%) | 1 (3,1) | 5 (2,9) | 0,347 |
| Solo esteroide, n (%) | 1 (3,4) | 8 (4,6) | 0,748 |
| Esteroide e inmunomodulador, n (%) | 27(93,1) | 158 (90,8) | 0,787 |
| Solo inmunomodulador, n (%) | 1 (3,4) | 3 (1,7) | 0,561 |
| Tratamiento de mantenimiento | |||
| Ninguno, n (%) | 1 (3,1) | 5 (2,9) | 0,347 |
| Solo esteroide, n (%) | 1 (3,2) | 9 (5,2) | 0,659 |
| Esteroide e inmunomodulador, n (%) | 23 (74,2) | 124 (71,7) | 0,610 |
| Solo inmunomodulador, n (%) | 7 (22,6) | 35 (20,2) | 0,711 |
| Suspensión de inmunosupresión | 0 | 5 (2,9) | 0,347 |
| Ácido ursodesoxicólico, n (%) | 31 (96,8) | 39 (21,9) | < 0,001 |
| Respuesta al tratamiento | |||
| Remisión bioquímica, n (%) | 23 (74,2) | 144 (87,3) | 0,061 |
| Remisión parcial, n (%) | 6 (19,4) | 18 (10,9) | 0,186 |
| No respuesta, n (%) | 2 (6,5) | 3 (1,8) | 0,006 |
| Sin dato/no aplica, n (%) | 1 | 13 | |
| Recaída, n/n total (%)a | 2/26 (7,7) | 16/127 (12,6) | 0,711b |
| Desarrollo cirrosis, n/n total (%)c | 4/19 (21,05%) | 11/95 (11,6) | 0,105b |
| Muerte durante el seguimiento, n (%) | 1 (3,2) | 5 (2,8) | 0,946b |
| Trasplante hepático, n (%) | 6 (18,8) | 10 (5,6) | 0,009 |
| Recurrencia en trasplantados | 1 (16,6) | 1 (10) | 0,170 |
| Indicación de retrasplante | 1 (16,6) | 0 | 0,183 |
| Muerte en trasplantados, n/n total (%) | 0/6 | 2/10 | 0,242 |
| Media en meses al TOH | 31,8 | 38,7 | 0,780 |
CPB, colangitis biliar primaria; HAI, hepatitis autoinmune;TOH, trasplante ortotópico de hígado.
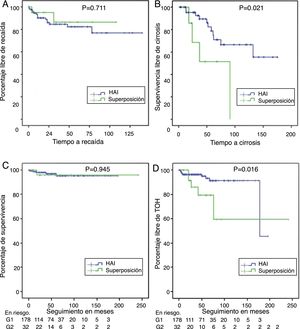
Con tendencia no significativa, porcentualmente hubo mayor cantidad de pacientes con respuesta bioquímica en HAI: 144 (87,3%) que en HAI-CBP: 23 (74,2%) (p=0,061); asimismo, la proporción de recaídas en quienes durante el seguimiento se documentó remisión completa o parcial fue del 12,6% en HAI vs 7,7% en HAI-CBP (p=0,711) (fig. 3A).
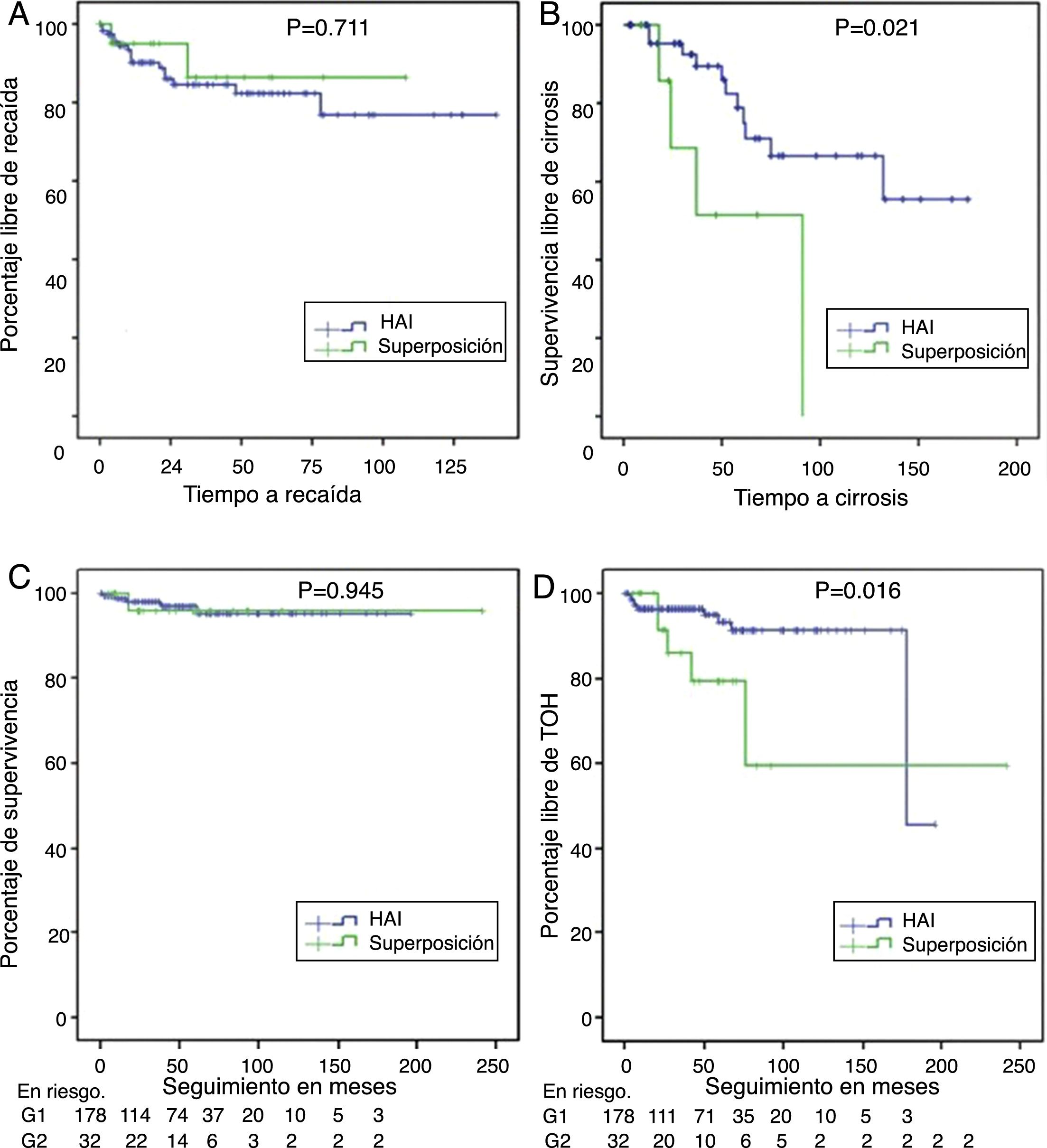
Supervivencia libre de recaída en quienes lograron remisión bioquímica o parcial (panel A), supervivencia libre de cirrosis en aquellos con fibrosis F3 o no reportada (panel B), supervivencia diferencial en pacientes con HAI y síndrome de superposición (panel C) y supervivencia libre de trasplante en HAI y superposición (panel D).
De los pacientes no cirróticos o F4 al momento del diagnóstico, el 21% en HAI-CBP y el 11,6% en HAI progresaron a cirrosis durante el seguimiento, sin diferencias estadísticamente significativas (p=0,105). En pacientes con fibrosis grado2 o menor no se documentaron casos de progresión a cirrosis, pero sí en aquellos con fibrosis grado3 o no reportada en el informe de biopsia, 4 de 8 (50%) en superposición y 11 de 49 (22,4%) en HAI, con diferencia significativa (p=0,024) (fig. 3B), incluso en quienes se documentó respuesta bioquímica sin recaída durante el seguimiento (50%, n=3 de 6 vs 11,7%, n=4 de 34; p=0,009).
Adicionalmente, se realizó TOH con frecuencia significativamente mayor en superposición (18%, n=6 vs 5,6%, n=10; p=0,009); también porcentaje de retrasplante (3,1%, n=1 vs 0; p=0,183) y mortalidad relacionada a causa hepática (fig. 3C,D), aunque estas dos últimas diferencias sin significancia estadística. En los pacientes trasplantados la diferencia en seguimiento no fue significativa, siendo 28,2meses en HAI, menor que en sobreposición (56,8meses).
DiscusiónEl presente estudio reporta los resultados de una cohorte retrospectiva comparativa de pacientes con HAI y síndrome de superposición HAI-CBP en un centro de referencia para pacientes con enfermedades hepáticas. En ambos grupos la mayor parte de la población perteneció al sexo femenino, similar a lo reportado en estudios anteriores6,9,11, con la media y rango de edad semejantes para pacientes con superposición publicados en otras series16 y sin diferencia importante en relación a aquellos con HAI. La prevalencia registrada, respecto de aquellos con CBP según las dos series más grandes publicadas, es del 4,8 al 9,2%4,16 con el uso de los criterios actuales más aceptados en los diferentes estudios, pero no determinada respecto de pacientes con HAI, que fue del 15,2% en la serie actual, siendo esta la primera aproximación a dicha estimación, y mayor al global reportado entre las hepatopatías autoinmunes17.
Al igual que lo reportado en el año 2007 por Heurgué et al.17 en una serie comparativa multicéntrica en Francia de 15 pacientes con superposición, 48 pacientes con HAI y 52 con CBP, no se hallan diferencias para comorbilidades autoinmunes asociadas, ni en los niveles promedio de bilirrubina total, albúmina sérica o estadios de fibrosis al diagnóstico, pero sí diferencias en la media de fosfatasa alcalina y el tiempo de protrombina; sin embargo, en esta cohorte sí se hallaron diferencias en las medianas de ALT.
La respuesta clínica y bioquímica en pacientes con síndrome de superposición ha sido estudiada4,18 con recomendaciones claras para CBP y HAI pero aún controversiales en HAI-CBP. Algunos estudios sugieren que pacientes con HAI-CBP y niveles de fosfatasa alcalina menores a dos veces el límite superior de la normalidad responden de forma similar a aquellos con HAI sin UDCA, como fue hallado por Czaja18, en donde hasta el 75% presentan remisión bioquímica y o histológica y el 81% normalización o casi normalización bioquímica e histológica con inmunosupresores; en la presente serie solo cuatro pacientes tuvieron niveles menores a dos veces el límite superior de la normalidad, dos con fibrosis F4, uno de estos sin UDCA como parte del manejo, el cual requirió TOH sin recurrencia de enfermedad, y en los tres restantes, con UDCA y azatioprina, se documentó adecuada respuesta bioquímica.
En pacientes con niveles de FA>2veces el LSN se ha propuesto como estrategia de manejo, además de inmunomoduladores, el uso de UDCA, con lo que se logra mejoría significativa de los niveles de FA, GGT y ALT, como fue demostrado por Chazouillères et al.4 en el año 1998, con 12 pacientes con superposición, y prevención de progresión a cirrosis, como fue demostrado 8 años después por el mismo autor19 con 17 pacientes.
Los 32 pacientes con superposición de la serie actual, excepto uno ya mencionado, recibieron UDCA como parte del manejo. Ninguno de los 11 (34%) con estadio de fibrosis menor a F3 progresó a cirrosis. Uno de los dos pacientes detectados con fibrosis F3 progresó a cirrosis sin indicación de TOH hasta el último seguimiento; uno de los 9 pacientes sin dato sobre el grado de fibrosis en reporte de biopsia fue perdido de seguimiento, y 3 (37,5%) de los restantes progresaron a cirrosis a pesar de manejo combinado con UDCA e inmunosupresión, uno de estos con indicación de TOH al término del periodo de estudio. Estos desenlaces son peores a los reportados por Chazouillères et al.19, quienes no demuestra casos de progresión a fibrosis en los tratados inicialmente con manejo combinado (UDCA e inmunosupresión), lo que sugiere la eficacia del UDCA desde estadios iniciales de la enfermedad.
Al igual que lo publicado por Silveira et al.5, al comparar los pacientes con HAI-CBP con los de CBP se demuestran en los pacientes con HAI-CBP peores desenlaces, como sangrado, varices esofágicas, muerte e indicación de TOH, en un estudio comparativo de 26 pacientes con HAI-CBP y 109 con CBP en la Clínica Mayo en Rochester seguidos por más de 6años, diferente a lo hallado previamente por Lohse et al.9, que reportan similar respuesta bioquímica (definida por reducción mayor a dos veces el límite superior de normalidad) en aquellos con CBP, proponiendo abandonar la denominación de síndrome de superposición; o Joshi et al.17 en un estudio multicéntrico canadiense y de la Clínica Mayo con 16 pacientes con superposición en el cual no encontraron diferencias en cuanto a supervivencia o necesidad de trasplante hepático a 7años respecto de aquellos con CBP con o sin ANA positivos. Estos pacientes también presentan de forma significativa mayor tasa de progresión a cirrosis, mayor porcentaje de no respuesta a manejo e indicación de trasplante, como se expone en esta serie.
Entre las limitaciones que se encuentran están: ser un estudio unicéntrico, con muestreo por conveniencia en un hospital de referencia en donde el espectro de enfermedad puede contener aquellos con mayor gravedad e inducir sesgo de referencia, la naturaleza retrospectiva del estudio con limitado número de pacientes en el grupo de síndrome de superposición HAI-CBP, la longitud y las pérdidas de seguimiento en algunos pacientes que limitan la detección de posibles diferencias significativas en mortalidad y retrasplante, así como la carencia de datos completos en algunos pacientes.
Adicionalmente, durante el seguimiento se realizan determinaciones seriadas de paraclínicos a criterio médico tratante, como niveles de transaminasas, bilirrubinas y albúmina, entre otras, pero no perfil diferencial de HLA ni sus implicaciones pronósticas; en muchos casos tampoco se realizó control histológico para determinar respuesta histológica por aparente respuesta bioquímica adecuada, algunos de estos con progresión a cirrosis documentada posteriormente.
Estudios clínicos aleatorizados multicéntricos multinacionales podrían superar estas limitantes y de esta forma detectar posibles diferencias en respuesta al manejo y a recaídas no detectadas en la serie actual, así como para estandarizar el mejor método de seguimiento y de manejo en estos pacientes.
Entre las fortalezas, según búsqueda sistemática realizada en las diferentes bases de datos y literatura gris, esta cohorte representa el estudio con mayor cantidad de pacientes incluidos en cada grupo para comparación, con la primera aproximación a la prevalencia de esta forma de superposición respecto de aquellos con HAI, con una muestra adecuadamente caracterizada, con seguimiento clínico periódico relativamente largo con evaluación bioquímica seriada para determinar respuesta, así como representatividad poblacional, dado que se trata de pacientes procedentes de diferentes regiones de Colombia.
En conclusión, el síndrome de superposición HAI-CBP representa una proporción no despreciable respecto de aquellos con HAI, por lo cual debe investigarse ante la sospecha y ser reconocido, ya que estos pacientes presentan curso y pronóstico desfavorable, dado por mayor riesgo de progresión a cirrosis en fibrosis avanzada, incluso con remisión bioquímica documentada, además de mayor necesidad de trasplante hepático e incluso retrasplante, aunque en este caso sin significancia estadística según la serie actual.
Conflicto de interesesLos autores manifiestan no tener conflicto de intereses.