Vedolizumab (VDZ), un anticuerpo monoclonal humanizado que se une específicamente a -α4β7-integrina, aprobado para el tratamiento de la enfermedad de Crohn (EC) y la colitis ulcerosa (CU), ha demostrado su eficacia en ensayos clínicos controlados.
ObjetivoDescribir una población tratada con VDZ y evaluar su efectividad y seguridad a largo plazo en práctica clínica.
MétodosEstudio observacional y multicéntrico en pacientes con enfermedad inflamatoria intestinal tratados con VDZ durante al menos un año. Se evaluaron los índices de actividad, niveles de calprotectina fecal y proteína C reactiva, hospitalizaciones, cirugías y eventos adversos.
ResultadosSe analizaron un total de 73 pacientes (43 CU y 30 EC). El 74 y 23% de CU y el 90 y 37% de EC habían llevado previamente más de un anti-TNF y más de un inmunosupresor respectivamente. VDZ se suspendió en 17 pacientes (23%), 10 CU y 7 EC, debido a la falta o pérdida de respuesta antes del primer año o a eventos adversos. Veintisiete (63%) CU y 16 (53%) pacientes con EC requirieron intensificación de la dosis. A los 6 meses, el 70 y 42% de CU y el 80 y 43% de EC lograron respuesta clínica y remisión respectivamente. Al año, el 58 y 35% de CU y el 47 y 43% de EC mantuvieron la respuesta clínica y la remisión, respectivamente. La proteína C reactiva disminuyó significativamente tanto en la EC como en la CU. Sin embargo, la disminución de la calprotectina fecal se logró durante el seguimiento solo en CU pero no en EC. Ocho pacientes con EC que habían sido tratados previamente con ustekinumab evitaron la cirugía al año. En 8 CU (18,6%) se realizó colectomía y 4 EC (13,3%) necesitaron cirugía. Seis pacientes (8%) (5 UC y una enfermedad de Crohn) tuvieron eventos adversos. El uso concomitante de corticoides o inmunomoduladores no aumentó la efectividad. A mayor número de anti-TNF previos, menos remisión en la CU y respuesta en la EC.
ConclusionesTras un año de VDZ se induce respuesta y remisión clínica en una no desdeñable proporción de pacientes refractarios a diferentes biológicos o inmunosupresores. VDZ puede considerarse una alternativa en intolerantes a inmunosupresores con pocos eventos adversos.
Vedolizumab (VDZ), a human monoclonal antibody that binds specifically to α4β7-integrin, and is approved for the treatment of Crohn's disease (CD) and ulcerative colitis (UC), has demonstrated its efficacy in controlled clinical trials.
ObjectiveTo describe a population treated with VDZ and to evaluate its long-term efficacy and safety in clinical practice.
MethodsAn observational and multicentre study was carried out on patients with inflammatory bowel disease treated with VDZ for at least one year. An evaluation was performed on the activity indices, faecal calprotectin and C-reactive protein levels, hospital admissions, surgeries, and adverse events.
ResultsA total of 73 patients were analysed (43 UC and 30 CD). More than one anti-TNF and more than one immunosuppressive was previously used by 74 and 23%, respectively, of UC patients, and 90 and 37%, respectively of CD patients. VDZ was stopped in 17 (23%) patients, 10 UC and 7 CD, due to a lack or loss of response before the first year, or due to adverse events. An intensification of the dose was required in 26 (63%) UC, and 16 (53%) CD patients. At 6 months, 70 and 42% of UC patients, and 80 and 43% of CD patients achieved a clinical response and remission, respectively. At one year, 58 and 35% of UC patients and 47 and 43% of CD patients, maintained the clinical response and remission, respectively. The C-reactive protein decreased significantly in both CD and UC patients. However, the decrease in faecal calprotectin was only achieved during follow-up in UC, but not in CD patients. Eight patients with CD that had been treated previously with ustekinumab avoided surgery at one year. A colectomy was performed on 8 (18.6%) UC patients, and 4 (13.3%) CD patients needed surgery. Six patients (8%) (5 UC and 1 CD) had adverse events. The concomitant use of corticosteroids or immunomodulators did not increase the efficacy. Those with a higher number of previous anti-TNF treatments showed less remissions in UC and responses in CD.
ConclusionsAfter one year of VDZ, a clinical response and remission was induced in a considerable percentage of patients refractory to different biological or immunosuppressive therapies. VDZ can be considered as an alternative in those intolerant to immunosuppressives, with few adverse events.
Hasta la introducción de los nuevos biológicos, vedolizumab (VDZ) y ustekinumab, no había alternativa de tratamiento en los pacientes con enfermedad inflamatoria intestinal (EII) intolerantes o no respondedores a la terapia convencional con fármacos biológicos antifactor de necrosis tumoral alfa (anti-TNF) e inmunosupresores y la cirugía era inevitable en la mayoría de los casos. Estos fármacos responden a la necesidad de nuevas dianas terapéuticas ya que aproximadamente un tercio de los pacientes con EII que reciben agentes anti-TNF no responden en ningún momento a este tratamiento (fallo primario) y una proporción significativa (mayor a un tercio) experimenta una pérdida de respuesta (fallo secundario) o intolerancia al tratamiento1. La falta de respuesta a los agentes anti-TNF puede relacionarse con la compleja fisiopatología de la EII y también a la peculiar farmacocinética y farmacodinámica de estos tratamientos. En casos de no respuesta o pérdida de la misma con niveles normales, el TNF-α no sería la citoquina fundamental implicada en la alteración de la respuesta inmune, sino que actuarían otras vías y moléculas proinflamatorias distintas que perpetuarían el mantenimiento de la actividad de la enfermedad2.
VDZ es un anticuerpo monoclonal humanizado que se une específicamente a la α4β7-integrina que se expresa en los linfocitos T colaboradores que migran al tracto gastrointestinal y favorecen la inflamación en la colitis ulcerosa (CU) y la enfermedad de Crohn (EC)3,4. Mediante la unión a α4β7 del linfocito, VDZ inhibe la migración y adhesión de estas células a MadCAM-1 (molécula de adhesión celular adresina de la mucosa 1) expresada principalmente en las células endoteliales del intestino5. Por todo esto, VDZ es un fármaco muy selectivo del tracto gastrointestinal con menos eventos adversos e inmunogenicidad que los inmunosupresores (tiopurinas) y los anti-TNF (infliximab y adalimumab fundamentalmente) disponibles para el tratamiento de la EII hasta la aprobación de este fármaco3,4.
VDZ está aprobado desde mayo del 2014 para el tratamiento de la CU y la EC ya que demostró su eficacia y seguridad en los ensayos clínicos pivotales GEMINI I6 y II7 respectivamente. Los resultados del GEMINI I demostraron que VDZ era más eficaz que placebo como tratamiento de inducción y mantenimiento en la CU activa con tasas de remisión en la semana 6 del 16,9% en tratados con VDZ vs. 5,4% en tratados con placebo y en la semana 52 del 41,8% en pacientes tratados con VDZ cada 8 semanas vs. 15,9% en grupo placebo6. La eficacia fue mayor en los pacientes no tratados previamente con anti-TNF8.
El estudio GEMINI II evaluó la eficacia del fármaco en pacientes con EC. También demostró superioridad de VDZ frente a placebo tanto en la inducción, con porcentajes de remisión del 14,5% en tratados vs. 6,8% en grupo placebo (semana 6), como en el mantenimiento a largo plazo (semana 52) con tasas de remisión de 39% en tratados vs. 21,6% en el grupo de placebo7. La eficacia también fue superior en los pacientes anti-TNF naïve9.
Después de los ensayos pivotales hay pocos estudios en práctica clínica poscomercialización. Datos procedentes de estudios observacionales han demostrado que VDZ es efectivo en la inducción de la remisión clínica libre de corticoides ya en la semana 14 tanto en la EC (18-31%) como en la CU (19-36%)10–13. El estudio SWIBREG sueco14 y la serie del grupo francés GETAID11 han demostrado porcentajes de remisión clínica superiores al 60% al año. También VDZ es capaz de conseguir la curación mucosa en un elevado porcentaje de pacientes15, tiene un buen perfil de seguridad16–18 y es capaz de mejorar la calidad de vida de los pacientes con EII a corto y largo plazo12,15.
Por todo lo anteriormente expuesto el objetivo primario del presente estudio es describir los resultados clínicos y de seguridad en una población de pacientes tratados con VDZ a medio y largo plazo (6 y 12 meses) en la práctica clínica real en nuestro medio. Los objetivos secundarios son evaluar las tasas de hospitalización y cirugías, el impacto del VDZ sobre los valores de la proteína C reactiva (PCR) y de la calprotectina fecal (CF) y la descripción de factores predictivos de efectividad.
Material y métodosEstudio observacional y multicéntrico en el que participaron 3 hospitales de Valencia con Unidades de Referencia en EII. Se incluyeron pacientes con diagnóstico de EC y de CU según los criterios habituales19 que aceptaron participar y dieron el consentimiento para revisar su historia clínica. El comité ético de los mismos aprobó el estudio. Los pacientes incluidos debían haber estado tratados con VDZ durante al menos un año y en caso de haber suspendido antes el tratamiento, debían haber sido seguidos al menos durante un año. Los datos de eficacia fueron obtenidos a partir de toda la cohorte inicial, teniendo en cuenta los pacientes a los que se les retiró el fármaco antes del primer año y considerándose «fracasos».
En todos los pacientes, VDZ se administró por vía intravenosa a dosis de 300mg en las semanas 0, 2 y 6 y después cada 8 semanas, de acuerdo con el protocolo de práctica clínica. En caso de falta o pérdida de respuesta, se determinó el manejo y el momento de intensificación de dosis de fármaco en caso de ser necesario.
Se recopilaron los datos demográficos (sexo, edad, antecedente de tabaquismo), tipo de EII (EC o CU) y clasificación de Montreal, datos de la enfermedad tales como duración de la enfermedad, tratamientos biológicos e inmunosupresores previos.
Se evaluó la actividad endoscópica al inicio del tratamiento (basal) y la actividad clínica, niveles de CF y PCR basal, a los 6 y a los 12 meses en los casos que estuviera disponible. La gravedad endoscópica y/o radiológica en el caso de la EC se definió como leve, moderada o grave a criterio del clínico. La valoración de la actividad clínica se evaluó mediante el índice de Harvey-Bradshaw para la EC y el índice de Mayo parcial para la CU. Se consideró remisión clínica en la EC un índice de Harvey ≤ 4 y en la CU un índice de Mayo parcial ≤ 2, con todas las puntuaciones de uno como máximo y con una subpuntuación de rectorragia de 0. La respuesta clínica se definió como la reducción en el índice de Mayo parcial ≥3 puntos y una disminución ≥30% respecto a la basal, con una disminución de ≥1 punto en la subescala de sangrado rectal (puntuación absoluta 0-1). Para la EC, la respuesta se definió como una disminución en el índice de Harvey ≥3 puntos sin alcanzar la remisión.
La definición de fracaso al tratamiento incluyó: 1) la recidiva clínica, considerada como la presencia de un empeoramiento clínico, cuantificado mediante índice de Harvey en EC e índice de Mayo parcial en CU junto con aumento de los parámetros inflamatorios (PCR y CF) sobre los valores iniciales y 2) necesidad de introducir corticoides, la imposibilidad de retirada de los mismos o el ingreso o cirugía por actividad de la enfermedad.
No se consideró fracaso ni la adición de salicilatos orales o tópicos ni la adición de corticoides de acción tópica. Tampoco se consideró fracaso la necesidad de dosis extra en semana 10 ni el acortamiento del intervalo siempre que hubiera respuesta posteriormente.
En caso de pérdida o falta de respuesta los cambios en el tratamiento se realizaron a discreción del médico responsable del seguimiento del paciente.
También se investigaron el número de hospitalizaciones, cirugías y eventos adversos al año, así como posibles predictores de respuesta del tratamiento.
Análisis estadísticoEl análisis estadístico de los datos se realizó mediante Microsoft Excel 2016. Se ha realizado un análisis descriptivo de las variables. Las variables continuas se expresaron como media y desviación estándar y mediana y primer y tercer cuartil. Las variables categóricas se expresaron como frecuencias y porcentajes. Se realizó un estudio multivariante (regresión de Cox) para determinar los factores predictivos de respuesta. Para todos los test se consideró como significativa una p < 0,05.
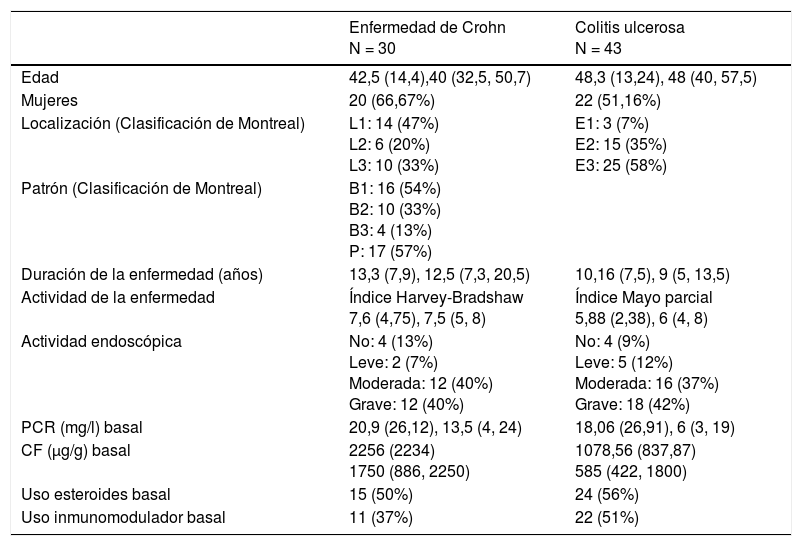
ResultadosDatos demográficos, fenotipo e historial de tratamientos previosSe analizaron un total de 73 pacientes (43 CU y 30 EC). En la tabla 1 se especifican las características de los mismos en el momento del inicio del tratamiento. La mayoría de los pacientes con EC tenían localización ileal (47%), patrón inflamatorio (54%) y el 57% tenían antecedentes de afectación perianal. En la CU, la mayoría fueron pancolitis (58%).
Características demográficas y clínicas de los pacientes
| Enfermedad de Crohn N = 30 | Colitis ulcerosa N = 43 | |
|---|---|---|
| Edad | 42,5 (14,4),40 (32,5, 50,7) | 48,3 (13,24), 48 (40, 57,5) |
| Mujeres | 20 (66,67%) | 22 (51,16%) |
| Localización (Clasificación de Montreal) | L1: 14 (47%) L2: 6 (20%) L3: 10 (33%) | E1: 3 (7%) E2: 15 (35%) E3: 25 (58%) |
| Patrón (Clasificación de Montreal) | B1: 16 (54%) B2: 10 (33%) B3: 4 (13%) P: 17 (57%) | |
| Duración de la enfermedad (años) | 13,3 (7,9), 12,5 (7,3, 20,5) | 10,16 (7,5), 9 (5, 13,5) |
| Actividad de la enfermedad | Índice Harvey-Bradshaw 7,6 (4,75), 7,5 (5, 8) | Índice Mayo parcial 5,88 (2,38), 6 (4, 8) |
| Actividad endoscópica | No: 4 (13%) Leve: 2 (7%) Moderada: 12 (40%) Grave: 12 (40%) | No: 4 (9%) Leve: 5 (12%) Moderada: 16 (37%) Grave: 18 (42%) |
| PCR (mg/l) basal | 20,9 (26,12), 13,5 (4, 24) | 18,06 (26,91), 6 (3, 19) |
| CF (μg/g) basal | 2256 (2234) 1750 (886, 2250) | 1078,56 (837,87) 585 (422, 1800) |
| Uso esteroides basal | 15 (50%) | 24 (56%) |
| Uso inmunomodulador basal | 11 (37%) | 22 (51%) |
Los datos se expresan en número absoluto (%), media (desviación estándar) y mediana (1.r, 3.r cuartil).
Basal: al inicio del tratamiento; CF: calprotectina fecal; PCR: proteína C reactiva.
La actividad de la enfermedad clínica y endoscópica fue en general de moderada a grave (80% en EC y 79% en CU). Tanto la PCR como la CF estaban elevadas y fueron mayores al inicio del tratamiento en la EC (PCR 20,9 y 18,06mg/l y CF 2256 y 1078μg/g en EC y CU respectivamente) (tabla 1).
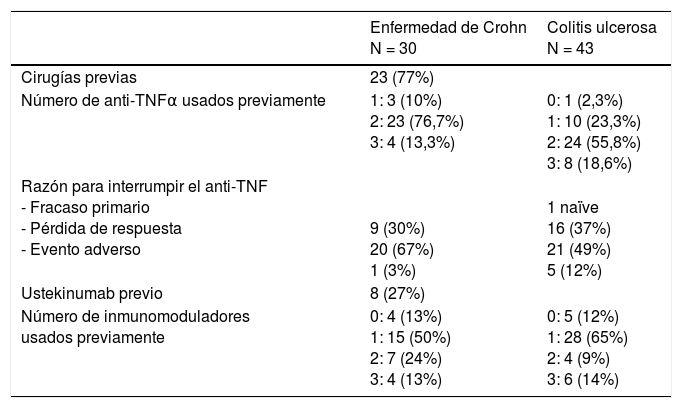
Respecto a la duración de la enfermedad en el momento de administrar VDZ, en ambos casos la media fue superior a 10 años. En la EC 23 pacientes (77%) habían sido intervenidos previamente, 15 pacientes tenían una cirugía previa, 5 tenían 2 cirugías y 3 con ≥3 cirugías. Además, los pacientes habían sido tratados con múltiples tratamientos previamente. El 74% de CU y el 90% de EC habían llevado más de un anti-TNF previamente. La mayoría venían de pérdida de respuesta al anti-TNF (67% de EC y 49% de CU) (tabla 2). Asimismo 8 pacientes con EC (27%) habían sido tratados previamente con ustekinumab administrado de forma subcutánea y a las dosis aconsejadas antes de su aprobación para la EC. Al 23% de CU y al 37% de EC se les había pautado anteriormente más de un inmunosupresor (tabla 2). El 47% de los pacientes había tenido un evento adverso previo con azatioprina que precisó la retirada de este tratamiento (9 pacientes por pancreatitis, 9 por intolerancia digestiva, 6 por hepatotoxicidad, 4 por leucopenia y 6 pacientes por otros eventos menos frecuentes).
Historia de tratamientos previos
| Enfermedad de Crohn N = 30 | Colitis ulcerosa N = 43 | |
|---|---|---|
| Cirugías previas | 23 (77%) | |
| Número de anti-TNFα usados previamente | 1: 3 (10%) 2: 23 (76,7%) 3: 4 (13,3%) | 0: 1 (2,3%) 1: 10 (23,3%) 2: 24 (55,8%) 3: 8 (18,6%) |
| Razón para interrumpir el anti-TNF - Fracaso primario - Pérdida de respuesta - Evento adverso | 9 (30%) 20 (67%) 1 (3%) | 1 naïve 16 (37%) 21 (49%) 5 (12%) |
| Ustekinumab previo | 8 (27%) | |
| Número de inmunomoduladores usados previamente | 0: 4 (13%) 1: 15 (50%) 2: 7 (24%) 3: 4 (13%) | 0: 5 (12%) 1: 28 (65%) 2: 4 (9%) 3: 6 (14%) |
Los datos se expresan en número absoluto (%).
Aproximadamente la mitad de los pacientes llevaron corticoides e inmunomoduladores durante la inducción (tabla 1).
Respuesta y remisión clínicaVDZ se suspendió en 17 pacientes (23%) antes del primer año, 10 CU y 7 EC (media de tiempo de tratamiento 22±14 y 26±12 semanas respectivamente) por falta o pérdida de respuesta (13 pacientes) o por eventos adversos (4 pacientes).
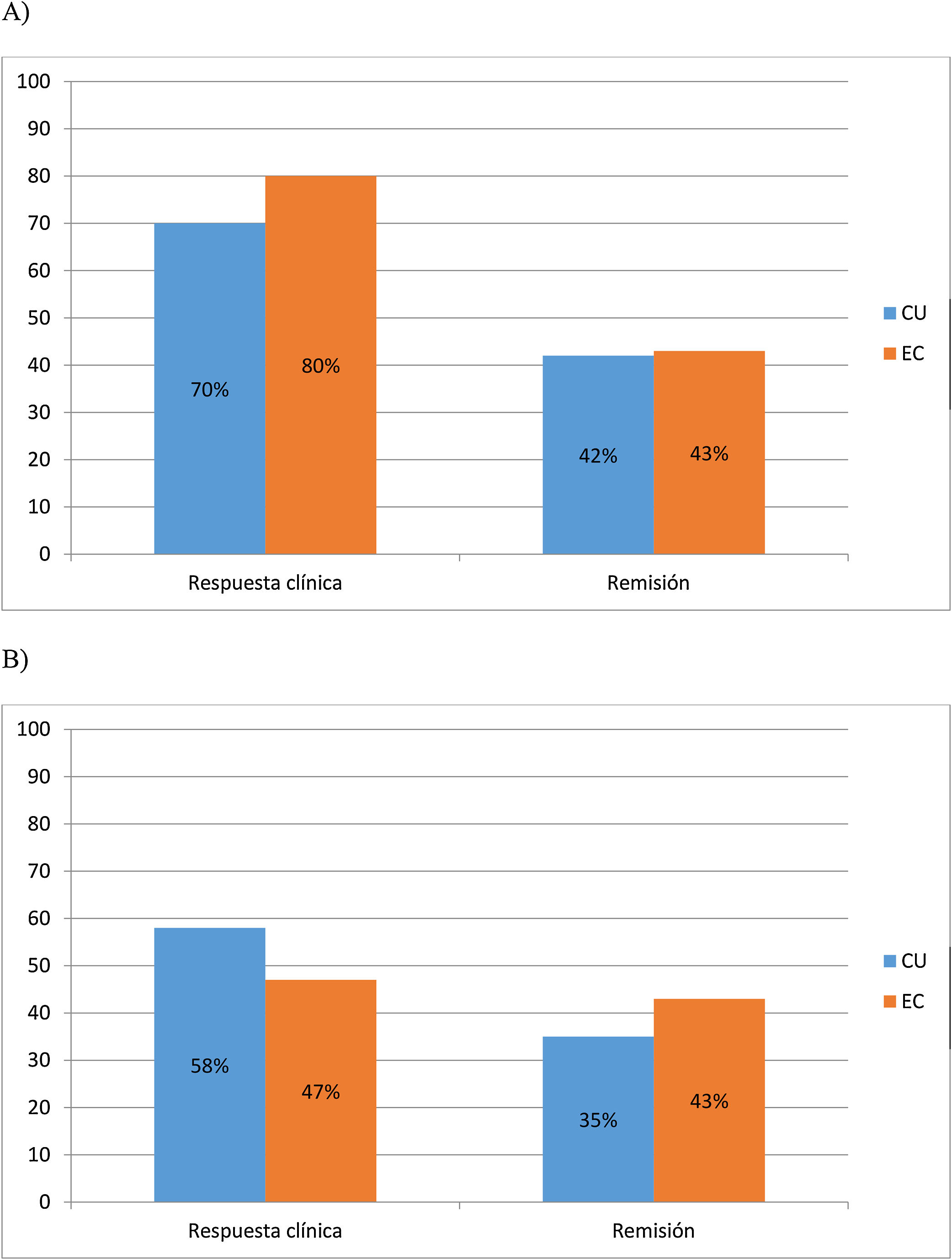
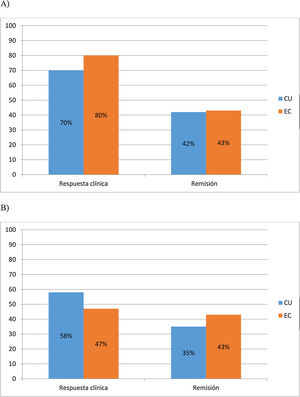
A los 6 meses, el 70% (30/43) y 42% (18/43) de CU y el 80% (24/30) y 43% (13/30) de EC lograron respuesta y remisión clínica respectivamente. Al año, el 58% (25/43) y 35% (15/43) de CU y el 47% (14/30) y 43% (13/30) de EC mantuvieron la respuesta clínica y la remisión, respectivamente (fig. 1 A y B).
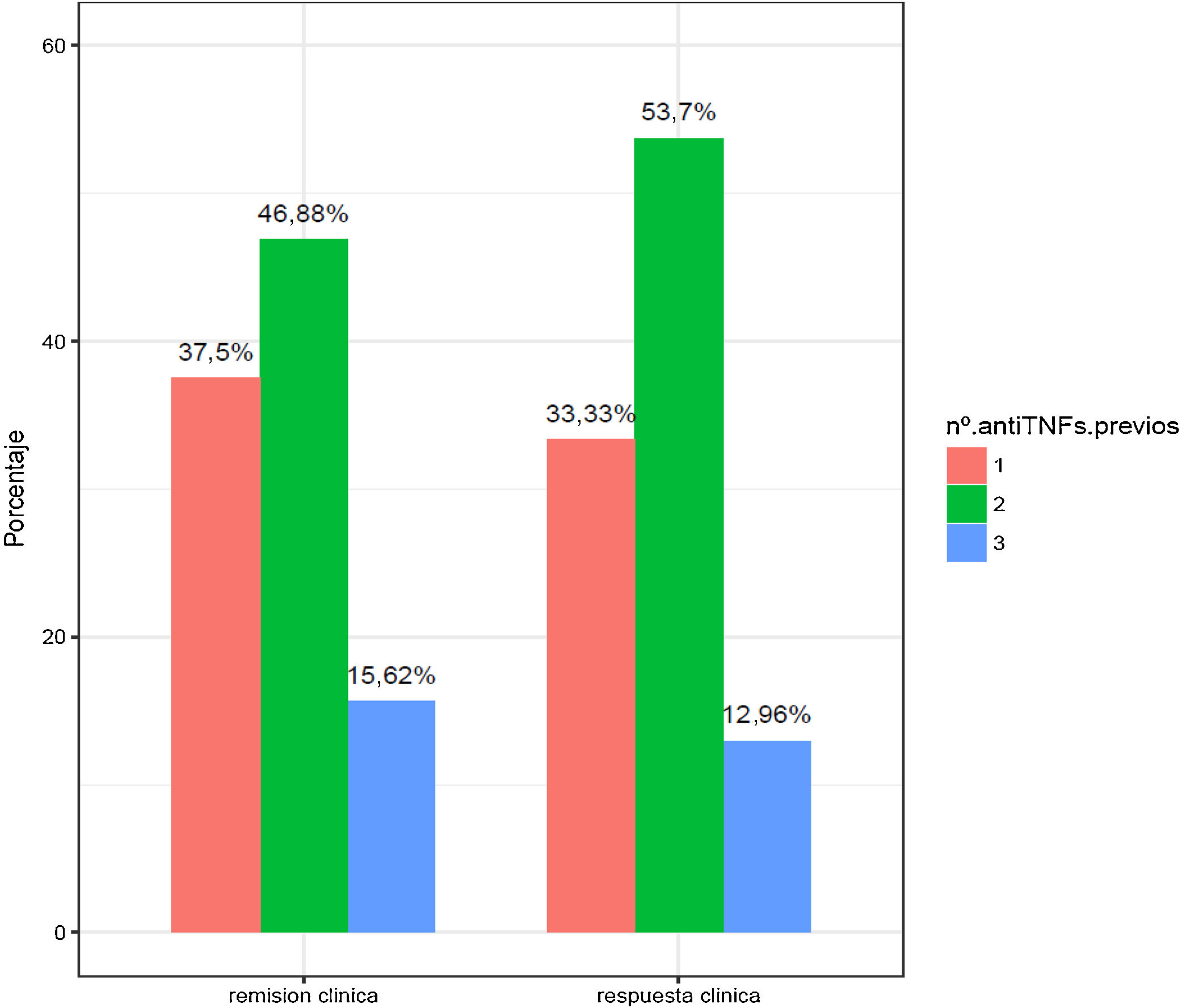
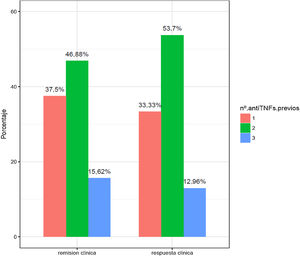
En la figura 2 se exponen los porcentajes de respuesta y remisión clínica en función del número de anti-TNF usados previamente. Los pacientes con fracaso a tres anti-TNF son los que presentaron una peor tasa de respuesta y remisión (15,62 y 12,96%).
Manejo de la falta y pérdida de respuestaVDZ se suspendió en 13 pacientes (17,8%), 7 CU y 6 EC debido a la falta o pérdida de respuesta antes del primer año. Durante el seguimiento, presentaron pérdida de respuesta 27 (63%) CU y requirieron intensificación de la dosis: 13 pacientes en semana 10, 3 pacientes en semana 14, 6 pacientes en semana 18, 4 pacientes en semana 24 y uno en semana 50 (media 16±9,2 semanas). El clínico pasó a administrar el fármaco cada 6 semanas en 3 pacientes y cada 4 semanas en 24 pacientes.
En la EC 15 (50%) pacientes presentaron pérdida de respuesta y precisaron dosis adicional o acortamiento del intervalo: 7 pacientes en semana 10, 2 pacientes en semana 14, 2 pacientes en semana 18, 3 pacientes en semana 24 y uno en semana 50 (media 17,2 ± 10,6 semanas). Se pasó a administrar el fármaco cada 6 semanas en 4 pacientes y cada 4 semanas en 11 pacientes.
SeguridadSeis pacientes del total (8%) (5 CU y un EC) tuvieron eventos adversos durante el seguimiento, en 4 pacientes (3 CU y 1 EC) obligó a la retirada antes del primer año. Los efectos adversos principalmente encontrados fueron rinofaringitis, artralgias, infecciones no oportunistas y una reacción relacionada con la infusión.
Cirugías y hospitalizacionesEn cuanto a los 8 pacientes con EC que habían sido tratados previamente con ustekinumab todos evitaron la cirugía al año. De toda la cohorte analizada, 12 pacientes precisaron intervención quirúrgica al año, 8 CU (18,6%) se sometieron a colectomía y 4 EC (13,3%) necesitaron cirugía abdominal con resección (3 resecciones ileocólicas y una colectomía subtotal con anastomosis ileorrectal). Respecto al postoperatorio, 2 pacientes tuvieron complicaciones menores: un paciente con CU presentó íleo paralítico y otro con EC un absceso de la pared abdominal. Requirieron hospitalizaciones 10 pacientes con CU (23%) y 8 con EC (27%) durante el año de seguimiento.
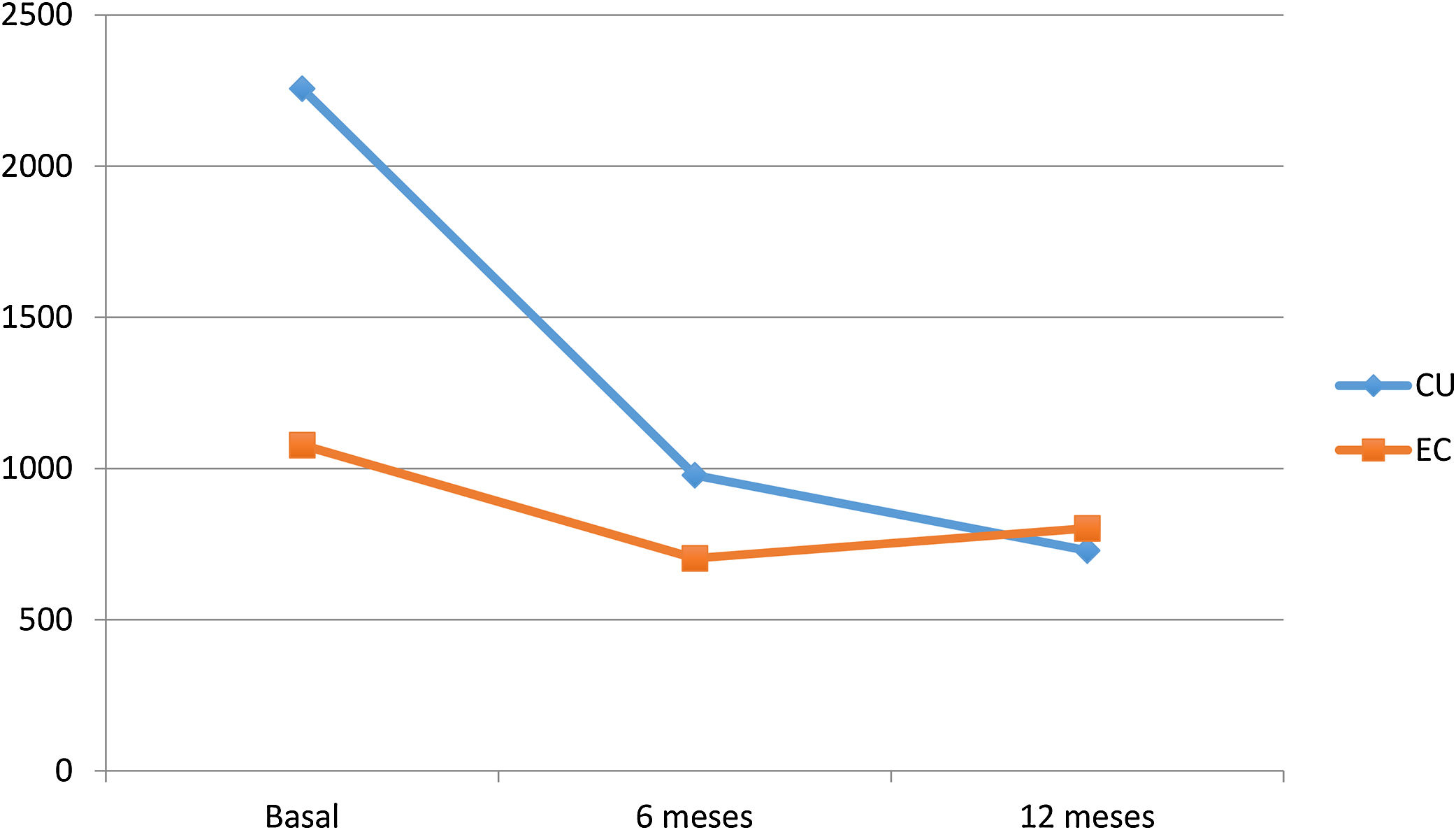
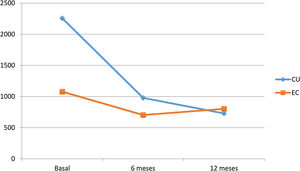
Impacto sobre los biomarcadores de inflamaciónVDZ logró reducir la PCR tanto en la CU como en la EC al año de seguimiento (20,9mg/l, 9,1mg/l y 7,9mg/l en CU vs. 18mg/l, 11,23mg/l y 10,1mg/l en EC, basal, 6 meses y un año respectivamente). Sin embargo, la disminución de las cifras de CF durante el seguimiento fue superior en los pacientes con CU (2256, 978 y 729μg/g en CU vs. 1078, 703, 802μg/g en EC, basal, 6 meses y un año respectivamente) (fig. 3).
Predictores de efectividad clínicaEn el análisis multivariado, el uso concomitante de corticoides o inmunomoduladores no aumentó la efectividad del fármaco. Solo el número de tratamientos previos con anti-TNF se relacionó con la ausencia de remisión en la CU y la falta de respuesta en la EC.
DiscusiónEn este estudio de evaluación de la eficacia de VDZ tras un año de seguimiento se ha demostrado que es un fármaco seguro, con pocos EA y capaz de inducir respuesta y remisión clínica en pacientes con larga evolución de la enfermedad, intervenidos y refractarios a otras líneas terapéuticas. Además, podría evitar cirugías y necesidad de hospitalización. No parece precisar de terapia combinada para aumentar su eficacia y esta es mayor cuanto menos anti-TNF se han usado previamente.
Los datos de eficacia obtenidos en este trabajo son similares a los descritos en estudios publicados de vida real, pero el momento de evaluación fue diferente. La mayor parte de los estudios en la vida real evalúan la respuesta en la semana 12 o 1410–14, a diferencia de los estudios pivotales que valoran la eficacia antes. En el ensayo de inducción GEMINI 2, la disminución del CDAI, de los niveles de PCR y las mayores diferencias de eficacia con placebo aparecieron muy tarde, al año de tratamiento7 y en el GEMINI 3 se observó que la remisión clínica era detectable en la semana 10 pero no en la semana 620. VDZ por sus propiedades farmacocinéticas, tiene una respuesta más lenta que los anti-TNF, sin embargo, como tratamiento de mantenimiento, los datos de VDZ muestran una remisión profunda y sostenida en pacientes que inicialmente respondieron a la inducción, con una menor pérdida de eficacia a largo plazo que los anti-TNF21. Por ello, nosotros hemos evaluado a los pacientes a los 6 meses (semana 24) y al año (semana 52).
Solo dos estudios han evaluado la eficacia de VDZ a los 6 meses y por tanto, son comparables con nuestros resultados. El estudio americano US VICTORY analizó la respuesta clínica y la respuesta y remisión libre de corticoides a los 6 meses en la EC (32, 26 y 18% respectivamente), siendo las tasas de respuesta clínica algo inferiores a las de nuestra serie22. La población analizada también había sido tratada con varios agentes biológicos previos, anti-TNF e incluso ustekinumab. El segundo estudio es finlandés (FINVEDO), evaluó la remisión clínica a los 6 meses y obtuvo los mismos resultados en CU (41,8 y 42% en nuestro trabajo). Sin embargo, en EC tuvo porcentajes de remisión mucho mayores (73,3% frente al 43% en nuestro estudio)23. En esta serie, mayor que la nuestra (108 EC y 139 CU), las características de los pacientes con EC fueron similares en cuanto a edad (42,5 vs. 40,3 años), duración de la enfermedad (13,3 vs. 13,9 años) y distribución del patrón de la enfermedad (B1 54 vs. 52,8%, B2 33 vs. 41,7% y B3 13 vs. 12%). También el porcentaje de pacientes bajo tratamiento concomitante con inmunosupresores y corticoides fue similar. Solo diferían en la localización de la enfermedad y en el número de anti-TNF previos. En nuestra población con EC la mayoría tenía localización ileal (47%) y en el estudio FINVEDO solo el 12% era ileal, la mayoría tenían afectación de colon (L2 26,9% y L3 59,3%)23. A este respecto, se ha observado in vitro que la respuesta de VDZ por inhibición de α4β7 no es idéntica en EC y CU. Mientras que en la CU se observa un aumento rápido de los linfocitos T reguladores, con una disminución de la ratio T efectores/T reguladores, que potencialmente lleva a la supresión de la inflamación sistémica, esto no ocurre en la EC, apoyando así la idea de que los efectos de la inhibición de α4β7 no son idénticos en ambas patologías24. La base fisiopatológica de este efecto parece ser debida a que en el íleon existen niveles aumentados de que α4β1 y el bloqueo de α4β7 a través de VDZ es eludido25. Por otro lado, respecto a los tratamientos previos, en nuestra población el 90% de EC venían de fallo a dos o más anti-TNF y un 25% había sido tratado además con ustekinumab. Por tanto, nuestra población tenía, en principio, factores de riesgo de mala respuesta26.
En cuanto a la eficacia obtenida a largo plazo, a las 52 semanas, nuestros resultados son similares a los ensayos clínicos pivotales6,7. Es sorprendente porque a diferencia de los ensayos clínicos, en práctica clínica se permite la intensificación de la dosis del fármaco (en nuestra cohorte, más de la mitad la precisaron y de forma precoz) y el uso concomitante de otros tratamientos. En práctica clínica el estudio sueco SWIBREG que incluyó 147 pacientes con EC y 92 con CU, a las 52 semanas encontró en la EC y en la CU tasas de respuesta clínica similares a nuestro estudio (59 vs. 58% y 53 vs. 47% respectivamente). Sin embargo, la tasa de remisión clínica que obtuvo fue mucho mayor en la EC (64 vs. 35%) y en la CU (60 vs. 43%)14. En este caso, los pacientes incluidos en el estudio SWIBREG tenían un tiempo de evolución de la enfermedad menor que el de nuestros pacientes (8,5 años en EC y 4 años en CU) y la mayoría solo habían fracasado a un anti-TNF, factores que pueden favorecer la respuesta a biológicos y por tanto, podrían haber contribuido a obtener mejores resultados1,14,22,26. En el presente estudio también el número de anti-TNF previos se correlacionó con la respuesta al fármaco, un factor ya estudiado y constante en casi todos los estudios publicados26. Curiosamente la respuesta a VDZ parece que fue mejor en los que recibieron dos anti-TNF que en aquellos que recibieron uno y tres anti-TNF probablemente porque el porcentaje de pacientes que habían recibido 2 anti-TNF previos era mayor en las dos patologías.
En nuestra serie, se incluyeron pacientes con EC que habían sido tratados no solo con anti-TNF sino también con ustekinumab (inhibidor de la IL12/23) aunque en las dosis y vía de administración recomendada precomercialización del fármaco en EC y por tanto, no ajustada a peso y subóptima, pudiendo haber perdido parte de la potencial eficacia de este fármaco. VDZ fue eficaz en ellos evitando la cirugía al año de tratamiento. Hasta la fecha solo el estudio VICTORY ha incluido pacientes tratados previamente con otro fármaco biológico con mecanismo de acción distinto al anti-TNF, sin embargo, no analiza los resultados en este subgrupo22. Aunque la vía inflamatoria más estudiada en la EII se describe como dependiente del TNF-α y su bloqueo se asocia con la mejoría de la inflamación, una gran parte de pacientes no responde o pierde la respuesta con el tiempo27. La posible eficacia a un tercer mecanismo de acción tras haber intentado el bloqueo de 2 vías inflamatorias diferentes, deja patente que la fisiopatología de la EC es muy compleja y que existen otros mecanismos involucrados en la perpetuación del estado inflamatorio crónico en la EC y por tanto, el beneficio de usar nuevos fármacos para intentar bloquear otras vías inflamatorias28.
Una gran proporción de pacientes de nuestra serie presentó eventos adversos a azatioprina (47%) y el uso concomitante con corticoides e inmunomoduladores no se asoció a mejor respuesta al fármaco. Hoy en día se sabe que el tratamiento combinado con anti-TNF más un inmunosupresor es superior a la monoterapia con anti-TNF tanto en la EC29 como en la CU30. Esto es debido al efecto adyuvante que ejerce el inmunosupresor disminuyendo la inmunogenicidad, la capacidad de desarrollar anticuerpos contra el anti-TNF y, por tanto, la pérdida de respuesta al fármaco. En este sentido, ya se ha apuntado que VDZ podría ser una buena alternativa en pacientes con intolerancia a las tiopurinas y refractarios a tratamiento médico debido a su baja inmunogenicidad, a su elevada seguridad y a que parece que el uso concomitante con inmunosupresores no mejora la eficacia del fármaco31.
VDZ fue útil para prevenir la cirugía y solo 12 pacientes (16%) precisaron intervención quirúrgica al año. Además, con pocas complicaciones posquirúrgicas, solo en 2 pacientes (17%). A este respecto existe controversia en la literatura. Existen series que describen que los pacientes con EII que recibieron VDZ dentro de los 30 días previos a cirugía abdominal mayor experimentaron más complicaciones postoperatoria que los pacientes que recibieron anti-TNF o que no recibieron ninguna terapia biológica32 y otros que no tuvieron más complicaciones con VDZ33. Por tanto, serán necesarios más estudios teniendo en cuenta todas las variables clínicas además de la experiencia de los centros donde se lleva a cabo la cirugía.
Nuestra tasa de eventos adversos al año fue baja, del 8%, y similar a las obtenidas en otros estudios de vida real11,13. Los eventos adversos observados más frecuentemente con VDZ son cefalea, parestesias, artralgias, reacciones cutáneas paradójicas, fatiga, nasofaringitis, infecciones de vías superiores, tos, infección gastrointestinal y dolor abdominal11,12,16. En general, tanto los estudios pivotales como los de práctica clínica demuestran un buen perfil de seguridad del fármaco, con bajas tasas de incidencia de infecciones graves y tumores malignos durante un período de tratamiento prolongado, además de que no se ha descrito ningún caso de leucoencefalopatía multifocal progresiva16.
En nuestra cohorte, la PCR disminuyó tanto en la EC como en la CU, sin embargo, la disminución de las cifras de CF fue superior en los pacientes con CU a pesar de partir de niveles muy superiores. Estos datos deben interpretarse con cautela, puesto que el número de pacientes incluidos no era suficiente para realizar un análisis estadístico. Además, hubo pérdidas en el seguimiento, debido a la retirada precoz (antes del año) y a que no estaban estos parámetros documentados en todos los momentos de evaluación (basal, 6 meses, año de tratamiento). Existen otros estudios que sí han evaluado la respuesta biológica mediante la progresión de la PCR y la CF durante el tratamiento con VDZ. El estudio alemán observó que los niveles de CF en la CU disminuían progresivamente en todos los tiempos evaluados (semana 0, 6 y 14), sin embargo, en la EC la bajada fue más lenta y menos significativa12. El estudio sueco encontró que la CF disminuía significativamente en EC y CU pero la PCR solo disminuía en la EC14. Los niveles de PCR altos en la inducción10,11 así como la disminución precoz (en semana 14) de PCR y CF34 se han correlacionado con la respuesta al fármaco. Por tanto, parece que el uso de estos biomarcadores es útil y debe ser explorado en profundidad para ver el posible impacto que tiene el tratamiento con VDZ sobre estos.
Las limitaciones de nuestro estudio son fundamentalmente el carácter retrospectivo de la recogida de datos y el escaso número de pacientes incluidos (solo 30 EC). Además, no se ha valorado la remisión endoscópica y al tratarse de un estudio en vida real se ha permitido la administración de tratamientos concomitantes (salicilatos orales y tópicos) y no se han considerado fracaso las dosis adicionales o intensificaciones. Tampoco se han contemplado, como en un ensayo clínico, periodos de lavado del fármaco biológico previo. Todo ello puede interferir en los resultados en sentido positivo. Sin embargo, se describe por primera vez la posible respuesta a VDZ tras fracaso a fármacos con diferentes mecanismos de acción en pacientes con EC. Además, nuestra cohorte es muy representativa del uso actual del VDZ en nuestro medio. Se tiende a utilizar el fármaco en pacientes con mucho tiempo de evolución de la enfermedad, patrones de enfermedad agresivos, historia previa de cirugías y exposición previa a más de un anti-TNF e inmunosupresores, por tanto, en una población con bajas probabilidades de responder a VDZ. En un futuro es probable que usemos este fármaco de forma más precoz y en determinados pacientes con necesidad de mayor perfil de seguridad. VDZ es probablemente una buena alternativa en pacientes con intolerancia a las tiopurinas y refractarios a tratamiento médico, debido a su baja inmunogenicidad y a su elevada seguridad.
Conflicto de intereses- -
Marisa Iborra colabora en ponencias o asesoramiento con Takeda y MSD.
- -
Belén Beltrán Niclos colabora en ponencias y asesoramiento con Abbvie, Ferrer, Otzuka, Pfizer, Takeda.
- -
Nuria Maroto Arce ha participado como ponente y consultora para MSD, Abbvie, Takeda, Ferring, Tillots Pharma.
- -
Isabel Ferrer-Bradley colabora en ponencias con Abbvie y Ferrer.
- -
Maia Bosca colabora en asesoramiento o ponencias con Abbvie, Ferring, Takeda, Kern Pharma y MSD.
- -
Miguel Mínguez colabora en asesoramiento o ponencias con Allergan, Takeda, Abbvie y Janssen.
- -
Joaquín Hinojosa del Val colabora en asesoramiento o ponencias con MSD, Abbvie, Ferring, Faes Farma, Shire Pharmaceuticals, Chiesi, Otsuka Pharmaceutical, Pfizer–Hospira, Kern Pharma, UCB Pharma, Vifor Pharma, Janssen, Takeda y Dr. Falk Pharma.
- -
Pilar Nos Mateu colabora en ponencias y asesoramiento con Abbvie, Ferrer, MSD, Otsuka, Takeda, Kern, Biogen, Ferring.