Las recomendaciones son consejos dados por considerarse beneficiosos y no dejan de ser sugerencias, abiertas por tanto a diferentes interpretaciones. En ese sentido, el objetivo final de la revisión ha sido, con las evidencias disponibles, intentar homogeneizar al máximo la aproximación al diagnóstico y tratamiento medicoquirúrgico de una de las manifestaciones más complejas de la enfermedad de Crohn como son las fístulas perianales simples y complejas
Recommendations are advice that is given and considered to be beneficial; however, they are still suggestions and are therefore open to different interpretations. In this sense, the final objective of the review has been to try to homogenize, with the evidence available, the approach to the diagnosis and medical/surgical treatment of one of the most complex manifestations of Crohn's disease, such as simple and complex perianal fistulas.
El concepto de enfermedad perianal (EPA) incluye las anomalías anorrectales (fisura, fístula o absceso, repliegues cutáneos y maceración perianal) presentes en los pacientes con enfermedad de Crohn (EC) de cualquier otra localización. La misma denominación puede aplicarse cuando los hallazgos anorrectales son compatibles con dicha enfermedad sin que todavía haya evidencias objetivas de la misma. Alrededor del 9% de los pacientes diagnosticados de EC debutan con patología anal o perianal, e incluso esta puede preceder el inicio de los síntomas intestinales en varios años. La mayoría de los enfermos con EC presentan alguna anomalía perianal que suele ser asintomática hasta en el 70% de los casos. La incidencia de los problemas anales en la EC varía enormemente según las series publicadas (20-80%). Esta incidencia también resulta variable dependiendo de si la EC afecta al intestino delgado (22-71%) o al colon (47-92%)1.
La historia natural de la EPA es conocida solo de forma parcial y varía dependiendo del tipo de lesión y de su gravedad. En un estudio de cohorte de inicio (1970-1993) que recogió la totalidad de pacientes con EC del condado de Olmsted (Minnesota), el 20% desarrollaron fístulas perianales, siendo el riesgo acumulativo a los 10 y 20años del 21 y del 26%, respectivamente; el 34% de los pacientes desarrollaron fístulas recidivantes; el 83% requirieron tratamiento quirúrgico (la mayor parte de las veces cirugía menor), y hasta el 23% precisaron una resección intestinal2. En este sentido, una revisión realizada en nuestro país que incluyó a 2.391 pacientes con diagnóstico de EC y con un tiempo de evolución de su enfermedad de 12años, el 24% desarrollaron fístulas perianales (la mitad de ellas complejas) asociadas con frecuencia a abscesos y estenosis del conducto anal3.
La EPA incluye tres tipos de lesiones: primarias, secundarias y concomitantes o casuales4: a)lesiones primarias, que derivan del proceso patológico primario encontrado en el intestino y reflejan la actividad general de la propia EC; b)lesiones secundarias, que son complicaciones mecánicas o infecciosas de las lesiones primarias, más que una manifestación directa de la EC, y c)lesiones concomitantes, que hacen referencia a cualquiera de las lesiones anteriores pero sin relación directa con la EC, pudiendo preceder a la aparición de la enfermedad con independencia de esta (tabla 1).
Manifestaciones clínicasLa EPA se manifiesta como erosiones superficiales anales, repliegues cutáneos, fisura, absceso, fístula o estenosis anal. En general, suelen ser lesiones poco sintomáticas o completamente asintomáticas, de localización atípica, y es frecuente la multiplicidad de ellas. El diagnóstico es fácil si el paciente ya está diagnosticado de EC. Si es una forma de inicio algunos rasgos pueden orientar a que se trata de una EPA asociada a una EC, como la multiplicidad de las lesiones, la localización lateral de las fisuras, las úlceras anales o perianales profundas, la estenosis anal, múltiples orificios fistulosos y escasa o nula sintomatología a pesar del llamativo aspecto de las lesiones4.
La lesión anal más frecuente son los repliegues cutáneos, y la segunda, por orden de frecuencia, son las fístulas que suelen ser crónicas e indoloras, salvo que exista pus a tensión por un absceso anal subyacente. En este último caso son dolorosas, pueden cursar con fiebre o febrícula y a la exploración se suele ver el orificio fistuloso externo con signos inflamatorios y bajo tensión. Es frecuente que existan varios orificios fistulosos externos no solo en la región perianal sino en zonas más alejadas, como los glúteos, los muslos o los genitales. En las mujeres son también frecuentes las fístulas anovaginales o rectovaginales, sobre todo si hay afectación rectal.
DiagnósticoExploración región anal, perianal y perinéLa exploración de la región anoperineal debe seguir una sistemática para obtener el máximo rendimiento, siendo recomendable describir la situación y el número de orificios fistulosos externos, palpar posibles trayectos indurados entre el orificio fistuloso externo y el ano, realizar tacto rectal, realizar una anuscopia instilando suero fisiológico o agua oxigenada diluida al 50% por cada uno de los orificios fistulosos externos apreciando la salida por los orificios internos, realizar rectoscopia para evaluar la presencia de proctitis e intentar clasificar las fístulas como simples o complejas5.
Exploración/revisión bajo anestesia (EBA)La exploración anorrectal bajo anestesia por un cirujano colorrectal experto es obligatoria en la evaluación completa de la EPA en la EC, y es la prueba de referencia con la que contrastar las técnicas de imagen. Durante esta revisión se reconocerán y clasificarán los distintos tipos de trayectos fistulosos, la existencia de cavidades asociadas y, además, podremos drenar abscesos, colocar/cambiar sedales, tomar biopsias y realizar rectoscopia. La EBA debe indicarse con carácter preferente ante la aparición de dolor con sospecha de absceso, no estando justificada su demora por no disponer de ninguna prueba complementaria de imagen6. Del mismo modo, cuando se vaya a iniciar tratamiento con biológicos hay que descartar cualquier proceso séptico perianal mediante pruebas de imagen e indicar EBA ante cualquier duda para drenaje del foco séptico o colocación de sedales. La EBA tiene una precisión superior al 90% para delimitar los trayectos y localizar focos sépticos, superior a cualquier otra exploración complementaria7. En los casos en que la EBA no puede identificar correctamente las fístulas o abscesos, fundamentalmente porque existe induración, estenosis o fibrosis cicatricial, puede ser necesario repetir la exploración o recurrir a pruebas de imagen.
Técnicas de imagenTomografía axial computarizada (TAC) de pelvis menorLa TAC tiene un papel muy limitado en la evaluación de la EPA8. Su capacidad de resolución es baja, y expone a los pacientes a radiaciones ionizantes, evitadas con la resonancia magnética (RM) y la ecografía endoanal (EEA). Es una exploración complementaria obsoleta para evaluar la EC perianal.
Resonancia magnética de pelvis menorLa RM pélvica es una técnica no invasiva de gran precisión diagnóstica, siendo considerada la técnica de imagen de referencia de la EPA9. Ha demostrado ser muy eficaz para detectar colecciones purulentas en la pelvis, demostrar fístulas ocultas, evaluar la extensión de la enfermedad proximal o el nivel de la fístula, especialmente en pacientes con sepsis perianal y síntomas recurrentes, y puede diferenciar entre actividad y fibrosis10,11. Su precisión diagnóstica se sitúa en torno al 80-100%11. Existen varias clasificaciones de las fístulas perianales que se basan en índices radiológicos medidos por RM9. El índice radiológico más comúnmente utilizado es el índice de Van Assche, que combina características anatómicas de los trayectos fistulosos y hallazgos radiológicos relacionados con la inflamación de la fístula11. La RM es la técnica de imagen más precisa para evaluar la EPA, y debe ser la primera técnica a realizar para su caracterización9.
Ecografía endoanalLa EEA es una alternativa útil a la RM para diagnosticar las fístulas perianales en manos de un explorador experto, aunque su rentabilidad puede estar limitada por su menor penetrancia en profundidad12. La EEA permite una visualización detallada del complejo esfinteriano anal, con una precisión entre el 86-95% para la identificación del tipo de trayecto fistuloso y entre el 62-94% para la localización de los orificios fistulosos internos13. No obstante, no puede identificar de forma adecuada abscesos supraelevadores o localizados más allá de 4cm del conducto anal, ya que su distancia focal es limitada. La rentabilidad de esta exploración también puede estar limitada por la presencia de una estenosis anal. La posibilidad de realizar EEA con reconstrucción de imagen 3D, la infusión local de peróxido de hidrógeno y el uso del doppler color pueden mejorar su precisión14. La precisión de la ecografía transperineal es similar a la de la EEA y puede ofrecer ventajas con respecto a la RM para diagnosticar fístulas anovulvares15. Como se ha comentado, la EBA, la EEA y la RM tienen una precisión similar en el estudio de las fístulas anales. La combinación de más de una de esas técnicas puede constituir el enfoque más adecuado para pacientes con EC con fístula compleja o absceso (pudiendo alcanzar el 100% de precisión)9. La utilización de una u otra técnica dependerá de la disponibilidad y de la experiencia del equipo que trata al paciente.
La RM pélvica y la EEA son superiores a la exploración física para evaluar la respuesta al tratamiento de la EPA (descartan actividad en el trayecto aunque el orificio externo esté cerrado), aunque no hay estudios que comparen ambas técnicas en este escenario9. La RM pélvica se usa frecuentemente para evaluar la respuesta de la EPA al tratamiento médico, a pesar de que no está bien definido en qué momento debe hacerse esta, ni qué índice radiológico es el más óptimo para analizarla9.
EndoscopiaLa valoración de la actividad rectal mediante endoscopia es esencial para el posterior manejo de la EPA. La endoscopia permite evaluar la gravedad y la extensión de la actividad luminal, especialmente rectal, además de detectar algunas complicaciones como el cáncer o las estenosis. La presencia de proctitis es un factor predictivo de no curación de las fístulas y de altas tasas de proctectomía15.
En la práctica clínica la evaluación de las fístulas perianales debería combinar la exploración física de la región anal y perianal, la realización de una endoscopia para evaluar el recto y la RM pélvica para la descripción anatómica y de la actividad inflamatoria. La EEA es una alternativa útil a la RM, con una precisión similar en el estudio de las fístulas perianales.
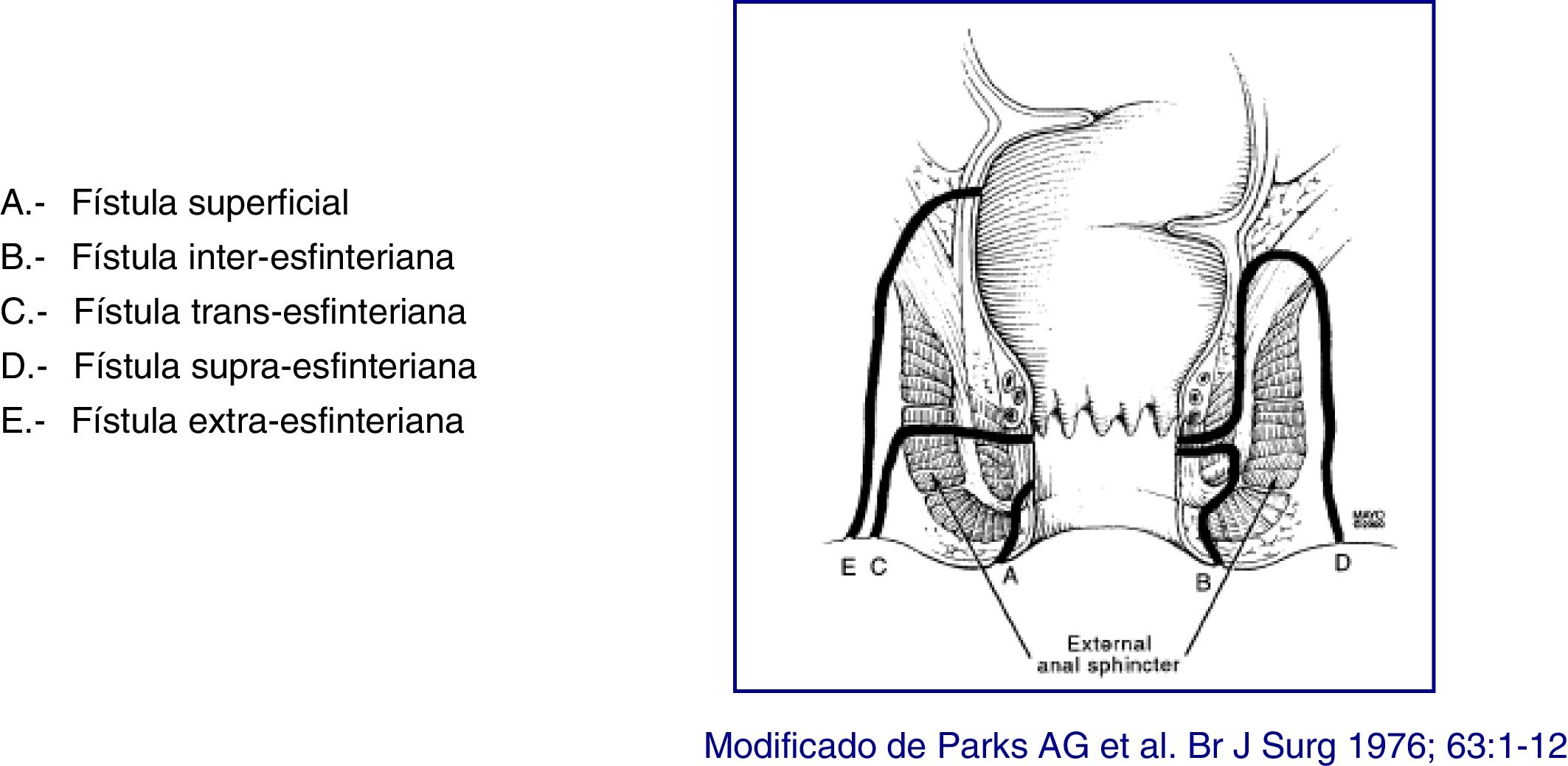
Clasificación de las lesionesLa descripción anatómica de las fístulas debe incluir el tipo de fístula, su relación anatómica con el conducto anal (esfínter interno y externo), los orificios externos y su localización, la identificación de los orificios internos y la presencia de tractos secundarios y de abscesos. El trayecto de la fístula debe describirse sobre su presencia en el espacio interesfinteriano, transesfinteriano, supraesfinteriano o extraesfinteriano, siendo importante señalar la presencia de abscesos y su relación con los esfínteres. La descripción de los orificios externos e internos sigue el sistema del «reloj anal», en el que, con el paciente en posición de litotomía, el periné anterior está ubicado a las 12h y el posterior a las 6h. Así mismo, los tractos secundarios deben definirse en relación con el plano del músculo elevador (infra o supraelevador) y por su extensión horizontal (en herradura). Otro aspecto importante durante la descripción es constatar la supuración o no a través de los orificios externos, así como la evaluación del recto. Una correcta clasificación de las fístulas permite un tratamiento más apropiado y mejores resultados. Dada la gran heterogeneidad de lesiones en la EC perianal es aconsejable utilizar algún tipo de escala o clasificación que permita establecer de forma objetiva las lesiones que presenta el paciente, así como la evolución de las mismas y su respuesta al tratamiento.
Una de las primeras clasificaciones anatomopatológicas fue propuesta en 1978 por Hughes del grupo de Cardiff (clasificación de Hugues-Cardiff). En ella se evaluaba la presencia o no de ulceración, fístula o absceso y estenosis, junto con la presencia de enfermedad intestinal, patología anal asociada y actividad de las lesiones16. Esta clasificación no ha sido validada, y aunque es una de las más conocidas, su aplicación en la práctica de rutina es difícil y de interés limitado en términos de manejo del paciente.
La clasificación basada en el índice de actividad de la enfermedad de Crohn perianal (Perianal Disease Activity Index [PDAI]) valora de un modo funcional el efecto de la EPA sobre aspectos fundamentales de la vida del paciente17 (tabla 2). La revisión técnica de la American Gastroenterological Association (AGA) publicada en 2003 propuso una clasificación más sencilla identificando las fístulas como «simples» o «complejas»18 (tabla 3). Aunque posiblemente ninguna de las clasificaciones propuestas cumple al 100% los requisitos idóneos para esa finalidad, es aconsejable utilizar alguna con el fin de unificar criterios en un grupo de trabajo y poder valorar de un modo objetivo la evolución de las lesiones y su respuesta a los distintos tratamientos.
Índice de actividad de la enfermedad perianal (PDAI)
| Descarga |
| 0. Ausente |
| 1. Mínimo mucoso |
| 2. Moderado moco o pus |
| 3. Importante |
| 4. Incontinencia fecal |
| Dolor/restricción actividades |
| 0. No restricción actividades |
| 1. Escaso disconfort, no restricción |
| 2. Moderado disconfort, algunas limitaciones |
| 3. Marcado disconfort y restricción |
| 4. Severo dolor y limitación |
| Grado de induración |
| 0. No induración |
| 1. Induración mínima |
| 2. Induración moderada |
| 3. Induración marcada |
| 4. Fluctuación/absceso |
| Restricción de la actividad sexual |
| 0. No restricción actividad sexual |
| 1. Restricción leve |
| 2. Limitación moderada |
| 3. Limitación marcada |
| 4. Limitación total |
| Tipo de enfermedad perianal |
| 0. Ausente/colgajos cutáneos |
| 1. Fisura anal o desgarro mucoso |
| 2. < 3 fístulas perianales |
| 3. ≥ 3 fístulas perianales |
| 4. Ulceración esfínter anal |
Fuente: Irvine17.
Clasificación de la American Gastroenterological Association (AGA) de las fístulas perianales
| Fístulas simples | Fístulas complejas |
|---|---|
| • Bajas (superficial, interesfinteriana, transesfinteriana baja)• Orificio externo único• No dolor ni fluctuación• ¿Actividad rectal? | • Altas (inter o transesfinteriana alta, supra o extraesfinteriana)• Múltiples orificios• Dolor/fluctuación que sugiere absceso perianal• Actividad rectal• Fístulas rectovaginales• Estenosis anal |
En la actualidad el sistema más preciso anatómicamente y más útil clínicamente lo constituye la clasificación de Parks, que utiliza el esfínter anal interno y externo como referencia y considera cinco tipos de fístula: superficial, interesfinteriana, transesfinteriana, supraesfinteriana y extraesfinteriana19 (fig. 1). Sin embargo, esta clasificación no aporta información sobre la complejidad de la fístula (tractos secundarios o presencia de abscesos) o la presencia de proctitis. Habitualmente los cirujanos colorrectales utilizan esta clasificación anatómica. Otra clasificación anatómica de las fístulas es la de St. James's University Hospital20, que se basa en los hallazgos de la RM con contraste; es utilizada por muchos radiólogos, aunque no está validada y su aplicabilidad en la práctica clínica es limitada. No hay ninguna clasificación ideal, pues a las anatómicas les falta el aspecto de la funcionalidad, y viceversa. Por su sencillez y facilidad de uso, la de Parks y la de la AGA son las más ampliamente utilizadas.
Valoración de la gravedadLos índices de actividad clínica de la enfermedad de Crohn (CDAI, Harvey-Bradshaw, Van Hees) no reflejan la gravedad de las lesiones perianales, por lo que se requieren índices específicos, como el índice de actividad de la EPA, el PDAI (tabla 2)17. Este índice ha sido validado en pacientes en tratamiento con metronidazol y comprende cinco categorías: dos relacionadas con la calidad de vida y tres con la gravedad de la EPA, estando cada una de ellas graduada en una escala de 5puntos (0, asintomático; 4, síntomas graves). Una de las principales limitaciones de este índice es que no se ha definido un punto de corte adecuado para poder establecer la respuesta clínica relevante, aunque se ha observado que usando la valoración clínica (supuración activa de la fístula y/o signos de inflamación local) como referencia, un punto de corte del PDAI>4 se asocia a una precisión clínica del 87%.
Una alternativa es el índice de Present, que valora el número de orificios que supuran tanto de forma espontánea como con la presión digital en la región perianal, considerando una respuesta eficaz la reducción en el número de ellos (en el 50% o más) en dos o más visitas consecutivas (respuesta parcial) y el cierre de las fístulas como la ausencia de supuración espontánea o tras la presión digital (respuesta completa)21. Es un índice dependiente del explorador y, aunque está aceptado en el contexto de ensayos clínicos, no está validado. Una de las principales limitaciones de este índice es que puede clasificar a una fístula como cerrada pero persistir el trayecto con actividad en tramos más proximales. Por ello, para establecer el cierre completo de una fístula se requiere una técnica de imagen, en concreto la RM pélvica, y de forma arbitraria se han sugerido 12meses como el tiempo de evaluación9. La combinación de una descripción anatómica de las fístulas con datos que reflejen actividad inflamatoria viene definida en el índice de Van Assche, aunque su correlación con el PDAI es débil11. Un índice clásico, el Anal Disease Activity Index, desarrollado por el grupo de Alexander-Williams y que define la afectación anal mediante una escala analógica de dolor, tiene una aplicabilidad clínica limitada22.
A pesar de las limitaciones descritas con los diferentes índices disponibles, actualmente el PDAI es el validado, y aunque debería ser el utilizado para evaluar la gravedad, su uso en la práctica clínica es limitado. La alternativa de uso del índice de Present es una opción, teniendo presentes las limitaciones referidas. Por ese motivo, la aproximación más adecuada para evaluar la gravedad no debe limitarse al uso de índices clínicos sino que precisa ser completada con alguna técnica de imagen.
Evaluación específica de las fístulasLas fístulas pueden originarse en una fisura penetrante o en una glándula anal infectada, y es frecuente que existan varios orificios fistulosos externos no solo en la región perianal, sino en zonas más alejadas, como los glúteos, los muslos o los genitales. Suponen la segunda manifestación de EPA en orden de frecuencia después de los repliegues cutáneos. Estas fístulas son crónicas e indoloras, salvo que haya pus a tensión, y la mayor parte suelen ser bajas y simples (especialmente en la localización ileal e ileocólica), aunque hay una proporción relativamente alta de fístulas complejas (más frecuente en la EC de colon)23. En estos últimos casos se requiere un estudio del grado de complejidad mediante técnicas de imagen, principalmente por RM o EEA9,18.
Normalmente las fístulas complejas, supurativas o no, tienen más de un orificio fistuloso alejado a más de 3cm del ano, con más de un trayecto, y son relativamente bien toleradas. Siempre que se pueda, sobre todo si se trata de una fístula compleja, se procederá a la colocación de un sedal laxo entre el orificio externo e interno con la finalidad de asegurar un drenaje adecuado, disminuir la probabilidad de absceso y la aparición de nuevos trayectos fistulosos. Si el recto está afectado hay más probabilidad de que las fístulas sean más agresivas y se origine un estado séptico que requiera actuaciones radicales, como la ileostomía derivativa o la proctectomía24. En la práctica clínica se utiliza la clasificación de la AGA en fístulas simples y complejas, aunque simultáneamente también se usa la clasificación de Parks para describir la relación de los esfínteres con el trayecto fistuloso12,24.
Tratamiento médicoSalicilatosLos salicilatos orales no parecen tener ningún efecto sobre la EPA, aunque algunos estudios sugieren que los tratamientos tópicos, en casos concretos, sí pueden mejorarla, probablemente al disminuir la inflamación rectal12,25. Así pues, no son adecuados para el tratamiento directo de la EPA, ni como tratamiento exclusivo de la misma, pero podrían ser de utilidad administrados de forma tópica en determinados pacientes con proctitis.
CorticoidesLos corticoides se han asociado a un empeoramiento de la EPA porque dificultan el cierre de las fístulas, aumentan el débito a través de las mismas, favorecen la aparición de abscesos y, por tanto, aumentan la necesidad de cirugía perianal12,26. Se pueden administrar para la actividad luminal, pero teniendo en cuenta que, previsiblemente, no van a mejorar la EPA y que incluso la pueden empeorar, se aconseja pautarlos el mínimo tiempo imprescindible. Solo hay observaciones clínicas, series de casos, opiniones de expertos y mención en revisiones.
AntibióticosLos antibióticos, sobre todo ciprofloxacino y metronidazol, se utilizan como tratamiento de primera línea de la EPA, conjuntamente (y como puente inicial) con la cirugía y el uso de tiopurinas y de anti-factor de necrosis tumoral (anti-TNF)6. Las fístulas están fundamentalmente colonizadas por gérmenes grampositivos y no hay ningún cambio en la flora bacteriana tras el tratamiento antibiótico, lo que hace pensar que este puede ser eficaz por otros mecanismos o, quizá, que en la EPA de la enfermedad inflamatoria intestinal actúan como bacteriostáticos y no bactericidas27.
Diversos estudios observacionales, con tamaños muestrales pequeños (5-26 pacientes), y dos metaanálisis ponen de manifiesto la utilidad del metronidazol y del ciprofloxacino, solos o en combinación, en el tratamiento de la EPA, incluso con cierre completo de las fístulas a las 6-8semanas de iniciar el tratamiento, aunque la enfermedad recidiva al reducir o suspender el fármaco6,12,28-31. La respuesta inicial a los antimicrobianos es buena, pero los efectos secundarios (intolerancia digestiva con dosis altas de metronidazol o la neuropatía que puede aparecer con dosis bajas pero mantenidas) y la aparición de resistencias, así como la recidiva de la enfermedad al cesar la toma o disminuir la dosis, pueden limitar su uso crónico27.
Se ha establecido su papel como puente hasta que sean efectivos otros tratamientos médicos, como las tiopurinas, o como potenciador de fármacos anti-factor de necrosis tumoral alfa (anti-TNFα). Un estudio abierto y prospectivo realizado a 20semanas en 52pacientes demostró que la combinación de antibióticos y azatioprina es más eficaz que los antibióticos exclusivamente (48% vs 15%, p=0,03), sugiriendo su utilidad como puente hasta que la tiopurina ejerza su efecto32. En otro estudio, también de bajo tamaño muestral (24 pacientes de Crohn con EPA), se observó mayor disminución del PDAI en el grupo tratado con ciprofloxacino e infliximab (IFX) que en el de IFX solo, pero sin obtener diferencias significativas al analizar la respuesta global33. Un estudio multicéntrico, doble ciego y controlado con placebo, que incluía 76 pacientes con EC y EPA, demostró la superioridad del tratamiento combinado de adalimumab (ADA) con ciprofloxacino frente a ADA en monoterapia en el tratamiento de las fístulas perianales. En la semana12 se observó respuesta clínica en el 71% de los tratados con ADA y ciprofloxacino y en el 47% de los que llevaron ADA y placebo (p=0,047). Las tasas de remisión también fueron superiores en el grupo que tomaba antibiótico (65% vs 33% ADA solo, p=0,009)34.
Las evidencias disponibles sugieren que los antibióticos, si es posible, se pautarán siempre al diagnóstico de la EPA o de un nuevo brote, como puente al tratamiento médico inmunomodulador o biológico y a un drenaje quirúrgico, si procede. Solo como tratamiento coadyuvante en las fístulas.
TiopurinasLas tiopurinas, azatioprina y su metabolito mercaptopurina, parecen mejorar los síntomas de la EPA a largo plazo y reducir el número de intervenciones perianales sin asociar cierre completo de fístulas35. En los años ochenta se publicaron varios estudios en los que se mostraba un cierre parcial o completo de las fístulas perianales (31-71%) o rectovaginales (25-50%) a los 3meses de tratamiento con mercaptopurina, a dosis de 1,5mg/kg36-39. En 1995 se publicó un metaanálisis sobre las tiopurinas en la EC y, como hallazgo secundario, se observó una mejoría significativa, parcial o completa, de las fístulas. El 54% de los que habían recibido tiopurinas presentaron mejoría, frente al 21% de los del grupo placebo (odds ratio [OR]:4,44; IC95%: 1,5-13,2)40. Dos metaanálisis posteriores sobre las tiopurinas en el tratamiento de la EC en los que secundariamente se evalúa la eficacia de las tiopurinas en la EPA observan diferencias significativas a favor41,42. Por tanto, hacen falta ensayos clínicos aleatorizados que tengan como objetivo primario determinar si existe mejoría real de la EPA con las tiopurinas. Actualmente, las guías de ECCO y el consenso de Toronto8,23 recomiendan su uso como tratamiento de primera línea de la EPA, conjuntamente con antibióticos, en las fístulas perianales complejas y en las simples con proctitis asociada, aunque la evidencia sea contradictoria y el grado de recomendación sea bajo.
Ciclosporina y tacrolimusUn metaanálisis de la Cochrane de 2005, que incluía 4 ensayos controlados, determinó que la ciclosporina no es eficaz en la EC activa, no estando justificado su uso en la EPA43.
En 2011 se publicó una revisión sistemática sobre el efecto de tacrolimus en la enfermedad inflamatoria intestinal44. En ella se analizaban también los estudios relacionados con la EPA, entre los que destaca el de Sandborn et al.45, por tratarse de un ensayo clínico controlado (aunque de bajo tamaño muestral), el de González Lama et al.46, por sugerir que el tratamiento prolongado obtiene mayor número de cierre de fístulas, y el de Lowry et al.47), que, aunque retrospectivo, tiene en cuenta el uso concomitante de mercaptopurina, con buenos resultados. Las conclusiones de la revisión son que, administrado a largo plazo (6meses), por vía oral, se obtiene una mejoría y una remisión de las fístulas perianales del 43-57% y del 10-29%, respectivamente. En todos los estudios mencionan los efectos secundarios (temblor, parestesias, nefrotoxicidad, etc.), que generalmente ceden reduciendo la dosis de tacrolimus o retirando el fármaco. El tratamiento tópico con tacrolimus puede ser eficaz, como coadyuvante, en el ano de Crohn con úlceras o fisuras, pero no en las fístulas. Por lo tanto, el tacrolimus, por vía oral (0,1-0,3mg/kg/día), podría ser una opción a considerar en casos de fístulas refractarias a tratamiento biológico.
Anti-TNFLos fármacos anti-TNF revolucionaron el tratamiento de la EPA en 1999. Una revisión sistemática y metaanálisis ha puesto de relieve que los anti-TNF son eficaces en el tratamiento de las fístulas27,48. El IFX y el ADA han demostrado su utilidad en la inducción y mantenimiento de la remisión de la EPA48; los datos sobre certolizumab son escasos y no concluyentes48.
En 1999, Present et al.49 publicaron el primer ensayo clínico aleatorizado y controlado con 94 pacientes, con al menos una fístula activa, tratados con IFX a dosis de 5 o 10mg/kg, comparado con un grupo control tratado con placebo. De los tratados con IFX, el 62% presentaron mejoría de la EPA y el 56% lograron cierre de las fístulas en una mediana de tiempo de 2semanas desde el inicio de la respuesta. Posteriormente, el estudio ACCENTII confirmó el cierre de las fístulas con la inducción de IFX (5mg/kg, a las 0, 2 y 6semanas; respuesta inicial del 69%) y demostró que el IFX (5mg/kg cada 8semanas) era superior al placebo en la prevención de la recidiva a los 12meses con cierre fistuloso completo del 36 y del 19% (p=0,009) y respuesta del 46 y del 23% (p=0,01) de los tratados con IFX y placebo, respectivamente. Sin embargo, casi la mitad de los pacientes tratados con IFX experimentaban una recurrencia durante el primer año50,51. El IFX también ha mostrado reducir el número de hospitalizaciones y cirugía52. Todos estos resultados han sido respaldados por estudios basados en la práctica clínica53,54.
El ADA ha demostrado su eficacia en la EPA como objetivo secundario de dos ensayos clínicos aleatorizados6. En 2007 se publicaron los resultados del estudio CHARM, en los que el 30% de los 113pacientes con EPA presentaron cierre de fístulas tras 26semanas de tratamiento, frente al 13% del placebo, manteniendo dicho efecto durante las 56semanas del estudio55. El estudio CHOICE obtuvo resultados similares, con un cierre fistuloso asociado a una mejoría de la calidad de vida en el 39% de los pacientes56. Sin embargo, en el estudio CLASSIC-157 y en el GAIN58 no se encontraron diferencias significativas entre el ADA y el placebo. Un estudio español abierto observó que el 41% de los 22pacientes con fístulas complejas presentaban mejoría con la inducción de ADA (160-80mg) y el 23%, remisión59. En otro estudio español, prospectivo, que incluía 16 pacientes, se analizó la evolución de los pacientes con EPA que iniciaban tratamiento con ADA tras fallo previo a IFX, observando una reducción significativa del drenaje de las fístulas y del PDAI a las 48semanas60. Un estudio retrospectivo y multicéntrico español analizó la efectividad de ADA en el tratamiento de las fístulas perianales (83% complejas) en 46pacientes naïve a tratamiento anti-TNF. La respuesta al tratamiento fue del 72% (54% remisión, 18% respuesta parcial) y 49% (41% remisión, 8% respuesta) a los 6 y 12meses, respectivamente. En los pacientes con fístulas complejas la respuesta fue del 66% a los 6meses y del 39% a los 12meses61. Teniendo en cuenta que la mayoría de los resultados son positivos, las guías lo consideran una buena opción en el tratamiento de la EPA6,23.
Se ha analizado la eficacia del certolizumab en el cierre de las fístulas en los estudios PRECiSE 1 y 2, sin observar diferencias significativas respecto del placebo en la inducción de la remisión62,63. En el análisis de un subgrupo de 58 pacientes, del PRECiSE2 (55de ellos con EPA), respondedores a la inducción con el certolizumab, aleatorizados a placebo vs anti-TNF, en la semana26 se observaba cierre fistuloso en el 36% de los que recibieron certolizumab versus el 17% de los que recibieron placebo (p=0,038), pero esta diferencia desaparecía en el seguimiento64. Una reciente revisión sistemática confirma estos datos48. A la vista de las evidencias disponibles es discutible la recomendación de uso de certolizumab en el tratamiento de la EPA.
Hay datos escasos y controvertidos sobre la eficacia del uso combinado de los inmunosupresores y de anti-TNF para el tratamiento de las fístulas perianales. En el estudio ACCENTII la respuesta al año es similar entre los pacientes con tratamiento combinado y los que reciben monoterapia con IFX51. Sin embargo, otros estudios han observado una asociación positiva entre el tratamiento combinado y el cierre de las fístulas, siendo de especial interés en los pacientes con proctitis asociada y naïve a tratamiento inmunomodulador65. Por tanto, aunque los datos son escasos y de calidad baja, en base a las evidencias disponibles sobre la mayor eficacia de la terapia combinada en la EC luminar66 y que niveles de anti-TNF mayores (impacto de terapia inmunosupresora concomitante sobre la farmacocinética) se han asociado a una mayor probabilidad de cierre de las fístulas, en este escenario clínico se sugiere el uso de la terapia combinada al inicio del tratamiento anti-TNF23.
VedolizumabEl vedolizumab es un anticuerpo monoclonal humanizado contra la integrina α4β7 de administración intravenosa, indicado en la colitis ulcerosa y la EC moderada-grave67,68. Actualmente aún no hay resultados de ningún estudio que haya intentado evaluar directamente la eficacia del vedolizumab en la EPA. El 12% de los pacientes del estudio pivotal GEMINI-2 tenían EPA al inicio del estudio. En una evaluación post-hoc se observó que, en la semana52, los que habían recibido el biológico cada 8semanas (n=17) presentaban cierre de las fístulas en el 41,2% de los casos, frente al 22,7% (n=22) de los que lo recibían cada 4semanas y al 11% del grupo placebo (n=18)69.
Los resultados del US VICTORY Consortium indican que la EPA es uno de los factores que se asocian a menor respuesta con vedolizumab70. Por otro lado, el análisis post-hoc de los 35 pacientes (20,2%) con EPA del estudio OBSERV-IBD puso de manifiesto que el 42,9% a las 14 semanas y un tercio a las 52 estaban en remisión de la EPA tras ser tratados con vedolizumab71. Un estudio multicéntrico, observacional del GETAID que analiza la eficacia de vedolizumab como tratamiento de rescate en 102 pacientes con fístulas perianales complejas en actividad observa remisión clínica en 23/102 (22,5%) y retirada de los sedales en 9/61 (15%) pacientes que los llevaban al inicio del tratamiento72. Hay un ensayo clínico en desarrollo para evaluar la eficacia del vedolizumab en la EPA (NCT02630966).
Por tanto, no hay estudios suficientes para aconsejar el vedolizumab como tratamiento de primera línea en la EPA compleja, aunque los resultados en la práctica clínica sugieren que puede ser útil como tratamiento de rescate en determinados casos.
UstekinumabUstekinumab es un anticuerpo monoclonal frente a la subunidad p40 de las interleucinas 12 y 23, indicado en el tratamiento de la EC activa, de moderada a grave, en pacientes adultos que hayan tenido una respuesta inadecuada, presenten pérdida de respuesta o sean intolerantes al tratamiento convencional o a antagonistas de TNFα, o presenten contraindicaciones médicas a esos tratamientos.
No hay ningún estudio prospectivo que evalúe específicamente la eficacia del ustekinumab en la EPA. Se ha obtenido información indirecta de los ensayos clínicos UNITI-1 y UNITI-2 en los que el 10,8-15,5% de los pacientes tenían fístulas activas al inicio del estudio. El 24,7% de los pacientes con EPA experimentaron un cierre completo de las fístulas en la semana8, frente al 14,1% del grupo placebo (p=0,073)73. En el CERTIFI se observó respuesta en la semana 22 en 9/19 (47%) pacientes con fístulas del grupo de ustekinumab frente a 6/20 (30%) de los pacientes tratados con placebo74. Así mismo, en el IM-UNITI había mejor respuesta en el grupo tratado con ustekinumab en la semana 44 (12/15 pacientes [80%]) frente al placebo (5/11 [45,5%]), pero sin diferencias significativas (p=0,64)75.
De los estudios de práctica clínica hay que destacar un estudio español multicéntrico y retrospectivo con ustekinumab subcutáneo en diferentes pautas y que incluye 116 pacientes con EC que observa que de los 18 pacientes con EPA activa al iniciar el biológico, 11 (61%) mejoran76. El estudio BioLAP, multicéntrico, observacional del GETAID, confirma la eficacia de ustekinumab, como tratamiento de rescate, en inducir la remisión clínica en 56/148 (38%) pacientes con fístulas perianales complejas a los 6meses de tratamiento, facilitando la retirada de los sedales en el 37% de los pacientes que los llevaban al inicio del tratamiento77.
Son necesarios estudios controlados, prospectivos que analicen la eficacia del ustekinumab en la EPA para poder concluir si es útil o no en el tratamiento de primera línea de la misma. Por otra parte, hay que analizar si la pauta aceptada actualmente para la EC (una infusión endovenosa cuya dosis está basada en el peso y, posteriormente, 90mg/sc cada 8-12 semanas) obtiene mejores resultados en la EPA que las pautas previas, que variaban en función de la práctica de cada hospital y que utilizaban como referencia las dosis empleadas en dermatología y en reumatología.
Por tanto, no hay estudios suficientes para aconsejar ustekinumab como tratamiento de primera línea en la EPA. Los estudios de práctica clínica sugieren su uso como opción de rescate en fístulas complejas con fracaso al tratamiento anti-TNF.
Otros tratamientos médicosHay algunas publicaciones de casos o series de casos que muestran mejoría de la EPA con talidomida o metotrexato, entre otros, pero no hay suficiente evidencia como para recomendarlos en la práctica clínica18,68.
Tratamiento quirúrgicoSiempre hay que tener presente que el tratamiento quirúrgico de las fístulas debe asociarse al tratamiento médico de la EPA y de la enfermedad luminal. Ambos tratamientos variarán en función de la complejidad de las fístulas, el curso evolutivo y la actividad del tramo intestinal afectado.
En relación con las diferentes técnicas quirúrgicas aplicables a la EC perianal, apenas hay evidencia científica de cuál es el mejor método. La mayoría de las publicaciones no recogen grandes series, no son prospectivas y el objetivo final puede variar ampliamente de unos autores a otros78,79. Una fístula de origen criptoglandular tiene un tratamiento distinto de la fístula relacionada con la EC. En la primera el objetivo es curar la fístula preservando la continencia, mientras que en la segunda hay que añadir por delante de estos objetivos el mejorar la calidad de vida y evitar la proctectomía, así como la ileostomía. Antes de iniciar un tratamiento local o específico quirúrgico de las fístulas hay que evaluar la extensión y la actividad de la enfermedad luminal, sobre todo si hay afectación rectal. Del mismo modo, antes de realizar cualquier técnica quirúrgica sobre la fístula es requisito indispensable drenar los focos sépticos y colocar sedales, excepto en casos de que la fístula no sea productiva. En caso de que exista proctitis se aconseja localmente ser lo más conservadores posible, pues se han descrito evoluciones muy tórpidas de las heridas que pueden tardar meses en cerrar, o incluso acabar en proctectomía80.
Otros factores que influyen en el manejo quirúrgico definitivo se basan en la gravedad de los síntomas, en la complejidad de la fístula y en el estado de la continencia. Es por estas razones que solo intervendríamos aquellas fístulas que condicionen o alteren la calidad de vida del paciente, preservando la continencia, y siempre después de tener controlada la sepsis local activa. Cualquier fístula que es bien tolerada puede no requerir ninguna intervención quirúrgica, mientras que las que son sintomáticas, pero sin complicaciones asociadas, se tratan mejor médicamente80. Normalmente, cuanto mayor es la complejidad de la fístula, o cuaantas más intervenciones se hayan realizado, peores suelen ser los resultados de la intervención.
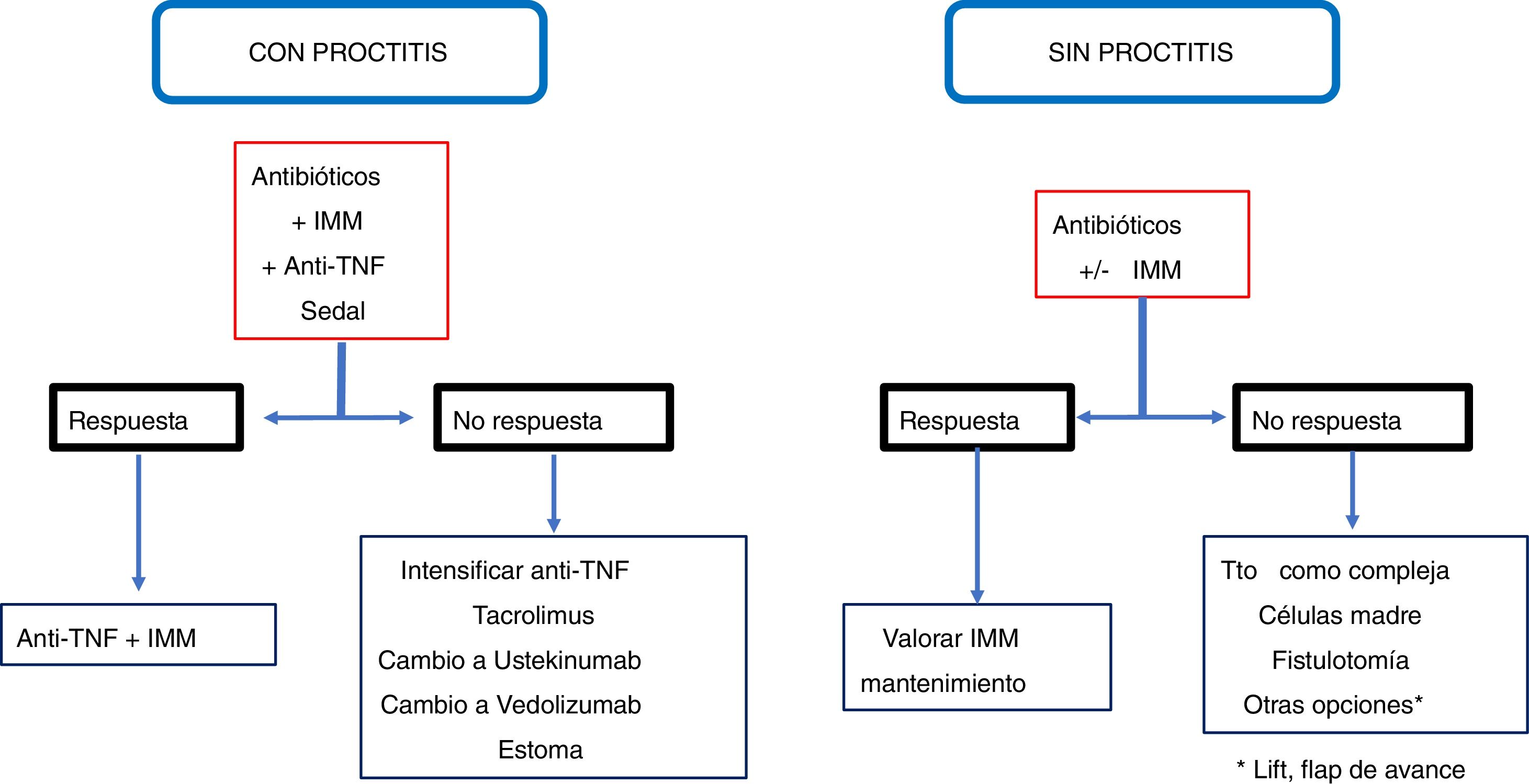
Una norma a tener presente es que siempre hay que evaluar el recto antes de una cirugía de fístula anal, puesto que la existencia de proctitis debe limitar la cirugía agresiva; los sedales laxos son un buen recurso en esos casos y el tratamiento médico es la opción de primera línea.
Fístulas sencillasNo suelen tener proctitis asociada y la fistulotomía es la técnica recomendada, con más del 80% de resultados satisfactorios80. Sin embargo, si se trata de una mujer y la fístula es de localización anterior el riesgo de incontinencia es muy elevado y no se aconseja su realización12. Las cifras de recurrencia son muy variables, aunque en la mayoría de series son inferiores al 20%, y los problemas de incontinencia después de esta cirugía suelen ser leves, oscilando entre el 0 y el 50%12,23,68.
Otras técnicas que pueden utilizarse en las fístulas sencillas, con muy poca frecuencia, son la colocación de sedales laxos, el colgajo de avance rectal o la ligadura interesfinteriana del trayecto fistuloso (LIFT), que se reservan para cuando hay riesgo de incontinencia o proctitis muy limitada12,23,81. Ninguna de estas tres técnicas lesiona el mecanismo esfinteriano. En una revisión sistemática Soltani y Kaiser82 observan que el colgajo de avance en las fístulas de Crohn tiene una curación en el 64% de casos y asocia un 9,4% de incontinencia, aunque la calidad de los artículos analizados no es suficiente para conseguir un alto nivel de evidencia. Respecto a la técnica LIFT, no existe suficiente experiencia en la EC para poder pronunciarse sobre los resultados81. Por tanto, la técnica quirúrgica más aconsejable ante una fístula simple es la fistulotomía si no hay proctitis, y el sedal laxo si esta última está presente.
Fístulas complejasEn estos casos la fistulotomía y los sedales cortantes están contraindicados por el elevado riesgo de incontinencia. Si no existe proctitis asociada ni estenosis anal o anorrectal, el colgajo de avance mucoso puede ser una buena opción, aunque las cifras de éxito oscilan entre el 25 y el 75%, y la incontinencia aparece en el 10% de los casos82,83. Esta técnica quirúrgica es la que más ampliamente se ha evaluado para el tratamiento de las fístulas de la EPA.
Recientemente se ha utilizado un nuevo procedimiento o técnica de tratamiento video-asistido de la fístula (VAAFT), que no daña el mecanismo esfinteriano y que se puede utilizar sola o en combinación con el colgajo. Aunque la experiencia es limitada y los resultados parecen ser buenos, con un 81% de cierre de fístulas84, su futuro está por determinar.
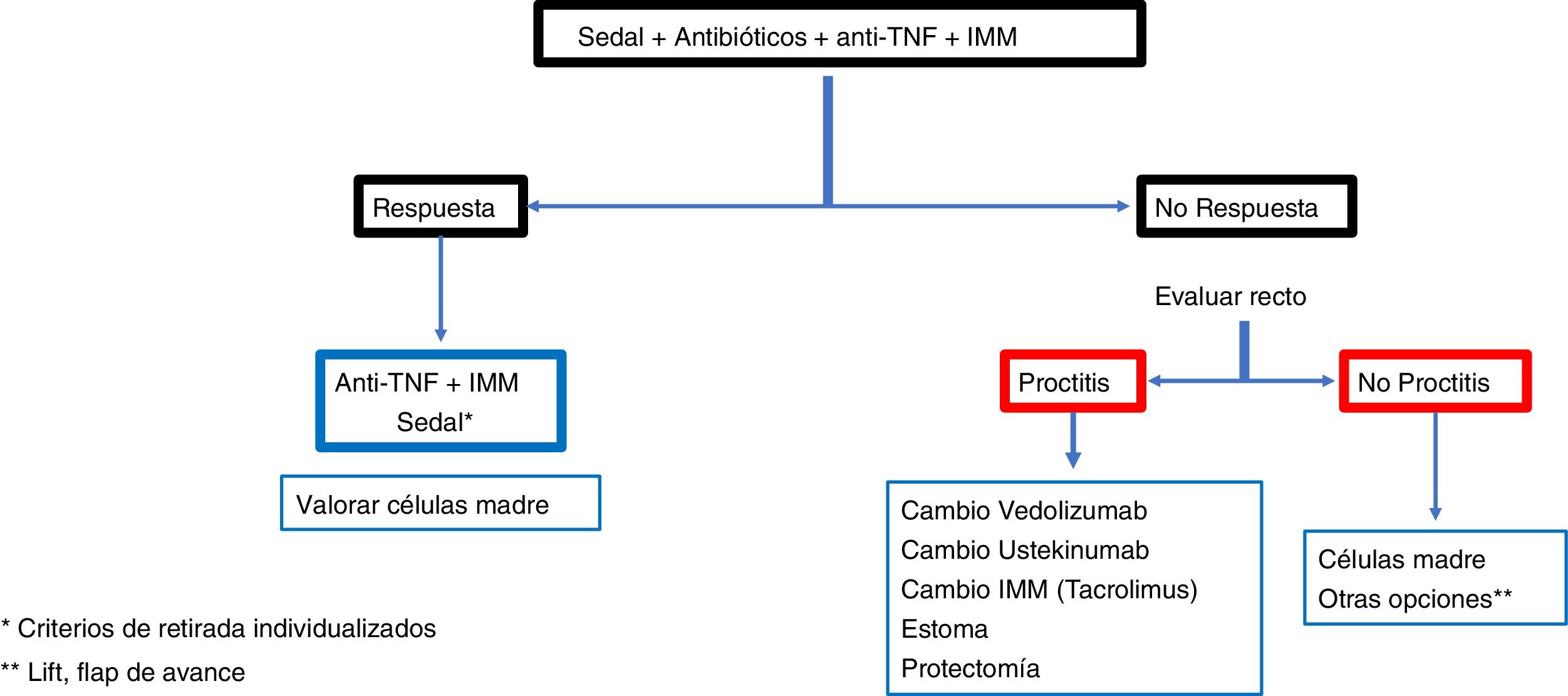
En una fístula compleja, incluso sin proctitis, la mayoría de autores prefieren los sedales anudados laxamente para que actúen de drenaje junto con el tratamiento farmacológico80,85. No obstante, lo habitual en estas fístulas es que exista afectación rectal, en cuyo caso el tratamiento de elección es el sedal de drenaje. En estos pacientes no debería realizarse nunca la fistulotomía o el colgajo de avance rectal, porque las cifras de incontinencia (40%), heridas no cicatrizadas (60%) y proctectomías (60%) son muy altas82.
En los casos de sepsis perianal grave con fístulas complejas los sedales de drenaje se colocan para evitar heridas perineales grandes, prevenir la extensión de los abscesos o fístulas y disminuir el dolor86. Además, con ello se preserva la función esfinteriana y se mantiene la continencia anal. Las diferentes series demuestran mejoría en el 90% de los pacientes evitando o retrasando la proctectomía o la diversión fecal85,86. Una buena opción para considerar es la combinación de terapias biológicas, como el anti-TNF, junto a la aplicación de sedales laxos, puesto que los resultados de curación o cierre de las fístulas es mucho mejor si se combinan ambos procedimientos12,78,79.
Existe controversia acerca de cuánto tiempo debe permanecer el sedal, pues una vez retirado existe un alto índice de recurrencias80,87. Algunos piensan que debe mantenerse indefinidamente, aunque otros opinan que debe utilizarse como primer paso para una cirugía posterior definitiva. Desde un punto de vista práctico, el «atrapamiento» del sedal sugiere la necesidad de retirada.
En una una fístula compleja, si no hay proctitis asociada el colgajo de avance es el procedimiento más adecuado, mientras que si hay proctitis se recomienda la colocación de sedal laxo.
Fístulas anovaginales o rectovaginalesAparecen en el 9% de las pacientes. La mayoría son anovaginales y no requieren tratamiento si son muy bajas u ocasionan pocos síntomas. Las rectovaginales están asociadas con ulceraciones profundas o proctitis y su aparición es un factor pronóstico desfavorable. Si hay afectación rectal lo mejor es la colocación de un sedal o considerar un estoma derivativo que finalmente puede acabar no cerrándose o practicando una proctectomía88. Si el recto está sano o mínimamente afectado, existe buena función esfinteriana y no hay EPA activa, se puede proceder a su reparación mediante colgajo endorrectal, vaginal o cutáneo, obteniéndose cifras de curación entre el 30 y el 70%89. Sin embargo, la experiencia es escasa y la evidencia prácticamente ausente. En caso de fístulas recidivadas puede considerarse una interposición muscular (gracilis, bulbocavernoso o esfinteroplastia)90. Por tanto, en una fístula rectovaginal, al igual que en otros tipos de fístulas, no hay reglas absolutas ni una técnica estandarizada idónea. La proctitis, la altura de la fístula y la sintomatología van a influir en la decisión, pudiendo utilizar un colgajo de avance mucoso en ausencia de proctitis hasta el sedal o derivación con estoma en presencia de actividad rectal.
La indicación de un estoma derivativo en las fístulas anales se reserva para casos agresivos difíciles de manejar con métodos conservadores. Debe considerarse ante una sepsis perianal grave no controlable médicamente ni con drenaje de los focos sépticos, en casos de ulceraciones profundas recurrentes y en fístulas complejas o rectovaginales que alteren seriamente la calidad de vida, cuando no hay respuesta al tratamiento medicoquirúrgico estándar88.
Otros procedimientos quirúrgicosSe han descrito un gran número de ellos, pero ninguno tiene la suficiente evidencia como para hacer fuertes recomendaciones. La bibliografía y la experiencia son escasas y hacen falta más estudios para confirmar su verdadera utilidad23,68,81. Entre otros, se han utilizado los adhesivos tisulares o sellantes de fibrina, la colocación de un tapón de colágeno porcino y la inyección de grasa autóloga fragmentada alrededor del trayecto fistuloso, obteniéndose resultados muy variables.
En el caso de los sellantes de fibrina es donde más experiencia existe, y las cifras de curación definitiva oscilan entre el 17 y el 57% de los casos; con el tapón de colágeno las cifras varían entre el 25 y el 80%, y con la grasa autóloga los resultados parecen esperanzadores, con el 80% de buenos resultados, pero la experiencia es mínima91,92. Aunque apenas hay evidencia para estos procedimientos, dada su inocuidad y puesto que no perturban el mecanismo esfinteriano, pueden ser utilizados en algunos casos específicos. De modo anecdótico, se ha utilizado en enfermos de Crohn la ablación del trayecto fistuloso con láser, obteniendo curaciones cercanas al 70% tras una primera intervención y superiores al 90% si se volvían a intervenir los pacientes en los que recurría la fístula93. Sin embargo, a estos pacientes se les asociaba un colgajo de avance mucoso, por lo que no se puede conocer bien si el cierre era favorecido por el láser o por el propio colgajo.
Anti-TNF localHay siete series de casos publicadas, con tamaños muestrales bajos (de 9 a 33 pacientes), en las que se comunican los resultados con la inyección local de INX (entre 15-25mg cada 4semanas)94-97 o ADA (20 o 40mg cada 2semanas)98-104 y se refiere el cierre de fístulas en el 31-75% de los casos, con la ventaja de que las inyecciones pueden repetirse. Son necesarios más estudios para poder recomendar su uso en el tratamiento habitual de la EPA.
Células madreLa administración de células madre mesenquimales (CMM) autólogas o heterólogas en las fístulas perianales de la EC es una terapia que ha estado desarrollándose desde principios de los años 2000. Las CMM poseen capacidad inmunomoduladora, suprimiendo la activación y la proliferación de las célulasT, la diferenciación dendrítica celular y la proliferación de las células natural Killer81. Estas propiedades podrían ser muy relevantes en la EC fistulizante, debido a que en la patogenia de las fístulas hay activación de células dendríticas y linfocitos, así como proliferación de las células natural killer101. A principios de los años 2000 se publicaron los primeros estudios con células madre obtenidas de médula ósea y de tejido adiposo en las fístulas perianales de la EC, obteniendo resultados muy prometedores102-104.
El primer ensayo clínico aleatorizado y controlado con placebo se publicó en el año 2016105. Comparaba la eficacia de una inyección simple de 120millones de CMM alogénicas derivadas de tejido adiposo, frente a placebo, en 107 y 105 pacientes, respectivamente. El tratamiento fue un éxito en el 51,5% de los pacientes tratados con CMM, frente al 35,6% en el grupo placebo. El beneficio del tratamiento se mantuvo en la semana 52 en el 56,3% de pacientes del grupo de CMM, frente al 38,6% de los pacientes en el grupo placebo106. El darvadstrocel (Cx601) es una terapia celular que se presenta como una suspensión de células madre expandidas alogénicas humanas adultas de origen mesenquimal extraídas de tejido adiposo que en marzo del 2018 obtuvo la autorización de comercialización.
El uso de terapias celulares en las fístulas perianales de la EC se perfila como un tratamiento atractivo y muy prometedor. En principio está aprobada su indicación para el tratamiento de las fístulas perianales complejas en pacientes adultos con EC luminal inactiva o leve (especial referencia a la proctitis) cuando las fístulas han presentado una respuesta inadecuada a un tratamiento convencional (sedal, antibiótico, azatioprina) o biológico de primera línea (anti-TNF).
Oxígeno hiperbáricoSe ha utilizado en el tratamiento de la EC, asumiendo que existe una alteración en la oxigenación tisular que facilita la proliferación de anaerobios. La elevación de la presión parcial del O2 durante un periodo de tiempo de 90min en cámara hiperbárica (2,5atmósferas absolutas) ha demostrado su eficacia en la inducción de la remisión en 10pacientes con fístulas perianales (50% remisión completa; 20% remisión parcial; 20 a 40 sesiones)107. Aunque el O2 hiperbárico puede ser útil como última opción en pacientes con EC perianal crónica refractaria a otros tratamientos o como complemento de la cirugía, deben realizarse estudios controlados antes de recomendar esta opción de tratamiento en el manejo de la EPA108.
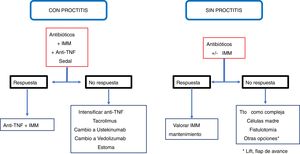
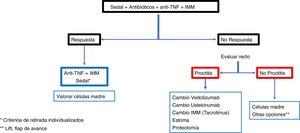
ConclusiónLas recomendaciones son consejos dados por considerarse beneficiosos y no dejan de ser sugerencias, abiertas por tanto a diferentes interpretaciones. En ese sentido, el objetivo final de la revisión ha sido, con las evidencias disponibles, intentar homogeneizar al máximo la aproximación al diagnóstico y al tratamiento medicoquirúrgico de una de las manifestaciones más complejas de la enfermedad de Crohn como son las fístulas perianales. En las figuras 2 y 3 se resume la aproximación al manejo de las fístulas simples y complejas basándose en las conclusiones derivadas de esta revisión.
Conflicto de interesesJavier Gisbert ha realizado asesoramiento científico, soporte para investigación y/o actividades formativas para MSD, Abbvie, Hospira, Pfizer, Kern Pharma, Biogen, Takeda, Janssen, Roche, Sandoz, Celgene, Ferring, Faes Farma, Shire Pharmaceuticals, Dr. Falk Pharma, Tillotts Pharma, Chiesi, Casen Fleet, Gebro Pharma, Otsuka Pharmaceutical, Vifor Pharma, Almirall, Nycomed, AstraZeneca, Casen Recordati, Mayoly, Allergan.
Joaquín Hinojosa ha realizado asesoramiento científico, soporte para investigación y/o actividades formativas para MSD, Abbvie, Ferring, Faes Farma, Shire Pharmaceuticals, Chiesi, Otsuka Pharmaceutical, Pfizer-Hospira, Kern Pharma, UCB Pharma, Vifor Pharma, Sandoz, Biogen, Janssen, Takeda, Celgene y Dr. Falk Pharma.
Marta Maia Boscá declara haber participado en actividades educativas, reuniones científicas y comités financiados por MSD, Ferring, Abbvie, Janssen y Takeda.
Nuria Maroto declara haber participado en actividades educativas, reuniones científicas y comités financiados por MSD, Ferring, Abbvie, Janssen y Takeda.
Pilar Nos ha realizado asesoramiento científico, soporte para investigación y/o actividades formativas para MSD, Abbvie, Ferring, Faes Farma, Otsuka Pharmaceutical, Pfizer,Janssen, Takeda y Dr. Falk Pharma.
Beltrán Belén ha realizado asesoramiento científico, soporte para investigación y/o actividades formativas para AbbVie, Otsuka, Pfizer,
Takeda, and MSD
Miguel Mínguez ha realizado asesoramiento científico, soporte para investigación y/o actividades formativas Takeda, Abbvie y MSD.
Los demás autores declaran no tener ningún conflicto de intereses.