La compleja fisiología de la función tiroidea durante el embarazo requiere la evaluación hormonal según valores de referencia para cada trimestre, cada zona y con las técnicas de cada laboratorio. Los objetivos de este estudio fueron analizar la función tiroidea en los tres trimestres de gestación y establecer los valores de referencia de las hormonas en las mujeres gestantes de nuestra área sanitaria (Lugo).
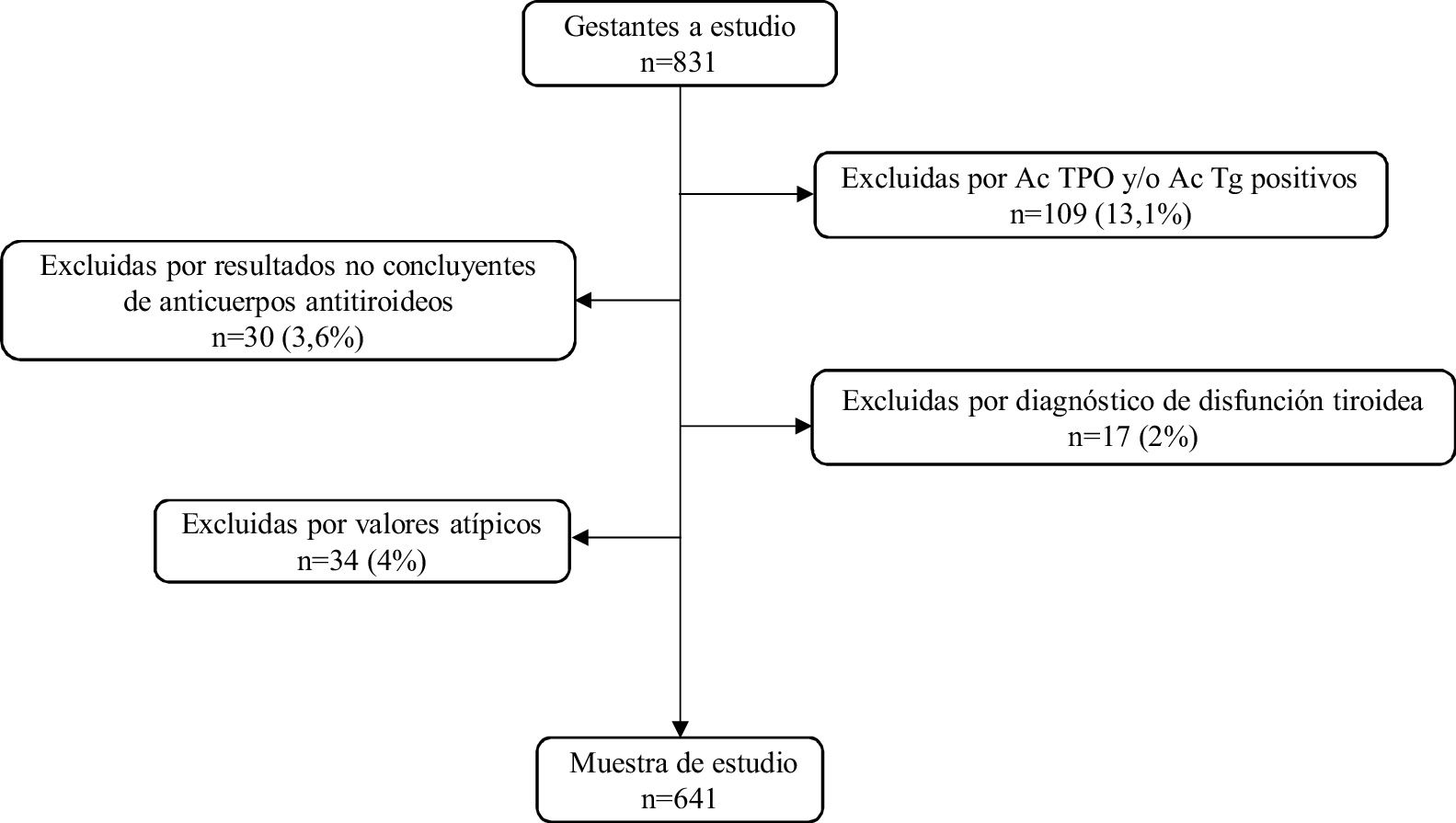
MétodosUn total de 831 gestantes fueron incluidas en el estudio (mediana de edad: 33años; rango: 16-47años). Una vez aplicados los criterios de exclusión, nuestra muestra estuvo compuesta por 641 gestantes, tamaño que puede considerarse representativo de la población de referencia.
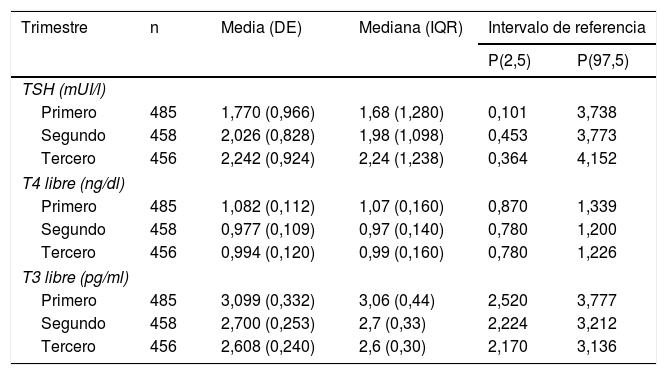
ResultadosLos intervalos de referencia fueron los siguientes: TSH primer trimestre, 0,10-3,74mUI/l; segundo trimestre, 0,45-3,77mUI/l; y tercer trimestre, 0,36-4,15mUI/l. Para T4L en el primer trimestre, 0,87-1,34ng/dl; segundo trimestre, 0,78-1,20ng/dl; y tercer trimestre, 0,78-1,23ng/dl. Para la T3L en el primer trimestre, 2,52-3,78pg/ml; segundo trimestre, 2,22-3,21pg/ml; y tercer trimestre, 2,17-3,14pg/ml. Se confirmó presencia de autoinmunidad tiroidea en 109 mujeres (13,1%), que presentaron valores de TSH superiores a las gestantes sin autoinmunidad tiroidea.
ConclusiónLos intervalos de referencia para la TSH, T4L y T3L obtenidos en este trabajo están por debajo de los utilizados en la población adulta no gestante en nuestro laboratorio, por lo que permitirán identificar de manera más precisa una posible disfunción tiroidea en las gestantes de nuestra área evitando un infradiagnóstico de hipotiroidismo subclínico y reduciendo las posibles complicaciones perinatales asociadas.
The complex physiology of thyroid function during pregnancy requires a hormonal evaluation according to reference values for each trimester, each area, and with the techniques of each laboratory. The objectives of this study were to analyse thyroid function in the three trimesters of pregnancy and to establish the reference values of hormones in pregnant women in this health area (Lugo).
MethodsA total of 831 pregnant women were included in the study (median age: 33years, age range: 16-47years). Once the exclusion criteria were applied, the sample consisted of 641 pregnant women, a size that can be considered representative of the reference population.
ResultsThe reference intervals were as follows: TSH first trimester, 0.10-3.74mIU/L; second trimester, 0.45-3.77mIU/L; and third trimester, 0.36-4.15mIU/L. For Free T4 in the first trimester, 0.87-1.34ng/dL; second trimester, 0.78-1.20ng/dL; and third trimester, 0.78-1.23ng/dL. For Free T3 in the first trimester, 2.52-3.78pg/mL; second trimester, 2.22-3.21pg/mL; and third trimester, 2.17-3.14pg/mL. The presence of thyroid autoimmunity was confirmed in 109 women (13.1%), who presented with higher TSH values than pregnant women without thyroid autoimmunity.
ConclusionThe reference intervals for TSH, Free T4, and Free T3 obtained in this study are below those used in the non-pregnant adult population in this laboratory. This should help to identify more accurately a possible thyroid dysfunction in pregnant women in the study area, avoiding an underdiagnosis of subclinical hypothyroidism and reducing the possible associated perinatal complications.
Un funcionamiento correcto de la glándula tiroidea es esencial en todas las etapas de la vida, especialmente en la gestación y durante el desarrollo fetal. El embarazo supone una demanda extraordinaria para el tiroides, y el embarazo normal implica cambios complejos en la fisiología tiroidea, produciendo que durante la gestación aumente el riesgo de disfunción tiroidea1 asociada a una mayor morbilidad materna y morbimortalidad perinatal2. Durante el embarazo se asocia especialmente a abortos3–5, partos prematuros4–6, aumento de pérdida fetal7, anemia y hemorragia posparto8. En el recién nacido está asociado con inadecuado desarrollo neurofisiológico y peso bajo, que inclusive podría producir una reducción de 7puntos sobre el coeficiente intelectual de niños entre 7 y 9años9. Además, en gestantes eutiroideas la presencia de anticuerpos antitiroideos aumenta el riesgo de hipotiroidismo10, también de prematuridad, aborto y desarrollo de tiroiditis posparto11,12. Todos estos motivos acreditan la importancia de los programas tanto de cribado como de control de la función tiroidea durante la gestación.
Diversas sociedades científicas, como la American Thyroid Association (ATA) y The Endocrine Society, han publicado guías para el diagnóstico y manejo de la disfunción tiroidea en el embarazo13,14. Asimismo, la Sociedad Española de Endocrinología y Nutrición recomienda el cribado universal de la función tiroidea durante el periodo pregestacional o el primer trimestre15.
El diagnóstico de la disfunción tiroidea se fundamenta en la medida de los parámetros hormonales de laboratorio. No obstante, la interpretación de los biomarcadores de función tiroidea es distinta en mujeres gestantes, ya que durante el embarazo surgen un conjunto de cambios no solo en las concentraciones de hormonas tiroideas, sino también en proteínas transportadoras, tiroglobulina y gonadotropina coriónica humana debido a la elevación de estrógenos, que dan lugar a diferentes resultados analíticos de las mujeres no gestantes, lo cual puede llevar a una interpretación errónea de los resultados en la práctica clínica16. Por todo ello, es conveniente que las hormonas tiroideas sean evaluadas frente a los valores de referencia de cada trimestre y cada zona, utilizando técnicas de laboratorio propias13–16.
El objetivo de este estudio fue establecer los valores de referencia para las hormonas tiroideas tirotropina (TSH), tiroxina libre (T4L) y triyodotironina libre (T3L) en los tres trimestres de gestación con la metodología empleada en nuestro laboratorio y conocer la prevalencia de enfermedad tiroidea autoinmunitaria en las mujeres gestantes de nuestra área de salud.
Material y métodosMaterialSe trata de un estudio prospectivo a partir de 831 mujeres gestantes pertenecientes al área sanitaria del Hospital Universitario Lucus Augusti de Lugo en el periodo comprendido entre enero de 2017 y enero de 2018. Se definieron los trimestres de gestación por semanas: el primer trimestre (T1) entre las semanas 01 y 13+6, el segundo trimestre (T2) entre las semanas 14 y 27+6, el tercer trimestre (T3) entre las semanas 28 y 42.
Todas las mujeres gestantes del área sanitaria realizan analíticas trimestrales de control del embarazo con perfiles de pruebas específicos para cada trimestre. Cada perfil contiene una prueba «guía» que nos permite identificar en qué trimestre se encuentra la gestante (T1, T2 o T3). Para el presente trabajo, a las peticiones identificadas por trimestres se añadieron pruebas de cada analito a estudio definidas en el Sistema Informático del Laboratorio (SIL) como TSH estudio, T4L estudio, T3L estudio, AcTPO (anticuerpos antiperoxidasa) estudio y AcTg (anticuerpos antitiroglobulina) estudio. Sobre los perfiles solicitados habitualmente en la gestación se añadieron las pruebas generadas para el estudio, siempre que estos perfiles no las contuvieran.
Los criterios de exclusión utilizados al seleccionar las gestantes para establecer los intervalos fueron los siguientes:
- •
Autoinmunidad tiroidea definida por AcTPO y/o AcTg positivos.
- •
Diagnóstico de hipotiroidismo o hipertiroidismo en la petición.
- •
Pacientes con diabetes mellitus.
- •
Gestantes con hormonas tiroideas o anticuerpos tiroideos solicitados previamente por enfermedad tiroidea previa.
Las determinaciones de TSH, T4L, T3L, AcTPO y AcTg se realizaron en los autoanalizadores ADVIA Centaur XP® y ADVIA Centaur XPT® (Siemens Healthcare Diagnostics, Erlangen, Alemania). Para la determinación de TSH se utilizó un inmunoensayo en sándwich de dos puntos que utiliza la tecnología quimioluminométrica y cantidades constantes de anticuerpos, con un rango de ensayo de 0,010 a 150mUI/l y con los siguientes coeficientes de variación interensayo (CVi) para 3 niveles: nivel 1=0,74mUI/l, CVi=2,5%; nivel 2=5,65mUI/l, CVi=2,4%; nivel 3=18,98mUI/l, CVi=2,4%. La determinación de T4L se realizó mediante un inmunoensayo competitivo que utiliza tecnología de quimioluminiscencia directa, con un rango de ensayo de 0,1 a 12ng/dl y CVi para 3 niveles: nivel 1=0,72ng/dl, CVi=3,3%; nivel 2=1,47ng/dl, CVi=2,2%; nivel 3=3,01ng/dl, CVi=2,5%. La determinación de T3L se realizó mediante un inmunoensayo competitivo que utiliza tecnología de quimioluminiscencia directa, con un rango de ensayo de 0,2 a 20pg/ml y CVi para 3 niveles: nivel 1=1,9pg/ml, CVi=3,1%; nivel 2=4,3pg/ml, CVi=2,4%; nivel 3=9,2=pg/ml, CVi=2,5%. La determinación de AcTPO y AcTg se realizó mediante un inmunoensayo competitivo que utiliza tecnología de quimioluminiscencia directa, con un rango de ensayo de 15 a 500UI/ml para AcTg y de 28 a 1.300UI/ml para AcTPO. Para la identificación de los resultados positivos se utilizó el punto de corte establecido por el fabricante (>60UI/ml).
Análisis estadísticoPara el análisis de los datos se utilizó el programa estadístico R v. 3.4.3. Para comprobar la normalidad de la distribución de TSH, T4L y T3L se empleó el test de Kolmogorov-Smirnov, ya que nuestro tamaño muestral es superior a 50. Para detectar las posibles diferencias en los valores de las hormonas tiroideas según el trimestre de gestación se empleó el test no paramétrico de Kruskal-Wallis ya que las variables no presentan una distribución normal. Estas variables se expresan como mediana (amplitud intercuartílica). Se consideró siempre p<0,05 para todos los test de significación. Se definió el intervalo de referencia para cada una de las hormonas tiroideas y el intervalo comprendido entre los percentiles 2,5-97,516–20.
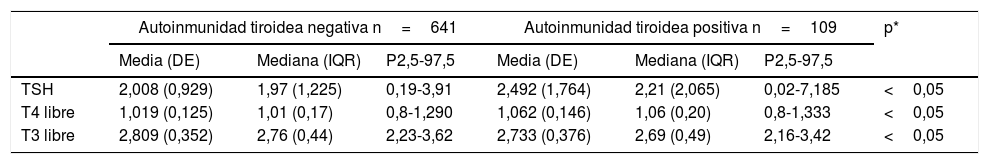
ResultadosDe las 831 gestantes incluidas en el estudio (edad mediana: 33años; rango: 16-47años) se confirmó presencia de autoinmunidad tiroidea, definida por AcTPO y/o AcTg positivos, en 109 mujeres (el 13,1%; edad media de 33,6años; límites: 16-46años): 42 mujeres fueron positivas para AcTPO y AcTg, 36 para AcTPO y 13 para AcTg; las 18 mujeres restantes presentaron uno de los anticuerpos negativos en alguno de los trimestres: en 13 mujeres el AcTg, en 4 el AcTPO y en un caso fueron negativos ambos anticuerpos pero en trimestres distintos. Los resultados de las hormonas de función tiroidea en gestantes con y sin autoinmunidad tiroidea se hallan recogidos en la tabla 1.
Resultados de las hormonas tiroideas en gestantes con y sin autoinmunidad tiroidea
| Autoinmunidad tiroidea negativa n=641 | Autoinmunidad tiroidea positiva n=109 | p* | |||||
|---|---|---|---|---|---|---|---|
| Media (DE) | Mediana (IQR) | P2,5-97,5 | Media (DE) | Mediana (IQR) | P2,5-97,5 | ||
| TSH | 2,008 (0,929) | 1,97 (1,225) | 0,19-3,91 | 2,492 (1,764) | 2,21 (2,065) | 0,02-7,185 | <0,05 |
| T4 libre | 1,019 (0,125) | 1,01 (0,17) | 0,8-1,290 | 1,062 (0,146) | 1,06 (0,20) | 0,8-1,333 | <0,05 |
| T3 libre | 2,809 (0,352) | 2,76 (0,44) | 2,23-3,62 | 2,733 (0,376) | 2,69 (0,49) | 2,16-3,42 | <0,05 |
*p: significación estadística obtenida por el test no paramétrico de Wilcoxon-Mann-Whitney.
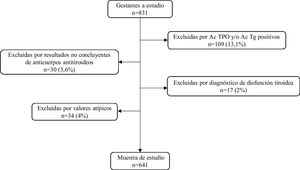
Para la obtención de los intervalos de referencia se estudiaron 641 gestantes (mediana de edad: 33años; límites: 16-47años) una vez excluidas 190 aplicando los criterios especificados en el diagrama de flujo de la figura 1.
Las medidas de centralización y dispersión de la muestra (media, mediana) así como los intervalos de referencia (percentiles 2,5 y 97,5) se recogen en la tabla 2.
Medidas de dispersión y centralización e intervalos de referencia de las hormonas tiroideas
| Trimestre | n | Media (DE) | Mediana (IQR) | Intervalo de referencia | |
|---|---|---|---|---|---|
| P(2,5) | P(97,5) | ||||
| TSH (mUI/l) | |||||
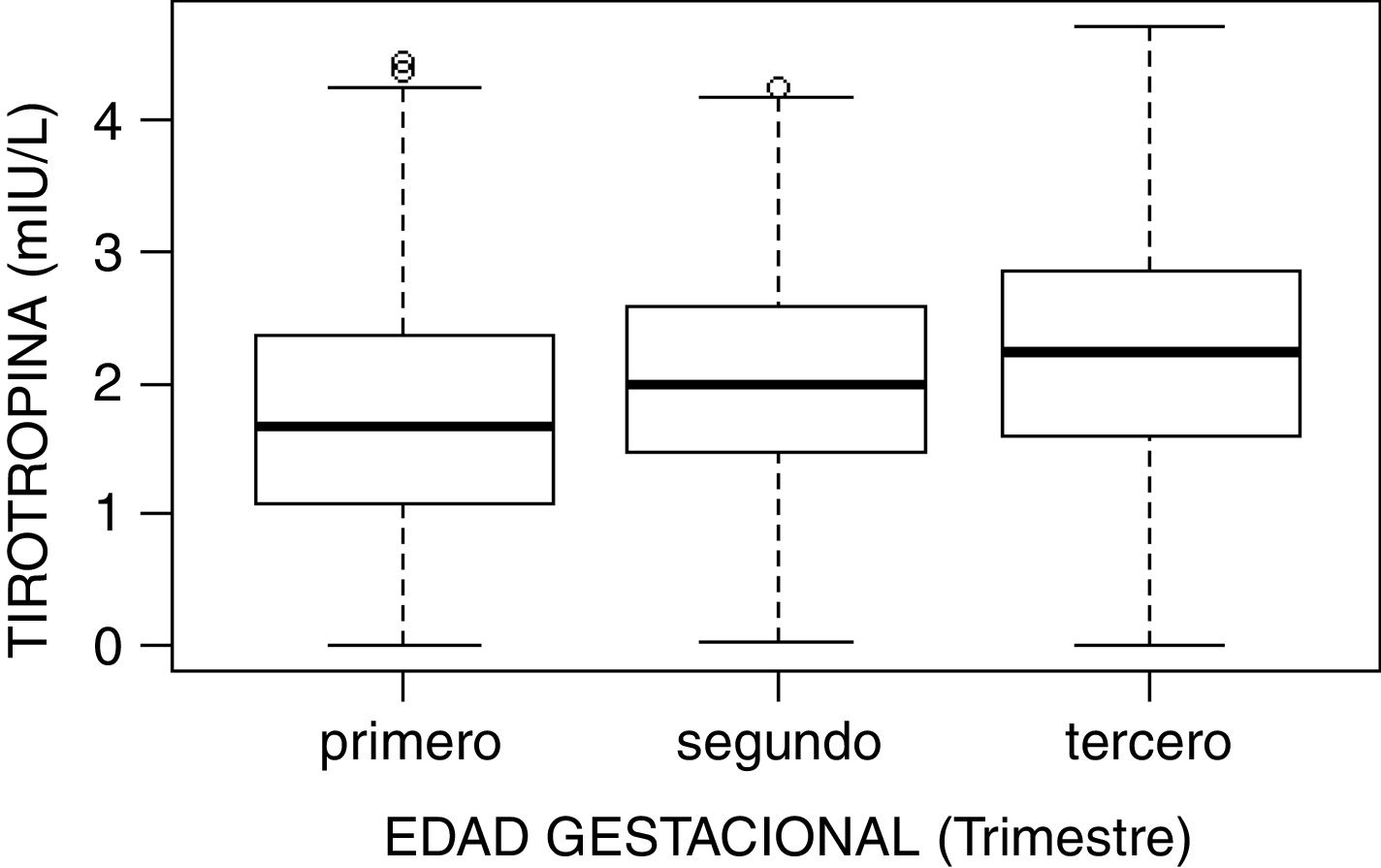
| Primero | 485 | 1,770 (0,966) | 1,68 (1,280) | 0,101 | 3,738 |
| Segundo | 458 | 2,026 (0,828) | 1,98 (1,098) | 0,453 | 3,773 |
| Tercero | 456 | 2,242 (0,924) | 2,24 (1,238) | 0,364 | 4,152 |
| T4 libre (ng/dl) | |||||
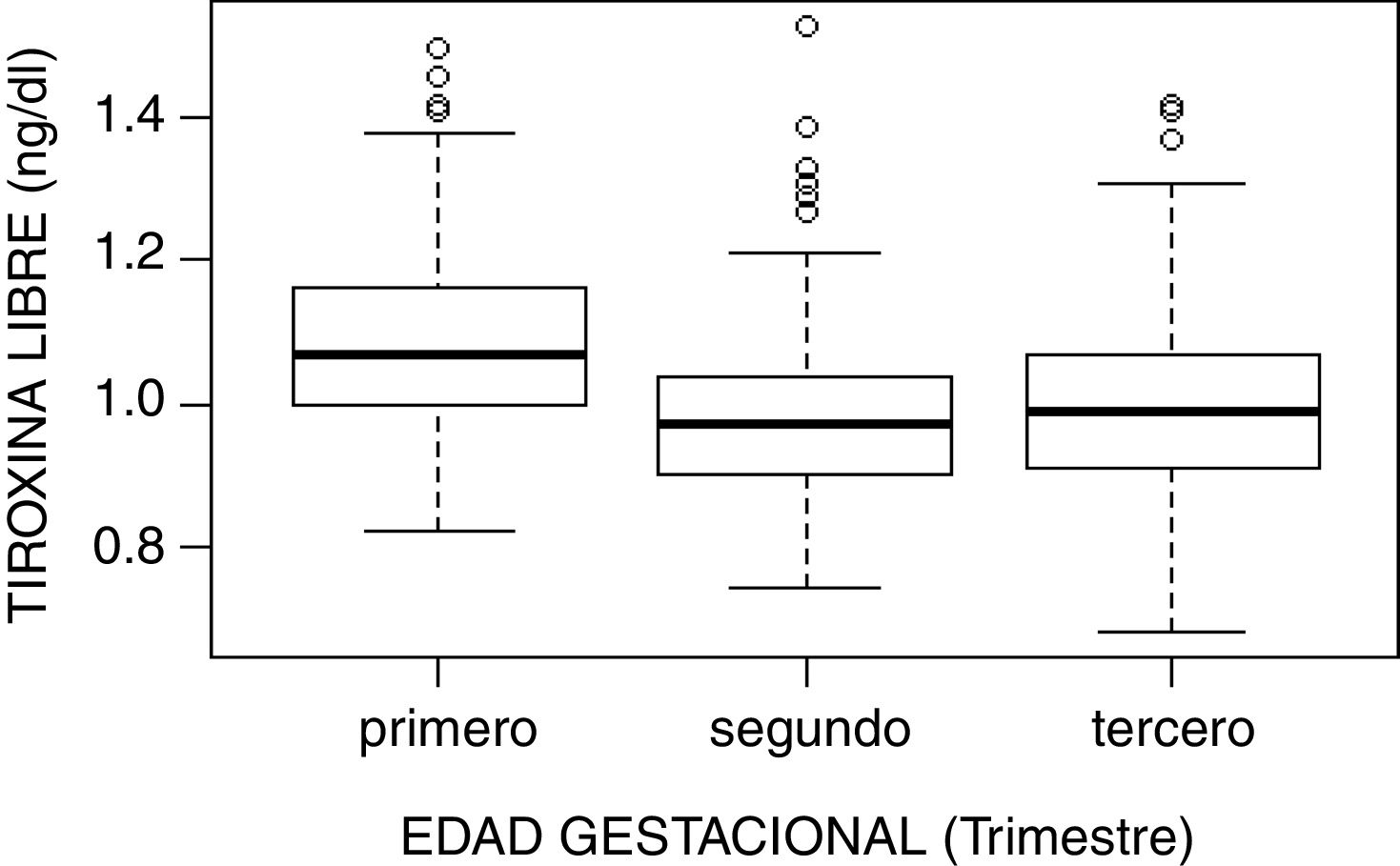
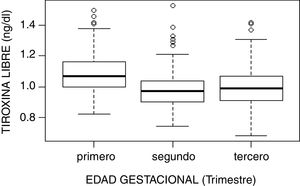
| Primero | 485 | 1,082 (0,112) | 1,07 (0,160) | 0,870 | 1,339 |
| Segundo | 458 | 0,977 (0,109) | 0,97 (0,140) | 0,780 | 1,200 |
| Tercero | 456 | 0,994 (0,120) | 0,99 (0,160) | 0,780 | 1,226 |
| T3 libre (pg/ml) | |||||
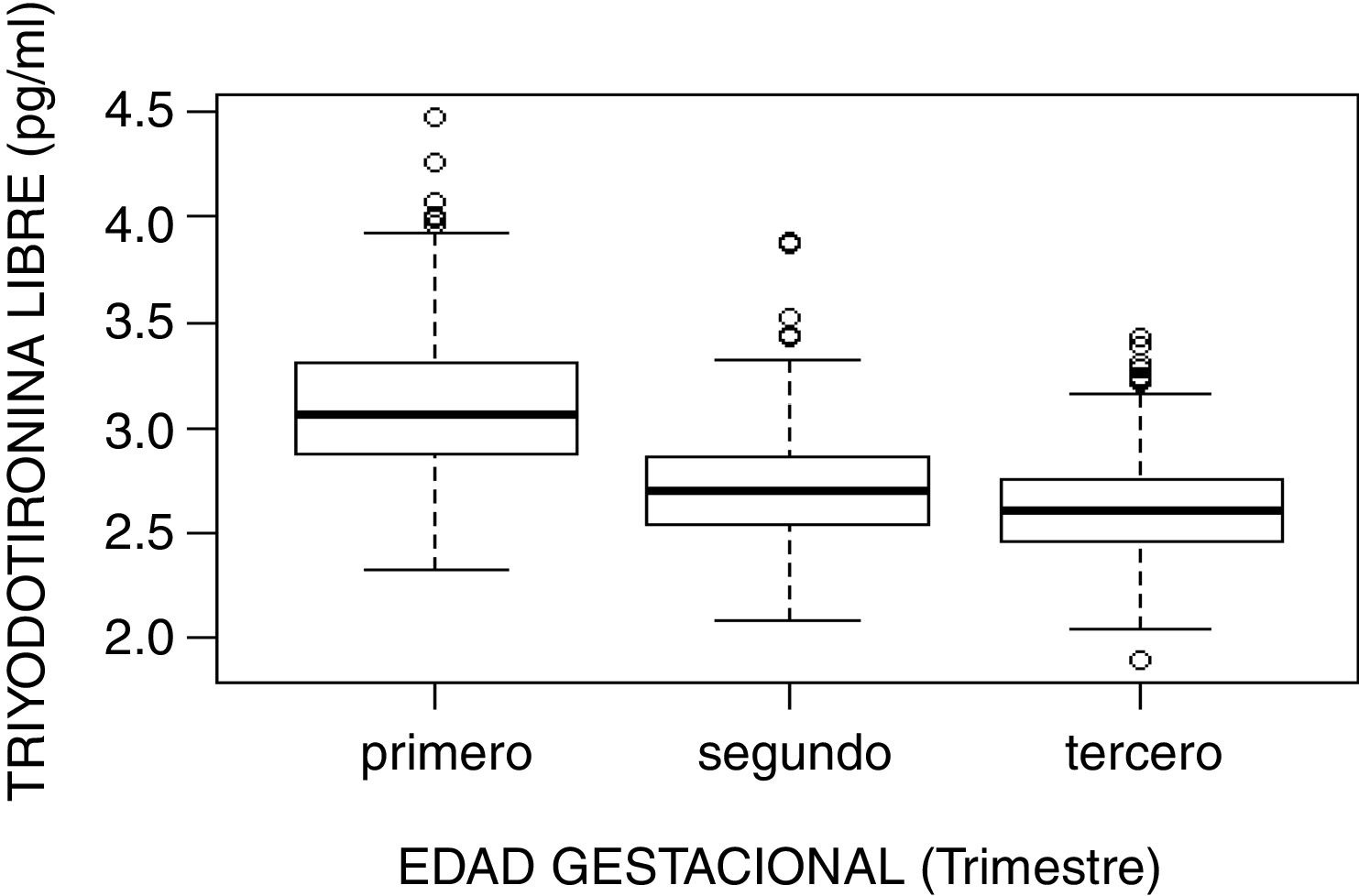
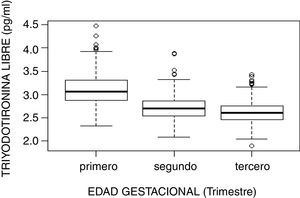
| Primero | 485 | 3,099 (0,332) | 3,06 (0,44) | 2,520 | 3,777 |
| Segundo | 458 | 2,700 (0,253) | 2,7 (0,33) | 2,224 | 3,212 |
| Tercero | 456 | 2,608 (0,240) | 2,6 (0,30) | 2,170 | 3,136 |
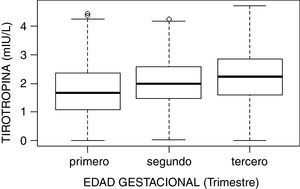
El estudio de comparación de medianas (Kruskal-Wallis) mostró diferencias significativas en las hormonas tiroideas (TSH, T4L, T3L) atendiendo al trimestre gestacional (p<0,05). En el caso de la TSH se observó un aumento de su concentración al avanzar la edad gestacional con medianas de 1,68, 1,98 y 2,24mUI/l en primer, segundo y tercer trimestre, respectivamente (p<0,001). Por el contrario, la T3L disminuye a medida que avanzan los trimestres con unas medianas de 3,06, 2,70 y 2,60pg/ml, respectivamente (p<0,001). La T4L refleja una tendencia clara de descenso entre el primer trimestre y el segundo y tercero con medianas de 1,07 a 0,97ng/dl y 0,99ng/dl, respectivamente. Estas diferencias quedan reflejadas en los diagramas de cajas de cada variable según la edad gestacional (figs. 2–4).
El debate instaurado sobre cuándo considerar un posible hipotiroidismo en la gestación a causa de los cambios fisiológicos de la función tiroidea durante este periodo, y las recomendaciones13 sobre la conveniencia de establecer valores de referencia propios en cada laboratorio, nos ha llevado a calcular de una manera más precisa los valores de referencia de estas hormonas en nuestra población gestante.
Además, las técnicas analizadas (TSH, T4L, T3L) se encuentran acreditadas por la Norma UNE-EN ISO 15189 y la obtención de valores de referencia en nuestra población gestante se incluyó como plan de mejora de dicha acreditación.
Este estudio pretende definir en mujeres gestantes sanas los límites de normalidad de las hormonas tiroideas para cada trimestre de gestación, para un método analítico determinado y una zona/población concreta, dada la compleja fisiología de la función tiroidea durante la gestación que da lugar a cambios significativos en las concentraciones de las hormonas tiroideas15,16.
La prevalencia de enfermedad tiroidea autoinmunitaria en nuestra población fue del 13,95%, superior a otros estudios españoles como la descrita por García de Guadiana et al.17 (5,2%) y Santiago et al.18 (5,4%), y más similar a otros estudios como los de Pearce et al.19 (12,4%) y Bocos et al.20 (14,77%). Como demuestran otros estudios17–19, la presencia de anticuerpos antitiroideos se asoció a valores de TSH más elevados, lo que ostenta la exclusión de las gestantes con autoinmunidad tiroidea para la obtención de los intervalos de referencia tal y como establece la National Academy of Clinical Biochemistry21.
Los valores de TSH presentan un descenso considerable en el primer trimestre debido al efecto estimulador del receptor de TSH por acción de la gonadotropina coriónica humana (βhCG). Los intervalos de referencia obtenidos para TSH en gestantes durante el primer trimestre (0,10-3,74mUI/) difieren de los utilizados en nuestro laboratorio en la población no gestante (0,35-5,5mUI/). El percentil 97,5 de TSH obtenido en este estudio correspondió a una concentración de 3,74mUI/l, valor próximo a 4mUI/l punto de corte propuesto por la American Thyroid Association (ATA) para la TSH en el primer trimestre en ausencia de valores de referencia propios13. Además, dichos intervalos difieren de otros estudios como el de Vila et al.22 y Lombardo Grifol et al.23, con la misma metodología que la utilizada en nuestro estudio, diferencias probablemente atribuibles a la población de referencia. Del mismo modo ocurre con otros estudios17,18, donde las diferencias entre los intervalos propuestos se deben al uso de tecnología diferente.
Con respecto a la T4L, se observó un descenso de las concentraciones en el segundo y tercer trimestre, de forma similar a lo descrito en otros estudios17–20, y los límites del intervalo de referencia obtenido (0,87-1,34ng/dl) fueron diferentes a los empleados para población no gestante en nuestro laboratorio (0,78-1,53ng/dl).
En nuestro estudio no se han realizado determinaciones de yoduria para evaluar el estado nutricional del yodo de las gestantes debido al sobrecoste que supondría su envío al laboratorio externo, ya que es una prueba que no consta en nuestra cartera de servicios. Por otro lado, desde hace años, en nuestra comunidad autónoma24, a las mujeres gestantes se les prescribe yoduro potásico antes de la gestación, si es posible, durante la misma y en el periodo de lactancia, tal y como recogen distintas asociaciones y grupos de trabajo13,25.
En conclusión, los intervalos de referencia para la TSH, T4L y T3L obtenidos en este trabajo están por debajo de los utilizados en la población adulta no gestante en nuestro laboratorio, por lo que permitirán identificar de manera más precisa una posible disfunción tiroidea en las gestantes de nuestra área evitando un infradiagnóstico de hipotiroidismo subclínico y reduciendo las posibles complicaciones perinatales asociadas.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónEste estudio no ha recibido ningún tipo de financiación.
AutoríaTAF: concepción y diseño del estudio, análisis e interpretación de los datos, realización del borrador y revisión del contenido y aprobación definitiva de la versión que se presenta.
MMGV: recopilación y adquisición de los datos, revisión crítica del contenido y aprobación definitiva de la versión presentada.
MJBA: concepción y diseño del estudio, recopilación y adquisición de los datos, revisión crítica del contenido y aprobación definitiva de la versión presentada.
MCSPM: concepción y diseño del estudio, creación de los perfiles analíticos en el Sistema Informático del Laboratorio utilizados en el estudio, revisión crítica del contenido y aprobación definitiva de la versión presentada.
LMS: adquisición de los datos, revisión crítica del contenido y aprobación definitiva de la versión presentada como jefa del Servicio Análisis Clínicos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.