La neuromielitis óptica es un trastorno autoinmune, inflamatorio y desmielinizante del sistema nervioso central que afecta a la médula espinal y al nervio óptico, de carácter recurrente. Rituximab ha sido utilizado en el tratamiento de varias enfermedades neurológicas de probable naturaleza autoinmune o donde la inmunidad humoral estaba implicada. El objetivo de este estudio es evaluar la eficacia y seguridad de rituximab en el tratamiento de la neuromielitis óptica en un hospital terciario.
MétodosEstudio retrospectivo de pacientes con neuromielitis óptica tratadas con 2 infusiones de rituximab 1.000mg separadas por 15 días, cada 6-8 meses. Se evaluó la puntuación EDSS, la existencia de brotes, el estado general, el recuento de CD19+, la presencia de anticuerpos anti-NMO y las reacciones adversas.
ResultadosSe trataron 6 pacientes, todas mujeres (mediana de edad 46 años; rango 38-58). En 3 de ellas (50%) se detectó la presencia de anticuerpos anti-NMO. La EDSS basal fue de 4 (rango 2-5,5). Dos pacientes recibieron previamente algún fármaco inmumodulador. La mediana desde el primer brote hasta el tratamiento con rituximab fue de 3,7 años (rango 1,7-6,9); 2 pacientes presentaron alguna reacción adversa tras la primera infusión del fármaco. En cuanto a la respuesta, 4 pacientes no volvieron a tener brotes y su EDSS no progresó, en una paciente no se observó mejoría clínica y otra no pudo evaluarse.
ConclusionesEl uso de rituximab en pacientes con neuromielitis óptica puede considerarse una alternativa terapéutica interesante, ya que no existen tratamientos autorizados para esta enfermedad. Son necesarios más estudios con rituximab para establecer el lugar de este fármaco en la terapéutica de la neuromielitis óptica.
Neuromyelitis optica is an inflammatory and usually relapsing demyelinating autoimmune disease of the central nervous system that targets the optic nerves and spinal cord. Rituximab has been used for different neurological diseases that are probably immune-mediated or involving humoural immunity. The objective of this study is to evaluate the efficacy and safety of rituximab as treatment for neuromyelitis optica in a tertiary hospital.
MethodsRetrospective study of patients with neuromyelitis optica treated with rituximab 1000mg on days 1 and 15, repeated every 6 to 8 months. We recorded EDSS score, relapse rate, overall condition, CD19+ count, presence of anti-NMO antibodies, and possible adverse reactions.
ResultsSix patients were treated; all were women with a median age of 46 years (range, 38-58). Anti-NMO antibodies were detected in 3 patients (50%). Baseline EDSS was 4 (range 2.0-5.5). Two patients had previously been treated with an immunomodulatory drug. Median time from the first rituximab infusion to first relapse was 3.7 years (range 1.7-6.9). Two patients had infusion reactions after the first dose of rituximab. Four patients remained relapse-free and their EDSS score did not progress during rituximab treatment, one patient showed no clinical improvement, and one patient could not be evaluated.
ConclusionRituximab can be considered an attractive therapeutic alternative for patients with neuromyelitis optica as there are no approved treatments for this disease. Further studies with rituximab are needed to establish the role of this drug in treating neuromyelitis optica.
La neuromielitis óptica (NMO) es un trastorno autoinmune, inflamatorio y desmielinizante del sistema nervioso central que afecta a la médula espinal y al nervio óptico, de carácter recurrente1. Atendiendo a los criterios publicados en 2006 para el diagnóstico de la NMO se requiere la constatación de haber sufrido al menos un episodio de neuritis óptica y otro de mielitis, y al menos 2 de los 3 criterios siguientes: lesión de tipo desmielinizante que abarque 3 o más cuerpos vertebrales, RMN que no cumpla los criterios de Paty para el diagnóstico de la esclerosis múltiple (EM), y anticuerpos anticuoporina-4 (Ac. anti-NMO)2. Actualmente no hay ensayos clínicos que evalúen el tratamiento para esta enfermedad3. Se han utilizado fármacos inmunosupresores/inmunomoduladores, y en los brotes, glucocorticoides y plasmaféresis. En la autoinmunidad, la autorreactividad dependiente de T depende de las células B a través de su papel como células presentadoras de antígeno o como células coestimuladoras4. Dado que la producción patológica de anticuerpos es una característica común de numerosas enfermedades autoinmunes, en los últimos años rituximab (RTX) ha sido utilizado en el tratamiento de varias afecciones neurológicas de probable naturaleza autoinmune, o en las cuales la inmunidad humoral estaba implicada5. RTX es un anticuerpo que actúa contra las células B CD20+ provocando su depleción de la circulación sanguínea durante 6-8 meses5. El objetivo de este estudio es evaluar la eficacia y seguridad de RTX en el tratamiento de la NMO en un hospital terciario.
MétodosEstudio retrospectivo de pacientes con NMO diagnosticadas de acuerdo con los criterios de Wingerchuck et al.2, tratadas con RTX. Se utilizó un régimen de ciclos consistente en 2 infusiones de 1.000mg separadas por 15 días, que se repitieron cada 6-8 meses (en función del nivel de linfocitos CD19+>1%); en una paciente se utilizó un régimen de 4 dosis de 375mg/m2. Las pacientes fueron vistas el día de la infusión y cada 3 meses, recogiéndose la puntuación de la EDSS (escala de Kurtzke), la existencia de brotes, el estado general, el recuento de CD19+ y los Ac. anti-NMO. Se recogieron de forma reglada las reacciones adversas durante el tratamiento con RTX. Todas las pacientes fueron informadas de los posibles riesgos y beneficios del tratamiento con RTX, con especial énfasis en el posible desarrollo de leucoencefalopatía multifocal progresiva, síndrome de liberación de citoquinas y reacciones alérgicas, obteniéndose el consentimiento informado de todas. El periodo de seguimiento fue al menos de 6 meses desde la última administración de RTX.
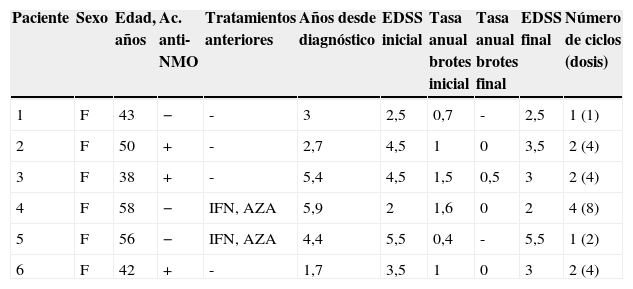
ResultadosLas características clínicas de las pacientes se muestran en la tabla 1. Dos pacientes se trataron previamente con algún fármaco inmumodulador y todas recibieron glucocorticoides para los brotes y plasmaféresis en aquellos que eran refractarios. Dos pacientes presentaron algún tipo de reacción adversa relacionada con la infusión tras la primera dosis de RTX; en uno de los casos se resolvió con la administración de 80mg de metilprednisolona y un antihistamínico, pero en el otro se suspendió el tratamiento ante la persistencia de los síntomas. En cuanto a la respuesta, 4 pacientes han reducido la tasa anual de recaída y su EDSS no ha progresado, y una paciente no obtuvo mejoría clínica tras 2 dosis de RTX y se cambió a ciclofosfamida. No se pudo evaluar la respuesta a RTX de una paciente por recibir una sola dosis tras una reacción adversa grave relacionada tras la primera infusión; también en este caso el tratamiento alternativo fue ciclofosfamida. La mediana de tiempo de seguimiento de las 4 pacientes con respuesta fue de 34 meses (rango 15-56). Se monitorizaron los títulos de Ac. anti-NMO en todos los pacientes positivos para ver su evaluación tras el tratamiento con RTX, negativizándose en una de las pacientes. Se repitió la determinación de Ac. anti-NMO a las pacientes seronegativas, manteniéndose el mismo resultado.
Características clínicas de los pacientes
| Paciente | Sexo | Edad, años | Ac. anti-NMO | Tratamientos anteriores | Años desde diagnóstico | EDSS inicial | Tasa anual brotes inicial | Tasa anual brotes final | EDSS final | Número de ciclos (dosis) |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | F | 43 | − | - | 3 | 2,5 | 0,7 | - | 2,5 | 1 (1) |
| 2 | F | 50 | + | - | 2,7 | 4,5 | 1 | 0 | 3,5 | 2 (4) |
| 3 | F | 38 | + | - | 5,4 | 4,5 | 1,5 | 0,5 | 3 | 2 (4) |
| 4 | F | 58 | − | IFN, AZA | 5,9 | 2 | 1,6 | 0 | 2 | 4 (8) |
| 5 | F | 56 | − | IFN, AZA | 4,4 | 5,5 | 0,4 | - | 5,5 | 1 (2) |
| 6 | F | 42 | + | - | 1,7 | 3,5 | 1 | 0 | 3 | 2 (4) |
Ac. anti-NMO: anticuerpos antiacuaporina-4; AZA: azatioprina; EDSS: Expanded Disability Status Scale; F: femenino; IFN: interferón beta.
Actualmente no existe una terapia estándar para esta enfermedad, normalmente de carácter recurrente y habitualmente de pronóstico más grave. En algunas series, hasta el 30-40% de los pacientes fallecen por complicaciones respiratorias a los 5 años, hallazgo altamente infrecuente en pacientes con EM6. En los últimos años se han utilizado distintos esquemas de dosificación de RTX en el tratamiento de la NMO, de manera análoga a la EM y otras enfermedades autoinmunes4,5,7. Una paciente comenzó con una pauta de 4 dosis de 375mg/m2, y posteriormente todas han recibido 2 dosis de 1.000mg separadas por 15 días. La repetición del esquema con RTX a los 6-9 meses se apoya en la experiencia obtenida en pacientes con EM, basado en el tiempo en que reaparecen en sangre las células B CD20+8. La eficacia en nuestras pacientes es algo menor a la hallada en otros estudios, como la serie de Bedi et al., en la que todos los pacientes estabilizaron o mejoraron su EDSS9, la de Jacob et al.10, una de las series más amplias publicadas y en la que un alto porcentaje de pacientes mejoraron tras el tratamiento con RTX, o la de Kim et al.11, en la que la tasa de recaídas se redujo en un 88%. En nuestra serie, el 80% de las pacientes tratadas con RTX han reducido la tasa anual de recaída, una de ellas sufrió un brote al mes de comenzar el tratamiento con RTX, pero posteriormente se ha mantenido libre de recaídas, y las otras 3 pacientes se mantuvieron libres de brotes desde el inicio de RTX. El reducido número de pacientes limita la comparación de los resultados obtenidos con los de los estudios mencionados anteriormente. En la serie de Pellkofer et al.12, 8 de los 10 pacientes redujeron la tasa de recaídas y correlacionaron la aparición de estas con la reaparición de células B. En este estudio se apunta que aunque los Ac. anti-NMO están involucrados en la patogénesis de esta enfermedad, los títulos de estos no se reducen con la administración de RTX12. Recientemente, Kim et al. publicaron los resultados tras un seguimiento de 5 años en 30 pacientes con enfermedad del espectro de la NMO tratados con RTX; hasta un 87% de los pacientes mostraron reducción en la tasa anual de recaídas y un 60% permanecieron libres de estas13. El recuento de CD19 en sangre nos informa de que la depleción de células B permanece y, por tanto, se mantiene el efecto de RTX10,12. Estos autores monitorizan las células B CD27+ en lugar de los CD19+, ya que apuntan que la determinación de CD27+ es más sensible que la de CD19+, y utilizan este dato para decidir el retratamiento con RTX. La mayoría de los pacientes tratados en estos estudios presentaron Ac. anti-NMO; en nuestro caso, el hecho de que solo 3 pacientes presenten Ac. anti-NMO puede explicar los resultados más modestos, que también han informado otros autores14. La seropositividad del test varía entre distintas poblaciones, por ejemplo, en pacientes con EM óptico-espinal, variante de la NMO, este dato oscila entre un 27-63%15. El limitado número de casos y el corto periodo de seguimiento en algunos pacientes dificulta conocer con exactitud el papel de RTX en la terapéutica de esta enfermedad en nuestro centro.
ConclusiónLa experiencia positiva de RTX en otras enfermedades autoinmunes, junto con la gravedad que en ocasiones cursa esta enfermedad, apoyan esta opción terapéutica. El uso de RTX en pacientes con NMO puede considerarse una alternativa terapéutica interesante, ya que no existen tratamientos autorizados para esta enfermedad. Son necesarios más estudios con RTX para establecer el lugar de este fármaco en la terapéutica de la NMO.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.