El síndrome opsoclono-mioclono-ataxia es un trastorno del movimiento, de origen frecuentemente paraneoplásico o parainfeccioso, caracterizado por el desarrollo agudo o subagudo de sacadas oculares anormales, multidireccionales de gran amplitud, asociadas a inestabilidad troncular y mioclonías difusas. En menor grado aparecen: disartria, ataxia apendicular y/o deterioro del nivel de consciencia. Los síntomas neurológicos preceden al diagnóstico tumoral en el 50% de casos y la neuroimagen suele ser normal. En adultos, la respuesta del síndrome opsoclono-mioclono-ataxia paraneoplásico (SOMAP) al tratamiento inmunomodulador es parcial o nula con posibles recidivas, pudiendo desembocar en una encefalopatía difusa mortal. Además, algunos pacientes manifiestan recurrencias que precisan reiniciar el tratamiento. Dada la extremada infrecuencia de esta entidad de presumible etiopatogenia inmunomediada, carecemos de directrices procedentes de ensayos clínicos que nos aporten un protocolo farmacológico estandarizado1-16. Presentamos un caso de SOMAP recurrente en un adulto inmunocompetente, con remisión clínica solo tras administración intravenosa (IV) de pulsos de metilprednisolona y ciclofosfamida (PMC).
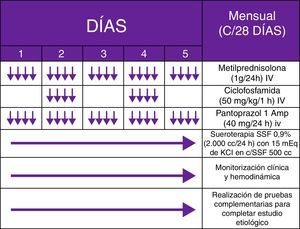
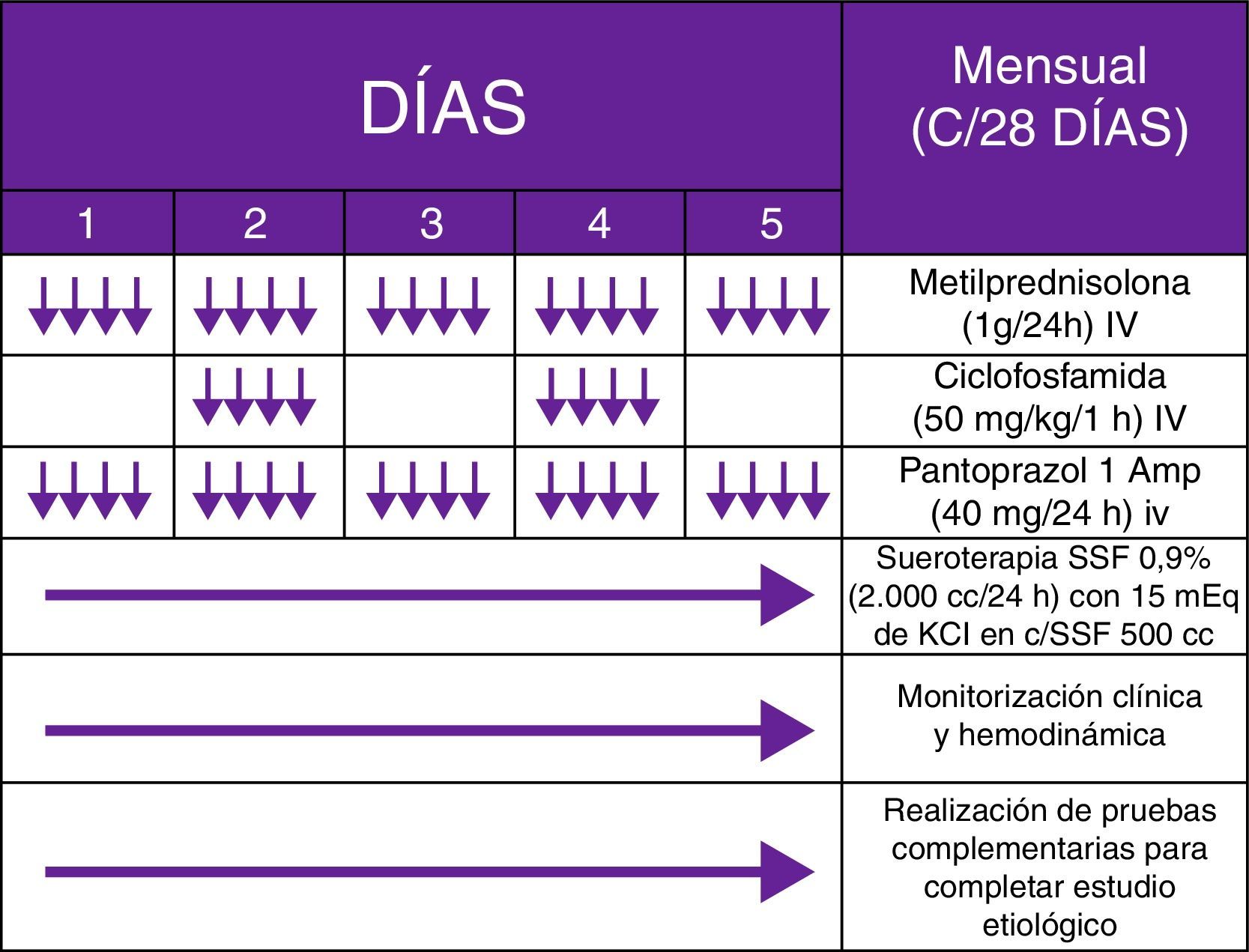
Se trataba de un varón de 62 años, con antecedentes de tabaquismo (índice paquete/año de 94) y enolismo (3-4 copas de whisky/día) severos, que acudió a urgencias por un cuadro incapacitante, iniciado 2 semanas antes, consistente en marcha atáxica, con lateropulsión bilateral alternante y caídas subsecuentes. Debido a la sospecha de cerebelopatía, se cursó ingreso hospitalario en planta de Neurología, solicitando estudio analítico-radiológico completo. Durante el ingreso, el paciente empeoró, exhibiendo fluctuación del nivel de consciencia, pensamiento incoherente, alucinaciones visuales, jergafasia, disartria, agitación psicomotriz, mioclonías multifocales y nistagmo binocular en los primeros días horizontorrotatorio, y de forma posterior multidireccional (Anexo 1. Material adicional [vídeo disponible en la web]). Tras descartar mediante un estudio analítico general, etiología tóxico-metabólico-infecciosa, así como afectación tumoral con RM craneal, PET-TAC whole-body (fig. 1) y ecografía testicular, se obtuvo positividad para Acs anti-CV2 (tabla 1) y un patrón Delta grado ii generalizado en el electroencefalograma. Ante un posible SOMAP, y a pesar de no existir respuesta a un ciclo de megadosis corticoidea (1g/día/5 días) y 2 posteriores de inmunoglobulinas IV (0,4g/kg/día/5 días), basándonos en los protocolos recogidos en la literatura pediátrica, decidimos administrar PMC mensuales IV (fig. 2) (habiendo demostrado ser una medida efectiva y con un coste económico significativamente menor que rituximab), obteniendo una resolución semiológica. Por desgracia, se produjo una reagudización al año tras reducir la medicación, con objetivación y confirmación anatomopatológica de carcinoma microcítico pulmonar (fig. 3), asociando metastatización extratorácica (pleural, hepática y suprarrenal). Finalmente, el paciente fue diagnosticado de SOMAP definido, falleciendo 7 meses más tarde, durante un último ingreso.
Estudio con PET-TAC whole-body (realizado un año después del comienzo clínico, durante el primer reingreso del paciente). Se identifica un foco hipermetabólico en el hilio pulmonar izquierdo con un valor máximo de captación estandarizada (SUVmáx) de 2-[18F]fluoro-2-desoxi-D-glucosa (18F-FDG) igual a 3,92 en región interlobar (un SUVmáx, ≥ 2,5 es por lo general indicativo de una alta probabilidad de malignidad), sin traducción morfológica en la TAC sin contraste intravenoso, y que podía estar en relación con adenopatía. Lo cual fue confirmado ulteriormente, al realizar una punción de la región hipermetabólica, guiada mediante ultrasonografía endobronquial (EBUS), sin hallar tejido tumoral.
Resultado de las muestras de suero y líquido cefalorraquídeo tras procesamiento y posterior determinación de anticuerpos
| Acs anti- | Muestra | Técnica de cribado | Técnica de confirmación | Resultado |
|---|---|---|---|---|
| Hu | Suero | Inmunohistoquímica | Inmunoblot | Negativo |
| CV2 | Suero | Inmunohistoquímica | Inmunoblot | Positivo |
| Ma1/2 | Suero | Inmunohistoquímica | Inmunoblot | Negativo |
| Anfifisina | Suero | Inmunohistoquímica | Inmunoblot | Negativo |
| GAD | Suero | Inmunohistoquímica | RIA | Negativo |
| LGI1a | Suero | Inmunohistoquímica | CBA | Negativo |
| CASPR2a | Suero | Inmunohistoquímica | CBA | Negativo |
| NMDA-R | LCR | Inmunohistoquímica | CBA | Negativo |
| AMPA-R | LCR | Inmunohistoquímica | CBA | Negativo |
| GABAB-R | LCR | Inmunohistoquímica | CBA | Negativo |
Acs: antineuronales; AMPA-R: receptor de glutamato de tipo ácido 2-amino-3-propanoico; CASPR2: proteína símil 2 asociada a contactina; CBA: cell-based assay (inmunocitoquímica sobre células HEK [células de riñón embrionarias humanas] transfectadas con el antígeno; CV2 (CRMP-5-IgG): proteína 5 mediadora de la respuesta de la colapsina; GABA-R: receptor del ácido γ-aminobutírico tipo B; GAD: decarboxilasa del ácido glutámico; Hu (ANNA-1): anticuerpo antinuclear neuronal de tipo i; Ma1: MA1: proteína 1 específica testicular y neuronal; Ma2: antígeno onconeuronal; NMDA-R: receptor del glutamato de tipo N-metil-D-aspartato. LGI1: proteína 1 inactivada del glioma rica en leucina; RIA: radioinmunoensayo.
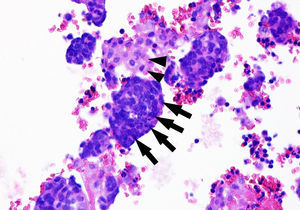
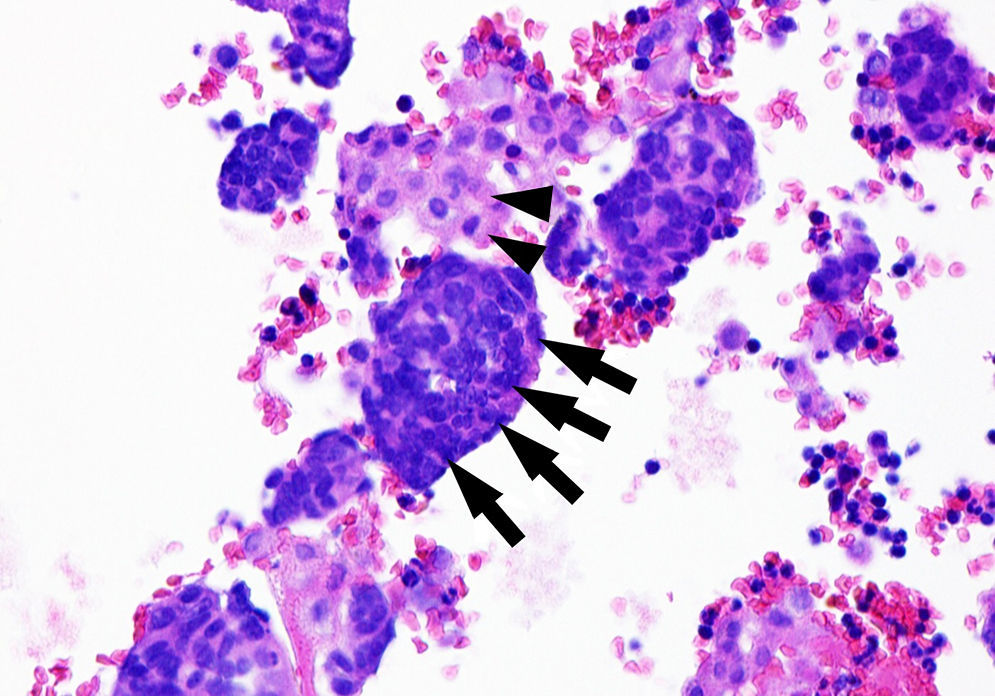
Citología de líquido pleural hemático. Imagen correspondiente a bloque celular (tinción con hematoxilina-eosina): se podían distinguir células tumorales (moldeamiento nuclear con relación núcleo/citoplasma muy elevada, abundantes figuras de mitosis y un citoplasma escaso) (flechas), entremezcladas con células mesoteliales reactivas (citoplasma más amplio y eosinófilo, más claro de color rosáceo) (puntas de flecha). En la inmunohistoquímica de las células tumorales se obtuvo un resultado positivo ante: factor 1 de transcripción tiroidea (TTF-1, indicando un origen primario pulmonar), cromogranina/sinaptofisina, CD56 y Ki-67 (MIB-1) (en el 57% de las células neoplásicas). Todo ello compatible con infiltración o metástasis de carcinoma neuroendocrino pulmonar de célula pequeña.
Los síndromes neurológicos paraneoplásicos (SSNNPP) son excepcionales, con una incidencia < 1% en pacientes cancerosos. En adultos, los más habituales son el carcinoma pulmonar de células pequeñas (CPCP) (con Acs anti-Hu o anti-CV2) y el de mama (con Acs anti-Ri). Por otro lado, el CPCP constituye el 20% de los tumores pulmonares malignos. Surge de las células basales neuroendocrinas de Kulchitsky, suele ser central y se asocia con frecuencia a adenopatías mediastínicas. Se caracteriza por una alta malignidad, con gran facilidad para generar metástasis extratorácicas (presentes en el 95% de casos). El porcentaje de pacientes con CPCP que desarrollan SSNNPP se estima en un 3%1-18. Los SSNNPP suelen evolucionar con gran celeridad, de forma que en unas pocas semanas puede haber un daño neuronal irreversible. El curso remitente-recurrente confiere un peor pronóstico y las secuelas motoras y cognitivo-conductuales se erigen a medio-largo plazo como el principal obstáculo en el manejo de estos pacientes. Por esta razón, el tratamiento debe aplicarse lo antes posible. El tratamiento del SOMAP debe incluir el del cáncer y el uso de inmunoterapias. Los corticoides son la alternativa más efectiva en el SOMAP. Otras terapias disponibles son: ciclofosfamida, azatioprina, ciclosporina A, rituximab, gammaglobulinas y plasmaféresis. Sin embargo, las recurrencias son habituales tras el descenso o la retirada del tratamiento. Por ello se aconseja utilizar terapias multimodales para prevenir las recaídas y mejorar el pronóstico a largo plazo1-16. La respuesta a PMC se ha descrito en el SOMAP infantil19, pero no en adultos. Este, por tanto, se trata del primer caso descrito de SOMAP recurrente del adulto, con resolución clínica gracias a la utilización de PMC. Para realizar esta aseveración, llevamos a cabo una búsqueda bibliográfica mediante la base de datos informatizada «PubMed (MEDLINE)». En consecuencia, proponemos como opción terapéutica precoz el uso de PMC en casos de SOMAP refractario a corticoides e inmunoglobulinas, para brindar una mejor calidad de vida y paliar las secuelas neurocognitivas que aparecen hasta en el 80% de estos enfermos11,20. La elaboración de estudios analíticos y experimentales, que reúnan más casos, supondría una ayuda inestimable, para esclarecer el nivel de evidencia en población adulta, de esta modalidad de tratamiento combinado con propiedades inmunosupresoras.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Dr. José Tejeiro Martínez, el Dr. Francisco Cabrera Valdivia, la Dra. Victoria Galán Sánchez-Seco, la Dra. Carla Sonsireé Abdelnour Ruiz, la Dra. María Molina Sánchez, la Dra. María Henedina Torregrosa Martínez y la Dra. Pilar Hernández Navarro.
Trabajo presentado como póster en la LXVI Reunión Anual de la Sociedad Española de Neurología (Valencia, 18 de noviembre del 2014).





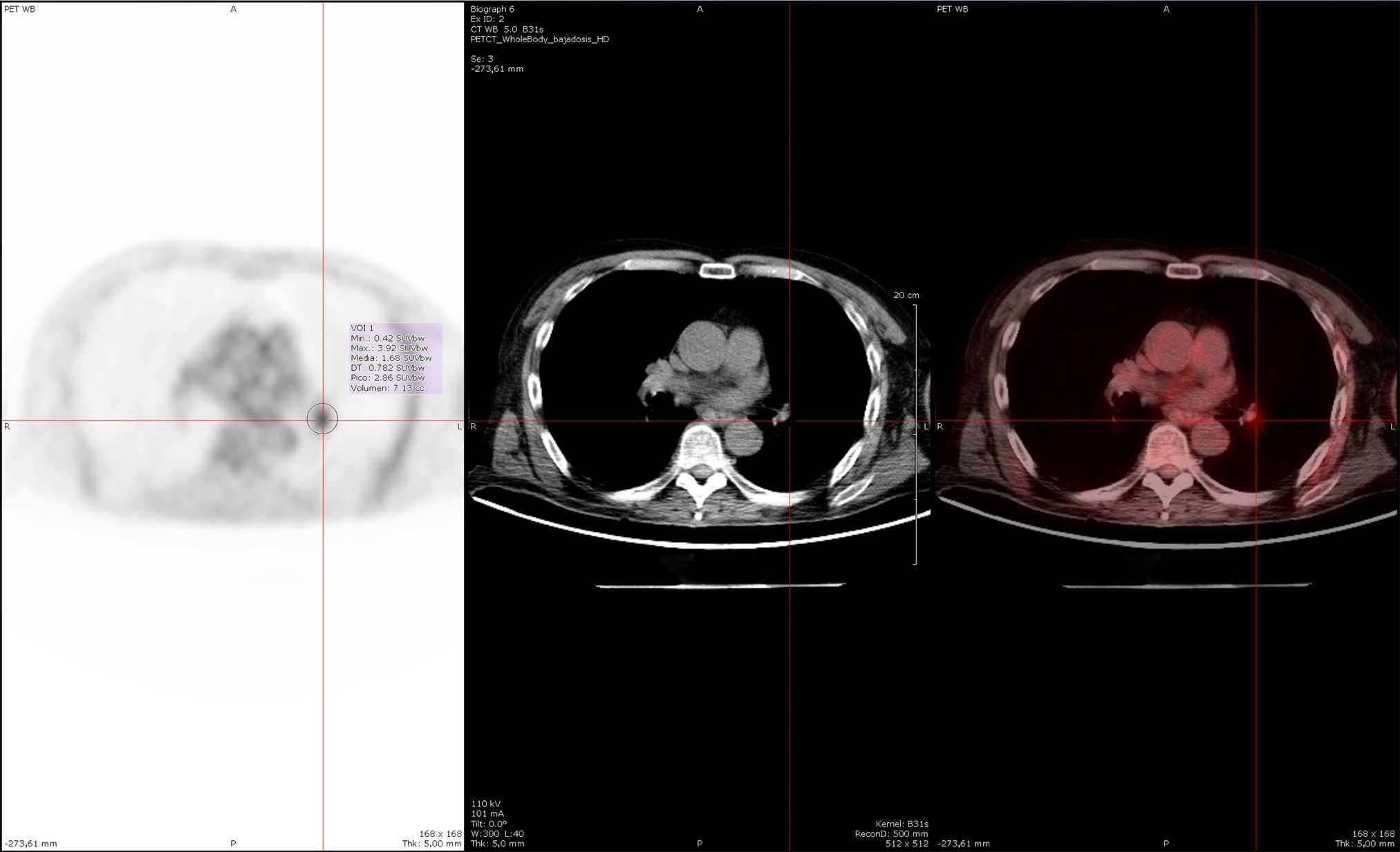

![Estudio con PET-TAC whole-body (realizado un año después del comienzo clínico, durante el primer reingreso del paciente). Se identifica un foco hipermetabólico en el hilio pulmonar izquierdo con un valor máximo de captación estandarizada (SUVmáx) de 2-[18F]fluoro-2-desoxi-D-glucosa (18F-FDG) igual a 3,92 en región interlobar (un SUVmáx, ≥ 2,5 es por lo general indicativo de una alta probabilidad de malignidad), sin traducción morfológica en la TAC sin contraste intravenoso, y que podía estar en relación con adenopatía. Lo cual fue confirmado ulteriormente, al realizar una punción de la región hipermetabólica, guiada mediante ultrasonografía endobronquial (EBUS), sin hallar tejido tumoral. Estudio con PET-TAC whole-body (realizado un año después del comienzo clínico, durante el primer reingreso del paciente). Se identifica un foco hipermetabólico en el hilio pulmonar izquierdo con un valor máximo de captación estandarizada (SUVmáx) de 2-[18F]fluoro-2-desoxi-D-glucosa (18F-FDG) igual a 3,92 en región interlobar (un SUVmáx, ≥ 2,5 es por lo general indicativo de una alta probabilidad de malignidad), sin traducción morfológica en la TAC sin contraste intravenoso, y que podía estar en relación con adenopatía. Lo cual fue confirmado ulteriormente, al realizar una punción de la región hipermetabólica, guiada mediante ultrasonografía endobronquial (EBUS), sin hallar tejido tumoral.](https://static.elsevier.es/multimedia/02134853/0000003200000002/v3_201706020006/S0213485315000869/v3_201706020006/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)