Existen pocas validaciones de la versión en español de la prueba Montreal Cognitive Assessment (MoCA-S) en Latinoamérica.
ObjetivoEvaluar las propiedades psicométricas y la validez discriminativa del MoCA-S en adultos mayores de Santiago de Chile.
MétodosCiento setenta y dos individuos agrupados según diagnóstico clínico basado en Clinical Dementia Rating (CDR) en: deterioro cognitivo leve tipo amnésico (DCL-a, n=24), DCL no-amnésico (DCL-na, n=24), demencia leve (n=20) y 104 cognitivamente sanos fueron evaluados con el MoCA-S y Mini-Mental test de Folstein (MMSE) como prueba de contraste, para determinar la validez discriminativa del MoCA-S.
ResultadosLos promedios ± desviación estándar de edad y escolaridad fueron 73±6 y 11±4, respectivamente, sin diferencias significativas entre los grupos. La consistencia interna fue buena (α de Cronbach 0,772), la fiabilidad interevaluador muy buena (coeficiente de correlación de Spearman 0,846 [p<0,01]) y la fiabilidad intraevaluador (test-retest) fue 0,922 bilateral (p<0,001). La prueba fue eficaz y válida para la detección del DCL-a (ABC=0,903) y demencia leve (ABC=0,957); menos eficaz en DCL no-a (ABC=0,629). El punto de corte de mejor rendimiento para DCL-a fue < 21 y para demencia leve < 20; sensibilidad/especificidad de 75/82% y 90/86%, respectivamente. La escolaridad mostró una importante influencia en el puntaje, por ello se adicionaron 2 puntos para escolaridad < 8 años y un punto para escolaridad entre 8 y 12 años (MoCA-S1-2). El MoCA-S1-2 fue significativamente más discriminativo que el MMSE para diferenciar DCL-a y demencia.
ConclusionesEl MoCA-S1-2 es una prueba breve, de fácil administración y útil para el diagnóstico de DCL-a y demencia leve.
Few studies have validated the Spanish-language version of the Montreal Cognitive Assessment (MoCA-S) test in Latin American populations.
ObjetiveTo evaluate the psychometric properties and discriminant validity of the MoCA-S in elderly patients in Santiago de Chile.
Methods172 individuals were grouped according to their clinical diagnosis based on the Clinical Dementia Rating (CDR) scale as follows: amnestic mild cognitive impairment (aMCI; n±24), non-amnestic MCI (naMCI; n±24), mild dementia (n±20), and cognitively normal (n±104). Participants were evaluated with both the MoCA-S and the Mini–Mental State Examination (MMSE) to determine the discriminant validity of the MoCA-S.
ResultsMean age and years of schooling were 73±6 and 11±4 years, respectively, with no significant intergroup differences. The MoCA-S displayed good internal consistency (Cronbach's α: 0.772), high inter-rater reliability (Spearman correlation coefficient: 0.846; P<.01), and high intra-rater reliability (test-retest reliability coefficient: 0.922; P<.001). The MoCA-S was found to be an effective and valid test for detecting aMCI (AUC±0.903) and mild dementia (AUC±0.957); its effectiveness for detecting naMCI was lower (AUC±0.629). The optimal cut-off points for aMCI and mild dementia were<21 and<20, respectively, with sensitivity and specificity rates of 75% and 82% for aMCI and 90% and 86% for mild dementia. The level of education had a great impact on scores: as a result, 2 points were added for patients with less than 8 years of schooling and one point for patients with 8-12 years of schooling (MoCA-S1-2). The MoCA-S1-2 showed significantly greater discriminant validity than the MMSE for differentiating aMCI from dementia.
ConclusionsThe MoCA-S1-2 is a short, easy-to-use, and useful test for diagnosing aMCI and mild dementia.
En las últimas décadas, Chile ha experimentado un envejecimiento acelerado de su población1-3; actualmente es la tercera población más envejecida de Latinoamérica después de Cuba y Uruguay, teniendo una de las tasas de demencia en mayores de 60 años más altas del mundo (8%)4,5.
El deterioro cognitivo leve (DCL) es aquel deterioro que va más allá de lo que se espera para el envejecimiento normal, pero insuficiente para constituir una demencia. Se caracteriza por presentar una tasa de conversión a demencia del 10-30% por año, comparado con el 1-2% anual en ancianos cognitivamente normales6-9. El DCL amnésico (DCL-a), tanto uni como multidominio, es el que más se asocia a progresión a enfermedad de Alzheimer (EA). De acuerdo con los nuevos criterios diagnósticos del año 20119, el DCL-a correspondería a «DCL debido a EA».
El diagnóstico de DCL y demencia es, hasta la fecha, clínico, basado en la historia, la evaluación neurosicológica y los exámenes de laboratorio que permitan descartar factores confundentes10,11. El uso de biomarcadores para la EA, como la medición de niveles de péptido amiloide y tau total o fosforilado en líquido cefalorraquídeo, o la detección de amiloide en el cerebro mediante tomografía de emisión de positrones9,12, son cada vez de mayor utilidad, pero aún de alto costo o invasivos9,10,13. Por ello, las pruebas neurosicológicas siguen siendo las herramientas básicas de diagnóstico y pesquisa de deterioro cognitivo en la práctica clínica10.
El Mini-Mental State Examination (MMSE)14 es la prueba de tamizaje cognitivo, más ampliamente usada para la evaluación de pacientes con problemas de memoria. Sin embargo, tiene varias limitaciones15,16: no evalúa abstracción ni funciones ejecutivas, tiene un fuerte sesgo por variables socioeducativas, con variaciones de alrededor de 7 puntos en población sana con distinta escolaridad17, es poco sensible en estadios iniciales del deterioro cognitivo y está sujeto a derechos de autor, desventajas que son largamente superadas por nuevas pruebas de tamizaje cognitivo15,16,18,19. En la validación del MMSE para demencia en Chile, Quiroga et al.20 encontraron una especificidad del test de un 44%, es decir, alrededor del 56% de falsos positivos. Sin embargo, el MMSE asociado al cuestionario de actividades funcionales de Pfeffer (PFAQ) aplicado a un informante válido mostró una sensibilidad para la detección de demencia del 94,4%, con una especificidad del 83,3%. El MMSE + PFAQ es de utilización habitual en nuestro país20. Sin embargo, estos test carecen de la suficiente validez para la pesquisa de las etapas más precoces de deterioro cognitivo.
El Montreal Cognitive Assessment test (MoCA test) es una herramienta de tamizaje para detectar DCL desarrollado por Nasreddine et al. en el año 200521. Existen numerosos estudios de contraste del MoCA con el MMSE, que demuestran su superioridad para la detección de DCL, siendo altamente confiable en validaciones internacionales21-26. El MoCA evalúa funciones ejecutivas, atención, abstracción, memoria, lenguaje, capacidades visuoconstructivas, cálculo y orientación. Es de fácil administración, con una duración aproximada de 10 min21. El puntaje máximo es de 30 puntos, con un punto de corte para DCL y demencias < 26 en países desarrollados21. Su mayor inconveniente es poseer un alto sesgo educacional, por lo que en la versión original se recomienda la adición de un punto si la escolaridad es inferior a 12 años21. Sin embargo, en poblaciones con muy baja escolaridad, la adición de un punto puede ser insuficiente23,27,28.
Existen muy pocas validaciones del MoCA en población de habla hispana; Lozano Gallego et al.23 lo validaron en España y en Latinoamérica las únicas validaciones existentes del MoCA-S fueron realizadas en Colombia26,28. Ha sido validado también en hispanoparlantes en Estados Unidos, aunque los resultados no son comparables, pues algunos participantes eran bilingües27. Por ello, es necesario conocer el punto de corte en la población chilena. Los objetivos de este estudio fueron: 1) estudiar las propiedades psicométricas del test de MoCA-S; 2) estudiar la validez discriminativa del MoCA-S para el diagnóstico de DCL y demencia leve en población chilena, y compararla con el MMSE, la prueba de tamizaje validada en Chile, y 3) determinar los ítems más sensibles del MoCA para la detección de DCL y demencia.
Pacientes y métodosDiseñoEstudio de validación para prueba diagnóstica, transversal, de tipo mixto (descriptivo y correlacional).
ParticipantesHombres y mujeres, de edades ≥ 60 años, con deterioro cognitivo o voluntarios cognitivamente normales y sin otras patologías que incidieran en la evaluación fueron reclutados desde centros del adulto mayor (Recoleta, Santiago Centro y Las Condes) y centros clínicos (Hospital Clínico Universidad de Chile, Consultorio Rosita Renard de Ñuñoa y Hospital San José de Melipilla). Se excluyó a pacientes analfabetos, con alteraciones sensoriales importantes, patologías médicas descompensadas, enfermedades psiquiátricas y demencia moderada a severa. Los participantes se clasificaron de acuerdo con la evaluación clínica en cognitivamente normales, con demencia leve y con DCL, a su vez subdivididos en DCL-a y DCL no amnésico (DCL-na). Para la estimación del tamaño muestral mínimo para controles, DCL y demencia leve se utilizaron 3 tablas de contingencia por razones de verosimilitud, considerando una hipótesis unilateral, prevalencia y proporción de falsos positivos, de acuerdo con la corrección de Fleiss y esperando un mínimo del 75% de sensibilidad y especificidad.
ProcedimientoEl estudio fue aprobado por el Comité de Ética de la Facultad de Medicina y el Hospital Clínico de la Universidad de Chile. Todos los adultos mayores firmaron un consentimiento informado. Se consideró como estándar de oro el diagnóstico clínico basado en la entrevista semiestructurada del Clinical Dementia Rating (CDR)29 y de acuerdo con los criterios para demencia del Manual Diagnóstico y Estadístico de los Trastornos Mentales, 4.ª edición, y para DCL de Petersen et al.6,8 y Albert et al9. La clasificación CDR=0, CDR=0,5 y CDR=1 corresponde a individuos cognitivamente sanos, con DCL y demencia leve, respectivamente29. El diagnóstico de DCL-a y DCL-na fue definido según la queja principal (memoria u otra función cognitiva) del paciente e informante y de acuerdo con el CDR con sus 6 subítems (memoria, orientación, razonamiento y resolución de problemas, actividades fuera del hogar, actividades domésticas y autocuidado)29. Sobre la base de ello se clasificó a los pacientes en DCL-a, aquellos que tenían un deterioro en la memoria episódica progresivo, pero sin afección importante de la funcionalidad previa, correspondiendo a una forma muy inicial de Alzheimer (DCL tipo Alzheimer según criterios Albert et al.9), y en DCL-na, a todos aquellos individuos con cambios cognitivos que afectaban a otras áreas cognitivas distintas a la memoria. De esta manera, el grupo DCL-na incluyó a todos aquellos participantes que no tenían cognición normal, pero no eran DCL-a, siendo por ello un grupo muy heterogéneo. Los test MoCA-S y MMSE fueron aplicados por 2 profesionales entrenados en los respectivos centros comunales y clínicos participantes. Los resultados del MMSE en el grupo DCL-na no se incluyeron en el análisis debido a que los datos eran incompletos. La versión oficial del MoCA-S en español (http://www.mocatest.org/pdf_files/test/MoCA-Test-Spanish.pdf) se modificó para adaptarlo a nuestro entorno sociocultural cambiando «cara» por «rostro» y «comuna» por «localidad», y se puntuó, siguiendo las recomendaciones de los autores, en 7 subítems: visuoespacial/ejecutivo, identificación, atención, lenguaje, abstracción, recuerdo diferido y orientación (www.mocatest.org). Luego de la aplicación de los test, los sujetos fueron evaluados por neurólogas en forma ciega al resultado de los test, en presencia de un informante válido y con un intervalo no superior a 3 meses desde la aplicación del MoCA-S y el MMSE. Para el cálculo de fiabilidad inter e intraevaluador se aplicó el mismo test a submuestras de sujetos 10 días después de la primera evaluación.
Análisis estadísticoPara determinar la validez discriminativa del MoCA-S se realizaron 3 tipos de análisis: 1) se compararon los rendimientos del MoCA-S, ajustados por edad, sexo y educación en los distintos grupos mediante el test ANCOVA y análisis post hoc de Bonferroni; 2) se calcularon las medias estandarizadas y los intervalos de confianza del 95%, así como el tamaño del efecto de acuerdo con Cohen30, para determinar la magnitud de las diferencias, y 3) se construyeron curvas Receiver Operating Characteristic (ROC) y se comparó el área bajo la curva (ABC) con el método de Hanley y McNeil31, considerando significativas las diferencias de puntajes z ≥ 1,5, clasificando ABC ≥ 0,9 como excelente, entre 0,89 y 0,8 como buena y<0,8 como pobre32. Se determinaron la sensibilidad, la especificidad, los valores predictivos positivos y negativos,y los intervalos de confianza del 95%. El punto de corte del máximo rendimiento se calculó utilizando el índice de Youden y priorizando especificidad por sobre sensibilidad, para disminuir falsos positivos. La validez convergente entre MoCA-S y MMSE se realizó mediante análisis de correlación de Pearson. La consistencia interna se evaluó mediante α de Cronbach y la fiabilidad mediante el coeficiente de correlación de Spearman. Los análisis se realizaron mediante el software estadístico SPSS17.
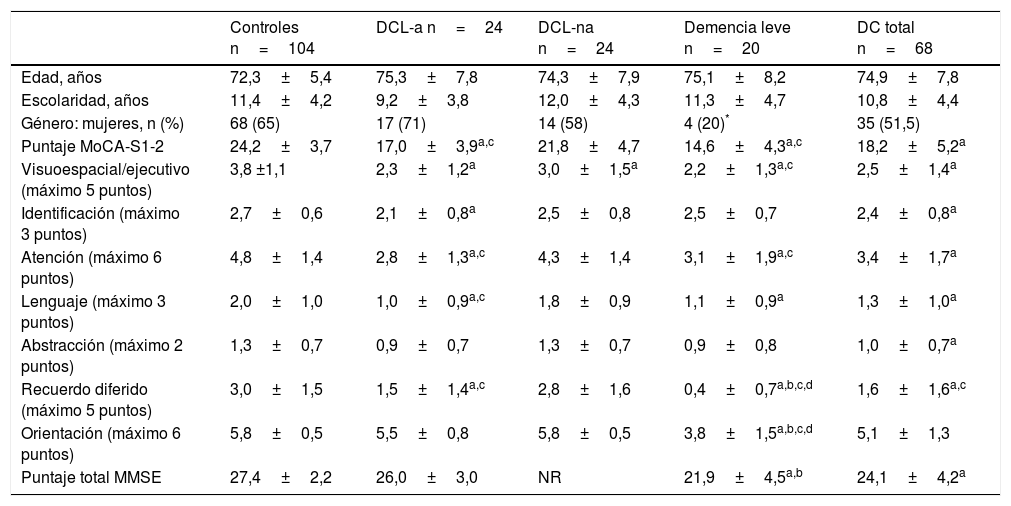
ResultadosCaracterísticas de la muestraDe un total de 404 adultos mayores reclutados, se incluyó a 172, luego de aplicar criterios de inclusión y exclusión. Los participantes se distribuyeron en 104 cognitivamente normales (grupo control, CDR=0); 48 en DCL (CDR=0,5), subdivididos en 24 DCL-a y 24 DCL-na, y 20 con demencia leve (CDR=1). A su vez, se agrupó a todos aquellos con deterioro cognitivo (DCL + demencia) en el grupo deterioro cognitivo total (DC) (tabla 1). No hubo diferencias significativas en edad ni escolaridad entre los distintos grupos. Un 17% de la muestra (n=30) tenía escolaridad ≤ 6 años. El grupo demencia tenía mayor proporción de varones.
Datos demográficos y medias de las distintas puntuaciones del MOCA-S, MoCA-S1, MoCA-S1-2 y MMSE
| Controles n=104 | DCL-a n=24 | DCL-na n=24 | Demencia leve n=20 | DC total n=68 | |
|---|---|---|---|---|---|
| Edad, años | 72,3±5,4 | 75,3±7,8 | 74,3±7,9 | 75,1±8,2 | 74,9±7,8 |
| Escolaridad, años | 11,4±4,2 | 9,2±3,8 | 12,0±4,3 | 11,3±4,7 | 10,8±4,4 |
| Género: mujeres, n (%) | 68 (65) | 17 (71) | 14 (58) | 4 (20)* | 35 (51,5) |
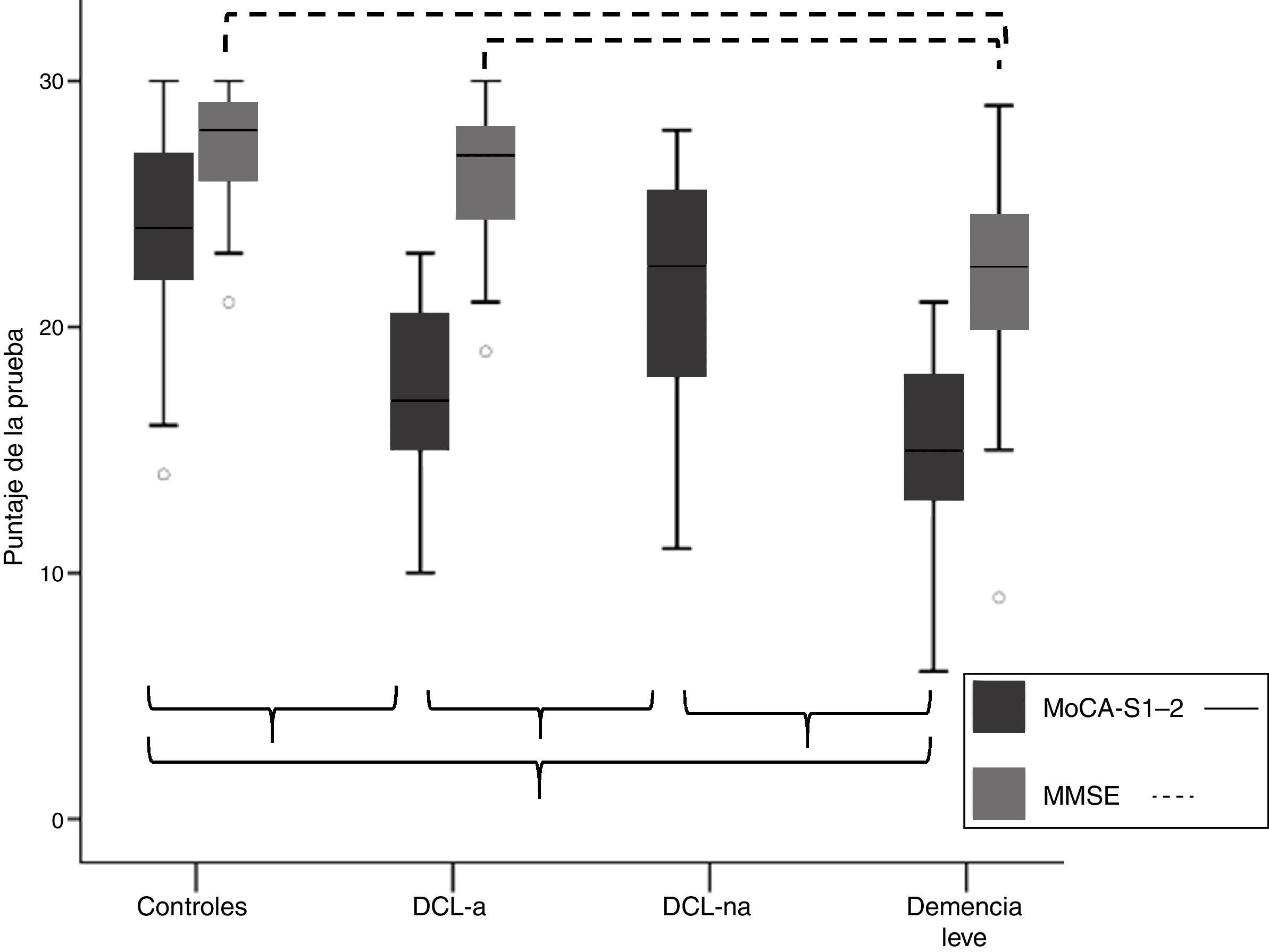
| Puntaje MoCA-S1-2 | 24,2±3,7 | 17,0±3,9a,c | 21,8±4,7 | 14,6±4,3a,c | 18,2±5,2a |
| Visuoespacial/ejecutivo (máximo 5 puntos) | 3,8 ±1,1 | 2,3±1,2a | 3,0±1,5a | 2,2±1,3a,c | 2,5±1,4a |
| Identificación (máximo 3 puntos) | 2,7±0,6 | 2,1±0,8a | 2,5±0,8 | 2,5±0,7 | 2,4±0,8a |
| Atención (máximo 6 puntos) | 4,8±1,4 | 2,8±1,3a,c | 4,3±1,4 | 3,1±1,9a,c | 3,4±1,7a |
| Lenguaje (máximo 3 puntos) | 2,0±1,0 | 1,0±0,9a,c | 1,8±0,9 | 1,1±0,9a | 1,3±1,0a |
| Abstracción (máximo 2 puntos) | 1,3±0,7 | 0,9±0,7 | 1,3±0,7 | 0,9±0,8 | 1,0±0,7a |
| Recuerdo diferido (máximo 5 puntos) | 3,0±1,5 | 1,5±1,4a,c | 2,8±1,6 | 0,4±0,7a,b,c,d | 1,6±1,6a,c |
| Orientación (máximo 6 puntos) | 5,8±0,5 | 5,5±0,8 | 5,8±0,5 | 3,8±1,5a,b,c,d | 5,1±1,3 |
| Puntaje total MMSE | 27,4±2,2 | 26,0±3,0 | NR | 21,9±4,5a,b | 24,1±4,2a |
Datos demográficos y puntajes total de MMSE y MoCA-S1-2 y de sus subítems en los grupos control, DCL-a, DCL-na, demencia leve y DC total. Promedios±desviación estándar.
NR: no realizado.
La consistencia interna de los 7 subítems del MoCA-S (visuoespacial/ejecutivo, identificación, atención, lenguaje, abstracción, recuerdo diferido y orientación) mostró un α de Cronbach de 0,772, considerado bueno. La fiabilidad interevaluador fue muy buena (coeficiente de correlación de Spearman 0,846 bilateral, p<0,01). Respecto a los subítems del MoCA-S, la fiabilidad intraevaluador (n=49) fue buena y significativa en todos los ítems, a excepción de orientación (p=0,308). Los ítems más estables fueron atención, lenguaje, recuerdo diferido e identificación. La fiabilidad intraevaluador (test-retest) fue 0,922 bilateral, p<0,001. Se encontró una correlación significativa e inversa con la edad (r=0,237, p=0,004) y directa con la escolaridad (r=0,408, p<0,001). La correlación con el MMSE mostró una validez convergente significativa (r=0,661, p<0,001).
Dada la alta correlación del MoCA-S con la escolaridad en nuestro y otros estudios23,27, y debido a que el 17% de los participantes tenía ≤ 6 años de escolaridad (20-30% en chilenos > 65 años, según la encuesta Casen Chile 2007)33, se probó la validez discriminativa al adicionar 1 punto si la escolaridad era ≤ 12, como recomendado por Nasredine (MoCA-S1)21, o 2 puntos si la escolaridad era ≤ 8 años y 1 punto si la escolaridad estaba entre 8 y 12 (MoCA-S1-2). Esta última mostró la mejor validez discriminativa, por lo cual basamos nuestros resultados, figuras y tablas en esta puntuación.
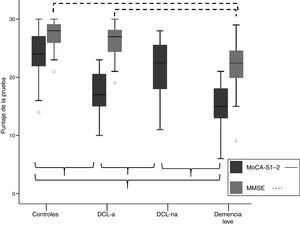
Validez discriminativa del test de Montreal Cognitive Assessment (MoCA-S)Comparación de medias del MoCA-S entre los grupos de clasificación cognitivaLa tabla 1 muestra las medias±desviación estándar (DE) de la puntuación total del MoCA-S1-2, así como el puntaje total del MMSE y los puntajes de los subítems del MoCA. La figura 1 muestra las medias ± DE del MoCA-S1-2 y MMSE según grupos de clasificación cognitiva. El análisis ANCOVA (covariables edad, educación y género) con corrección post hoc de Bonferroni mostró diferencias significativas (F = 45,2, p<0,001) entre las medias del MoCA-S1-2 para todos los grupos, con valores significativamente mayores en el grupo control versus DCL-a y demencia leve, y en el grupo DCL-na versus DCL-a y demencia leve, sin diferencias entre demencia leve y DCL-a, ni entre DCL-na y controles (tabla 1) (fig. 1). En cambio, el MMSE solo mostró diferencias significativas (F = 19,3, p<0,001) entre demencia leve versus controles y DCL-a, sin mostrar diferencias entre controles y DCL-a.
Análisis de tamaño de efectoEl test MoCA-S1-2 tuvo un tamaño de efecto moderado para el diagnóstico de DCL-a (índice r de Pearson=0,692 y d de Cohen=1,90) y bueno para el diagnóstico de demencia leve (r=0,79, d=2,55). Para el diagnóstico de DCL-na, el tamaño de efecto fue bajo (r=0,277, d=0,58). El MMSE tuvo un tamaño de efecto moderado para demencia (r=0,681, d=1,86) y bajo para DCL-a (r=0,22, d=0,45).
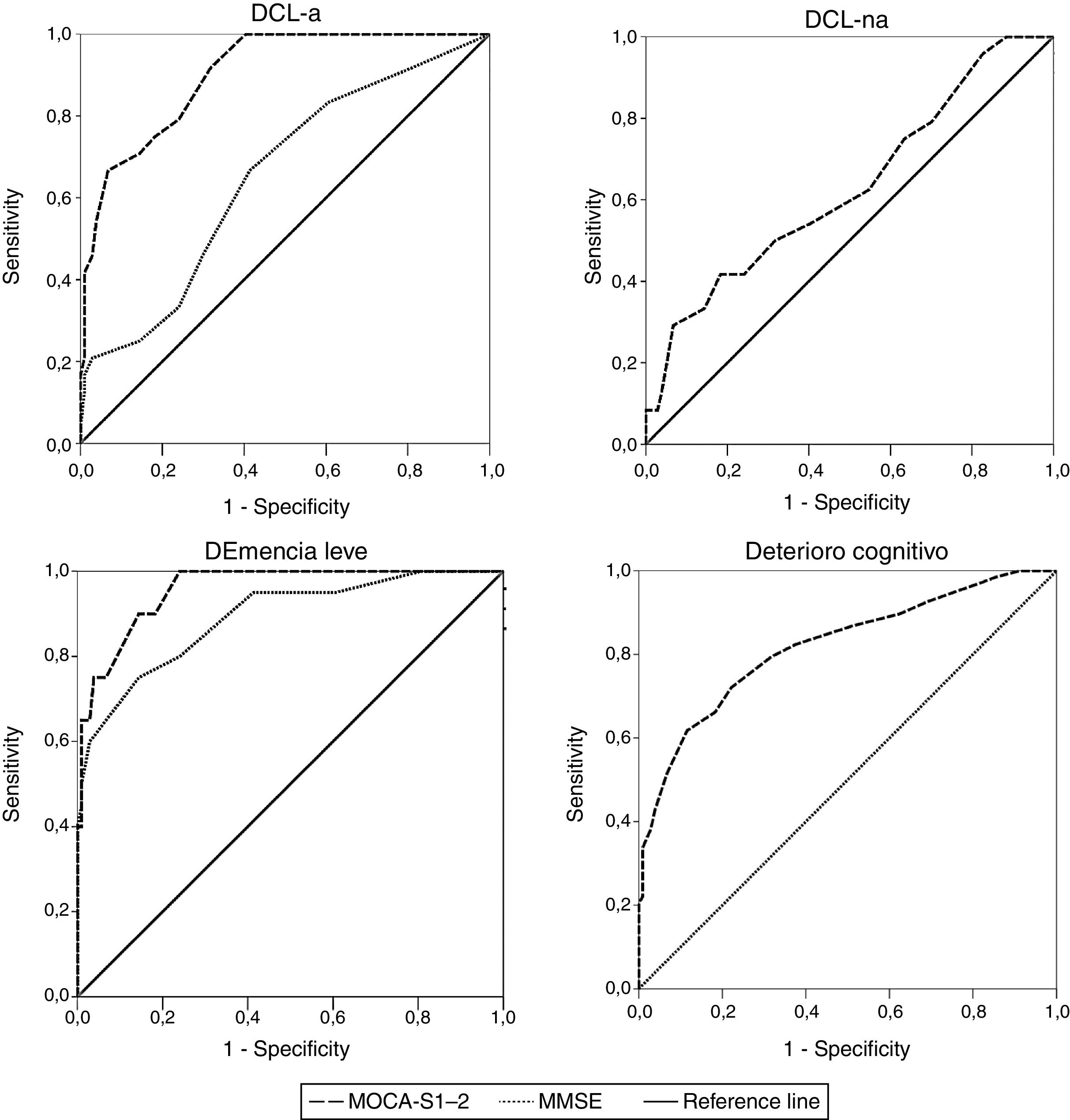
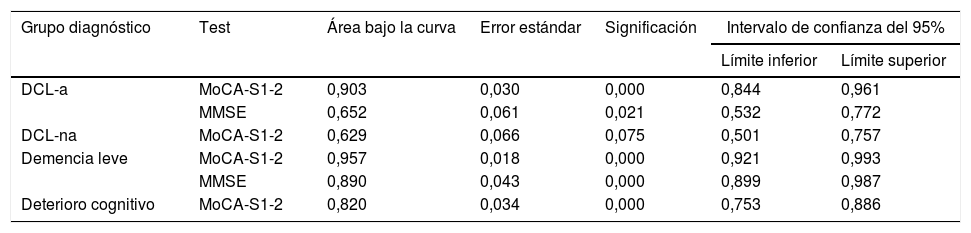
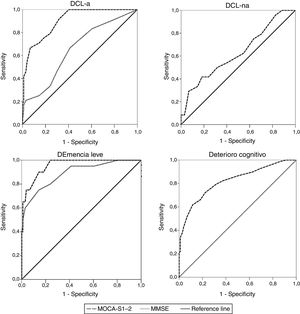
Análisis de curvas receiver operating characteristic (ROC) del MoCA-SLa tabla 2 muestra los valores de ABC de los test MoCA-S1-2 y MMSE para discriminar entre controles versus DCL-a, DCL-na, demencia leve y deterioro cognitivo total (DCL+demencia leve). El MoCA-S1-2 mostró una excelente capacidad para diferenciar entre controles y DCL-a (ABC > 0,9), significativamente mejor que el MMSE (ABC > 0,6, z=3,69) (fig. 2). Para demencia leve, la capacidad discriminativa del MoCA-S1-2 fue excelente y la del MMSE buena (tendencia no significativa a mejor discriminación con MoCA-S1-2, z=1,39). Para DCL-na no hay datos del MMSE; el MoCA-S1-2 mostró baja capacidad discriminativa (ABC>0,6). Para deterioro cognitivo total (DCL-a+DCL-na+demencia leve) la validez discriminativa con MoCA-S1-2 fue buena (ABC>0,8) (tabla 2) (fig. 2).
Utilidad diagnóstica del MOCA-S1-2 para diferenciar controles de DCL-a, DCL-na, demencia leve y deterioro cognitivo
| Grupo diagnóstico | Test | Área bajo la curva | Error estándar | Significación | Intervalo de confianza del 95% | |
|---|---|---|---|---|---|---|
| Límite inferior | Límite superior | |||||
| DCL-a | MoCA-S1-2 | 0,903 | 0,030 | 0,000 | 0,844 | 0,961 |
| MMSE | 0,652 | 0,061 | 0,021 | 0,532 | 0,772 | |
| DCL-na | MoCA-S1-2 | 0,629 | 0,066 | 0,075 | 0,501 | 0,757 |
| Demencia leve | MoCA-S1-2 | 0,957 | 0,018 | 0,000 | 0,921 | 0,993 |
| MMSE | 0,890 | 0,043 | 0,000 | 0,899 | 0,987 | |
| Deterioro cognitivo | MoCA-S1-2 | 0,820 | 0,034 | 0,000 | 0,753 | 0,886 |
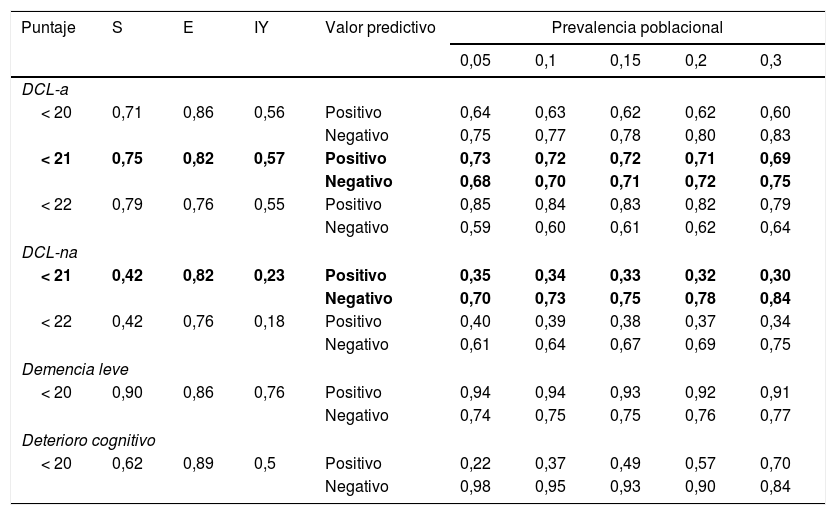
De acuerdo con el índice de Youden, el puntaje de máximo rendimiento del test MoCA-S1-2 fue < 21 puntos para distinguir entre controles y DCL-a (sensibilidad 75%, especificidad 82%) (tabla 3). Con este punto de corte, la sensibilidad y la especificidad para DCL-na fueron del 42 y el 82%, respectivamente. Para distinguir el grupo demencia leve de controles el mejor rendimiento fue con punto de corte < 20 (sensibilidad 90%, especificidad 86%). Para deterioro cognitivo total (DCL+demencia leve) el mejor punto de corte fue también < 20. En la tabla 3 se muestran los valores predictivos positivos y negativos del MoCA-S1-2 considerando prevalencias de deterioro cognitivo entre un 5 y un 30% en > 65 años.
Puntos de corte propuestos para el MOCA-S1-2 considerando distintas prevalencias de deterioro cognitivo y Demencia
| Puntaje | S | E | IY | Valor predictivo | Prevalencia poblacional | ||||
|---|---|---|---|---|---|---|---|---|---|
| 0,05 | 0,1 | 0,15 | 0,2 | 0,3 | |||||
| DCL-a | |||||||||
| < 20 | 0,71 | 0,86 | 0,56 | Positivo | 0,64 | 0,63 | 0,62 | 0,62 | 0,60 |
| Negativo | 0,75 | 0,77 | 0,78 | 0,80 | 0,83 | ||||
| < 21 | 0,75 | 0,82 | 0,57 | Positivo | 0,73 | 0,72 | 0,72 | 0,71 | 0,69 |
| Negativo | 0,68 | 0,70 | 0,71 | 0,72 | 0,75 | ||||
| < 22 | 0,79 | 0,76 | 0,55 | Positivo | 0,85 | 0,84 | 0,83 | 0,82 | 0,79 |
| Negativo | 0,59 | 0,60 | 0,61 | 0,62 | 0,64 | ||||
| DCL-na | |||||||||
| < 21 | 0,42 | 0,82 | 0,23 | Positivo | 0,35 | 0,34 | 0,33 | 0,32 | 0,30 |
| Negativo | 0,70 | 0,73 | 0,75 | 0,78 | 0,84 | ||||
| < 22 | 0,42 | 0,76 | 0,18 | Positivo | 0,40 | 0,39 | 0,38 | 0,37 | 0,34 |
| Negativo | 0,61 | 0,64 | 0,67 | 0,69 | 0,75 | ||||
| Demencia leve | |||||||||
| < 20 | 0,90 | 0,86 | 0,76 | Positivo | 0,94 | 0,94 | 0,93 | 0,92 | 0,91 |
| Negativo | 0,74 | 0,75 | 0,75 | 0,76 | 0,77 | ||||
| Deterioro cognitivo | |||||||||
| < 20 | 0,62 | 0,89 | 0,5 | Positivo | 0,22 | 0,37 | 0,49 | 0,57 | 0,70 |
| Negativo | 0,98 | 0,95 | 0,93 | 0,90 | 0,84 | ||||
E: especificidad; S: sensibilidad; IY: índice de Youden.
En negrita, valores con mejor índice de Youden.
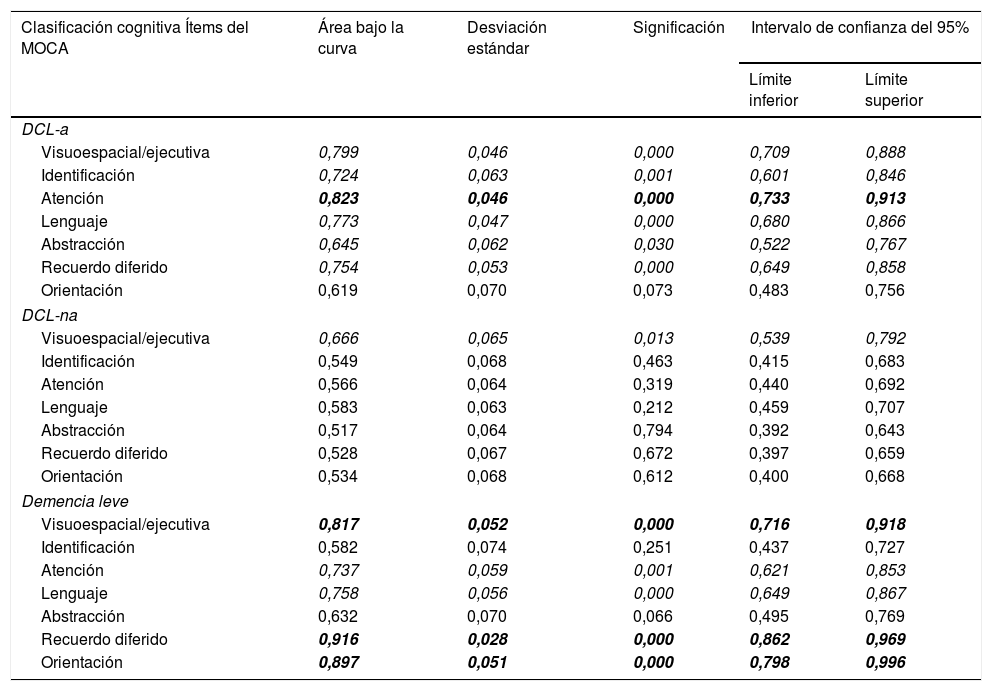
El análisis de curvas ROC por subítem mostró diferencias significativas entre las medias del grupo control y DCL-a en todos los dominios excepto orientación (tabla 4). Los subítems con mayor capacidad discriminativa fueron atención, visuoespacial/ejecutivo, lenguaje y recuerdo diferido. Comparando el grupo control con DCL-na, solo hubo diferencia significativa en el subítem visuoespacial/ejecutivo. Entre el grupo control y demencia leve hubo diferencia significativa en todos los subítems a excepción de abstracción e identificación, siendo los de mayor capacidad discriminativa recuerdo diferido, orientación, visuoespacial/ejecutivo y lenguaje. Comparando los grupos DCL-a y DCL-na, los dominios atención, lenguaje y recuerdo diferido fueron significativamente menores en DCL-a (p<0,05) y comparando demencia y DCL-a los ítems recuerdo diferido y orientación fueron mayores en el grupo DCL-a (p<0,005). Finalmente, comparando DCL-na y demencia, los ítems atención, lenguaje, recuerdo diferido y orientación fueron mayores en el grupo DCL-na (p<0,05).
Comparación de las áreas bajo la curva de los subítems del MOCA-S1-2 para diferenciar a controles de DCL-a, DCL-na y demencia leve
| Clasificación cognitiva Ítems del MOCA | Área bajo la curva | Desviación estándar | Significación | Intervalo de confianza del 95% | |
|---|---|---|---|---|---|
| Límite inferior | Límite superior | ||||
| DCL-a | |||||
| Visuoespacial/ejecutiva | 0,799 | 0,046 | 0,000 | 0,709 | 0,888 |
| Identificación | 0,724 | 0,063 | 0,001 | 0,601 | 0,846 |
| Atención | 0,823 | 0,046 | 0,000 | 0,733 | 0,913 |
| Lenguaje | 0,773 | 0,047 | 0,000 | 0,680 | 0,866 |
| Abstracción | 0,645 | 0,062 | 0,030 | 0,522 | 0,767 |
| Recuerdo diferido | 0,754 | 0,053 | 0,000 | 0,649 | 0,858 |
| Orientación | 0,619 | 0,070 | 0,073 | 0,483 | 0,756 |
| DCL-na | |||||
| Visuoespacial/ejecutiva | 0,666 | 0,065 | 0,013 | 0,539 | 0,792 |
| Identificación | 0,549 | 0,068 | 0,463 | 0,415 | 0,683 |
| Atención | 0,566 | 0,064 | 0,319 | 0,440 | 0,692 |
| Lenguaje | 0,583 | 0,063 | 0,212 | 0,459 | 0,707 |
| Abstracción | 0,517 | 0,064 | 0,794 | 0,392 | 0,643 |
| Recuerdo diferido | 0,528 | 0,067 | 0,672 | 0,397 | 0,659 |
| Orientación | 0,534 | 0,068 | 0,612 | 0,400 | 0,668 |
| Demencia leve | |||||
| Visuoespacial/ejecutiva | 0,817 | 0,052 | 0,000 | 0,716 | 0,918 |
| Identificación | 0,582 | 0,074 | 0,251 | 0,437 | 0,727 |
| Atención | 0,737 | 0,059 | 0,001 | 0,621 | 0,853 |
| Lenguaje | 0,758 | 0,056 | 0,000 | 0,649 | 0,867 |
| Abstracción | 0,632 | 0,070 | 0,066 | 0,495 | 0,769 |
| Recuerdo diferido | 0,916 | 0,028 | 0,000 | 0,862 | 0,969 |
| Orientación | 0,897 | 0,051 | 0,000 | 0,798 | 0,996 |
En cursiva: nivel de significación < 0,05; en cursiva y negrita: nivel de significación < 0,05 y ABC ≥ 0,8.
Este estudio determinó las propiedades psicométricas y la validez discriminativa del puntaje total y por subítems del test MoCA-S para el diagnóstico de DCL-a, DCL-na y demencia leve, basados en el diagnóstico clínico como estándar de oro, en una muestra total de 172 sujetos reclutados desde distintos centros clínicos y comunitarios de Santiago de Chile. Encontramos que el MoCA-S presenta buenas capacidades psicométricas, pero con un gran efecto de la escolaridad, por lo que se adicionó 1 punto si la escolaridad era entre 8 y 12, y 2 puntos si la escolaridad era < 8 (MoCA-S1-2). Con ello el MoCA-S1-2 resultó una prueba válida y útil y para el diagnóstico de DCL-a y demencia leve, menos discriminativa para DCL-na. Así mismo, el MoCA-S1-2 fue superior al MMSE para la discriminación de DCL-a y demencia leve. El ítem visuoespacial/ejecutivo fue el único discriminativo en todas las comparaciones, mientras que atención y recuerdo diferido mostraron alta validez discriminativa en DCL-a y demencia, respectivamente.
Los puntajes medios obtenidos en los distintos grupos diagnósticos de nuestro estudio están dentro del rango de los reportados en la literatura con el MoCA-S, pero existe mucha variación en los puntajes promedios en relación con la escolaridad de la población estudiada. En el estudio de validación realizado en España por Lozano Gallego et al.23 en una población de edades algo menores (media de 68,8 versus 73,3 años) y media educacional inferior a la de este estudio (7,15 versus 11,0 años) se reportó una media (corregida por escolaridad) similar a la del presente trabajo para el grupo DCL, pero más de 3 puntos inferior para el grupo control, 19,83 versus 23,4. En Latinoamérica las únicas validaciones del MoCA-S fueron realizadas en Colombia. Gómez et al.28, en una población de adultos mayores sin demencia y muy baja escolaridad (promedio 4,8 años), reportaron un alto efecto de esta en los resultados del MoCA. Así, en sujetos con menos de 5 años de escolaridad o analfabetos el puntaje promedio fue 17,1, en aquellos con educación primaria completa (5 años) 18,9 y en aquellos con más de 5 años de escolaridad, 21,6 puntos. En otro estudio en Colombia en personas con promedio de edad de 73 años se encontraron variaciones importantes en el rendimiento del MoCA según la escolaridad y el estrato socioeconómico, con puntajes promedios de 15 en personas sin escolaridad y de 25 puntos en aquellas con estudios universitarios completos34. En cambio, en un estudio en Bogotá, en una población con alto nivel de escolaridad (promedio 12 años), Gil et al.26 encontraron medias significativamente más altas, con 25,2 puntos en el grupo control.
El punto de corte para DCL < 21 resulta bastante más bajo que el indicado en la versión original21, pero es consistente con la mayoría de las validaciones internacionales del MoCA. Así, estudios de validación a nivel de la comunidad en Estados Unidos también reportan valores de corte más bajos24,35; Luis et al.24 indican un punto de corte < 23, ya que con < 26 puntos se generaba muy baja especificidad (35%), y Rossetti et al.35 en un estudio comunitario con 2.653 participantes sin deterioro cognitivo encontraron un promedio de 23 puntos, con un 66% de los participantes bajo el punto de corte de 26. En los estudios del MoCA-S también se recomiendan puntos de cortes más bajos. El estudio en España indica un punto de corte < 21 para DCL y < 14 para demencia23, mientras que el estudio colombiano en población de alta escolaridad sugiere puntos de corte < 23 para DCL y demencia26. Las validaciones del MoCA en países asiáticos también reportan puntos de corte más bajos que el propuesto en la versión original y similares a los obtenidos en este estudio: < 22 en la versiones cantonés36 y < 23 puntos en la de Beijing37. Una validación reciente de MoCA cantonés en el sur de China38 mostró punto de corte < 23 para DCL-a (sensibilidad 78% y especificidad 73%) y < 20 para demencia (sensibilidad 94% y especificidad 92%). Existe discusión sobre las ventajas de mejorar la sensibilidad versus la especificidad en la detección de deterioro cognitivo39. Considerando los costos asociados a la derivación a atención secundaria de sujetos clasificados como falsos positivos, nosotros preferimos priorizar la especificidad por sobre la sensibilidad, favoreciendo puntos de corte más bajos.
Existen pocos datos en la literatura sobre la aplicación del MoCA haciendo distinción entre pacientes con DCL-a y DCL-na. En un estudio en pacientes con enfermedad cardiovascular, el MoCA con un punto de corte < 24 tuvo una sensibilidad del 100% para DCL-a y el 83% para DCL-na, con especificidades del 50 y 53%, respectivamente40. En otro estudio de personas evaluadas un año posterior a un accidente cerebrovascular o isquemia transitoria, clasificándolos en DCL-a y DCL-na, nuevamente el MoCA fue más útil para el diagnóstico de DCL-a, con un punto de corte < 25 obtuvieron una sensibilidad para DCL-a del 100% y una especificidad del 83%, mientras que para DCL-na usando ese punto de corte la sensibilidad fue del 75%. Los autores discuten que la baja sensibilidad del MoCA en DCL-na puede relacionarse con la falta de pruebas dependientes de velocidad de procesamiento41,42. Nuestros resultados con el MoCA-S1-2 con punto de corte < 21 muestran una muy buena discriminación para DCL-a (con ABC=0,903, especificidad del 82% y sensibilidad del 75%). En el grupo no amnésico, en cambio, el MoCA-S1-2 no muestra buena discriminación (ABC = 629, sensibilidad del 42% y especificidad del 82%), lo que es concordante con la heterogeneidad del grupo en nuestra muestra. Por otra parte, el grupo DCL-na en este estudio tenía menos deterioro cognitivo, con una media no significativamente diferente a la del grupo control. En el caso de demencia, el MoCA-S1-2 con punto de corte < 20 mostró muy buena discriminación (ABC=0,957, sensibilidad del 90% y especificidad del 86%) (tabla 3) (fig. 2).
Al comparar las curvas ROC entre MoCA-S1-2 y MMSE como test de contraste para la distinción entre el grupo control y DCL-a, las ABC fueron significativamente mejores para el MoCA-S1-2 (0,903 versus 0,652; z=3,7). En cambio, para la distinción entre los grupos control y demencia ambos test fueron buenas, con una diferencia no significativa a favor del MoCA-S (ABC 0,957 para el MoCA-S y 0,890 para el MMSE; z=1,4). Por lo tanto, el MMSE es adecuado para la detección de demencia pero no para la detección de DCL.
Al realizar un análisis por subítems, destaca que el ítem «recuerdo diferido» no haya sido el más discriminativo en DCL-a. Esto podría deberse a que la inclusión de solo 5 palabras sea poco sensible para amnesias leves, lo cual ocurre también con otras pruebas de memoria «cortas» como el Memory Impairment Screen43, que incluye solo 4 palabras y es válido en etapas de demencia, pero no en DCL. Algo similar ocurre con el «foto test», cuya prueba de memoria incluye 6 objetos, y no resulta muy sensible en etapas de DCL, pero sí en etapas de demencia44. En cambio, las pruebas de memoria más largas han demostrado tener incluso un valor predictivo para aquellos DCL que se convertirán a demencia45.
El subítem «visuoespacial/ejecutivo», en cambio, discriminó a los controles comparados con todos los otros grupos, siendo el único que discriminó el DCL-na. Además, tuvo buen nivel de discriminación para DCL-a y demencia leve con ABC ≥ 0,8. Esta alta sensibilidad ya había sido demostrada46,47 y puede deberse a que las funciones ejecutivas están alteradas precozmente en la EA y en otras demencias45. Los puntajes de atención fueron levemente menores en DCL-a comparado con demencia leve (aunque la diferencia no es significativa). Esto podría deberse a que el grupo DCL-a tenía muy baja escolaridad y justamente el ítem atención fue el de mayor correlación con la escolaridad. Otros ítems altamente discriminativos entre controles y DCL-a y demencia leve fueron atención, recuerdo diferido y lenguaje. Es importante destacar que 3 de los subítems con mejor capacidad discriminativa (visuoespacial/ejecutivo, atención y lenguaje) están compuestos por varios subítems a su vez. Por otra parte, atención, recuerdo diferido y lenguaje fueron los ítems más estables en test y retest. Por ello, se podría plantear que los ítems visuoespacial/ejecutivo, lenguaje, atención y recuerdo diferido son válidos y fiables en poblaciones con escolaridades medias a altas como la de este estudio y que eventualmente podrían ser utilizables de manera aislada. De hecho, se han formulado distintas versiones abreviadas del MoCA test: mini-MoCA46, short-MoCA47, MoCA 5min protocol48, T-MoCA short49 50 y MEFO50, en las cuales se han utilizado parte de estos 4 ítems o bien sacando la parte visuoespacial y agregado la orientación para poder usarlo vía telefónica. Estas versiones han tenido muy buena validez con respecto al test original: el T-MoCA short49, MoCA 5min protocol48 y MEFO50 incluyen memoria (recuerdo diferido), fluidez (fonológica con la letra p) y orientación, pero con distintas formas de puntuarlos, siendo el MEFO una prueba de 13 puntos validada en Chile por nuestro grupo50.
Como limitante cabe señalar que nuestra población de adultos mayores tiene una escolaridad superior a la media nacional y se excluyó a los analfabetos, por lo cual nuestros datos no son extrapolables a poblaciones con muy baja escolaridad, como reportado por Gómez et al.28 en Colombia. Los ítems más discriminativos en nuestro estudio tuvieron alta correlación con la escolaridad (r > 0,3) y en el estudio de Gómez et al.28 fueron los de mayor problema en la gente de baja escolaridad: visuoespacial/ejecutivo (imposibilidad de completar el trail making, reloj ni cubo), atención (por imposibilidad de realizar las restas seriadas) y la fluencia verbal fonológica (por escaso vocabulario). Por este motivo, en estas poblaciones es necesario adaptar la prueba, cambiando estos ítems por otros o, mejor aún, utilizar otra prueba28. Creemos, por lo tanto, que el MoCA-S es útil y confiable para el diagnóstico de DCL-a y demencia en poblaciones con niveles medios a altos de escolaridad, no recomendamos su uso en población de muy baja escolaridad.
FinanciaciónFondecyt 1110189, 1151297 (MIB) y ACT1403 (CD).
Conflicto de interesesLos autores declaran no tener conflictos de interés.
Este trabajo fue presentado en el 66.° Congreso Anual de la Sociedad de Neurología Psiquiatría y Neurocirugía (SONEPSYN), Pucón, Chile, 2011.