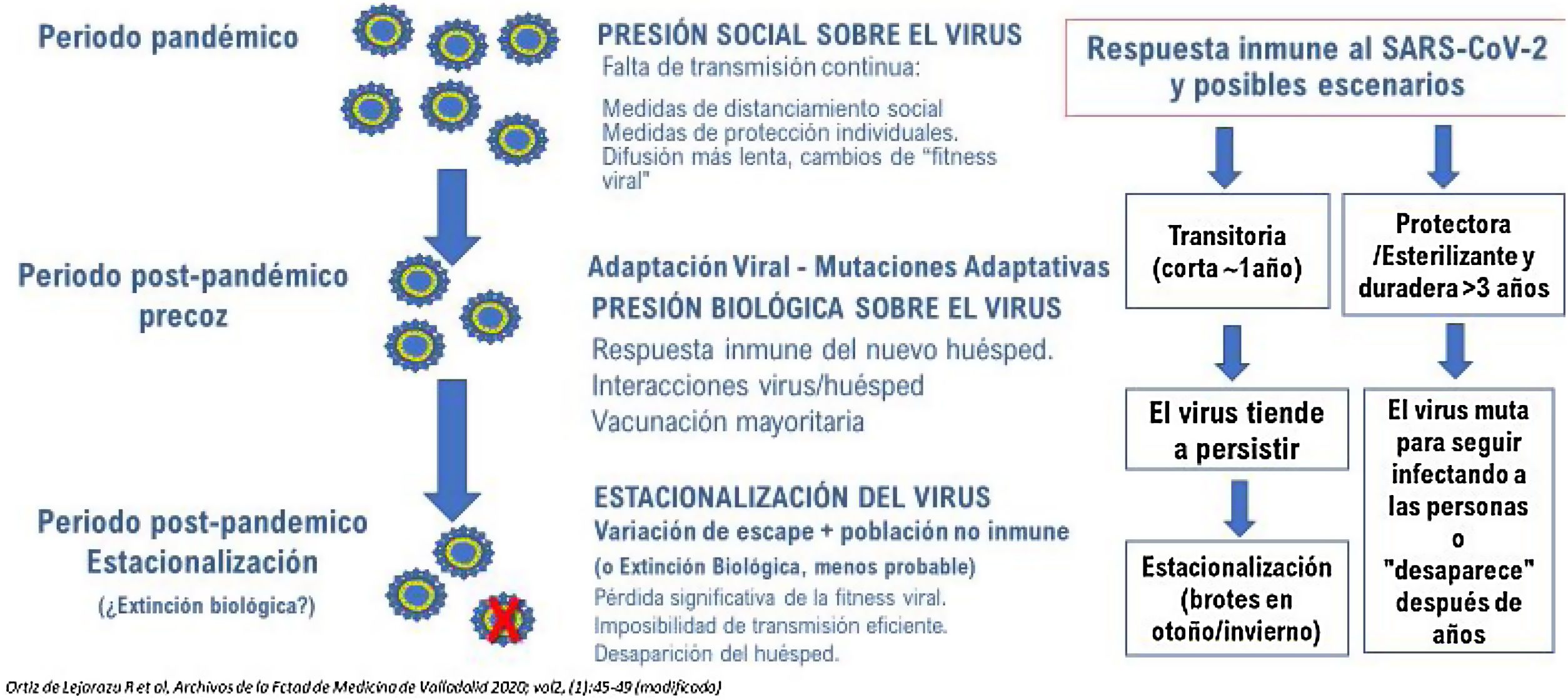
Con vacunas efectivas para SARS-CoV-2 que permitan la finalización de la pandemia de COVID-19 en el plazo de 1-2 años, en el periodo post pandémico es clave el mantenimiento de la inmunidad contra el virus1. El futuro de la vacunación frente al SARS-CoV-2 dependerá fundamentalmente de tres factores interrelacionados: la efectividad y naturaleza de las vacunas, la confianza de las personas en ellas y las estrategias vacunales junto con la evolución del virus fruto de la presión biológica inmune en tres escenarios distintos: el escenario pandémico, el post pandémico precoz y el post pandémico tardío, en los que la difusión e impacto del SARS-COV-2 necesariamente cambiará (fig. 1).
Se sabe que los coronavirus endémicos causan infecciones del tracto respiratorio superior asintomáticas o leves y su seroprevalencia aumenta desde la infancia hasta la edad adulta, con reinfecciones separadas por años o meses, en su mayoría asintomáticas, facilitando su persistencia2. Por otra parte, hay una gran proporción de infecciones por SARS-CoV-2 asintomáticas o leves que inducen una inmunidad menor y otras con diseminación pulmonar y sistémica, que inducen una inmunidad mayor y más duradera3.
Distintos interrogantes conforman el futuro de la vacunación frente a SARS-CoV-2. Dejando aparte la duración de la protección, los correlatos exactos de protección o la necesidad de revacunaciones a los 9-10 meses de la primera dosis de algunas vacunas, hay otros factores más importantes sobre la evolución del virus y su impacto en el número reproductivo básico de la infección (R0) y la efectividad de las vacunas actuales. La primera variante vírica, consecuencia de la mutación 614G, se hizo dominante en todo el mundo en un periodo inferior a dos meses, demostrando así su mayor infecciosidad. Las sucesivas variantes de preocupación (concern) aparecidas en distintos continentes del mundo; B.1.1.7 (británica. Alfa), B.1.351 (sudafricana, Beta), P.1 (brasileña y japonesa, Gamma) y la B.1.617 (india, Delta) logran evadir en mayor medida los efectos protectores conferidos por la vacuna4, aunque persiste una inmunidad de base celular ligada a linfocitos T CD45 y persiste una protección importante frente a enfermedad grave y muerte. Esas variantes, fruto de mutaciones deleciones o inserciones, afectan no sólo a la proteína S1 o a la región RBD, sino también a otras proteínas estructurales del virus. Esto es importante ya que cuando aparecen variantes con mayor difusión su R0 es mayor y la difusión más rápida, si además las variantes hacen disminuir la efectividad de las vacunas, ambos factores hacen que la cobertura necesaria para alcanzar la inmunidad colectiva sea superior al 70%.
La evolución de los coronavirus endémicos no es bien conocida y es posible que su emergencia en el pasado, más letal que la actual, se haya confundido con pandemias de gripe6. Tras la emergencia pandémica, las infecciones de la niñez y las reinfecciones en la edad adulta fortalecen y mantienen la inmunidad. La seroprevalencia frente a estos coronavirus en la población es del 60 al 70% y se mantiene dinámicamente por reinfecciones que refuerzan la inmunidad grupal protegiendo indirectamente de infecciones graves a los vulnerables3. Por lo tanto, es probable que el SARS-CoV-2 permanezca presente en la población7. En ocasiones y en áreas geográficas aisladas sin vacunar, la reintroducción del virus podría ocasionar brotes de mayor o menor amplitud.
El concepto de inmunidad de grupo en las infecciones respiratorias es complejo y distinto de otras infecciones, abarcando desde la infección natural hasta la vacunación, pasando por las reinfecciones y revacunaciones periódicas que modulan y dirigen la inmunidad colectiva8. Por todo ello, las vacunas de la siguiente generación deberán adaptarse a la evolución del virus y a su respuesta en humanos en los escenarios mencionados al inicio. El desarrollo de vacunas actualizadas o polivalentes que incluyan las variantes que escapan más al efecto de las vacunas deberá ser prioritario9. En el periodo pandémico agudo la estrategia de proteger sanitarios, vulnerables y servicios esenciales o de gran interacción social, deberá dar paso paulatinamente en el periodo post pandémico precoz al refuerzo de las personas vulnerables o aquellas otras que lo precisen en razón de su actividad social. Si estos aspectos se descuidan, se podrían dar retrocesos que hicieran perder la confianza en la vacunación y volvieran a experimentar estrés los hospitales. Las modernas plataformas de producción de vacunas permiten cambios de la diana del virus con bastante agilidad y algunos países ya han legislado su actualización, de forma similar a las de las vacunas de gripe. Sin embargo, puede haber durante ese escenario pandémico desfases y cuellos de botella en el suministro que deberán ser anticipados o previstos por los expertos. Por último, se deberá afrontar el debate sobre la vacunación de los niños, ya que ninguna viriasis respiratoria emergente puede ser controlada sin la prevención de la infección en los niños y adolescentes10.
En el escenario post pandémico precoz algunos de los factores mencionados anteriormente serán mejor comprendidos (duración de la protección, rol de la inmunidad celular, imprinting natural, etc.) la estrategia será entonces centrar la vacunación en aquella población más susceptible de enfermedad grave por SARS-CoV-2 que precise dosis de recuerdo. También será importante conocer el efecto de otras pautas de vacunación, de la alternancia de dosis o de vacunas distintas o el refuerzo producido por vacunas proteicas, de nanopartículas, adyuvadas, etc. que serán aprobadas en los próximos meses11. Todo ello requiere de respuestas e instrucciones coherentes que refuercen la confianza de la población en las vacunas, las soluciones «políticas» suelen ser las peores en este escenario.
Con los conocimientos actuales todo apunta a que este virus ha venido para quedarse y se desconoce el tiempo que tardará en minimizar sus efectos, si es que lo llega a hacer7,12. Por tanto, este nuevo agente etiológico de la neumonía adquirida en la comunidad con connotaciones clínicas sistémicas importantes y graves, precisará su inclusión específica en el calendario vacunal del niño y del adulto, con indicaciones justificadas que escapan al alcance de este artículo.
A diferencia de los virus de la gripe con gran potencial de variación genética, hasta ahora en el SARS-CoV-2, sólo las mutaciones en el gen S han generado variantes con resistencia parcial a anticuerpos generados por infecciones anteriores o vacunas. La aparición geográfica de mutantes de escape del SARS-CoV-2 debe tenerse en cuenta en el diseño y administración de vacunas, pero no debería influir en el logro de inmunidad colectiva de la población que en el periodo pandémico supone convertir a individuos naive en no naive. Bastaría con suficiente inmunidad cruzada (incluida la inmunidad celular) y la combinación de infecciones naturales de menor gravedad que reforzarían la protección, especialmente la inmunidad de mucosas5,12, para que la revacunación fuera sólo necesaria en determinadas personas o ante la aparición de mutantes de escape de difusión amplia.
En el escenario post pandémico tardío, la vacunación contra SARS-CoV-2 para las personas vulnerables dependerá más del grado de inmunidad poblacional que del individual. La inmunidad poblacional reducirá progresivamente tanto la carga viral excretada por cada individuo como la propagación del virus. Esto reducirá la difusión, evitará casos clínicos y reducirá la carga de enfermedad en la población, protegiendo indirectamente a los más vulnerables, pero es probable que no logre detener completamente la propagación viral. Por tanto, es plausible que con el tiempo el SARS-CoV-2 se convierta en el quinto coronavirus endémico y sea objeto de una atención más específica en nuestros calendarios de vacunación y en nuestra práctica clínica. El desarrollo de una vacuna pancoronavírica o universal, sino frente a todos los coronavirus al menos frente a todos los Betacoronavirus humanos, es una propuesta en los foros científicos13,14 y podría alcanzarse antes que una vacuna universal frente a la gripe, pero eso es algo para debatir más adelante.