Los niños con parálisis cerebral (PC) tienen mayor riesgo de deficiencia de vitamina D (VD). Aunque existen bastantes estudios sobre VD en PC, hay limitada información sobre suplementación con VD en estos pacientes.
ObjetivoEvaluar el efecto de la suplementación con VD en monodosis en las concentraciones plasmáticas de 25-hidroxi-vitamina-D (25OHD) en niños con PC.
Pacientes y métodoEstudio controlado, prospectivo y aleatorizado. Se estudiaron 30 niños chilenos (19 varones) con PC, mediana de edad de 9,9 años (6,2-13,5). Se registraron las variables clínicas y bioquímicas incluyendo 25OHD (tiempo 0 y 8 semanas). El grupo suplementado (S) recibió 100.000UI D3 oral (tiempo 0), comparado con el grupo placebo (P).
ResultadosEntre las características clínicas destaca: gastrostomizados (60%), desnutrición (30%), postración (93,3%), uso de antiepilépticos (70%) y uso de antiepilépticos inductores del metabolismo de VD (43,3%). Las mediciones basales de variables bioquímicas fueron normales. La 25OHD fue insuficiente en 4/30 y deficiente en 6/30. No hubo asociación de 25OHD con las variables estudiadas. Completaron el estudio 8 pacientes en el grupo S y 10 en el P. En ambos grupos no se observaron diferencias significativas en las variables basales. A las 8 semanas la calcemia, la fosfemia y la fosfatasa alcalina fueron normales en ambos grupos, la 25OHD en el grupo P fue normal en 6/10 e insuficiente+deficiente en 4/10 y normal en 8/8 en el grupo S (test exacto de Fisher, p=0,07).
ConclusionesUna monodosis de 100.000UI de VD podría normalizar las concentraciones de 25OHD en niños con PC. Se necesitan más estudios para confirmar estos resultados.
Children with cerebral palsy (CP) have an increased risk of vitamin D (VD) deficiency. Although there are many studies on VD and CP, there is limited information about VD supplementation in these patients.
ObjectiveTo evaluate the effect of supplementation with a single dose of VD on the plasma concentrations of 25-hydroxy-vitamin-D (25OHD) in children with CP.
Patients and methodProspective-randomised-controlled-trial, including 30 Chilean children (19 males) with CP, median age 9.9 years (6.2-13.5). Clinical and biochemical variables including 25OHD, were recorded (time 0 and 8 weeks). Patients were allocated to the supplemented (S) group receiving 100,000 IU oral D3 at baseline, and compared with the placebo (P) group.
ResultsAmong clinical features are highlighted: gastrostomy (60%), underweight (30%), bed-ridden (93.3%), antiepileptic drugs (70%), and 43.3% used VD metabolism inducing antiepileptics. Baseline biochemical measurements were normal. The 25OHD was insufficient in 4/30 and deficient in 6/30. 25OHD levels were not associated with the variables studied. Eight patients completed the study in the S group, and 10 in P group. The placebo and supplementation groups had no significant difference in baseline variables. Serum calcium, phosphate, and alkaline phosphatase levels at 8 weeks were normal in both groups, with no statistically significant differences. 25OHD in the P group was normal in 6/10, and insufficient+deficient in 4/10, and the S group was normal in all (8/8) (exact Fisher test P=.07).
ConclusionsA single dose of 100,000 IU VD could normalise the concentrations of 25OHD after 8 weeks of supplementation in Children with CP, but more studies are required to confirm these results.
Los niños con parálisis cerebral (PC) poseen una menor densidad mineral ósea y un mayor riesgo de presentar fracturas1–4. En un centro de Estados Unidos en el que controlan niños con osteopenia y osteoporosis un porcentaje importante de los pacientes a atender tienen el diagnóstico de PC5.
La vitamina D (VD) es uno de los factores involucrados para lograr una adecuada salud ósea, la cual posee además otras múltiples propiedades como inmunomodulador que aún están en estudio. Una de ellas es la asociación entre deficiencia de VD y mayor riesgo de presentar infecciones respiratorias virales, pero que en estudios de suplementación de VD los resultados no son concluyentes en demostrar la disminución de este riesgo6. Los niños con PC presentan una mayor prevalencia de insuficiencia y/o deficiencia de VD, principalmente por menor exposición solar (menor deambulación) y por el uso de fármacos antiepilépticos (FAE), ambos factores difíciles de revertir1,7–9. Con la alimentación no se logra cumplir con las recomendaciones de ingesta de VD, incluso con el uso de alimentos fortificados, siendo la suplementación farmacológica una forma de alcanzar un adecuado estado nutricional de VD en estos niños9–13.
Esta suplementación debe ser permanente, siendo para algunos pacientes difícil de cumplir ante los numerosos cuidados que necesitan y los múltiples fármacos que deben recibir. En este sentido, la suplementación con dosis intermitentes y elevadas de VD que pudieran ser seguras y eficientes en lograr suficiencia de VD ha sido poco estudiada.
El objetivo de esta investigación fue estudiar el efecto de una suplementación de VD en dosis única sobre las concentraciones plasmáticas de 25 hidroxi-vitamina D (25OHD) en niños con PC.
Pacientes y métodoEstudio preliminar controlado y aleatorizado. Los sujetos se reclutaron en el Servicio de Neurología Infantil del Hospital Clínico San Borja Arriarán (HCSBA). Los criterios de inclusión fueron: tener diagnóstico de PC y ser residentes de la región metropolitana. Los criterios de exclusión fueron: sospecha o diagnóstico de comorbilidades que pudieran interferir en las concentraciones plasmáticas de 25OHD tales como insuficiencia hepática, síndromes malabsortivos, insuficiencia renal crónica etapa≥iii, estar recibiendo suplementación de VD mayor o igual a 1.000UI/día en los últimos 3 meses y haber estado hospitalizado por más de 15 días en los últimos 3 meses.
El tamaño muestral se calculó asumiendo que ambos grupos tendrían valores semejantes a la inclusión en el estudio, en torno a 15ng/ml de 25 OHD11,12,14,15. Al cabo de las 8 semanas de suplementación el grupo suplementado aumentaría a valores en torno a 25ng/ml y el grupo control no suplementado se mantendría en los valores iniciales9,13. De acuerdo a los estudios en niños chilenos de Santiago, la desviación estándar de estas mediciones está en torno a 7,5ng/ml16. Con un error alfa de 5%, un poder de 80% y una diferencia entre los promedios de ambos grupos al final del periodo de estudio estimada en 0,9DE, se requerirían 11 sujetos por grupo. Asumiendo una pérdida 30% de los sujetos estimamos que el tamaño muestral requerido era de 15 sujetos por grupo.
Para el ingreso al protocolo se realizó una invitación al cuidador principal del niño cuando acudía a un control programado con un neurólogo infantil. Se obtuvo la firma en el consentimiento escrito e informado.
Se recopilaron datos de actividad motora gruesa clasificándola según la Escala internacional de actividad motora gruesa (EIAMG)17: grado i camina sin dificultades; ii camina con limitaciones; iii camina usando apoyo; iv autovalencia limitada (podría usar silla de ruedas); y grado v, postración, transportado en silla de ruedas. Además se obtuvo la vía de alimentación (oral, sonda nasogástrica, gastrostomía o mixta), uso de FAE, consignando si utiliza FAE inductores del metabolismo de VD (fenitoína, fenobarbital, carbamazepina).
Se realizó antropometría: medición de peso en balanza directamente o por diferencia de peso con ayuda de un adulto, talla en podómetro o por estimación por medición de longitud de la tibia (LT) por fórmula: 3,26×LT (cm)+30,8, en donde LT corresponde a la longitud entre tuberosidad anterior de la tibia a maléolo interno18. Con estas medidas se elaboraron los índices T/E e IMC. Para la evaluación nutricional se utilizaron los patrones de referencia para niños y adolescentes con PC, según la actividad motora y el sexo19. Se realizó diagnóstico de talla baja si T/E≤p5, talla normal T/E entre p5-p95, bajo peso si IMC/E≤p10, eutrofia o normal IMC/E p10-p90 y exceso de peso ≥p90.
Se tomó una muestra de sangre en ayunas para 25OHD, calcemia, fosfemia y fosfatasa alcalina (FA). En el laboratorio central del HCSBA se determinó la calcemia, fosfatemia y FA; las muestras de plasma para 25OHD se analizaron una vez completado el estudio utilizando técnica de radioinmunoanálisis (RIA), en el laboratorio del Departamento de Nutrición de la Facultad de Medicina de la Universidad de Chile. Se definió como normal las concentraciones de 25OHD>30ng/ml (>75nmol/l), insuficiencia 20-30ng/ml (50-74nmol/l), deficiencia <20ng/ml (<50nmol/l) y elevada >100ng/ml (>250nmol/l)4,10,20.
La aleatorización se realizó con tabla de números aleatorios por un colaborador independiente al estudio, quien no tuvo acceso a los pacientes ni a la base de datos de esta investigación, el cual etiquetó en frascos numerados las cápsulas idénticas en su exterior de VD o placebo, siendo imposible identificar su contenido por parte del investigador principal, la enfermera, el sujeto de estudio ni los familiares o cuidadores del paciente. La dosis de VD fue de 100.000UIVD3, que corresponde a la dosis utilizada previamente en otras investigaciones21–26.
La asignación de los sujetos a grupo estudio o control se realizó de forma correlativa en la medida que ingresaban en el protocolo por la enfermera, que tomó la muestra supervisada por la investigadora responsable del estudio.
A las 8 semanas se citó para la segunda toma de muestra de sangre.
Los datos se analizaron con el programa STATA 12.0. Se realizó estadística descriptiva. Se analizaron todos los datos con estadística no paramétrica, expresando en mediana con rango intercuartil (RIC) p25-p75, se utilizó test Mann Whitney, correlación de Spearman entre variables cuantitativas, Chi cuadrado para variables categóricas y test exacto de Fisher para evaluar cambios en la proporción de deficientes-insuficientes pre y postsuplementación.
Este trabajo fue aprobado previamente por el Comité de Ética de Investigación en Seres Humanos de la Facultad de Medicina de la Universidad de Chile.
ResultadosSe estudiaron 30 niños, 15 en cada grupo, 19 de ellos correspondieron a varones (63,3%), con una mediana de edad de 9,9 años (6,2-13,5). Todos los sujetos presentaron talla normal, 18 niños (60%) tenían gastrostomía, 20 niños presentaron eutrofia, 9 estaban con bajo peso y un niño era obeso. Según la clasificación de la EIAMG un niño tenía grado i (3,3%), uno grado ii (3,3%) y 28 niños (93,3%) tenían grado v. En cuanto al uso de FAE, 21 niños (70%) recibían FAE y 13 (43,3%) usaban FAE inductores del metabolismo de la VD.
En 20 niños (67,7%) la toma de muestras se realizó en las estaciones de otoño-invierno, y en 10 niños (32,3%) en primavera-verano.
En el tiempo uno se encontró una mediana (RIC) para calcemia de 9,8mg/dl (9,5-10), fosfatemia de 4,7mg/dl (4,1-5,3) y FA de 201UI/l (153-290). La 25OHD presentó una mediana de 36,4ng/ml (26,7-50,7), siendo normal (suficiencia de VD) en 20 niños (66,7%), insuficiente en 4 niños (13,3%) y deficiente en 6 niños (20%). No se encontraron diferencias significativas entre los grupos estudiados. Tampoco hubo asociación entre las concentraciones de 25OHD con diagnóstico nutricional, uso de GTT, uso de FAE inductores, estación del año en que se realizó la medición de 25OHD, ni con la calcemia, fosfematemia y FA.
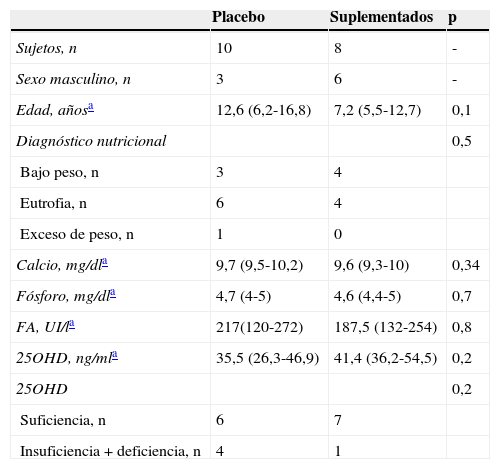
Completaron el estudio 18 niños, 10 en el grupo P y 8 en el grupo S, 2 niños fallecieron previo a la segunda toma de muestras por causas infecciosas (bronconeumonía e infección urinaria alta) y en 10 niños no se concretó la segunda cita del protocolo. Una vez finalizado el estudio se abrió la aleatorización. Al comparar el grupo P y S no se encontraron diferencias significativas en las variables basales estudiadas en el tiempo 1 (tabla 1).
Características basales según los grupos de estudio (análisis por protocolo)
| Placebo | Suplementados | p | |
|---|---|---|---|
| Sujetos, n | 10 | 8 | - |
| Sexo masculino, n | 3 | 6 | - |
| Edad, añosa | 12,6 (6,2-16,8) | 7,2 (5,5-12,7) | 0,1 |
| Diagnóstico nutricional | 0,5 | ||
| Bajo peso, n | 3 | 4 | |
| Eutrofia, n | 6 | 4 | |
| Exceso de peso, n | 1 | 0 | |
| Calcio, mg/dla | 9,7 (9,5-10,2) | 9,6 (9,3-10) | 0,34 |
| Fósforo, mg/dla | 4,7 (4-5) | 4,6 (4,4-5) | 0,7 |
| FA, UI/la | 217(120-272) | 187,5 (132-254) | 0,8 |
| 25OHD, ng/mla | 35,5 (26,3-46,9) | 41,4 (36,2-54,5) | 0,2 |
| 25OHD | 0,2 | ||
| Suficiencia, n | 6 | 7 | |
| Insuficiencia+deficiencia, n | 4 | 1 |
FA: fosfatasas alcalinas; 250HD: 25 hidroxi vitamina D.
En el segundo tiempo se realizó análisis por protocolo. Las medianas (RIC) de las variables para el grupo P fueron: calcemia de 9,7mg/dl (9,5-10,2), fosfatemia de 4,7mg/dl (4-5), las FA de 217 UI/l (120-272). En el grupo S la calcemia fue de 9,6mg/dl (9,3-10), fosfatemia de 4,7mg/dl (4,3-5,1), FA de 187,5UI/l (132-254). La calcemia, fosfatemia y FA fueron normales y sin diferencias significativas entre ambos grupos.
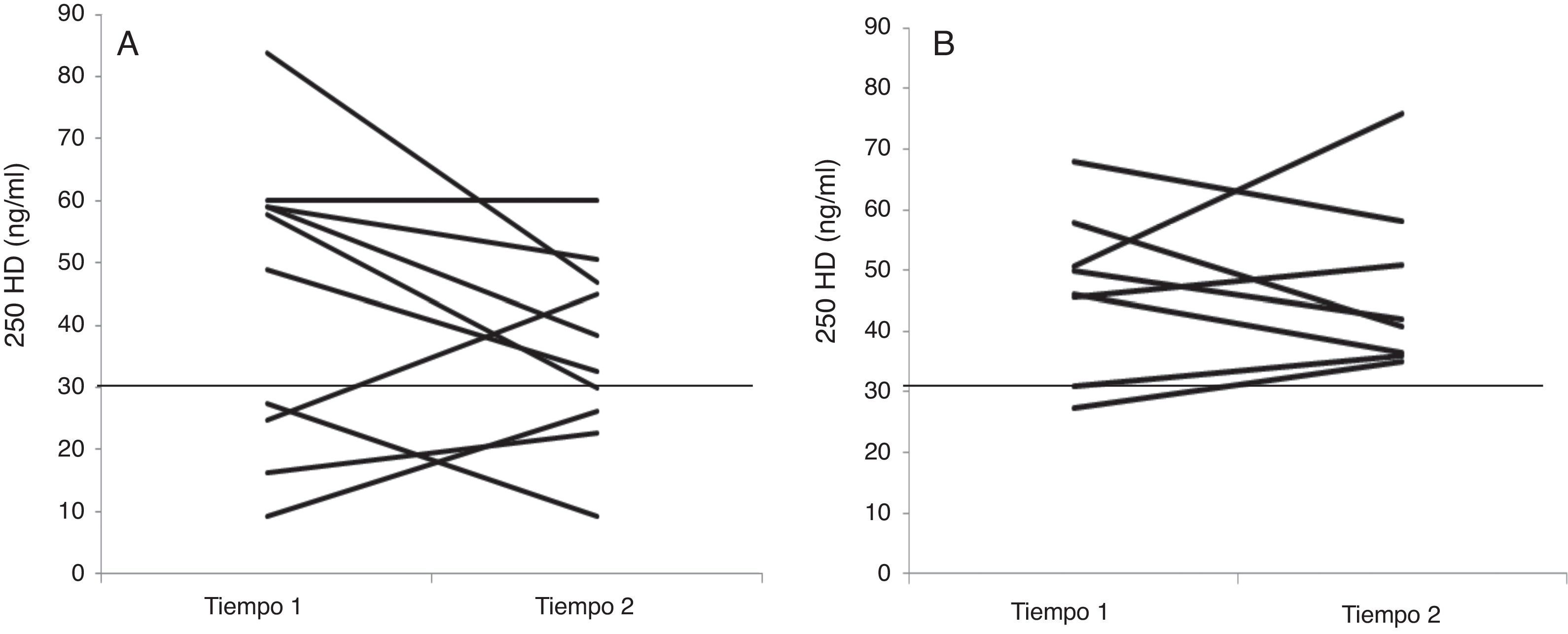
La mediana de 25OHD en el grupo P (10 niños) fue de 35,5ng/ml (26,3-46,9), siendo normal o suficiente en 6 niños e insuficiente+deficiente en 4 niños. En el grupo S (8 niños) la 25OHD tuvo una mediana de 41,4ng/ml (36,2-54,5), siendo normal en los 8 niños del grupo, y no se encontró diferencia significativa entre las proporciones de suficiencia e insuficiencia+deficiencia de VD entre ambos grupos (test exacto de Fisher, p=0,07). En el grupo S ningún niño presentó hipercalcemia o concentraciones de 25OHD mayores a 100ng/dl, la que es considerada de riesgo (fig. 1).
Concentraciones de 25OHDng/ml en el tiempo 0 (tiempo 1) y 8 semanas (tiempo 2). A corresponde al grupo placebo y B al grupo suplementado con monodosis de vitamina D. La línea horizontal en ambas figuras representa la concentración de 25OHD límite entre suficiencia e insuficiencia+deficiencia.
La deficiencia de VD es un problema conocido en niños con PC. Al revisar estudios de otros países se encuentra una gran variabilidad en la presencia de deficiencia de VD en niños con PC. Por ejemplo, en niños con PC moderada a severa de control ambulatorio de Estados Unidos se encontró un 52,6% de deficiencia de VD, y en niños de Sudáfrica con PC institucionalizados los promedios de 25OHD fueron de 8ng/ml en aquellos que tenían el antecedente de fracturas óseas y de 9,4ng/ml en los que no las habían presentado1,8. En otros estudios en que se incluyeron además otras enfermedades con discapacidad motora y/o epilepsia se han encontrado valores promedio de 18ng/ml que corresponden a deficiencia9,13. En esta muestra estudiada tanto las concentraciones de 25OHD como el porcentaje de deficiencia de VD están en una mejor situación si nos comparamos con algunas de las publicaciones previamente analizadas. No conocemos la situación de Chile sobre el estado nutricional de VD en niños con PC, por otro lado en un estudio en escolares aparentemente sanos de Santiago se encontró un promedio de 25OHD de 28,8ng/ml16. Sin embargo, este estudio no fue diseñado para determinar la prevalencia de deficiencia de VD, siendo necesario realizar otras investigaciones con este objetivo.
No se encontró asociación entre los valores de 25OHD y la época del año en que se tomó la muestra al comparar entre los meses con mayor y menor exposición solar; lo que concuerda en otros estudios de niños con PC moderada-severa, lo que se explica por la limitada movilidad que presentan en forma permanente y por su compromiso motor grueso de postración1,7,12. Existen otros factores asociados a deficiencia e insuficiencia de VD, como son el estado nutricional, uso de FAE, uso de FAE inductores, pero tampoco se encontró una asociación, lo que podría explicarse por el tamaño muestral estudiado.
Al analizar las concentraciones de 25OHD en el grupo placebo se pudo ver que la gran mayoría de los niños que presentaron insuficiencia o deficiencia de VD la mantuvieron en ambos tiempos de medición, no así en el grupo suplementado, en que mejoraron las concentraciones de 25OHD de insuficiencia a suficiencia. A pesar de no encontrar una diferencia significativa, es posible observar una tendencia del efecto beneficioso de este tipo de suplementación. Es importante destacar que en el grupo que fue suplementado con VD ningún niño presentó concentraciones elevadas de 25OHD, incluso considerando a los niños que inicialmente tenían concentraciones normales de 25OHD, lo que otorga seguridad al uso de monodosis si se utiliza como prevención o tratamiento de deficiencia de VD en niños con PC como se ha comprobado en otras investigaciones, tanto en niños sanos como con PC21–25.
En los niños que poseen PC o discapacidad motora por otra causa está recomendado requerimientos mayores de VD que en la población general, siendo estos entre 800 a 1000UI/día27. El aporte de VD en la dieta por los alimentos como forma natural, e incluso de aquellos fortificados, es insuficiente. En niños con PC se ha encontrado deficiencia de VD y de otros micronutrientes, incluso en aquellos niños que están suplementados11. Por lo tanto, la suplementación farmacológica adquiere gran importancia. La suplementación de VD ha demostrado mejorar las concentraciones de 25OHD y la densidad mineral ósea en estos niños9,28,29. Estas suplementaciones han sido en distintas dosis diarias de 400 a 2.000UI de VD por períodos entre 3 a 12 meses generando cambios significativos desde estados de deficiencia a insuficiencia, con mejoría de la densidad mineral ósea, disminución de fosfatasas alcalinas y sin presentar hipercalcemia9,13. Cabe destacar que en los estudios mencionados no se alcanzaron concentraciones de suficiencia de VD (>30ng/ml).
En relación con la suplementación con monodosis de VD existen estudios en recién nacidos y lactantes menores de un año sanos con dosis seguras de usar del valor de 200.000UI semestrales o 100.000UI trimestralmente26, y en escolares sanos que viven en zonas de menor exposición solar (55° latitud sur) con dosis de 100.000-150.000UI anual en el inicio de invierno21,22. En otros estudios el uso de VD en monodosis ha demostrado ser seguro al realizar seguimiento además de calcemia, calciuria y nefrolitiasis23,24.
Las recomendaciones internacionales indican estudiar el estado nutricional de VD con 25OHD, pero solamente para población en riesgo de presentarla, siendo los niños con PC uno de estos grupos. El objetivo actual en niños con PC es mantener concentraciones de 25OHD en rangos de suficiencia, para lo cual debe asegurarse una suplementación adecuada de VD según las características de cada niño, con evaluaciones periódicas de 25OHD y aporte suficiente de calcio4,27,30.
Este trabajo presenta limitaciones, siendo una de las más importantes el tamaño muestral que completó el estudio, por lo cual es necesario evaluar con un mayor número de pacientes la efectividad del uso de monodosis en deficiencia de VD en niños que poseen PC.
En conclusión, en niños con PC la suplementación con una monodosis de 100.000UI de VD podría ser capaz de mantener un estado de suficiencia de VD. Se necesitan más estudios para confirmar estos resultados.
Conflicto de interesesEste trabajo cumple con los requisitos sobre consentimiento/asentimiento informado, comité de ética, financiación, estudios animales y sobre la ausencia de conflicto de intereses según corresponda.
Agradecimientos a los pacientes y sus familiares o cuidadores, a la Sra. Celia Morales y a la enf. Angélica López del Servicio de Neurología Infantil del HCSBA, al Dr. Jonathan Velásquez y al personal de enfermería de Pequeño Cottolengo, Santiago de Chile.