Las técnicas de imagen se usan habitualmente en el diagnóstico preoperatorio de los pacientes con dolor de cadera. En los últimos años han aumentado las capacidades diagnósticas de las técnicas de imagen tales como la ecografía, la tomografía computarizada y la resonancia magnética. Actualmente, se utilizan para confirmar una sospecha diagnóstica, excluir otras causas potenciales de dolor de cadera o periarticular y, además, sirven de herramienta para el cirujano de la cadera en la planificación quirúrgica. Asimismo, permiten evaluar áreas difíciles de visualizar en la artroscopia de cadera y por todo ello se utilizan como herramienta en la toma de decisión del tratamiento.
Las radiografías simples continúan siendo la técnica inicial de elección. La ecografía puede utilizarse en el diagnóstico de la patología extraarticular, como guía para aspirar líquido articular para su posterior análisis o bien, junto con la TAC, como guía para punciones intramusculares o perineurales. Las imágenes de TAC con reconstrucción en 3D de los huesos de la pelvis y de las caderas ofrecen una visión ósea global y se utilizan con frecuencia en la planificación preoperatoria. Avances técnicos recientes en resonancia magnética han expandido el uso potencial de esta técnica de imagen en los trastornos de la cadera habiendo aumentado su precisión diagnóstica.
En este artículo se describe el papel actual de las técnicas de imagen en el diagnóstico de la patología de la cadera y de las partes blandas periarticulares.
Imaging techniques are frequently used in the diagnosis and management of patients with hip pain prior to arthroscopy. In recent years the capabilities of imaging techniques, such as ultrasound, computed tomography (CT), and magnetic resonance imaging (MRI), have expanded. At present, imaging techniques help to confirm a suspected diagnoses, to exclude other potential source of intra-articular or peri-articular hip pain, and to provide the hip surgeon with a pre-operative map. They also assess difficult to see areas during hip arthroscopy, and therefore may be used for clinical decision-making.
Plain radiographs are usually the first step in the imaging management. Ultrasound can be used in the assessment of extra-articular disease and, along with CT, it can be used to guide intra-muscular and peri-neural injections, or to perform joint fluid aspiration. Three-dimensional CT reconstruction of the hip and pelvis offers a global view of hip-bone anatomy, and is often used for pre-operative planning. Recent developments in hardware and software have increased the potential use of MRI in the current diagnosis of hip disorders with increasingly accuracy.
In this article, the current role of imaging techniques in the diagnosis of hip joint disorders and surrounding soft tissues is described.
La articulación de la cadera es una enartrosis, difícil de evaluar mediante técnicas de imagen. La radiografía (Rx) convencional continúa siendo la técnica de elección inicial en el estudio de pacientes con sintomatología de cadera. Avances recientes en otras técnicas como la tomografía computarizada (TAC) o la resonancia magnética (RM) han incrementado su capacidad diagnóstica. Específicamente, la RM permite en la actualidad evaluar prácticamente todas las estructuras intraarticulares y extraarticulares de la cadera facilitando el diagnóstico preoperatorio de la patología ósea, labrum, cartílago y ligamento redondo y excluir la patología periarticular.
Además, mediante TAC y RM se pueden obtener imágenes en 3 dimensiones (3D) del fémur y acetábulo para la planificación quirúrgica. Por otra parte, la ecografía y la TAC pueden utilizarse como guía de punciones intramusculares o perineurales (tabla 1).
Utilidad de las técnicas diagnósticas en la patología articular y periarticular de la cadera
| Técnica diagnóstica |
|---|
| Labrum |
| Artrografía RM (1,5 Teslas o <) |
| RM convencional (3 Teslas) |
| Cartílago |
| Artrografía RM |
| Ligamento redondo |
| Artrografía RM |
| Deformidad Cam |
| 3D TAC o 3D RM con reconstrucción radial |
| Rx: limitación si es anterolateral |
| Deformidad Pincer |
| Rx evaluación global |
| TAC o RM: mejor para versión acetabular |
| Displasia cadera |
| Rx para diagnóstico |
| 3D TAC o 3D RM para planificación quirúrgica |
| Conflicto iliopsoas |
| Artroscopia |
| Artrografía RM puede sugerir el diagnóstico |
| Ecografía para punción guiada de anestésicos/corticoides |
| Conflicto isquiofemoral |
| RM |
| TAC para punción guiada de anestésicos/corticoides |
| Conflicto subespinoso |
| TAC o RM mejor que Rx |
| 3D TAC para planificación quirúrgica |
| Síndrome subglúteo profundo |
| RM |
| Ecografía o TAC para punción guiada de anestésicos/corticoides |
| Síndrome trocantérico |
| Ecografía o RM |
En esta revisión se expondrá inicialmente la patología y hallazgos por imagen de la patología intraarticular incluyendo las alteraciones del labrum, cartílago y ligamento redondo; posteriormente se abordarán las alteraciones óseas asociadas a conflicto femoroacetabular (CFA) y displasia de cadera, y finalmente se revisará la patología periarticular incluyendo fundamentalmente los conflictos del iliopsoas, isquiofemoral y subespinoso y el síndrome subglúteo profundo.
Patología intraarticularLabrumLas roturas del labrum son una causa conocida de dolor de cadera y constituyen la indicación más frecuente de artroscopia de cadera1. Es conocida la función del labrum en la estabilidad de la cadera, en disminuir la carga del cartílago y en mantener el efecto de sellado del fluido articular2.
Por ello, existe una asociación importante entre lesiones del labrum y del cartílago, lo que vincula la rotura del labrum al desarrollo progresivo de coxartrosis3.
Las lesiones del labrum y del cartílago pueden aparecer en múltiples patologías, especialmente en CFA, displasia del desarrollo de la cadera, en la enfermedad de Legg-Calvé-Perthes, deslizamiento de la epífisis femoral proximal, conflicto del iliopsoas, traumatismo y coxartrosis4.
La mayoría de las roturas del labrum se localizan en cuadrante anterosuperior, probablemente porque esta región soporta mayor carga mecánica. Las del cuadrante posterosuperior son la segunda localización más frecuente predominando en atletas jóvenes5.
La ubicación de las roturas puede mostrar su causa: las anteriores pueden originarse por conflicto del iliopsoas o por inestabilidad de la cadera, las anterolaterales por CFA y las posteriores por inestabilidad o secundarias a lesión por contragolpe en CFA6.
Las lesiones del labrum se diagnostican con artrografía-RM y se describen según su situación horaria. De los tipos de rotura descritas por Seldes, las roturas tipo I por desinserción del labrum respecto del cartílago y del acetábulo son mucho más frecuentes que las roturas tipo II o roturas intrasustancia7 (fig. 1). La presencia de quistes intra o paralabrales indica rotura subyacente del labrum aunque esta no sea evidente8-10.
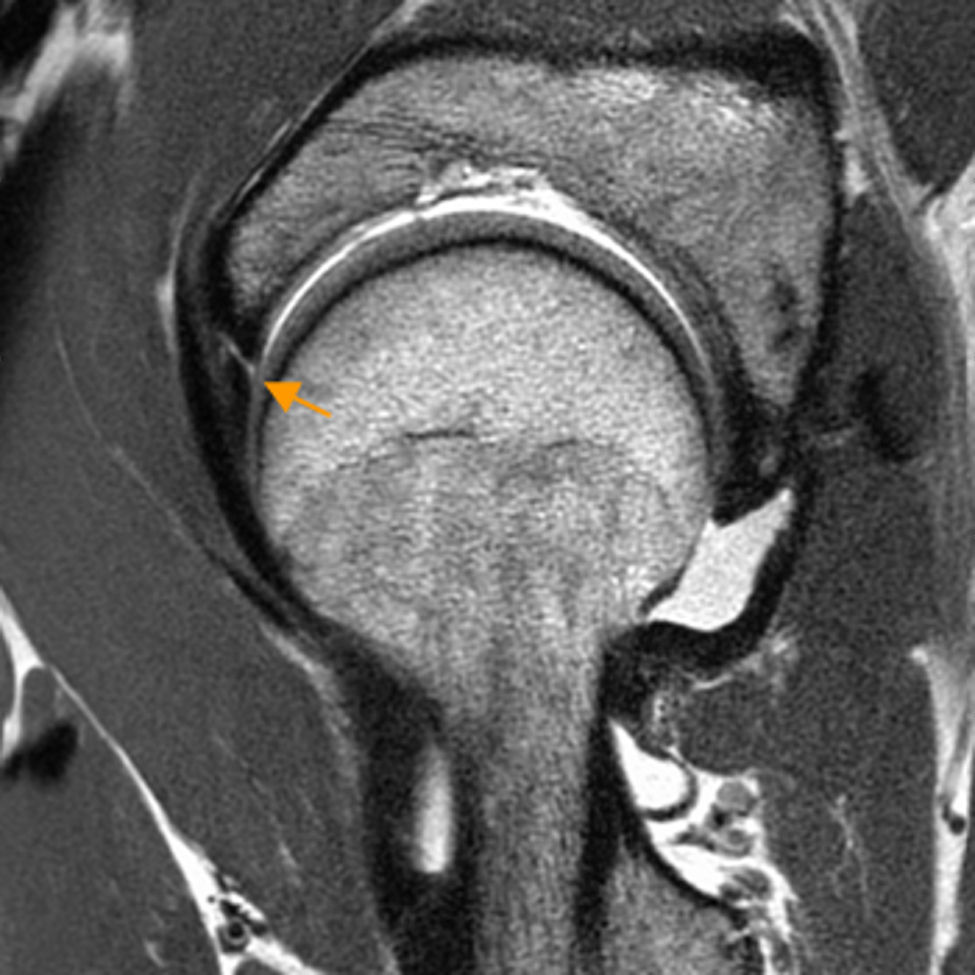
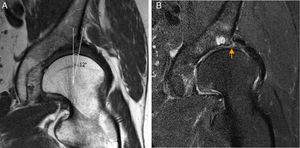
CartílagoLa Rx solo detecta signos secundarios de condropatía avanzada como quistes subcondrales y estrechamiento del espacio articular después de una extensa pérdida de cartílago. La artrografía-RM detecta más precozmente la condropatía y se utiliza para su diagnóstico, si bien presenta aún limitaciones técnicas4,11. Utilizando maniobras de tracción, la artrografía-RM mejora su rendimiento diagnóstico12. Así, Schamaranze ha señalado una precisión diagnóstica del 92-93% para lesiones del labrum, 83-91% para condropatía acetabular y 88-92% para condropatía femoral13 (fig. 2a).
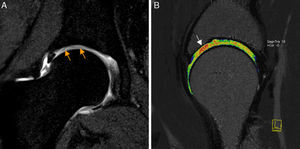
Condropatía acetabular. A) Corte coronal T1 de artrografía-RM de cadera derecha en T1 que muestra una línea hipointensa ondulante en la superficie del cartílago (flechas naranjas) y un aumento de señal lineal en la interfase cartílago-hueso subcondral, indicando delaminación condral que alcanza la superficie del cartílago adyacente a la unión condrolabral. B) Corte sagital de RM mapeo T2 de la cadera derecha. Área de condropatía precoz en cuadrante anterosuperior de predominio en el acetábulo definido en color rojo (flecha blanca). El mapeo T2 evalúa el contenido de colágeno y la arquitectura de la matriz colagénica, a diferencia de los estudios con realce tardío del cartílago con gadolinio cargado negativamente que evalúan el contenido en proteoglicanos.
Los equipos de 3 Teslas mejoran la evaluación condrolabral. Un estudio reciente señala una sensibilidad similar de la RM convencional (no-artrográfica) y la artrografía-RM en equipos de 3 Teslas para las lesiones del labrum. No obstante, para la evaluación de condropatía, la artrografía-RM supera a la RM convencional14.
Nuevas técnicas de evaluación del cartílago con RM (realce tardío del cartílago con gadolinio [dGEMRIC], mapeo T2, T1 rho) han mostrado la posibilidad de detectar alteraciones estructurales del cartílago previas a la alteración morfológica11,15 (fig. 2b).
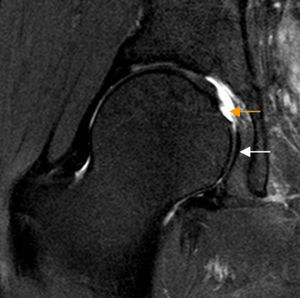
Ligamento redondoLa rotura del ligamento redondo (LR) es una causa de dolor de cadera y se considera la tercera causa más frecuente de coxalgia en atletas16-19.
El LR parece tener cierta función en la estabilidad de la cadera20,21 y así: 1) se ha descrito un aumento significativo de lesiones del cartílago acetabular asociadas a su rotura22; 2) en pacientes con CFA y rotura del LR se ha demostrado un aumento de lesiones condrales en la región inferomedial del acetábulo23.
Las lesiones del LR incluyen sinovitis rodeando al ligamento con o sin atrapamiento, roturas parciales de bajo o alto grado o asociadas a coxartrosis y roturas completas adquiridas, por avulsión o por ausencia del ligamento24.
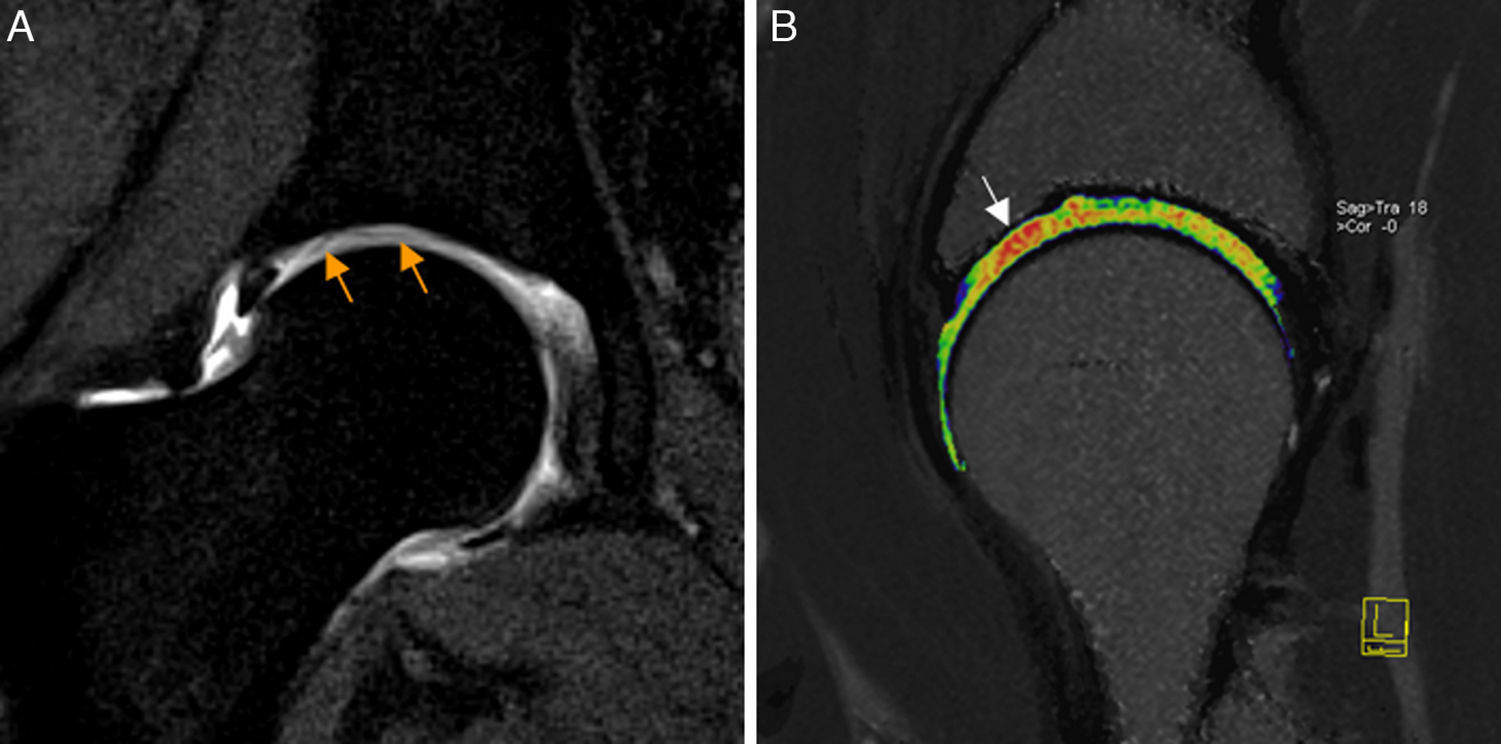
La artrografía-RM permite identificar la mayoría de las lesiones del LR25. Para roturas completas no existen diferencias significativas entre RM convencional y artrografía-RM, mientras que para roturas parciales es superior la artrografía-RM26 (fig. 3). Realizando artrografía-RM con tracción, un estudio reciente ha descrito alta sensibilidad (92%) y especificidad (98%) para las roturas completas del LR y menor para el diagnóstico conjunto de roturas parciales (sensibilidad 87% y especificidad 95%) a pesar de que el LR intacto y el LR con rotura parcial pueden tener apariencia similar27,28.
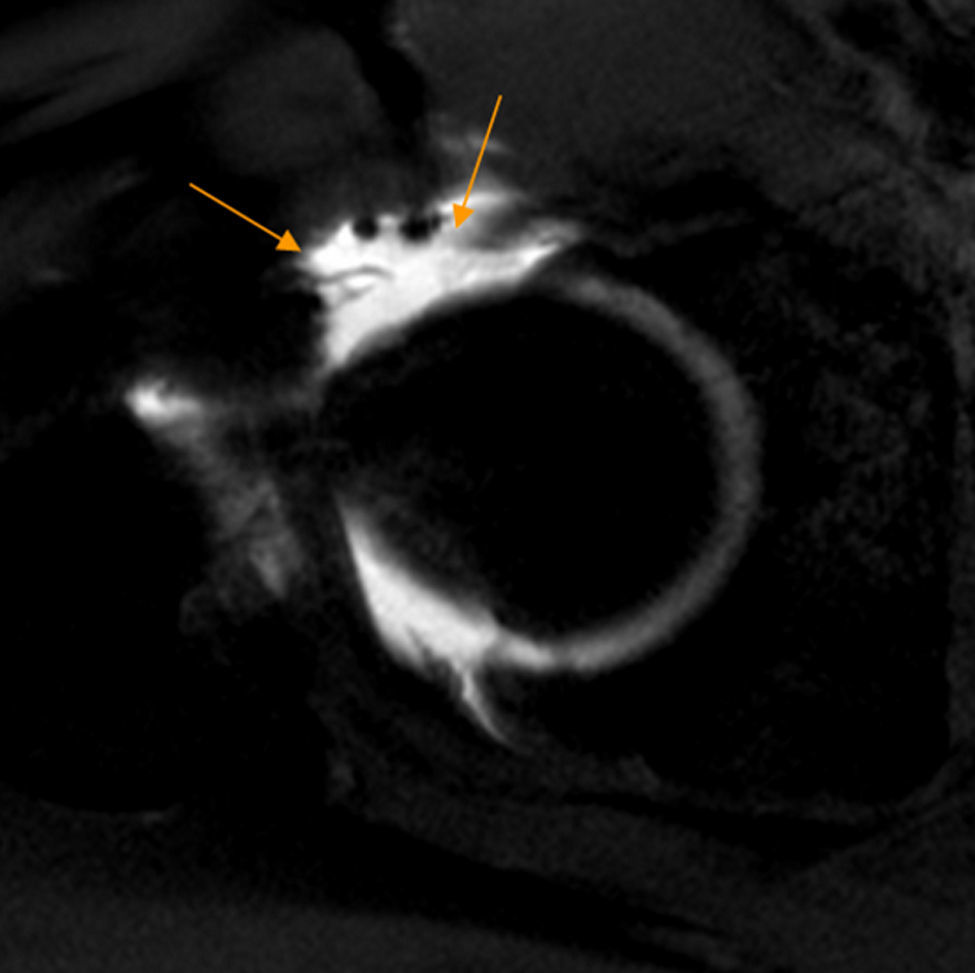
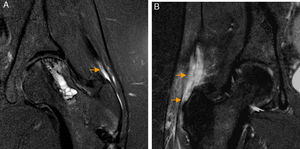
Rotura del ligamento redondo. El corte coronal T2 con saturación grasa de RM de cadera derecha muestra rotura del ligamento redondo en su inserción en la fóvea capitis que está ocupada por fluido articular (flecha naranja). La región caudal del ligamento redondo se identifica como una banda de hiposeñal lineal en situación medial a la cabeza femoral (flecha blanca).
El CFA se produce por contacto repetitivo anormal entre la unión cabeza-cuello femoral y el borde acetabular en las fases terminales del movimiento de la cadera. Puede originarse en el lado femoral cuando la unión cabeza-cuello ha perdido su morfología esférica (deformidad Cam), en el lado acetabular (deformidad Pincer) o más frecuentemente, ser mixto. Produce lesiones progresivas en el labrum y cartílago pudiendo causar artropatía degenerativa precoz6.
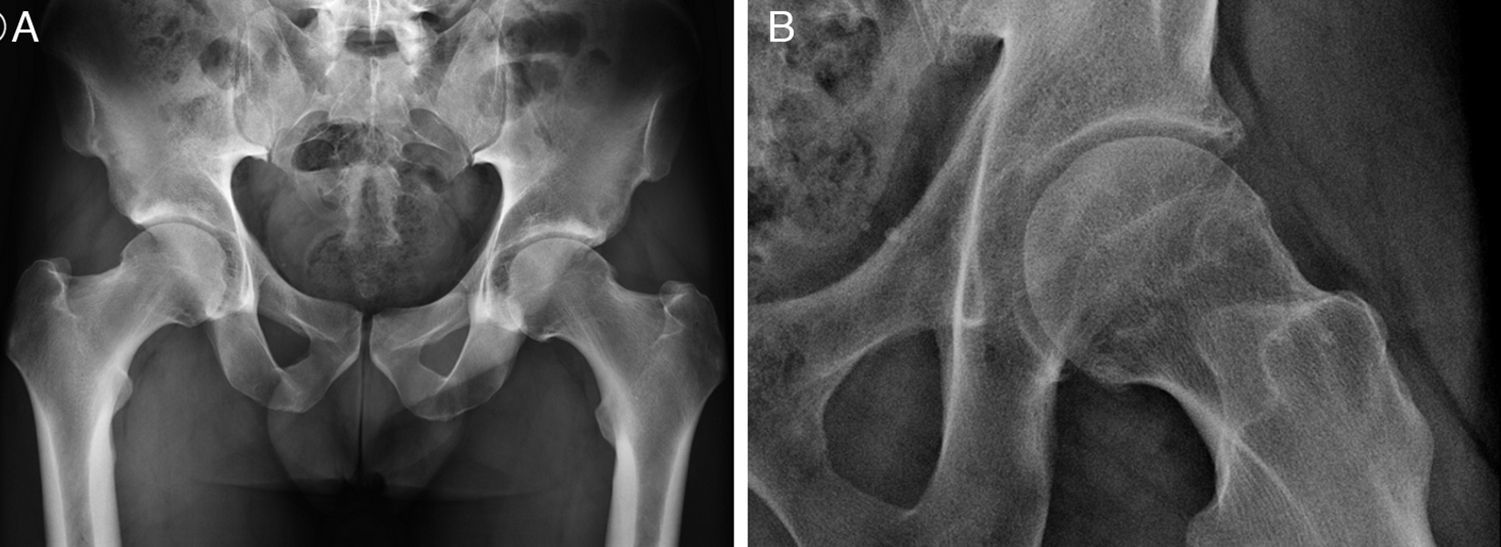
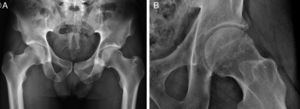
El papel de las técnicas de imagen en CFA incluye evaluar la patología ósea, del labrum y cartílago, de las estructuras capsuloligamentarias y excluir patología periarticular. La patología ósea se evalúa inicialmente con Rx, realizándose una proyección pélvica anteroposterior y otra axial6 (fig. 4a). Alternativamente a la proyección axial puede realizarse una axial de Dunn, preferiblemente en 45° de flexión, para evaluar anomalías de la superficie anterior de la unión cabeza-cuello femoral29 (fig. 4b). Otras proyecciones incluyen la lateral en posición de rana y la de falso perfil30.
A) Rx en proyección pélvica anteroposterior. La proyección pélvica anteroposterior se realiza en decúbito supino con 15° de rotación interna de las piernas para compensar la antetorsión femoral y visualizar mejor la superficie lateral de la transición cabeza-cuello femoral. El coxis y la sínfisis del pubis deben estar alineados y separados por una distancia de 1 a 2cm.
B) Rx en proyección axial de Dunn en 45° de flexión de cadera izquierda. Las proyecciones axiales de Dunn se realizan en decúbito supino con la cadera a estudio flexionada 45 o 90°, con abducción de 20° y sin rotación de la cadera.
La patología del labrum, cartílago y capsuloligamentaria se evalúa preferentemente con RM y/o artrografía-RM. Las calcificaciones del labrum se diagnostican mediante Rx y TAC.
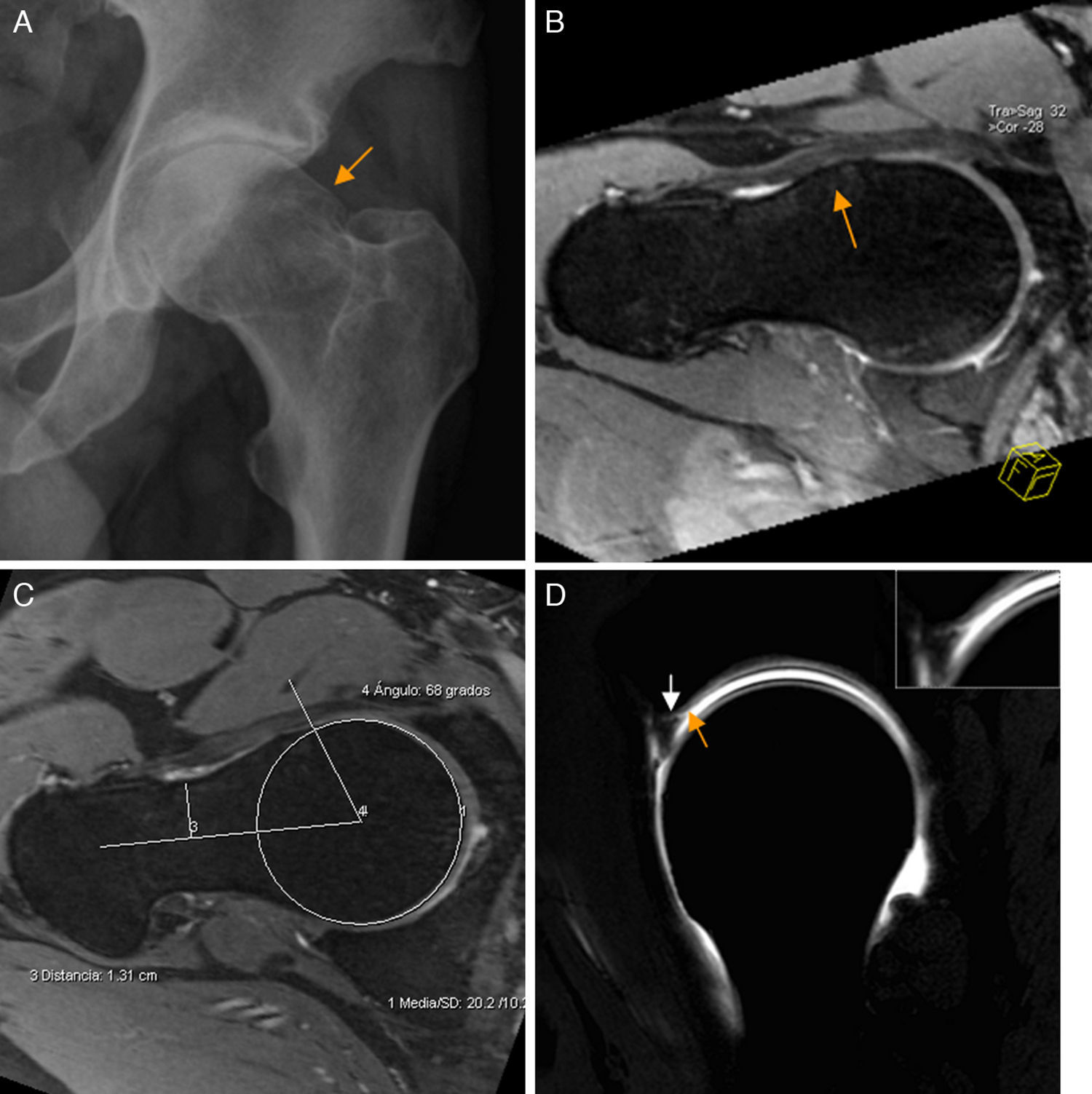
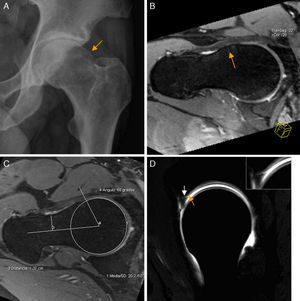
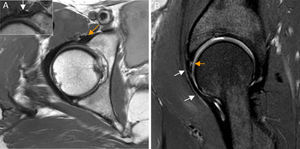
Conflicto femoroacetabular tipo CamEn el CFA tipo Cam existe pérdida de la esfericidad de la transición cabeza-cuello femoral por una deformidad ósea y/o osteocondral (giba) que, con los movimientos de flexión y rotación interna, cizalla el cartílago y la unión condrolabral lesionando el labrum.
El ángulo alfa se utiliza para diagnosticar el CFA tipo Cam y puede calcularse mediante Rx, TAC o RM6,31-33. Un valor de ángulo alfa<50-55° se considera normal32,34, aunque la deformidad Cam se ha descrito en asintomáticos35. Por ello se ha propuesto medir el ángulo alfa en región anterosuperior con un valor de corte de 60°, para aumentar la especificidad diagnóstica de CFA tipo Cam manteniendo una sensibilidad del 72-80%36.
En Rx, la proyección AP identifica deformidades superolaterales configurando la imagen «en mango de pistola». La proyección lateral identifica deformidades anteriores6,32. No obstante, no evalúa las localizadas en el sector anterolateral. Por ello, se recomienda utilizar RM con cortes radiales o reconstrucciones de TAC 3D para evaluar la deformidad Cam en múltiples planos y en toda su extensión9 (fig. 5). Los cortes radiales utilizan el cuello femoral como eje de rotación permitiendo evaluar completamente la circunferencia de la unión cabeza-cuello femoral9.
Conflicto femoroacetabular tipo Cam. A) En la proyección axial de Dunn en 45° de flexión de cadera izquierda se aprecia pérdida de la esfericidad de la unión cabeza-cuello femoral por una giba superolateral (flecha naranja) configurándose una imagen «en mango de pistola». B) El corte radial en 3D gradiente T2 de RM de cadera derecha muestra los mismos hallazgos (flecha naranja) en la superficie anterior de la unión cabeza-cuello femoral. C) Medición del ángulo alfa: se define como el ángulo creado por una línea entre el centro de la cabeza femoral y la parte más estrecha del cuello femoral y otra línea entre el centro de la cabeza femoral y el punto anterior en el que la distancia desde el centro de la cabeza femoral excede el radio del platillo subcondral de la propia cabeza femoral. D) El corte sagital en T1 gradiente 3D de artrografía-RM de cadera derecha muestra la deformidad Cam anterior, una rotura del labrum de espesor parcial en la unión condrolabral (flecha blanca) y una leve irregularidad y adelgazamiento del cartílago adyacente por leve condropatía (flecha naranja), más evidente en la imagen de magnificación.
Los cortes radiales no parecen aumentar el rendimiento diagnóstico de las roturas del labrum37.
En el CFA Cam la lesión del labrum es típicamente anterosuperior y asocia progresivamente reblandecimiento del cartílago acetabular anterolateral, adelgazamiento o delaminación del cartílago, ulceración, y finalmente desprendimiento del cartílago38,39 (fig. 5). También puede aparecer condropatía parafoveal femoral asociada40. La delaminación condral se detecta cuando hay fluido o gadolinio con morfología lineal en la interfase cartílago-hueso subcondral41, aunque la RM es poco sensible en su detección. También se ha descrito como signo útil para el diagnóstico de delaminación la presencia de una banda lineal de hiposeñal en la superficie del cartílago acetabular que puede ser de morfología ondulada (signo de la ola o alfombra) (fig. 2a). Los quistes fibrosos aparecen tanto en el CFA Cam como en el Pincer y se localizan en la región anterosuperior del cuello femoral, en la zona del choque42.
Conflicto femoroacetabular tipo PincerEl CFA tipo Pincer se produce por sobrecubrimiento acetabular que puede ser focal por retroversión acetabular, o global por coxa profunda o protrusión acetabular.
Para diagnosticar el sobrecubrimiento acetabular por Rx30 se utilizan distintas mediciones y signos:
Sobrecubrimiento acetabular global:
- -
Ángulo centro-borde lateral: deformidad Pincer si ≥40°.
- -
Índice acetabular: deformidad Pincer si ≤0°.
- -
Índice de extrusión de cabeza femoral: deformidad Pincer si <25% de la cabeza femoral sin cubrir por el acetábulo.
- -
Coxa profunda: la fosa acetabular no sobrepasa la línea ilioisquiática.
- -
Protrusión acetabular: la cabeza femoral sobrepasa la línea ilioisquiática.
Retroversión acetabular:
- –
Anterior: la pared anterior es lateral a la posterior (signo radiológico del «8» o del lazo).
- –
Posterior: la pared posterior del acetábulo pasa medial al centro de la cabeza femoral (signo de la pared posterior).
No obstante, la versión acetabular se evalúa más eficazmente mediante cortes axiales de TAC o RM que incluyan la pelvis ósea y ambas caderas para corregir posibles inclinaciones de la pelvis. Existe una anteversión de 15-25° en individuos normales43.
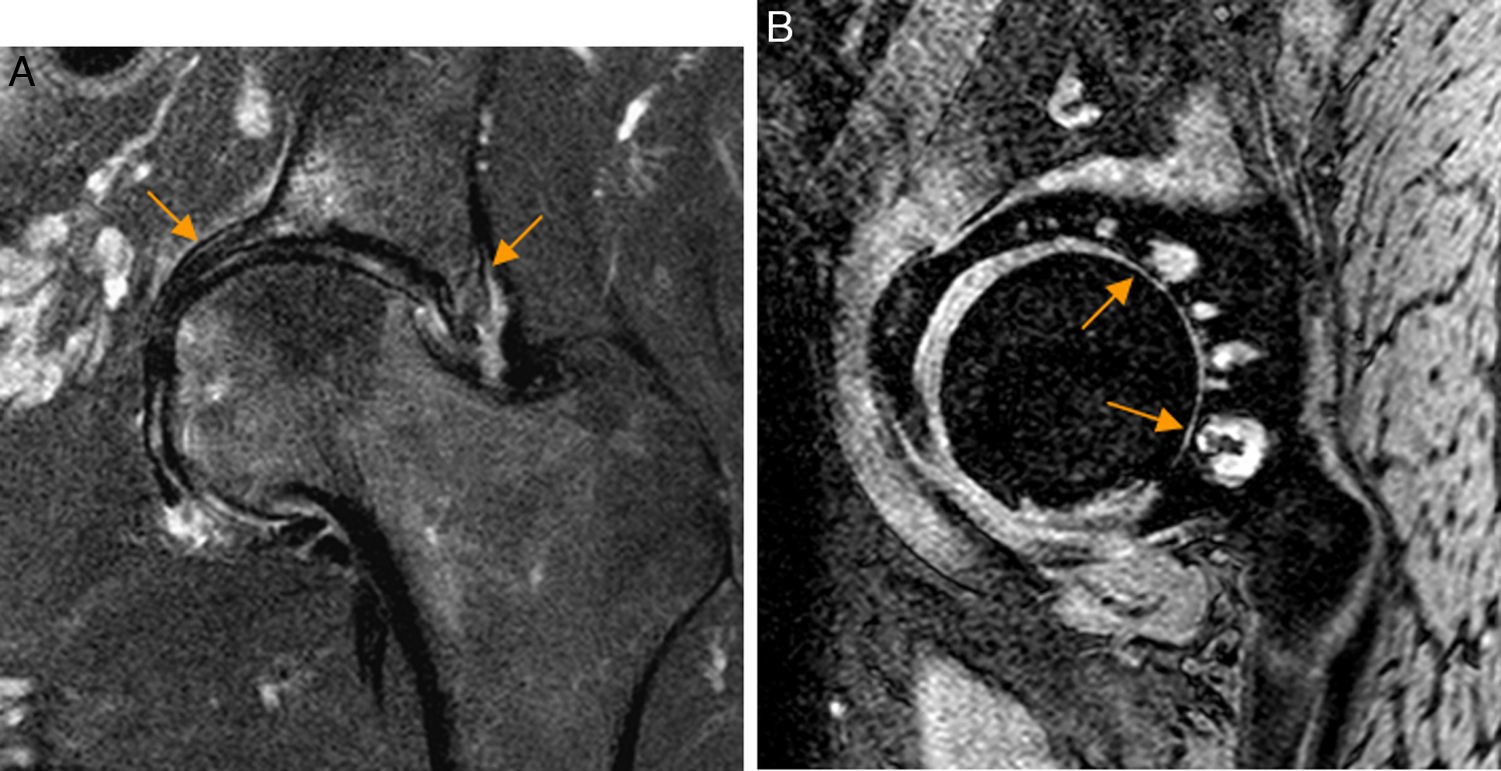
En el CFA tipo Pincer, el impacto repetido del borde acetabular sobre el cuello femoral origina calcificación, degeneración y rotura del labrum y de la unión condrolabral, así como lesiones marginales del cartílago adyacente al borde acetabular que se extienden siguiendo el margen acetabular.
También pueden identificarse os acetabuli, estando debatido que puedan ser secundarios a fracturas de estrés del borde acetabular y cuya extirpación, especialmente si son grandes, puede conducir a inestabilidad de la cadera44-46. En fases crónicas de CFA Pincer pueden aparecer lesiones condrales por contragolpe en la región posteroinferior del espacio articular38 (fig. 6).
Conflicto femoroacetabular tipo Pincer por sobrecobertura acetabular global. A) En el corte coronal T2 con saturación grasa de RM de cadera izquierda se identifica protrusión acetabular con sobrecubrimiento acetabular y abombamiento de la pared medial del acetábulo (flechas naranjas). B) En el corte sagital gradiente T2 de RM de cadera izquierda se aprecia pinzamiento del espacio articular posterior con quistes subcondrales que se extiende desde la región posterosuperior a la posteroinferior (flechas naranjas) en relación con avanzada condropatía secundaria a lesión por contragolpe.
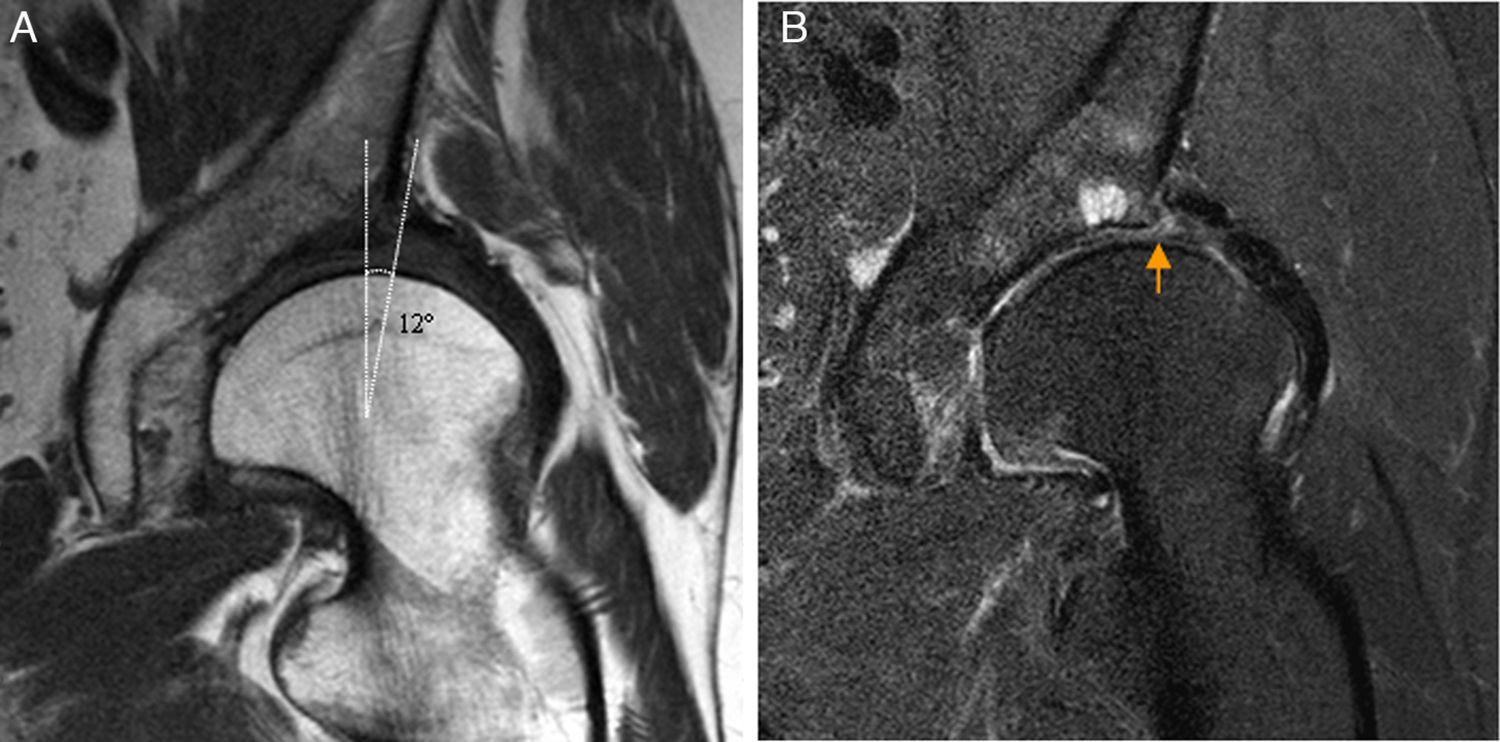
El diagnóstico de displasia se ha realizado clásicamente con Rx. Las mediciones más utilizadas para evaluar la deficiencia acetabular son: el ángulo centro-borde que evalúa la cobertura lateral de la cabeza femoral por el acetábulo en proyección AP de pelvis, el ángulo vertical centro-borde anterior medido en proyección de falso perfil que evalúa la cobertura anterior y el índice acetabular que evalúa la superficie de carga acetabular. La displasia de cadera se caracteriza por un ángulo centro-borde disminuido (<25°) y un índice acetabular aumentado (>13°). Otras mediciones incluyen el ángulo delta para evaluar la presencia de fóvea alta y el ángulo cuello-diáfisis femoral para descartar coxa valga/vara asociada47.
En la displasia acetabular se produce sobrecarga mecánica del borde acetabular que origina lesión condral y del labrum y artrosis precoz10,48. La Rx carece de sensibilidad para detectar la artrosis precoz, aunque un ángulo centro-borde <15° y un índice acetabular >20° se ha asociado a patología condrolabral severa. La artrografía-RM permite detectar las alteraciones óseas y las lesiones asociadas del labrum (hipertrofia, degeneración y rotura), del cartílago y del LR que permiten planificar el tratamiento artroscópico asociado a la osteotomía periacetabular49,50 (fig. 7).
Displasia de cadera en adulto joven. A) El corte coronal T1 de RM de cadera izquierda muestra escasa cobertura lateral de la cabeza femoral por el acetábulo y ángulo centro-borde disminuido. B) El corte coronal T2 con saturación grasa de cadera izquierda muestra rotura degenerativa del labrum acetabular (flecha naranja) y quistes subcondrales por avanzada condropatía asociada.
Si la RM está contraindicada, la artrografía-TAC permite evaluar el daño condrolabral5,51.
Además, la RM y especialmente la TAC aportan información en 3D mejorando la detección y caracterización de la deficiencia acetabular y permitiendo la planificación quirúrgica52.
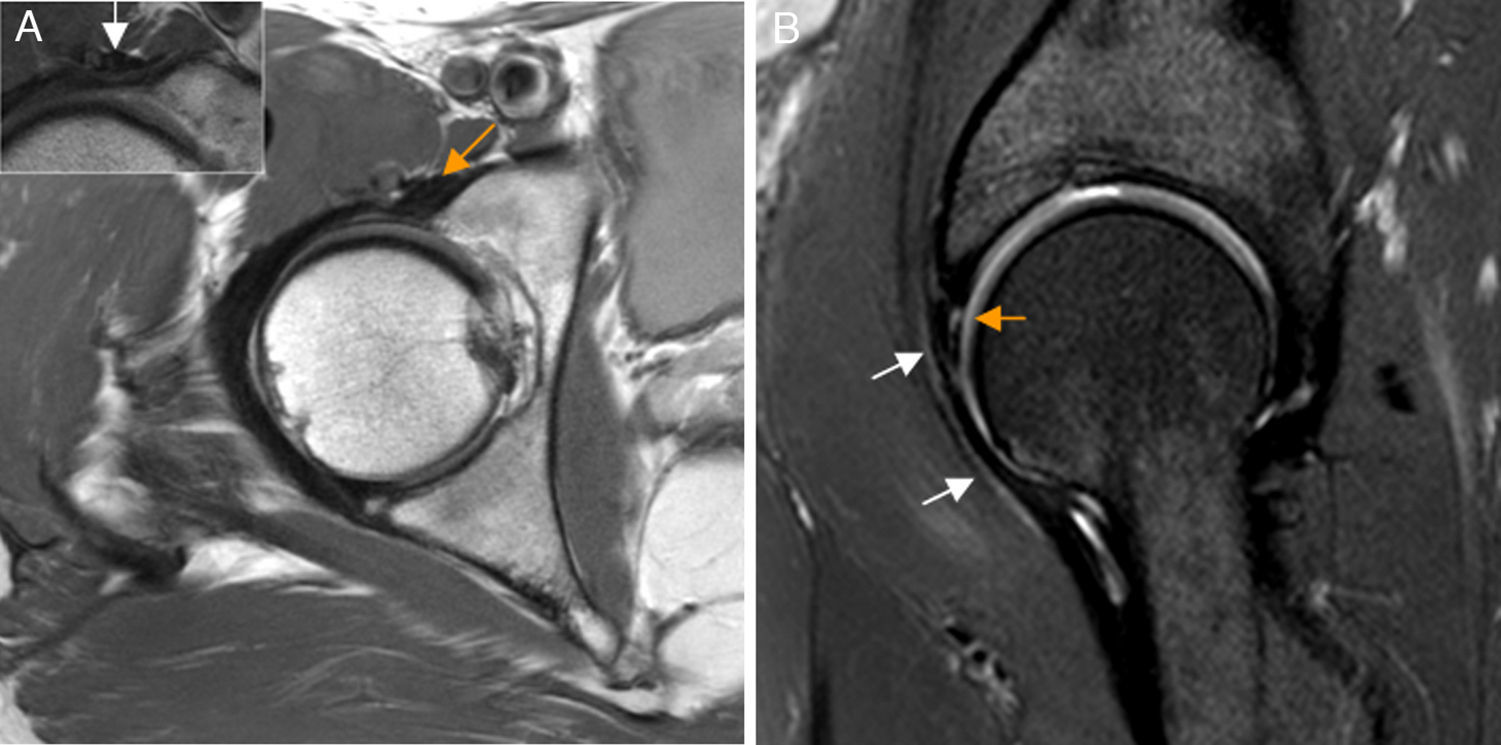
Patología periarticularConflicto del iliopsoasEstá producido por el tendón del iliopsoas en su curso anterior a la cápsula articular. El tendón puede estar tenso, inflamado o con adherencias capsulares produciendo una lesión del labrum anterior por tracción repetitiva con la extensión de la cadera. Un músculo iliocapsular hiperactivo o hipertrófico que produzca tracción del complejo capsulolabral anterior también se ha postulado como causa53.
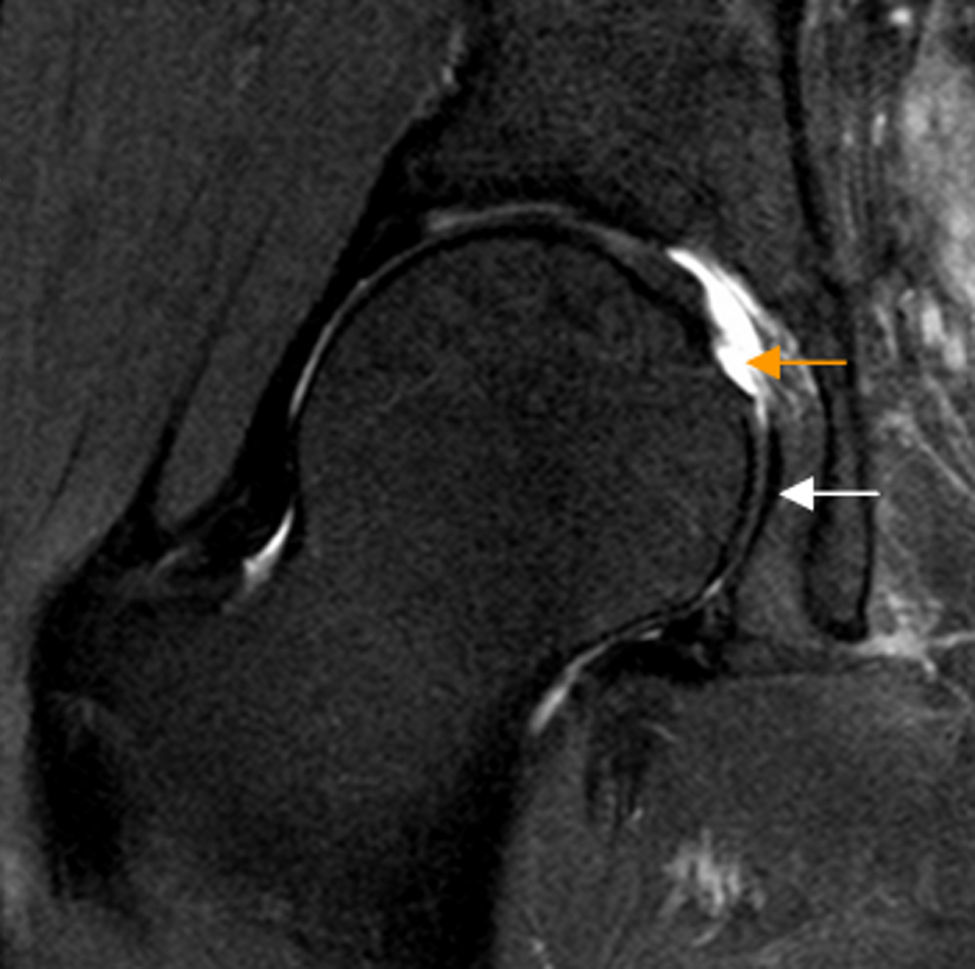
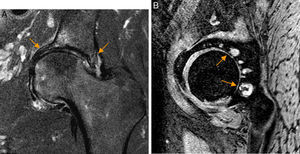
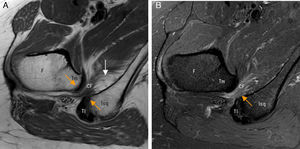
El conflicto del iliopsoas es un diagnóstico artroscópico no habiendo criterios clínicos o de imagen validados para su diagnóstico preoperatorio. Una rotura del labrum a las 3h sin sobrepasar las 2h podría sugerir el diagnóstico. Otros signos asociados incluyen inclinación lateral o estrechamiento del tendón en plano transverso en la zona que cruza la cápsula anterior54 (fig. 8).
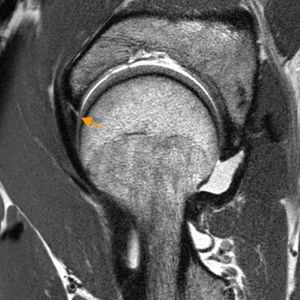
Conflicto del iliopsoas. A) En el corte axial en densidad protónica de RM de cadera derecha el tendón del iliopsoas presenta una orientación oblicua (flecha naranja) y no horizontal en situación anterior a la cápsula articular, identificándose: B) la rotura del labrum anterior asociada en el plano sagital (flecha naranja, b) y leve aumento de señal anterior a la cápsula articular y profunda al tendón del iliopsoas (flechas blancas, b). En la imagen de magnificación de una cadera derecha se detalla una morfología normal del tendón del iliopsoas que sigue un trayecto horizontal en el plano axial (flecha blanca, a).
El tendón puede estar formado por más de un componente tendinoso que es necesario liberar en la tenotomía artroscópica55. Las inyecciones peritendinosas de corticoides y/o anestésicos guiadas por ecografía pueden ser una alternativa como tratamiento conservador.
Conflicto isquiofemoralSe caracteriza por un estrechamiento doloroso del espacio entre la tuberosidad isquiática y el trocánter menor (distancia isquiofemoral) con conflicto directo entre ambos huesos y/o con compresión intermitente del músculo cuadrado femoral (MCF) interpuesto56,57.
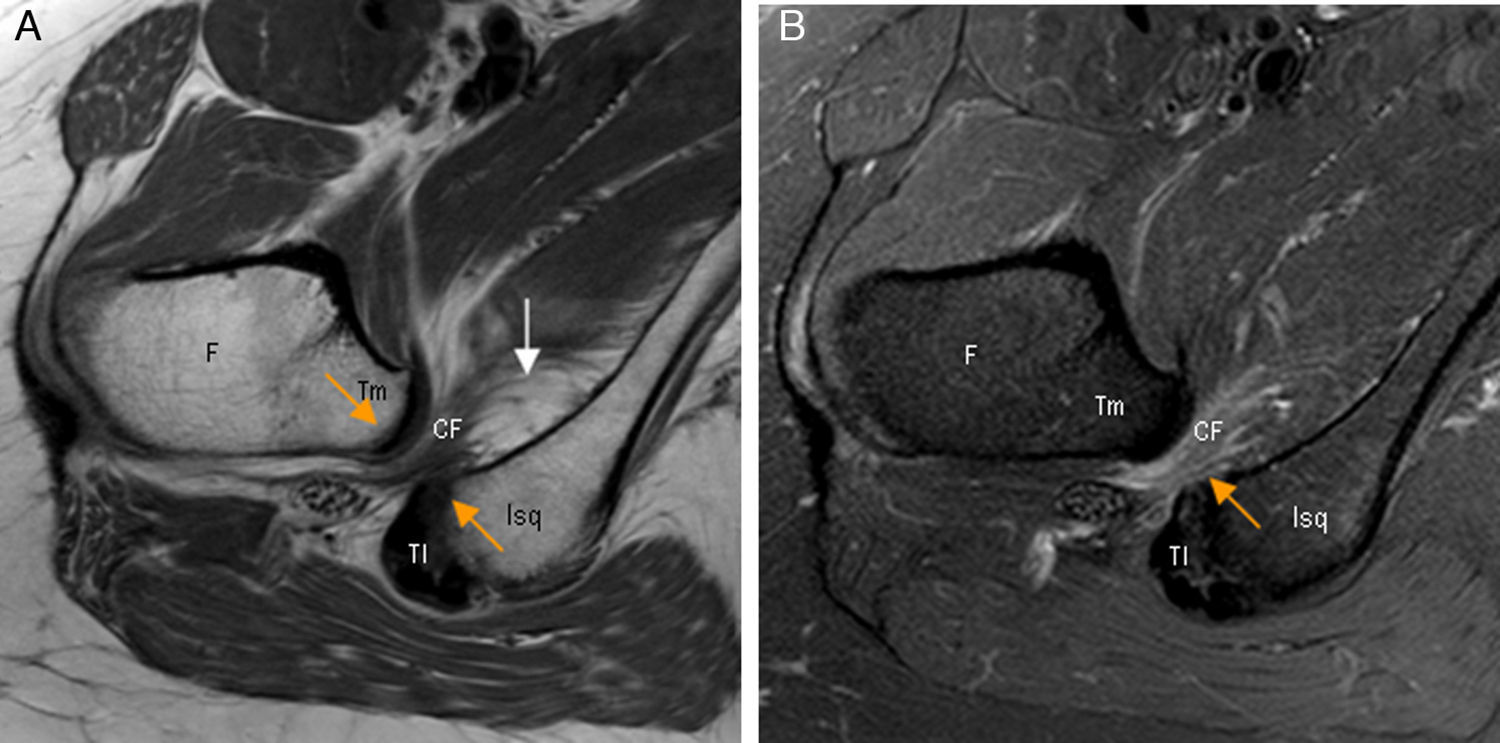
La RM demuestra edema y/o infiltración grasa del MCF con o sin atrofia muscular. Ocasionalmente aparece edema rodeando al tendón del psoas. La distancia isquiofemoral está disminuida con valores medios de 13±5mm (en controles: 23±8mm), aunque esta distancia puede variar según el grado de rotación interna o externa de la cadera56,58 (fig. 9).
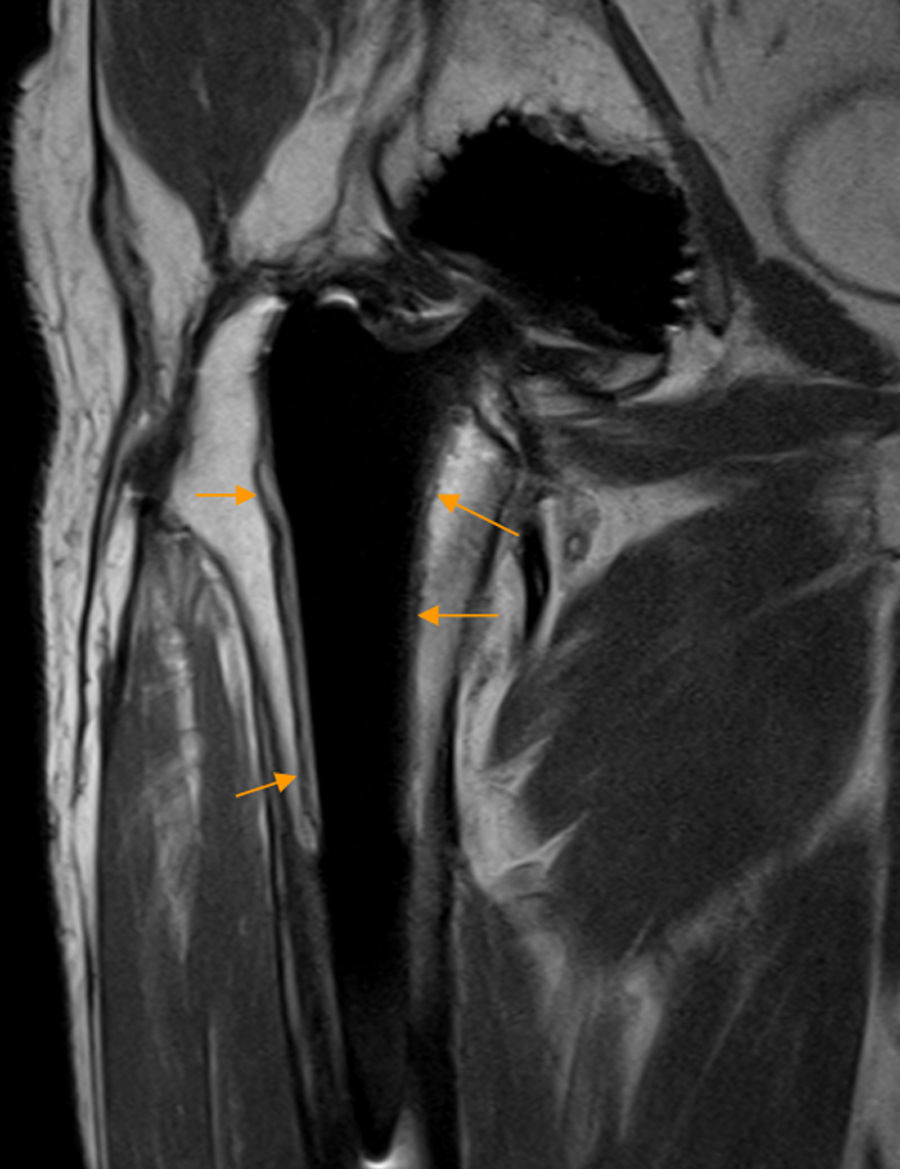
Conflicto isquiofemoral. A) El corte axial en densidad protónica de RM de cadera derecha muestra una disminución de la distancia isquiofemoral (flechas naranjas) con atrofia del músculo cuadrado femoral que presenta infiltración grasa junto a la inserción isquiática (flecha blanca). B) En el corte axial T2 con saturación grasa de cadera derecha se observa edema del músculo cuadrado femoral en la zona del estrechamiento (flecha naranja).
CF: músculo cuadrado femoral; F: fémur; Isq: apófisis isquiática; TI: tendones isquiotibiales; Tm: trocánter menor.
La TAC puede utilizarse de guía en el tratamiento conservador mediante inyecciones intramusculares de anestésicos y corticoides59.
Conflicto subespinosoLa espina iliaca anteroinferior (EIAI) se localiza proximal al borde acetabular y sirve de origen al tendón directo del músculo recto femoral. En atletas adolescentes son frecuentes las avulsiones de la EIAI. Generalmente responden al tratamiento conservador, pero ocasionalmente la apófisis se desplaza inferiormente y condiciona una unión anómala, quedando una EIAI aumentada de tamaño que puede originar un conflicto mecánico entre el cuello femoral y la propia EIAI con la flexión de la cadera llamado conflicto de la EIAI60.
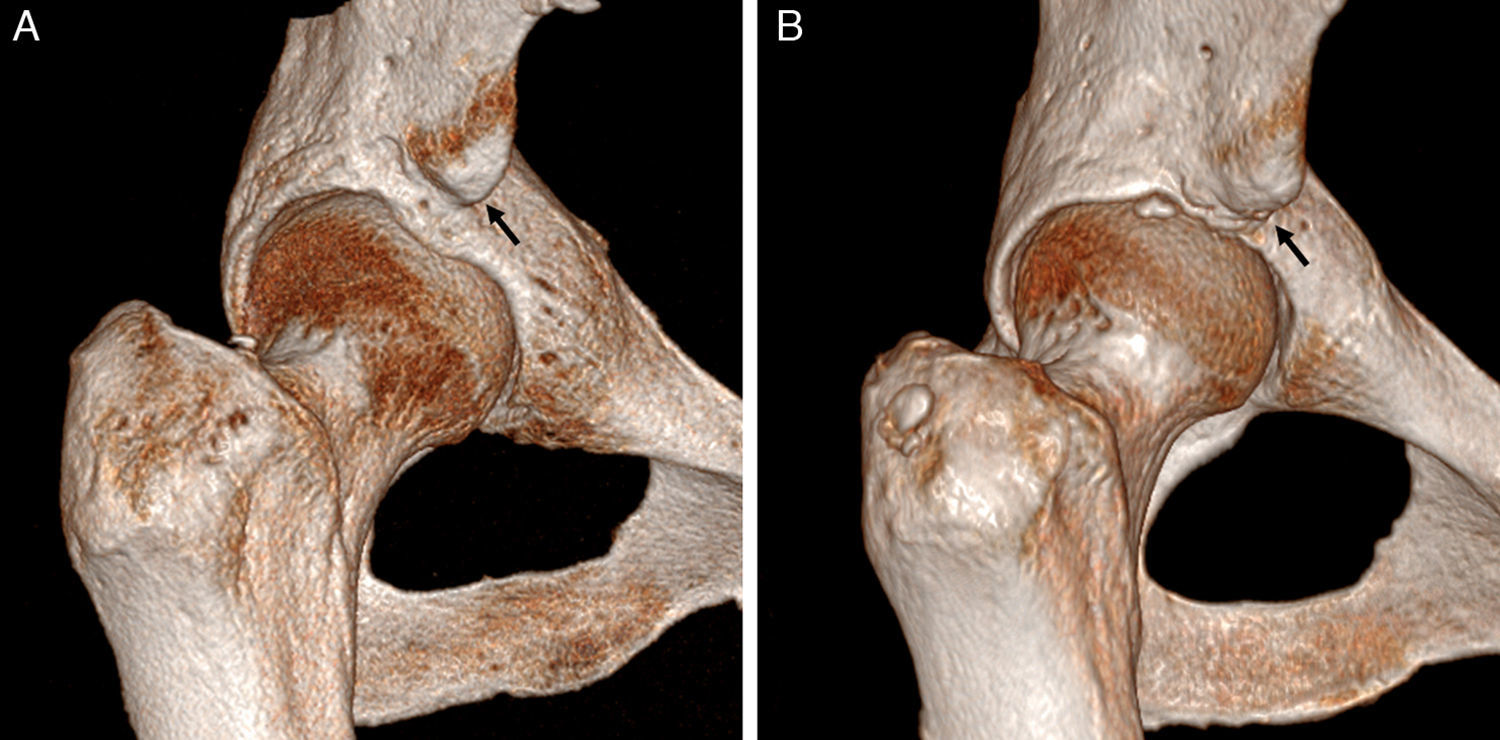
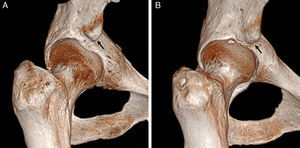
Hetsroni clasificó mediante TAC los tipos de EIAI: tipo I si existe una pared lisa entre la EIAI y el borde acetabular; tipo II si la EIAI alcanza el nivel del borde acetabular, y tipo III si sobrepasa caudalmente el borde acetabular61 (fig. 10). Los tipos II y III asocian disminución de la flexión y rotación interna de la cadera, por lo que actualmente se plantea su tratamiento quirúrgico-artroscópico. Frecuentemente existe deformidad Cam asociada61.
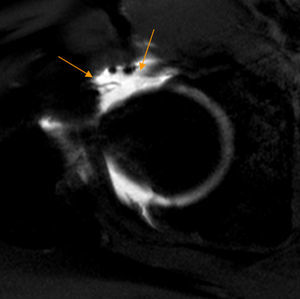
Conflicto subespinoso. Las imágenes de reconstrucción con TAC 3D en plano coronal con rotación interna de la cadera derecha demuestran: A) una espina iliaca anteroinferior (EIAI) normal tipo I, que se sitúa proximal al borde acetabular y con pared lisa entre la EIAI y el borde acetabular, y B) una EIAI tipo II que alcanza el nivel del borde acetabular (flechas negras).
El tipo de EIAI puede diagnosticarse con Rx mediante proyección AP de pelvis o de falso perfil de cadera o, con mayor exactitud, con TAC o RM. Las reconstrucciones 3D con TAC pueden utilizarse en la planificación quirúrgica. La artrografía-RM demuestra la patología articular asociada a la deformidad Cam62.
Síndrome subglúteo profundoEl síndrome subglúteo profundo (SSP) es una patología que describe un dolor en la región glútea secundario a atrapamiento extrapélvico del nervio ciático en el espacio subglúteo63.
Sus causas incluyen: bandas fibrovasculares, variantes anatómicas del músculo piramidal, músculos rotadores externos, estructuras vasculares, lesiones de músculos-tendones isquiotibiales, fibrosis glútea y lesiones ocupantes de espacio. El síndrome piramidal puede considerarse un subgrupo del SSP que ocurre por hipertrofia-contractura del músculo piramidal con neuritis del ciático, por atrapamiento dinámico del nervio por el músculo piramidal o por variantes anatómicas del recorrido del nervio ciático (que predisponen a atrapamiento) tras aparecer un factor desencadenante64,65.
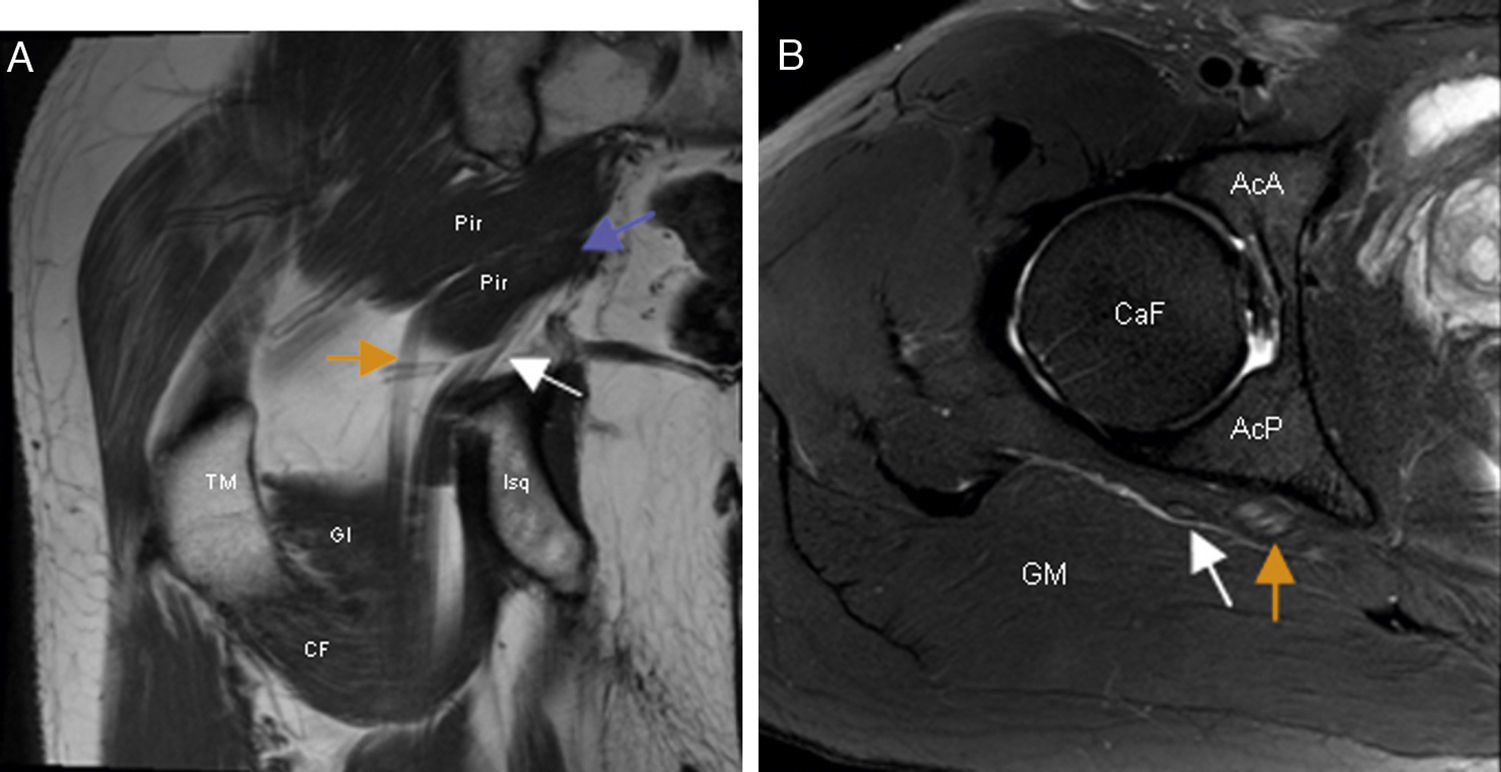
La RM identifica variantes anatómicas musculares y en ocasiones la causa del atrapamiento (fig. 11). Además, la llegada de los equipos de 3 Teslas ha permitido el desarrollo de la neurografía-RM que identifica la patología intraneural detectando aumentos de señal fascicular y/o aumento de volumen del nervio facilitando la localización del atrapamiento65,66.
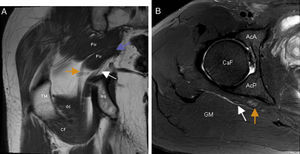
Síndrome subglúteo profundo. A) El corte coronal en T1 de RM de cadera derecha demuestra la presencia de un vientre accesorio del músculo piramidal (flecha morada) que separa los componentes tibial (flecha naranja) y peroneal (flecha blanca) del nervio ciático en el espacio subglúteo. B) En el corte axial en T2 con saturación grasa de RM de la cadera derecha se observa aumento de señal fascicular y aumento de volumen del componente tibial (flecha naranja) del nervio ciático. El componente peroneal del nervio (flecha blanca) es normal. AcA: región anterior del acetábulo; AcP: región posterior del acetábulo; CaF: cabeza femoral; CF: músculo cuadrado femoral; GI: músculo gémino inferior; GM: músculo glúteo mayor; Pir: músculo piramidal; TM: trocánter mayor.
La ecografía y la TAC sirven de guía en el tratamiento con inyecciones intramusculares y perineurales67.
Otras aplicacionesEn el síndrome trocantérico la ecografía y la RM identifican la tendinopatía o rotura de los tendones glúteos medio y/o menor, el grado de retracción tendinosa y la atrofia-infiltración grasa de los vientres musculares permitiendo planificar el tratamiento (fig. 12). La Rx identifica las avulsiones óseas68,69.
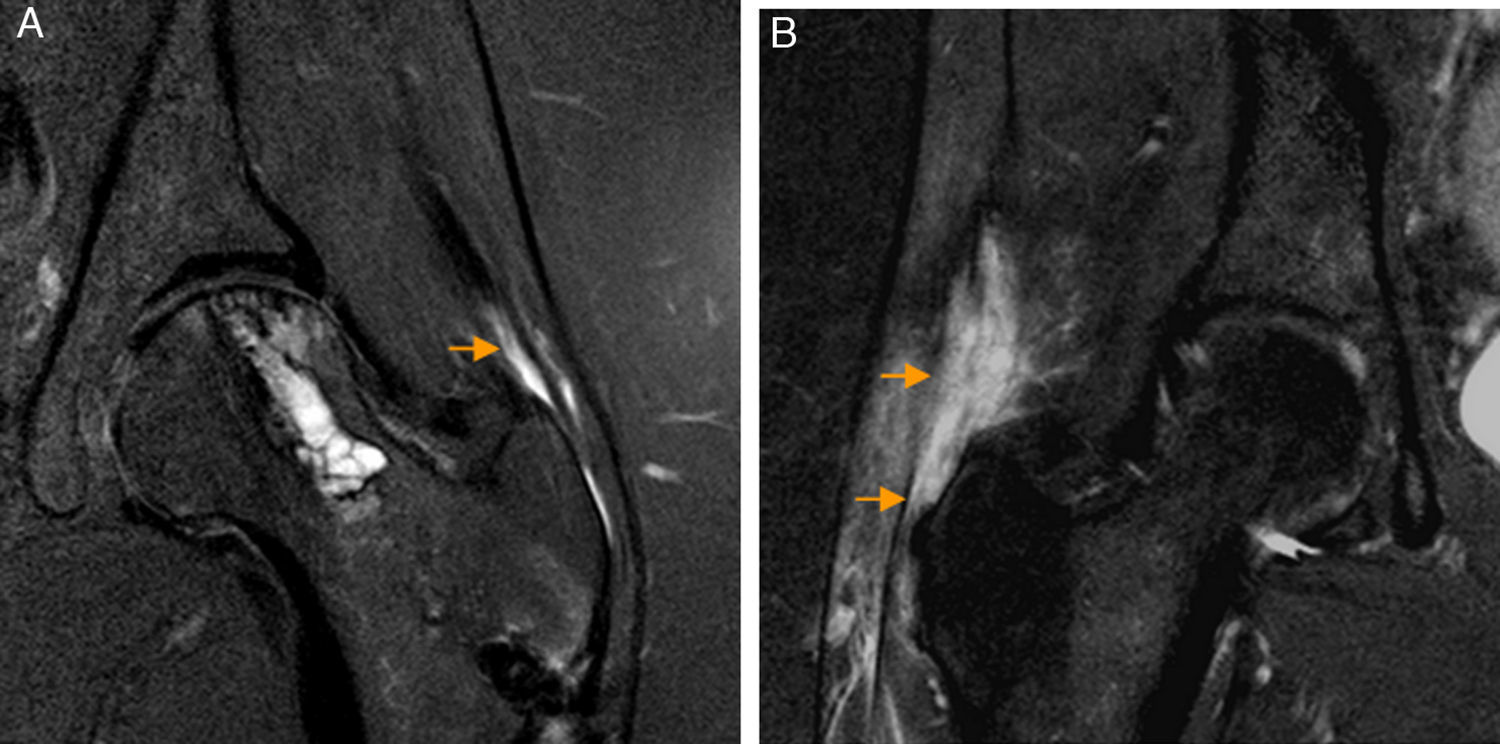
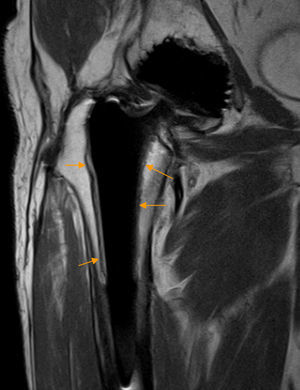
Rotura del tendón del glúteo medio. A) El corte coronal T2 con saturación grasa de RM de cadera izquierda demuestra una rotura parcial longitudinal del tendón del glúteo medio como una zona de aumento señal lineal que afecta a las fibras profundas del tendón (flecha naranja). También se observan cambios secundarios a descompresión previa de la cabeza femoral. B) En otro paciente, en el corte coronal T2 con saturación grasa de RM de cadera derecha se aprecia una rotura completa del tendón del glúteo medio desde su trayecto proximal al trocánter mayor hasta la inserción trocantérea que se manifiesta como una extensa área de hiperseñal que interrumpe el trayecto del tendón (flechas naranjas).
En la inestabilidad de la cadera, la RM permite evaluar las lesiones capsuloligamentarias70 y los defectos capsulares tras artroscopia71 (fig. 13). Otras aplicaciones incluyen el diagnóstico de osteonecrosis, de condromatosis sinovial y de complicaciones asociadas a las prótesis de cadera72-75 (fig. 14).
Osteolisis aséptica en prótesis de cadera. El corte coronal en densidad protónica de RM de cadera y fémur proximal derecho demuestra un área de osteolisis bordeando al vástago femoral (flechas naranjas), más evidente en la superficie externa del vástago, caracterizada por una banda de hiperseñal delimitada superficialmente por una fina capa hipointensa.
Los autores declaran no tener ningún conflicto de intereses.