La deficiencia (insuficiencia o deficiencia) de vitamina D es un problema clínico especialmente prevalente en ancianos con fracturas de baja energía, sobre todo de cadera, aunque también se ha relacionado con fracturas de estrés y de alta energía.
Son muchas las evidencias que apoyan la necesidad de mantener unos niveles adecuados de vitamina D en sangre para reducir el número de fracturas por fragilidad, favorecer la consolidación de las mismas, mejorar la función neuromuscular de los pacientes, evitar las caídas, prevenir las infecciones quirúrgicas o mejorar la duración de las artroplastias.
Sin embargo, no es habitual que el cirujano ortopédico y traumatólogo considere determinar los valores de vitamina D en este tipo de pacientes e instaurar el tratamiento adecuado.
Se recomienda mantener niveles superiores a 30-40ng/ml (75-100nmol/l) de vitamina D y la ingesta, en casi todos los casos, de 800 a 1.000UI/día de vitamina D para alcanzar estos niveles.
Vitamin D deficiency or insufficiency is a clinical problem particularly prevalent in elderly patients with low-energy fractures, particularly hip fractures, but has also been associated with stress fractures and high energy fractures.
There is much evidence that supports the need to maintain adequate levels of vitamin D in the blood in order to; reduce the number of fragility fractures, furthering the consolidation of these, improve neuromuscular function of patients, prevent falls, prevent surgical infections, or improve the length of arthroplasties.
However, it is rare for the orthopaedic surgeon to request the values of vitamin D in these patients and give the appropriate treatment
It is recommended to maintain levels higher than 30-40ng/ml (75-100nmol/l) and increase vitamin D intake, in almost all cases, from 800 to 1,000IU/day to achieve these levels.
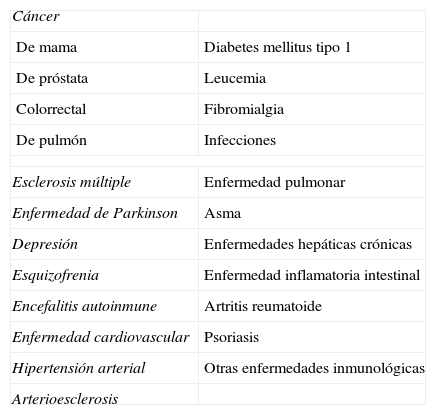
En los últimos años se ha constatado un notable incremento del interés por la vitamina D, no solo por la importancia que tiene en el metabolismo óseo-mineral, sino también por los efectos extraóseos cada vez mejor conocidos de este sistema hormonal (tabla 1).
Procesos extraóseos con los que se relaciona la vitamina D
| Cáncer | |
| De mama | Diabetes mellitus tipo 1 |
| De próstata | Leucemia |
| Colorrectal | Fibromialgia |
| De pulmón | Infecciones |
| Esclerosis múltiple | Enfermedad pulmonar |
| Enfermedad de Parkinson | Asma |
| Depresión | Enfermedades hepáticas crónicas |
| Esquizofrenia | Enfermedad inflamatoria intestinal |
| Encefalitis autoinmune | Artritis reumatoide |
| Enfermedad cardiovascular | Psoriasis |
| Hipertensión arterial | Otras enfermedades inmunológicas |
| Arterioesclerosis | |
El hecho de haberse constatado valores séricos bajos de vitamina D en diferentes grupos poblacionales, tanto sanos como enfermos, ha disparado la voz de alarma sobre la importancia de la deficiencia de esta vitamina.
Desde el punto de vista de la Cirugía Ortopédica y Traumatología (COT), la deficiencia de vitamina D ha sido relacionada con una peor coordinación neuromuscular, una mayor incidencia de caídas, una mayor incidencia de fracturas de alta y baja energía y un mayor índice de complicaciones esqueléticas y extra-esqueléticas relacionadas con el tratamiento de las mismas.
Por todo ello nos ha parecido oportuno evaluar la importancia que para los profesionales de esta especialidad tiene esta deficiencia, estableciendo los criterios básicos de diagnóstico y tratamiento de este tipo de afección.
Metabolismo de la vitamina DLa vitamina D está considerada actualmente como un complejo hormonal capaz de regular la formación de calcio y la absorción de calcio y fósforo en el intestino1–4. Tanto si su procedencia deriva de la síntesis cutánea por acción de un determinado tipo de rayos ultravioleta B (aporte: 60-85%), o directamente de la alimentación (aporte: 15-40%), la vitamina D circula por la sangre unida a una proteína transportadora específica (vitamin D binding protein o [BDP]). De esta manera la hormona D es trasladada a los diferentes tejidos y órganos periféricos diana, almacenándose en los depósitos lipídicos de los mismos, y desde ellos a las células que la necesitan.
Por sí misma, la vitamina D no es un producto activo, debiendo pasar por distintas hidroxilaciones hasta llegar a su forma biológicamente activa. La primera de ellas ocurre en el hígado, donde gracias a la 25-hidroxilasa hepática se transforma en 25-hidroxicolecalciferol (25[OH]D). La segunda, en el riñón, mediante la acción de la 1α-hidroxilasarenal, que la convierte en 1,25 dihidroxivitamina D3 (1,25[OH]2D), también denominada 1,25 dihidroxicolecalciferol o calcitriol, el metabolito activo de la misma.
En los tejidos y órganos diana, la 1,25[OH]2D se une de forma muy específica a unos receptores nucleares, miembros de la superfamilia de los receptores nucleares de hormonas, llamados receptores para la vitamina D (NR1l, calcitriol receptor, vitamin D receptor o VDr)5, que actúan, activando o inhibiéndola transcripción de los diversos genes responsables de la síntesis de proteínas vitamina D dependientes. Se ha demostrado que el VDR actúa modulando los efectos que la forma activa de vitamina D tiene sobre el receptor del retinoide X (RXR)6,7.
Este mecanismo de acción justifica la gran variedad de acciones endocrinas (relacionadas con la 1,25[OH]2D circulante de origen renal), autocrinas (relacionadas con la 1,25[OH]2D sintetizada localmente en tejidos y órganos diana) y paracrinas del calcitriol en el organismo (fig. 1).
El mejor conocimiento de los diversos mecanismos de acción de la vitamina D, y de sus bases moleculares, ha sido trascendental para estimar la importancia que tiene la adquisición y mantenimiento de unos niveles adecuados de 1,25[OH]2D para el idóneo funcionamiento de múltiples procesos biológicos8–14, lo que de alguna manera ha revolucionado el enfoque terapéutico de las alteraciones fisiopatológicas de los mismos15–20.
Vitamina D y fracturas de baja energíaSe conoce como fractura de baja energía o fractura por fragilidad, a aquella resultante de una caída desde una altura igual o menor a la propia altura, o bien, a aquella que se presenta en ausencia de un traumatismo previo obvio.
Los niveles bajos de vitamina D están relacionados con una mayor prevalencia de este tipo de fracturas (especialmente fracturas por fragilidad de la cadera) debido fundamentalmente al hiperparatiroidismo secundario que inducen, si bien, como después analizaremos, pudieran estar igualmente relacionadas con la disminución del tono y del control neuromuscular, y por tanto con el aumento del riesgo de caídas que induce la deficiencia de esta vitamina.
Desde el punto de vista fisiopatológico, el aumento persistente del nivel de la hormona paratiroidea (PTH) actúa como un potente estimulador de la resorción ósea, lo que determina por un lado, una disminución progresiva de la cantidad de hueso formado y, por otro, de un adelgazamiento de todos sus elementos estructurales, con la consiguiente mengua de la resistencia ósea que todo ello supone.
Las tasas de hipovitaminosis D en los pacientes con fractura de cadera varían según las series: un 36% en Finlandia21,22, un 40-68% en el Reino Unido23–25, un 50-78% en EE. UU.26,27, un 62-90% en Japón28,29, un 67-91% en España30,31 y un 96,7% en la India32. No obstante, a pesar de esta alta prevalencia, la hipovitaminosis D está notoriamente infradiagnosticada en todos estos pacientes, posiblemente debido a diferentes factores33, entre los que destaca, sin duda, la falta de consideración de esta afección como agente etiopatogénico.
Además de en las fracturas de cadera de baja energía se han constatado también niveles inadecuados de vitamina D en pacientes con fracturas vertebrales y no vertebrales excluidas las de cadera22,30–32.
A pesar de la clara relación entre fracturas de baja energía y deficiencia de vitamina D, existe todavía controversia en la literatura sobre el efecto preventivo de la misma. Diferentes metaanálisis34,35 parecen demostrar que la administración de vitamina D sola tiene poca probabilidad de prevenir fracturas por fragilidad, aunque cuando es administrada con suplementos de calcio sí parece reducir el riesgo de fracturas de cadera, sobre todo en pacientes institucionalizados.
Bischoff-Ferrari et al.35, tras analizar 12 ensayos clínicos aleatorizados controlados con placebo para fracturas no vertebrales (n=42.279 individuos) y 8 ensayos clínicos aleatorizados para fractura de cadera (n=40.886 individuos) en los que compara vitamina D con o sin calcio y con calcio o placebo, demuestra que la prevención de fracturas no vertebrales y de cadera con suplementos de vitamina D es dosis dependiente. En su estudio, las dosis más altas de vitamina D (>400UI) redujeron las fracturas no vertebrales tanto en individuos que vivían en la comunidad (–29%) como en pacientes institucionalizados (–15%) y su efecto resultaba independiente de los suplementos adicionales de calcio. El efecto antifractura de la vitamina D resultaba más importante en pacientes mayores de 70 años, así como en aquellos que presentaban bajos niveles de vitamina D al inicio del estudio, y siempre y cuando la adherencia al tratamiento fuese adecuada.
Por ello, y por el coste-beneficio que implica la reducción de este tipo de fracturas, autores como van den Bergh et al.36 proponen que a todos los pacientes con fracturas por fragilidad de tipo osteoporótico se les inicie tratamiento con 800 UI diarias de vitamina D. En este mismo sentido cabe señalar que la respuesta antifractura de los fármacos antiosteoporóticos es menor cuando la repleción de la vitamina D resulta insuficiente.
Vitamina D y fracturas de estrésDesde hace poco tiempo ha surgido el interés por saber si fisiopatológicamente las fracturas por estrés aparecen en un hueso estructuralmente alterado por efecto de los niveles bajos de vitamina D.
Así, Burgi et al.37, en un estudio de cohortes efectuado en 600 mujeres con fracturas de estrés de tibia y peroné, encontró una relación inversa entre el gradiente de 25[OH]D y el riesgo de fractura por estrés. El riesgo resultó ser el doble en mujeres con niveles séricos de 25[OH]D<20ng/ml frente a las que tenían valores ≥40ng/ml. Sin embargo, Välimäki et al.38 en un estudio prospectivo sobre la aparición de fracturas por estrés y sus factores etiopatogénicos efectuado en 179 jóvenes que realizaban el servicio militar, encontró que las fracturas por estrés se asociaban a niveles altos de PTH sin insuficiencia de vitamina D concomitante (p=0,022), a pesar de lo cual recomendaban igualmente la ingesta de suplementos de vitamina D para prevenir el déficit de vitamina D y reducir los niveles séricos de PTH.
Estos hallazgos parecen indicar la existencia de una posible predisposición genética a la aparición de este tipo de fracturas, vinculada o no a la deficiencia de vitamina D. Así se ha demostrado que ciertos polimorfismos del receptor de la vitamina D (VDR) pueden estar asociados con el incremento del riesgo de fracturas por estrés en el personal militar39,40.
Desde el punto de vista de la eficacia de la administración preventiva de vitamina D en este tipo de fracturas, Lappe et al.41 demostraron que la administración de altas dosis diarias de calcio (2g) y de vitamina D (800UI) a mujeres reclutas durante 8 semanas, determina una reducción en un 20% de la incidencia de fracturas de estrés (p<0,003). En este mismo sentido, Burgi et al.37 estiman como objetivo para la prevención de las fracturas por estrés administrar altas dosis de vitamina D hasta alcanzar concentraciones de 25[OH]D en suero >40ng/ml. Estas evidencias iniciales hacen sugerir a Tenforde et al.42 la necesidad de realizar nuevos estudios controlados que demuestren una menor incidencia de fracturas de estrés tras un tratamiento preventivo con vitamina D.
Vitamina D y fracturas de alta energíaSi bien existe una clara evidencia científica de que la insuficiencia/deficiencia de vitamina D se constata más frecuentemente en pacientes con fractura de baja energía, existen dudas a la hora de consensuar que la incidencia de esta afección resulta igualmente elevada en pacientes con fracturas por alta energía.
Con independencia de las dudas que plantea el hecho de que se haya identificado esta afección en porcentajes relativamente importantes (25%) de varones jóvenes con fractura de alta energía, continúan siendo contados los trabajos que se hacen eco de una relación entre fracturas de alta energía e insuficiencia/deficiencia de vitamina D43,44.
Dumitrescu et al.43 analizando la presencia de factores de riesgo de osteoporosis (entre ellos la presencia de insuficiencia/deficiencia de vitamina D) en pacientes mayores de 50 años con fractura vertebral o no vertebral y osteoporosis densitométrica en columna, no encuentran diferencias significativas entre fracturas asociadas a traumatismos de alta o baja energía, lo que sugiere una prevalencia mayor o menor de la misma en ambos tipos de fracturas.
Sin embargo, Steele et al.44, mediante un análisis retrospectivo de 44 historias clínicas de pacientes de entre 19 y 95 años con fracturas no vertebrales, demuestran que en general la insuficiencia de vitamina D resulta más frecuente en mujeres que en varones (75 vs 40%), proporción que se hace más evidente en el caso de fracturas por alta energía (80 vs 25%). El porcentaje de insuficiencia de vitamina D en varones con fracturas de alta energía resultaba por tanto menor que en mujeres, si bien en ellos estas fracturas se produjeron en pacientes significativamente más jóvenes. Los autores concluyen su trabajo recomendando la evaluación de los niveles de 25[OH]D en todos los pacientes con fractura de baja o alta energía y su corrección de acuerdo con las recomendaciones de la Sociedad Americana de Investigación Ósea y Mineral (ASBMR) y Fundación Nacional de Osteoporosis (NOF).
Vitamina D, tono, fuerza y control neuromuscularEl tono, la fuerza y el control neuromuscular están condicionados, entre otros factores, por la edad, la alimentación y el ejercicio físico, pero también posiblemente por la existencia de una relación entre ellos y los receptores específicos de la vitamina D del músculo estriado45.
En este sentido, en estudios efectuados tanto en mujeres jóvenes como en mujeres mayores de 70 años, se han identificado varios alelos (ApaI, BSMIyTaqI)46–49 relacionados de un modo u otro con la fuerza muscular. Asimismo se ha visto que la disminución del tono muscular que acontece con la edad es debida a una menor expresión del VDR50. Ambas circunstancias podrían explicar que, con independencia de su grado de repercusión clínica, las diferencias de potencia muscular ligadas al déficit de vitamina D lleguen a alcanzar el 34%51.
No obstante, muy recientemente, la teoría de la modulación del tono y la fuerza muscular por los receptores específicos de la vitamina D del músculo estriado se ha visto cuestionada, al resultar estos indetectables en el músculo esquelético52.
Desde el punto de vista clínico, se ha observado que valores de 20ng/ml de 25[OH]D se asocian con un aumento del balanceo corporal al caminar53, y un mayor desplazamiento del centro de gravedad (marcha anserina o de pato), así como con una baja propiocepción del miembro, lo que determina un control alterado de la marcha. Esta alteración podría explicarse por los posibles efectos de la vitamina D sobre los distintos componentes involucrados en la propia regulación de la marcha, incluyendo el componente muscular, el componente de neurofeedback y el componente neurológico central54.
Concentraciones séricas de 25[OH]D<10-12ng/ml provocan una disminución manifiesta de la fuerza muscular53,55–57, 2,57 veces superior a la de los pacientes que tienen valores de vitamina D significativamente más altos57.
Valores séricos de 25[OH]D<8ng/ml se relacionan frecuentemente con la presencia de una miopatía franca, caracterizada por una pérdida importante de masa muscular (sarcopenia)57,58 relacionada con el alelo Folkl del VDR. La miopatía de la deficiencia de vitamina D es de localización proximal y afecta generalmente a las extremidades inferiores, caracterizándose por debilidad muscular, alteración de la marcha con aumento del balanceo corporal, dificultad para la incorporación y para subir escaleras y dolor muscular difuso, síntomas que se acompañan, en ocasiones, de parestesias, artralgias y/u otros síntomas igualmente inespecíficos que determinan en ocasiones diagnósticos clínicos erróneos (enfermedad reumática, polimialgia, desórdenes psiconeuróticos, fibromialgia y enfermedades malignas, etc.)51.
El estudio electrofisiológico de esta miopatía suele mostrar potenciales de acción de unidad motora polifásicos y de baja amplitud y duración, sin evidenciar anomalías en la transmisión del nervio motor ni en la unión neuromuscular. El estudio histológico confirma la miopatía e identifica una atrofia selectiva de las fibras musculares de contracción rápida (tipo II), lo que explicaría la contracción muscular más lenta y débil y el retardo de la fase de relajación tras la contracción muscular59. Como consecuencia de ello, se altera la respuesta de reacción muscular rápida necesaria para compensar los desequilibrios, lo que, al afectar a la musculatura proximal de las extremidades inferiores, conlleva generalmente un aumento del riesgo de caídas.
Todas estas alteraciones neuromiopáticas resultan justificadas por el mecanismo fisiopatológico directo ligado a los VDR, pero también parcialmente por otros mecanismos indirectos como la disminución del calcio y fosfato séricos secundaria a la hipovitaminosis D, lo que justificaría también que la fase de relajación en la contracción muscular sea más prolongada. De igual manera, en los casos de insuficiencia/deficiencia de vitamina D asociadas a hiperparatiroidismo secundario, el aumento de PTH puede conducir por sí mismo a atrofia y debilidad muscular debido al aumento de la tasa de calcio intracelular y a la disminución de la cantidad de proteínas contráctiles que produce60.
Por el contrario, niveles séricos de vitamina D≥20ng/ml se asocian con un mejor funcionamiento de la extremidad inferior, una mayor fuerza muscular61 y un menor número de caídas existiendo una correlación positiva entre los valores de 25[OH]D y la ausencia de caídas55,56,62–64. Seguramente por esta razón, la suplementación de vitamina D en dosis de 700-1.000 UI ha demostrado reducir en un 19% el riesgo de caídas en personas mayores, mientras que dosis menores de 700UI no lo han hecho62. En este mismo sentido, un reciente metaanálisis de Bischoff-Ferrari et al.65 ha demostrado que el tratamiento con vitamina D, con o sin suplementos de calcio, reduce la tasa de caídas en un 22%. Un análisis secundario del subgrupo de personas que tomaron vitamina D (700UI/día) con calcio (500mg/día) demostró en mujeres aunque no en varones un efecto reductor de las caídas del 46%, reducción que alcanzó el 65% en las mujeres menos activas66. Frente a estos resultados Cameron señala que efectivamente los suplementos de vitamina D reducen la tasa de caídas, pero no el riesgo de sufrirlas67.
El efecto beneficioso de la vitamina D sobre el tono, fuerza y función neuromuscular pudiera estar relacionado, por un lado, con un efecto directo sobre el número y tamaño de las fibras musculares tipo II, y por otro, con una activación de la proteína-cinasa C que favorece el aumento de la reserva intracelular de calcio necesaria para la adecuada contracción muscular.
Vitamina D y el callo óseoA pesar del importante papel que desempeña la vitamina D en la aparición y el tratamiento de la osteoporosis, son escasos los trabajos que se han centrado en la influencia que ejerce en su reparación, consolidación, tanto desde el aspecto clínico como el de investigación básica.
Melhus et al.68 en un estudio experimental efectuado en ratas ovariectomizadas con depleción de vitamina D, demuestran que las propiedades mecánicas del callo de fractura están conservadas, lo que le sugiere que una formación inalterada del callo puede por sí misma compensar los efectos potencialmente significativos de la carencia de vitamina D y de estrógenos. En esta línea, Delgado-Martínez et al.69 señalan que la deficiencia de vitamina D no empeora la consolidación, dependiendo la resistencia mecánica total del callo solo en cierta parte de los niveles de calcitriol previos.
Sin embargo, Lindgren et al.70 en su estudio demuestran que una deficiencia de vitamina D bloquea la formación de hueso maduro durante la fase de reparación de la fractura, en tanto que el depósito de osteoide permanece inalterado.
Sean cuales sean los efectos de la deficiencia de vitamina D sobre el callo de fractura, los beneficios de la administración de vitamina D y sus metabolitos sobre la curación de las mismas han sido firmemente demostrados en modelos experimentales con animales sanos70,71, animales con déficit de vitamina D72–75 y animales con fracturas osteoporóticas76. La mayor parte de ellos han evaluado los efectos de la 1,25[OH]2D3 y 24,25[OH]2D3 y menos la acción de la 1-hidroxicolecalciferol, 25-OH-D69,77 o de la 1α,25-dihidroxi-2β(3-hidroxipropoxi) vitamina D3 (ED-71)78,79.
Si bien en un primer momento se advirtió de la posibilidad de que tras la administración de 1,25[OH]2D se produjese una inhibición de la síntesis de colágeno tipo I y una reducción de los niveles de procolágeno RNAm80, Omeroglu et al.71 demostraron que una sola dosis alta de vitamina D3 aumenta la cantidad de colágeno presente en el callo de fractura y acelera la organización de las fibras de colágeno, aumentando también la proliferación y diferenciación de células osteoprogenitoras del mismo. Cabe resaltar, que en este estudio se constató una mayor vascularización de los callos de fractura del grupo tratado con vitamina D3 en las primeras etapas de la curación de la fractura, efecto angiogénico descrito también por Hulth et al.81.
De manera más específica, y en estudios experimentales posteriores, se ha constatado que las células derivadas del periostio de ratas viejas responden de manera muy pobre a la 1,25[OH]2D382 siendo en el hueso esponjoso donde fundamentalmente se produce la respuesta proliferativa a la vitamina D.Con respecto a la administración combinada de 1,25[OH]2D y 24,25[OH]2D, Dekel et al.73 demuestran en pollos con déficit de vitamina D, que esta asociación proporciona unas mejores propiedades mecánicas del callo fracturario.Complementando el estudio anterior, Lidor et al.74,75 demostraron que las concentraciones de metabolitos de la vitamina D3 aumentan en el callo y en la epífisis proximal del hueso fracturado, encontrando una correlación significativa entre los niveles de 24,25[OH]2D, la actividad de la fosfatasa alcalina en los primeros 7 días tras la fractura y la formación de callo óseo cartilaginoso. Por el contrario, la 1,25[OH]2D se correlacionó con el grado de mineralización y de remodelado del callo.Yamane et al.79 al evaluar el efecto del metabolito ED71 (1α,25[OH]2D3) –producto análogo de la vitamina D que realiza una potente inhibición de la reabsorción ósea en situaciones de depleción estrogénica83 – demuestran que, en un modelo experimental de distracción ósea, este sustitutivo de la vitamina D es capaz de incrementar el volumen del callo óseo en las fases tempranas, facilitando la formación y aposición de hueso cortical denso.
Desde el punto de vista de investigación clínica, varios autores84,85 parecen demostrar el papel activo que desempeña la 24,25[OH]2D en la mineralización del callo durante el proceso de reparación de la fractura, al encontrar con respecto a los niveles basales un aumento significativo (p<0,05) de los niveles plasmáticos de este metabolito a las 6 semanas de la fractura, incrementos que se acompañan de aumentos progresivos de hasta el 40% de la 24-hidroxilasa renal85.De igual manera, Jingushi et al.86 demostraron que la concentración en plasma de 1,25[OH]2D desciende rápidamente al tercer día de la fractura y sigue disminuyendo hasta el décimo día, debido posiblemente a un aumento de la absorción por el callo de fractura.Este aumento de la absorción de los metabolitos de la vitamina D por el callo de fractura permite a Fu et al.76 sugerir que este sea el mecanismo por el cual la 1,25[OH]2D promociona la curación de las fracturas osteoporóticas, al actuar sobre las células óseas locales y sus receptores. En su trabajo los autores evaluaron igualmente el efecto de la 1,25[OH]2D sobre las propiedades microestructurales y biomecánicas del callo óseo, demostrando que la resistencia máxima del callo al test de flexión era superior en el grupo de 1,25[OH]2D3 con respecto al grupo control.A raíz de los resultados obtenidos en estos estudios preclínicos y clínicos, se han propuesto diferentes tipos de intervenciones terapéuticas con vitamina D y sus metabolitos para mejorar la formación del callo de fractura, proponiéndose la prescripción general de 1,25[OH]2D76, de una combinación de 1,25[OH]2D y 24,25[OH]2D o de de una vitamina D3 y vitamina K187 a pacientes con fractura por fragilidad con el fin no solamente de optimizar el proceso de consolidación y el del resultado biomecánico del callo sino de mejorar en general la calidad ósea del hueso osteoporótico. En este mismo sentido, Lidor et al.75 llegan a promover la aplicación local de 24,25[OH]2D en las fracturas por fragilidad para acelerar su curación y prevenir las pseudoartrosis.
Vitamina D, artrosis, artroplastia y aflojamiento protésicoVarios son los trabajos que han evaluado tanto experimental como clínicamente el papel que la insuficiencia/deficiencia de vitamina juega en la artrosis de cadera o rodilla, en la cirugía de sustitución articular y en el proceso de integración y de aflojamiento protésicos.
Los bajos niveles de 25[OH]D se han asociado al dolor articular88 y al desarrollo de una artrosis de rodilla o cadera89–92, sobre todo en pacientes menores de 60 años92, no encontrándose, sin embargo, asociación entre los VDR TaqI VDR, BSMI y ApaI y la susceptibilidad a la artrosis en un metaanálisis que incluyó 3.372 sujetos93. Esta posible asociación con la enfermedad osteodegenerativa lleva a sugerir a Heidari et al. la conveniencia de determinar los niveles de esta vitamina en los primeros estadios de la enfermedad92.
En la cirugía de reconstrucción articular, y posiblemente debido a la importante agresión tisular, substancial pérdida de masa ósea y reacción inflamatoria subsiguiente, se ha demostrado a partir del segundo día de la intervención, un incremento significativo de las concentraciones de proteína C-reactiva (p<0,001) y una disminución también significativa de la 25[OH]D (≈40%) (p<0,001), descenso que se hace todavía más llamativo a los tres meses de la cirugía (20-30%; p<0,01)94.
Si a esta situación le añadimos el hecho de que a muchos de los pacientes a los que se ha realizado una sustitución artroplástica por artrosis presentan una osteoporosis, un déficit de vitamina D27,90,94–96 y un hiperparatiroidismo secundario94 sería lógico pensar que la supervivencia del implante pudiese verse alterada al estar anómalamente elevado el catabolismo óseo. En este sentido, Nawabi et al.97 han encontrado resultados de supervivencia significativamente mayores en pacientes con niveles suficientes de vitamina D, encontrando una correlación positiva entre sus niveles séricos y la evolución postoperatoria del implante.
La hipótesis más aceptada para explicar el aflojamiento aséptico de las artroplastias98 propone que las partículas de desgaste inducen una reacción inflamatoria crónica por estimulación directa de monocitos y macrófagos99–102 lo que genera una elevada liberación de enzimas y sustancias mediadoras de la inflamación a nivel local. Esta cascada enzimática, produciría vía RANK-RANKL (receptor activator of nuclear factor kappa-B, receptor activator of nuclear factor kappa-Bligand) una mayor activación de los osteoclastos, produciendo un aumento de la reabsorción ósea en la interfaz hueso-implante103 que conduciría al fracaso por aflojamiento de la prótesis.
Pero ¿qué papel juega la vitamina D en este proceso? Se sabe que los monocitos y los macrófagos se pueden diferenciar en células de características citoquímicas y funcionales propias de los osteoclastos. Este hecho se ha conseguido in vitro a partir de células esplénicas de ratón en presencia de la 1,25[OH]2D y del factor de diferenciación de los osteoclastos (ODF), el RANKLy el factor estimulante de colonias de macrófagos (M-CSF)104 o a partir de macrófagos tomados de aflojamientos protésicos en presencia de 1,25[OH]2D, sin la necesidad del M-CSF105.A la vista de estos y otros estudios, Peersman et al.106 sugieren la necesidad de confirmar los posibles efectos negativos de los suplementos orales de vitamina D3 en pacientes con riesgo de aflojamiento protésico, sobre todo en pacientes con procesos inflamatorios de base.En este sentido, y desde el punto de vista clínico, Nixon et al.107 determinaron los niveles de vitamina D en 80 pacientes con artroplastia total de cadera con y sin aflojamiento protésico, no encontrando diferencias significativas entre ambos grupos (t-test; p=0,31), si bien el 19% tenían una deficiencia (<25mmol/l) y el 41% una insuficiencia de vitamina D (<50mmol/l).
Vitamina D e infeccionesLa vitamina D ejerce efectos antimicrobianos por distintos mecanismos, aún no esclarecidos del todo. En este sentido, recordemos que los receptores de la vitamina D se encuentran presentes en casi todos los tejidos, teniendo sus niveles circulantes una acción directa sobre los macrófagos, facilitando la motilidad y la acción fagocítica de los neutrófilos por estimulación de péptidos antimicrobianos, tales como la betadefensina 2 y la catelicidina108.
Una de las complicaciones quirúrgicas más graves y de compleja erradicación es la infección por el Staphylococcus aureus (S. aureus) y el S. aureus meticilin resistente (MRSA), gérmenes en los que se ha revelado la presencia de un potente estimulador de la activación de los osteoclastos109 siendo los principales causantes de osteomielitis, artritis y aflojamiento séptico de las artroplastias.
Olsen et al.110 evaluaron la posibilidad de que la vitamina D fuese un factor determinante en la colonización nasal por S. aureus. En su estudio un aumento de los niveles de vitamina D supuso una reducción de entre el 30 y el 50% de las colonizaciones. Un estudio previo realizado para investigar la asociación entre los niveles séricos de vitamina D y el status de portador nasal de MRSA en una población no institucionalizada de los EE.UU. (datos del National Health and Nutrition Examination Survey de los años 2001-2004) apreció que las personas con deficiencia de vitamina D tenían un riesgo estadísticamente significativo de 2,04 de portar MRSA (IC del 95%: 1,09-3,84)111.
Varios grupos de investigación están tratando de evaluar la posibilidad de que exista un condicionamiento genético para esta relación y que diferentes polimorfismos del VDR están implicados en la misma112–114.
ConclusionesLa insuficiencia (niveles de 25[OH]D entre 20 y 30ng/ml [50 y 75nmol/l]) y la deficiencia de vitamina D (niveles de 25[OH]D inferiores a 20ng/ml [<50nmol/l]) son un problema clínico relevante en los pacientes adultos candidatos a cirugía ortopédica y/o traumatológica, resultando especialmente prevalente en ancianos con fractura de cadera.
La edad (al decrecer con ella la síntesis cutánea y renal de la vitamina D), un bajo grado de exposición solar, un aporte dietético inadecuado (no compensado por la síntesis cutánea) y una discapacidad funcional antes de la fractura pueden actuar como factores desencadenantes de esta afección.
Son muchas las evidencias que apoyan la necesidad de mantener unos niveles adecuados de vitamina D en sangre para reducir el número de fracturas por fragilidad, favorecer la consolidación de las mismas, mejorar la función neuromuscular de los pacientes, prevenir las infecciones quirúrgicas, etc., y sin embargo, no es habitual que se haga determinaciones de la misma en este tipo de pacientes y que se instaure el tratamiento adecuado.
Por ello, la evidencia científica actual señala que, con independencia de que en la mayoría de los casos no se disponga de la técnica de laboratorio adecuada o de que esta resulta excesivamente cara, se debe indicar una determinación de los niveles de vitamina D en todos los pacientes con fractura osteoporótica de cadera y en los pacientes con fractura, de alta o baja energía, que presentan factores de riesgo de osteoporosis.
Existe un claro criterio mayoritariamente favorable a aconsejar niveles superiores a 30-40ng/ml (75-100nmol/l) de vitamina D, y a recomendar, en casi todos los casos, de 800 a 1.000UI/día de vitamina D para alcanzar estos niveles115, teniendo en cuenta que el tratamiento ha de mantenerse en el tiempo dado que el beneficio obtenido con el aporte de vitamina D se pierde en gran medida a los dos años de la interrupción terapéutica116.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.