La osteoporosis se caracteriza por una reducción de la masa ósea y una alteración de la calidad del hueso que determina una mayor susceptibilidad para sufrir fracturas que denominamos por fragilidad o de perfil osteoporótico. En estimaciones recientes, se calcula una incidencia anual de aproximadamente 200.000 nuevas fracturas en nuestro país, con una repercusión económica cercana a los 3.000 millones de euros. Además, se prevé que para el año 2025 se incremente este número en 80.000 fracturas, con un aumento paralelo en sus costes derivados de aproximadamente un 30%1. Esta mayor incidencia se debe fundamentalmente al aumento progresivo de la esperanza de vida, con el consecuente envejecimiento de la población, y que propiciará un escenario poblacional más susceptible. La edad es uno de los factores de riesgo de fractura más importantes, independiente además de la densidad mineral ósea (DMO), no solo por el deterioro progresivo de la resistencia ósea que puede originar, sino también porque a mayor edad, existen más problemas de movilidad, de dependencia y de existencia de comorbilidades que pueden estar directamente implicados en la consecución de la fractura2. Es cierto que si tenemos en cuenta el factor edad a la hora de analizar los datos de incidencia de fracturas parece que existe una tendencia a la reducción y estabilización de las mismas en el tiempo3, postulándose como una explicación plausible el aumento de los tratamientos antiosteoporóticos4, pero pese a esto, las previsiones en valor absoluto son al alza5, con las repercusiones clínicas y económicas que de ello se derivan.
Dentro de las fracturas de perfil osteoporótico se consideran fracturas «mayores» a las del fémur proximal, húmero proximal, vértebras y radio distal, ya que son las que más consecuencias tienen, tanto en datos de morbimortalidad como de costes6,7. Es complicado establecer la incidencia real de todas estas fracturas, ya que los sistemas de recogida de datos son heterogéneos y de difícil estandarización, aunque en el caso de las de fémur proximal, la necesidad de ingreso hospitalario y de solución quirúrgica en la mayoría de los pacientes facilita un mejor estudio y conocimiento. Se calcula que en la Unión Europea se producen anualmente unos 640.000 casos, mientras que en España el número asciende a unas 60.0008. Los datos epidemiológicos referentes a la fractura de cadera en España refieren una incidencia aproximada, según series, de unos 300 casos por 100.000 habitantes/año, con una razón de 3-4:1 en mujeres frente a los hombres9-15.
¿Qué importancia clínica tiene la fractura osteoporótica?Las principales fracturas de perfil osteoporótico repercuten no solo en la calidad de vida de los pacientes, sino también en su esperanza de vida.
Las consecuencias clínicas de la fractura vertebral son fundamentalmente el dolor de espalda, la cifosis y la pérdida de estatura. La percepción de calidad de vida además se reduce a medida que aumenta el número de fracturas16. Probablemente debido a diversas comorbilidades del paciente mayor, las fracturas vertebrales asocian, además, una disminución de la esperanza de vida que se ha estimado en unos 6años17.
La fractura de húmero proximal es la tercera fractura más común a partir de los 65años, englobando el 5% de todas las fracturas. Son más frecuentes en mujeres, generalmente con un alto grado de independencia. Se ha producido un importante incremento en los últimos 30años y se consideran claramente relacionadas con la osteoporosis18. Reducen la capacidad funcional, limitando de forma significativa las actividades de la vida diaria a los 6meses de la fractura19.
Las fracturas del radio distal no conllevan un aumento de la mortalidad, probablemente porque se producen en pacientes más jóvenes y con menor grado de afectación de su estado de salud, pero pueden originar secuelas que limiten la percepción de su calidad de vida, sobre todo en pacientes más mayores20.
La fractura de cadera es un proceso clínico grave que implica una significativa morbimortalidad21. Se estima que estos pacientes tienen una mortalidad intrahospitalaria según series cercana al 5%, con un 20% de pacientes que fallecen el primer año. El 30% tienen una incapacidad permanente, el 40% presentan limitaciones serias de deambulación de forma independiente, con un 80% de pacientes que tienen incapacidad de realizar al menos una actividad independiente cada día. La tasa de mortalidad de estos pacientes duplica la de las personas de la misma edad sin fractura, con los problemas respiratorios y cardiovasculares como principales causas de defunción dentro de los primeros 30días22.
No hay que olvidar que la presencia de una fractura de perfil osteoporótico es uno de los factores de riesgo más importantes para la aparición de nuevas fracturas, sobre todo durante el primer año23. Pese a esta consideración, en un estudio que analiza la carga asociada a las fracturas de cadera en España24, en el que un 22,2% de los pacientes fracturados había tenido una fractura previa, solo un 1,8% de los pacientes habían sido diagnosticados de osteoporosis con criterios densitométricos y tan solo un 15,6% informaron de haber recibido en algún momento un tratamiento previo para la osteoporosis.
Evaluación diagnóstica¿Qué es la osteoporosis?La definición que podríamos considerar «oficial» acordada en una conferencia de consenso se describe como un trastorno generalizado del esqueleto caracterizado por una alteración de la resistencia ósea que predispone a la persona a un mayor riesgo de fractura25. Conceptualmente la resistencia ósea es la integración de la cantidad y la calidad del hueso, añadiéndose a definiciones previas criterios cualitativos que implican que este riesgo de fractura está condicionado no solo por «cuánto» hueso hay, sino también por «cómo» es ese hueso y «cómo» está organizado.
¿Qué es la fractura osteoporótica?La fractura de perfil osteoporótico es aquella que se produce tras un traumatismo de baja energía, como una caída de la propia altura, o en ausencia de un traumatismo identificable26, localizada en cualquier hueso del esqueleto axial o periférico, con excepción del cráneo y el macizo facial, una vez excluidas otras causas de fragilidad esquelética (fracturas patológicas)27. Como se ha comentado anteriormente, las más frecuentes y relevantes son las de columna vertebral, fémur proximal, antebrazo distal y húmero proximal. Otras localizaciones son menos frecuentes, como las fracturas del extremo distal del fémur, las fracturas costales, las fracturas del extremo distal del húmero, las proximales de tibia y las de los huesos de la pelvis9.
¿Cuáles son los factores de riesgo de una fractura osteoporótica?Podemos considerar que una fractura de perfil osteoporótico se produce en un contexto determinado: existe una fragilidad ósea y el paciente sufre una caída. Por tanto, todas aquellas situaciones que impliquen una pérdida de la consistencia del hueso y aquellas que conlleven que el paciente tenga mayor tendencia a una caída pueden considerarse factores de riesgo de este tipo de fracturas. Existen numerosos factores de riesgo tanto de osteoporosis como de fractura osteoporótica identificados, e indudablemente, cuando concurren varios de ellos, aumenta considerablemente el riesgo28. En los principales estudios epidemiológicos realizados en nuestro entorno29-32 se reflejan como principales factores de riesgo la edad avanzada, el sedentarismo, los antecedentes personales de fractura, los antecedentes familiares de fractura, la menopausia precoz, las enfermedades que pueden producir osteopenia como la artritis reumatoide, el consumo de corticoides, las caídas y el resultado de la densitometría29-32.
En lo que respecta a nuestra especialidad sería destacable, como se ha comentado con anterioridad, la presencia de una fractura previa como factor predictor de nuevas fracturas, ya que el traumatólogo es el que maneja habitualmente este tipo de pacientes y puede disponer de una buena oportunidad de actuación para la prevención de la aparición de nuevas fracturas.
Respecto a la medición de la masa ósea mediante densitometría, aunque se reconoce que su resultado puede ser considerado como un factor de riesgo, también se reconoce que la mayoría de las fracturas se producen con una DMO normal u osteopénica30, por lo que se considera una medida con capacidad no predictiva en poblaciones asintomáticas o sin un alto riesgo de fractura33.
¿Qué es y para qué sirve la herramienta FRAX®?El modelo FRAX® es una herramienta de evaluación del riesgo de fractura para hombres y mujeres de entre 40 y 90años. Permite calcular la probabilidad de riesgo absoluto de fractura de cadera y de fracturas principales (vertebral, cadera, húmero y muñeca) a 10años. Está basada una serie de metaanálisis que identifican los factores de riesgo clínicos que se asocian con un mayor riesgo de fractura, así como en datos de incidencia y prevalencia de fracturas en cada país. Los factores de riesgo que tiene en cuenta son la edad, el sexo, el peso, la talla, la presencia de fracturas previas, la historia de fractura en padre/madre, el tabaquismo, el tratamiento con corticoides durante más de 3meses, la presencia de artritis reumatoide, el diagnóstico de osteoporosis secundaria y el consumo de alcohol. Se puede realizar el cálculo añadiendo el valor de la DMO en cuello femoral, aunque también es válido sin criterio densitométrico34.
El interés del FRAX® radica en la posibilidad de establecer un umbral de intervención que pueda ser útil en la toma de decisiones tanto diagnósticas como terapéuticas. Uno de sus principales problemas es la falta de validación en nuestro país, por lo que no queda determinado cuáles son los valores idóneos a partir de los cuales es conveniente instaurar una estrategia de tratamiento.
Los principales estudios realizados en nuestro país para valorar la capacidad discriminativa de la herramienta32,35-37 reflejan que la versión española del FRAX® infravalora el riesgo de fractura principal y de cadera a la mitad, por lo que su capacidad predictiva es baja. Se recomienda seguir los puntos de corte del FRAX® del Reino Unido, que sí está validado, por ser similar al FRAX® español corregido35. Otras debilidades del test es que solo se puede emplear en pacientes que no han recibido tratamiento previamente, que no valora la presencia de caídas y que no diferencia entre las diferentes fracturas y su número, pero pese a esto, puede ser una herramienta útil para establecer un escenario de riesgo para cada paciente.
¿Qué supone un alto riesgo de fractura osteoporótica?Es difícil establecer la definición de «paciente con alto riesgo de fractura». En un documento de consenso realizado en nuestro país en el que se expusieron diferentes puntos de vista en función de las especialidades implicadas38, se concluyó que la edad avanzada, los antecedentes personales y familiares de fractura y la masa ósea muy baja son factores que contribuyen significativamente a un incremento del riesgo de fractura, y por tanto es importante tenerlos en cuenta a la hora de establecer estrategias de manejo de este tipo de pacientes. Empleando la herramienta FRAX®, podemos considerar un alto riesgo de fractura si existe un riesgo de fractura de cadera ≥3% o de fractura ≥20%39. El análisis individualizado de cada paciente, con su historial clínico detallado, nos debe situar en un escenario de riesgo que debemos saber identificar, sobre todo cuando confluyen varios de estos factores, para evitar, en la medida de lo posible, la aparición de la fractura.
¿Qué datos analíticos son importantes para el diagnóstico de la fractura osteoporótica?Podemos establecer que existe una osteoporosis primaria, posmenopáusica o senil y una secundaria, que engloba una serie de patologías que producen una pérdida de la masa ósea, una alteración estructural del hueso, una disminución de su resistencia y, en definitiva, una aumento del riesgo de fractura.
En el varón, la osteoporosis es secundaria hasta en el 60% de los casos40,41, siendo las causas más frecuentes de la misma el hipogonadismo, el alcoholismo, el tratamiento corticoideo, los tratamientos de carencia androgénica en el carcinoma de próstata y el mieloma42. Por el contrario, solo un 30% de las mujeres que aparentemente presentan osteoporosis primaria posmenopáusica tienen una causa identificable de osteoporosis secundaria41. Esta circunstancia no debe resultar un impedimento para la realización en estas pacientes de pruebas diagnósticas diferenciales que excluyan las principales causas secundarias de la enfermedad43,44. Los motivos más frecuentes de osteoporosis secundaria en la mujer son la hipoestrogenemia, el hipertiroidismo, el hiperparatiroidismo primario, la diabetes mellitus tipoi, la artritis reumatoidea, el tratamiento corticoideo y el anticonvulsivante.
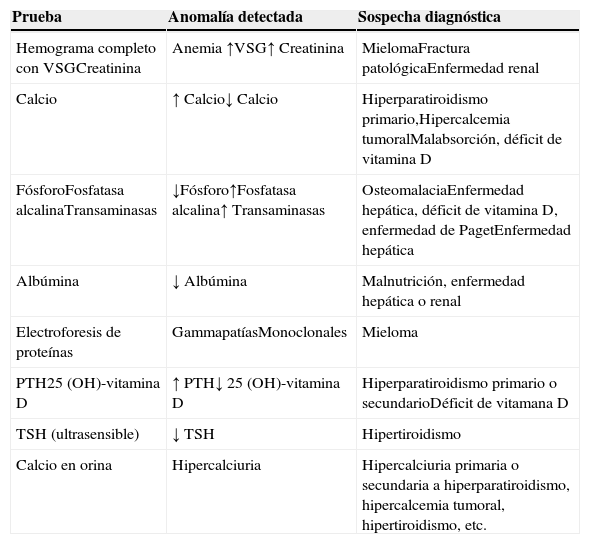
Respecto a la analítica básica que hay que solicitar para descartar las causas más frecuentes de osteoporosis secundaria, esta debería constar de un estudio analítico basal (hemograma completo con VSG, bioquímica sérica con calcio, fósforo, fosfatasa alcalina, transaminasas, urea, creatinina y calcio en orina de 24h) y un estudio específico dirigido al cribado de las causas más importantes de osteoporosis secundaria desde el punto de vista clínico (albúmina, proteínas, proteinograma, niveles séricos de TSH, PTH, 25-OH vitaminaD) que permitirán generalmente identificar cualquier trastorno hematológico, mineral o electrolítico, y desvelar alguna otra enfermedad sistémica o endocrinometabólica que se haya pasado por alto en la valoración inicial del paciente. No se recomienda la determinación sistemática de los marcadores óseos para el diagnóstico diferencial de la paciente con osteoporosis45. Su medición puede ser útil para ayudar a identificar a sujetos con un mayor riesgo de fractura, y especialmente para valorar de forma precoz la respuesta a un tratamiento, tanto antirresortivo como osteoformador. Como sinopsis metodológica para descartar las causas más frecuentes de osteoporosis secundaria recomendamos la realización de las pruebas analíticas recogidas en la tabla 1.
Pruebas analíticas en el diagnóstico diferencial de la osteoporosis
| Prueba | Anomalía detectada | Sospecha diagnóstica |
|---|---|---|
| Hemograma completo con VSGCreatinina | Anemia ↑VSG↑ Creatinina | MielomaFractura patológicaEnfermedad renal |
| Calcio | ↑ Calcio↓ Calcio | Hiperparatiroidismo primario,Hipercalcemia tumoralMalabsorción, déficit de vitamina D |
| FósforoFosfatasa alcalinaTransaminasas | ↓Fósforo↑Fosfatasa alcalina↑ Transaminasas | OsteomalaciaEnfermedad hepática, déficit de vitamina D, enfermedad de PagetEnfermedad hepática |
| Albúmina | ↓ Albúmina | Malnutrición, enfermedad hepática o renal |
| Electroforesis de proteínas | GammapatíasMonoclonales | Mieloma |
| PTH25 (OH)-vitamina D | ↑ PTH↓ 25 (OH)-vitamina D | Hiperparatiroidismo primario o secundarioDéficit de vitamana D |
| TSH (ultrasensible) | ↓ TSH | Hipertiroidismo |
| Calcio en orina | Hipercalciuria | Hipercalciuria primaria o secundaria a hiperparatiroidismo, hipercalcemia tumoral, hipertiroidismo, etc. |
La prueba radiológica básica para el diagnóstico de la fractura osteoporótica es la radiografía simple. No solo aporta un diagnóstico de confirmación de la mayoría de las fracturas, sino que también es posible realizar una aproximación al grado de pérdida de masa ósea y de desestructuración cualitativa del hueso afecto. Si bien la radiografía simple solo es capaz de detectar cambios en la masa ósea cuando ya se ha producido una pérdida de DMO superior al 30%, sí permite realizar generalmente una valoración aproximativa del grado de osteoporosis regional ósea. Por ejemplo, a nivel de la cadera se ha utilizado con este fin el clásico índice radiológico de Singh, que no es más que una valoración semicuantitativa del grado de osteoporosis regional de la extremidad proximal de fémur basada en los patrones radiológicos de pérdida progresiva de los haces trabeculares de compresión y tensión, a medida que va disminuyendo la masa ósea46.
El diagnóstico en ocasiones puede ser complicado, por ejemplo en lo que respecta a la fractura vertebral, al no haber una línea de fractura identificable47. Su determinación está basada en criterios morfométricos basados en la medición del tamaño vertebral en su porción anterior, media y posterior, habiéndose descrito varios métodos de medida, siendo de estos el más aceptado el semicuantitativo de Genant48. Se considera una deformidad ligera cuando existe una reducción del 20 a 25% de la altura anterior media o posterior del cuerpo vertebral, una deformidad moderada cuando hay una disminución del 25-40% de la altura posterior, media o anterior del cuerpo vertebral, y una deformidad grave cuando existe un 40% o más de reducción de la altura posterior, media o anterior del cuerpo vertebral.
Por otro lado, en ocasiones las fracturas vertebrales pueden ser poco expresivas clínicamente o pasar desapercibidas, pudiéndose realizar el diagnóstico de forma incidental en una exploración radiológica realizada por otro motivo, como por ejemplo una radiografía de tórax49, lo cual puede ser importante tener en cuenta para el cribado de la enfermedad.
En otras ocasiones pueden ser útiles pruebas como la tomografía axial computarizada (TAC) y a la resonancia magnética (RM). En el caso de la TAC, nos puede resultar de utilidad en el diagnóstico de fracturas ocultas, especialmente en algunos casos de fracturas del cuello femoral que no se aprecian correctamente en examen radiográfico simple, y también en algunas fracturas complejas, en las que la reconstrucción tridimensional del segmento óseo fracturado nos puede ayudar en la elección de la técnica quirúrgica. La resonancia magnética puede ser también útil en determinadas fracturas lentas (sacro, cadera…) en las que las manifestaciones radiográficas suelen ser tardías, y en aquellos casos en los que se dude si una fractura vertebral es aguda, o antigua, pudiendo visualizar el edema óseo. También nos puede ayudar en algunas fracturas de columna en las que haya dudas sobre la integridad del muro posterior y se piense realizar alguna técnica de aumento con cemento de metilmetacrilato, ya que la falta de integridad del muro posterior constituye una contraindicación relativa para su realización.
¿Cómo diagnosticamos densitométricamente la osteoporosis?Se recomienda como técnica de referencia para medir la DMO, la absorciometría radiográfica de doble energía (dual energy X-ray absorciometry [DXA]). La DXA es una técnica con una buena precisión, baja exposición radiológica y que permite la medición de la DMO tanto en el esqueleto axial como en el periférico.
Aporta 2 valores: T-score (número de desviaciones estándar [DS] de la DMO de un individuo en comparación a una población de referencia normal) y Z-score (número de DS de la DMO de un individuo en relación a una población de su mismo sexo, raza y edad). Aunque el T-score puede medirse en la columna lumbar, cuello femoral y cadera, la OMS recomienda que para la clasificación de osteoporosis se utilicen los valores en cuello femoral. Los valores que se obtienen son aplicables tanto a hombres como a mujeres.
El Z-score no se utiliza para definir osteoporosis, pero puede identificar pacientes con menor DMO que la esperada para su edad en niños y adultos de menos de 50años en los que está recomendado para la interpretación de los resultados. Si se utiliza en el seguimiento, debe manejarse la misma técnica y evaluar el T-score en la misma zona anatómica50.
El diagnóstico de osteoporosis puede verse influido por diversos factores, como la región donde se realiza la medición, los posibles artefactos (fracturas, artrosis, escoliosis, calcificaciones vasculares, osteomalacia, etc.), el número de regiones exploradas y los valores de referencia aplicados, por lo que es recomendable explorar al menos 2 regiones del esqueleto. Si no es posible realizar una DXA en la columna lumbar o en la cadera, se recomienda realizar la DXA en el tercio distal del radio del antebrazo no dominante. Esto puede suceder en caso de alteraciones anatómicas (grandes escoliosis, trastornos degenerativos, fracturas vertebrales múltiples, obesidad mórbida) o problemas de tipo técnico (presencia de elementos de tipo metálico por cirugía del raquis, artroplastia de cadera).
Los ultrasonidos, los equipos DXA periféricos y la tomografía computarizada cuantitativa central o periférica son útiles para predecir un riesgo elevado de fractura pero no deben utilizarse para el diagnóstico, el seguimiento o la evaluación de la respuesta terapéutica en pacientes con osteoporosis.
Los valores clásicos que definen la masa ósea son: DMO normal con un T-score≥−1,0DS, osteopenia con una T-score entre −1,0 y −2,5DS, y osteoporosis con una T-score≤−2,5DS.
¿Cuándo hay que solicitar una densitometría ósea?El cribado densitométrico de la población general no es coste efectivo y existe una gran variabilidad en cuanto a las indicaciones de la densitometría. No obstante, la evaluación de factores de riesgo y la presencia de fractura sí ha demostrado ser coste eficaz, y esta eficacia se incrementa cuando se añade el uso de la DXA51. Como cualquier prueba complementaria, antes de solicitarla es esencial tener la seguridad de que el resultado de esta va a influir en la decisión terapéutica que se va a tomar. Es un factor más a tener en cuenta en la evaluación global del riesgo de fractura. Podríamos considerar que está indicada en las siguientes situaciones52,53:
- a)
Mujeres y hombres mayores de 65años con riesgo moderado de fractura, establecido a través de sus factores de riesgo o con la herramienta FRAX®, cuando el valor de su resultado pueda suponer un cambio en la actitud terapéutica.
- b)
En pacientes menores de 65años con factores de riesgo elevado para fracturas por fragilidad.
- c)
En pacientes menores de 40años con factores de riesgo muy elevado de fractura como antecedentes de varias fracturas de perfil osteoporótico, fractura osteoporótica mayor o tratamiento con altas dosis de corticoides.
- d)
Antes del inicio de tratamientos que puedan afectar a la DMO.
Se recomienda realizar los controles densitométricos cada 2-3años. En general no se recomienda realizar los controles densitométricos antes de los 2años, ya que se ha observado que algunas pacientes tratadas pierden masa ósea el primer año pero pueden ganarla durante el segundo año.
Abordaje terapéutico¿Cómo abordar el tratamiento de una fractura vertebral aguda osteoporótica?Una vez confirmado el diagnóstico de fractura vertebral por fragilidad y descartados otros procesos que puedan comenzar como tal, el tratamiento inicial es conservador, y el objetivo prioritario es conseguir un control adecuado de los síntomas para reducir en la medida de lo posible el tiempo de reposo y evitar la atrofia muscular. El control del dolor, la prevención de complicaciones como el íleo paralítico o la deformidad progresiva que este tipo de fracturas pueden producir, la terapia rehabilitadora encaminada a facilitar una recuperación funcional en el menor tiempo posible y la prevención secundaria de la aparición de nuevas fracturas son los pilares básicos en su abordaje. Ocasionalmente puede ser necesario el ingreso hospitalario para un mejor control de la sintomatología.
El control satisfactorio del dolor mejora el bienestar del paciente y contribuye a una movilización precoz, lo cual reduce las complicaciones derivadas del encamamiento, entre las que se encuentran la pérdida ósea54. El tratamiento inicial debe hacerse con paracetamol y antiinflamatorios no esteroideos, utilizando opiáceos si fuera preciso, intentando controlar un dolor que suele persistir de 6 a 12semanas55. En ocasiones puede ser necesario realizar reposo en cama con colchón duro, pero siempre durante un período corto de tiempo, iniciando ya la primera semana la sedestación y deambulación progresivas.
Pese al uso extendido de ortesis como tratamiento de la fase aguda de la fractura vertebral, solo hay un estudio prospectivo aleatorizado con este tipo de dispositivos56. En este trabajo se aprecia una mejora en el dolor, en la calidad de vida y en la recuperación de las actividades diarias, así como un mayor desarrollo muscular. La tasa de abandonos de los corsés suele ser muy alta, por lo que se recomiendan dispositivos ligeros y fáciles de utilizar. Los dispositivos tipo Jewett y los semirrígidos de ensilladura lumbar tipo CAMP, con tirantes en los hombros, son generalmente mejor tolerados.
En lo que respecta al tratamiento quirúrgico, podemos considerar 2 escenarios: primero, cuando existe una afectación neurológica secundaria a la fractura, hecho infrecuente en las fracturas osteoporóticas, y segundo, cuando existe un fracaso del tratamiento conservador, sobre todo en lo referido al control del dolor. En el primer caso es necesario recurrir a la cirugía convencional, bien con abordaje posterior o combinado anterior y posterior, teniendo en cuenta la poca resistencia del tejido óseo de estos pacientes que puede conllevar fracasos en la instrumentación y en la artrodesis. En el segundo caso podemos recurrir a técnicas mínimamente invasivas como son la vertebroplastia y la cifoplastia.
Estas técnicas, consistentes en la introducción de un cemento de polimetilmetacrilato en el cuerpo vertebral fracturado, directamente o bien con un balón que previamente corrige la altura vertebral, tienen como objetivo estabilizar la fractura y disminuir el dolor. En un reciente trabajo que analiza los riesgos y beneficios de ambas técnicas en comparación con el tratamiento conservador57 se concluye que aunque pueda existir una mejora inicial del control del dolor, a largo plazo los beneficios analgésicos y funcionales son discretos. Además, existe un riesgo aumentado de nuevas fracturas en las vértebras adyacentes a las tratadas con estas técnicas, sobre todo en aquellos pacientes con un mayor número de vértebras fracturadas, en los que se realiza un mayor número de procedimientos, en los de mayor edad, en los que tienen una menor DMO y en los que existe fuga del cemento. Debido a ello, deben ser utilizadas bajo criterios clínicos estrictos, cuando un adecuado tratamiento analgésico no ha sido efectivo en el control del dolor y siempre que se compruebe la existencia de edema óseo en la vértebra tras examen con resonancia magnética. La cifoplastia difiere de la vertebroplastia en que proporciona una mejor reestructuración de la anatomía de la vértebra y disminución del ángulo cifótico, pero también con un coste mayor.
¿Cómo abordar el tratamiento de una fractura no vertebral aguda osteoporótica?Como se ha comentado anteriormente, las fracturas no vertebrales más frecuentes son las de fémur proximal, las de húmero proximal y las de muñeca. Dejando de lado el tratamiento específico de cada una de ellas, que excede el cometido de esta guía, es importante destacar que en general estas fracturas poseen unas características que las diferencian de las que aparecen en huesos con una densidad y conectividad óseas normales, y por tanto es importante tenerlas en cuenta, sobre todo si optamos por un tratamiento quirúrgico, para evitar, en la medida de lo posible, fracasos en su manejo. Existen factores mecánicos y biológicos que las diferencian de las que aparecen en pacientes sin osteoporosis. Entre los factores mecánicos se puede destacar la localización de la fractura, que afecta fundamentalmente a la zona metafisaria, estructurada mayoritariamente por hueso trabecular cuyo déficit en la osteoporosis, sobre todo en las trabéculas horizontales, va a originar una disminución de la resistencia a la presión lateral, por lo que la estabilidad de la fijación interna es en ocasiones difícil de conseguir. También el hueso cortical tiene su importancia, ya que en el proceso osteoporótico aparece adelgazado, con un mayor número de poros y con mayor diámetro, características que también pueden tener su influencia negativa en la estabilidad del implante. En lo que respecta a los factores biológicos, parece que el hueso osteoporótico consolida de manera diferente al hueso sano, aunque haya pocos trabajos a nivel clínico que lo reflejen58; además, hay que tener en cuenta el estado general del paciente que sufre la fractura, que suele ser de edad avanzada, frecuentemente con varias comorbilidades, y habitualmente polimedicado, factores que pueden influir de forma negativa en el resultado final del tratamiento59.
El objetivo principal del tratamiento de este tipo de fracturas es recuperar lo más precozmente posible la función, y para conseguirlo es necesario tener una fijación sólida de la fractura. Esto no será siempre fácil por las razones expuestas anteriormente. Por ello, en determinados casos tendremos que hacer un planteamiento terapéutico diferente al que se hace en el paciente joven. Todo ello hace que el tratamiento de las fracturas en el paciente con osteoporosis suponga un reto para el cirujano ortopédico.
¿Cuáles son las medidas no farmacológicas que se deben utilizar?Existen una serie de medidas consideradas universales para la prevención primaria y secundaria de las fracturas por fragilidad. En primer lugar limitar los hábitos tóxicos, no solo por su repercusión ósea sino también por su beneficio en otros ámbitos de la salud. La supresión del tabaco, la reducción del consumo de alcohol hasta menos de 3unidades diarias y moderar la ingesta de bebidas ricas en cafeína favorecen el mantenimiento de la masa ósea60,61. Una dieta adecuada, evitando el exceso de sal que favorece la excreción renal de calcio, con ingesta adecuada de proteínas (1g/kg/día) y de calcio, unos 1.000-1.200mg/día, junto con un adecuado aporte de vitaminaD (sobre 800UI diarias), hace que el riesgo de fractura sea menor39,62. Se ha postulado que la suplementación con preparados de calcio pueda estar en relación con eventos cardiovasculares63, aunque no existe suficiente evidencia para confirmarlo64. Se recomienda que los pacientes tengan un adecuado aporte de calcio, preferiblemente proporcionado por la dieta, recurriendo a preparados farmacológicos en caso contrario. Evitar el sedentarismo, promoviendo el ejercicio físico regular durante toda la vida, adaptado para cada edad e individuo, puede fortalecer la musculatura, mejorar el equilibrio, la agilidad y la salud en general. Este ejercicio en las primeras décadas de la vida favorece la adquisición de un pico de masa óptimo, mientras que en los adultos mejora o mantiene esta masa ósea con ejercicios de impacto y carga65,66. Las estrategias de prevención de caídas, promoviendo el ejercicio físico multicompetente, con la reducción y retirada de fármacos que las pueden originar, corrigiendo déficits sensoriales, tratando diversas enfermedades sobre todo cardiovasculares, modificando riesgos del hogar y corrigiendo déficits nutricionales, sobre todo en lo referente a la vitaminaD, son uno de los pilares no farmacológicos del manejo de estos pacientes67.
¿Qué importancia tiene la vitamina D en cirugía ortopédica y traumatología?La vitamina D es una hormona tipo esteroide que actúa sobre sus receptores en una gran variedad de tejidos y células. En el caso del hueso, interviene en diversos procesos celulares, favorece la mineralización de la matriz osteoide y regula los niveles plasmáticos de calcio y también, por extensión, de los niveles de hormona paratiroidea. Su déficit severo induce una disminución de la calcemia y un aumento de la hormona paratiroidea que provocan un incremento en la remodelación ósea y una disminución de la masa ósea que puede originar raquitismo en el niño y osteomalacia y osteoporosis en el adulto68.
Se ha constatado la existencia de una relación entre los niveles bajos de vitaminaD y una mayor prevalencia de fracturas de perfil osteoporótico, con tasas de hipovitaminosis en pacientes con fractura de cadera en algunas series superiores al 90%. Pese a esta consideración, parece que la administración aislada de la hormona tiene poca probabilidad de prevenir las fracturas por fragilidad, no así si se realiza conjuntamente con suplementos de calcio, consiguiendo reducir el riesgo de fracturas de cadera, sobre todo en pacientes institucionalizados69.
La vitaminaD también influye en el mantenimiento del tono muscular, cuestión de especial importancia en la prevención de las caídas. Desde el punto de vista clínico, valores de 20ng/ml de vitaminaD se han asociado a un aumento del balanceo corporal, baja propiocepción del miembro y un mayor desplazamiento del centro de gravedad que alteran el control de la marcha70. Cuando estos niveles son menores de 10-12ng/ml se produce una disminución manifiesta de la fuerza muscular, estableciéndose una miopatía franca o sarcopenia de localización proximal, generalmente en extremidades inferiores71, cuando dichos niveles se encuentran por debajo de 8ng/ml. Esta miopatía por deficiencia de vitaminaD puede contribuir igualmente a un aumento del riesgo de caídas y, por tanto, a la producción de una fractura.
Respecto a la formación del callo óseo, la administración de vitaminaD aumenta la calidad de colágeno, acelera la organización de sus fibras y la proliferación y diferenciación de las células osteoprogenitoras del callo de fractura. Asimismo, induce una mayor vascularización del callo en las primeras etapas de la curación de la fractura sin interferir en el proceso natural de consolidación de la misma, mejorando su consistencia y resistencia, fundamentalmente en el hueso esponjoso72, lo que invita a pensar que unos niveles adecuados de vitaminaD ejercerán una acción positiva en el proceso de consolidación tras una fractura.
Otro punto importante es la asociación entre niveles bajos de vitaminaD y el desarrollo de artrosis de cadera y rodilla73, existiendo además trabajos que encuentran cifras de supervivencia de los implantes tras la cirugía de recambio articular significativamente superiores en pacientes con niveles adecuados de vitaminaD74.
Respecto a la dosis diaria a administrar y los niveles sanguíneos a conseguir, un reciente metaanálisis75 establece que para mantener una adecuada masa ósea podrían ser suficientes dosis de 800UI diarias, para mantener unos niveles cercanos a 40ng/ml, asegurando siempre una correcta ingesta de calcio de 1.000-1.200mg —preferiblemente con la dieta—, aunque hay autores que defienden una suplementación a dosis superiores76.
¿Qué fármacos están actualmente disponibles para la prevención y tratamiento de la fractura osteoporótica?Antirresortivos o anticatabólicosTerapia hormonal sustitutivaActualmente no está recomendado su uso como tratamiento de le osteoporosis; se debe valorar su uso para el tratamiento de los síntomas asociados a la menopausia, utilizando la menor dosis y durante el menor tiempo posible, bajo supervisión de un ginecólogo. Se debe informar a la paciente de los efectos beneficiosos sobre el esqueleto que este tratamiento aporta.
RaloxifenoMecanismo de acción77Análogo selectivo del receptor estrogénico (SERM). Cuando actúa sobre las células diana se comportan como agonistas/antagonistas de los receptores estrogénicos de manera tejido específicas. Con este perfil farmacológico se postulan efectos estrogénicos favorables evitando los efectos desfavorables sobre mama y endometrio. Se puede considerar el raloxifeno como un SERM de segunda generación dentro de este grupo terapéutico
Eficacia antifractura78Raloxifeno tiene eficacia probada en la reducción de riesgo de fractura vertebral con un grado de recomendación A a la dosis de 60mg/día orales.
Paciente idóneo para usoMujer no fértil con poco riesgo de fractura de cadera sin factores de riesgo cardiovasculares en la que se quiera disminuir el riesgo de padecer fractura vertebral y concomitantemente disminuir el riesgo de padecer cáncer de mama en ausencia de cáncer de endometrio o metrorragia no filiada.
Aspectos de seguridad para conocer en su usoDe la evidencia disponible podemos concluir que los 2 efectos secundarios más relevantes son:
Fenómenos tromboembólicos: 0,9% (con un número necesario de tratamientos para tener el evento de 157 con un intervalo de confianza del 95%).
Sofocos: 13,5% (con un número necesario de tratamientos para tener el evento de 20 con un intervalo de confianza del 95%).
BazedoxifenoMecanismo de acciónAnálogo selectivo del receptor estrogénico (SERM) con gran afinidad a los receptores estrogénicos alfa y beta, pero siendo su unión claramente superior a los receptores alfa. Se puede considerar el bazedoxifeno como un SERM de tercera generación dentro de este grupo terapéutico por la selectividad de su mecanismo de acción, aunque no está claramente establecida la trascendencia clínica de este hecho.
Eficacia antifractura79Bazedoxifeno, a la dosis de 20mg/día orales, tiene eficacia probada en la reducción de riesgo de fractura vertebral establecida con criterios morfológicos.
Paciente idóneo para usoSimilar a raloxifeno.
Aspectos de seguridad para conocer en su usoEl perfil de seguridad es similar al de raloxifeno, si bien algunas agencias han establecido planes de vigilancia de seguridad cardiovascular.
CalcitoninaEs una hormona polipeptídica que inhibe parcialmente la formación y la actividad de los osteoclastos. Ha sido retirada su indicación como terapia para la osteoporosis bajo recomendaciones de la Agencia Europea de Medicamentos, por el riesgo de desarrollo de enfermedades neoplásicas con su tratamiento a largo plazo en su presentación intranasal80. Actualmente sus indicaciones en solución inyectable o en perfusión son la prevención de la pérdida aguda de masa ósea debida a la inmovilización repentina, tratamiento del Paget en pacientes que no responden a otros tratamientos y en la hipercalcemia originada por el cáncer, siempre con una duración de la administración lo más corta posible.
BifosfonatosMecanismo de acciónSon análogos químicos de pirofosfato, se unen a la hidroxiapatita del hueso. Los bifosfonatos de primera generación, o no nitrogenados, actúan disminuyendo la resorción ósea de los osteoclastos, induciendo su apoptosis por la producción de metabolitos tóxicos del ATP, actualmente casi en desuso, mientras que los de segunda generación, que poseen grupo amino que les confiere mucha más potencia antirresortiva, actúan interfiriendo en la vía metabólica del mevalonato, que altera el borde ondulado del osteblasto y finalmente produce su apoptosis. Según el fármaco, pueden ser administrados de forma oral y/o intravenosa (tabla 2).
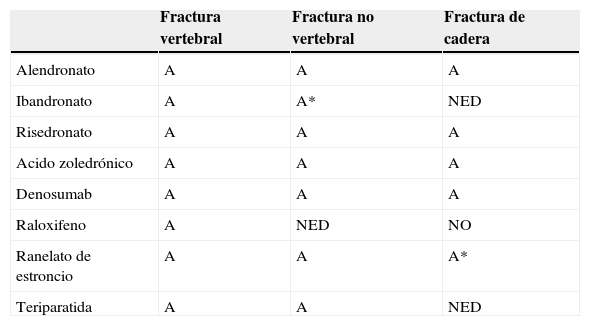
Resumen de la eficacia de los diferentes fármacos disponibles
| Fractura vertebral | Fractura no vertebral | Fractura de cadera | |
|---|---|---|---|
| Alendronato | A | A | A |
| Ibandronato | A | A* | NED |
| Risedronato | A | A | A |
| Acido zoledrónico | A | A | A |
| Denosumab | A | A | A |
| Raloxifeno | A | NED | NO |
| Ranelato de estroncio | A | A | A* |
| Teriparatida | A | A | NED |
A: grado de recomendación A; A*: estudio post hoc; NED: no evidencia disponible.
Varios ensayos clínicos han demostrado que aumentan la DMO y reducen el riesgo de fractura.
El estudio pivotal FIT con alendronato81 demostró una reducción del 47% en el riesgo relativo (RR) de aparición de nuevas fracturas vertebrales (RR: 0,53; IC95%: 0,41-0,68), una reducción del 51% en el de fractura de cadera (RR: 0,49; IC95%: 0,23-0,99) y una reducción del 48% en el riesgo de fracturas de la extremidad distal del radio (RR: 0,52; IC95%: 0,31-0,87).
El estudio VERT con risedronato82 ha demostrado una reducción significativa del 41% en la incidencia de fractura vertebral (RR: 0,59; IC95%: 0,42-0,82) y una reducción del 39% en la de fractura no vertebral (RR: 0,61; IC95%: 0,39-0,94) en mujeres que presentaban al menos una fractura vertebral de base.
El estudio HIP83 evaluó la eficacia de risedronato frente a placebo, que demostró una disminución significativa del 30% en RR de padecer una fractura de cadera (RR: 0,7; IC95: 0,6-0,9; p=0,02).
Ibandronato en el estudio BONE84 redujo significativamente el RR de nuevas fracturas vertebrales morfométricas en comparación con placebo en un 62% para el grupo continuo diario (RR: 0,38; IC95%: 0,25-0,59).
El estudio HORIZON85 con zoledronato demostró reducir la fracturas vertebrales en un 70% (RR: 0,30; IC95%: 0,24-0,38) y una disminución del 41% de las fracturas de cadera (RR: 0,59; IC95%: 0,42-0,83).
Paciente idóneo para usoMujer posmenopáusica con riesgo elevado de fracturas. El ibandronato no ha demostrado disminuir el riesgo fractura de cadera en estudios prospectivos. El risedronato y zoledronato también están aprobados en España para el tratamiento de la osteoporosis en varón y osteoporosis corticoidea.
Aspectos de seguridad para conocer en su usoLos bifosfonatos son en general bien tolerados, con pocos efectos secundarios. Se han descrito alteraciones en el tracto gastrointestinal alto, que puede ser minimizado tomado correctamente el fármaco (en ayunas y en sedestación o bipedestación) y espaciando las dosis con preparados semanales o mensuales. El uso prolongado de bifosfonatos podría ser un factor de riesgo para la aparición de fracturas de estrés en el fémur y la aparición de osteonecrosis mandibular tras un proceso quirúrgico en los maxilares. Son procesos graves, pero poco frecuentes. Se precisan estudios prospectivos de calidad para definir la duración óptima de su tratamiento (ver más adelante «¿Durante cuánto tiempo hay que tratar a los pacientes?»).
La infusión intravenosa de zoledronato puede producir febrícula, artralgia y mialgias en las primeras 24-72h de la primera infusión, disminuyendo la incidencia en las sucesivas infusiones.
DenosumabMecanismo de acciónDenosumab es un anticuerpo monoclonal humano que se une con gran afinidad al RANK ligando, impidiendo la activación de su receptor (RANK) en la superficie de los precursores de los osteoclastos y en los osteoclastos. Al bloquear el mecanismo RANKL/RANK se inhiben la formación, la función y la supervivencia de los osteoclastos, que se traduce en una disminución de la resorción ósea.
Eficacia antifracturaEn el trabajo pivotal86 se objetiva una reducción estadísticamente significativa del 68% en fractura vertebral, fractura no vertebral (RR: 20%: IC95%: 0,67-0,95) y fractura de cadera (RR: 40%; IC95%: 0,37-0,97). Recientemente se ha publicado un subanálisis del estudio FREEDOM87 sobre pacientes con alto riesgo de fractura en el que se observó una reducción significativa (del 62%) del riesgo de fractura de cadera en pacientes mayores de 75años. Esta reducción fue significativa ya a los 12meses de iniciar el tratamiento.
Paciente idóneo para usoMujeres posmenopáusicas y hombres88 con riesgo elevado de fracturas, especialmente si no se pueden emplear bifosfonatos. En varones con cáncer de próstata para el tratamiento de la pérdida ósea asociada con la supresión hormonal y riesgo elevado de fracturas.
Aspectos de seguridad para conocer en su usoLos principales aspectos de seguridad están relacionados con el mecanismo de acción de la molécula. Por un lado, y ya que en RANKL no solo se expresa en el osteoclasto, el bloqueo de la activación del receptor RANK puede manifestarse como aumento del riesgo de celulitis e infección. Varios ensayos clínicos han señalado en el apartado de efectos adversos del tratamiento con denosumab una mayor incidencia de infecciones, tanto cutáneas (celulitis, incluidos casos de erisipela) como de órganos internos (neumonía, diverticulitis, infecciones urinarias), aunque con cifras absolutas bajas89. Para los mismos autores, este tipo de eventos tendría una etiología heterogénea, sin patrón clínico claro que sugiera relación con el tiempo o duración de la exposición al denosumab.
Por otro lado, deben monitorizarse los posibles efectos hipersupresores del remodelado óseo a largo plazo de la molécula. Recientemente, la Agencia Española de Medicamentos y Productos Sanitarios emitió una nota informativa90 advirtiendo del riesgo de osteonecrosis maxilar e hipocalcemia tras la utilización del fármaco, esta última sobre todo en casos de insuficiencia renal, recomendando revisión de la higiene bucal y evitar procedimientos invasivos dentales durante el tratamiento para prevenir la primera y corregir la hipocalcemia preexistente, manteniendo una ingesta adecuada de calcio y vitaminaD para la prevención de la segunda. La incidencia de osteonecrosis de maxilar en población osteoporótica en tratamiento con el fármaco es muy baja, con tasas que oscilan entre menos del 0,001% y el 0,15% al año91. En los estudios STAND92 y DECIDE93 el perfil de seguridad es similar al de bifosfonatos.
Fármacos anabólicosDentro del grupo de fármacos puramente anabólicos contamos en la actualidad únicamente con la 1,34PTH o teriparatida, excluyendo la 1,84PTH, retirada ya del mercado. Teriparatida es el primer fármaco anabólico análogo de la hormona paratiroidea humana (PTH) que actúa estimulando la formación ósea. Es la porción activa N-terminal (secuencia de los aminoácidos 1,34) de la PTH de origen ADN recombinante.
Mecanismo de acciónLa administración intermitente de teriparatida estimula los osteoblastos a través de múltiples mecanismos. Su repercusión fundamental es el aumento de su número, de su diferenciación y de su actividad, inhibiéndose por otra parte su apoptosis. Incrementa la cantidad, la calidad y la resistencia del hueso.
Eficacia antifractura1,34 PTH es eficaz en la reducción de las fracturas vertebrales y no vertebrales, sin que tenga estudios específicos diseñados para analizar su eficacia en la reducción de fracturas de cadera. El estudio pivotal o de referencia fue realizado en mujeres posmenopáusicas con al menos una fractura vertebral previa, y constató una reducción del riesgo de nuevas fracturas vertebrales del 35% (RR: 0,35; IC95%: 0,22-0,55) y una disminución del riesgo de fracturas no vertebrales del 47% (RR: 0,47; IC95%: 0,25-0,88)94.
Paciente idóneo para usoEl fármaco está indicado para el tratamiento de mujeres posmenopáusicas con elevado riesgo de fractura, que se constata por una DMO baja y/o existencia de fracturas de perfil osteoporótico previas. Recoge en su ficha técnica indicación para el tratamiento de la osteoporosis asociada a la terapia mantenida con glucocorticoides y para la osteoporosis del varón. Asimismo puede estar indicado en pacientes en los que se aprecia una respuesta inadecuada al tratamiento antirresortivo95, y en aquellos que presentan intolerancia a otros fármacos para el manejo de la enfermedad.
Aunque teriparatida ha demostrado a nivel clínico una mejoría en la consolidación de las fracturas de radio distal96, son necesarios más estudios bien diseñados para establecer una recomendación del fármaco para tal fin. La mayoría de los trabajos en la literatura que reflejan sus efectos beneficiosos en el desarrollo del callo de fractura son experimentales o con serie de casos97, no estando recogida esta indicación en su ficha técnica. Asimismo se ha planteado en algunos trabajos la administración de teriparatida para promover la consolidación de las fracturas atípicas que se pueden producir en los pacientes que reciben tratamiento mantenido con bifosfonatos, pero en el momento actual, y según las últimas recomendaciones de la Sociedad Americana de Metabolismo Óseo98, no existe suficiente evidencia para establecer su recomendación sistemática, reservándose su uso para aquellos casos en los que no se consigue la consolidación con el tratamiento conservador, tras la suspensión del bifosfonato y el mantenimiento de un adecuado balance de calcio y vitaminaD.
Aspectos de seguridad para conocer en su usoTeriparatida es un fármaco seguro. Pese a que en estudios experimentales preclínicos en ratas Fisher ovariectomizadas se apreció un aumento de la incidencia de osteosarcomas (con dosis muy superiores a las empleadas en humanos y tratadas durante el 80% de la vida de los animales), no hay casos descritos de osteosarcoma relacionados con el fármaco en humanos. La posología recomendada es de 20μg/día por vía subcutánea durante 24meses, preferentemente en administración matinal99. Se contraindica en pacientes con enfermedades metabólicas diferentes a la osteoporosis, incluyendo hiperparatiroidismo y enfermedad de Paget, en pacientes que hayan recibido radioterapia previa sobre el esqueleto, que tengan elevaciones no explicadas de la fosfatasa alcalina, con hipercalcemia preexistente o con insuficiencia renal severa. Los efectos secundarios más frecuentes, generalmente leves, son mareos, náuseas, cefaleas, calambres y dolor de piernas. Pueden producir una elevación transitoria de la concentración sérica del calcio.
Fármacos de acción mixta: ranelato de estroncioEl ranelato de estroncio (RE), un medicamento activo por vía oral frente a la osteoporosis, actúa disociando el metabolismo óseo, disminuyendo por un lado la resorción y aumentando por otro la formación de hueso, razón por la cual se le considera un agente de acción dual o mixta100.
Mecanismo de acciónDesde el punto de vista de su mecanismo de acción, el RE parece estimular el receptor sensible del calcio (CaSR) de los osteoblastos, induciendo la activación de la vía de señalización de la proteincinasa mitogénica y promoviendo así la proliferación y la diferenciación celular osteoblástica. Además, podría activar también la osteoprotegerina, disminuyendo la expresión del ligando unido al receptor activador del factor nuclear kappa B (RANK-L), receptor transmembranario implicado en la diferenciación y maduración de los osteoclastos, consiguiendo reducir la resorción ósea101.
Eficacia antifracturaEl RE ha demostrado en sus estudios pivotales Spinal Osteoporosis Therapeutic Intervention (SOTI)100 y Treatment of Peripheral Osteoporosis (TROPOS)102 ser capaz de reducir, frente a placebo, el riesgo de fracturas osteoporóticas vertebrales y no vertebrales.
Aunque el estudio TROPOS no se diseñó para evaluar este parámetro, en las mujeres del subgrupo de alto riesgo (mayores de 74años con DMO T-score en cuello femoral de −3 o menor) el riesgo de sufrir una fractura de cadera se redujo en un 36%.
Paciente idóneo para usoActualmente está considerado un fármaco de diagnóstico hospitalario que solo deberá emplearse en pacientes con osteoporosis severa y alto riesgo de fractura y en los que no pueda utilizarse ninguna otra alternativa terapéutica, y además la decisión de tratamiento deberá ser adoptada por un médico con experiencia en el manejo de esta patología. Estas circunstancias se deben a diferentes cuestiones de seguridad que se exponen a continuación.
Aspectos de seguridad para conocer en su usoEl fármaco actualmente tiene un uso muy restringido tras la aparición de 3 alertas sanitarias. La primera, en 2007, comunicaba la posible aparición con el tratamiento del llamado síndrome DRESS, una forma de reacción de hipersensibilidad muy infrecuente que aparece a las 3-6semanas de iniciar el tratamiento consistente en fiebre, exantema, eosinofilia y afectación sistémica. La segunda, en 2012, por el riesgo de tromboembolismo venoso, a raíz de la publicación en Francia de un estudio en el que identificaron 199 reacciones adversas graves con RE103, de los que la mitad correspondían a tromboembolismo venoso (TEV). Se contraindicó su uso en pacientes con tromboembolismo actual o previo (trombosis venosa profunda y embolismo pulmonar) y en pacientes inmovilizados de forma temporal o permanente. La tercera, en 2014, tras constatarse en los ensayos clínicos con este fármaco un mayor riesgo de infarto de miocardio en los pacientes tratados con RE en comparación con los tratados con placebo. Las indicaciones actuales del fármaco104 son pacientes con osteoporosis severa y alto riesgo de fracturas que no puedan utilizar otras alternativas terapéuticas por contraindicación o intolerancia y que no presenten ni tengan antecedentes de cardiopatía isquémica, enfermedad arterial periférica o patología cerebrovascular. No deben utilizarse tampoco en pacientes con hipertensión arterial no controlada o inmovilización permanente o temporal.
¿Qué fármacos están en desarrollo para la prevención y el tratamiento de la fractura osteoporótica?Inhibidores de la catepsina K: odanacatibLa catepsina K es una proteasa que se expresa fundamentalmente en los osteoclastos y que es responsable de la degradación de la matriz ósea, compuesta en un 90% de colágeno tipoi. Su disfunción es la responsable de la picnodisostosis, una enfermedad autosómica recesiva esclerosante poco frecuente asociada, entre otras características clínicas, a la presencia de fracturas frecuentes. El mecanismo de acción de odanacatib, de administración oral y semanal, es el bloqueo selectivo y reversible de esta catepsina sin afectar al número de osteoclastos y sin almacenarse en el hueso a largo plazo. Los pacientes que recibieron odanacatib presentaron, a los 2años de tratamiento, un aumento significativo de la DMO del 5,5% en columna lumbar, del 3,8% en cuello femoral y del 3,2% en cadera total en comparación con placebo105. Este incremento se mantiene a los 5años, con un 7,9% de mejoría en columna lumbar y un 5,8% en cadera total106 con un buen perfil de seguridad. Incrementa también la DMO en pacientes que recibieron previamente y durante al menos 3años alendronato, con resultados a 2años107, y parece que en estudios preclínicos no afecta a la consolidación ósea108.
Inhibidores de la esclerostina: blosozumab y romosozumabLa esclerostina frena la formación ósea por su efecto sobre la vía Wnt/β-catenina. La enfermedad de Van Buchem o hiperostosis cortical generalizada y la esclerosteosis se producen como consecuencia de una alteración en el gen SOST que la produce. En estudios preclínicos, la administración de anticuerpos anti-esclerostina ha demostrado ser capaz de incrementar los marcadores de formación, la DMO y la resistencia ósea109. Blosozumab y romosozumab son distintos anticuerpos monoclonales humanos inhibidores de la esclerostina que están siendo evaluados clínicamente (en cuanto a eficacia y seguridad) como posibles agentes anabólicos para el tratamiento de la osteoporosis. En ese sentido, la administración de blosozumab (tanto las dosis únicas como las múltiples) produjo respuestas dependientes de la dosis en la esclerostina y en los marcadores de formación y resorción, así como incrementos significativos de la DMO a nivel de columna y cadera110. El uso previo de bifosfonatos no pareció alterar de manera importante la respuesta, tanto en lo relacionado con los marcadores de formación como en lo referente al incremento de DMO, siendo bien tolerado y con buen perfil de seguridad. En algunos pacientes se detectaron anticuerpos anti-blosozumab, pero sin ningún patrón con relación a la dosis o vía de administración. Muy recientemente también se ha publicado un trabajo que presenta cómo romosozumab actúa como un potente agente anabólico, capaz de estimular la formación y de disminuir la resorción ósea, de manera que incrementa rápidamente la DMO a nivel de la columna vertebral y de la cadera111. Debido a que el diseño del estudio incluye al alendronato y a la teriparatida como comparadores open-label, el romosozumab demuestra conseguir en 12meses incrementos superiores a los conseguidos por las otras 2 moléculas. Desde el punto de vista de seguridad, romosozumab no presentó efectos adversos preponderantes, excepción hecha de reacciones en el lugar de la inyección. El 20% de los pacientes tratados con esta molécula presentaron anticuerpos, 3% de ellos con actividad neutralizante.
Otros fármacosHay otros fármacos en desarrollo, como los fármacos que inhiben los canales del cloro, los inhibidores de la Src-cinasa, como el saranacatib, anticuerpos anti-Dkk1, antagonistas del receptor sensor del calcio y la PTHrP, pero están aún en fases muy precoces.
¿Es posible una terapia combinada o secuencial?Terapia combinadaLa terapia combinada o el empleo de 2 o más fármacos de forma simultánea es una estrategia de tratamiento que debe ser valorada cuidadosamente por la potencial suma de efectos adversos y el aumento del coste que supone.
Se han estudiado multitud de combinaciones de fármacos: estrógenos con diferentes bifosfonatos, estrógenos con teriparatida, alendronato con teriparatida y PTH 1,84, raloxifeno con alendronato, raloxifeno con teriparatida y recientemente denosumab con teriparatida. La mayoría de estas combinaciones consiguen una mejora de la DMO mayor que la obtenida en monoterapia, pero que no se traduce en una reducción de la incidencia de fracturas, salvo el uso de estrógenos y teriparatida, que demostró una reducción sustancial de nuevas fracturas vertebrales112. Incluso algunas asociaciones podrían ser perjudiciales, como las de alendronato con PTH, con la hipótesis de que el alendronato podría reducir los efectos anabólicos de esta hormona113,114.
Una combinación que podría ser interesante en determinados pacientes de especial alto riesgo de fractura es la de denosumab y teriparatida, ya que en un estudio publicado recientemente, aunque sin datos de reducción de fracturas, se ha constatado un efecto sumatorio de ambos fármacos en la DMO tanto de columna lumbar como de cadera total y de cuello femoral115.
Terapia secuencialEl hecho de que la osteoporosis pueda requerir un tratamiento farmacológico durante varios años, unido a la aparición de efectos secundarios con el tratamiento prolongado con ciertos fármacos (como los bifosfonatos) y a la limitación en el tiempo de la terapia con otros (como la teriparatida), hacen que el cambio o la alternancia farmacológica sea necesaria en muchos de los pacientes.
Hay secuencias terapéuticas que parecen claras, como el paso de bifosfonatos a teriparatida y la continuación con bifosfonatos tras teriparatida. Son fármacos que juntos, como se ha comentado anteriormente, no muestran ventajas, pero que de forma secuencial pueden ser complementarios, si bien es cierto que la administración previa de bifosfonatos podría ralentizar de alguna manera la acción de la PTH.
Existen muchos interrogantes acerca de cuánto tiempo mantener un determinado fármaco, salvo la teriparatida, cuya duración establecida en ficha técnica no puede superar los 24meses. En el caso de los bifosfonatos, considerados el tratamiento estándar de primera línea de la enfermedad, parece razonable mantenerlos durante 5años, a partir de los cuales, y en función del riesgo de fractura del paciente, se puede plantear mantener el tratamiento más tiempo reevaluando periódicamente al paciente, establecer unas vacaciones terapéuticas o suspenderlo116. En el caso del ranelato de estroncio hay estudios que avalan la eficacia del fármaco tras 8años de tratamiento117, pese a que recientes comunicaciones acerca de su seguridad cardiovascular puedan limitar su uso. Respecto al denosumab, hay trabajos que hablan de la eficacia del fármaco en lo referente al incremento progresivo de la DMO tanto en columna lumbar, como en cadera y en tercio distal de radio a los 8años de tratamiento118.
Parece razonable, por tanto, individualizar inicialmente el tratamiento dependiendo del tipo de cada paciente y de su riesgo de sufrir una fractura. Posteriormente se ha de establecer el tiempo para mantenerlo, en función de lo recogido en la literatura. Si hemos de cambiar el fármaco, es preferible utilizar principios activos con diferente mecanismo de acción.
¿Cuándo hay que instaurar el tratamiento farmacológico?Se debería instaurar tratamiento farmacológico en aquellos pacientes que:
- 1.
Tengan unos valores densitométricos en cuello femoral con una T igual o mayor que −2,5 DE.
- 2.
Presenten fractura por fragilidad previa.
- 3.
Presenten un elevado riesgo de fractura según la herramienta FRAX®. Es difícil establecer el umbral por el cual decidir instaurar el tratamiento farmacológico en función de los resultados obtenidos con esta herramienta. Clásicamente se ha considerado como alto riesgo de fractura si existe un riesgo de fractura de cadera ≥3% o de fractura mayor ≥20%39. No obstante, como se ha comentado anteriormente, su riesgo predictivo de fractura para la población española es bajo. Cada país debe adecuar cuáles son los niveles de riesgo en función de sus características, y en ese sentido nos parece interesante una reciente revisión del riesgo de una cohorte española119, en la que se establece un cribado mixto utilizando el FRAX® y la medición de la DMO, según la cual pacientes con riesgo considerado elevado (≥7,5%) e intermedio (≥5% y <7,5%) serían susceptibles de medición de la DMO, que si confirmara el diagnóstico, indicaría necesidad de tratamiento farmacológico, siendo esta forma de proceder, mucho más coste-afectiva.
Una vez tomada la decisión de iniciar una terapia farmacológica, el punto clave es realizar una elección adecuada. Para ello, a la hora de elegir un fármaco debemos tener en cuenta los siguientes aspectos:
1. Eficacia, entendiendo esta como la capacidad de un fármaco para producir una acción clínica. En el caso de la osteoporosis la acción clínica que debemos valorar es la eficacia antifractura y, en segundo lugar, la eficacia sobre indicadores subrogados de la misma (por ejemplo, DMO o marcadores de remodelado óseo), pues aunque se relacionan con la variable fractura, no necesariamente tienen una relación clara y completa con ella.
La eficacia antifractura la conocemos a través de los resultados de los ensayos clínicos. Aunque lo deseable sería disponer de ensayos controlados comparando fármacos entre sí teniendo como variable principal la eficacia antifractura, la mayor cantidad de información de los ensayos clínicos a día de hoy se obtiene comparando la molécula frente a placebo. En este tipo de estudios se muestra la eficacia antifractura como RR, medida relativa del efecto que indica cuántas menos veces tiende a desarrollarse el evento (fractura) en el grupo de sujetos expuestos al fármaco. Debemos entenderlo como la cantidad de riesgo que sigue presente a pesar de la medida farmacológica, pues un RR de la unidad indica que no hay relación entre la fractura y la acción medicamentosa.
De acuerdo con los ensayos clínicos pivotales principales con los que se ha obtenido la comercialización de los fármacos disponibles en la actualidad conocemos el grado de evidencia de eficacia antifractura vertebral, no vertebral y de cadera (tabla 2).
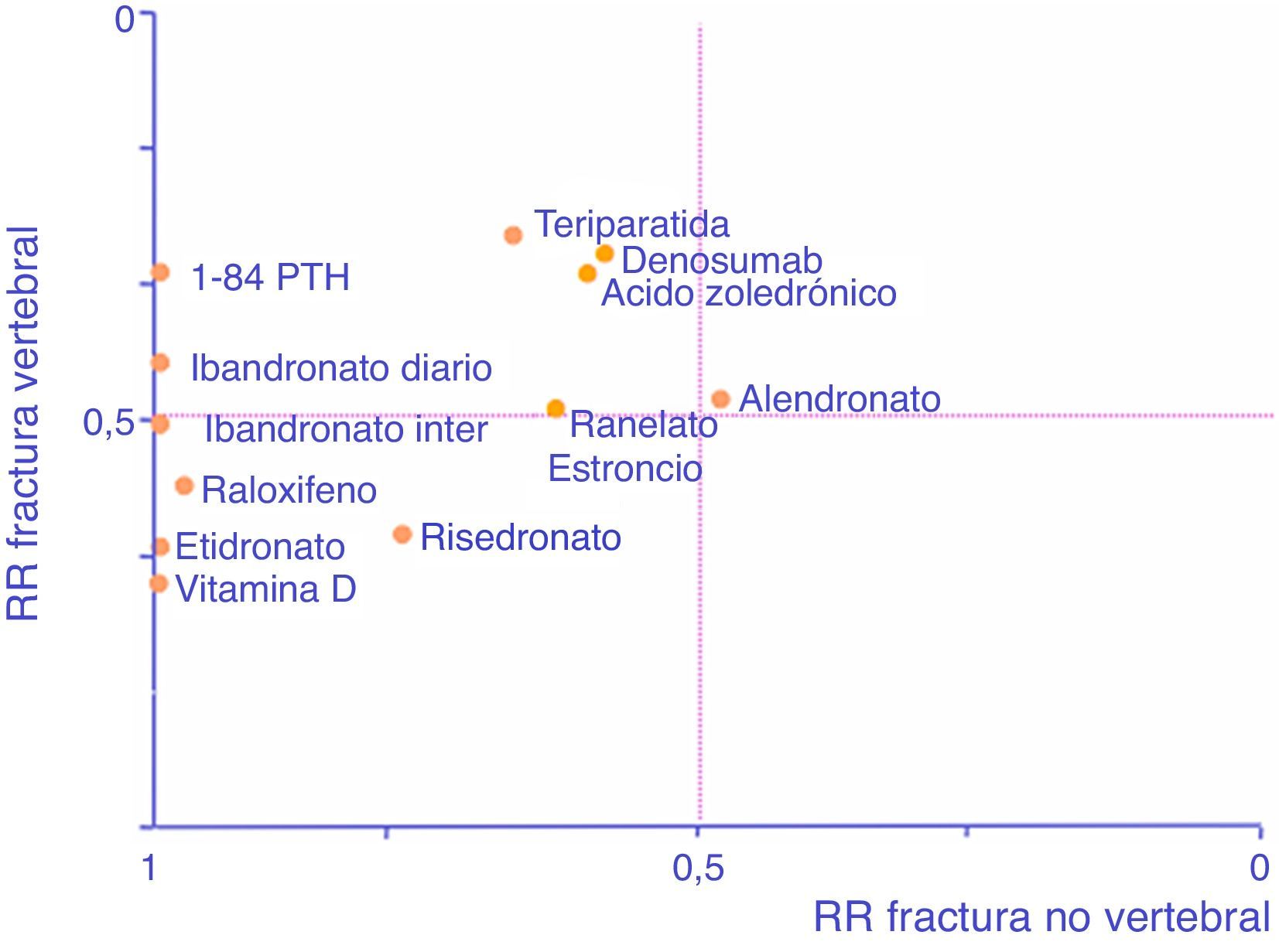
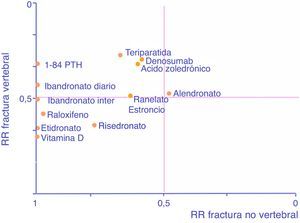
A modo de ayuda y adaptado de Cranney y Guyatt120, el gráfico de la figura 1 recoge la eficacia conocida de las moléculas en forma de RR para permitir seleccionar un fármaco en función de nuestro interés en prevenir uno u otro tipo de fracturas. Cuanto más a la derecha esté un fármaco, mayor eficacia tendrá en reducción de fracturas no vertebrales, y cuanto más arriba, mayor eficacia tendrá en reducción de fractura vertebral.
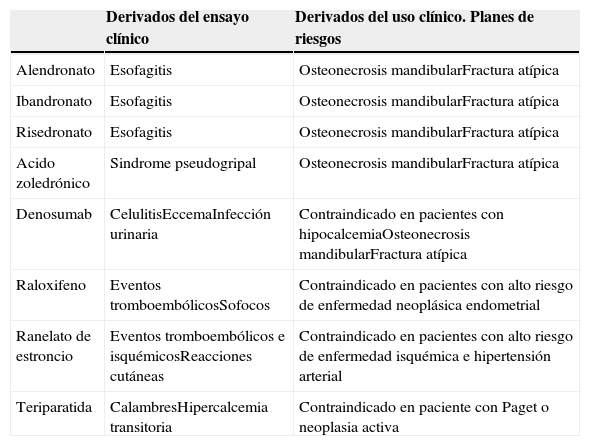
2. Seguridad, entendiendo esta como la probabilidad de un medicamento de causar efectos adversos injustificables. Hay que asumir que todo fármaco tiene la capacidad de generar un daño, y que la seguridad de un medicamento es por tanto una característica relativa a analizar en un contexto clínico determinado. Por ejemplo, los fármacos quimioterápicos tienen efectos secundarios asumibles en el marco de una terapia antineoplásica e inaceptable fuera de este contexto. De nuevo los ensayos clínicos nos van a proporcionar información clara de la toxicidad esperable de un fármaco, pero no debemos olvidar que la verdadera información que refleja los efectos secundarios de una molécula la proporcionan, con el tiempo, los registros de farmacovigilancia (tabla 3).
Principales efectos secundarios de los distintos fármacos
| Derivados del ensayo clínico | Derivados del uso clínico. Planes de riesgos | |
|---|---|---|
| Alendronato | Esofagitis | Osteonecrosis mandibularFractura atípica |
| Ibandronato | Esofagitis | Osteonecrosis mandibularFractura atípica |
| Risedronato | Esofagitis | Osteonecrosis mandibularFractura atípica |
| Acido zoledrónico | Sindrome pseudogripal | Osteonecrosis mandibularFractura atípica |
| Denosumab | CelulitisEccemaInfección urinaria | Contraindicado en pacientes con hipocalcemiaOsteonecrosis mandibularFractura atípica |
| Raloxifeno | Eventos tromboembólicosSofocos | Contraindicado en pacientes con alto riesgo de enfermedad neoplásica endometrial |
| Ranelato de estroncio | Eventos tromboembólicos e isquémicosReacciones cutáneas | Contraindicado en pacientes con alto riesgo de enfermedad isquémica e hipertensión arterial |
| Teriparatida | CalambresHipercalcemia transitoria | Contraindicado en paciente con Paget o neoplasia activa |
3. Adherencia, entendiendo esta como la coincidencia entre el comportamiento de un enfermo y los consejos de salud y prescripciones que ha recibido. Existe evidencia que sugiere que una posología cómoda para el enfermo aumenta la adherencia y persistencia a un tratamiento. La mejor posología es aquella que mejor entiende el enfermo que se adapta a su patrón de vida. Por lo tanto, una adecuada atmósfera de comunicación entre el médico y su paciente permitiría «pactar» qué medicación es la más adecuada en relación con las preferencias en posología del enfermo y su riesgo absoluto de fracturas. El incumplimiento no solo lleva a la ineficacia terapéutica, que es su consecuencia más importante, sino que además representa en conjunto un coste sanitario que no tiene justificación (tabla 4).
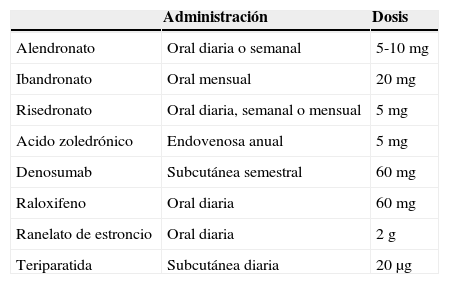
Posología aprobada de los tratamientos disponibles
| Administración | Dosis | |
|---|---|---|
| Alendronato | Oral diaria o semanal | 5-10 mg |
| Ibandronato | Oral mensual | 20 mg |
| Risedronato | Oral diaria, semanal o mensual | 5 mg |
| Acido zoledrónico | Endovenosa anual | 5 mg |
| Denosumab | Subcutánea semestral | 60 mg |
| Raloxifeno | Oral diaria | 60 mg |
| Ranelato de estroncio | Oral diaria | 2 g |
| Teriparatida | Subcutánea diaria | 20 μg |
4. Impacto económico. Del mismo modo que existen ensayos clínicos aleatorizados para conocer la eficacia de un fármaco, existen modelos matemáticos probabilísticos para determinar si el empleo de un fármaco es coste-eficaz. Es en este contexto donde las autoridades sanitarias deben tomar las decisiones en relación con la financiación de los distintos grupos de enfermos. De un modo general podemos concluir que el tratamiento de los pacientes con alto riesgo de fracturas es coste-efectivo casi independientemente del fármaco elegido121-123.
¿Durante cuánto tiempo hay que tratar a los pacientes?Podemos partir de un razonamiento lógico y establecer que el tratamiento debe ser mantenido mientras el paciente esté en riesgo de sufrir una fractura. Como se ha comentado anteriormente, no existen dudas acerca de la duración del tratamiento con fármacos como la teriparatida, cuyo tiempo está claramente establecido en 24meses. Con el resto de fármacos surgen interrogantes en ocasiones difíciles de resolver, sobre todo en pacientes jóvenes en los que puede ser necesario un tratamiento mantenido durante varios años.
Respecto a los bifosfonatos, la aparición de una serie de efectos adversos como las llamadas fracturas atípicas98,124 y la necrosis maxilar han encendido la voz de alarma sobre la conveniencia de mantener el tratamiento durante un largo período de tiempo (tabla 5)125.
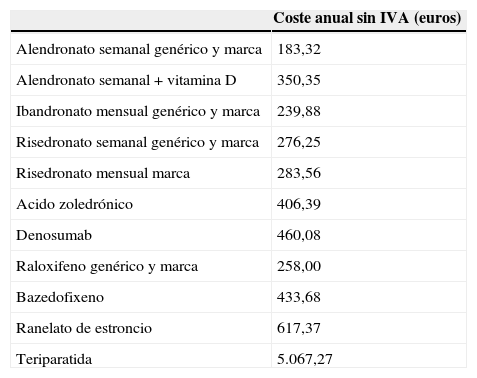
Coste anual de los diferentes medicamentos125
| Coste anual sin IVA (euros) | |
|---|---|
| Alendronato semanal genérico y marca | 183,32 |
| Alendronato semanal + vitamina D | 350,35 |
| Ibandronato mensual genérico y marca | 239,88 |
| Risedronato semanal genérico y marca | 276,25 |
| Risedronato mensual marca | 283,56 |
| Acido zoledrónico | 406,39 |
| Denosumab | 460,08 |
| Raloxifeno genérico y marca | 258,00 |
| Bazedofixeno | 433,68 |
| Ranelato de estroncio | 617,37 |
| Teriparatida | 5.067,27 |
Los ensayos clínicos denotan que la eficacia de estos fármacos en base al efecto antifractura y al incremento de la DMO durante 3años de tratamiento mantiene un perfil claramente favorable sin efectos adversos destacables, y con fármacos como el alendronato y el zoledronato los efectos residuales beneficiosos se mantienen tras la suspensión del fármaco administrado durante 3-5años. Se considera que pacientes con T-score menor a −2,5DE y que han sufrido una nueva fractura podrían continuar el tratamiento, y pacientes con T-score superior a −2,5DE podrían suspenderlo, dentro del concepto de «vacaciones terapéuticas», pero siempre reevaluando el riesgo posterior de sufrir nuevas fracturas126. Con ranelato de estroncio y denosumab existen estudios que avalan su eficacia y su seguridad a 8años117,118, y aunque con este último han aparecido casos aislados de fracturas atípicas, parece que en los estudios de extensión no se ha confirmado la tendencia apreciada con los bifosfonatos a este respecto.
Podemos considerar que el tratamiento debe ser individualizado, utilizando terapia secuencial en caso de necesidad de mantenerla por el riesgo de fractura, utilizando fármacos de diferente mecanismo de acción, como se ha comentado anteriormente.
Concepto de fallo en el tratamientoCuando un paciente está recibiendo tratamiento farmacológico hay que tener en cuenta que estos fármacos reducen el riesgo de fractura, pero no lo eliminan127. Para poder valorar que un fármaco no está ejerciendo su efecto debemos considerar que la adherencia es correcta, que los niveles de calcio y vitaminaD son adecuados y que la duración del tratamiento ha sido suficiente (un ciclo de remodelado óseo varía en su duración en 3-6meses, siendo necesario al menos un año de tratamiento para poder evaluar un fallo), considerándose también que solo un reducido porcentaje de pacientes que tienen tales premisas puede decirse que no responde al mismo127. Las causas para la no respuesta pueden ser múltiples, aunque la mayoría de casos pueden estar en relación con un estado óseo previo muy deteriorado, los niveles de vitaminaD muy bajos, existencia de fracturas previas que generan una estructura ósea muy frágil o persistencia del riesgo de caídas128. Medimos el fallo en base a 3 consideraciones: aparición de fracturas en el transcurso del tratamiento, no evolución favorable de la DMO y no respuesta de los marcadores óseos. La aparición de una fractura no implica necesariamente un fallo del tratamiento, ya que la osteoporosis per se aumenta este riesgo y los fármacos pueden reducirlo hasta en un 50%, por lo que la probabilidad de fractura persiste. Respecto a la DMO, se considera inadecuada una pérdida del 4-5% con respecto a mediciones previas129. Los fármacos reducen en un 50-60% los marcadores de resorción y en un 30% los de formación. Tienen como limitaciones que varían en función del sexo, edad, raza, hora de extracción de la muestra y de si el paciente está en ayunas o no, por lo que la variabilidad intraindividual es elevada (20-30%)129. En una propuesta de definición de qué es lo que se puede considerar fallo terapéutico127, se puede plantear en estos 3 escenarios: cuando existen 2 o más fracturas, con una fractura sin reducción de marcadores óseos y/o disminución significativa de la DMO, y en la situación de no reducción de marcadores y disminución significativa de DMO.
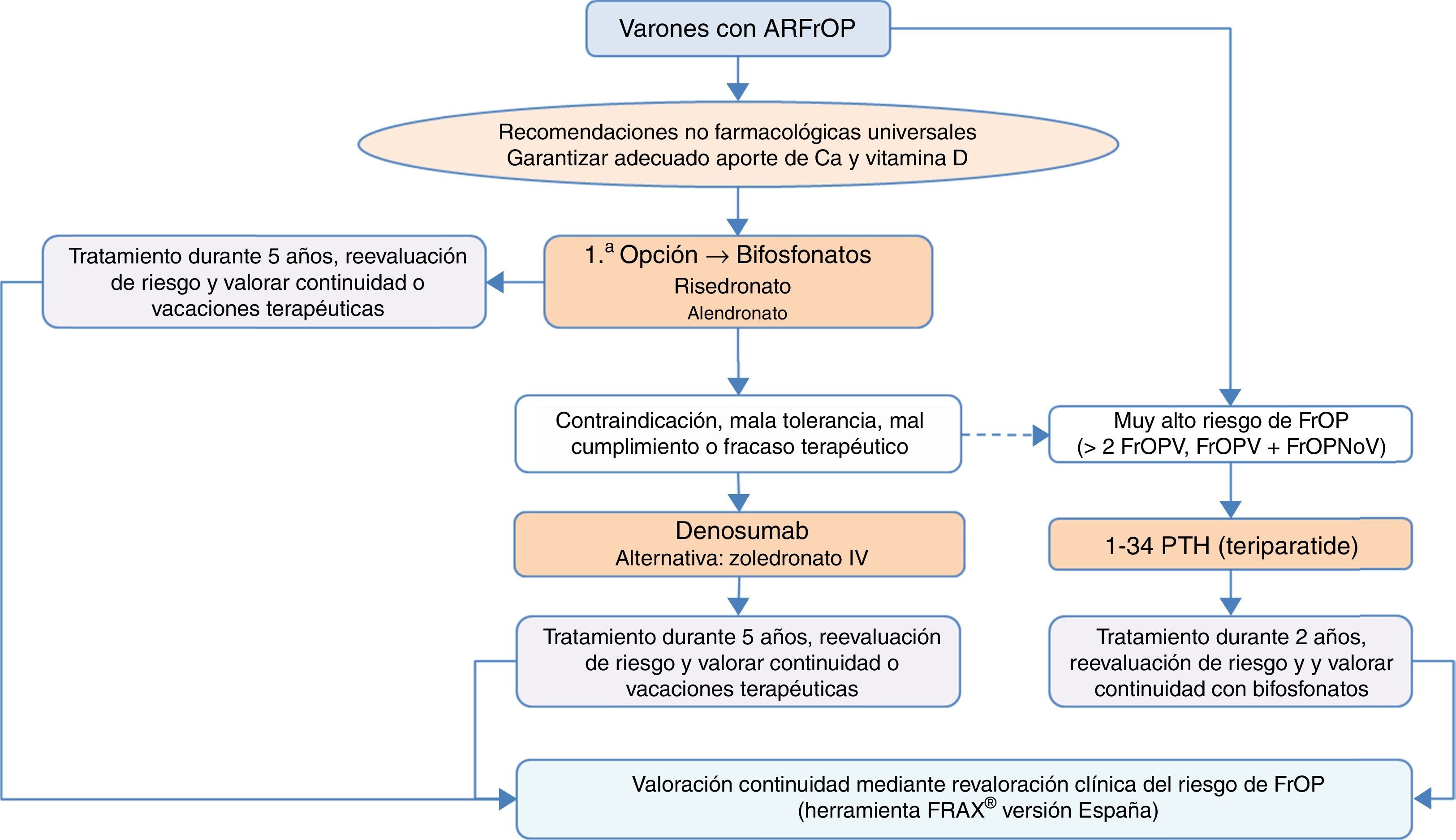
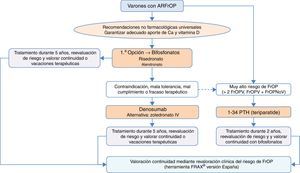
¿Cómo se diagnostica y trata la osteoporosis del varón y la secundaria al uso de glucocorticoides?En comparación con la osteoporosis posmenopáusica, la osteoporosis del varón tiene unas características diferenciales: es menos frecuente pero con una morbimortalidad superior, es habitualmente secundaria (siendo el hipogonadismo, la corticoterapia, el alcoholismo, los tratamientos de privación androgénica y el mieloma sus causas más frecuentes)130, y tiene una menor tasa de fracturas, sobre todo de cadera, debido a una menor esperanza de vida en el hombre131. El riesgo de fractura, la indicación de densitometría y sus puntos de corte diagnósticos se establecen en base a los mismos criterios que en la mujer53. Los fármacos aprobados para su tratamiento en España son risedronato, zoledronato, teriparatida, denosumab y ranelato de estroncio. Denosumab tiene también indicación en el tratamiento de la pérdida ósea asociada a la supresión hormonal en hombres con cáncer de próstata con elevado riesgo de fractura. La terapia con testosterona no se recomienda como tratamiento estándar por sus efectos secundarios asociados132.
La osteoporosis inducida por glucocorticoides es la causa más frecuente de osteoporosis secundaria. Existe evidencia que dosis diarias de 5mg o más de prednisona o dosis equivalente, con una duración de 3meses o superior, incrementan el riesgo de fractura, considerándose en la mayoría de las guías el umbral de intervención farmacológica133. El diagnóstico es sencillo mediante la historia clínica. Se debe tener en cuenta que las herramientas para evaluar el riesgo de fractura suelen subestimar dicho riesgo en la osteoporosis inducida por corticoides, especialmente cuando se usan altas dosis. La medición de la masa ósea mediante DEXA es esencial antes de iniciar el tratamiento, aunque la grave alteración de la microarquitectura ósea que producen los corticoides puede facilitar la aparición de fracturas con valores normales de masa ósea. Esto se debe tener en cuenta a la hora de plantear planes terapéuticos. La aparición de fracturas puede producirse precozmente en íntima relación con la rápida pérdida de masa ósea durante el primer año de tratamiento con corticoides, motivo por el cual la profilaxis debe comenzar de forma precoz. Los tratamientos aprobados en España para este fin son el alendronato, el risedronato y el zoledronato. En pacientes de alto riesgo de fractura se puede considerar teriparatida.
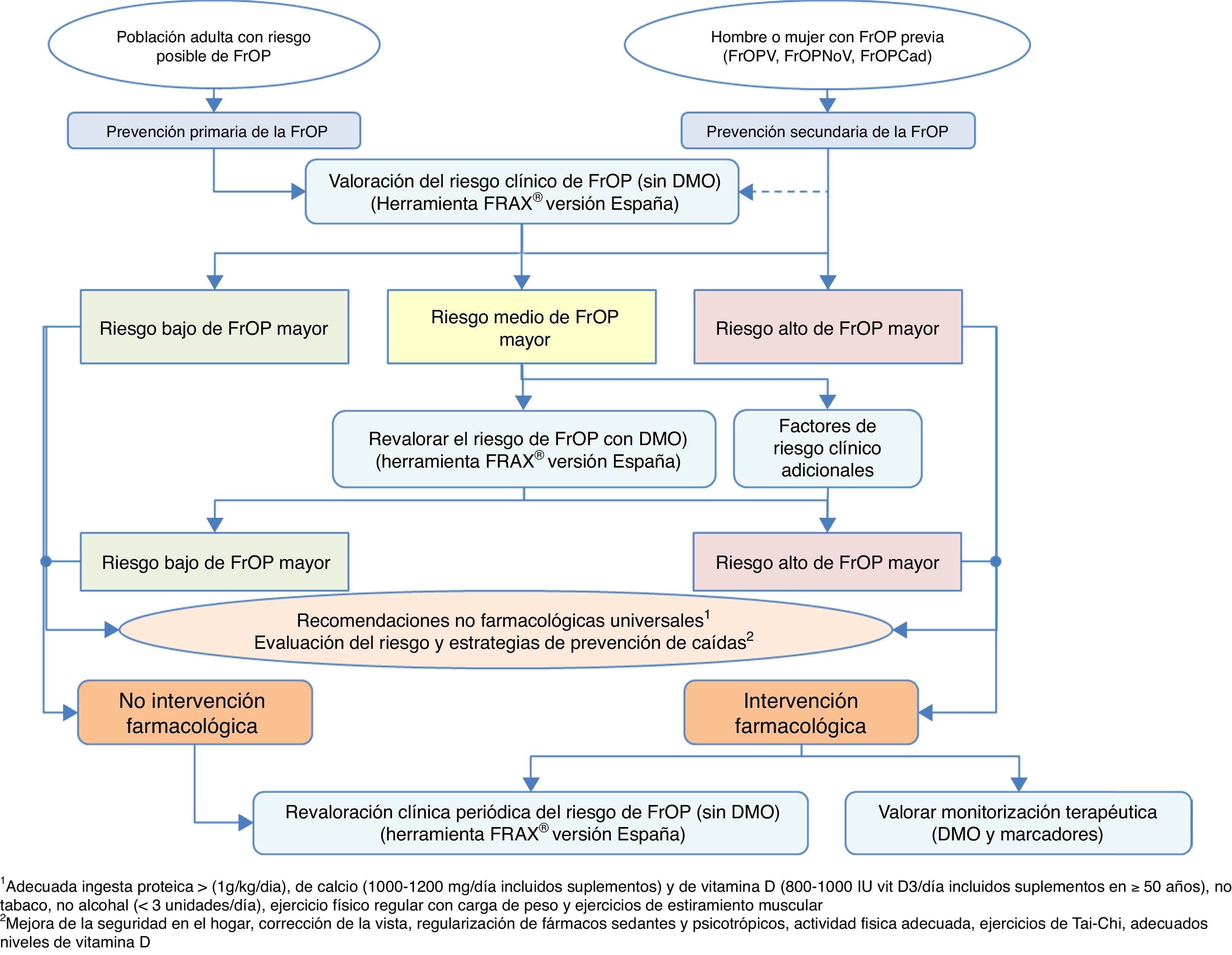
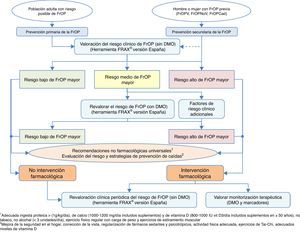
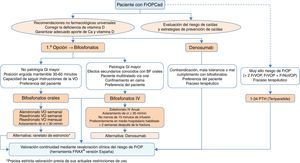
Algoritmos de decisión clínicaAlgoritmo de identificación e indicación terapéuticaEn la figura 2 se recoge la sistemática para realizar una identificación de pacientes susceptibles de comenzar una intervención farmacológica, basada en 2 niveles de prevención básicos: una prevención primaria, considerando como tal aquellas medidas a tomar con pacientes que no han sufrido aún una fractura, y prevención secundaria, la actitud con pacientes que ya han sufrido alguna fractura de perfil osteoporótico.
Desde el punto de vista de nuestra especialidad, creemos de vital importancia incidir sobre todo en la prevención secundaria, ya que por un lado somos nosotros los que atendemos este tipo de fracturas, y además, en muchas ocasiones los únicos, y por otro lado los niveles de cobertura tras una fractura referenciados en la literatura son preocupantemente bajos134-137, pese a que en la práctica totalidad de las guías nacionales e internacionales se recomiende, tras una fractura por fragilidad, establecer un tratamiento preventivo de nuevos eventos futuros138.
Esta recomendación de tratamiento está basada en que es conocido el aumento del riesgo de nuevas fracturas que tienen los pacientes que han sufrido ya una139. Es fácilmente comprobable con estudios de incidencia de fracturas, pero además es una situación clínica muy conocida por los traumatólogos; solo es necesario revisar la historia clínica del paciente para comprobar que previamente a la fractura que se está manejando, es muy probable que hayan existido otras.
Por este motivo, en el algoritmo consideramos a estos pacientes como de alto riesgo de fractura osteoporótica mayor, con intervención farmacológica prácticamente obligada, sin necesidad de más estudios que corroboren la fragilidad ósea. Obviamente, dependerá de la expectativa vital del paciente, de su calidad de vida, de sus condicionantes clínicos, pero la gran mayoría de los pacientes van a ser candidatos tras una fractura a realizar medidas para evitar otras. Además, asumimos que deben aplicarse también las medidas no farmacológicas universalmente reconocidas, y como aspecto fundamental, la evaluación del riesgo de caídas con la correspondiente implementación de medidas para reducir su incidencia.
Respecto a la prevención primaria, consideramos que quizás sea menos aplicable a la práctica diaria dentro de nuestro ámbito de trabajo; no obstante, creemos que para establecer un mapa de riesgo del paciente puede ser de gran utilidad la herramienta FRAX®, realizada inicialmente sin medición de la masa ósea mediante densitometría.
Como se ha comentado anteriormente, esta herramienta permite calcular la probabilidad de riesgo absoluto de fractura de cadera y de fracturas principales (vertebral, cadera, húmero y muñeca) a 10años. Como referencia, nos parecen interesantes los puntos de corte establecidos en una cohorte española119 en la que se determina un riesgo elevado en aquellos pacientes con un resultado de la medición ≥7,5%, y un riesgo intermedio ≥5% y <7,5%. Con estos datos, podemos seleccionar aquellos pacientes en los que la medición de la DMO sea más coste-efectiva y revalorar el riesgo que existe de sufrir una fractura osteoporótica mayor o no, y actuar en consecuencia.
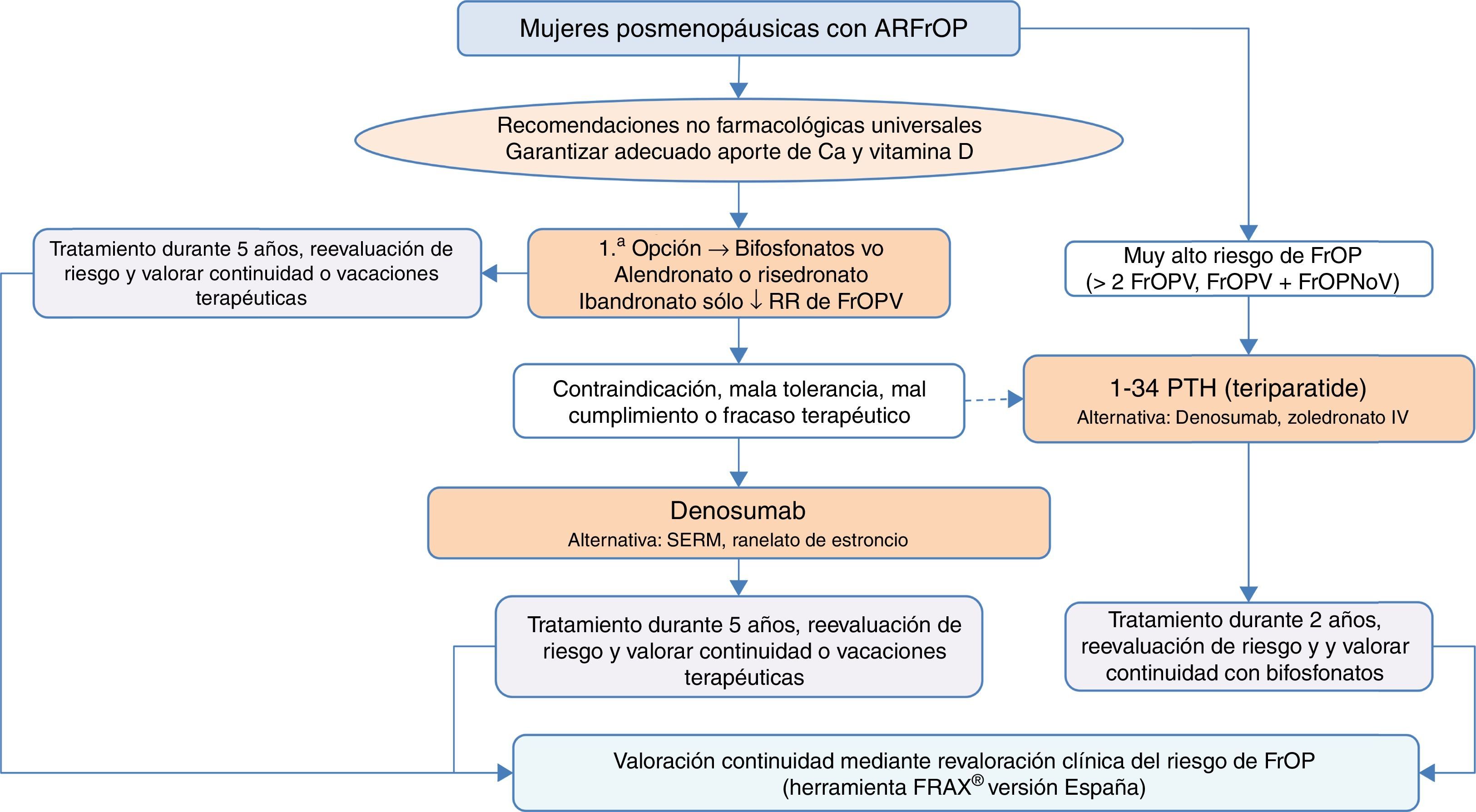
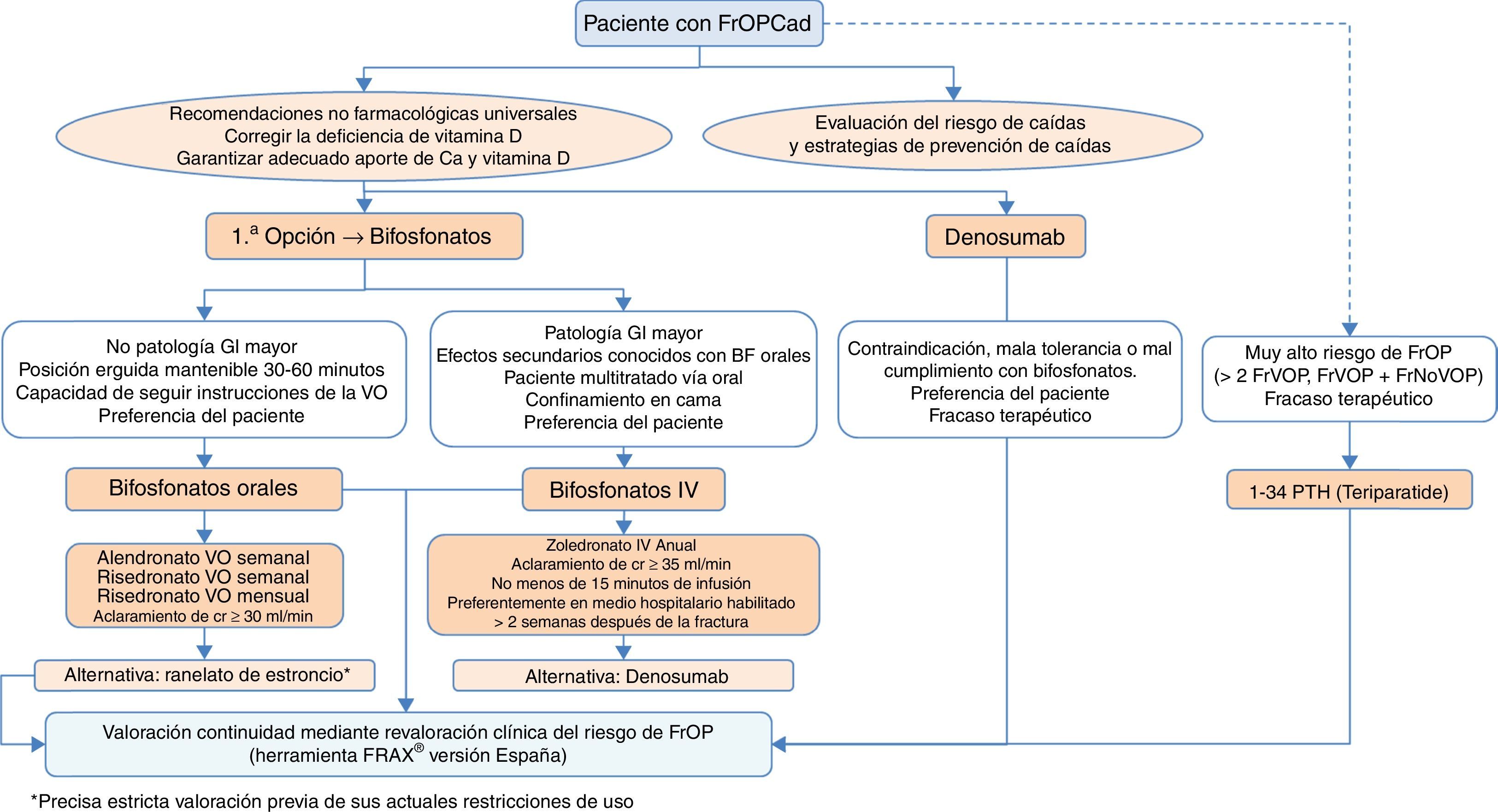
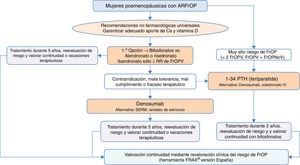
Algoritmo de tratamiento de mujeres posmenopáusicas con alto riesgo de fracturaEs una de las situaciones clínicas más frecuentes, y el algoritmo de tratamiento se recoge en la figura 3. Como premisa fundamental antes de iniciar la terapia, debemos garantizar el cumplimiento de las recomendaciones no farmacológicas universales, así como realizar un adecuado aporte de calcio y vitaminaD, 1.000-1.200mg diarios del primero y 800UI diarios de la segunda.
Como primera opción de tratamiento recomendamos los bifosfonatos orales, con alendronato y risedronato como opción preferencial por su eficacia en la reducción de fracturas vertebrales, no vertebrales y de cadera. De forma selectiva, en el caso de que nuestro interés sea la reducción de las fracturas vertebrales, se podría plantear como primera opción el ibandronato. En caso de contraindicación, mala tolerancia oral, mal cumplimiento o falta de eficacia terapéutica planteamos como opción preferencial el denosumab, anticuerpo monoclonal con reconocida eficacia también en la reducción de fracturas vertebrales, no vertebrales y de cadera. De forma alternativa, podría plantearse raloxifeno, modulador selectivo de los receptores estrogénicos, que solo tiene evidencia reconocida en la reducción de fracturas vertebrales, y el ranelato de estroncio, aunque con indicación muy restringida, como se ha comentado con anterioridad.
Por otro lado, en pacientes con especial riesgo, considerado en el algoritmo como «muy alto riesgo de fractura osteoporótica», que podríamos definir como aquellas situaciones en las que ha habido más de 2 fracturas vertebrales o una fractura vertebral y otra no vertebral, el tratamiento osteoformador con teriparatida puede ser una buena opción durante 2años, para el posterior mantenimiento con un fármaco antirresortivo. Como alternativa a este tratamiento consideramos un bifosfonato más potente administrado anualmente por vía parenteral, el zoledronato, o el mismo denosumab, en régimen de una inyección subcutánea semestral.
El resumen podría ser claro: correcta indicación y correcto seguimiento del paciente y de su riesgo de fractura, pudiendo variar los regímenes de tratamiento para un mantenimiento de la cobertura antifractura.
Algoritmo de tratamiento de varones con alto riesgo de fracturaLos fármacos aprobados para su tratamiento en España son risedronato, zoledronato, teriparatida, ranelato de estroncio y recientemente denosumab. Alendronato está aprobado en Estados Unidos.
En base a esta disponibilidad terapéutica, y de modo paralelo a la osteoporosis posmenopáusica, en nuestro algoritmo de la figura 4 establecemos como primera opción de tratamiento nuevamente los bifosfonatos, en este caso con risedronato como opción preferencial. También en caso de contraindicación, mala tolerancia oral, mal cumplimiento o adherencia o fracaso terapéutico consideramos como opciones el denosumab semestral o el zoledronato anual. De forma paralela, si el paciente es de especial riesgo, con la definición anteriormente comentada, la opción que consideramos preferencial es el tratamiento durante 2años con teriparatida.
Creemos de especial interés la osteoporosis en el varón, ya que habitualmente suscita menor interés en el tratamiento y prevención de nuevas fracturas que en la mujer, con índices de infratratamiento comparativo significativos140, pero que indudablemente origina fracturas, que aunque tienen un menor número absoluto, tienen una mayor repercusión en aspectos de morbimortalidad.
Algoritmo de tratamiento de la fractura de caderaLas opciones preferenciales que se muestran en la figura 5 son fármacos con eficacia demostrada en reducción de fracturas de cadera, esto es los bifosfonatos, salvo el ibandronato o el denosumab. Dentro de los primeros, el alendronato y risedronato son los indicados, salvo en circunstancias de patología gastrointestinal mayor, efectos secundarios conocidos con los bifosfonatos orales, paciente polimedicado, encamamiento o preferencia del paciente, en cuyo caso la opción más idónea sería el zoledronato intravenoso anual, que debe ser administrado de forma lenta, en medio hospitalario y siempre por indicación de ficha técnica, al menos 2 semanas después de haberse producido la fractura para no interferir en el proceso de consolidación. El denosumab es una alternativa a los bifosfonatos, sobre todo en situaciones de mala tolerancia a los mismos, mala adherencia farmacológica o fracaso terapéutico previo.
Planteamos teriparatida en pacientes de especial riesgo. No tiene reconocida eficacia antifractura en cadera, aunque sí tiene efecto farmacológico demostrado a este nivel141, ya que en pacientes que han sufrido una fractura de cadera junto con antecedentes de otra fractura por fragilidad, el riesgo de nueva fractura es muy significativo y podría ser una opción válida.
Nivel de evidenciaNivel de evidencia V.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesIEF ha participado como ponente en eventos científicos de las compañías Lilly, Amgen y MSD. Ha sido investigador en ensayos clínicos promovidos por Amgen.
JRCR ha participado como investigador principal y/o colaborador en ensayos clínicos promovidos por las compañías Amgen y Lilly, y ha sido ponente en eventos científicos de las compañías Amgen, Lilly, MSD, Pfizer y Servier.
RLG ha participado como investigador principal en estudios promovidos por Lilly y Amgen. Consultor de MSD.
LRR ha participado como investigador principal para ensayos promovidos por Amgen. Ponente en eventos científicos de las compañías Lilly, Amgen y MSD. Consultor de Amgen.
El resto de autores declaran no tener conflicto de intereses.