Diferentes especies de Candida causan candidiasis diseminada, y esta afecta especialmente a pacientes inmunodeprimidos y a los que se encuentran hospitalizados en unidades de cuidados intensivos (UCI).
ObjetivoDeterminar la frecuencia y sensibilidad al fluconazol y al voriconazol de aislamientos de Candida spp. provenientes de pacientes en UCI y remitidos a la Corporación para Investigaciones Biológicas para estudios de sensibilidad entre el 2001–2007.
MétodosSe utilizó la técnica de difusión en agar siguiendo las especificaciones del Clinical and Laboratory Standard Institute (M44A). La prueba de Chi2 y la prueba de Kruskal Wallis se utilizaron para comparar los cambios en la frecuencia de aislamientos de Candida spp. y la sensibilidad a los azoles según el año de aislamiento.
ResultadosDel total de 337 aislamientos, 147 (43,6%) correspondieron a Candida albicans, seguidos por Candida tropicalis con 79 aislamientos (23,4%), Candida parapsilosis con 47 aislamientos (13,9%), Candida glabrata con 32 aislamientos (9,5%), Candida guilliermondii con 12 aislamientos (3,6%) y Candida krusei con 11 aislamientos (3,3%). El 2,7% restante correspondió a otras especies (Candida famata, Candida lusitaniae, Candida lipolytica, Candida pelliculosa y Candida spp.). De estos aislamientos, el 78,3% fue sensible, el 11,9% sensible dependiente de la dosis y el 9,8% resistente al fluconazol. Para el voriconazol, el 94% sensible, el 2,4% sensible dependiente de la dosis y el 3,6% fue resistente.
ConclusionesEstos datos señalan un cambio en la frecuencia de especies aisladas así como la presencia de nuevos patrones de sensibilidad, lo que hace necesario la tipificación y la realización de pruebas de sensibilidad a los antifúngicos para conocer las características de los aislamientos circulantes y, de esta manera, predecir un tratamiento exitoso.
Disseminated candidiasis is caused by different Candida species and mainly affects immunocompromised patients and those hospitalized in intensive care units (ICU).
ObjectiveOur aim was to determine the frequency and susceptibility of Candida spp. isolates to fluconazole and voriconazole, obtained from patients hospitalized in ICU in the city of Medellin during the years 2001–2007.
MethodsThe agar diffusion technique based on the protocols recommended by the CLSI from the United States (M44A) was used. The Chi2 test and the Kruskal Wallis statistical methods were used to compare changes in the frequency of Candida spp. isolates and their susceptibility to azoles by year of isolation.
ResultsA total of 337 isolates were analyzed, 147 (43.6%) of which corresponded to Candida albicans, followed by 79 (23.4%) Candida tropicalis, 47 (13.9%) Candida parapsilosis, 32 (9.5%) Candida glabrata, 12 (3.6%) Candida guilliermondii and 11 (3.3%) Candida krusei. The remaining isolates (2.7%) were distributed among other species (Candida famata, Candida lusitaniae, Candida lipolytica, Candida pelliculosa and Candida spp.) Most of these isolates (78.3%) were susceptible; 11.9% were dose-dependent susceptible (DDS) and 9.8% resistant to fluconazole. For voriconazole, we observed that 94.1% of the isolates were susceptible, 2.4% DDS and 3.6% resistant.
ConclusionsThese data indicate a notable change in the species frequency, as well as a new susceptibility patterns that requires the precise identification of the causative organism and susceptibility testing in order to determine the characteristics of the isolates circulating in ICUs and then to treat them appropriately.
Las infecciones causadas por levaduras del género Candida han aumentado en los últimos años y se han convertido en un grave problema de salud que afecta de preferencia a los individuos inmunodeprimidos y a los pacientes internados en las unidades de cuidado intensivo (UCI). Estos últimos están predispuestos a tener infecciones por Candida spp. debido a alteraciones intrínsecas del sistema inmunitario secundarias a desnutrición, translocación bacteriana, neutropenia y traumas mayores, además de factores extrínsecos como procedimientos invasores (líneas centrales, ventilación mecánica, cateterismo vesical), hospitalización prolongada y uso de nutrición parenteral, esteroides y antibióticos de amplio espectro8,9.
Con el paso del tiempo se han observado importantes cambios en las especies de Candida spp. causantes de infección, y aunque Candida albicans sigue siendo la especie más prevalente, Candida parapsilosis, Candida glabrata, Candida tropicalis, Candida guilliermondii y Candida krusei han adquirido mayor importancia, dependiendo del país, del tipo de paciente y de la edad. Este aumento no es sólo atribuible a todos los factores ya mencionados, sino también al uso de nuevos sistemas para la identificación de las levaduras que poseen mayor especificidad y sensibilidad18.
Aunque paralelamente al incremento en las infecciones por Candida spp. se han introducido nuevos agentes antifúngicos con un espectro antimicótico más amplio y mayor potencia antifúngica4, la alta proporción de fracasos terapéuticos, la aparición frecuente de efectos adversos y la emergencia de especies fúngicas intrínsecas o secundariamente resistentes son problemas crecientes que no han logrado resolverse hasta ahora7,21.
Ante la emergencia de resistencia a los agentes antimicóticos en algunos aislamientos de especies de Candida, se han introducido nuevos compuestos, como el voriconazol, que ofrecen otras alternativas terapéuticas con mejor perfil de sensibilidad17.
A pesar de la relevancia de las infecciones invasoras por Candida spp. en los individuos hospitalizados en las UCI, existe poca información sobre los perfiles de sensibilidad y las especies aisladas en nuestro medio. El presente estudio utilizó los datos del programa de vigilancia antifúngica ARTEMIS para describir el comportamiento local de las infecciones invasoras por Candida spp. en pacientes hospitalizados en UCI con el objeto de conocer la frecuencia de los aislamientos de Candida spp., el perfil de sensibilidad al fluconazol y al voriconazol así como también su comportamiento a lo largo del tiempo.
Materiales y métodosEn este trabajo se incluyeron solo los aislamientos de Candida spp. provenientes de zonas estériles, de pacientes hospitalizados en las UCI de la ciudad de Medellín, Colombia, entre los años 2001–2007.
AislamientosSe estudiaron un total de 337 aislamientos de Candida spp., enviados al Laboratorio de la Unidad de Micología Médica y Experimental de la Corporación para Investigaciones Biológicas entre los años 2001–2007, provenientes de pacientes tanto pediátricos como adultos, que se encontraban internados en las UCI de varios centros hospitalarios de la ciudad de Medellín, Colombia. Las muestras remitidas se sembraron en agar glucosado de Sabouraud sin antibióticos para confirmar la viabilidad y pureza de los aislamientos y determinar, como se indica a continuación, el género y la especie así como realizar las pruebas de sensibilidad in vitro a fluconazol y voriconazol.
Identificación de las levadurasSe confirmó el género y la especie de estos aislamientos con las técnicas de producción de tubo germinal, tamizaje en medio CHROMagar Candida® (CHOMagar Microbiology, París, Francia), y pruebas de asimilación con la prueba API 20C AUX (Biomérieux, Marcy, L’Etoile, Francia).
Sensibilidad in vitro a los antifúngicosPara la determinación de la sensibilidad a fluconazol y voriconazol se utilizó el método de difusión en disco M44-A14 descrito por el Clinical and Laboratory Standard Institute (CLSI [antes NCCLS – National Commitee for Clinical Laboratory standards]). Este método utiliza discos de 25μg de fluconazol y de 1μg de voriconazol (Becton Dickinson, Spark, EE.UU.), agar Mueller Hinton (BBL, Cockeysville, EE.UU.) suplementado con glucosa al 2% y con 0,5μg/ml de azul de metileno. Se preparó una suspensión de las levaduras, y se ajustó su concentración a una turbidez de 0,5 en la escala de McFarland con agua destilada estéril.
Las placas con el agar Mueller Hinton suplementado se inocularon con un escobillón humedecido con esta suspensión, de acuerdo con las recomendaciones para este método, y con incubación a 35°C durante 18–24h. La lectura se efectuó en un lector de cajas de Petri provisto de un analizador digital de imagen BIOMIC (Giles Scientific, EE.UU.), que mide los milímetros de inhibición y los convierte a concentración mínima inhibitoria (CMI) por medio de una curva de regresión14.
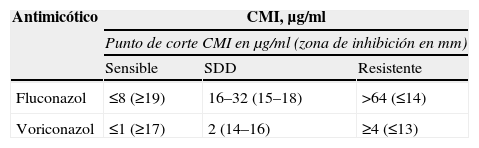
Los aislamientos se clasificaron según los valores de la CMI como sensibles (S), sensibles dependiente de la dosis (SDD) o resistentes (R) al antifúngico estudiado, que se correlacionó con los criterios recomendados en el método de referencia M44-A del CLSI para el fluconazol y para el voriconazol17, como se muestra en la tabla 1.
Interpretación de las concentraciones mínimas inhibitorias a los antifúngicos por la técnica de difusión en agar
| Antimicótico | CMI, μg/ml | ||
| Punto de corte CMI en μg/ml (zona de inhibición en mm) | |||
| Sensible | SDD | Resistente | |
| Fluconazol | ≤8 (≥19) | 16–32 (15–18) | >64 (≤14) |
| Voriconazol | ≤1 (≥17) | 2 (14–16) | ≥4 (≤13) |
Tomado de NCCLS M44-A (8).
CMI: concentración mínima inhibitoria; SDD: sensible dependiente de la dosis.
El control de calidad se realizó semanalmente utilizando una cepa control de la American Type Culture Collection (ATCC) (C. albicans 90028), que presenta un rango de inhibición de 28–39mm para fluconazol y de 31–42mm para voriconazol. Los resultados de la zona de inhibición, la sensibilidad, el valor de la CMI y el control de calidad se almacenaron electrónicamente.
Análisis estadísticoTodos los resultados se almacenaron en una base de datos creada en Microsoft Excel® (Microsoft, Redmond, WA) para este propósito, y se analizaron utilizando el programa SPSS® versión 15.0 (SPSS Inc., Chicago, Il). Los datos cualitativos se presentaron como frecuencias absolutas y porcentajes. La prueba de Chi2 de tendencias se utilizó para comparar los cambios en la frecuencias de aislamientos de Candida spp. y la sensibilidad a los azoles según el año de aislamiento. Los cambios en la CMI según los años de evaluación se compararon empleando la prueba de Kruskal Wallis. Todos los datos se consideraron estadísticamente significativos con valores de p<0,05.
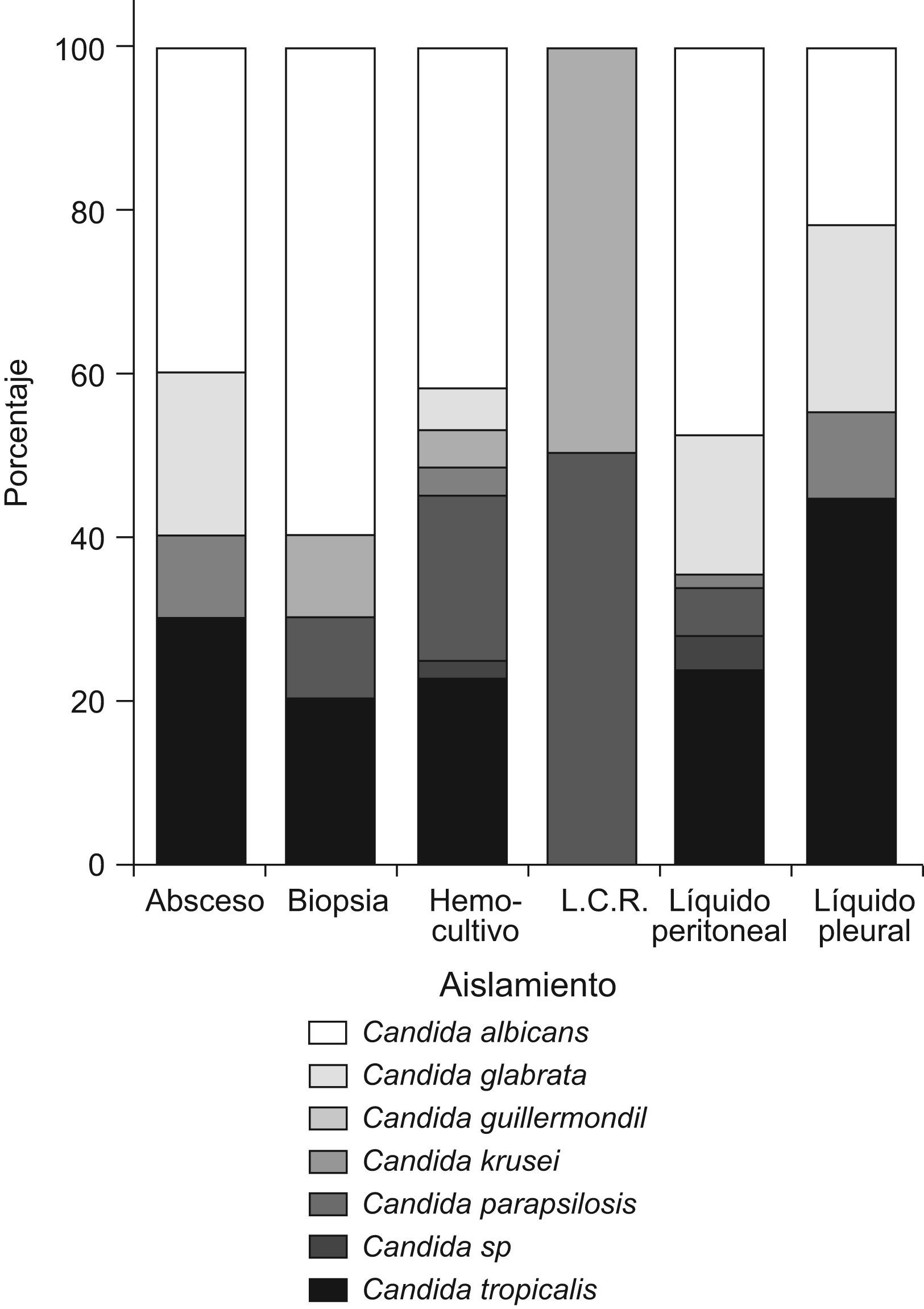
ResultadosDel total de muestras analizadas (n=337), 195 (57,9%) correspondieron a hemocultivos, 111 (32,9%) a líquidos peritoneales, 10 (3%) a biopsias de órganos profundos, 10 (3%) a abscesos cerrados, 9 (2,7%) a líquidos pleurales y 2 (0,6%) a líquidos cefalorraquídeos.
De los aislamientos obtenidos, 147 (43,6%) correspondieron a C. albicans, seguidos por C. tropicalis con 79 aislamientos (23,4%) y C. parapsilosis con 47 aislamientos (13,9%). Las otras especies se encontraron en menor proporción: 32 aislamientos (9,5%) de C. glabrata, 12 aislamientos (3,6%) de C. guilliermondii, 11 aislamientos (3,3%) de C. krusei y 9 aislamientos (2,7%) de Candida spp., distribuidos en especies diferentes (Candida famata, Candida lusitaniae, Candida lipolytica, Candida pelliculosa y Candida spp.).
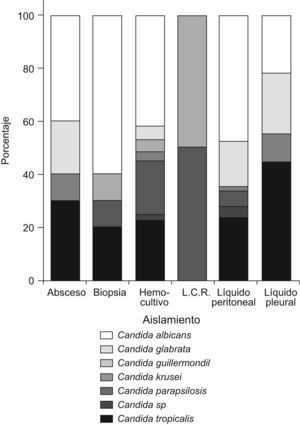
En los hemocultivos, C. albicans se aisló en 82 casos (41,8%), seguida por C. tropicalis en 44 casos (22,9%) y en tercer lugar por C. parapsilosis con 39 aislamientos (19,9%). En las muestras de cavidad peritoneal predominó C. albicans en 53 casos (47,7%) seguida de, C. tropicalis en 26 casos (23,4%) y C. glabrata en 19 casos (17,1%). En la figura 1 se presentan las especies aisladas según el tipo de muestra.
El estudio de sensibilidad al fluconazol mostró que de todas las especies de Candida estudiadas, el 78,3% de los aislamientos fue S, el 12,2% fue SDD y el 9,5% fue R. Para el voriconazol, el 94% de los aislamientos fue S, el 2,4% fue SDD, mientras que el 3,6% presentó resistencia al antimicótico.
El 95,2% de los aislamientos de C. albicans fue S al fluconazol, seguidos por el 86% de C. tropicalis, el 65,6% de C. glabrata y el 59,6% de C. parapsilosis. Con el voriconazol, la totalidad de los aislamientos de C. albicans fueron S al antimicótico, seguidos por C. tropicalis (96,2%), C. parapsilosis (93,6%) y C. glabrata (84,4%); C. krusei es una especie de Candida intrínsecamente R al fluconazol, que presentó disminución de la sensibilidad al voriconazol en el 54,6% de los aislamientos (el 36,4% fue SDD y el 18,2% fue R). En las tablas 2 y 3 se describen las sensibilidades al fluconazol y al voriconazol según los aislamientos de Candida spp.
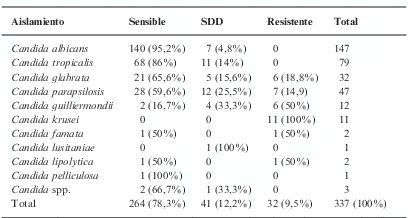
Distribución de la sensibilidad de los aislamientos de Candida spp. al fluconazol
| Aislamiento | Sensible | SDD | Resistente | Total |
| Candida albicans | 140 (95,2%) | 7 (4,8%) | 0 | 147 |
| Candida tropicalis | 68 (86%) | 11 (14%) | 0 | 79 |
| Candida glabrata | 21 (65,6%) | 5 (15,6%) | 6 (18,8%) | 32 |
| Candida parapsilosis | 28 (59,6%) | 12 (25,5%) | 7 (14,9) | 47 |
| Candida guilliermondii | 2 (16,7%) | 4 (33,3%) | 6 (50%) | 12 |
| Candida krusei | 0 | 0 | 11 (100%) | 11 |
| Candida famata | 1 (50%) | 0 | 1 (50%) | 2 |
| Candida lusitaniae | 0 | 1 (100%) | 0 | 1 |
| Candida lipolytica | 1 (50%) | 0 | 1 (50%) | 2 |
| Candida pelliculosa | 1 (100%) | 0 | 0 | 1 |
| Candida spp. | 2 (66,7%) | 1 (33,3%) | 0 | 3 |
| Total | 264 (78,3%) | 41 (12,2%) | 32 (9,5%) | 337 (100%) |
SDD: sensible dependiente de la dosis.
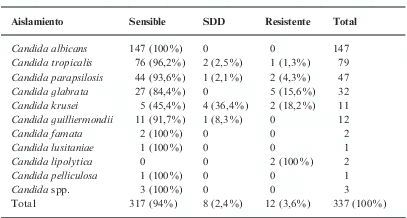
Distribución de la sensibilidad de los aislamientos de Candida spp. al voriconazol
| Aislamiento | Sensible | SDD | Resistente | Total |
| Candida albicans | 147 (100%) | 0 | 0 | 147 |
| Candida tropicalis | 76 (96,2%) | 2 (2,5%) | 1 (1,3%) | 79 |
| Candida parapsilosis | 44 (93,6%) | 1 (2,1%) | 2 (4,3%) | 47 |
| Candida glabrata | 27 (84,4%) | 0 | 5 (15,6%) | 32 |
| Candida krusei | 5 (45,4%) | 4 (36,4%) | 2 (18,2%) | 11 |
| Candida guilliermondii | 11 (91,7%) | 1 (8,3%) | 0 | 12 |
| Candida famata | 2 (100%) | 0 | 0 | 2 |
| Candida lusitaniae | 1 (100%) | 0 | 0 | 1 |
| Candida lipolytica | 0 | 0 | 2 (100%) | 2 |
| Candida pelliculosa | 1 (100%) | 0 | 0 | 1 |
| Candida spp. | 3 (100%) | 0 | 0 | 3 |
| Total | 317 (94%) | 8 (2,4%) | 12 (3,6%) | 337 (100%) |
SDD: sensible dependiente de la dosis.
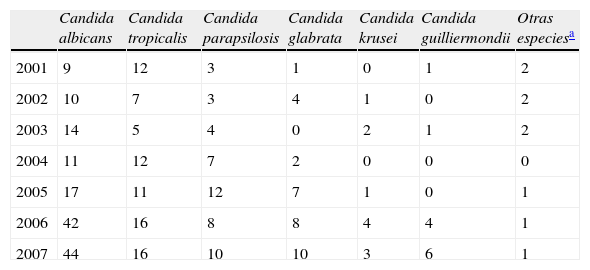
Al comparar la frecuencia de aislamientos de Candida spp. según el año de evaluación, C. albicans fue la especie predominante en todos los años del estudio, excepto en el año 2001 y en el año 2004, cuando C. tropicalis fue la especie aislada con más frecuencia; sin embargo, no se observaron diferencias estadísticamente significativas en las frecuencias de los aislamientos de Candida spp. entre los años de estudio (p=0,10). En la tabla 4 se describen los aislamientos de Candida spp. distribuidos según el año de estudio.
Distribución de las especies de Candida, según el año de estudio (n.o)
| Candida albicans | Candida tropicalis | Candida parapsilosis | Candida glabrata | Candida krusei | Candida guilliermondii | Otras especiesa | |
| 2001 | 9 | 12 | 3 | 1 | 0 | 1 | 2 |
| 2002 | 10 | 7 | 3 | 4 | 1 | 0 | 2 |
| 2003 | 14 | 5 | 4 | 0 | 2 | 1 | 2 |
| 2004 | 11 | 12 | 7 | 2 | 0 | 0 | 0 |
| 2005 | 17 | 11 | 12 | 7 | 1 | 0 | 1 |
| 2006 | 42 | 16 | 8 | 8 | 4 | 4 | 1 |
| 2007 | 44 | 16 | 10 | 10 | 3 | 6 | 1 |
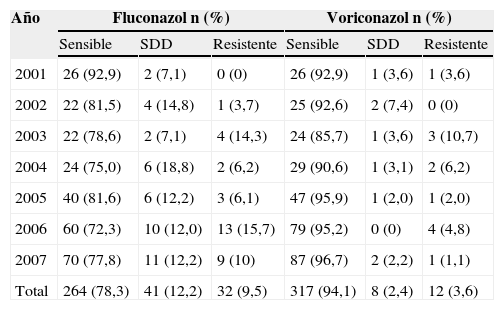
Al comparar los perfiles de sensibilidad al fluconazol durante los diferentes años del estudio (tabla 5), se encontró que una proporción del 15,7% de los aislamientos de Candida spp. había sido R al fluconazol en el año 2006, y éste fue el año en el que se detectaron más aislamientos R (4 aislamientos de C. krusei y de C. parapsilosis, 3 aislamientos de C. glabrata y 2 aislamientos de C. guilliermondii), seguido por el año 2003, cuando el 14,3% de los aislamientos fue R (2 aislamientos de C. krusei y un aislamiento de C. parapsilosis y de C. lipolytica). En el año 2004 se presentó la más alta proporción de aislamientos SDD; el 18,8% de todos los aislamientos obtenidos en este año presentó esta característica. Sin embargo, no se encontraron diferencias estadísticamente significativas cuando se compararon las CMI para fluconazol entre los diferentes años estudiados (p=0,43).
Distribución de la sensibilidad al fluconazol y voriconazol según el año de estudio
| Año | Fluconazol n (%) | Voriconazol n (%) | ||||
| Sensible | SDD | Resistente | Sensible | SDD | Resistente | |
| 2001 | 26 (92,9) | 2 (7,1) | 0 (0) | 26 (92,9) | 1 (3,6) | 1 (3,6) |
| 2002 | 22 (81,5) | 4 (14,8) | 1 (3,7) | 25 (92,6) | 2 (7,4) | 0 (0) |
| 2003 | 22 (78,6) | 2 (7,1) | 4 (14,3) | 24 (85,7) | 1 (3,6) | 3 (10,7) |
| 2004 | 24 (75,0) | 6 (18,8) | 2 (6,2) | 29 (90,6) | 1 (3,1) | 2 (6,2) |
| 2005 | 40 (81,6) | 6 (12,2) | 3 (6,1) | 47 (95,9) | 1 (2,0) | 1 (2,0) |
| 2006 | 60 (72,3) | 10 (12,0) | 13 (15,7) | 79 (95,2) | 0 (0) | 4 (4,8) |
| 2007 | 70 (77,8) | 11 (12,2) | 9 (10) | 87 (96,7) | 2 (2,2) | 1 (1,1) |
| Total | 264 (78,3) | 41 (12,2) | 32 (9,5) | 317 (94,1) | 8 (2,4) | 12 (3,6) |
SDD: sensible dependiente de la dosis.
La mayor proporción de aislamientos R al voriconazol se observó en el año 2003, cuando el 10,7% (3 de los 28 aislamientos) fue R, y presentó una resistencia cruzada con fluconazol (2 aislamientos de C. krusei y uno de C. lipolytica). En el año anterior se presentó la mayor proporción de aislamientos SDD (7,4%); sin embargo, tampoco se observaron diferencias estadísticamente significativas cuando se compararon las CMI para voriconazol (p=0,22) entre los diferentes años (tabla 5).
DiscusiónEl aumento de las infecciones causadas por Candida en los pacientes hospitalizados en las UCI, con una mortalidad atribuible del 49%10, el incremento de los aislamientos de especies diferentes a C. albicans, frecuentemente menos S a los antimicóticos16, las variaciones regionales de las especies de Candida y la resistencia a los antimicóticos2 han creado la necesidad de identificar la especie de todos los aislamientos clínicos de Candida16,18 y conocer los perfiles de sensibilidad a los diferentes antimicóticos2, mediante un sistema de vigilancia epidemiológica que permita el seguimiento riguroso de los aislamientos procedentes del medio hospitalario, con el objeto de lograr intervenciones terapéuticas más rápidas y eficaces, que, a su vez, permitan un control oportuno de las infecciones producidas por las diferentes especies de este género.
La disponibilidad de un método rápido, sencillo, económico y preciso, como lo es el método de difusión de disco con lectura computarizada14, y la red colaborativa del programa ARTEMIS, a la que pertenecen 137 instituciones de 40 países, han permitido crear un sistema de vigilancia epidemiológica que suministra información oportuna y fiable sobre la resistencia a antifúngicos y la frecuencia de las especies de Candida en las instituciones de salud.
En el presente estudio se seleccionaron los aislamientos provenientes de sitios normalmente estériles de pacientes hospitalizados en las UCI de la ciudad de Medellín, Colombia, y se buscó limitar la población de estudio a especies de Candida implicadas en enfermedad invasora.
Aunque la especie más frecuentemente aislada fue C. albicans (se encontró en el 43,6% de las diferentes muestras clínicas estudiadas), la suma de las otras especies del género fue superior al 50%, lo que confirma el aumento de estos patógenos emergentes, como se ha observado en otros países5,6,12,16.
Al analizar la frecuencia de los aislamientos de las diferentes especies de Candida en el tiempo, se observó que C. albicans continuaba siendo la especie más comúnmente recuperada de la mayoría de las muestras clínicas, incluidos los hemocultivos (41,8%). No obstante, algunas de las demás especies de Candida, no albicans como C. tropicalis y C. parapsilosis representaron conjuntamente el 37,3% de todos los aislamientos, lo que demostró una incidencia alta semejante a la reportada para Latinoamérica; esto las confirma como patógenos emergentes en la región19. C. glabrata ocupó el cuarto lugar, con el 9,1% de aislamientos de las muestras clínicas; las especies menos frecuentes fueron C. guilliermondii (3,6%) y C. krusei (3,3%). La distribución de las especies en el país confirma las variaciones geográficas observadas por Pfaller et al, quienes señalaron cómo las especies más frecuentemente aisladas en Latinoamérica eran C. tropicalis y C. parapsilosis, mientras que para Estados Unidos y Europa fueron C. glabrata y C. parapsilosis18. C. tropicalis es la principal causa de infección invasora, especialmente fungemia, en pacientes neutropénicos o con neoplasias hematológicas1. Es importante anotar que a pesar del frecuente uso profiláctico de azoles en este tipo de pacientes, las cepas de C. tropicalis continúan conservando una alta sensibilidad al fluconazol, como se evidencia en esta serie.
A diferencia de los hallazgos reportados en Europa y Estados Unidos3,18, las variaciones en la distribución de las especies de Candida en función del tiempo no pudieron demostrarse en nuestro estudio. Aunque estas variaciones están estrechamente ligadas al uso profiláctico de fluconazol3, estrategia preventiva no implementada aún en las UCI de la zona, la semejanza de la proporción de especies de Candida diferentes de C. albicans encontrada en este estudio (56,4%) frente a las proporciones encontradas en Europa (60%) y Estados Unidos (53%) indica un cambio en la distribución de las especies de Candida ocurrido en años anteriores al período de estudio.
Las pruebas de sensibilidad antifúngica al fluconazol revelaron que durante el período del estudio el 78,3% de los aislamientos de Candida spp. fue S, el 12,2% fue SDD y el 9,5% fue R.
La alta frecuencia de aislamientos de las 2 especies de Candida más S al fluconazol, C. albicans y C. tropicalis (el 95,2 y el 86%, respectivamente), indica que este compuesto podría ser una alternativa de tratamiento si las circunstancias del paciente lo permiten.
Para C. parapsilosis se observó una sensibilidad disminuida al fluconazol (59,6%) con respecto a lo observado a nivel global, lo que indica un aumento de la resistencia de esta especie en nuestra región, posiblemente relacionada con exposición previa al azol. Además, es conocido que C. parapsilosis es comensal habitual de la piel y que se aísla con mayor frecuencia en pacientes pediátricos19, dato importante para nuestro estudio, debido a que los aislamientos provenían tanto de niños como de adultos. Influyen también los factores de virulencia de esta especie, los que se han relacionado tanto con la nutrición parenteral como con el uso prolongado de catéteres (mecanismo de transmisión exógena), hallazgo que podría estar relacionado con el aumento paulatino de esta especie en los últimos tiempos.
Por otro lado, las cifras más altas de resistencia a fluconazol se observaron en C. guilliermondii y C. krusei, con el 50 y el 100%, respectivamente.
El 94% de los aislamientos de Candida spp. fue S al voriconazol, el 2,4% fue SDD y el 3,6% fue R, y mostró CMI menores al voriconazol que al fluconazol, un comportamiento previamente descrito en otros estudios13,22. Aunque el voriconazol se considera el tratamiento de elección para infecciones causadas por C. krusei15, estudios realizados en Latinoamérica han descrito que aislamientos de esta especie presentan variaciones notables en su sensibilidad en comparación con las de Norteamérica11,18,20, situación que se ha visto reflejada en esta serie, donde se encontró que el 45,4% de los aislamientos de C. krusei es S a voriconazol y el 18,2% es R (tabla 3). Si bien C. krusei se considera un patógeno infrecuente, se hace necesario realizar estudios adicionales en la región que determinen las variaciones en la resistencia de C. krusei a los azoles.
En conclusión, los datos obtenidos en este estudio demuestran una buena actividad de ambos antimicóticos, fluconazol y voriconazol, frente a las especies del género Candida más frecuentemente aisladas; sin embargo, el riesgo de infección por especies R y la constante amenaza de un nuevo cambio en la distribución de las especies de Candida hacen necesaria la identificación de la especie aislada y el conocimiento de la sensibilidad a los antifúngicos para garantizar ofrecer el tratamiento más acertado y su más oportuna administración a pacientes críticamente enfermos.