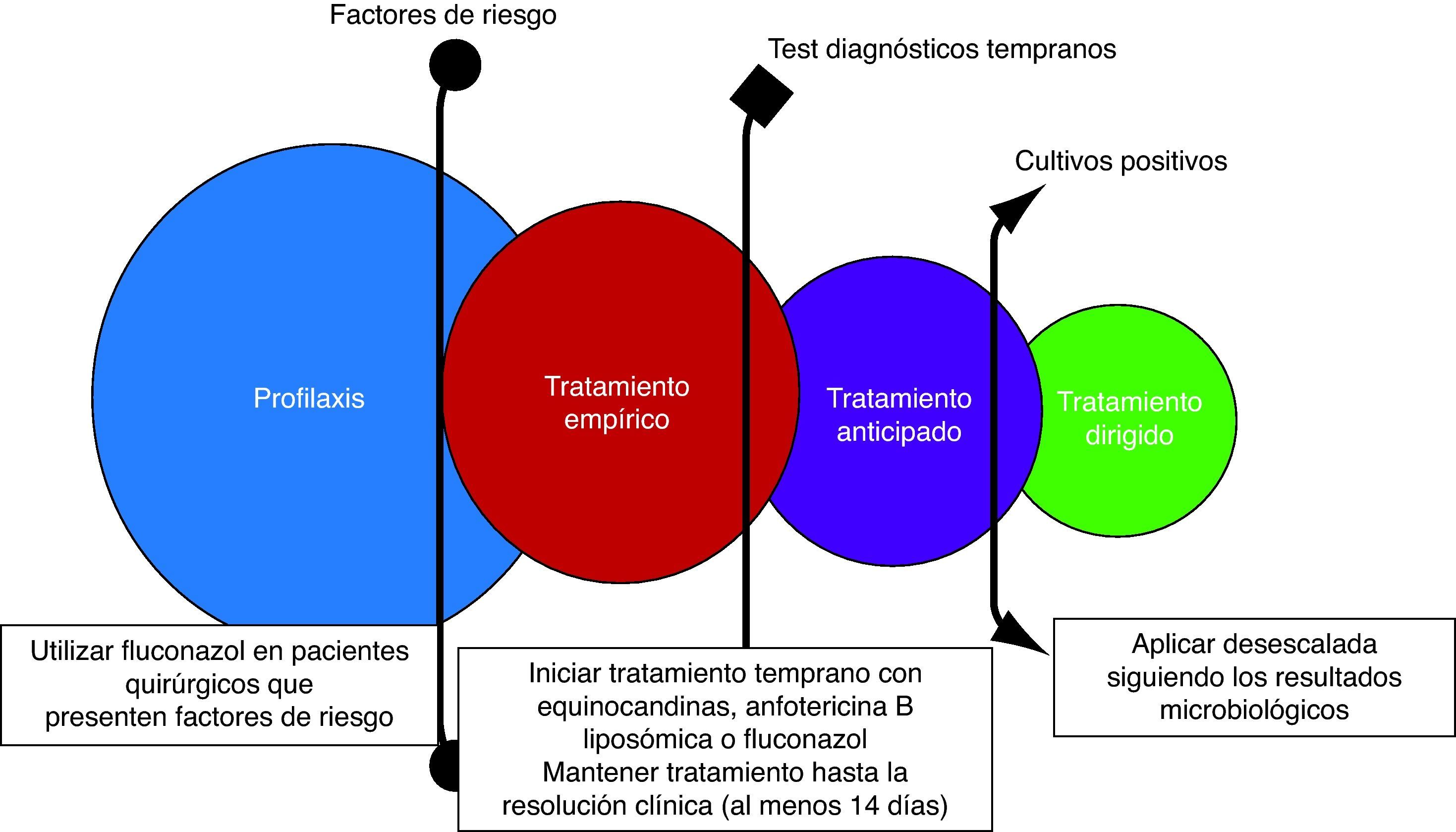
Debido a sus tasas altas de morbimortalidad y a los elevados costes sanitarios asociados, las infecciones fúngicas invasivas en el paciente crítico son un adecuado objetivo para el desarrollo de estrategias terapéuticas, tanto profilácticas, como empíricas o anticipadas. Para intentar disminuir su elevada mortalidad, se han desarrollado nuevas técnicas de laboratorio que ayudan a la instauración temprana del tratamiento. En los últimos años se ha evaluado el papel de los nuevos antifúngicos en este contexto, aunque son escasos los estudios que incluyen a pacientes críticos. La mayoría de las guías y las recomendaciones publicadas respaldan la estrategia de desescalada terapéutica, especialmente en el paciente con inestabilidad hemodinámica, aconsejando el uso de equinocandinas como primera opción en la candidiasis invasiva y de voriconazol para el tratamiento de la aspergilosis invasiva.
Invasive fungal infections, especially in the critical care setting, have become an excellent target for prophylactic, empiric, and pre-emptive therapy interventions due to their associated high morbidity, mortality rate, increased incidence, and healthcare costs. For these reasons, new studies and laboratory tests have been developed over the last few years in order to formulate an early therapeutic intervention strategy in an attempt to reduce the high mortality rate associated with these infections. In recent years, evidencebased studies have shown the roles that the new antifungal drugs play in the treatment of invasive mycosis in seriously ill and complex patients, although data from critically ill patients are more limited. New antifungal agents have been analyzed in different clinical situations in critical care units, and the increasing number of non-Candida albicans species suggest that the application of early echinocandin therapy in critically ill patients with invasive candidiasis is a good option. Voriconazole should be recommended for invasive aspergillosis as a first line option.
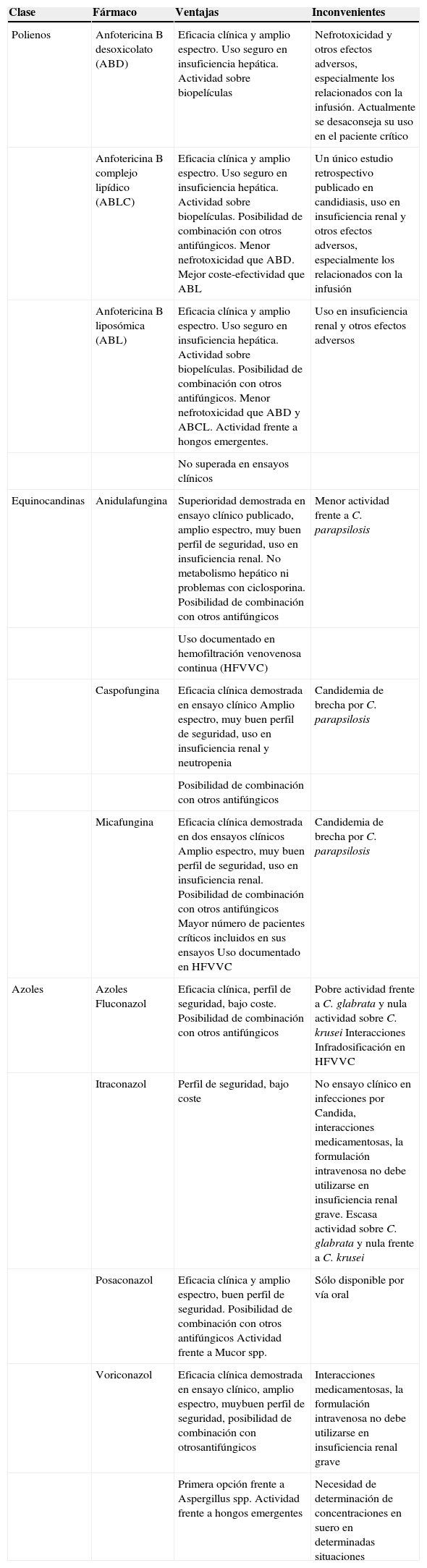
En los últimos años se han incrementado notablemente los recursos terapéuticos de fármacos antifúngicos. Son numerosos los estudios basados en la evidencia a partir de los nuevos antifúngicos y estos fármacos han adquirido un importante protagonismo en el tratamiento de las infecciones fúngicas invasivas (IFI) en los pacientes críticos. Sin embargo, los datos de eficacia en este tipo de pacientes son más limitados y muchas veces se extrapolan del resto de la población hospitalaria. En la tabla 1 se resumen las principales ventajas e inconvenientes de los antifúngicos sistémicos cuando se utilizan en la unidad de cuidados intensivos (UCI).
Antifúngicos sistémicos disponibles y su uso en pacientes críticos
| Clase | Fármaco | Ventajas | Inconvenientes |
| Polienos | Anfotericina B desoxicolato (ABD) | Eficacia clínica y amplio espectro. Uso seguro en insuficiencia hepática. Actividad sobre biopelículas | Nefrotoxicidad y otros efectos adversos, especialmente los relacionados con la infusión. Actualmente se desaconseja su uso en el paciente crítico |
| Anfotericina B complejo lipídico (ABLC) | Eficacia clínica y amplio espectro. Uso seguro en insuficiencia hepática. Actividad sobre biopelículas. Posibilidad de combinación con otros antifúngicos. Menor nefrotoxicidad que ABD. Mejor coste-efectividad que ABL | Un único estudio retrospectivo publicado en candidiasis, uso en insuficiencia renal y otros efectos adversos, especialmente los relacionados con la infusión | |
| Anfotericina B liposómica (ABL) | Eficacia clínica y amplio espectro. Uso seguro en insuficiencia hepática. Actividad sobre biopelículas. Posibilidad de combinación con otros antifúngicos. Menor nefrotoxicidad que ABD y ABCL. Actividad frente a hongos emergentes. | Uso en insuficiencia renal y otros efectos adversos | |
| No superada en ensayos clínicos | |||
| Equinocandinas | Anidulafungina | Superioridad demostrada en ensayo clínico publicado, amplio espectro, muy buen perfil de seguridad, uso en insuficiencia renal. No metabolismo hepático ni problemas con ciclosporina. Posibilidad de combinación con otros antifúngicos | Menor actividad frente a C. parapsilosis |
| Uso documentado en hemofiltración venovenosa continua (HFVVC) | |||
| Caspofungina | Eficacia clínica demostrada en ensayo clínico Amplio espectro, muy buen perfil de seguridad, uso en insuficiencia renal y neutropenia | Candidemia de brecha por C. parapsilosis | |
| Posibilidad de combinación con otros antifúngicos | |||
| Micafungina | Eficacia clínica demostrada en dos ensayos clínicos Amplio espectro, muy buen perfil de seguridad, uso en insuficiencia renal. Posibilidad de combinación con otros antifúngicos Mayor número de pacientes críticos incluidos en sus ensayos Uso documentado en HFVVC | Candidemia de brecha por C. parapsilosis | |
| Azoles | Azoles Fluconazol | Eficacia clínica, perfil de seguridad, bajo coste. Posibilidad de combinación con otros antifúngicos | Pobre actividad frente a C. glabrata y nula actividad sobre C. krusei Interacciones Infradosificación en HFVVC |
| Itraconazol | Perfil de seguridad, bajo coste | No ensayo clínico en infecciones por Candida, interacciones medicamentosas, la formulación intravenosa no debe utilizarse en insuficiencia renal grave. Escasa actividad sobre C. glabrata y nula frente a C. krusei | |
| Posaconazol | Eficacia clínica y amplio espectro, buen perfil de seguridad. Posibilidad de combinación con otros antifúngicos Actividad frente a Mucor spp. | Sólo disponible por vía oral | |
| Voriconazol | Eficacia clínica demostrada en ensayo clínico, amplio espectro, muybuen perfil de seguridad, posibilidad de combinación con otrosantifúngicos | Interacciones medicamentosas, la formulación intravenosa no debe utilizarse en insuficiencia renal grave | |
| Primera opción frente a Aspergillus spp. Actividad frente a hongos emergentes | Necesidad de determinación de concentraciones en suero en determinadas situaciones |
Debido a su eficacia y seguridad, el fluconazol puede ser seleccionado como tratamiento de primera línea en pacientes con sospecha o documentación de candidiasis invasiva (CI)44,47; sin embargo, el aumento de CI causada por especies potencialmente resistentes al fluconazol (hasta casi el 17,1% en un estudio multicéntrico publicado recientemente en pacientes críticos25), su posible mayor tasa de mortalidad34, la dificultad para reconocer factores predictores de infecciones por aislados potencialmente resistentes49, así como la posible inferioridad del fluconazol frente a las equinocandinas45, resaltan la necesidad de iniciar el tratamiento con un antifúngico de amplio espectro (hasta que se identifique la especie de Candida) con el objeto de evitar un tratamiento antifúngico empírico inadecuado y, por tanto, el aumento de mortalidad asociada a éste18. Por ello, en este tipo de pacientes hay que considerar la desescalada terapéutica56, siempre y cuando la situación clínica y evolutiva lo permitan, especialmente en ausencia de fallos orgánicos.
La desescalada antifúngica es una estrategia que intenta conseguir un tratamiento empírico adecuado en pacientes de riesgo alto evitando la excesiva utilización de antifúngicos56. Después de iniciar el tratamiento con un antifúngico de amplio espectro, este debe sustituirse por fluconazol cuando la identificación o la sensibilidad del aislamiento lo permitan. Sin embargo, y como previamente ha demostrado un grupo español, es necesario alcanzar un cociente entre la dosis del antifúngico y la concentración mínima inhibitoria (CMI) mayor o igual a 100 para asegurar una alta tasa de curación en candidemia cuando el paciente sea tratado con fluconazol48. Por esta razón, cuando se aplique el concepto de desescalada, la dosis de fluconazol debe ajustarse de forma correcta; sin embargo, su importante aclaramiento en pacientes que precisen técnicas de depuración renal continua hace inviable esta aproximación en los pacientes que requieran estas técnicas4.
ItraconazolEl itraconazol dispone de una formulación intravenosa de amplio espectro. Sin embargo, la ausencia de ensayos clínicos en pacientes con candidemia, sus importantes interacciones farmacológicas y la escasa información sobre el uso de su excipiente (ciclodextrina), en especial en pacientes con insuficiencia renal, son factores importantes que limitan su uso en el paciente crítico. Asimismo, se ha documentado un 46-53% de aislamientos de Candida glabrata y un 31% de Candida krusei resistentes a él56.
VoriconazolEs el primer triazol de segunda generación disponible aprobado en España y en otros países europeos para el tratamiento de la aspergilosis invasiva, infecciones por Candida resistente al fluconazol, como aquéllas por C. krusei y C. glabrata, así como para el tratamiento de infecciones graves por Fusarium y Scedosporium, si bien posteriormente se ha aceptado su indicación para la candidemia en pacientes no neutropénicos.
El voriconazol ha probado su eficacia en el tratamiento de la aspergilosis invasiva en un ensayo reciente y ya clásico, donde los autores demostraron que el tratamiento con voriconazol se asoció a una mejor respuesta clínica, una mejoría significativa en la supervivencia (el 71 frente al 58% a las 12 semanas) y menores efectos adversos graves que el tratamiento con anfotericina B, por lo que se ha convertido hoy día en el fármaco de elección para este tipo de pacientes17. Voriconazol también ha demostrado que es eficaz y bien tolerado para infecciones fúngicas refractarias y/o emergentes, como fusariosis, escedoporiosis, peniciliosis o criptococosis43. Uno de los problemas más importantes del tratamiento de la aspergilosis cerebral es la escasa penetración de los antifúngicos en el sistema nervioso central (SNC). Sin embargo, la administración de voriconazol produce valores farmacológicos medibles en líquido cefalorraquídeo, que pueden superar CMI para Aspergillus27. En un estudio retrospectivo, se trató a pacientes con aspergilosis del SNC con voriconazol como tratamiento de rescate, con una mediana de 51 días. Se observaron respuestas completas y parciales en el 35% de los pacientes, con una tasa de supervivencia del 31%51. Estos resultados implican que hay suficiente evidencia para usar el voriconazol como primera elección, sólo o combinado, en aspergilosis sospechadas o probadas y otras infecciones por hongos menos frecuentes en nuestro ámbito13,26,55.
En un estudio sobre uso compasivo de voriconazol en el tratamiento de candidemia y candidiasis invasiva en pacientes con intolerancia a otros antifúngicos o con infección refractaria a éstos36, se demostró que este nuevo fármaco era eficaz como tratamiento de rescate incluso en presencia de uso previo de azoles e infecciones por C. krusei, hallazgos que a su vez dos grupos españoles han corroborado33,41.
Posteriormente, se llevó a cabo un estudio observacional en diversas UCI españolas (estudio PACIFV) con el objetivo de analizar y describir el uso clínico y la tolerancia del voriconazol en la práctica diaria en pacientes críticos2. El voriconazol se usó como tratamiento de rescate para infecciones fúngicas, incluidas las que previamente habían recibido azoles, y fue eficaz en el 50% de los casos, siendo Candida albicans y Aspergillus fumigatus los patógenos más frecuentes.
El primer estudio multicéntrico, prospectivo, aleatorizado y abierto, en 422 pacientes no neutropénicos con candidemia tratados con voriconazol frente al tratamiento con anfotericina B desoxicolato seguida de fluconazol, mostró resultados equivalentes en eficacia y mortalidad22. En más de la mitad de los episodios se aislaron especies de Candida no-C. albicans (55%) con una distribución similar en ambos grupos. No hubo diferencias en la respuesta clínica entre voriconazol y anfotericina B, aunque para Candida tropicalis, la respuesta fue mayor en el grupo tratado con voriconazol, a pesar de que todos los aislamientos fueron sensibles in vitro a la anfotericina B. La aparición de disfunción renal fue estadísticamente menor también en el grupo de voriconazol. Los resultados de este estudio son fácilmente aplicables a los pacientes críticos debido a que casi la mitad de los pacientes incluidos estaban ingresados en la UCI. La única limitación para el uso de voriconazol en pacientes con insuficiencia renal grave es la acumulación, y la posible toxicidad secundaria, del excipiente usado en su formulación intravenosa (ciclodextrina), por lo que no se recomienda su uso en pacientes con valores de creatinina sérica superiores a 2,5mg/dl, si bien no hay datos sobre su uso en los pacientes en los que se realice algún tipo de depuración extrarrenal. Sin embargo, no es necesario ningún tipo de ajuste en la insuficiencia renal si se usa la formulación oral. Las potenciales interacciones con otros fármacos no contraindican su uso en la mayoría de los casos, aunque sí que obligan a hacer un seguimiento farmacocinético de ellos y del propio voriconazol, especialmente en pacientes trasplantados. Estas interacciones farmacológicas deberán tenerse en cuenta, especialmente en pacientes que estén recibiendo rifampicina o sirolimus, casos en los que se deberá suspender su uso42.
Sin embargo, a pesar de sus posibles ventajas a priori, ni las recientes guías de la Infectious Diseases Society of America, ni las de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica, entre otras, consideran su uso como primera elección y lo reservan para el tratamiento de la infección por C. krusei y C. glabrata, con sensibilidad intermedia a fluconazol, debido a la posible resistencia cruzada con fluconazol y por tratarse su estudio esencial para esta indicación de un ensayo clínico abierto y no doble ciego, entre otras causas1,23,26.
PosaconazolEl posaconazol, un triazol de amplio espectro de uso exclusivo por vía oral, tiene una importante actividad in vitro frente a una gran variedad de hongos, incluidos Aspergillus, Candida, Cryptococcus e Histoplasma. Se ha estudiado ampliamente en modelos animales y en los ensayos clínicos ha demostrado ser eficaz en IFI, incluidas las refractarias a otros antifúngicos5. En pacientes con leucemia aguda o síndrome mielodisplásico que reciben quimioterapia, el posaconazol es más eficaz en prevenir la aparición de IFI que el fluconazol o el itraconazol, y su uso en esta indicación se asocia con una supervivencia mayor7. Sin embargo, dado que la única vía de administración de este fármaco hasta el momento es la vía oral, es difícil considerar este fármaco de primera línea para el tratamiento de la IFI en la UCI.
PolienosAnfotericina BLa primera formulación comercializada hace más de 40 años fue la anfotericina B desoxicolato, que se convirtió en el tratamiento de elección de las IFI y en el comparador por excelencia en casi todos los ensayos clínicos en candidemia realizados9; sin embargo, su elevada tasa de nefrotoxicidad (53%) limita su uso e impide alcanzar las concentraciones plasmáticas necesarias para tratar la mayoría de las IFI54. Además, el uso de formulaciones lipídicas en lugar de anfotericina B desoxicolato en el tratamiento de las IFI confirmadas o sospechadas se asocia a una disminución de la mortalidad del 28%3. Las formulaciones lipídicas de anfotericina B disponibles en el mercado español son anfotericina B complejo lipídico y anfotericina B liposómica.
En el único ensayo clínico en CI en el que se usó la anfotericina B liposómica (3mg/kg/día) como comparador frente a la micafungina, no se observaron diferencias en eficacia clínica ni en mortalidad, pero los efectos adversos fueron más frecuentes en el grupo de la anfotericina B liposómica24. Por su parte, la eficacia de la anfotericina B complejo lipídico está menos documentada. Actualmente, sólo se dispone de la información derivada de un registro estadounidense (CLEAR) que incluyó 923 episodios de candidiasis/candidemia demostradas durante 5 años en más de 160 centros19. La respuesta clínica favorable (curación o mejoría) en este estudio fue del 61%, similar a la obtenida por otros antifúngicos en recientes ensayos clínicos.
Actualmente, la mayoría de los expertos respaldan el uso de la anfotericina B liposómica en pacientes críticos como tratamiento alternativo en CI y de primera línea en aspergilosis invasiva, como lo demuestran las vigentes recomendaciones que avalan este fármaco como primera opción, especialmente en pacientes neutropénicos1,12,13,38.
EquinocandinasLas equinocandinas pertenecen a una nueva clase de antifúngicos con un novedoso mecanismo de acción que consiste en interferir en la formación de la pared celular mediante la inhibición de la (1→3)-β-glucano sintetasa. Desde su introducción hace casi una década, han representado un notable avance en el tratamiento de pacientes con IFI, y su uso se asocia a una mejoría en el pronóstico de los pacientes, como lo demuestra un estudio español recientemente publicado en el que los pacientes que reciben este tratamiento en un estudio comparativo con diseño antes-después retrospectivo presentan una mejoría en la supervivencia de una forma estadísticamente significativa35.
Actualmente, hay tres equinocandinas comercializadas en España: caspofungina, anidulafungina y micafungina. Debido a su eficacia, excelente perfil de seguridad y actividad sobre biopelículas11,21, las equinocandinas deberían considerarse como tratamiento antifúngico de primera elección en pacientes con insuficiencia renal, dispositivos intravasculares, en tratamiento con inmunosupresores o ingresados en UCI, tal como se recomienda en las ultimas guías publicadas, con un idéntico nivel de evidencia (AI) para las tres equinocandinas disponibles1,38.
CaspofunginaEn un ensayo clínico publicado en el año 2002, se confirmó la actividad antifúngica de la caspofungina como al menos equivalente a la de la anfotericina B desoxicolato para el tratamiento de CI31, tanto en pacientes no neutropénicos, como neutropénicos. La respuesta clínica fue favorable con caspofungina en el 73,4% de los casos y con anfotericina B desoxicolato en el 61,7%. Aunque no hubo diferencias en la mortalidad a las 6-8 semanas, la toxicidad fue mayor en el grupo de la anfotericina B. Otros dos estudios han corroborado su eficacia, tanto en pacientes críticos, como en pacientes inmunodeprimidos6,8. Asimismo, la caspofungina es tan eficaz como la anfotericina B liposómica en pacientes con neutropenia febril, así como en el tratamiento de rescate de la aspergilosis invasiva, por lo que estas indicaciones no se deben olvidar en el tratamiento de este tipo de pacientes28,53.
AnidulafunginaLa anidulafungina comparte con los fármacos de su grupo las principales características de las equinocandinas, pero aporta ventajas frente al resto de éstas, ya que se metaboliza de forma diferente (es degradada por proteasas en el torrente sanguíneo), por lo que elude las interacciones con fármacos de metabolización hepática (citocromo P450) y la posible toxicidad hepática de éstas en combinación con la ciclosporina52. Además, hasta el momento es el único fármaco antifúngico que ha demostrado superioridad tanto en eficacia clínica, supervivencia y seguridad frente a otro (fluconazol) en un ensayo clínico en candidiasis invasiva/candidemia en pacientes no neutropénicos, si bien este ensayo se realizó con un diseño de no inferioridad45. Por tanto, debería considerarse un fármaco de primera línea para el tratamiento de las candidemias en pacientes críticos no neutropénicos. En un reciente análisis post hoc de este ensayo clínico que incluye a pacientes graves (APACHE II > 15, evidencia de sepsis grave o estancia en UCI), se ha revalidado dicha superioridad en este tipo de pacientes20. En otro análisis post hoc realizado en episodios de CI causados por C. albicans, se ha corroborado la superioridad de la anidulafungina frente al fluconazol, con una negativización más rápida de los hemocultivos y una persistencia menor de la infección46.
Todavía no se han publicado los resultados del ensayo clínico ICE del que hasta ahora sólo se han comunicado resultados parciales en varios congresos internacionales. Se trata de un estudio multicéntrico, abierto, prospectivo de fase 3b en adultos ingresados en UCI con un APACHE II < 25, candidemia/CI confirmada en las 48 horas previas o en las 48 horas posteriores al inicio del tratamiento en estudio y, como mínimo, una de las situaciones siguientes: cirugía abdominal previa, tumor sólido, insuficiencia renal o hepática, trasplante de órgano sólido, neutropenia y edad > 65 años. Los pacientes recibieron anidulafungina intravenosa durante un mínimo de 10 días, con la opción posterior de tratamiento oral con voriconazol/fluconazol. La respuesta global (clínica y microbiológica combinadas) fue del 69,5% (intervalo de confianza del 95%, 61,6-76,6) al final del tratamiento total y del 70,7% al final del tratamiento intravenoso; esa misma respuesta fue del 60,2 y del 50,5% a las 2 y 6 semanas, respectivamente, después del final del tratamiento total. Además, los efectos adversos fueron leves y poco frecuentes. La publicación definitiva de estos datos afianzará su uso en los subgrupos descritos.
MicafunginaRecientemente, en dos ensayos clínicos publicados, la micafungina, la segunda equinocandina comercializada en Estados Unidos y la tercera en España, ha demostrado al menos la misma eficacia que la anfotericina B liposómica (3mg/kg)24, presenta menores efectos secundarios que sus comparadores (anfotericina B liposómica y caspofungina) y las dosis de 100 y 150mg son igual de eficaces en el tratamiento de la CI40. En la actualidad es la equinocandina que más pacientes críticos ha incluido en sus dos ensayos clínicos pivotantes. Además, en un análisis post hoc en pacientes críticos realizado con los pacientes del ensayo frente a anfotericina B liposómica, se corroboró su eficacia en pacientes críticos con una respuesta clínica favorable del 62,5% en los 263 pacientes incluidos10.
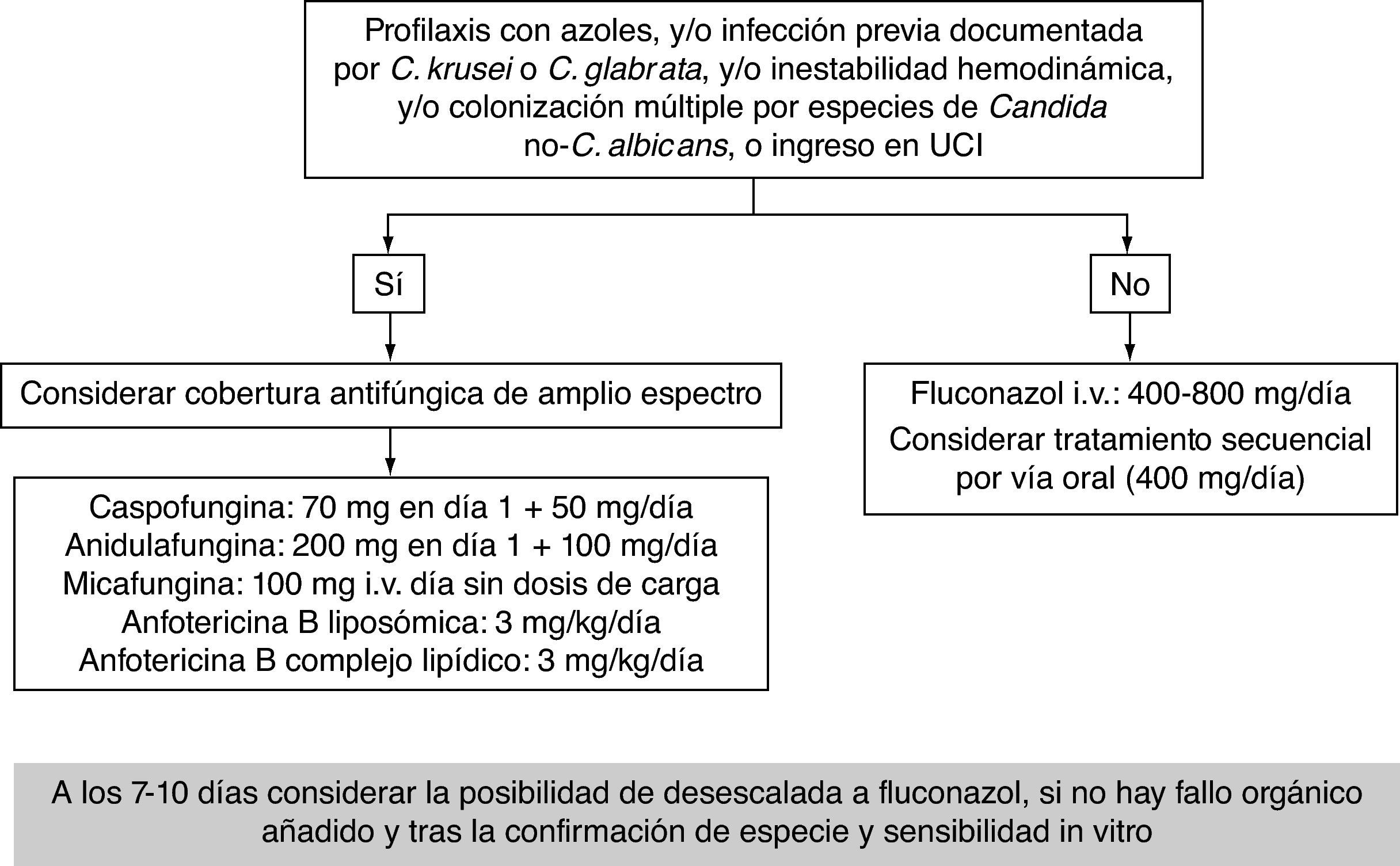
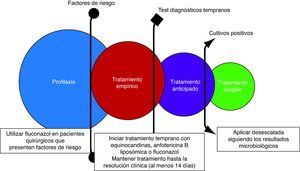
Una estrategia uniformePor todo lo anteriormente expuesto, las equinocandinas, la anfotericina B (especialmente la formulación liposómica) y el fluconazol deben considerarse de primera elección para el tratamiento de la CI en pacientes críticos no neutropénicos1,38,56. La elección dependerá del escenario (profilaxis, tratamiento empírico, anticipado o dirigido), de la situación clínica del paciente y de su comorbilidad, y siempre debe asociarse a la retirada del catéter1,56. Además, el tratamiento debe instaurarse lo más temprano posible14,32 y mantenerse hasta un máximo de 15 días después del último cultivo negativo o la resolución de los signos/síntomas clínicos1,38, excepto antes de finalizar el mismo la presencia de candidiasis hepatoesplénica y endoftalmitis1,15,37,38. La aplicación de la desescalada temprana en nuestro medio debe ser mandataria, al menos inicialmente, debido al aumento de especies de Candida no-C. albicans. En las figuras 1 y 2 se propone un algoritmo de desescalada terapéutica en infecciones fúngicas y un protocolo de tratamiento basado en los diferentes escenarios clínicos.
La disponibilidad de nuevos antifúngicos, con nuevos y distintos mecanismos de acción y buena tolerancia clínica, ha ampliado las posibilidades para el uso de tratamiento antifúngico combinado en las micosis oportunistas más graves. Más aún, la sinergia descrita in vitro entre el voriconazol y las equinocandinas augura un potencial enorme para el uso de esta combinación29. Marr et al30 evaluaron la respuesta de 47 pacientes con aspergilosis pulmonar que recibieron voriconazol o una combinación de voriconazol y caspofungina como tratamiento de rescate. El tratamiento combinado se asoció a una mejor tasa de supervivencia a los 3 meses y a una menor mortalidad que la monoterapia con voriconazol. En otro estudio en pacientes trasplantados, se observó un efecto beneficioso del tratamiento combinado de voriconazol con caspofungina (disminución de la mortalidad a los 90 días del inicio) como tratamiento de primera línea frente a la anfotericina B en un subgrupo de pacientes con infección por A. fumigatus50. Aunque no hay ensayos de combinación en infecciones por Candida spp. en pacientes críticos, la alta mortalidad de estos episodios podría justificar su uso56, si bien siguiendo las últimas guía españolas estas se deberían reservar en casos de mala evolución, con candidemia persistente después de la retirada del catéter venoso central, especialmente si el paciente está neutropénico1. Por tanto, es necesario desarrollar nuevos ensayos clínicos que corroboren este posible beneficio.
Elección del tratamiento antifúngico en sepsis grave y shock sépticoLa presencia de inestabilidad hemodinámica es un factor muy importante para la elección del tratamiento antifúngico empírico y dirigido (fig. 1). Este hecho se ha considerado de forma amplia en las guías1,12,38,39 y recomendaciones16 publicadas, respaldando la estrategia de desescalada, en especial en el paciente inestable. Todas ellas recomiendan el uso de equinocandinas como primera opción en CI cuando el paciente presenta inestabilidad hemodinámica. Su alta eficacia clínica, su escasa toxicidad, su excelente perfil de seguridad y su amplio espectro hacen más que razonable esta proposición.
Conflicto de interesesLos autores han recibido honorarios de Pfizer en relación con la coordinación y la edición de este número monográfico de la Revista Iberoamericana de Micología.