La candidiasis invasora (CI) es la infección fúngica invasora (IFI) más frecuente en el paciente crítico, seguida por la aspergilosis pulmonar invasiva (API). Las guías internacionales ofrecen diferentes recomendaciones sobre los tratamientos antifúngicos de elección, si bien la mayoría de ellas se inclinan a favor de las equinocandinas para la CI y los triazoles para la API. Sin embargo, la anfotericinaB liposomal (AmB-L) se sigue recomendando, al menos como tratamiento alternativo, en ambas entidades clínicas. Aunque el manejo de las IFI ha mejorado en la última década, persisten ciertas controversias. Los fármacos antifúngicos disponibles tienen, en ocasiones, una actividad por debajo de la óptima, o son utilizados inadecuadamente en ciertas situaciones clínicas de IFI con pacientes en estado crítico. El objetivo de esta revisión es analizar la individualización del tratamiento antifúngico de la IFI en el paciente crítico, poniendo especial relevancia en el papel de la AmB-L. Este análisis está basado en las interacciones farmacológicas de los fármacos antifúngicos, la situación clínica, el foco de infección (se discute sobre la candidiasis peritoneal), la especie del hongo responsable de la infección y la necesidad de monitorizar la concentración de los fármacos antifúngicos en el suero del paciente.
Invasive candidiasis (IC) is the most common invasive fungal infection (IFI) affecting critically ill patients, followed by invasive pulmonary aspergillosis (IPA). International guidelines provide different recommendations for a first-line antifungal therapy and, in most of them, echinocandins are considered the first-line treatment for IC, and triazoles are so for the treatment of IPA. However, liposomal amphotericinB (L-AmB) is still considered a second-line therapy for both clinical entities. Although in the last decade the management of IFI has improved, several controversies persist. The antifungal drugs currently available may have a suboptimal activity, or be wrongly used in certain IFI involving critically ill patients. The aim of this review is to analyze when to provide individualized antifungal therapy to critically ill patients suffering from IFI, emphasizing the role of L-AmB. Drug-drug interactions, the clinical status, infectious foci (peritoneal candidiasis is discussed), the fungal species involved, and the need of monitoring the concentration of the antifungal drug in the patient are considered.
La atención de los pacientes críticos es a menudo compleja, porque el manejo de la situación clínica y la prescripción de cualquier tratamiento suele conllevar cierta incertidumbre. Las infecciones fúngicas invasoras (IFI), con incidencia al alza, suponen un reto para el facultativo a cargo del paciente crítico, tanto en su diagnóstico como en la individualización de su tratamiento, pese a los avances en la investigación, diagnóstico y desarrollo de nuevas moléculas antifúngicas52,77.
El objetivo de esta revisión es actualizar los cambios que se han producido recientemente en la epidemiología, diagnóstico y recomendaciones en el tratamiento de la IFI en los pacientes críticos, con el objetivo de plantear un tratamiento antifúngico individualizado.
Epidemiología de la IFI en los pacientes críticosLas unidades de pacientes críticos se han convertido en las últimas dos décadas en el epicentro hospitalario de muchas IFI, con la incidencia de la candidiasis invasora (CI) 7-10 veces suoerior a la incidencia de esta infección en las plantas de hospitalización45. Bajo el proyecto Candidemia/intra-abdominal candidiasis in European intensive care units (EUCANDICU), una publicación de 2019 de un estudio realizado en 23UCI europeas constata un aumento de la incidencia de la CI, con 7,07 episodios por 1.000 ingresos, que contrasta con las incidencias registradas hace 20años (dos episodios por 1.000 ingresos). Asimismo, llama la atención la mayor incidencia en las unidades médicas frente a las quirúrgicas (19,03 frente a 1,75 episodios por 1.000 ingresos, respectivamente)4.
En España, el estudio CANDIPOP, un estudio poblacional prospectivo sobre la candidemia, describía un predominio de la especie Candida albicans (44,6%), seguida de Candida parapsilosis (24,5%), si bien la presencia de Candida glabrata (13,2%) se había hecho más notable29,55. En el registro nacional ENVIN (para la vigilancia de la infección nosocomial), C.albicans se ha aislado aproximadamente en el 40% de todas las candidemias en la última década, porcentaje que se ha mantenido estable en los últimos años62. Además, Candida auris empieza a estar presente en brotes en varios centros hospitalarios españoles43,58, por lo que pronto se verá reflejada en los nuevos estudios epidemiológicos.
Respecto a la sensibilidad in vitro, Li et al. describen una resistencia al fluconazol del 18,8%34, similar a la observada en el estudio CANDIPOP (20,8%)55. La tasa de resistencia a las equinocandinas es muy baja, alrededor del 3%, aunque C.glabrata puede suponer una excepción, con tasas hasta del 10%9,53. En los centros donde se emplean azoles y profilaxis con equinocandinas se ha observado un aumento de las infecciones por C.glabrata, y se espera un aumento en la tasa de resistencias al contemplarse cada vez más la profilaxis con equinocandinas en los protocolos de manejo de los pacientes oncohematológicos36.
La mortalidad atribuida a la candidemia en UCI ha permanecido casi inalterada, con un mínimo descenso en los últimos años, con una mortalidad a los 30días del 35-50% y una mortalidad precoz (<7días) estimada del 16-31%4,34,36,47,55.
En cuanto a la aspergilosis pulmonar invasiva (API), un estudio del grupo ENVIN observó una incidencia de infección respiratoria de 2,46 casos por 1.000 pacientes en UCI y de 3,23 episodios por 10.000días de estancia en UCI. La mayoría de los diagnósticos se basan en el aislamiento de Aspergillus en al menos dos muestras respiratorias en pacientes con factores de riesgo, con casi todos los casos diagnosticados como API posible y, en ocasiones, como API probable2, al igual que los hallazgos en el estudio AspICU, donde solo el 17% de API eran probadas68.
La mortalidad de la API continúa siendo inaceptablemente elevada, determinada principalmente por el fallo respiratorio refractario. En el estudio AspICU, que recoge una de las mayores series de API en UCI (563 pacientes), la mortalidad observada fue del 38, del 67 y del 79% en la API posible, la probable y la probada, respectivamente68. En los últimos años se han descrito nuevos factores de riesgo para la API, por lo que los pacientes con enfermedad pulmonar obstructiva crónica (EPOC), con cirrosis o con insuficiencia hepática grave ya son considerados de riesgo intermedio. Si bien el principal factor de riesgo es la neutropenia y clásicamente se ha relacionado la API con el trasplante hematopoyético (TPH) alogénico, actualmente solo del 10 al 15% de los pacientes críticos con API padecen neutropenia, y el resto otras situaciones clínicas de base. Los pacientes con EPOC, casi todos en tratamiento con corticoterapia, representan más del 50%40. Garnacho et al.23, en un estudio multicéntrico con 1.753 pacientes, describen la EPOC y los esteroides como factores asociados significativamente con el aislamiento de Aspergillus en la UCI. Recientemente se han descrito dos nuevos grupos de riesgo de API: los pacientes infectados por el virus influenza H1N1 y los pacientes infectados por el SARS-CoV-212,15. La linfopenia, las alteraciones inmunitarias y el daño epitelial en la mucosa respiratoria inducido por estos virus, incluso en pacientes sin inmunodeficiencia, podrían predisponer al desarrollo de la API.
Van der Linden et al.35, en un estudio multicéntrico con 2.941 aislamientos de Aspergillus fumigatus, describen la existencia de cepas resistentes a los azoles en 11 de los 19 países participantes, con una prevalencia general de resistencia a estos fármacos antifúngicos del 3,2% asociada a un peor pronóstico (mortalidad del 88-100%). En un reciente estudio multicéntrico español se describe una resistencia a los azoles del 6,6% en aislamientos de A.fumigatus19.
Papel de las guías y recomendaciones recientes. Aproximación al diagnóstico y tratamientoTras analizar los resultados del estudio CANDIPOP, los pilares del tratamiento de la CI se deben basar en la instauración de un tratamiento antifúngico empírico precoz y en el control del foco infeccioso (lo que incluye, si lo hubiere, la retirada del catéter)55. La efectividad de estas acciones ha sido posteriormente corroborada por un estudio multicéntrico español con 294 pacientes que, además, apuesta por la seguridad de la desescalada en el tratamiento de la CI24. Con este objetivo, parece lógico establecer una estrategia diagnóstica precoz que combine la sospecha clínica y el uso de biomarcadores, tal y como abogan las recientes recomendaciones publicadas conjuntamente por la European Society of Intensive Care Medicine (ESICM) y el Critically Ill Patients Study Group de la European Society of Clinical Microbiology and Infectious Diseases (ESCMID)37, y el proyecto ÉPICO74.
Para el tratamiento antifúngico de la CI, tanto las últimas recomendaciones publicadas37 como el proyecto ÉPICO76 y las últimas guías americanas48 recomiendan el uso de las equinocandinas como tratamiento de elección en pacientes inestables (con el objeto de evitar la posible nefrotoxicidad de la anfotericinaB [AmB]), salvo que exista un fracaso terapéutico previo a dichos fármacos antifúngicos, intolerancia o la existencia de un foco infeccioso endovascular. En estos casos la recomendación es el uso de anfotericinaB liposomal (AmB-L) frente a otras posibles formulaciones de AmB.
En el tratamiento de la API del paciente crítico las guías americanas49 y las guías del Grupo de Estudio de Micología Médica de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (GEMICOMED-SEIMC/REIPI)22 recomiendan, con el mismo nivel de evidencia, el uso de voriconazol o isavuconazol antes que el de AmB-L, aunque las profilaxis previas condicionarán la elección del fármaco antifúngico. Un documento de consenso español25 priorizó el uso de AmB-L en el tratamiento de la API en el paciente crítico en los siguientes casos: tratamiento concomitante con fármacos metabolizados por el citocromo P4503A4 o el citocromo P4502C9, tratamiento concomitante con fármacos que pueden prolongar el intervalo QT, existencia de insuficiencia hepática grave (ChildC) o filtrado glomerular inferior a 50ml/min.
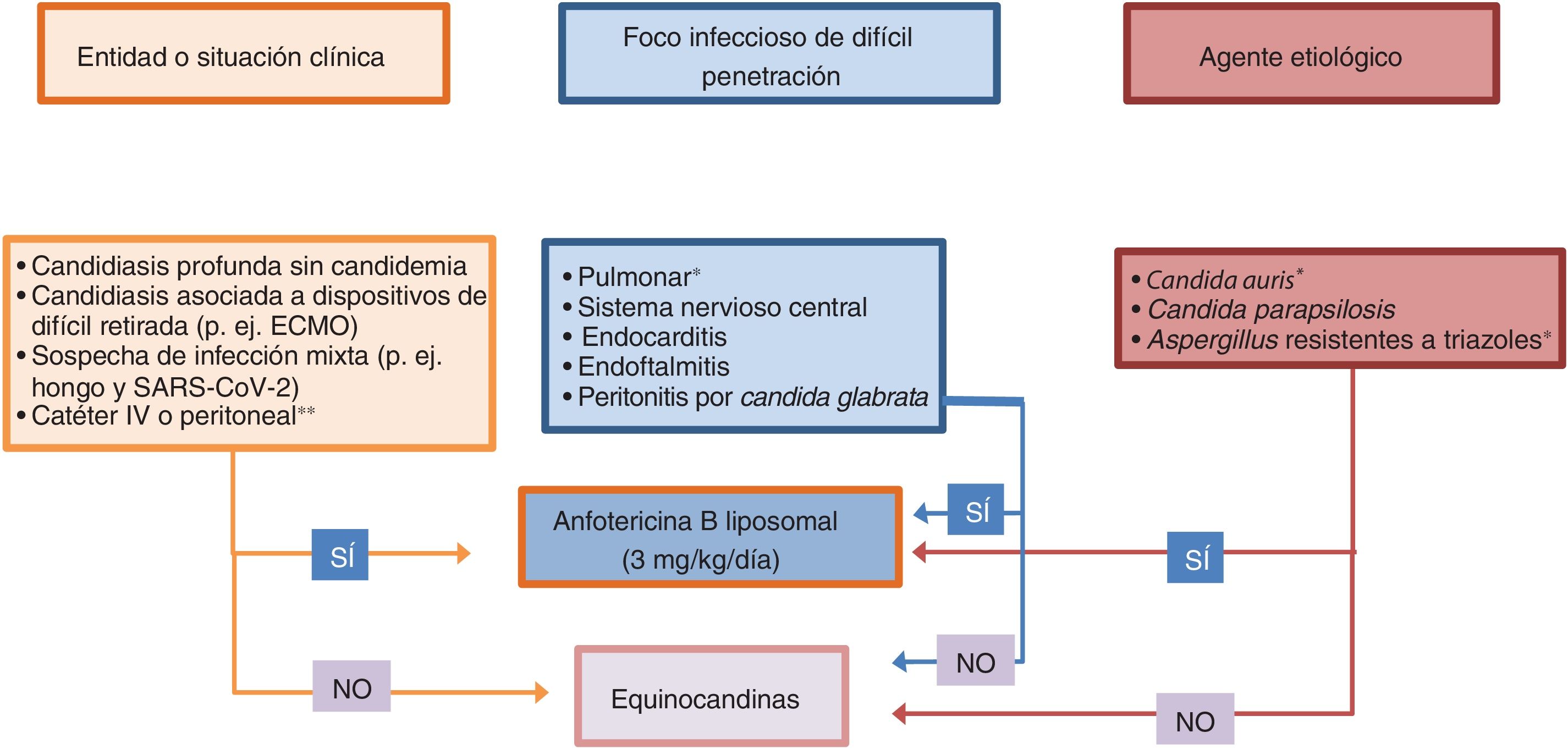
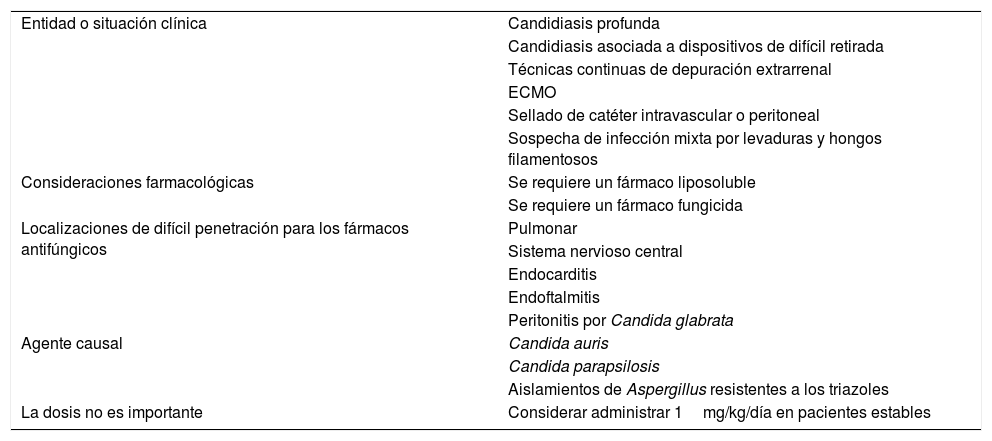
Individualización del tratamiento antifúngico de la IFI en el paciente críticoAunque las guías terapéuticas sobre IFI aportan información muy adecuada, el paciente crítico con sus importantes peculiaridades no es considerado específicamente en muchas ocasiones y, al basarse dichas guías en grados de evidencia, las recomendaciones para determinados subgrupos y escenarios clínicos no son posibles. A continuación se plantean diferentes tratamientos individualizados de la IFI en el paciente crítico. En la tabla 1 se recogen situaciones clínicas en las que el facultativo debe plantearse un tratamiento individualizado con AmB-L en pacientes críticos32. En la figura 1 se presenta un algoritmo basado en dichas consideraciones.
Uso de anfotericina B liposomal en el tratamiento de las infecciones fúngicas invasoras en pacientes críticos
| Entidad o situación clínica | Candidiasis profunda |
| Candidiasis asociada a dispositivos de difícil retirada | |
| Técnicas continuas de depuración extrarrenal | |
| ECMO | |
| Sellado de catéter intravascular o peritoneal | |
| Sospecha de infección mixta por levaduras y hongos filamentosos | |
| Consideraciones farmacológicas | Se requiere un fármaco liposoluble |
| Se requiere un fármaco fungicida | |
| Localizaciones de difícil penetración para los fármacos antifúngicos | Pulmonar |
| Sistema nervioso central | |
| Endocarditis | |
| Endoftalmitis | |
| Peritonitis por Candida glabrata | |
| Agente causal | Candida auris |
| Candida parapsilosis | |
| Aislamientos de Aspergillus resistentes a los triazoles | |
| La dosis no es importante | Considerar administrar 1mg/kg/día en pacientes estables |
ECMO: oxigenación por membrana extracorpórea.
Dentro de las CI se deben distinguir tres entidades clínicas de interés: a)presencia de candidemia sin candidiasis profunda; b)candidemia con candidiasis profunda, y c)candidiasis profunda sin candidemia. Aproximadamente un tercio de los pacientes con CI se encuentra en cada una de estas situaciones. Modelos experimentales muestran que, en el segundo escenario clínico, la infección profunda se mantiene a pesar de la desaparición de Candida del torrente sanguíneo10. En el caso de las API, estas se acompañan de importantes áreas de inflamación y necrosis que dificultan la llegada del fármaco antifúngico14. Es en esta situación cuando datos como la actividad fungicida, las características Pk/Pd del fármaco antifúngico, su penetración y su acumulación en los tejidos tienen especial importancia.
La AmB tiene actividad fungicida contra especies de Candida y Aspergillus, mientras que los azoles solo son fungicidas contra Aspergillus y las equinocandinas solo contra Candida27. Las equinocandinas y los polienos tienen una penetración tisular muy similar, si bien las equinocandinas alcanzan muy bajas concentraciones en el corazón, los nódulos linfáticos, el ojo, el cerebro y en el compartimento peritoneal6,20. Sin embargo, las diferentes formulaciones de AmB, sobre todo la AmB-L, tienen la importante capacidad de acumularse en los tejidos conforme disminuye su concentración en sangre, y alcanza así elevadas concentraciones en el pulmón infectado73 de manera más marcada, y también en el cerebro, el bazo, el corazón y los riñones71.
La monitorización de la concentración plasmática de un fármaco está justificada en determinadas situaciones por su comportamiento farmacocinético impredecible, por el estrecho margen terapéutico, por las interacciones farmacológicas y por el rango de concentración definido. En general, los azoles (itraconazol, voriconazol, posaconazol, isavuconazol) se encuentran en esta situación, a diferencia de las equinocandinas y de la AmB33. Las interacciones farmacológicas, como en el caso de los azoles, y determinados cuadros clínicos de la infección (asociados a peor pronóstico) refuerzan la necesidad de monitorizar las concentraciones plasmáticas de los fármacos antifúngicos, especialmente cuando distintos estudios describen la existencia de dosis insuficientes de estos en el paciente crítico, lo cual puede provocar una mayor mortalidad26,64. En el caso de no poder determinar en el paciente la concentración del fármaco antifúngico en plasma o no tener los resultados en tiempo real, no se deberían utilizar fármacos antifúngicos que requieran estos controles.
Uso de fármacos antifúngicos en situaciones especialesLas biopelículas de Candida en catéteres y otros dispositivos médicos incrementan la resistencia a los azoles, en menor medida a las equinocandinas y a la AmB, lo que se asocia con un peor pronóstico1,70. Un estudio realizado en 294 pacientes con candidemia concluyó que uno de los factores independientes asociados con una mayor mortalidad fue la infección por una cepa de Candida productora de biopelícula, que en el caso del estudio incluía a las especies C.albicans y C.parapsilosis69. La técnica de sellado del catéter con fármacos antifúngicos también puede ser un ejemplo de la diferente eficacia de los fármacos antifúngicos para evitar la formación de biopelículas o eliminarlas. Un estudio sobre la actividad in vitro de la AmB-L en comparación con la caspofungina y el voriconazol sobre biopelículas de C.albicans puso de manifiesto la mayor rapidez y la efectividad dosis-dependiente de la AmB-L frente a la caspofungina, que, además, mostró un efecto inverso concentración-dependiente56. También se ha observado el éxito del sellado de catéteres de diálisis peritoneal, sobre todo con AmB72.
Cuando se utilizan técnicas continuas de depuración extrarrenal no se precisa el ajuste de la dosis con ninguna de las tres equinocandinas comercializadas; sin embargo, no se recomienda el uso del fluconazol por la importante pérdida a través de la membrana de diálisis75. En un estudio con 900 pacientes bajo terapia de reemplazo renal que recibieron AmB-L se llegó a la conclusión de que no se precisa ningún tipo de ajuste en la posología de la AmB-L con estas terapias44.
Si se administran fármacos antifúngicos en pacientes con oxigenación por membrana extracorpórea deben usarse las mismas dosis pese a la posibilidad de tener menores concentraciones del fármaco, y la administración de voriconazol debe evitarse por la gran adsorción de este por la membrana59,65. La escasa experiencia publicada con AmB-L presenta resultados divergentes. En un estudio no se encontró necesario el aumento de la dosis7, mientras que en otro estudio posterior la dosis hubo de aumentarse al doble de la habitual78, por lo que lo recomendable es realizar un ajuste de la dosis en función de cada caso.
Fármacos antifúngicos según la entidad clínica y el foco de la infecciónAl igual que ocurre en las endocarditis y otras infecciones endovasculares, la AmB-L es en el antifúngico de elección en las candidiasis del sistema nervioso central60. Las equinocandinas tienen una escasa penetración67 y el fluconazol requiere el aumento de la dosis para conseguir una curación microbiológica66.
Las equinocandinas penetran mal en el globo ocular y muchos autores no recomiendan utilizarlas en caso de endoftalmitis candidiásica. Por tanto, ante una afectación ocular en un paciente con candidemia tratado con una equinocandina, se recomienda el cambio a AmB-L o a azoles46.
Fármacos antifúngicos según la especie implicadaEn las infecciones por C.parapsilosis se recomienda el uso de fluconazol o AmB-L; las equinocandinas no son el tratamiento de elección en estas candidiasis76. No obstante, se ha descrito un brote de candidemia por C.parapsilosis resistente a fluconazol en pacientes críticos en Portugal54.
Las CI por C.auris son posiblemente las únicas para las que está indicado el tratamiento combinado. En la serie de candidemias debidas a esta especie en el Hospital Universitario y Politécnico La Fe, en el 35,4% de los 76 episodios registrados hubo de administrarse un tratamiento combinado de una equinocandina junto con AmB-L58 debido a la mala respuesta clínica a las equinocandinas en monoterapia.
En el tratamiento de la API no debe olvidarse el aumento de la resistencia de A.fumigatus a los triazoles que recientemente se ha descrito en nuestro país19. En los centros donde se observe esta situación deberían tenerla en cuenta antes de tratar un paciente con API de manera empírica o dirigida.
Importancia de la dosisEl estudio AmBiLoad11, que comparaba dos dosis diferentes de AmB-L (10mg/kg/día frente a 3mg/kg/día) en pacientes oncohematológicos, mostró la misma eficacia clínica con ambas pautas pero con menor toxicidad con la dosis habitual de 3mg/kg/día. Otra forma de evitar la nefrotoxicidad de la AmB-L es el uso de dosis más bajas (1mg/kg/día). Un estudio farmacocinético avala esta posibilidad al observar que con esta dosis se consiguen concentraciones plasmáticas de AmB superiores a 2mg/dl durante más de 24h28, concentración muy superior a las CMI90 descritas para Candida en los estudios Fungemyca51 y CANDIPOP55. Trasladado a la clínica, en un pequeño estudio con esta misma dosis de AmB-L y las dosis habituales de caspofungina y micafungina en pacientes con candidemia los efectos adversos fueron los mismos con los tres fármacos antifúngicos, pero el coste por paciente fue menor con la AmB-L30.
Candidiasis intraabdominalLa candidiasis intraabdominal es la segunda presentación más frecuente de la CI. Entre los diferentes consensos y guías clínicas publicados sobre infecciones por Candida, las referencias al tratamiento de la peritonitis candidiásica (manifestación más habitual de la candidiasis intraabdominal) son escasas, probablemente por la moderada o baja calidad de la evidencia científica obtenida en esta patología infecciosa. Sin embargo, los pacientes con peritonitis candidiásica presentan una serie de características que merecen una aproximación y un tratamiento específico.
La fisiopatología de la contaminación peritoneal es una de estas peculiaridades, puesto que cuando se produce una perforación de una víscera hueca se liberan al peritoneo células de Candida presentes de manera habitual en la microbiota intestinal. Existen casos de peritonitis adquirida en la comunidad donde el tratamiento quirúrgico, incluyendo la limpieza de la cavidad abdominal y un tratamiento breve de antibióticos, llevará probablemente a una rápida recuperación del paciente. En estos casos el aislamiento de Candida no refleja una peritonitis candidiásica y habitualmente no es necesario iniciar un tratamiento antifúngico8,16,41. Sin embargo, en los pacientes que presentan una peritonitis recurrente debido a una dehiscencia anastomótica el riesgo de CI es mayor y puede ser necesario comenzar un tratamiento antifúngico empírico18,63. Por otra parte, la peritonitis candidiásica puede tener su origen en el aumento progresivo de la carga de Candida debido a una serie de factores de riesgo bien conocidos como los tratamientos antibióticos de amplio espectro, la cirugía abdominal previa, la nutrición parenteral, las terapias de reemplazo renal o la presencia de un catéter venoso central, entre otros. En estas situaciones lo difícil es decidir cuándo comenzar un tratamiento antifúngico, puesto que la infección no tiene lugar en un plazo de horas, sino en días8,41,42, y excepto para la candidemia que se detecta en una minoría de los casos de peritonitis17,41, instaurar un tratamiento antifúngico urgente no es una opción terapéutica validada.
Para el tratamiento antifúngico de la peritonitis candidiásica en el paciente crítico la mayoría de las recomendaciones y guías clínicas asumen el mismo criterio que para la candidemia y la CI sin otro tipo de valoración, decantándose por la utilización de equinocandinas13,48,61. Diferentes publicaciones han puesto de manifiesto en el paciente crítico las concentraciones plasmáticas subterapéuticas del fluconazol y las equinocandinas a las dosis recomendadas habitualmente3,38,64. Existe cierta controversia en cuanto a su utilización en la peritonitis candidiásica y otras formas de IFI intraabdominal debido a su mala penetración y a la aparición de resistencias en las infecciones causadas por C.glabrata39,50.
Un modelo murino de peritonitis con la especie C.glabrata estudió la eficacia de distintas dosis de caspofungina en el tratamiento. Debido a la pobre penetración de las equinocandinas, se generaron mutantes resistentes que podían proceder del tracto gastrointestinal31. Este hecho también se ha observado en los pacientes críticos mediante la medición de las concentraciones de las tres equinocandinas en el líquido abdominal de pacientes con sospecha de infección fúngica intraabdominal26; dichas concentraciones estuvieron por debajo de la concentración preventiva para la aparición de mutantes descrita por otros autores57.
Como han puesto de manifiesto varios autores5,32, la AmB-L debería ser una alternativa terapéutica al uso de las equinocandinas con el mismo grado de evidencia para el tratamiento de la CI y de la peritonitis candidiásica. Las concentraciones plasmáticas y en tejido que se alcanzan son similares en el paciente crítico y en voluntarios sanos21.
FinanciaciónLa publicación de este artículo ha sido financiada por Gilead. Gilead no ha intervenido ni ha influido en el contenido del mismo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.