El tratamiento de la infección fúngica invasora sigue siendo un reto, tanto para el diagnóstico como para la instauración de la terapia antifúngica adecuada. Candida auris es una levadura patógena responsable de brotes hospitalarios, especialmente en las unidades de cuidados intensivos; se caracteriza por una elevada resistencia a los antifúngicos, pudiendo llegar a ser multirresistente. En la actualidad, el tratamiento recomendado de las infecciones invasivas por este patógeno consiste en la administración de una equinocandina, previa realización de pruebas in vitro de sensibilidad antifúngica. En caso de no observar respuesta clínica o candidemia persistente, podrá considerarse la adición de anfotericina B liposomal o isavuconazol. Tanto la infección fúngica del sistema nervioso central como aquella asociada a dispositivos biomédicos, aunque siguen siendo entidades poco frecuentes que afectan fundamentalmente a pacientes inmunodeprimidos, han mostrado un aumento de su incidencia en los últimos años junto a una elevada morbimortalidad. El tratamiento de estas infecciones está condicionado por el conocimiento limitado de las propiedades farmacocinéticas de los antifúngicos. En el caso de las infecciones del sistema nervioso central resulta imprescindible caracterizar mejor los parámetros farmacocinéticos y farmacodinámicos de los fármacos antifúngicos para definir su eficacia en el tratamiento de estas infecciones.
The treatment of invasive fungal infections remains a challenge, both for the diagnosis and for the need of providing the appropriate antifungal therapy. Candida auris is a pathogenic yeast that is responsible for hospital outbreaks, especially in intensive care units; it is characterized by a high resistance to the antifungal agents and can become multidrug-resistant. At present, the recommended antifungal agents for the invasive infections with this pathogen are echinocandins, always after carrying out an antifungal susceptibility testing. In case of no clinical response or persistent candidemia, the addition of liposomal amphotericin B or isavuconazole may be considered. Both fungal infection of the central nervous system and that associated with biomedical devices remain rare entities affecting mainly immunocompromised patients. However, an increase in their incidence in recent years, along with high morbidity and mortality, has been shown. The treatment of these infections is conditioned by the limited knowledge of the pharmacokinetic properties of antifungals. A better understanding of the pharmacokinetic and pharmacodynamic parameters of the different antifungals is essential to determine the efficacy of the antifungal agents in the treatment of these infections.
Candida auris es una levadura emergente resistente a la mayoría de los fármacos antifúngicos disponibles. Desde su aparición, en 2009, ha sido considerada un patógeno estrechamente relacionado con los cuidados sanitarios, pudiendo causar infecciones invasivas con alta mortalidad asociada, sobre todo en pacientes ingresados en unidades de cuidados intensivos (UCI)13, tanto de adultos como pediátricas8. Ninguno de los estudios genómicos realizados hasta ahora han mostrado relación de las cinco especies del género Candida más prevalentes con C. auris. Sin embargo, se ha demostrado una estrecha relación de esta última con levaduras raramente asociadas a infección nosocomial como Candida haemulonii, Candida ruelliae, Candida pseudohaemulonii, Candida duobushaemulonii y Candida heveicola13.
EpidemiologíaUn reciente análisis completo del genoma de 304 aislamientos de C. auris de diferentes países ha dado lugar a su agrupación en cuatro clados ya descritos: clado I (Alemania, Canadá, Francia, India, Kenia, Pakistán, Arabia Saudí, Reino Unido, Emiratos Árabes Unidos y EE. UU.), clado II (Canadá, Japón, Corea del Sur y EE. UU.), clado III (Australia, Canadá, Kenia, Sudáfrica, España y EE. UU.) y clado IV (Colombia, Israel, Panamá, EE. UU. y Venezuela)9. A estos cuatro habría que añadir un posible V clado descrito en Irán10.
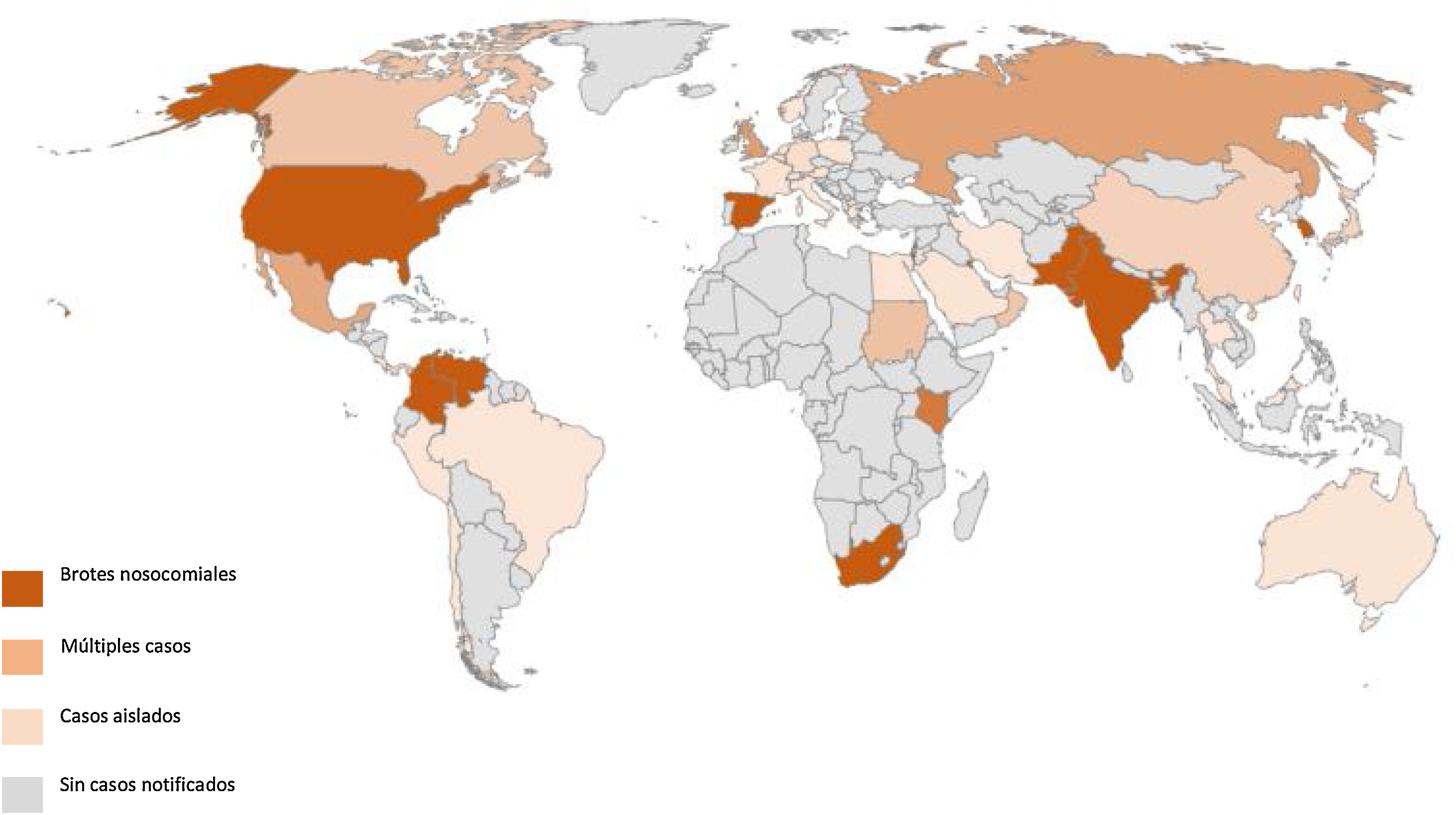
C. auris fue aislada por primera vez en 2009 a partir del exudado ótico de una paciente japonesa. Desde entonces, se han comunicado infecciones y colonizaciones por esta especie en 46 países de los cinco continentes6, y se ha convertido en una de las causas más frecuentes de candidemia en algunos hospitales de la India, Sudáfrica, Venezuela y España13,5,18 (fig. 1).
Países con casos y brotes hospitalarios por Candida auris hasta diciembre del 2020 (imagen adaptada del Centers for Disease Control and Prevention [CDC] Tracking Candida auris/Fungal Diseases, 2020). Se han notificado brotes hospitalarios en Colombia, India, Israel, Japón, Kenia, Kuwait, Pakistán, Sudáfrica, Corea del Sur, España, Reino Unido, EE. UU. y Venezuela.
C. auris puede colonizar múltiples localizaciones anatómicas (fosas nasales, boca, conducto auditivo externo, ingles, axilas y recto), así como aislarse de orina y heridas. Estas colonizaciones pueden ser muy persistentes, pudiendo permanecer hasta tres meses después del aislamiento inicial a pesar del uso de agentes como la clorhexidina, la nistatina o las equinocandinas18. Entre los factores de riesgo para la colonización se incluye el ingreso en UCI, principalmente en países endémicos, y el contacto con pacientes colonizados o la colonización de su entorno20. La persistencia de la colonización hace necesario el seguimiento de los pacientes mediante cultivos de vigilancia que se deben realizar semanalmente hasta el alta hospitalaria, así como el aislamiento de estos hasta obtener tres cultivos de vigilancia consecutivos negativos21.
La presentación clínica de las infecciones invasivas por C. auris, incluida la candidemia, es similar a la de las infecciones por otras especies del género Candida. Hasta la fecha, el espectro de infecciones por C. auris incluye candidemia, meningitis, osteomielitis, otomastoiditis, otitis media crónica, infecciones intraabdominales, pericarditis, derrame pleural, vulvovaginitis y panoftalmitis13,18,33. En el metaanálisis de Osei et al. que incluyó datos de 16 países, la candidemia fue la presentación más frecuente con un 67% de los casos18,33. La mortalidad atribuible a la infección por C. auris es difícil de determinar debido a la gran variedad de comorbilidades y/o coinfecciones de los pacientes que dificulta esta estimación. En la candidemia por C. auris la mortalidad global oscila entre el 28 y el 60%, incluida la de recién nacidos prematuros13,18,33. Independientemente del tipo de infección o estado inmunitario del paciente, el retraso en el inicio de la terapia antifúngica, ya sea por la identificación errónea de esta levadura o por un diagnóstico tardío, incrementa la mortalidad un 35%18. A pesar de la escasa información disponible, se han descrito varios episodios de complicaciones relacionadas con la candidemia: pericarditis, transmisión de C. auris de un donante a un receptor de un trasplante de pulmón, peritonitis, meningitis, endoftalmitis y osteomielitis18,40,41. En nuestro país, la tasa de complicaciones observada durante o después de la candidemia alcanzó el 8,8% a pesar de la instauración de un tratamiento antifúngico adecuado40,31.
Tratamiento de las infecciones por C. aurisEl tratamiento de las infecciones causadas por C. auris constituye un verdadero desafío para el clínico. Debido a sus altas tasas de resistencia a los fármacos antifúngicos y a la falta de guías específicas de manejo, las opciones terapéuticas deben considerarse en cada paciente individualmente. Un reciente metaanálisis de Osei et al. en el que se revisaba la sensibilidad de aislamientos de C. auris de 16 países mediante la aplicación de los puntos de corte clínicos recomendados por el Centers for Disease Control and Prevention (CDC), arrojó unos porcentajes de resistencia del 80,79% al fluconazol, 7,24% al itraconazol, 6,33% al posaconazol, 38,11% al voriconazol, 9,24% al isavuconazol y 26,23% a la anfotericina B (AmB)33,41.
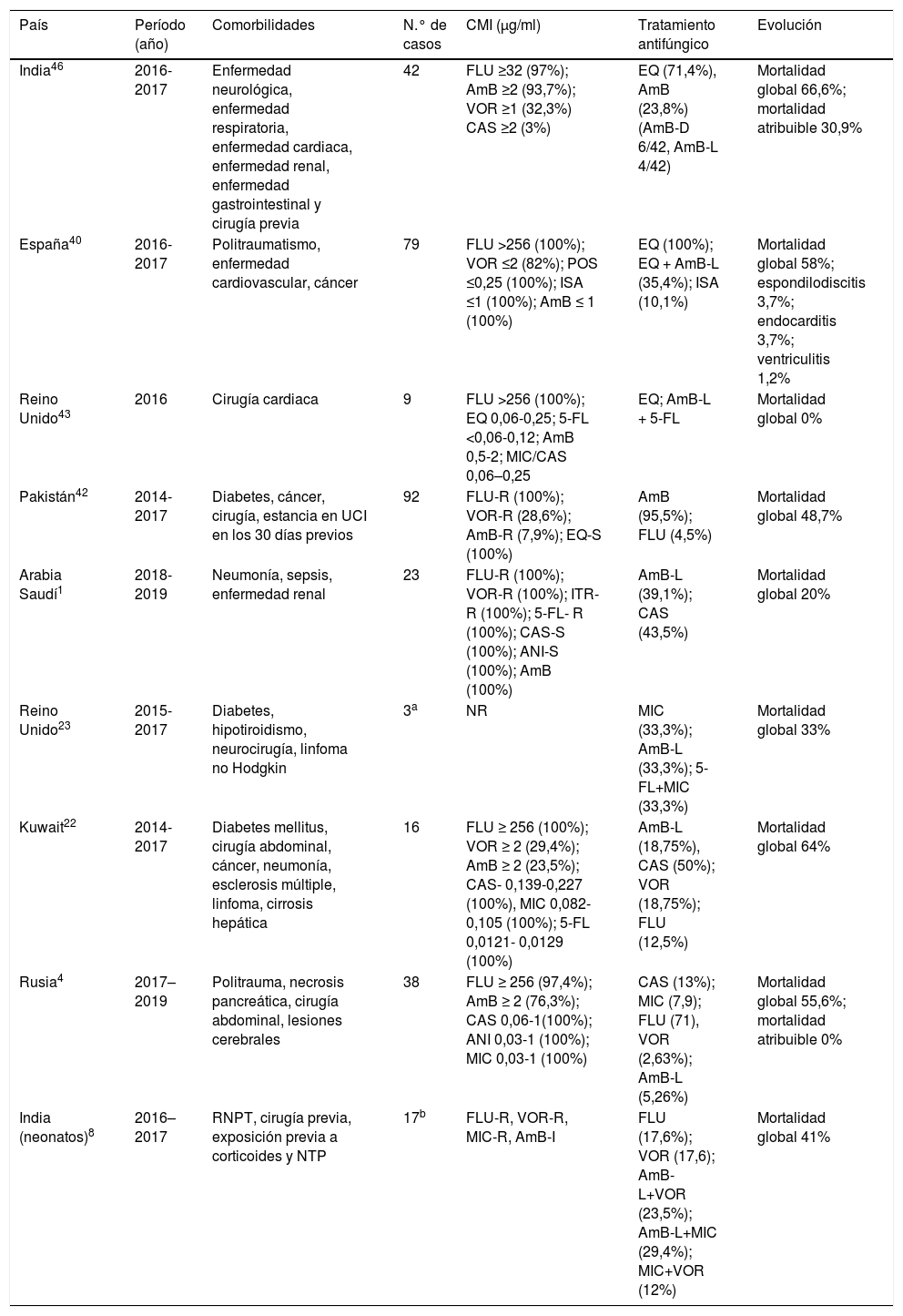
A pesar de la alta tasa de resistencia de C. auris a las distintas familias de fármacos antifúngicos, la mayoría de los aislamientos clínicos responden a las equinocandinas41, por lo que estas se siguen recomendado para el tratamiento inicial de infecciones invasivas por C. auris en pacientes adultos y niños de dos meses de edad o superior (excepto la anidulafungina, que no está aprobada para su uso pediátrico), siempre previa realización de las pruebas in vitro de sensibilidad antifúngica. En caso de no observar una respuesta clínica favorable o que la candidemia persista más allá del quinto día de tratamiento, podrá considerarse el cambio de tratamiento o la adición de anfotericina B liposomal (AmB-L) o isavuconazol40,41. En la tabla 1 se describe la terapia antifúngica adoptada y la evolución clínica de nueve series de casos publicadas hasta el 2020, incluyendo casos pediátricos.
Datos demográficos, perfil de sensibilidad, terapia antifúngica y evolución en nueve series de pacientes con candidemia e infección del sistema nervioso central por Candida auris (datos publicados hasta 2020)
| País | Período (año) | Comorbilidades | N.° de casos | CMI (μg/ml) | Tratamiento antifúngico | Evolución |
|---|---|---|---|---|---|---|
| India46 | 2016-2017 | Enfermedad neurológica, enfermedad respiratoria, enfermedad cardiaca, enfermedad renal, enfermedad gastrointestinal y cirugía previa | 42 | FLU ≥32 (97%); AmB ≥2 (93,7%); VOR ≥1 (32,3%) CAS ≥2 (3%) | EQ (71,4%), AmB (23,8%) (AmB-D 6/42, AmB-L 4/42) | Mortalidad global 66,6%; mortalidad atribuible 30,9% |
| España40 | 2016-2017 | Politraumatismo, enfermedad cardiovascular, cáncer | 79 | FLU >256 (100%); VOR ≤2 (82%); POS ≤0,25 (100%); ISA ≤1 (100%); AmB ≤ 1 (100%) | EQ (100%); EQ + AmB-L (35,4%); ISA (10,1%) | Mortalidad global 58%; espondilodiscitis 3,7%; endocarditis 3,7%; ventriculitis 1,2% |
| Reino Unido43 | 2016 | Cirugía cardiaca | 9 | FLU >256 (100%); EQ 0,06-0,25; 5-FL <0,06-0,12; AmB 0,5-2; MIC/CAS 0,06–0,25 | EQ; AmB-L + 5-FL | Mortalidad global 0% |
| Pakistán42 | 2014-2017 | Diabetes, cáncer, cirugía, estancia en UCI en los 30 días previos | 92 | FLU-R (100%); VOR-R (28,6%); AmB-R (7,9%); EQ-S (100%) | AmB (95,5%); FLU (4,5%) | Mortalidad global 48,7% |
| Arabia Saudí1 | 2018-2019 | Neumonía, sepsis, enfermedad renal | 23 | FLU-R (100%); VOR-R (100%); ITR-R (100%); 5-FL- R (100%); CAS-S (100%); ANI-S (100%); AmB (100%) | AmB-L (39,1%); CAS (43,5%) | Mortalidad global 20% |
| Reino Unido23 | 2015-2017 | Diabetes, hipotiroidismo, neurocirugía, linfoma no Hodgkin | 3a | NR | MIC (33,3%); AmB-L (33,3%); 5-FL+MIC (33,3%) | Mortalidad global 33% |
| Kuwait22 | 2014- 2017 | Diabetes mellitus, cirugía abdominal, cáncer, neumonía, esclerosis múltiple, linfoma, cirrosis hepática | 16 | FLU ≥ 256 (100%); VOR ≥ 2 (29,4%); AmB ≥ 2 (23,5%); CAS- 0,139-0,227 (100%), MIC 0,082- 0,105 (100%); 5-FL 0,0121- 0,0129 (100%) | AmB-L (18,75%), CAS (50%); VOR (18,75%); FLU (12,5%) | Mortalidad global 64% |
| Rusia4 | 2017–2019 | Politrauma, necrosis pancreática, cirugía abdominal, lesiones cerebrales | 38 | FLU ≥ 256 (97,4%); AmB ≥ 2 (76,3%); CAS 0,06-1(100%); ANI 0,03-1 (100%); MIC 0,03-1 (100%) | CAS (13%); MIC (7,9); FLU (71), VOR (2,63%); AmB-L (5,26%) | Mortalidad global 55,6%; mortalidad atribuible 0% |
| India (neonatos)8 | 2016–2017 | RNPT, cirugía previa, exposición previa a corticoides y NTP | 17b | FLU-R, VOR-R, MIC-R, AmB-I | FLU (17,6%); VOR (17,6); AmB-L+VOR (23,5%); AmB-L+MIC (29,4%); MIC+VOR (12%) | Mortalidad global 41% |
Incluye candidemia e infección del sistema nervioso central.
AmB: anfotericina B; AmB-L: anfotericina B liposomal; AmB-D: anfotericina B desoxicolato; ANI: anidulafungina; CAS: caspofungina; CMI: concentración mínima inhibitoria; EQ: equinocandinas; FLU: fluconazol; I: intermedio; ISA: isavuconazol; ITRA: itraconazol; MIC: micafungina; NR: no reportado; NTP: nutrición parenteral; R: resistente; RNPT: recién nacido pretérmino; S: sensible; UCI: unidad de cuidados intensivos; VOR: voriconazol; 5-FL: 5-fluorocitosina.
En el caso de los recién nacidos y lactantes de dos años o menores, el CDC recomienda la administración de 1 mg/kg/día de anfotericina B desoxicolato (AmB-D) como tratamiento de primera línea; si tras cinco días de tratamiento no se observa mejoría clínica o microbiológica, se debe considerar el cambio de tratamiento a AmB-L (5 mg/kg/día) o instaurar una terapia combinada (equinocandina más AmB-L)41. A pesar de que el manejo de la infección por C. auris es similar al de otras infecciones por Candida, hay que tener en cuenta que C. auris desarrolla rápidamente resistencia a los fármacos antifúngicos y, por lo tanto, los pacientes deben ser cuidadosamente monitorizados con cultivos de seguimiento y pruebas de sensibilidad in vitro a los fármacos antifúngicos13,18,41. El tratamiento de la candidemia incluye no solo una terapia antifúngica temprana, sino también una serie de medidas que abarcan la retirada de catéteres, el drenaje de colecciones y la búsqueda de focos metastásicos. Asimismo, la duración del tratamiento antifúngico va a estar determinada por la respuesta microbiológica. Basándonos en nuestra experiencia, recomendamos mantener el tratamiento antifúngico más allá de lo que indican las guías clínicas34 e iniciar la terapia antifúngica con tratamiento combinado (AmB-L junto con una equinocandina) durante cinco días. Si se observa una respuesta clínica favorable puede retirarse la AmB-L y continuar con la equinocandina durante 15 a 20 días más31.
Infección fúngica del sistema nervioso centralLa infección fúngica del sistema nervioso central (SNC) es una entidad clínica poco frecuente con una forma de presentación muy diversa16 (tabla 2). No obstante, debemos tener en cuenta que, en la mayor parte de los casos de micosis diseminadas, el SNC se ve afectado. La mayoría de estas infecciones tienen lugar en pacientes sometidos a trasplante hematológico, trasplante de órgano sólido, pacientes con neoplasias hematológicas, individuos bajo tratamiento quimioterápico, personas con infección por el virus de la inmunodeficiencia humana (VIH), pacientes diabéticos o aquellos sometidos a tratamientos prolongados con corticoides. Además, los pacientes tratados con agentes inmunomoduladores se han convertido en un grupo de riesgo emergente en los últimos años. Hay que destacar que algunas micosis del SNC pueden tener lugar en sujetos inmunocompetentes, como por ejemplo la criptococosis, la histoplasmosis, la coccidioidomicosis o la infección fúngica diseminada por Candida en el neonato prematuro.
Principales formas de presentación de las infecciones fúngicas del sistema nervioso central
| Síndrome | Géneros más frecuentemente implicados |
|---|---|
| Meningitis | Cryptococcus, Coccidioides, Exserohilum, Candida, Histoplasma |
| Meningoencefalitis | Cryptococcus, Coccidioides, Candida |
| Abscesos cerebrales | Aspergillus, Candida, mucormicetos, Blastomyces, Coccidioides, Histoplasma |
| Formas rinocerebrales | Mucor, Rhizopus, Absidia, Rhizomucor, Syncephalastrum |
| Osteomielitis de la base del cráneo | Aspergillus |
| Infartos cerebrales | Mucormicetos, Aspergillus |
| Formas diseminadas | Mucormicetos, Candida, Cryptococcus, Aspergillus, Coccidioides |
Fuente: adaptado de Góralska et al.16.
Los hongos que más frecuentemente están implicados en estas infecciones son Candida, Cryptococcus (excepto Cryptococcus gattii), Aspergillus, Fusarium,Rhizopus, Rhizomucor, Mucor y Trichosporon. De manera más infrecuente, también se han descrito infecciones por Cladophialophora bantiana (frecuente en India), Exophiala dermatitidis (frecuente en Asia), Rhinocladiella mackenziei (principalmente en Oriente Medio), y Verruconis gallopava (syn. Ochroconis gallopava). Los hongos dimorfos Blastomyces, Histoplasma, Coccidioides y Paracoccidioides tienen también importancia en determinadas zonas geográficas29. De manera global, la infección fúngica más frecuente del SNC es la meningoencefalitis criptocócica.
La mayoría de las infecciones fúngicas del SNC tienen como base patogenética la diseminación hematógena desde un punto distante. Ese foco distante es, en la mayor parte de las ocasiones, el pulmón o los senos paranasales11. El tratamiento de estas infecciones continúa siendo un reto a pesar de la mayor disponibilidad de nuevos fármacos antifúngicos en los últimos años. Es imprescindible caracterizar mejor los parámetros farmacocinéticos y fármacodinámicos de los fármacos antifúngicos cuando abordamos una infección del SNC3.
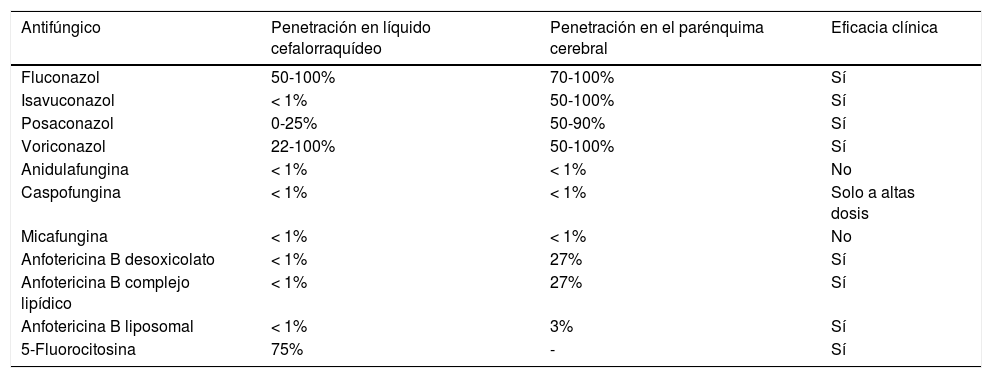
Importancia de la neurofarmacocinética en el sistema nervioso centralEl SNC es un santuario separado del torrente sanguíneo por la barrera hematoencefálica, y no todos los fármacos antifúngicos son capaces de penetrar por igual en su interior21. Realmente hay dos barreras: la que separa el líquido cefalorraquídeo (LCR) del torrente vascular y la que separa el parénquima cerebral del LCR. De hecho, la concentración de un fármaco antifúngico en el LCR no predice en numerosas ocasiones de manera adecuada la penetración de ese fármaco en el parénquima cerebral ni la eficacia clínica3 (tabla 3). Las características farmacológicas que se asocian con una mejor penetración en el SNC son las siguientes3 (tabla 4):
- •
Lipofilia: cuanto más lipófilo es un fármaco, mejor será su penetración a través de la membrana lipídica que rodea el SNC18.
- •
Unión a proteínas: únicamente la fracción libre de un fármaco es capaz de atravesar la barrera hematoencefálica. Debemos tener en cuenta que los fármacos más lipófilos se unen más a proteínas y, por tanto, la suma de estas dos características hace complicado predecir la penetración de un fármaco en el SNC.
- •
Tamaño molecular: las moléculas con un peso molecular por debajo de 450 Da difunden mejor a través de la barrera hematoencefálica.
- •
Volumen de distribución: este factor influye claramente en la penetración en el SNC y los fármacos con volúmenes de distribución en torno a 1 L/kg son los que mejor penetran32.
- •
Afinidad por las bombas de eflujo: los fármacos que tienen una elevada afinidad por las bombas de eflujo, como por ejemplo la glicoproteína P, la bomba de flujo más relevante a este nivel, son eliminados más fácilmente del SNC39.
Características neurofarmacocinéticas de los principales antifúngicos
| Antifúngico | Penetración en líquido cefalorraquídeo | Penetración en el parénquima cerebral | Eficacia clínica |
|---|---|---|---|
| Fluconazol | 50-100% | 70-100% | Sí |
| Isavuconazol | < 1% | 50-100% | Sí |
| Posaconazol | 0-25% | 50-90% | Sí |
| Voriconazol | 22-100% | 50-100% | Sí |
| Anidulafungina | < 1% | < 1% | No |
| Caspofungina | < 1% | < 1% | Solo a altas dosis |
| Micafungina | < 1% | < 1% | No |
| Anfotericina B desoxicolato | < 1% | 27% | Sí |
| Anfotericina B complejo lipídico | < 1% | 27% | Sí |
| Anfotericina B liposomal | < 1% | 3% | Sí |
| 5-Fluorocitosina | 75% | - | Sí |
Fuente: adaptado de Ashley et al.3.
Características asociadas a una mejor penetración en sistema nervioso central
| Característica | Antifúngicos |
|---|---|
| Lipofilicidad | Anfotericina B desoxicolato, anfotericina B complejo lipídico, anfotericina B liposomal, anidulafungina |
| Escasa unión a proteínas | Fluconazol, voriconazol, flucitosina |
| Bajo peso molecular | Isavuconazol, fluconazol, voriconazol, flucitosina |
| No sustrato de glicoproteína P | Anfotericina B desoxicolato, anfotericina B complejo lipídico, anfotericina B liposomal, isavuconazol, 5-fluorocitosina, caspofungina, micafungina, anidulafungina |
| Volumen de distribución en torno a 1 L/kg | Anfotericina B desoxicolato, anfotericina B complejo lipídico, anfotericina B liposomal, 5-fluorocitosina, anidulafungina, fluconazol |
Fuente: adaptado de Ashley et al.3.
La respuesta inflamatoria frente a los hongos se debe, entre otros, al gran tamaño de estos microorganismos y habitualmente tiene consecuencias sobre la microcirculación meníngea, lo que ocasiona una enfermedad focal que conduce a una cerebritis con formación de abscesos y a la invasión de los grandes vasos cerebrales. Ello da lugar a una vasculitis con fenómenos de oclusión vascular, infartos cerebrales y/o desarrollo de aneurismas micóticos. Además, esta respuesta inflamatoria condiciona la producción de enormes cantidades de exudados que contienen células inflamatorias, fibrina y plaquetas, y que dan lugar a fenómenos de aracnoiditis30. Hay muchos otros factores que alteran los parámetros neurofarmacocinéticos, como las comorbilidades del paciente, el estado de inmunodeficiencia, la hipoproteinemia y/o las modificaciones en la permeabilidad de la barrera hematoencefálica debido al uso de fármacos concomitantes. Además, la permeabilidad del SNC varía con la edad, siendo esta mayor en pacientes ancianos. Un factor importante que afecta a los parámetros neurofarmacocinéticos es la inflamación meníngea. Esta inflamación aumenta el paso de fármacos desde el torrente sanguíneo al LCR y, además, las bombas de eflujo, incluida la glicoproteína P, tienen una actividad reducida durante la inflamación53.
Tratamiento antifúngico de las infecciones del sistema nervioso centralLa elección del tratamiento antifúngico más adecuado depende de las características del antifúngico como, por ejemplo, su espectro de acción16 (tabla 5), su actividad fungistática o fungicida o sus propiedades farmacocinéticas. Además del tratamiento farmacológico, el abordaje quirúrgico de las lesiones, si es factible, mejora claramente el pronóstico.
Tratamiento recomendado de las infecciones fúngicas invasivas más frecuentes del sistema nervioso central (se excluyen las micosis endémicas)
| Infección | Tratamiento |
|---|---|
| Meningoecefalitis criptocócica | Anfotericina B liposomal (3-4 mg/kg/día) + 5-fluorocitosina (100 mg/kg/día) las primeras 4 semanas; continuar con fluconazol (400-800 mg/día) durante al menos 8 semanas |
| Criptococomas cerebrales | Anfotericina B liposomal (3-4 mg/kg/día) + 5-fluorocitosina (100 mg/kg/día) las primeras 6 semanas; continuar con fluconazol (400-800 mg/día) durante 6-8 meses |
| Candidiasis del sistema nervioso central | Anfotericina B liposomal (5 mg/kg/día) durante 4-6 semanas; continuar con fluconazol (400-800 mg/día) hasta curación clínica y analítica |
| Aspergilosis | Voriconazol (según concentración sérica). Anfotericina B liposomal si aparece intolerancia o no hay respuesta. El tratamiento debe prolongarse hasta la resolución clínica, radiológica y analítica |
| Mucormicosis | Anfotericina B liposomal (10 mg/kg/día) durante 6-8 semanas |
| Infecciones por Fusarium o Scedosporium apiospermum | Voriconazol hasta resolución de la infección |
| Feohifomicosis | Voriconazol o posaconazol en combinación con 5-fluorocitosina o una equinocandina |
Fuente: adaptado de las guías IDSA, ESCMID y ECMM
Parece claro que los parámetros farmacocinéticos/farmacodinámicos deberían desempeñar un papel esencial a la hora de definir la eficacia de los fármacos en el tratamiento de estas infecciones. Sin embargo, las guías terapéuticas se basan fundamentalmente en la experiencia clínica para definir las recomendaciones. La AmB y sus formulaciones lipídicas han sido y siguen siendo la piedra angular del tratamiento de la mayoría de las infecciones fúngicas del SNC35. Hay bastantes evidencias que sugieren que las tres formulaciones lipídicas no son terapéuticamente equivalentes. La AmB-L es menos tóxica que las otras y, además, se puede administrar a dosis más altas que la AmB-D50. La AmB-L alcanza concentraciones plasmáticas mucho más elevadas que las otras formulaciones. Además, el volumen de distribución de la AmB-L es muy inferior al de las otras, mientras que el área bajo la curva es mucho mayor. Del mismo modo, hay también muchos datos que sugieren que la AmB-L es la formulación lipídica preferida en el tratamiento de las infecciones del SNC: las concentraciones alcanzadas en este fueron significativamente más elevadas que las del resto de las formulaciones de AmB en un modelo experimental17. Con la AmB-L se consiguieron concentraciones próximas a 2 mg/g frente a cifras mucho más reducidas, hasta diez veces inferiores, en el caso de la anfotericina B complejo lipídico y en el de la AmB-D. Las concentraciones en el LCR de todas las formulaciones en los casos controles fueron inferiores a 0,1 mg/l. Además, la AmB-L alcanza concentraciones más elevadas en el parénquima cerebral que en el LCR cuando se administra de manera parenteral47.
A pesar de los datos, no se ha podido demostrar una correlación entre las concentraciones de AmB-L en el LCR y su eficacia en el tratamiento de estas infecciones21. En este contexto, la AmB se ha combinado en muchas ocasiones con la 5 fluorocitosina. Este fármaco tiene una excelente penetración en el SNC, pero no debería utilizarse como monoterapia debido al rápido desarrollo de resistencias27. También hay cierta experiencia clínica con el fluconazol, el voriconazol o el isavuconazol, que son opciones razonables de tratamiento en este tipo de infecciones45. Por el contrario, las equinocandinas no penetran adecuadamente en el SNC y no se emplean de rutina para tratar este tipo de infecciones.
Los fármacos con los que hay más experiencia en la administración por vía intratecal son la AmB-D y la AmB-L2,8. También se ha recurrido en ocasiones a la aplicación intraventricular de AmB-L mediante reservorios de Ommaya. Esta forma de administración no está exenta de efectos adversos, se han descrito cuadros de cefalea, náuseas y vómitos, y debería acompañarse siempre de un tratamiento sistémico para asegurar una exposición adecuada al fármaco.
Infecciones asociadas a biopelículas fúngicasLas biopelículas representan la forma de desarrollo microbiano más frecuente en la naturaleza y son la base patogenética para la proliferación de infecciones asociadas a dispositivos biomédicos. Los hongos más frecuentemente implicados en este tipo de infecciones son las especies de Candida. Prácticamente todos los hongos son capaces de formar biopelículas, pero destacan los géneros Candida, Aspergillus, Cryptococcus, Trichosporon, Coccidioides y Pneumocystis14. La candidiasis asociada con dispositivos biomédicos es especialmente problemática dada la elevada morbimortalidad que conlleva37,38.
La formación de una biopelícula de Candida es un proceso secuencial que requiere la adherencia a una superficie biótica o abiótica para la posterior proliferación de las levaduras y la formación de hifas. La síntesis de una matriz extracelular es fundamental porque contribuye a la maduración y cohesión de la biopelícula. Las biopelículas de Aspergillus también se pueden formar sobre superficies bióticas o abióticas y son las conidias las estructuras que se adhieren al sustrato. La formación del micelio tiene lugar a lo largo del proceso de maduración de la biopelícula26.
Resistencia de las biopelículas fúngicasLas biopelículas fúngicas son, en general, mucho más resistentes a la acción de los fármacos antifúngicos que sus correspondientes formas planctónicas. Hay múltiples trabajos que demuestran que las biopelículas de Candida son extremadamente resistentes a los agentes antifúngicos. Los mecanismos de resistencia de las biopelículas de Candida no están del todo bien establecidos y probablemente esta resistencia sea un fenómeno multifactorial que incluye la diferenciación a estados de crecimiento estacionario, la inducción de la expresión de elementos de resistencia, como por ejemplo bombas de eflujo, la dificultad en la difusión de los fármacos antifúngicos a través de la matriz extracelular y un microambiente hostil para estos fármacos25,28. La generación de esta resistencia a los fármacos antifúngicos es un proceso dinámico y se ha demostrado cómo esta aumenta a lo largo del desarrollo de la biopelícula7. Esta resistencia varía según el fármaco antifúngico y la especie implicada. Así, las biopelículas de Candida albicans y de Candida parapsilosis son relativamente resistentes al fluconazol, la AmB, la nistatina y el voriconazol. Las biopelículas de Aspergillus fumigatus son relativamente resistentes al itraconazol y las equinocandinas. Las de Cryptococcus, en cambio, no se ven afectadas por el fluconazol o el voriconazol y las biopelículas de Trichosporon asahii muestran una elevada resistencia a la AmB, la caspofungina, el voriconazol y el fluconazol. Por último, las biopelículas de Pneumocystis carinii son resistentes a los azoles y la AmB14.
Tratamiento de las infecciones asociadas a biopelículas fúngicasLas infecciones fúngicas asociadas a dispositivos biomédicos son raras, pero conllevan una morbimortalidad muy elevada. Los hongos más frecuentemente implicados son las especies de Candida, y los catéteres intravasculares y las prótesis articulares los dispositivos implicados más a menudo. Las biopelículas de Candida son resistentes a la acción de los azoles, incluidos los triazoles de nueva generación voriconazol, isavuconazol y ravuconazol19. Únicamente las formulaciones lipídicas de AmB y las equinocandinas parecen tener actividad frente a las biopelículas de Candida15,24. Otros fármacos antifúngicos como la nistatina, la terbinafina o la AmB-D tampoco han mostrado una gran actividad frente a biopelículas fúngicas. La capacidad de formación de una biopelícula in vitro puede ser un factor predictor independiente de mortalidad por candidemia asociada a catéter intravascular51.
La infección fúngica asociada a prótesis articulares representa menos de un 1% de todas las etiologías, pero su pronóstico es infausto. Aunque se han intentado tratamientos basados en el recambio de la prótesis en dos tiempos acompañados de terapias locales con AmB mediante espaciadores, la tasa de éxito oscila en torno a un 40% según los estudios48.
El tratamiento de estas infecciones únicamente con fármacos antifúngicos es, en general, insuficiente para conseguir la curación del paciente y habitualmente hay que retirar el dispositivo para conseguirla. La retirada de estos dispositivos tiene implicaciones complejas en el caso de, por ejemplo, catéteres de larga permanencia, válvulas cardiacas, prótesis articulares o shunts del SNC. En el caso concreto de los catéteres intravasculares, se ha ensayado en ocasiones, con éxito, el tratamiento local mediante el sellado de los catéteres con AmB-L o una equinocandina44,52,54.
El mecanismo que subyace en la extraordinaria actividad de las formulaciones lipídicas de AmB frente a las biopelículas de Candida no se conoce completamente. De hecho, es sorprendente que estas moléculas tan grandes sean capaces de penetrar a través de la matriz extracelular. Su elevado contenido en fosfolípidos puede facilitar su paso a través de esta matriz. Este último hecho no explica del todo su buena actividad puesto que formulaciones lipídicas de otros fármacos antifúngicos no han mostrado una buena actividad frente a las biopelículas. El mecanismo de acción de las equinocandinas frente a las biopelículas de Candida también es desconocido. La caspofungina, con un efecto inhibitorio en la formación de biopelículas, parece afectar a la morfología y al metabolismo de las levaduras en la biopelícula.
Otras opciones terapéuticasLa combinación de agentes antifúngicos puede mejorar el pronóstico de las infecciones fúngicas asociadas a dispositivos biomédicos, además de prevenir la aparición de resistencias relacionadas con los tratamientos en monoterapia. Algunos estudios in vitro han analizado la actividad de varias combinaciones de fármacos antifúngicos frente a las biopelículas de Candida. Los mejores resultados se obtuvieron con la combinación AmB/posaconazol (sinérgica) en comparación con otras combinaciones que tuvieron acciones indiferentes (AmB/caspofungina, AmB/fluconazol, fluconazol/caspofungina), o incluso antagónicas (voriconazol/micafungina)49. Algunos trabajos indican que la combinación de AmB con antibióticos (rifampicina o claritromicina) son eficaces frente a biopelículas de C. albicans, C. parapsilosis, Candida glabrata, Candida krusei y Candida tropicalis12. Otros antibióticos como la doxiciclina y la tigeciclina, además de agentes como la heparina y los parabenos, han mostrado una actividad sustancial contra las biopelículas de C. albicans en modelos in vitro. Raad et al. estudiaron en un modelo in vitro de formación de biopelículas de C. albicans la eficacia del sellado antibiótico. De las soluciones ensayadas, la minociclina en baja concentración más ácido etilenodiaminatetraacético (EDTA) redujo significativamente la carga fúngica en el catéter, mientras que la minociclina en alta concentración asociada a EDTA o solo la minociclina en alta concentración erradicaron por completo la carga fúngica de las biopelículas36.
FinanciaciónLa publicación de este artículo ha sido financiada por Gilead. Gilead no ha intervenido o influenciado en el contenido del mismo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.









![Países con casos y brotes hospitalarios por Candida auris hasta diciembre del 2020 (imagen adaptada del Centers for Disease Control and Prevention [CDC] Tracking Candida auris/Fungal Diseases, 2020). Se han notificado brotes hospitalarios en Colombia, India, Israel, Japón, Kenia, Kuwait, Pakistán, Sudáfrica, Corea del Sur, España, Reino Unido, EE. UU. y Venezuela. Países con casos y brotes hospitalarios por Candida auris hasta diciembre del 2020 (imagen adaptada del Centers for Disease Control and Prevention [CDC] Tracking Candida auris/Fungal Diseases, 2020). Se han notificado brotes hospitalarios en Colombia, India, Israel, Japón, Kenia, Kuwait, Pakistán, Sudáfrica, Corea del Sur, España, Reino Unido, EE. UU. y Venezuela.](https://static.elsevier.es/multimedia/11301406/0000003800000002/v10_202201311951/S1130140621000280/v10_202201311951/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)

