Desde hace 30 años la anfotericina B liposomal (AmB-L) es un agente fundamental para el tratamiento de las infecciones fúngicas invasoras (IFI) causadas por una gran variedad de hongos filamentosos y levaduriformes. Los numerosos estudios realizados en este periodo han generado una considerable evidencia sobre su eficacia y seguridad, y la han convertido en el fármaco antifúngico de referencia en el manejo de la IFI en pacientes oncohematológicos en diversas situaciones no mutuamente excluyentes. En primer lugar, AmB-L es el fármaco antifúngico de uso empírico más usado en pacientes con leucemia aguda y síndromes mielodisplásicos de alto riesgo en tratamiento con quimioterapia intensiva, y en los receptores de trasplante de progenitores hematopoyéticos. Además, en parte debido a la administración de nuevas terapias dirigidas (con pequeñas moléculas inhibidoras o anticuerpos monoclonales), cada vez son más frecuentes las infecciones oportunistas por hongos filamentosos en pacientes con enfermedades hematológicas considerados generalmente de bajo riesgo de IFI. Estos fármacos suelen tener un elevado potencial de interacciones farmacológicas que incluye a los triazoles, usados habitualmente en la prevención de IFI. Por último, los pacientes que desarrollan IFI de brecha debidas a concentraciones subterapéuticas de fármaco antifúngico o por la selección de hongos resistentes, requieren un tratamiento antifúngico de amplio espectro, generalmente con un agente de otra familia de fármacos antifúngicos. En ambas circunstancias el uso de AmB-L sigue siendo la mejor opción de terapia antifúngica precoz.
Liposomal amphotericin B (L-AmB) has been a key cornerstone for the management of invasive fungal infections (IFI) caused by a wide array of molds and yeasts during the last three decades. Multiple studies performed over this period have generated a large body of evidence on its efficacy and safety, becoming the main antifungal agent in the management of IFI in patients with hematologic malignancies in several not mutually exclusive clinical settings. First, L-AmB is the most commonly used antifungal agent in patients undergoing intensive chemotherapy for acute leukemia and high-risk myelodysplastic syndrome, as well as in hematopoietic stem cell transplant recipients. Additionally, due to the administration of newer targeted therapies (such as monoclonal antibodies or small molecule inhibitors), opportunistic mold infections are increasingly being reported in patients with hematologic malignancies usually considered low-risk for IFI. These agents usually have a high drug-drug interaction potential, being triazoles, commonly used for antifungal prophylaxis, included. Finally, patients developing breakthrough IFI because of either subtherapeutic concentrations of antifungal prophylactic drugs in blood or selection of resistant strains, require broad spectrum antifungal therapy, usually with an antifungal of a different class. In both situations, L-AmB remains as the best option for early antifungal therapy.
En las últimas tres décadas la anfotericina B liposomal (AmB-L) ha sido un componente esencial del tratamiento de soporte de los pacientes oncohematológicos, especialmente el de los pacientes con leucemia mieloblástica aguda y síndromes mielodisplásicos de alto riesgo en tratamiento con quimioterapia intensiva, y en los receptores de trasplante de progenitores hematopoyéticos (TPH). En este artículo se revisan los resultados de los ensayos clínicos en los que se basa el uso de AmB-L en pacientes oncohematológicos de alto riesgo de infección fúngica invasora (IFI) y se abordan dos situaciones especiales de importancia creciente, como son las IFI en pacientes oncohematológicos que reciben tratamientos con nuevos agentes biológicos y el problema del tratamiento de las IFI de brecha.
Eficacia de la anfotericina B liposomal en infecciones fúngicas invasoras documentadasLos primeros datos de eficacia en pacientes con IFI documentadas o sospechadas sin respuesta o intolerantes a la anfotericina B desoxicolato (AmB-D) proceden de tres grandes estudios llevados a cabo en pacientes con neoplasias y receptores de trasplantes32,33,39. Con dosis de AmB-L de 0,5 a 5mg/kg/día la respuesta global fue aproximadamente del 60%. La respuesta en pacientes evaluables con infecciones por Candida fue del 84%49 y en pacientes con Aspergillus del 58% al 77%32,33,39. En las últimas décadas la dosis de AmB-L≥5mg/kg/día se ha considerado estándar para el tratamiento de las mucormicosis, aunque no hay estudios sistemáticos4,23,40,41. Un ensayo de la European Organization for Research and the Treatment of Cancer comparó la eficacia de dos dosis de AmB-L para el tratamiento de la aspergilosis invasora (AI) probada o probable en pacientes neutropénicos. De un total de 120 pacientes aleatorizados para recibir 1mg/kg/día oo 4mg/kg/día de AmB-L, fueron evaluables 87. La mediana de duración del tratamiento fue 18 y 19 días, respectivamente. Hubo toxicidad renal en 1 de 41 pacientes (2%) que recibieron 1mg/kg/día y en 5 de 46 pacientes (11%) tratados con 4mg/kg/día; solo se suspendió permanentemente un tratamiento de la cohorte de 4mg/kg/día. Globalmente, la terapia con AmB-L fue efectiva en el 50-60% de los pacientes 12. Finalmente, los pacientes con IFI probada o probable por hongos filamentosos fueron aleatorizados para recibir una dosis de 3mg/kg/día o una dosis de 10mg/kg/día durante 14 días, seguida de 3mg/kg/día. De 201 pacientes con IFI confirmadas por hongos filamentosos, 107 recibieron 3mg/kg/día y 94 recibieron 10 mg/kg/día. El 97% de los casos fueron AI, el 93% tenían neoplasias hematológicas y el 73% eran neutropénicos. Se consiguió una respuesta favorable al tratamiento antifúngico en el 50% y el 46% de los pacientes en los grupos de 3 y 10mg/kg, respectivamente (p>0,05); la supervivencia a las 12 semanas fue del 72% y 59%, respectivamente (p>0,05). En el grupo de 10mg/kg/día las tasas de nefrotoxicidad y de hipopotasemia fueron significativamente mayores6. Por tanto, la dosis de 3mg/kg/día de AmB-L tuvo similar eficacia que la del voriconazol en el tratamiento de la AI, pero la escalada de dosis a 10mg/kg/día durante14 días no fue más efectiva, y sí más tóxica. Por último, un metaanálisis reciente concluye que en pacientes con AI la eficacia de AmB-L es comparable a la del voriconazol y a la del isavuconazol17.
Terapia antifúngica empírica en pacientes con neutropenia persistenteLa AmB-L se ha usado ampliamente como terapia antifúngica empírica en pacientes neutropénicos con fiebre persistente. El análisis combinado de dos estudios multicéntricos prospectivos abiertos de AmB-L (1 o 3mg/kg/día) y AmB-D (1mg/kg/día) aportó evidencia de una eficacia al menos equivalente, pero con significativamente menos efectos adversos con AmB-L (tabla 1)36. Un tercer gran estudio multicéntrico aleatorizado doble ciego de AmB-L (3mg/kg/día), en comparación con AmB-D (0,6mg/kg/día), mostró tasas similares de éxito terapéutico, pero menos IFI de brecha probadas con AmB-L (11 pacientes [3,2%]) frente a 27 pacientes con AmB-D ([7,8%]; p=0,009). Las reacciones relacionadas con la perfusión y la nefrotoxicidad también fueron significativamente menores con AmB-L47. En otro estudio multicéntrico aleatorizado doble ciego se constató igualmente una similar eficacia, pero mejor tolerancia con AmB-L (3 oo 5mg/kg/día) en comparación con anfotericina B complejo lipídico (5mg/kg/día)50. Posteriormente, ensayos clínicos a gran escala con nuevos fármacos antifúngicos, como voriconazol y caspofungina, confirmaron la eficacia y utilidad clínica de AmB-L en este contexto48,49.
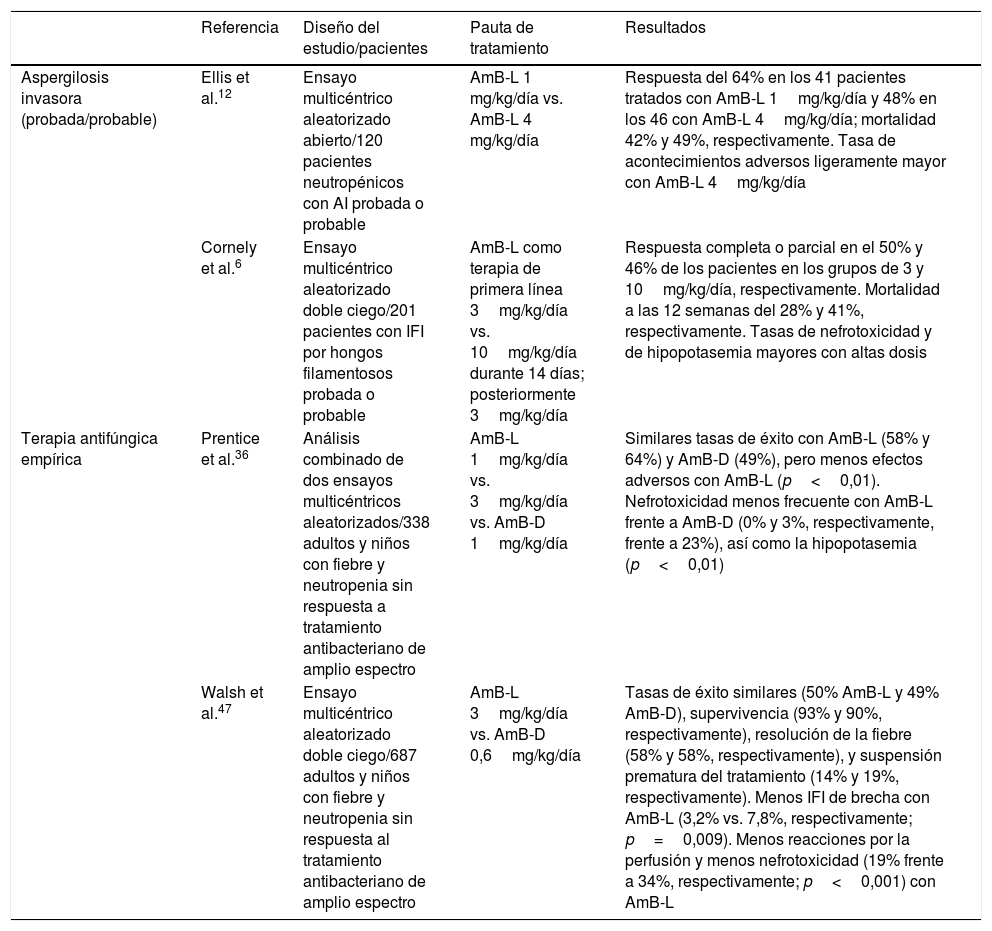
Principales ensayos clínicos con anfotericina B liposomal en el tratamiento de infecciones fúngicas invasoras en pacientes oncohematológicos
| Referencia | Diseño del estudio/pacientes | Pauta de tratamiento | Resultados | |
|---|---|---|---|---|
| Aspergilosis invasora (probada/probable) | Ellis et al.12 | Ensayo multicéntrico aleatorizado abierto/120 pacientes neutropénicos con AI probada o probable | AmB-L 1 mg/kg/día vs. AmB-L 4 mg/kg/día | Respuesta del 64% en los 41 pacientes tratados con AmB-L 1mg/kg/día y 48% en los 46 con AmB-L 4mg/kg/día; mortalidad 42% y 49%, respectivamente. Tasa de acontecimientos adversos ligeramente mayor con AmB-L 4mg/kg/día |
| Cornely et al.6 | Ensayo multicéntrico aleatorizado doble ciego/201 pacientes con IFI por hongos filamentosos probada o probable | AmB-L como terapia de primera línea 3mg/kg/día vs. 10mg/kg/día durante 14 días; posteriormente 3mg/kg/día | Respuesta completa o parcial en el 50% y 46% de los pacientes en los grupos de 3 y 10mg/kg/día, respectivamente. Mortalidad a las 12 semanas del 28% y 41%, respectivamente. Tasas de nefrotoxicidad y de hipopotasemia mayores con altas dosis | |
| Terapia antifúngica empírica | Prentice et al.36 | Análisis combinado de dos ensayos multicéntricos aleatorizados/338 adultos y niños con fiebre y neutropenia sin respuesta a tratamiento antibacteriano de amplio espectro | AmB-L 1mg/kg/día vs. 3mg/kg/día vs. AmB-D 1mg/kg/día | Similares tasas de éxito con AmB-L (58% y 64%) y AmB-D (49%), pero menos efectos adversos con AmB-L (p<0,01). Nefrotoxicidad menos frecuente con AmB-L frente a AmB-D (0% y 3%, respectivamente, frente a 23%), así como la hipopotasemia (p<0,01) |
| Walsh et al.47 | Ensayo multicéntrico aleatorizado doble ciego/687 adultos y niños con fiebre y neutropenia sin respuesta al tratamiento antibacteriano de amplio espectro | AmB-L 3mg/kg/día vs. AmB-D 0,6mg/kg/día | Tasas de éxito similares (50% AmB-L y 49% AmB-D), supervivencia (93% y 90%, respectivamente), resolución de la fiebre (58% y 58%, respectivamente), y suspensión prematura del tratamiento (14% y 19%, respectivamente). Menos IFI de brecha con AmB-L (3,2% vs. 7,8%, respectivamente; p=0,009). Menos reacciones por la perfusión y menos nefrotoxicidad (19% frente a 34%, respectivamente; p<0,001) con AmB-L |
AI: aspergilosis invasora; AmB-D: anfotericina B desoxicolato; AmB-L: anfotericina B liposomal; EORTC/MSG: European Organization for Research and the Treatment of Cancer/Mycoses Study Group; IFI: infección fúngica invasora.
La inmunoterapia está ganando cada vez más relevancia en el tratamiento de las neoplasias hematológicas, comparada con la quimioterapia, ya que permite modular el sistema inmune de los pacientes para tratar, prevenir o eliminar la enfermedad. En general, las estrategias utilizadas varían desde la administración de productos biológicos, como anticuerpos monoclonales o citocinas, hasta nuevas moléculas dirigidas a dianas moleculares específicas. No obstante, algunas de las terapias inmunomoduladoras, como las que inhiben o alteran determinados mecanismos inmunológicos, constituyen un riesgo para el paciente, ya que favorecen el desarrollo de complicaciones infecciosas graves, incluyendo IFI26-28,38. Tanto la enfermedad de base como los tratamientos concomitantes o los recibidos previamente impactan en el riesgo de infección. Las nuevas terapias incluyen células T con receptor de antígeno quimérico (CAR-T), moléculas específicas de anticuerpos anti-CD20 o CD2231, inhibidores del receptor de la célula B, entre los que destacan los inhibidores de la tirosincinasa de Bruton y el inhibidor de la fosfatidilinositol 3-cinasa delta (PI3Kδ) idelalisib, inhibidores de FLT3, como midostaurina, sorafenib y gilteritinib, y el inhibidor de BCL-2, venetoclax26.
Los anticuerpos monoclonales anti-CD20 (rituximab, ofatumumab y obinutuzumab)31 se asocian con un mayor riesgo de infección bacteriana, vírica y de reactivación de infecciones latentes, así como de IFI14,22,31. En un metaanálisis se constató la mayor incidencia de infecciones bacterianas con rituximab, aunque la incidencia no es superior a la asociada con los glucocorticoides22,31. El alemtuzumab (anti-CD52) se asocia con inmunosupresión grave y mantenida. Los inhibidores de la tirosincinasa de Bruton (ibrutinib y acalabrutinib) se asocian con infecciones bacterianas, especialmente respiratorias, IFI y otras infecciones oportunistas29,46. Las infecciones más frecuentes son las bacterianas, y en especial las infecciones respiratorias, pero también se ha descrito incremento de IFI con especial localización en el sistema nervioso central que ocurren principalmente en los primeros seis meses tras el inicio del tratamiento16. El inhibidor de la fosfatidilinositol 3-cinasa delta idelalisib se asocia con un aumento de la incidencia de neumonía por Pneumocystis jirovecii y reactivación de la infección por citomegalovirus. El inhibidor de BCL-2 venetoclax se asocia con infecciones respiratorias y neutropenia. Los inhibidores del punto de control inmune (nivolumab y pembrolizumab) parecen no incrementar, por sí mismos, el riesgo de infección. Sin embargo, el uso de glucocorticoides e inmunosupresores para controlar los efectos adversos inmunorrelacionados sí conlleva un aumento de infecciones, incluyendo IFI18,30. Otros fármacos como brentuximab, lenalidomida o los inhibidores de la desacetilasa de histonas no parecen asociarse con un mayor riesgo de infección26. Aunque existe poca experiencia en la valoración de las infecciones relacionadas con el uso de la terapia celular (CAR-T), se ha observado un mayor número de infecciones en pacientes que han recibido más de tres tratamientos antineoplásicos previamente o en los que han requerido tocilizumab o glucocorticoides para el manejo del síndrome de liberación de citocinas11.
No existen estudios descriptivos que aborden específicamente el riesgo y el manejo de la IFI en este grupo de pacientes. La incidencia real de las IFI asociadas con el uso de agentes biológicos no está establecida por diversos motivos14. En primer lugar, los agentes biológicos son relativamente nuevos en la práctica clínica y no existen estudios robustos sobre el riesgo de IFI asociado. Además, los pacientes que reciben terapias biológicas presentan generalmente alteraciones inmunológicas de base que, por sí mismas, pueden influir en el desarrollo de los procesos infecciosos. Otro motivo es la frecuente combinación de los tratamientos biológicos con inmunosupresores convencionales y en diferentes dosis. Por último, la ubicación geográfica del paciente es importante, ya que residir en áreas endémicas o visitarlas para cierto tipo de infecciones influye directamente en la posibilidad de desarrollar o no un proceso infeccioso.
La principal dificultad para establecer un plan de profilaxis antifúngica en pacientes que reciben tratamiento con los nuevos agentes biológicos es que la mayoría son incompatibles con los azoles25, por lo que se debe recurrir a otras familias de fármacos antifúngicos42. Se plantea, pues, un dilema de difícil solución, ya que debido a las interacciones farmacológicas no deben administrarse azoles de amplio espectro, y en el caso de considerar imprescindible administrarlos debería suspenderse la medicación antineoplásica, con el riesgo de recidiva o progresión de la enfermedad subyacente. Hay que tener presente dos puntos clave: que el riesgo de IFI en pacientes oncohematológicos tratados con tratamientos biológicos (ibrutinib, venetoclax, CAR-T) es mayor en los primeros meses de tratamiento con las nuevas moléculas23,37, y que la aparición de IFI en el sistema nervioso central tiene especial relevancia42,52. Por tanto, las opciones de profilaxis se centran en fármacos con bajo o nulo potencial de interacciones9,42. Sin embargo, en el caso de fuerte sospecha de IFI o ante una IFI probada/probable, el tratamiento antifúngico de elección es AmB-L, que permitiría el tratamiento de la IFI y mantener simultáneamente la terapia antineoplásica.
Infecciones fúngicas invasoras de brecha en pacientes oncohematológicosLa IFI afecta cada vez con mayor frecuencia a los pacientes que presentan alguna alteración en su sistema inmunitario y/o estructural pulmonar. La IFI se asocia con una elevada morbilidad, una estancia media prolongada, un incremento en los costes sanitarios y una elevada mortalidad. Por esta razón se recomiendan sistemáticamente las estrategias de prevención y de tratamiento anticipado5,7,44, sobre todo en las poblaciones de pacientes de elevado riesgo de IFI, como son los pacientes con enfermedades oncohematológicas, en especial leucemias agudas que reciben quimioterapia intensiva o los que son sometidos a TPH. La tabla 2 resume las profilaxis antifúngicas más frecuentemente recomendadas en estos pacientes.
Profilaxis antifúngicas más frecuentemente recomendadas en pacientes oncohematológicos
| Tipo de paciente | Contexto | Fármaco antifúngico recomendado | Recomendación/calidad de la evidencia |
|---|---|---|---|
| LMA | Quimioterapia intensiva | Posaconazol | Fuerte/alta |
| TPH alogénico | Neutropenia (periodo preinjerto) | PosaconazolVoriconazolFluconazol | Fuerte/moderada |
| Enfermedad del injerto contra el huésped, corticoterapia | PosaconazolVoriconazol | Fuerte/alta |
LMA: leucemia mieloblástica aguda; TPH: trasplante de progenitores hematopoyéticos.
La generalización del uso de la profilaxis ha hecho emerger un problema importante que es la aparición de IFI en pacientes que reciben fármacos antifúngicos, denominadas IFI de brecha. La aproximación diagnóstica y terapéutica de las IFI de brecha representa un reto de primer orden. Incluso la definición de IFI de brecha puede ser motivo de controversia, por lo que recientemente se generó un consenso europeo para resolver dudas sobre si debe considerarse IFI de brecha una IFI no cubierta con el fármaco antifúngico administrado, o sobre cuánto tiempo debe transcurrir entre la administración del fármaco antifúngico y el diagnóstico para considerarla IFI de brecha5. En resumen, se definió la IFI de brecha como aquella producida por cualquier hongo (incluidos los hongos fuera del espectro de actividad del antifúngico) durante la exposición a un fármaco antifúngico. El periodo que define a la IFI de brecha depende de las propiedades farmacocinéticas y se extiende al menos hasta un intervalo de dosificación después de la interrupción del fármaco.
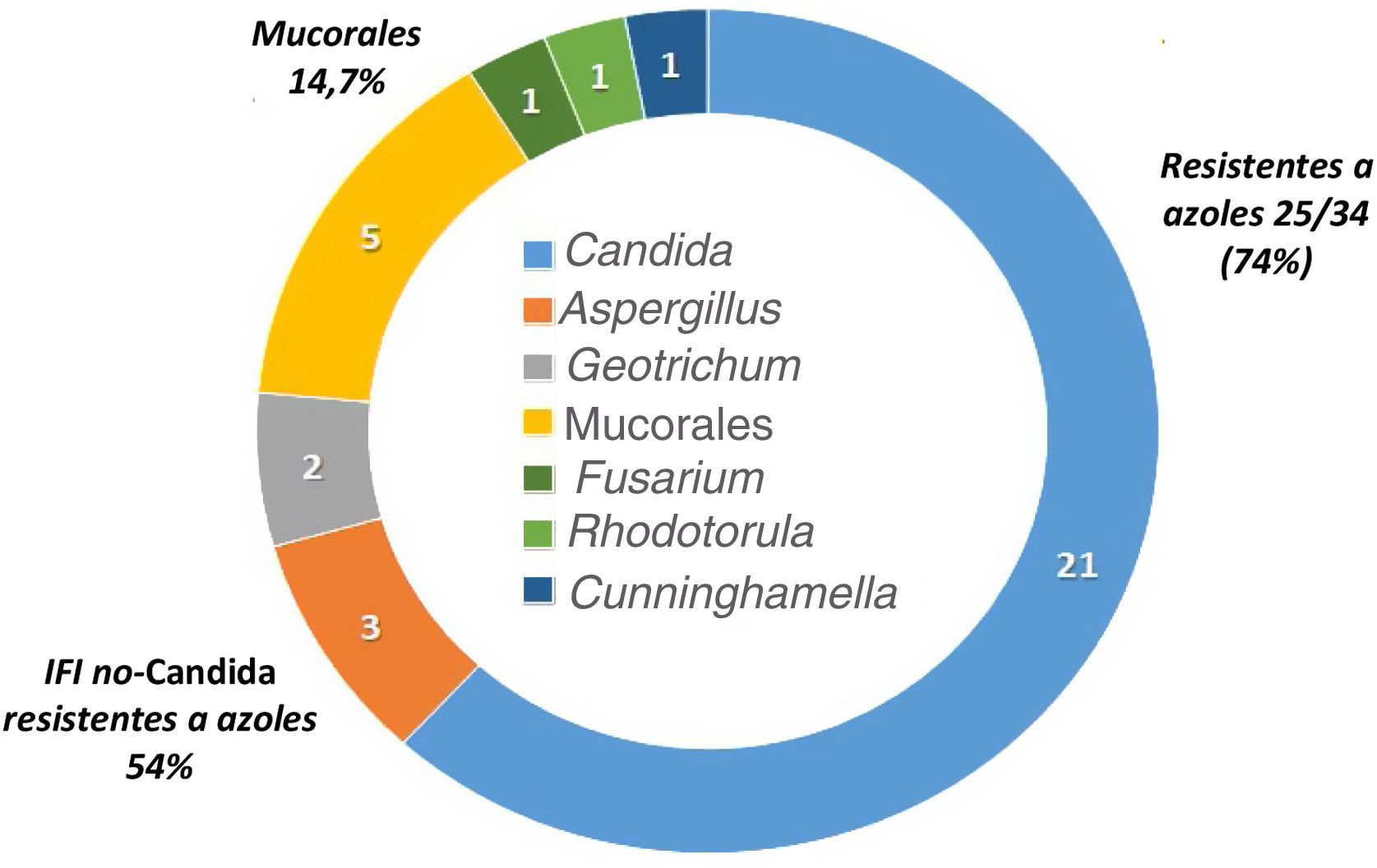
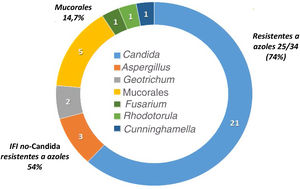
La epidemiología de la IFI de brecha es diferente de la de los pacientes que no reciben profilaxis antifúngica. La tabla 3 resume los estudios más importantes que describen la incidencia y epidemiología de la IFI de brecha en pacientes oncohematológicos2,3,7,8,20,28,34,37,44. Las profilaxis antifúngicas siempre disminuyen la incidencia de IFI, pero dependiendo del fármaco empleado se seleccionan con mayor frecuencia unas especies u otras de hongos. Así, la epidemiología de la IFI de brecha con el posaconazol muestra como hongos más frecuentes las especies de Candida resistentes a los azoles, Aspergillus y los mucorales. Por su parte, los pacientes que han recibido profilaxis con voriconazol y/o isavuconazol tienen IFI de brecha causadas por mucorales y otros hongos con alta frecuencia de resistencia a los azoles15,19,37. En las IFI de brecha a los azoles activos contra los hongos filamentosos, la incidencia de mucormucosis puede alcanzar el 30%21. Por último, los pacientes que reciben equinocandinas en profilaxis tienen con frecuencia IFI de brecha causadas por Aspergillus35. No existen datos epidemiológicos de la IFI de brecha en España publicados en revistas médicas. La figura 1 detalla las especies aisladas en los primeros 34 casos de IFI probada de un estudio multicéntrico que se está realizando actualmente sobre la epidemiología de la IFI de brecha en nuestro país (datos no publicados).
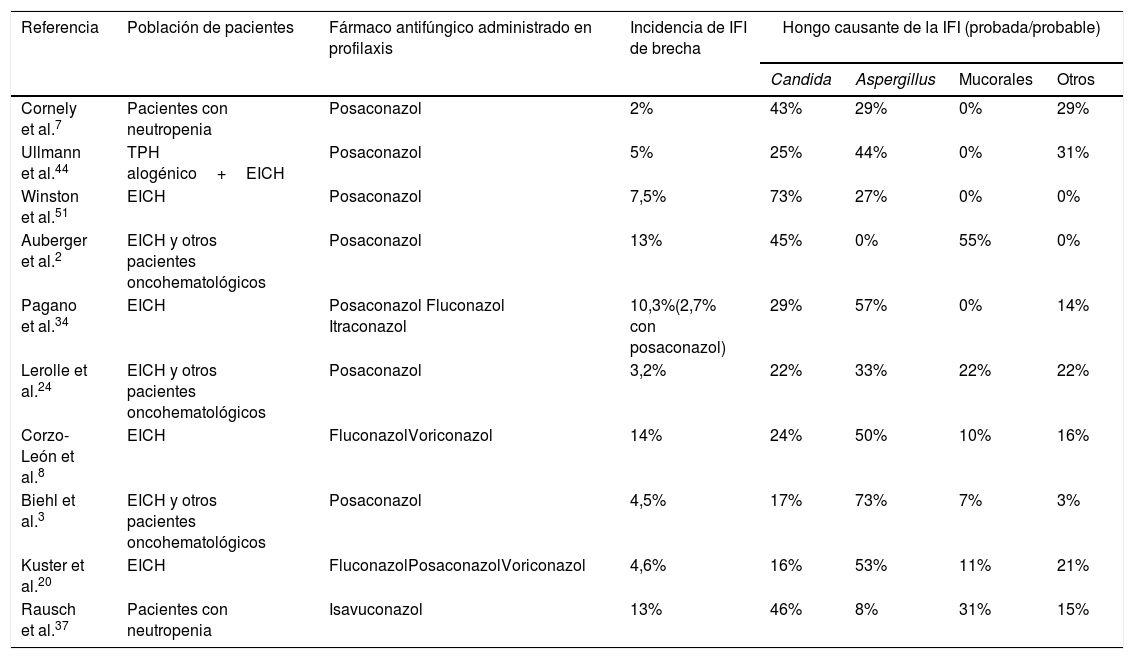
Incidencia y epidemiología de la infección fúngica invasora de brecha en las series más relevantes de pacientes oncohematológicos que reciben profilaxis antifúngica
| Referencia | Población de pacientes | Fármaco antifúngico administrado en profilaxis | Incidencia de IFI de brecha | Hongo causante de la IFI (probada/probable) | |||
|---|---|---|---|---|---|---|---|
| Candida | Aspergillus | Mucorales | Otros | ||||
| Cornely et al.7 | Pacientes con neutropenia | Posaconazol | 2% | 43% | 29% | 0% | 29% |
| Ullmann et al.44 | TPH alogénico+EICH | Posaconazol | 5% | 25% | 44% | 0% | 31% |
| Winston et al.51 | EICH | Posaconazol | 7,5% | 73% | 27% | 0% | 0% |
| Auberger et al.2 | EICH y otros pacientes oncohematológicos | Posaconazol | 13% | 45% | 0% | 55% | 0% |
| Pagano et al.34 | EICH | Posaconazol Fluconazol Itraconazol | 10,3%(2,7% con posaconazol) | 29% | 57% | 0% | 14% |
| Lerolle et al.24 | EICH y otros pacientes oncohematológicos | Posaconazol | 3,2% | 22% | 33% | 22% | 22% |
| Corzo-León et al.8 | EICH | FluconazolVoriconazol | 14% | 24% | 50% | 10% | 16% |
| Biehl et al.3 | EICH y otros pacientes oncohematológicos | Posaconazol | 4,5% | 17% | 73% | 7% | 3% |
| Kuster et al.20 | EICH | FluconazolPosaconazolVoriconazol | 4,6% | 16% | 53% | 11% | 21% |
| Rausch et al.37 | Pacientes con neutropenia | Isavuconazol | 13% | 46% | 8% | 31% | 15% |
EICH: enfermedad del injerto contra el huésped; TPH: trasplante de progenitores hematopoyéticos.
La aproximación diagnóstica cuando se sospecha una IFI de brecha debe ser rápida. Debe averiguarse cuanto antes si el paciente está siendo infectado por un hongo resistente al fármaco antifúngico recibido o si hay algún factor que no permite al fármaco antifúngico realizar su acción. Se recomienda asimismo realizar una tomografía computarizada pulmonar y la determinación de galactomanano y 1,3- β-D-glucano. Es importante tener en cuenta que el valor de ambos biomarcadores en pacientes que ya reciben un tratamiento antifúngico puede estar alterado. Como la sospecha de una IFI de brecha debe hacernos pensar en hongos menos frecuentes, debemos realizar procedimientos diagnósticos agresivos que permitan la identificación del hongo, incluyendo la punción pulmonar si es necesario.
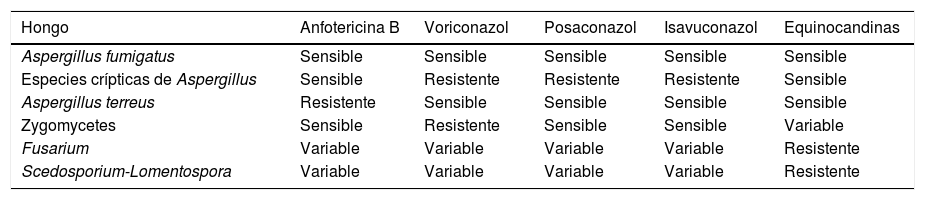
La tabla 4 resume la actividad de los fármacos antifúngicos más frecuentes frente a los hongos que más comúnmente causan IFI. Una peculiaridad destacable es que las especies crípticas de Aspergillus presentan con frecuencia resistencia intrínseca a los azoles1. Otra situación compleja es la aparición de cepas de Aspergillus fumigatussensu lato que, tras presentar alguna mutación, se hacen resistentes a los azoles. Este fenómeno se ha descrito con bastante frecuencia en el centro-norte de Europa, especialmente en los Países Bajos, y se caracteriza por la presencia de la mutación TR34-L98H en el gen cyp51A, lo que confiere una alta resistencia a los azoles. Estas cepas constituyen el 6,6% de los aislamientos en un estudio muy reciente de vigilancia epidemiológica efectuado en nuestro país13. En los próximos meses deberían extremarse las medidas de control epidemiológico para analizar la eventual expansión de estas cepas. Asimismo, en casos de tratamiento de formas crónicas de aspergilosis podrían producirse mutaciones adquiridas en diferentes genes que podrían disminuir la actividad de los azoles45.
Actividad intrínseca de los principales fármacos antifúngicos de uso sistémico contra los hongos causales de infecciones fúngicas invasoras más frecuentes
| Hongo | Anfotericina B | Voriconazol | Posaconazol | Isavuconazol | Equinocandinas |
|---|---|---|---|---|---|
| Aspergillus fumigatus | Sensible | Sensible | Sensible | Sensible | Sensible |
| Especies crípticas de Aspergillus | Sensible | Resistente | Resistente | Resistente | Sensible |
| Aspergillus terreus | Resistente | Sensible | Sensible | Sensible | Sensible |
| Zygomycetes | Sensible | Resistente | Sensible | Sensible | Variable |
| Fusarium | Variable | Variable | Variable | Variable | Resistente |
| Scedosporium-Lomentospora | Variable | Variable | Variable | Variable | Resistente |
El motivo más frecuente para que un azol no pueda ejercer su acción antifúngica es no alcanzar concentraciones terapéuticas del fármaco. En el caso del posaconazol los problemas de absorción son menos frecuentes en su nueva posología en tabletas43. Por su parte, el voriconazol presenta una metabolización hepática con una elevada variabilidad interpersonal10. El uso correcto de voriconazol requiere la medición de su concentración en sangre para asegurar una óptima dosificación. Por tanto, ante la sospecha de una IFI de brecha en un paciente que recibe azoles es obligatorio medir la concentración del fármaco antifúngico en el paciente. El análisis debe hacerse en una muestra recogida justo antes de la administración de una nueva dosis del azol. Concentraciones bajas del fármaco antifúngico sugerirían que la IFI de brecha puede deberse a la inacción del fármaco administrado. Por último, hay que descartar que algún factor del huésped pueda favorecer la IFI de brecha o ayudar a su perpetuación. Hay que descartar siempre que haya afectación de catéteres en una candidemia o lesiones necrosantes pulmonares de gran tamaño que podrían impedir la óptima penetración del antifúngico al tratar una IFI causada por hongos filamentosos.
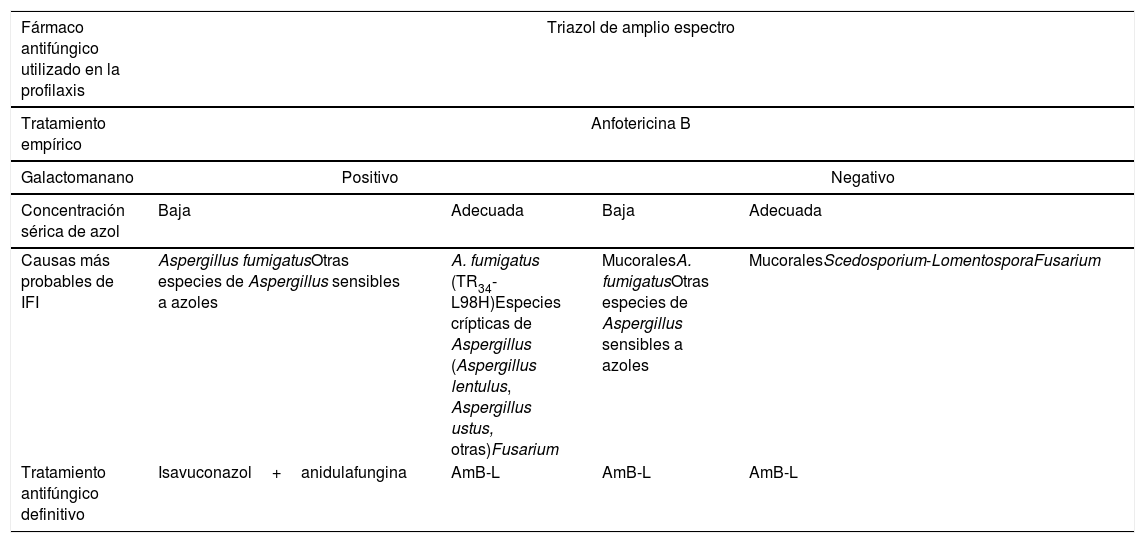
La decisión terapéutica ante la sospecha o confirmación de una IFI de brecha también debe ser rápida, generalmente con un cambio de tratamiento antifúngico. En ausencia de ensayos prospectivos sobre el tratamiento óptimo de una IFI de brecha parece lógico iniciar un tratamiento antifúngico empírico con un antifúngico de clase diferente al utilizado hasta el momento, idealmente con un fármaco de amplio espectro. La tabla 5 resume un planteamiento práctico para el tratamiento de la IFI de brecha en profilaxis con azoles, que es la más frecuente en los pacientes oncohematológicos, en el que la AmB-L tiene un papel muy destacado.
Planteamiento práctico del tratamiento de la infección fúngica invasora de brecha durante la profilaxis con azoles
| Fármaco antifúngico utilizado en la profilaxis | Triazol de amplio espectro | |||
|---|---|---|---|---|
| Tratamiento empírico | Anfotericina B | |||
| Galactomanano | Positivo | Negativo | ||
| Concentración sérica de azol | Baja | Adecuada | Baja | Adecuada |
| Causas más probables de IFI | Aspergillus fumigatusOtras especies de Aspergillus sensibles a azoles | A. fumigatus (TR34-L98H)Especies crípticas de Aspergillus (Aspergillus lentulus, Aspergillus ustus, otras)Fusarium | MucoralesA. fumigatusOtras especies de Aspergillus sensibles a azoles | MucoralesScedosporium-LomentosporaFusarium |
| Tratamiento antifúngico definitivo | Isavuconazol+anidulafungina | AmB-L | AmB-L | AmB-L |
AmB-L: anfotericina B liposomal.
La AmB-L sigue siendo un fármaco esencial para el manejo de las IFI en pacientes oncohematológicos debido a su amplio espectro de acción, a la eficacia clínica bien documentada y a la ausencia de interacciones farmacológicas relevantes. En las últimas tres décadas la AmB-L ha consolidado su posición en el esquema terapéutico, tanto en los pacientes de alto riesgo de IFI como los que reciben quimioterapia intensiva por leucemia aguda y los receptores de TPH alogénico, como en los pacientes oncohematológicos en tratamiento con nuevas terapias biológicas que pueden incrementar también el riesgo de IFI. Asimismo, es un elemento fundamental para el tratamiento precoz de las IFI de brecha en pacientes tratados previamente con triazoles y equinocandinas.
FinanciaciónLa publicación de este artículo ha sido financiada por Gilead. Gilead no ha intervenido o influenciado en el contenido del mismo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.