La micología clínica está en continuo desarrollo. La aparición de nuevas guías clínicas ha permitido mejorar el abordaje de las infecciones fúngicas oportunistas, especialmente en pacientes con inmunosupresión (oncohematológicos y/o receptores de un trasplante). Al mismo tiempo el desarrollo de nuevas herramientas de diagnóstico y de nuevos fármacos antifúngicos con mayor espectro de acción y menos efectos secundarios ha permitido la realización de diagnósticos más rápidos y tratamientos más eficaces. Junto a estos avances se ha producido un cambio en la epidemiología de la infección fúngica invasora (IFI), con la aparición de nuevos grupos de pacientes (p ej. EPOC, pacientes con cirrosis, post-gripe) y de nuevos microorganismos (Candida auris, Lomentospora prolificans, mucorales), y de hongos resistentes (aislamientos de Aspergillus resistentes a azoles) que el clínico deberá de tener en cuenta en el momento de valorar el tratamiento de un paciente con una IFI. En este artículo haremos una breve revisión de los avances en las últimas décadas y de los problemas emergentes.
Clinical mycology is in continuous development. The appearance of new clinical guidelines has made it possible to improve the approach to opportunistic fungal infections, especially in immunosuppressed patients (oncohematological and/or transplant recipients). At the same time, the development of new diagnostic tools and new antifungals with a greater spectrum of action and fewer side effects have led to faster diagnoses and treatments that are more effective. Along with these advances, there has been a change in the epidemiology of invasive fungal infection (IFI), with the appearance of new patients (e.g., COPD, liver cirrhosis, post-influenza) and new microorganisms (Candida auris, Lomentospora prolificans, mucorales), and resistant fungi (isolates of Aspergillus resistant to azoles) which the clinician must take into account when choosing the treatment of a patient with an IFI. In this paper we will briefly review the advances in recent decades and the emerging problems.
La aparición de nuevos tratamientos para las enfermedades oncohematológicas, autoinmunes e inflamatorias, como son las terapias biológicas y la terapia de células T con receptores quiméricos de antígenos (CAR-T), y el aumento del número de trasplantes de progenitores hematopoyéticos y de órgano sólido, han permitido disminuir de forma muy significativa la mortalidad de estos pacientes, al mismo tiempo que han mejorado su calidad de vida. Sin embargo, esto ha incrementado el número de pacientes susceptibles al desarrollo de una infección fúngica invasora (IFI). Afortunadamente, en las últimas décadas, el desarrollo en el diagnóstico, tratamiento y en la profilaxis de la IFI ha sido también muy significativo.
Avances en el diagnóstico y tratamiento de la IFI en las últimas décadasEl diagnóstico de la IFI ha conocido grandes cambios en los últimos años con la aparición de varios test que se han venido a unir a los métodos de diagnóstico micológico tradicionales (tinción y cultivo). Los test de antígenos, como el 1,3-β-D-glucano (BDG) y el galactomanano (GM), polisacáridos de la pared de varias especies de hongos, combinados con la tomografía computarizada, contribuyen de forma espectacular a mejorar y acelerar el diagnóstico de la IFI y el seguimiento de los pacientes con aspergilosis pulmonar invasora (API)43. La detección del antígeno capsular de Cryptococcus en suero y/o líquido cefalorraquídeo (LCR) permite el rápido diagnóstico de la criptococosis invasora43. La aparición de la técnica MALDI-TOF (matrix-assisted laser desorption/ionizationtime-of-flight) ha permitido a los laboratorios de Microbiología contar con una herramienta que identifica de forma rápida y correcta estos microorganismos43. Finalmente, la reacción en cadena de la polimerasa (PCR) posibilita una mejor detección, identificación y clasificación de los hongos y puede ser utilizada en diferentes muestras, desde hemocultivos a muestras respiratorias, LCR y biopsias, acortando así el tiempo de diagnóstico43.
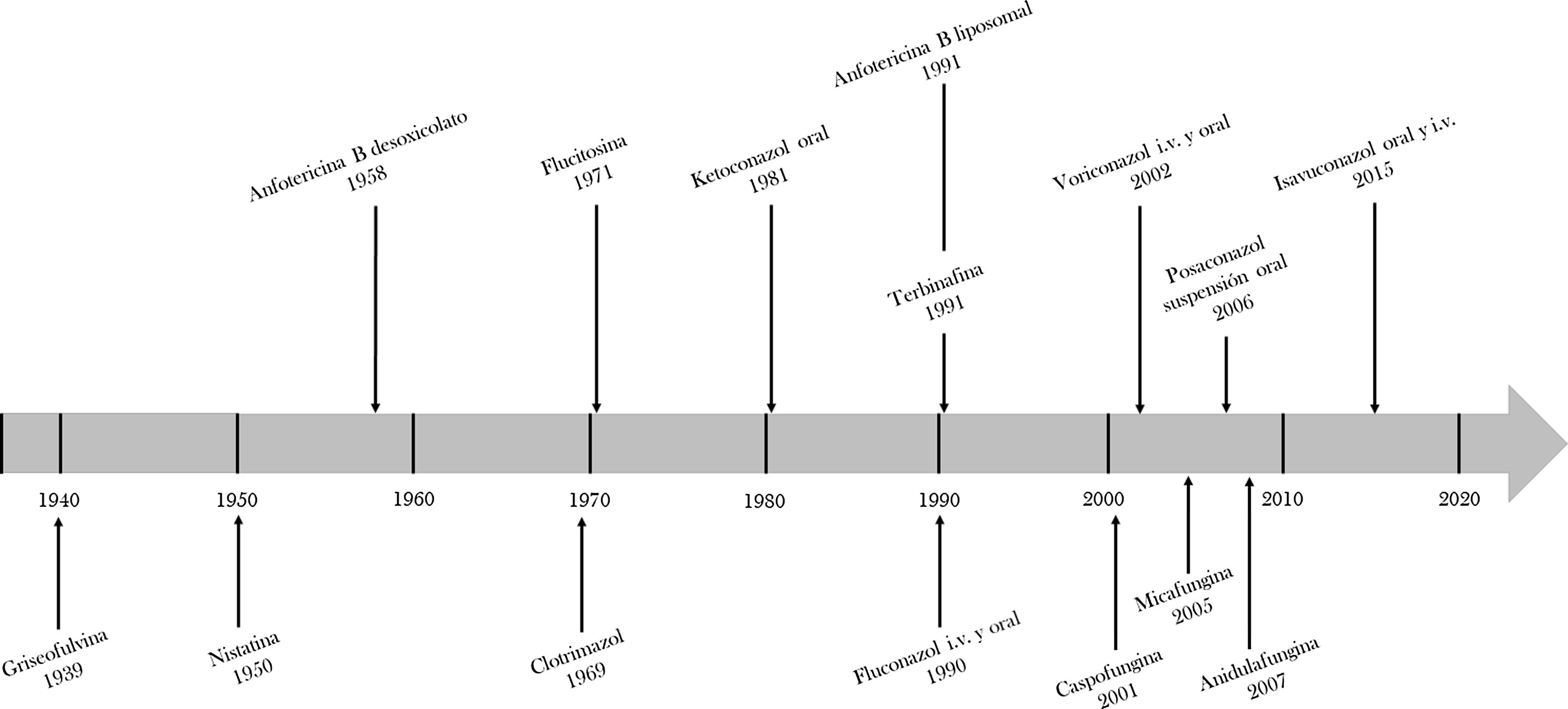
Otro de los mayores avances en las últimas décadas ha sido el desarrollo de nuevos fármacos antifúngicos (fig. 1). En 1958, se aprobó el primer fármaco antifúngico para uso sistémico, la anfotericina B desoxicolato (AmB-D)34. Pese a su gran espectro de acción, sus significativos efectos secundarios (deterioro de la función renal, anomalías electrolíticas y las reacciones en el momento de la perfusión) limitaron su uso. La aparición del fluconazol (1990) y posteriormente de la anfotericina B liposomal (AmB-L) en 1991, que mejoró de forma importante el perfil de seguridad de la AmB-D, manteniendo su amplio espectro de acción25, marcaron un avance importante en el tratamiento de la IFI34. Hoy por hoy, la AmB-L sigue siendo uno de los antifúngicos más utilizados en la práctica clínica, considerándose el tratamiento de elección en muchas IFI, fundamentalmente en pacientes con infecciones graves (tabla 1).
Indicaciones para el tratamiento con anfotericina B liposomal
| Tratamiento empírico en un paciente con neutropenia prolongada y síndrome febril persistente a pesar de tratamiento antibiótico de amplio espectroTratamiento de segunda línea de la candidiasis invasiva (excepto Candida lusitaniae)Tratamiento de primera línea de la meningitis criptocócica, en combinación con flucitosinaTratamiento de primera línea de la mucormicosisTratamiento de las infecciones graves por Sporothrix schenckiiTratamiento de las presentaciones graves de coccidioidomicosis y paracoccidioidomicosisTratamiento de la enfermedad grave por Histoplasma capsulatumTratamiento de las infecciones graves producidas por Blastomyces dermatitidisTratamiento de las micosis en pacientes que reciben tratamiento profiláctico con azoles de amplio espectroTratamiento de rescate de las aspergilosis que no responden al voriconazol o en las que se confirme resistencia a azolesTratamiento en pacientes que no pueden recibir azoles por interacciones farmacológicasTratamiento de la leishmaniasis visceral y cutáneaTratamiento profiláctico secundario de la leishmaniasis en pacientes inmunosuprimidos |
El arsenal frente a Aspergillus ha experimentado un gran avance con la aprobación del voriconazol (2002), que es hoy día el tratamiento de elección de la aspergilosis invasora (AI), y la del posaconazol (2006) que ha demostrado su eficacia en la profilaxis antifúngica en enfermos neutropénicos con leucemia mieloide aguda y síndrome mielodisplásico, así como en pacientes con enfermedad injerto contra huésped en tratamiento inmunosupresor4. La aparición del isavuconazol (2015) ha contribuido a incrementar el arsenal de antifúngicos con actividad frente a Aspergillus y mucorales, disminuyendo el riesgo de efectos secundarios asociados al uso de los azoles, como la hepatotoxicidad, y la aparición de interacciones medicamentosas, por ejemplo con los inmunosupresores anticalcineurínicos15. Por último, las equinocandinas, caspofungina (2001), micafungina (2005) y anidulafungina (2007), presentan un excelente perfil de tolerancia y de seguridad, y son hoy día el tratamiento de elección de la candidemia y la candidiasis invasora, especialmente en el paciente crítico34.
Hay también que destacar el gran esfuerzo realizado por los grupos de investigación españoles que han contribuido en la optimización del diagnóstico y tratamiento de la IFI. Así, por ejemplo, el estudio CANDIPOP, un gran programa de vigilancia de la candidemia en nuestro país, permitió conocer cuáles eran los factores de riesgo y las diferentes variables que condicionaban el pronóstico de la infección18,36. Los autores observaron que el inicio de un tratamiento antifúngico adecuado y la retirada del catéter venoso central en las primeras 48h de la candidemia reducía la mortalidad al séptimo día, mientras que los predictores de muerte entre el octavo y el trigésimo día incluían signos de disfunción orgánica, de sepsis grave o shock séptico, así como el grado de comorbilidad de los pacientes (edad y grado de inmunosupresión) y un origen primario de la candidemia. El estudio CANDI-Bundle puede considerarse la continuación del anterior y permitió evaluar el impacto de ocho medidas en el pronóstico de la candidemia10. El estudio concluyó que la implementación de un paquete de medidas correctamente estructurado y basado en la evidencia científica permite reducir la mortalidad temprana y global en pacientes con candidemia10. Por último, el estudio PCR-AGA, un ensayo abierto, controlado, aleatorizado en el que participaron 13 centros españoles y un total de 219 pacientes oncohematológicos con alto riesgo de desarrollar API, concluyó que una estrategia de monitorización combinada de GM sérico y detección de ADN de Aspergillus en suero mediante PCR permitía un diagnóstico más temprano y una menor incidencia de API que la utilización exclusiva de GM sérico2. Estos avances desarrollados por estudios españoles han sido incorporados a diferentes guías clínicas internacionales y han contribuido a mejorar la profilaxis y el tratamiento de las infecciones micóticas oportunistas1,22,26.
Nuevos pacientes, nuevos factores de riesgoEn los últimos años la importancia de la IFI ha ido en aumento, con un crecimiento progresivo de casos diagnosticados en sujetos que no presentan las características típicas de los pacientes inmunosuprimidos que clásicamente se asocian con esta complicación. Un ejemplo de estos pacientes de riesgo son los diagnosticados de enfermedad pulmonar obstructiva crónica (EPOC). Un estudio español en el que se revisaron todos los pacientes EPOC con aislamiento de Aspergillus en una muestra respiratoria durante un periodo de 12 años mostró que, aunque el 39% estaban sólo colonizados, un 55,3% presentaban una API aguda y el 5,7% una API crónica32. Aspergillus fumigatus fue la especie aislada con más frecuencia (90,3%). Los autores identificaron la oxigenoterapia domiciliaria, la presencia de bronquiectasias, la hospitalización en los tres meses previos y la terapia antifúngica con fluconazol y nistatina frente a Candida en el mes previo, como factores predictores independientes de desarrollar API32. Es de destacar que la mortalidad global alcanzó cifras del 46,7% a los 120 días, aumentando hasta el 56% cuando se prolongó el seguimiento. Además, el 21,2% de los pacientes colonizados desarrollaron una API en los años posteriores, con una mortalidad atribuible del 70%. Por tanto, es muy importante sospechar API e iniciar un tratamiento antifúngico de forma precoz en pacientes con exacerbación de EPOC que no presenten mejoría clínica tras recibir un tratamiento antibiótico y esteroideo adecuado, especialmente si presentan varios aislamientos de Aspergillus en muestras respiratorias y factores de riesgo para API32.
Actualmente está claramente establecida la asociación entre la infección por el virus de la gripe y el riesgo de desarrollar una API, especialmente en pacientes críticos. Un estudio multicéntrico y retrospectivo concluyó que el 14% de los pacientes con neumonía por el virus de la gripe ingresados en UCI desarrollaban API en comparación con el 5% de los pacientes en el grupo control que ingresaban por otras causas. Un modelo de regresión logística confirmó la asociación independiente entre la infección por el virus de la gripe y el riesgo de desarrollar una API. Los autores postularon que el virus de la gripe, al dañar el epitelio respiratorio y causar una disfunción del aclaramiento mucociliar, facilitaría la invasión por Aspergillus. Además, el síndrome de distrés respiratorio agudo, la hipoxia secundaria, la alteración de los niveles de citocinas pulmonares y sistémicas, y de la función de los fagocitos pulmonares produciría un estado de inmunodeficiencia adaptativa del huésped6, que facilitaría el desarrollo de una API41. Otro estudio, que incluyó a pacientes neutropénicos que recibían quimioterapia por diferentes enfermedades hematológicas concluyó que la infección por el virus de la gripe H1N1 podía ser un factor de riesgo para el desarrollo de API, incluso en enfermos que recibían profilaxis con posaconazol46. Por último, un estudio realizado en España en el que participaron tres centros hospitalarios que incluyó pacientes con enfermedades oncohematológicas y receptores de trasplante de órgano sólido, concluyó que estos pacientes presentaban un alto riesgo de desarrollar API a los pocos días de la infección por el virus de la gripe H1N123.
La reciente comunicación de numerosos casos de API en pacientes con infección por SARS-CoV-2ha hecho considerar la aparición de una nueva entidad (API asociada a COVID-19 o CAPA, por las siglas en inglés) y ha suscitado preocupación por el hecho de influir de forma muy negativa en el curso de la enfermedad producida por este coronavirus, causando una elevada mortalidad8,19,42. Un estudio observacional, prospectivo y unicéntrico realizado en España reportó que 8 de los 2723 pacientes con COVID-19 hospitalizados (0,3%) desarrollaron finalmente CAPA30. Todos los pacientes necesitaron de ingreso en la UCI por fracaso respiratorio y fallecieron pese al tratamiento antifúngico contra Aspergillus30. Dado que el diagnóstico se retrasa a menudo debido a que la presentación clínica y radiológica es inespecífica, es importante tener en cuenta los factores de riesgo que se han descrito en pacientes con CAPA y que incluyen los siguientes: edad avanzada, linfopenia, existencia de enfermedades respiratorias crónicas, tratamiento con corticosteroides y antibióticos, necesidad de ventilación mecánica y presencia de desregulación inmune con diminución de los linfocitos T CD4 y CD821,44. Recientemente las sociedades científicas ECMM e ISHAM (European Confederation for Medical Mycology e International Society for Human and Animal Mycology)27 han publicado una guía conjunta que pretende homogeneizar los criterios diagnósticos de CAPA, así como establecer recomendaciones para su diagnóstico y tratamiento. Por último, señalar que también se han descrito algunos pacientes con COVID-19 que han desarrollado mucormicosis31,35.
Finalmente, los pacientes oncohematológicos, en su mayoría en tratamiento con terapias biológicas o dirigidas, constituyen actualmente un nuevo grupo de riesgo en el desarrollo de una API. Un ejemplo son las API asociadas con el uso de ibrutinib, un inhibidor de la tirosina kinasa de Bruton (BTK)37. Estas API se han descrito especialmente durante los primeros tres meses de tratamiento en pacientes que han recibido otras líneas de tratamiento y en asociación con glucocorticoides, siendo excepcionales cuando se utiliza el ibrutinib como tratamiento de primera línea. Aproximadamente un 40% de las mismas se diseminan, afectando al sistema nervioso central. Un problema que hay que tener en cuenta es la interacción que tienen la mayoría de estos fármacos con los azoles.
Infecciones por hongos filamentosos emergentesEn los últimos años se han publicado varios estudios alertando de un aumento en el número de infecciones producidas por hongos filamentosos distintos de Aspergillus14,20. En un estudio realizado en Francia, en el que participaron más del 95% de los hospitales franceses, que analizaba el registro de la base de datos nacional se observó que entre 2004 y 2010 las infecciones producidas por mucorales en pacientes con neoplasias hematológicas habían aumentado de 73 a 105,8 casos por 100.000 pacientes/año, lo que corresponde a un aumento del 8,7% (p=0,05)7. Un estudio observacional y unicéntrico realizado en España, que revisó un total de 570.949 ingresos hospitalarios entre enero de 2007 y diciembre de 2015, detectó 19 casos de mucormicosis, fundamentalmente causados por Lichtheimia (42%) como infección de piel y partes blandas (52,6%)24. Los autores aprovecharon para comparar la incidencia de mucormicosis entre 2007 y 2015 (3,3 casos por 100.000 ingresos) con la incidencia entre 1988 y 2006 (1,2 casos por 100.000 ingresos), concluyendo que la incidencia de infección por mucorales ha estado en progresivo aumento en la última década45. AmB-L fue el fármaco antifúngico con la mayor actividad in vitro, seguida de posaconazol, itraconazol y voriconazol. Pese al tratamiento combinado médico y quirúrgico la mortalidad fue del 47,4%. AmB-L sigue siendo el tratamiento antifúngico de elección para las infecciones producidas por mucorales11.
La incidencia de infecciones producidas por Fusarium también ha aumentado en los últimos años. Un estudio observacional y retrospectivo realizado en Turquía que revisó los casos de fusariosis entre junio de 1995 y diciembre de 2014 describió un aumento progresivo de las infecciones producidas por Fusarium desde un promedio de 0,67 casos por año a 4,8 casos por año13. Voriconazol y posaconazol mostraron una importante variabilidad en su actividad según las especies de Fusarium implicadas, siendo AmB el fármaco antifúngico con la mejor actividad in vitro frente a todas las cepas de Fusarium analizadas13. Un estudio retrospectivo realizado en un hospital español y que incluyó los años 2004 a 2017, observó un aumento progresivo de casos de fusariosis invasiva, con una incidencia de 0,163 casos por 10.000 ingresos en el año 2004 hasta un máximo de 0,337 casos por 10.000 ingresos en el año 201617. Los autores concluyeron que, pese a ser una complicación infecciosa rara, la incidencia de fusariosis invasora estaba en aumento progresivo, presentándose como una IFI de brecha, fundamentalmente en pacientes oncohematológicos con neutropenia prolongada y en tratamiento profiláctico con fármacos antifúngicos distintos al posaconazol, como la micafungina17.
Finalmente, las infecciones producidas por Scedosporium y Lomentospora han ganado importancia en los últimos años, con un aumento progresivo internacional del número de casos clínicos publicados38. Sin embargo, un estudio unicéntrico español que revisó los casos de infección fúngica invasora entre 1998 y 2017 fue incapaz de detectar una tendencia de aumento de las infecciones por estos hongos3.
Infecciones por levaduras emergentesCandida auris fue primeramente identificada en Japón en 200940. Desde entonces esta especie ha sido un patógeno emergente mundial que representa un importante problema para los servicios sanitarios dada 1) su alta resistencia al fluconazol, que en ocasiones se extiende a otros antifúngicos comúnmente utilizados para tratar las infecciones producidas por especies de Candida, 2) la capacidad de formar biopelículas, lo que conlleva una mayor dificultad para su tratamiento y erradicación, 3) la dificultad para su identificación por los métodos estándar de microbiología, ya que fenotípicamente se puede confundir con otras levaduras, como Candida haemulonii, por lo que se requieren técnicas especiales como el MALDI-TOF y la identificación molecular a través de la secuenciación del genoma y, 4) la facultad de colonizar pacientes y su entorno, lo que resulta en una mayor capacidad de producir brotes en instituciones sanitarias, y específicamente en UCI28. Se han descrito brotes importantes de infección por C. auris en hospitales españoles, que en algunos casos persistieron pese a la implementación de medidas de control de infección y de vigilancia epidemiológica, ocasionando una importante mortalidad33,39.
Aspergillus fumigatus resistente a azolesPor último, cabe destacar la aparición global de cepas de A. fumigatus resistentes a azoles, lo que conlleva un importante problema clínico en el tratamiento y el pronóstico. Un estudio realizado en un centro hospitalario en Holanda ha descrito un aumento progresivo de la resistencia a los azoles desde un valor de 0,79% en 1996-2001, a 4,25% en 2002-2006, 7,17% en 2007-2011 y 7,04% en 2012-20169. El uso generalizado de fungicidas triazoles en las actividades agrícolas podría justificar este aumento5,12. En un estudio en el que participaron 30 centros hospitalarios españoles, y que analizó un total de 847 muestras de Aspergillus, principalmente de origen respiratorio, se observó una inesperada alta tasa de resistencia a azoles (7,4%), más en especies crípticas de Aspergillus que en A. fumigatus sensu stricto (95% frente a 5,5%, respectivamente)16. No se observó resistencia a AmB en A. fumigatus sensu stricto22. En cualquier caso, la repercusión en el pronóstico es muy significativa: un estudio de cohorte retrospectivo, realizado en tres hospitales universitarios holandeses durante un periodo de cinco años (2011–2015), que incluyó a 196 enfermos con API (37 de ellos con A.fumigatus resiste a voriconazol), observó entre los pacientes con aislamientos resistente un aumento de la mortalidad global del 21% el día 42 (49% vs. 28% en los pacientes con aislamientos sensibles al voriconazol; p=0,017) y del 25% el día 90 (62% vs. 37%; p=0,0038)29. El uso empírico inadecuado de voriconazol también se asoció a un aumento de la mortalidad (47% vs. 24%; p=0,016)29. Dado el mal pronóstico, varios expertos recomiendan que en zonas con una alta tasa de resistencia entre los aislamientos ambientales de A. fumigatus (tasa de resistencia superior al 10%), se cambie la profilaxis y el tratamiento empírico con azoles en monoterapia a una terapia antifúngica combinada con equinocandinas o con AmB-L.29. En el caso de confirmarse la resistencia a los azoles (CMI>2 mg/l), AmB-L es, hoy por hoy, el tratamiento antifúngico de elección22.
ConclusionesLa micología clínica está en continuo progreso. La aparición de nuevas guías clínicas ha contribuido a mejorar la atención de nuestros pacientes con infección fúngica oportunista, especialmente de pacientes inmunosuprimidos (oncohematológicos y/o receptores de un trasplante). Al mismo tiempo el desarrollo de nuevas herramientas diagnósticas y de nuevos fármacos antifúngicos, con mayor espectro de acción y con menos efectos secundarios, ha permitido un diagnóstico más rápido y tratamientos más efectivos. A pesar de todo ello, el cambio en la epidemiología de la IFI, con la aparición de nuevos pacientes y de microorganismos más patogénicos y menos sensibles a los antifúngicos (C. auris, L. prolificans, mucorales, aislamientos de Aspergillus resistentes a azoles) ha dificultado el tratamiento con azoles y candinas, mientras que la AmB-L continúa manteniendo un espectro estable de eficacia y sigue siendo el fármaco antifúngico de elección en muchas de estas difíciles situaciones tras 30 años desde su aparición.
FinanciaciónLa publicación de este artículo ha sido financiada por Gilead. Gilead no ha intervenido o influenciado en el contenido del mismo.
Conflicto de interesesJMA es consultor y/o participa como asesor de Astellas Pharma, Pfizer, Gilead, Merck Sharp and Dohme, Angelini, Mundypharma, Chimerix, United Medical, Biotoscana.